微拟球藻(Nannochloropsis sp.)又称拟微球藻或微绿球藻、眼状微拟球藻等,属于不等鞭毛门,眼点藻纲,眼点藻目,微拟球藻属。微拟球藻细胞为球形,直径约为2~4 μm,含有一个色素体,为淡绿色,是一种主要分布于海洋的饵料微藻[1]。微拟球藻因为富含不饱和脂肪酸,常被用于生产油脂,由此产生大量的脱脂藻渣。这部分藻渣含有丰富的蛋白质和碳水化合物,其营养成分值得进一步开发利用。可溶性多糖是碳水化合物的主要成分之一。研究表明,多糖具有抗炎、降脂、抗氧化、降血糖、免疫调节、肠道微生物群调节等多种生物活性[2]。天然来源的多糖具有毒性低、活性高,生物相容性好等特点,若将提取完油脂后藻渣中的碳水化合物回收利用,生产高附加值的产品,将大大提高微拟球藻的应用价值。近年来关于微拟球藻多糖的研究与日俱增。已有研究发现微拟球藻水溶性多糖富含(β1→3、β1→4)-葡聚糖、(α1→3、α1→4)-甘露聚糖和阴离子硫酸化异鼠李聚糖。研究表明,微拟球藻多糖的溶解度较好,易吸收,其中混合连接的高分子质量(β1→3、β1→4)-葡聚糖比(β1→4)-葡聚糖更易溶解[3]。PANDEIRADA等[4]发现富含甘露聚糖和硫酸化异鼠李聚糖的微拟球藻多糖对体外细胞具有较好的免疫刺激活性,其可以增强免疫反应,在生物医学或功能性食品中有较大的开发价值。
然而,天然来源的多糖分子质量一般比较大,生物活性和溶解度较低,不易跨越细胞膜屏障被吸收利用,导致其生物利用度低[5]。如何提高多糖的生物活性和利用度是近年来研究的一大热点。一般来说,小分子质量的多糖具有更高的生物活性,这可能是因为较小的分子质量更容易被生物体吸收和利用[6]。因此,对多糖进行有限水解是提高多糖生物活性的常用策略。由于多糖分子的高度聚合和复杂结构,其降解过程一直是一个具有挑战性的课题。常用的多糖降解方法有物理降解法、化学降解法和生物降解法。每种降解方法都有其自身的局限性,因此,选择开发一种能够经济快速获得低分子质量多糖的技术至关重要[5]。
近年来,超声波技术在生物化学领域得到了广泛应用。超声波具有空化效应和机械效应,能够破坏多糖分子间的氢键和疏水作用力,从而促进多糖降解。此外,超声波还可以提高反应体系的温度和压力,进一步加速多糖的降解过程。过氧化氢具有强氧化性,能够将多糖分子中的糖苷键断裂,从而实现多糖的降解。过氧化氢降解多糖是常用的方法之一,其降解效率高、反应条件温和,对多糖结构的损伤也较小[7]。还可以通过引入一些物质(如金属离子、抗坏血酸)或处理(如紫外线辐射和超声波处理)来活化产生自由基[8]。维生素C和Fe2+作为催化剂,可以提高过氧化氢的氧化活性,增强降解效果。
过氧化氢-维生素C和过氧化氢-Fe2+体系通过提供强氧化性和高效的催化活性,促进多糖的降解。本研究将超声波技术与过氧化氢-维生素C和过氧化氢-Fe2+体系相结合,通过高效液相色谱和傅里叶红外光谱等方法对微拟球藻多糖的化学成分、分子质量、单糖组成和抗氧化活性等方面进行测定;研究2种体系的降解效果并比较其差异,以期实现更加高效、可控的多糖降解。同时通过测定羟自由基、ABTS阳离子自由基清除能力和总还原力,分析微拟球藻多糖降解产物与其抗氧化活性之间的关系,以期为微拟球藻的高价值利用提供理论参考。
1 材料与方法
1.1 材料与试剂
微拟球藻藻粉,福建省海洋藻类活性物质重点实验室;纤维素酶Celluclast BG,丹麦诺维信;抗坏血酸(维生素C),如吉生物科技有限公司;考马斯亮蓝,上海蓝季科技发展有限公司;明胶,天津市光复精细化工研究所;标准单糖包括岩藻糖(fucose,Fuc)、鼠李糖(rhamnose,Rha)、阿拉伯糖(arabinose,Ara)、半乳糖(galactose,Gal)、葡萄糖(glucose,Glc)、木糖(xylose,Xyl)、甘露糖(mannose,Man)、果糖(fructose,Fru)、核糖(ribose,Rib)、半乳糖醛酸(galacturonic acid,Gal-UA)、葡萄糖醛酸(glucuronic acid,Glc-UA)、甘露糖醛酸(mannuronic acid,Man-UA)、古罗糖醛酸(guluronic acid,Gul-UA),sigma公司;总抗氧化能力检测试剂盒(ABTS快速法),上海碧云天生物技术股份有限公司;牛血清白蛋白标准品,国药集团化学试剂有限公司。其他所有试剂均为分析纯。
1.2 仪器与设备
KQ-600E超声波清洗器,昆山市超声仪器有限公司;DF-101S恒温加热磁力搅拌器,巩义市予华仪器有限公司;FDU-2110冷冻干燥机,日本东京理化;MCR302e流变仪,奥地利安东帕;Infinite M200 Pro酶标仪,瑞士帝肯公司;RE-52AA旋转蒸发仪,上海亚荣生化仪器有限公司;GL-10MD高速冷冻离心机,湖南湘仪实验室仪器开发有限公司;Zetasizer Nano-ZSE纳米粒度及Zeta电位仪,英国马尔文;K9840自动凯氏定氮仪,山东海能科学仪器有限公司;Thermo Nicolet IS 50傅里叶红外光谱仪、Thermo ICS 5000+离子色谱系统、U3000高效液相色谱系统、DionexTM CarboPacTM PA20(150 mm×3.0 mm,10 μm)液相色谱柱,美国赛默飞;Optilab T-rEX示差检测器,美国怀雅特;Ohpak SB-805 HQ(300 mm×8 mm,13 μm)凝胶排阻色谱柱,日本昭和电工株式会社。
1.3 实验方法
1.3.1 微拟球藻营养成分测定
微拟球藻蛋白质的测定参考GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》中凯氏定氮法。微拟球藻脂肪的测定参考GB 5009.6—2016《食品安全国家标准 食品中脂肪的测定》中索氏提取法。微拟球藻碳水化合物的测定参考苯酚-硫酸法[9]。
1.3.2 微拟球藻多糖的制备
采用纤维素酶解破壁、热水浸提、80%(体积分数)乙醇沉淀分离的方法制备微拟球藻粗多糖(图1)。
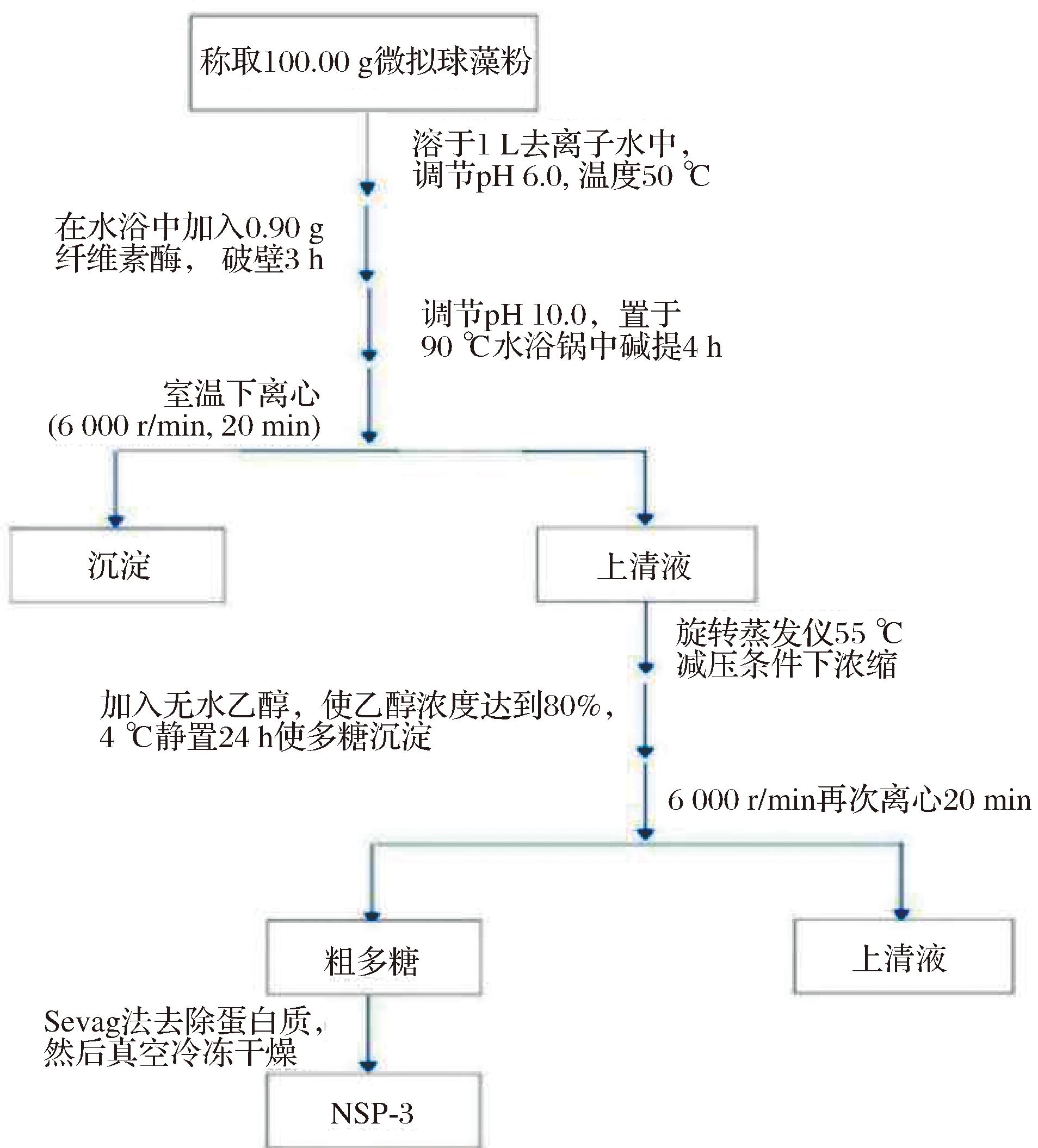
图1 微拟球藻多糖的制备
Fig.1 Preparation of polysaccharides from Nannochloropsis sp.
1.3.3 降解多糖的制备
1.3.3.1 超声辅助过氧化氢-Fe2+体系水解
参考严尚隆等[10]的方法,对微拟球藻多糖(Nannochloropsis sp.polysaccharides,NSP-3)进行过氧化氢-Fe2+体系水解。配制5 mg/mL NSP-3多糖溶液60 mL,调节pH值至3.0,加入过氧化氢(30%,4.53 mL)和FeSO4·7H2O(0.17 g),混匀后超声处理30 min(超声功率600 W)。调节pH值至7.0,离心(10 000 r/min,20 min),上清液冷冻干燥,得到超声辅助过氧化氢-Fe2+水解多糖产物,命名为Fe-NSP-3。按公式(1)计算回收率:
回收率![]()
(1)
式中:m2,水解后多糖质量,g;m1,水解前多糖质量,g。
1.3.3.2 超声辅助过氧化氢-维生素C体系水解
参考CHEN等[5]使用的方法,对NSP-3进行过氧化氢-维生素C体系水解。准确称取0.30 g NSP-3,加入去离子水配得5 mg/mL多糖溶液,调节pH值至3.0,加入过氧化氢(30%,0.14 mL)和抗坏血酸(0.21 g),混匀后超声处理30 min(超声功率600 W)。调节pH值至7.0,离心(10 000 r/min,20 min),上清液冷冻干燥,得到超声辅助过氧化氢-维生素C水解多糖产物,命名为C-NSP-3。
1.3.4 微拟球藻多糖理化分析
1.3.4.1 化学成分分析
以葡萄糖为标准品,采用苯酚法[9]测定NSP-3降解前后的总糖含量。以BSA为标准,采用考马斯亮蓝法[9]测定NSP-3降解前后的蛋白质含量。以半乳糖醛酸为标准采用硫酸-咔唑比色法[9]测定NSP-3降解前后的糖醛酸含量。以硫酸钾为标准采用氯化钡-明胶法[9]测定NSP-3降解前后的硫酸根含量。
1.3.4.2 多糖黏度测定
配制2 mg/mL的多糖溶液,采用MCR302e流变仪测定3种多糖组分NSP-3、C-NSP-3和Fe-NSP-3水溶液的黏度。
1.3.4.3 多糖分子质量测定
采用凝胶色谱-示差-多角度激光光散射系统(high pressure gel chromatography-multiple angle light scattering detector-differential refractive index detector, HPSEC-MALS-RI)和凝胶排阻色谱柱联用的方法,并根据马克·霍温克方程(Mark-Houwink equation)计算出每个组分对应的分子质量。
1.3.4.4 单糖组成分析
采用离子色谱系统,利用电化学检测器对单糖组分进行分析检测。液相色谱柱进样量5 μL。流动相A(H2O),流动相B(0.1 mol/L NaOH),流动相C(0.1 mol/L NaOH,0.2 mol/L NaAc),流速0.5 mL/min;柱温30 ℃;洗脱梯度:0 min V(A相)∶V(B相)∶V(C相)=95∶5∶0,26 min V(A相)∶V(B相)∶V(C相)=85∶5∶10,42 min V(A相)∶V(B相)∶V(C相)=85∶5∶10,42.1 min V(A相)∶V(B相)∶V(C相)=60∶0∶40,52 min V(A相)∶V(B相)∶V(C相)=60∶40∶0,52.1 min V(A相)∶V(B相)∶V(C相)=95∶5∶0,60 min V(A相)∶V(B相)∶V(C相)=95∶5∶0。取适量多糖样品,加入1 mL 2 mol/L 三氟乙酸溶液,121 ℃加热2 h,通氮气吹干。加入99.99%(体积分数)甲醇清洗3~4次后,无菌水溶解,转入色谱瓶中测定。根据各种标准品的峰面积计算其单糖浓度。
1.3.4.5 傅里叶红外光谱分析
使用红外光谱仪测定4 000~400 cm-1处NSP-3、C-NSP-3和Fe-NSP-3的红外吸收光谱。样品扫描次数32次,分辨率4 cm-1,检测器MCT,红外光源。
1.3.4.6 多糖的粒径
将3种多糖分别配制为1 mg/mL的多糖溶液,采用纳米粒度及Zeta电位仪检测NSP-3、C-NSP-3和Fe-NSP-3的粒径大小。测定参数保持默认(折射率1.330,吸收率0.000,黏度0.887 2,温度25 ℃,平衡时间120 s,探测角173°反向散射)。
1.3.5 抗氧化活性测定
1.3.5.1 羟自由基清除活性
参考YIN等[11]使用的方法并稍作修改,将400 μL的样品溶液、400 μL FeSO4(9 mmol/L)和400 μL水杨酸乙醇(9 mmol/L)混匀后,静置10 min;加入200 μL过氧化氢(9 mmol/L)振动混匀,在37 ℃静置30 min后,于510 nm处测样品组吸光度Ai,蒸馏水代替过氧化氢测对照组吸光度Ax,蒸馏水代替多糖样品测空白组吸光度A0。以维生素C作为阳性对照。羟自由基清除率(%)按公式(2)计算:
清除率![]()
(2)
式中:A0为空白组的吸光度;Ai为样品组的吸光度;Ax为对照组的吸光度。
1.3.5.2 ABTS阳离子自由基清除活性
按总抗氧化能力检测试剂盒(ABTS快速法)使用方法进行。
1.3.5.3 总还原力
本研究的总还原力测定采用铁氰化钾法[12]进行测定。取200 μL样品溶液、200 μL PBS(pH 6.6)和500 μL 1%(质量分数)铁氰化钾溶液混匀,50 ℃反应20 min,冷却至室温,加入200 μL 10%(质量分数)三氯乙酸溶液终止反应。3 000 r/min离心15 min后,取500 μL上清液,依次加入500 μL蒸馏水、100 μL 0.1%(质量分数)FeCl3溶液混匀,室温反应10 min,于700 nm处测定吸光度。以蒸馏水作为空白对照,以维生素C作为阳性对照。
1.4 统计分析
所有实验在相同条件下重复测定3次,采用SPSS 17.0软件进行显著性分析,P<0.05表示差异显著,结果以均值±标准差的方式表示。采用Origin 2022软件进行绘图。
2 结果与分析
2.1 部分水解对多糖生化组成的影响
本研究分别采用超声辅助过氧化氢-维生素C法和过氧化氢-Fe2+法对NSP-3进行部分水解,得到2种多糖产物C-NSP-3、Fe-NSP-3,回收率依次为(63.25±2.39)%、(79.69±1.56)%。由表1可知,C-NSP-3和Fe-NSP-3的总糖含量分别为(77.43±1.60)%和(66.21±2.73)%,比对照分别提高了4.05%(P>0.05)和降低了11.04%(P<0.05)。该结果表明维生素C催化对纯度影响不大,但是Fe2+催化会轻微降低多糖的纯度。这可能是由于金属离子诱导的自由基生成速率较快,伴随着较多的副反应,引入较多的非多糖类杂质,如色素、类胡萝卜素和多酚类物质等[13]。
表1 多糖的化学成分 单位:%
Table 1 Chemical composition of polysaccharides

注:同一列中不同字母表示有显著差异(P < 0.05)(下同)。
样品总糖蛋白质糖醛酸硫酸根NSP-374.43±0.76a2.45±0.04a18.19±1.47b9.15±0.47aC-NSP-377.43±1.60a1.39±0.18b25.27±2.80a5.50±0.51bFe-NSP-366.21±2.73b0.89±0.20c15.92±2.05b5.51±1.21b
此外,所得2种多糖的蛋白质和硫酸根含量均比水解前显著降低(表1)。这可能是多糖分子内连接的糖苷键在水解过程被破坏[8],导致部分硫酸基团与多糖结合的蛋白分子脱落。C-NSP-3的糖醛酸含量[(25.27±2.80)%]比水解前高38.92%,而Fe-NSP-3的糖醛酸含量虽然略有降低,但差异不显著(P>0.05)。该结果表明维生素C和Fe2+均能有效水解NSP-3,使其分子结构发生变化。多糖的化学含量改变主要归因于有限水解后活性基团的暴露[7]。虽然该结果与YAO等[14]采用紫外线-过氧化氢水解多糖的结论略有不同,但这可能是由于多糖来源不同,导致多糖结构也不同,羟自由基对糖苷键的选择性攻击跟多糖的结构有很大关系。
2.2 部分水解对多糖分子质量、粒径和黏度的影响
采用HPSEC-MALS-RI和凝胶排阻色谱分析多糖的分子质量分析,结果如图2和表2所示。C-NSP-3和Fe-NSP-3的重均分子质量分别为8.118、0.569 kDa,比NSP-3降低了17.83%和94.24%。该结果表明过氧化氢-维生素C和过氧化氢-Fe2+水解均能有效降低NSP-3的分子质量,但降低程度不同。Z均分子质量与重均分子质量的变化一致。多分散系数(Mw/Mn)是判断分子质量分布的关键参数,其值越小说明分子质量分布越小,聚合物链的长度越均匀。NSP-3的Mw/Mn>2,说明其分子质量分布范围较广,为宽分布高分子;C-NSP-3和Fe-NSP-3的Mw/Mn值为1.2~2,为适中分布高分子。以上结果表明,过氧化氢-维生素C和过氧化氢-Fe2+水解能降低多糖的多分散系数,使分子质量分布趋于集中,聚合物链的长度趋于均匀[15]。
表2 多糖的分子质量、粒径和黏度
Table 2 Molecular weight, particle size, and viscosity of polysaccharides

样品重均分子质量Mw/kDa数均分子质量Mn/kDa多分散系数Mw/Mn峰值分子质量Mp/kDaZ均分子质量Mz/kDa平均粒径/nm黏度/(mPa·s)NSP-39.8763.1483.1381.62837.698383.67±3.29a1.27±0.1aC-NSP-38.1186.1871.3124.67613.055145.27±4.65b0.96±0.1bFe-NSP-30.5690.3171.7960.1771.30575.04±1.10c0.93±0.1b

a-NSP-3;b-C-NSP-3;c-Fe-NSP-3
图2 分子质量分布
Fig.2 Molecular weight distribution
如表2所示,NSP-3经2种不同的体系有限水解后其平均粒径均明显降低。研究表明多糖的粒径越小,越有利于其发挥生物活性[16]。由图3可知,NSP-3的粒径主要由2种峰组成,其中约80%以上的粒径分布于100~1 000 nm,剩余约20%位于10~100 nm。C-NSP-3和 Fe-NSP-3的粒径主要集中在10~200 nm和10~100 nm。水解后的C-NSP-3和Fe-NSP-3的平均粒径分别为NSP-3的37.86%和19.56%。这主要是由于水解过程糖链断裂,大分子糖转变为小分子糖,使得平均粒径减小,这与Mw的变化一致。如表2所示,2种体系水解后多糖的黏度也显著降低,这可能是由于多糖溶液分子相互作用的减少所致[17]。
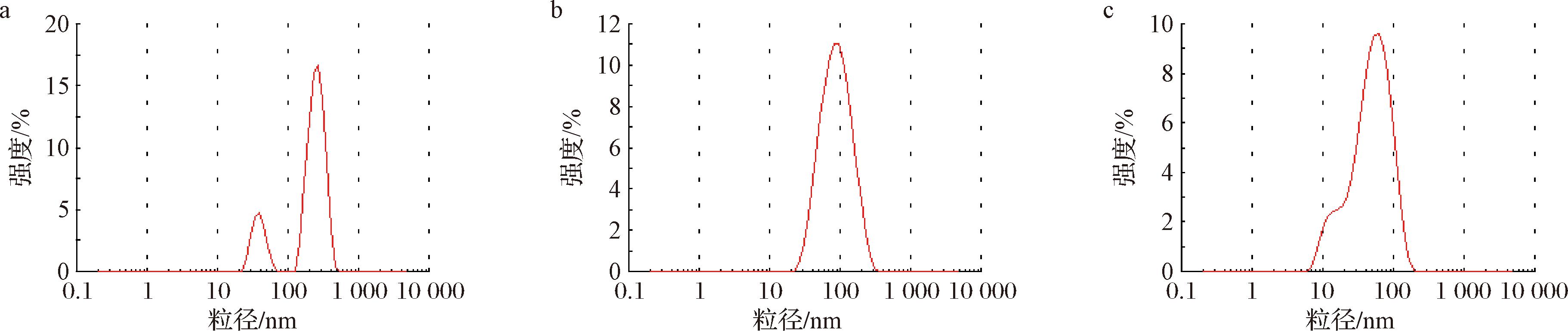
a-NSP-3;b-C-NSP-3;c-Fe-NSP-3
图3 粒径分布
Fig.3 Particle size distribution
Fe-NSP-3的分子质量和平均粒度更小,说明Fe2+的催化作用更强,超声辅助过氧化氢-Fe2+法降解的效果更好。YAN等[7]采用超声辅助过氧化氢-维生素C法和过氧化氢-Fe2+法对长松藻(Codium cylindricum)多糖部分水解,也发现Fe2+的催化作用更强,导致其分子质量更低。
2.3 部分水解对单糖组成的影响
标准单糖及3种多糖组分的色谱图如图4所示。NSP-3是由Glc、Man、Gal、Rib、Rha、Fuc、Xyl、Ara和Glc-UA等9种单糖为单元构建的杂多糖。经过水解处理后,C-NSP-3和Fe-NSP-3中的单糖组成与NSP-3基本一致,说明有限水解并未改变单糖的种类。谭诗敏等[18]采用过氧化氢-维生素C降解香水莲花多糖也发现类似的情况。两种方法水解后,其单糖的占比均发生了不同程度的改变(表3)。与NSP-3相比,C-NSP-3中的Glc占比明显提高,而Rha降低;Fe-NSP-3中的Glc和Rib均显著降低,而Glc-UA的占比则明显提高。说明Fe2+催化的自由基更容易攻击NSP-3中β-葡聚糖糖苷键(β1→3,β1→4)使Glc脱落,维生素C催化的自由基则倾向于攻击Rha附近的糖苷键,使Rha脱落。断裂的短糖链在透析过程中被除去,这可能是Fe-NSP-3中Glc含量降低,C-NSP-3中βRha含量降低的主要原因。
表3 单糖的摩尔比 单位:%
Table 3 Molar proportion of monosaccharides
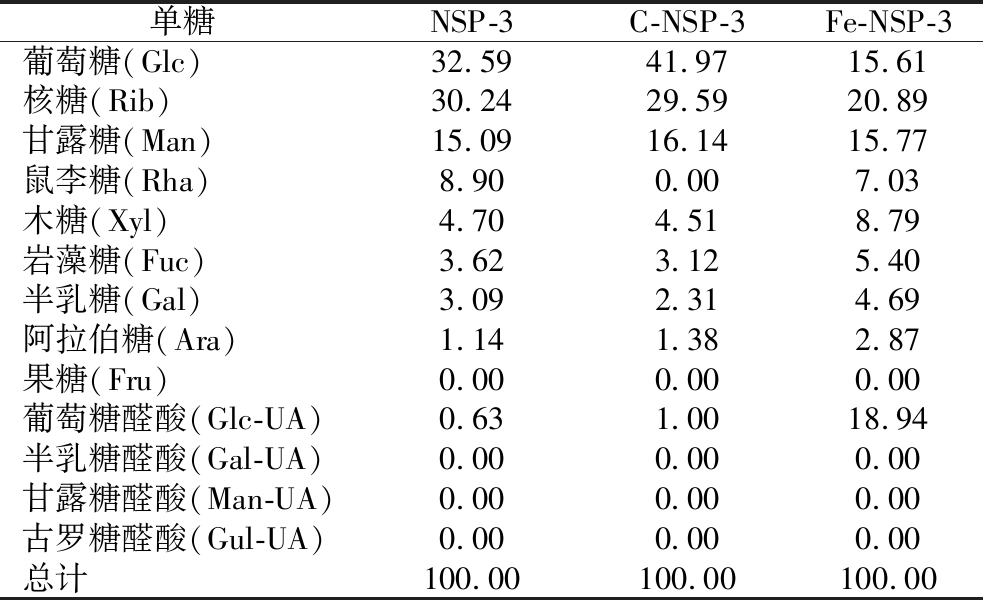
单糖NSP-3C-NSP-3Fe-NSP-3葡萄糖(Glc)32.5941.9715.61核糖(Rib)30.2429.5920.89甘露糖(Man)15.0916.1415.77鼠李糖(Rha)8.900.007.03木糖(Xyl)4.704.518.79岩藻糖(Fuc)3.623.125.40半乳糖(Gal)3.092.314.69阿拉伯糖(Ara)1.141.382.87果糖(Fru)0.000.000.00葡萄糖醛酸(Glc-UA)0.631.0018.94半乳糖醛酸(Gal-UA)0.000.000.00甘露糖醛酸(Man-UA)0.000.000.00古罗糖醛酸(Gul-UA)0.000.000.00总计100.00100.00100.00
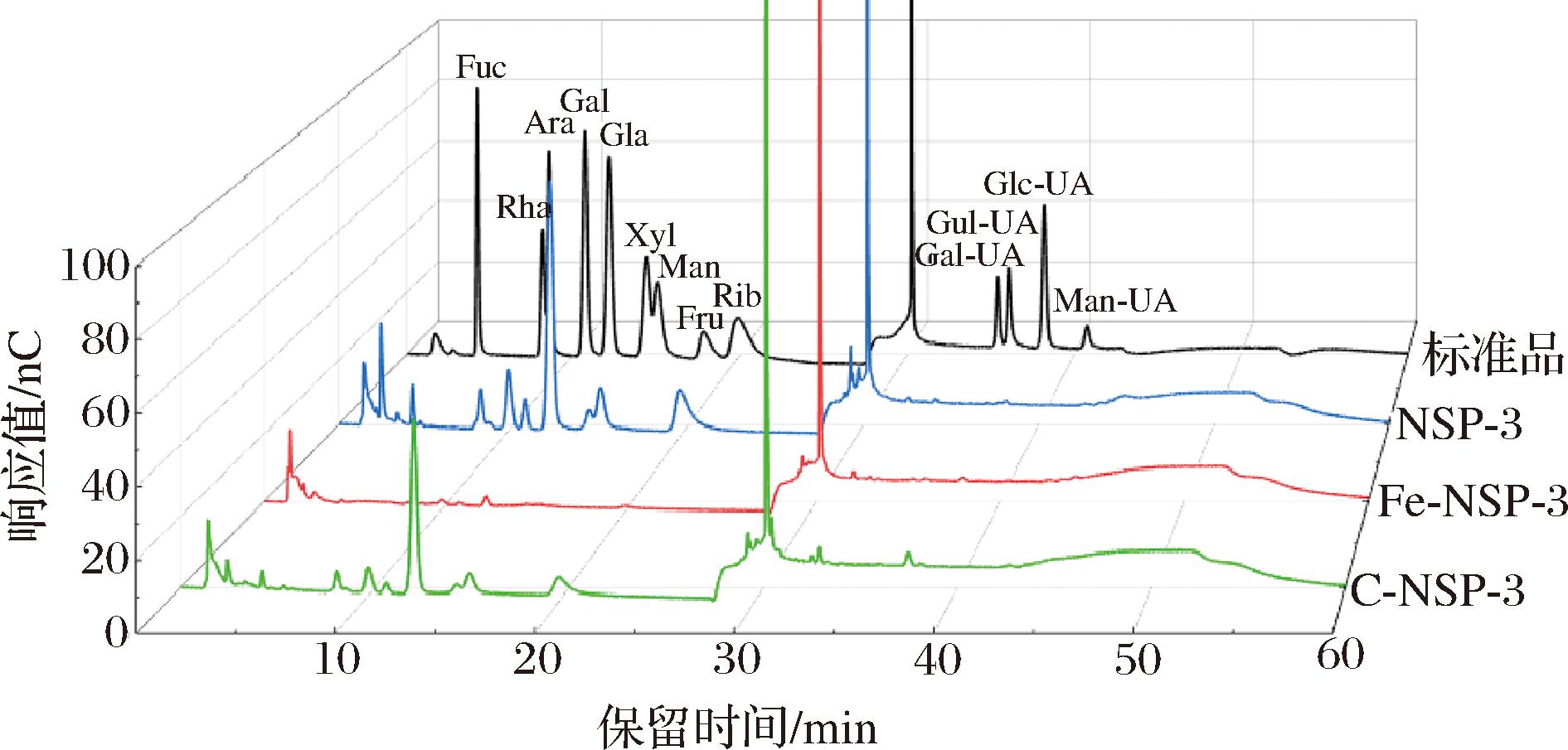
图4 标准单糖及多糖组分的色谱图
Fig.4 Chromatograms of standard monosaccharides and polysaccharide fractions
如图5所示,Glc、Rib和Man依然是所有样品中的主要单糖。C-NSP-3和Fe-NSP-3中Glc、Rib和Man的摩尔比分别为41.97∶29.59∶16.14和15.61∶20.89∶15.77。这可能是由于自由基降解多糖涉及自由基引发的链反应、分子的氧化和断裂,以及进一步的化学反应,这些过程会使大分子多糖降解为小分子多糖[13]。此外,单糖本身在支链和主链上分布不均匀,部分水解处理使得各糖链降解程度不同,导致单糖含量改变[19]。这与目前众多的研究结果一致,羟自由基降解和超声波降解相对温和,几乎不破坏多糖的结构,仅改变单糖含量。YAN等[7]采用超声辅助过氧化氢-维生素C法和过氧化氢-Fe2+法降解长松藻多糖,也发现降解处理不改变多糖的基本结构,仅改变单糖摩尔比。
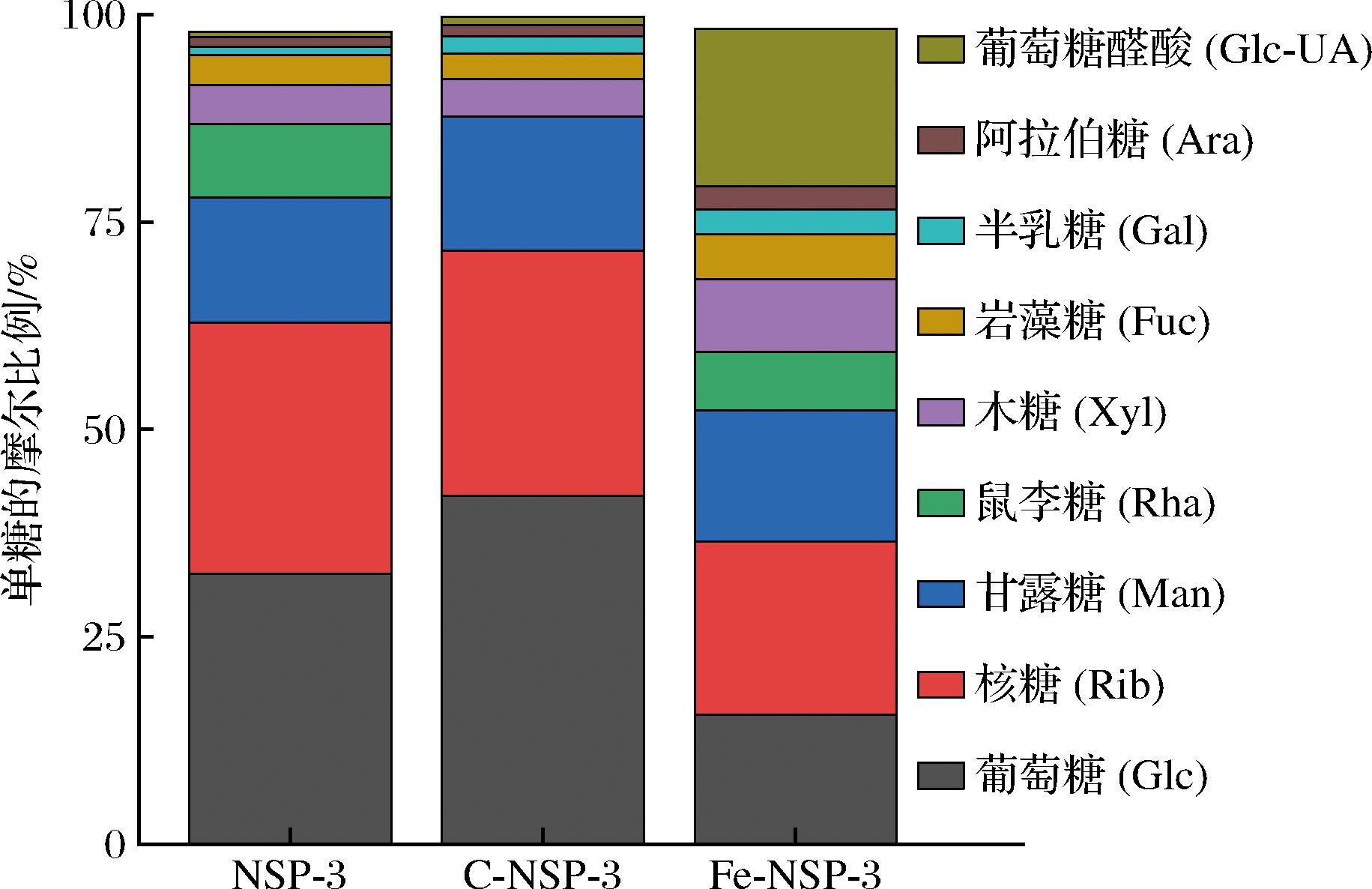
图5 单糖的摩尔比例
Fig.5 Molar ratio of monosaccharides
2.4 傅里叶红外光谱分析
NSP-3、Fe-NSP-3和C-NSP-3的红外光谱如图6所示。多糖降解后,红外光谱谱带与降解前变化不大,只是峰强度变弱,这与香水莲花和覆盆子果实降解多糖的红外光谱特征相似[18, 20],3 273、1 080 cm-1处的吸收峰为3种多糖的主要特征峰。3 273 cm-1(3 500~3 100 cm-1)附近强而宽的吸收峰,为O—H键的拉伸振动所致。2 937 cm-1(3 000~2 900 cm-1)附近的弱吸收峰归因于C—H键的存在[7]。在1 637、1 576 cm-1均观察到尖锐的吸收峰,这是由于C![]() O键的不对称拉伸振动,该区域的吸收峰都是结合水无定形区的吸收峰,表明存在游离的羧酸基。1 407 cm-1附近的峰值是由COO—键引起的,表明存在糖醛酸[21],这与糖醛酸基团的测定结果一致。1 200~1 000 cm-1(1 103、1 080、1 025 cm-1)区域的谱带被分配给C—O—C和C—O—H键,为C—O的拉伸振动,该区域的吸收峰归因于葡萄糖残基的吡喃糖环的拉伸振动。这些结果表明,NSP-3、Fe-NSP-3和C-NSP-3具有典型的多糖红外吸收峰,经过超声辅助过氧化氢-维生素C法和过氧化氢-Fe2+法有限水解处理后,3种多糖的红外光谱没有显著差异,没有检测到由降解引起的主要官能团转变,但降解处理会使官能团数量减少;表明降解对多糖的结构没有显著损伤,这与单糖组成分析结果一致。
O键的不对称拉伸振动,该区域的吸收峰都是结合水无定形区的吸收峰,表明存在游离的羧酸基。1 407 cm-1附近的峰值是由COO—键引起的,表明存在糖醛酸[21],这与糖醛酸基团的测定结果一致。1 200~1 000 cm-1(1 103、1 080、1 025 cm-1)区域的谱带被分配给C—O—C和C—O—H键,为C—O的拉伸振动,该区域的吸收峰归因于葡萄糖残基的吡喃糖环的拉伸振动。这些结果表明,NSP-3、Fe-NSP-3和C-NSP-3具有典型的多糖红外吸收峰,经过超声辅助过氧化氢-维生素C法和过氧化氢-Fe2+法有限水解处理后,3种多糖的红外光谱没有显著差异,没有检测到由降解引起的主要官能团转变,但降解处理会使官能团数量减少;表明降解对多糖的结构没有显著损伤,这与单糖组成分析结果一致。
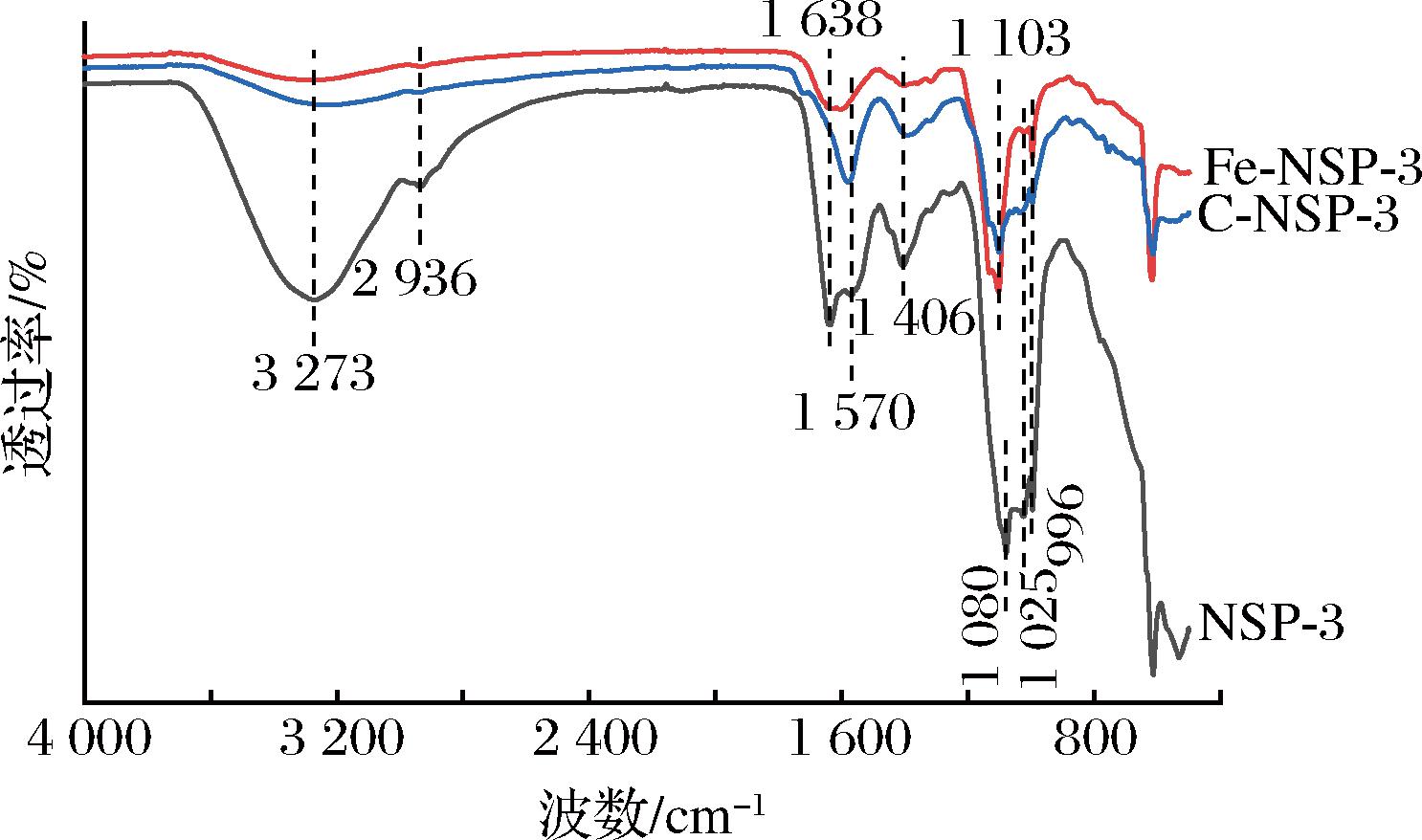
图6 三种多糖组分的傅里叶红外光谱图
Fig.6 Fourier infrared spectra of three polysaccharide fractions
2.5 多糖的抗氧化活性分析
2.5.1 羟自由基清除能力
有限水解前后多糖对羟自由基的清除活性如图7-a所示。经有限水解后,质量浓度低于4 mg/mL时羟自由基清除率大小排序为维生素C>C-NSP-3>Fe-NSP-3>NSP-3,质量浓度高于4 mg/mL时3种多糖的羟自由基清除率迅速升高,均接近阳性对照维生素C。在质量浓度为5 mg/mL时,NSP-3、C-NSP-3和Fe-NSP-3的羟自由基清除率分别为98.29%、86.66%和91.31%,远远高于叶托马尾藻多糖21.83%的清除率[22],表明水解前后微拟球藻多糖均具有较好的羟自由基清除能力,且微拟球藻多糖经超声辅助过氧化氢-维生素C和过氧化氢-Fe2+法有限水解后在质量浓度低于4 mg/mL时羟自由基清除能力会更好,高于4 mg/mL时质量浓度已趋于饱和,3种多糖的羟自由基清除率均迅速升高,接近阳性对照维生素C。
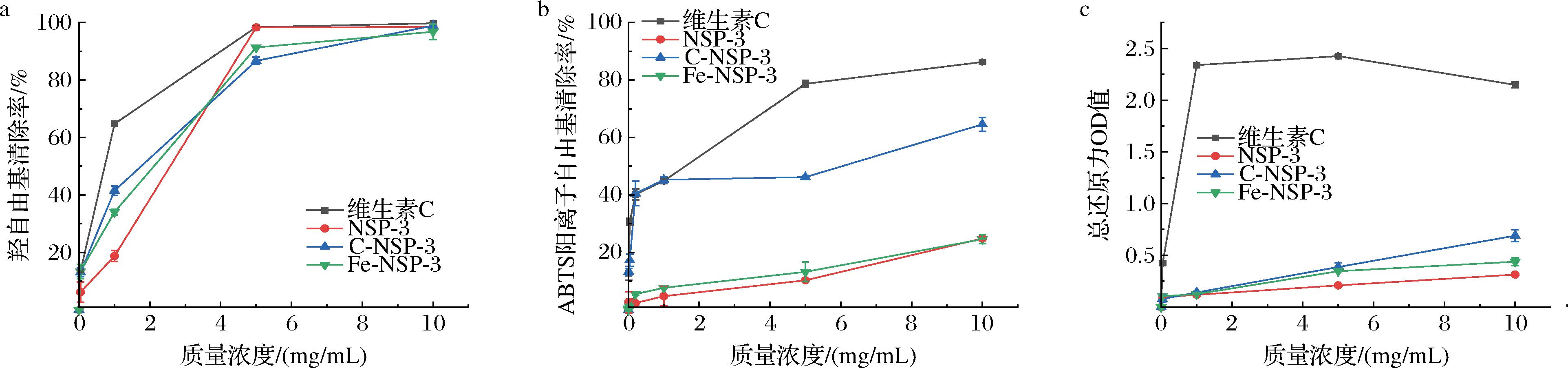
a-羟自由基;b-ABTS阳离子自由基;c-总还原力
图7 三种多糖的抗氧化活性
Fig.7 Antioxidant activity of three polysaccharides
2.5.2 ABTS阳离子自由基清除能力
有限水解前后多糖的ABTS阳离子自由基清除能力如图7-b所示。随着多糖浓度的增加,ABTS阳离子自由基清除率也相应增加。降解后C-NSP-3多糖的ABTS阳离子自由基清除能力迅速升高,质量浓度为0.2 mg/mL时ABTS阳离子自由基清除率便达到40.55%,接近阳性对照维生素C,效果显著强于其他多糖组分(P<0.05)。质量浓度为10 mg/mL时,对照组清除率为86.27%,NSP-3、C-NSP-3和Fe-NSP-3的ABTS阳离子自由基清除率分别为24.86%、64.59%和24.61%。Fe-NSP-3与降解前的NSP-3相比多糖质量浓度在低于8 mg/mL时ABTS阳离子自由基清除率显著提升(P<0.05),质量浓度接近10 mg/mL时与NSP-3相比无显著差异(P>0.05)。结果表明,微拟球藻多糖经有限水解后ABTS阳离子自由基清除率能明显提高,且超声辅助过氧化氢-维生素C法效果更好,在0.2 mg/mL时ABTS阳离子自由基清除率便接近阳性对照维生素C。Fe-NSP-3分子质量虽然低于C-NSP-3,但ABTS阳离子自由基清除能力却低于C-NSP-3,原因可能是Fe-NSP-3被过度降解,造成分子质量过低,氢键结构改变,对多糖的抗氧化活性产生了负面影响。降解过度的多糖其基于分子内氢键的独特键连接方式和构象将被破坏,羰基会从环状结构变为开链结构,破坏多糖分子的氢键结构,导致抗氧化活性降低[23]。同时,C-NSP-3的ABTS阳离子自由基清除能力还可能与C-NSP-3的糖醛酸含量显著提高有关。已有相关研究表明,多糖中的糖醛酸和硫酸盐含量与多糖活性有关[8]。
2.5.3 总还原力
有限水解前后微拟球藻多糖的总还原力如图7-c所示,3种多糖在测试范围内均呈浓度依赖性增加,质量浓度为10 mg/mL时,阳性对照组的吸光度值为2.15±0.03,C-NSP-3和Fe-NSP-3的吸光度值分别为0.69±0.06、0.44±0.04,显著高于水解前NSP-3的0.31±0.01,但远低于维生素C。当质量浓度为5 mg/mL时,还原力最低的NSP-3吸光度也可达0.21±0.01,高于5 mg/mL时褐藻多糖EGPS3-A的吸光度(0.13±0.04)[24]。结果表明,微拟球藻多糖的还原能力较好,2种体系水解后多糖的还原能力会显著提升(P<0.05),且超声辅助过氧化氢-维生素C法有限水解后多糖的还原能力更好。Fe-NSP-3还原力比C-NSP-3低的原因同样可能是Fe-NSP-3被过度降解。
3 结论
超声辅助过氧化氢-维生素C法和过氧化氢-Fe2+法均能有效水解微拟球藻多糖,其中过氧化氢-Fe2+法的降解效果更好,过氧化氢-维生素C法所得降解多糖产品纯度较高。两种水解方法均能显著降低多糖的Mw、平均粒径及黏度,并且基本不破坏多糖的结构,单糖组成和主要官能团未发生明显改变。有限水解之后的微拟球藻多糖的抗氧化活性有了显著增加,这主要是由于分子质量降低不仅使多糖的水溶性更好,并且可以暴露更多的活性位点,使其更容易与自由基接触。此外,多糖中的糖醛酸和硫酸盐含量与多糖的抗氧化活性也有关。可见,有限水解后的微拟球藻多糖分子质量更低,抗氧化作用更强,有望在食品、保健品和药品等领域开发出更多的应用价值。Fe2+催化作用更强的同时,也可能造成过度降解,导致多糖分子质量过低和氢键结构改变,对多糖的抗氧化活性产生负面影响,这为多糖降解方法的选择提供了理论依据。但由于多糖结构的复杂性和多样性,目前对多糖降解机理及降解产物活性关系的研究仍面临着很多问题,需要进一步研究降解多糖的分子结构与生物活性。
[1] 张美兰. 微拟球藻脂质提取及藻渣综合利用的研究[D].武汉:武汉轻工大学, 2023.ZHANG M L.Study on lipid extraction and comprehensive utilization of algae residue of Microcystis minuta[D].Wuhan:Wuhan Polytechnic University, 2023.
[2] YI Z Q, SU Y X, BRYNJOLFSSON S, et al.Bioactive polysaccharides and their derivatives from microalgae:Biosynthesis, applications, and challenges[J].Studies in Natural Products Chemistry, 2021,71:67-85.
[3] BURTON R A, FINCHER G B.(1, 3;1, 4)-beta-D-glucans in cell walls of the Poaceae, lower plants, and fungi:A tale of two linkages[J].Molecular Plant, 2009, 2(5):873-882.
[4] PANDEIRADA C O, MARICATO É, FERREIRA S S, et al.Structural analysis and potential immunostimulatory activity of Nannochloropsis oculata polysaccharides[J].Carbohydrate Polymers, 2019, 222:114962.
[5] CHEN S J, LIU H, YANG X Q, et al.Degradation of sulphated polysaccharides from Grateloupia livida and antioxidant activity of the degraded components[J].International Journal of Biological Macromolecules, 2020, 156:660-668.
[6] LI H Y, YI Y L, GUO S, et al.Isolation, structural characterization and bioactivities of polysaccharides from Laminaria japonica:A review[J].Food Chemistry, 2022, 370:131010.
[7] YAN S L, PAN C, YANG X Q, et al.Degradation of Codium cylindricum polysaccharides by H2O2-Vc-ultrasonic and H2O2-Fe2+-ultrasonic treatment:Structural characterization and antioxidant activity[J].International Journal of Biological Macromolecules, 2021, 182:129-135.
[8] CHEN X Y, SUN-WATERHOUSE D, YAO W Z, et al.Free radical-mediated degradation of polysaccharides:Mechanism of free radical formation and degradation, influence factors and product properties[J].Food Chemistry, 2021, 365:130524.
[9] 李菀, 胡月, 李光霞, 等.纤维素酶和果胶酶提取对甘草渣多糖抗氧化和抗肿瘤性能的影响[J].食品工业科技, 2020, 41(9):309-313;319.LI W, HU Y, LI G X, et al.Effects of cellulase and pectinase extraction on the antioxidant and antitumor activities of licorice residue polysaccharide[J].Science and Technology of Food Industry, 2020, 41(9):309-313;319.
[10] 严尚隆, 潘创, 杨贤庆, 等.长松藻多糖降解、结构表征及降血糖活性测定[J].食品与发酵工业, 2021, 47(18):119-126.YAN S L, PAN C, YANG X Q, et al.Degradation, structural characterization and hypoglycemic activity of polysaccharides from Codium cylindricum[J].Food and Fermentation Industries, 2021, 47(18):119-126.
[11] YIN C M, FAN X Z, FAN Z, et al.Optimization of enzymes-microwave-ultrasound assisted extraction of Lentinus edodes polysaccharides and determination of its antioxidant activity[J].International Journal of Biological Macromolecules, 2018, 111:446-454.
[12] WU J W, LI P, TAO D B, et al.Effect of solution plasma process with hydrogen peroxide on the degradation and antioxidant activity of polysaccharide from Auricularia auricula[J].International Journal of Biological Macromolecules, 2018, 117:1299-1304.
[13] 彭谦, 周鹏程, 徐同成, 等.H2O2降解多糖的作用机制及降解产物构效关系研究进展[J].食品与发酵工业, 2024,50(19):353-360.PENG Q, ZHOU P C, XU T C, et al.Progress on the mechanism of polysaccharide degradation by H2O2 and the conformational relationship of degradation products[J].Food and Fermentation Industries, 2024,50(19):353-360.
[14] YAO W Z, LIU M Y, CHEN X Y, et al.Effects of UV/H2O2 degradation and step gradient ethanol precipitation on Sargassum fusiforme polysaccharides:Physicochemical characterization and protective effects against intestinal epithelial injury[J].Food Research International, 2022, 155:111093.
[15] 王首人. 不同品种燕麦β-葡聚糖构象研究[D].天津:天津科技大学, 2022.WANG S R.Study on conformation of β-glucan from different oats[D].Tianjin:Tianjin University of Science &Technology, 2022.
[16] 东方, 于蕾, 程斌, 等.刺山柑多糖表征结构研究[J].哈尔滨商业大学学报(自然科学版), 2014, 30(5):558-560;576.DONG F, YU L, CHENG B, et al.Study on characterization of Cappraris spinosa L.polysaccharide[J].Journal of Harbin University of Commerce (Natural Sciences Edition), 2014, 30(5):558-560;576.
[17] YUAN D, LI C, HUANG Q, et al.Ultrasonic degradation effects on the physicochemical, rheological and antioxidant properties of polysaccharide from Sargassum pallidum[J].Carbohydrate Polymers, 2020, 239:116230.
[18] 谭诗敏, 罗志刚, 程建华.H2O2-VC降解对香水莲花多糖结构与活性的影响[J].食品科学, 2021, 42(24):48-53.TAN S M, LUO Z G, CHENG J H.Effect of H2O2-VC degradation system on the structure and activity of polysaccharides from Nymphaea hybrid[J].Food Science, 2021, 42(24):48-53.
[19] 黄海潮, 王锦旭, 潘创, 等.超声波辅助过氧化氢法降解坛紫菜多糖及其抗氧化活性的研究[J].南方水产科学, 2020, 16(1):110-119.HUANG H C, WANG J X, PAN C, et al.Degradation of Porphyra haitanensis polysaccharide by ultrasonic assisted hydrogen peroxide method and its antioxidant activity analysis[J].South China Fisheries Science, 2020, 16(1):110-119.
[20] XU Y Q, LIU N Y, FU X T, et al.Structural characteristics, biological, rheological and thermal properties of the polysaccharide and the degraded polysaccharide from raspberry fruits[J].International Journal of Biological Macromolecules, 2019, 132:109-118.
[21] AL-WRAIKAT M, HOU C, ZHAO G T, et al.Degraded polysaccharide from Lycium barbarum L.leaves improve wheat dough structure and rheology[J].LWT, 2021, 145:111372.
[22] 宋伟康. 叶托马尾藻及海葡萄多糖的提取、结构、抗氧化性以及藻渣吸附性能研究[D].海口:海南大学, 2018.SONG W K.Study on extraction, structure, antioxidant activity and adsorption of Sargassum yezoensis and grape polysaccharide[D].Haikou:Hainan University, 2018.
[23] AL-WRAIKAT M, LIU Y, WU L M, et al.Structural characterization of degraded Lycium barbarum L.leaves' polysaccharide using ascorbic acid and hydrogen peroxide[J].Polymers, 2022, 14(7):1404.
[24] 葛智超, 郎蒙, 李燕.裸藻多糖的分离纯化、单糖组成及其抗氧化活性[J].上海海洋大学学报, 2021, 30(3):564-571.GE Z C, LANG M, LI Y.Isolation, purification, monosaccharide composition and antioxidant activity analysis of Euglena gracilis polysaccharides[J].Journal of Shanghai Ocean University, 2021, 30(3):564-571.