大豆(Glycine max(Linn) Merrill.),温带物种,属豆科、大豆属植物[1]。中国是世界公认的大豆原产国,大豆栽培历史悠久[2]。大豆为人类提供约50%和25%以上的植物油和蛋白质,是世界主要的粮食油料作物之一[3]。且大豆富含多种有益于人体健康的生物活性物质,如异黄酮、生育酚等[4-5],在食品、饲料、保健及医学领域具有较高应用价值[6-8]。近年来,随着人们生活水平不断提高,大豆需求量不断增大。相关数据显示,2023年中国大豆进口量9 941万t,较上年的8 922万t增加11.4%[9]。同时,随着人们对于大豆食用需求越来越多样化,对大豆品质要求也在不断提高,大豆的品质特征成为影响大豆产业发展的重要因素。
根据目前国际市场要求,大豆品质性状主要是指外观品质、食用品质、营养品质和保健品质,其中外观品质和营养品质研究较为广泛。何梓彬等[10]和兰静等[11]分别对不同地区不同品种大豆的外观品质、营养品质和产量比较分析,发现不同品种间其外观品质、营养品质和产量存在显著差异;张秋英等[12]通过研究30个品种的菜用大豆籽粒化学组分,发现鲜食期的菜用大豆蔗糖、氨基酸含量显著高于成熟期,食用品质最佳,到成熟期其脂肪和蛋白质含量积累增加;ESCAMILLA等[13]对大豆蔗糖含量与籽粒品质性状的互作效应进行了分析研究,发现在开花早、成熟晚的大豆品种中更容易获得高蔗糖含量,而棉子糖与油脂和成熟度的相关性则受群体和环境的影响;张恒善等[14]研究了大豆籽粒脂肪和蛋白质形成积累规律,结果表明在籽粒发育过程中脂肪绝对含量呈递增曲线,蛋白质相对含量呈现前急后缓的下降曲线。目前,关于大豆代谢物的研究也有一定进展。张丽媛等[15]利用气相色谱-质谱法分离和鉴定了3个不同产地的黑河43号大豆的代谢产物,表明不同产地大豆代谢产物和代谢机制存在差异,带有产地属性;SHAN等[16]利用超高效液相色谱-四极杆飞行时间质谱(ultra high performance liquid chromatography-quadrupole time-of-flight mass spectrometry,UHPLC-QTOF-MS)方法发现小豆发酵可以产生次级代谢物抗肥胖效果;ZHANG等[17]利用液相色谱-四极杆-飞行时间串联质谱(liquid chromatography-quadrupole-time of flight mass spectrometry,LC-Q-TOF-MS/MS)揭示了大豆经枯草芽孢杆菌发酵后的纳豆成品的营养和功能特征;胡悦等[18]对丽豆和大豆进行了比较代谢组分析,研究发现,两者共检测出1 857种代谢物,且丽豆90%以上的代谢物与大豆成分类似、含量相近;分析两者差异代谢物发现,丽豆30%的化学组分含量显著高于大豆。可见,大豆的品质特性指标间存在着一定的相关性和相对独立性,前人研究主要针对不同品种、不同地区及加工过程中大豆营养品质和代谢物的变化,而针对大豆不同生育期的营养品质及其代谢物动态规律变化研究较少。
因此,本研究以新疆石河子种植的新大豆8号样品为实验材料,采集不同生长发育阶段(鼓粒前期、鼓粒中期、鼓粒后期和成熟期)大豆样品,探讨大豆中蛋白质含量、脂肪含量等品质指标的变化趋势,并利用UHPLC-QTOF-MS非靶向代谢组学技术对其关键代谢产物进行定性表征,分析其代谢产物和代谢途径,鉴定差异代谢产物,对其代谢机制进行探索,结合前期营养品质含量变化对其显著差异代谢物的累积规律进行研究。研究结果为新大豆8号的品质形成机理提供重要的理论依据,对新疆大豆营养品质调控技术的研究提供基础。
1 材料与方法
1.1 材料与试剂
所有大豆样品均采集于新疆石河子市农垦科学院大豆试验田,品种为新大豆8号,具体样品信息见表1。用于品质分析的样品经采集后,对其进行剥荚处理,籽粒使用打浆机进行研磨打浆,保存至-20 ℃冰箱,以备后续实验使用;用于代谢物分析的鲜样大豆在采后,需立即剥荚,籽粒放入5 mL螺纹旋盖保存管中,液氮速冻15 min后,立即保存至-80 ℃冰箱[19],干冰运输。
表1 大豆样品信息
Table 1 Origin information of soybean samples
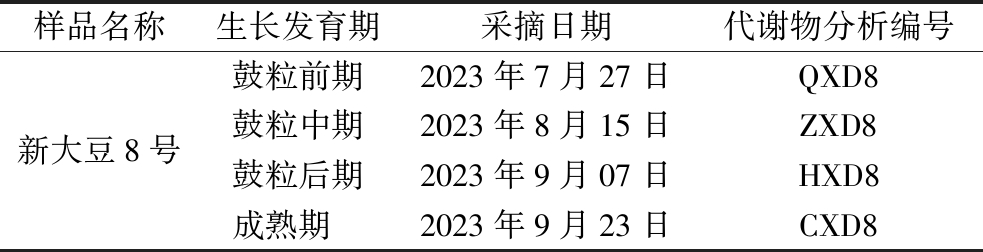
样品名称生长发育期采摘日期代谢物分析编号新大豆8号鼓粒前期2023年7月27日QXD8鼓粒中期2023年8月15日ZXD8鼓粒后期2023年9月07日HXD8成熟期 2023年9月23日CXD8
甲酸(质谱纯),上海麦克林生化科技股份有限公司;乙腈、甲醇(质谱纯),赛默飞世尔科技有限公司;无水乙醇、焦性没食子酸(分析纯),天津市致远化学试剂有限公司;三氟化硼甲醇络合物(分析纯),国药集团化学试剂有限公司;盐酸、硫酸、乙醚、石油醚(分析纯),成都市科隆化学品有限公司;碘化钾、2,6-二叔丁基对甲酚(分析纯),北京索莱宝科技有限公司;硫代硫酸钠标准溶液,上海阿拉丁生化科技股份有限公司;5种异黄酮单一标准品,大豆苷、黄豆黄苷、染料木苷、黄豆黄素、染料木素,上海源叶生物科技有限公司;37种脂肪酸甲酯混标,上海安谱实验科技股份有限公司。
1.2 仪器与设备
Triple-TOF7600超高效液相色谱串联四级杆飞行时间质谱联用仪,美国SCIEX公司;FD-1A-50冷冻干燥机,上海比郎仪器制造有限公司;WT-20Q全自动研磨仪,赛默飞世尔科技有限公司;ST-16R高速冷冻离心机,赛默飞世尔科技有限公司;HHH.S11-6电热恒温水浴锅,上海博讯实业有限公司医疗设备厂;HNDMT-2500涡旋混合仪,上海汗诺仪器有限公司;PB303-E万分之一分析天平,梅特勒-托利多仪器有限公司;MD-86L428立式-86 ℃超低温药品冷冻柜,Midea集团股份有限公司;Waters-2695高效液相色谱仪,美国Waters公司;S-433Dup全自动氨基酸分析仪,德国赛卡姆科学仪器有限公司;Kjeflex-K360全自动凯氏定氮仪,瑞士步琦有限公司;G6890 N气相色谱仪,安捷伦科技有限公司。
1.3 实验方法
1.3.1 营养品质指标测定方法
1.3.1.1 百粒鲜重
挑选100粒均匀完整、无虫眼病害的大豆籽粒进行称重,记录称重量。
1.3.1.2 百粒干重
先参照GB 5009.3—2016《食品安全国家标准 食品中水分的测定》测定大豆籽粒中的水分含量,再去除水分含量折算其干基百粒重,即为百粒干重。
1.3.1.3 灰分
参照GB 5009.4—2016《食品安全国家标准 食品中灰分的测定》,采用第一法对大豆样品进行总灰分的测定。
1.3.1.4 脂肪
参照GB 5009.6—2016《食品安全国家标准 食品中脂肪的测定》,采用第一法-索氏抽提法对大豆样品中的脂肪进行测定。
1.3.1.5 蛋白质
参照GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》,采用第一法-自动凯氏定氮法对大豆样品中的蛋白质进行测定。
1.3.1.6 可溶性糖
参照GB/T 37493—2019《粮油检验 谷物、豆类中可溶性糖的测定铜还原-碘量法》。
1.3.1.7 脂肪酸
参照GB 5009.168—2016《食品安全国家标准 食品中脂肪酸的测定》。
1.3.1.8 氨基酸
参照GB 5009.124—2016《食品安全国家标准 食品中氨基酸的测定》。
1.3.1.9 异黄酮
参照宋雯雯[20]大豆异黄酮提取方法及GB/T 26625—2011《粮油检验 大豆异黄酮含量测定》中高效液相色谱条件对所采集大豆样品进行提取测定。
1.3.2 代谢组学测定方法
1.3.2.1 样品提取
称取-80 ℃ 4个生长发育期大豆样品100 mg置于2 mL离心管中,加入300 μL的0.125%甲醇-甲酸水溶液,进行涡旋振荡30 s,20 ℃下超声15 min左右,在4 ℃ 10 000 r/min条件下离心15 min,取上清液过0.22 μm有机滤膜后得到待测样品,所有大豆待测样本等体积混合成质量控制样本(quality control,QC),所有样本贮存在4 ℃冰箱里,待测。
1.3.2.2 色谱条件
色谱柱选用ACQUITY UPLC HSS T3 1.8 μm,2.1 mm×100 mm;流动相A为0.1%甲酸水溶液;流动相B为含0.1%甲酸乙腈溶液;洗脱梯度:0~11.50 min,5%~30% B;11.50~11.51 min,30%~100% B;11.51~15.00 min,100% B;15.01~18.00 min,5% B;流速0.3 mL/min,进样量2 μL,柱温40 ℃,自动进样室温度4 ℃。
1.3.2.3 Q-TOF-MS条件
质谱采集模式:使用信息依赖型(information dependent acquisition,IDA)采集大豆样品数据。正离子模式:电喷雾电离(electrospray ionization,ESI)温度为500 ℃;喷雾器(nebulizer gas,GS1)为50 psi;辅助加热气(heating gas,GS2)为50 psi;质谱电压为5 500 V;帘气(curtain gas,CUR)压力为25 psi;去簇电压(declustering potential,DP)为60 V;离子碰撞能量(collision energy,CE)设置为10 eV。负离子模式:电喷雾电离(ESI)温度为500 ℃;喷雾器(GS1)为50 psi;辅助加热气(GS2)为50 psi;质谱电压为-4 500 V;帘气(CUR)压力为25 psi;去簇电压(DP)为-60 V;离子碰撞能量(CE)设置为-10 eV。
1.4 统计分析
营养指标测定试验重复3次,采用EXCEL 2020软件对4个阶段的测定数据进行整理,且用“平均值±标准偏差”(mean±SD)(n=3)表示,采用IBM SPSS 23.0软件对其进行显著性分析,采用单因素方差分析(one-way ANOVA)检验不同生长发育期间各指标成分的差异显著性,显著性水平设为0.05,采用GraphPad Prism 9.0软件进行绘图。
代谢差异物实验重复6次,将处理后的数据归一化为总峰强度后,在ropls R软件包中进行多变量数据分析,差异代谢物-多元统计分析(主成分分析principal component analysis,PCA;正交偏最小二乘法判别分析orthogonal partial least squares discriminant analysis,OPLS-DA;变量重要性variable importance,VIP)利用Version1.6.2 ropls R语言软件对分析结果进行作图;京都基因与基因组百科全书数据库KEGG通路富集、相关性分析和聚类分析利用Scipy Python Version1.0进行作图;代谢通路图使用Figdraw 2.0(www.figdraw.com)进行绘制。
2 结果与分析
2.1 大豆生长发育过程中营养品质动态变化规律
2.1.1 大豆生长发育过程中百粒重变化分析
大豆籽粒重量、大小和形状决定着其外观品质,从而对大豆的商品价值产生一定的影响。如图1所示,各时期大豆百粒鲜重分布呈类似正态分布,随着生长发育的进行,百粒鲜重从鼓粒初期的17.48 g,增长到鼓粒中期的39.58 g,又从鼓粒后期百粒鲜重开始下降直至成熟期的26.43 g;大豆百粒干重随发育时期的进行变化趋势显著,4个生长发育期大豆籽粒百粒干重变化整体呈现先上升后下降再上升的趋势,到鼓粒中期其百粒干重达到4个阶段中的最高峰值为34.29 g,鼓粒中期较鼓粒初期增加29.08 g,达到差异显著水平(P<0.05),鼓粒后期和成熟期平均百粒干重较为接近,均与鼓粒初期差异达显著水平(P<0.05),分别上升至22.62和24.80 g。大豆百粒干重与百粒鲜重各时期相比较发现,前3个发育时期百粒重量变化一致均表现为先上升后下降,而百粒干重从鼓粒后期至成熟期呈现出上升趋势,这可能是大豆籽粒发育后期,籽粒开始失水收缩,含水量降低的速度很快,直到降至接近收获时的重量。倪资园等[21]研究表明百粒鲜重的增长动态呈先上升后下降的抛物线式变化趋势,而百粒干重的趋势为“S”型曲线变化,这与本研究结果一致;吴润之[22]研究表明,鲜食大豆和粒用大豆干百粒重性状随发育时期上升明显,且鲜食大豆百粒重显著高于粒用大豆,大豆籽粒干重随着发育时间的延长而增加。本研究中研究对象为粒用型大豆,而其百粒干重呈现出先上升后下降再上升的变化趋势,这可能是大豆品种的不同其籽粒发育特征也有所不同导致。
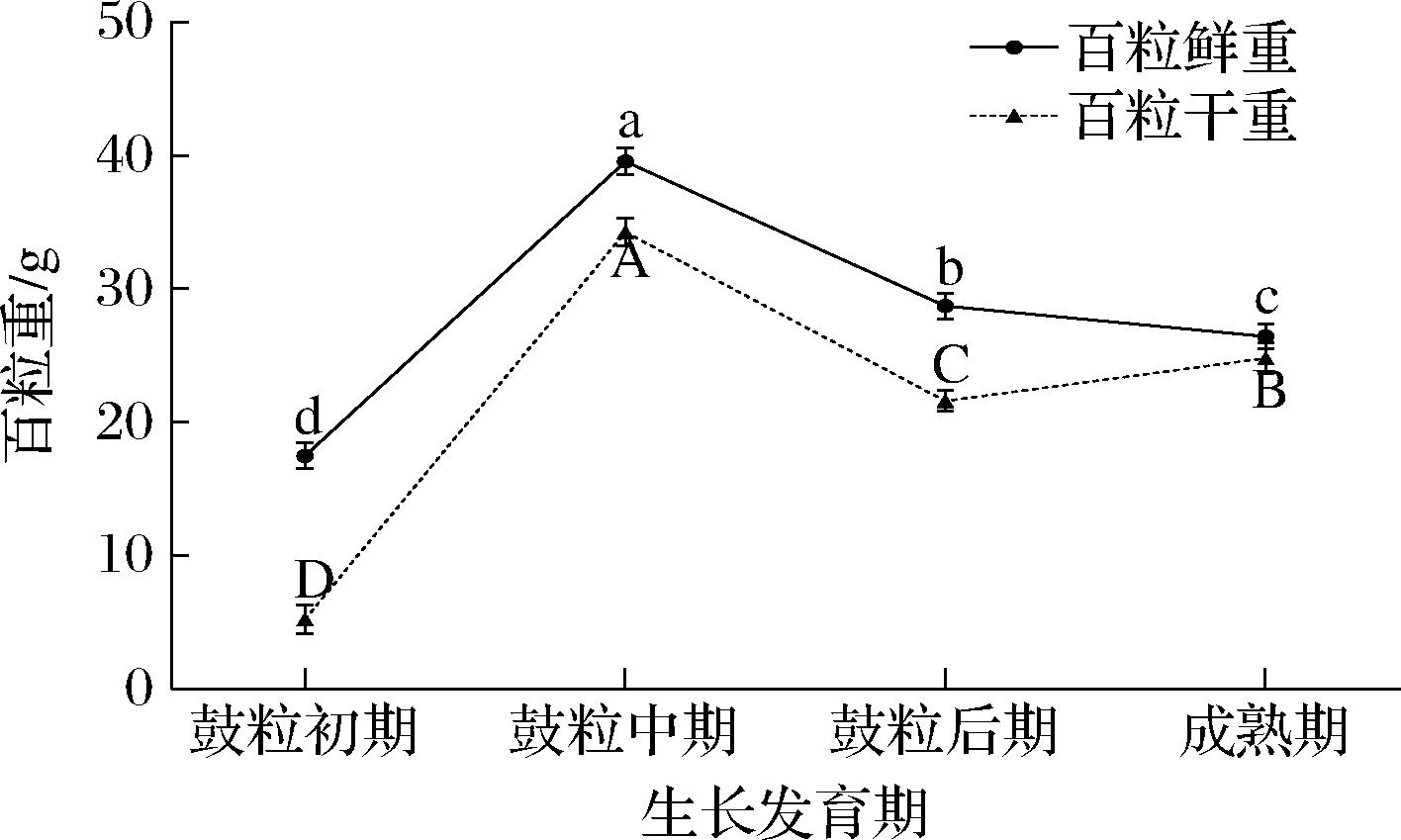
图1 大豆生长发育过程中百粒重变化
Fig.1 Changes of 100-grain weight during soybean growth and development
注:图中不同大小写字母表示不同时期处理组之间差异显著(P<0.05)(下同)。
2.1.2 大豆生长发育过程中灰分、脂肪、蛋白质、可溶性糖变化分析
大豆中灰分、脂肪、蛋白质含量随生长发育的进行明显上升,并且在鼓粒后期到成熟期上升幅度最大,而可溶性糖含量则在成熟期降低,含量变化见图2。灰分含量从鼓粒初期到鼓粒后期有明显的增加,且增加幅度较大(P<0.01),由1.29 g/100 g增加到5.29 g/100 g,鼓粒后期到成熟期灰分含量增加的趋势不明显(P>0.05)。大豆脂肪含量4个生长发育期均值由0.81 g/100 g依次升至4.50、16.93、19.96 g/100 g,较鼓粒初期上升幅度均超过15%,后3个时期脂肪含量增幅显著高于鼓粒初期(P<0.05)。蛋白质含量均值从7.25 g/100 g依次升至12.54、31.89、38.84 g/100 g,平均蛋白质和脂肪含量随生长发育的进行而变化的趋势基本一致,成熟期、鼓粒后期与鼓粒初期和鼓粒中期差异显著(P<0.05),成熟期与其他时期差异均达到了极显著水平(P<0.01)。王春雨等[23]研究表明小粒大豆、普通大豆和大粒大豆蛋白质和脂肪积累整体上均表现出鼓粒前期较低。与本研究结果相似。本研究中新大豆8号为早熟品种,这与赵晋忠等[24]研究的早熟品种研究结果一致,脂肪和蛋白质积累趋势一致呈上升态势。大豆可溶性糖含量积累动态呈现先上升后下降的趋势,在鼓粒后期可溶性糖含量达到峰值7.48 g/100 g,鼓粒后期可溶性糖含量显著高于(P<0.05)其他3个时期,这与刘业丽等[25]研究结果一致。
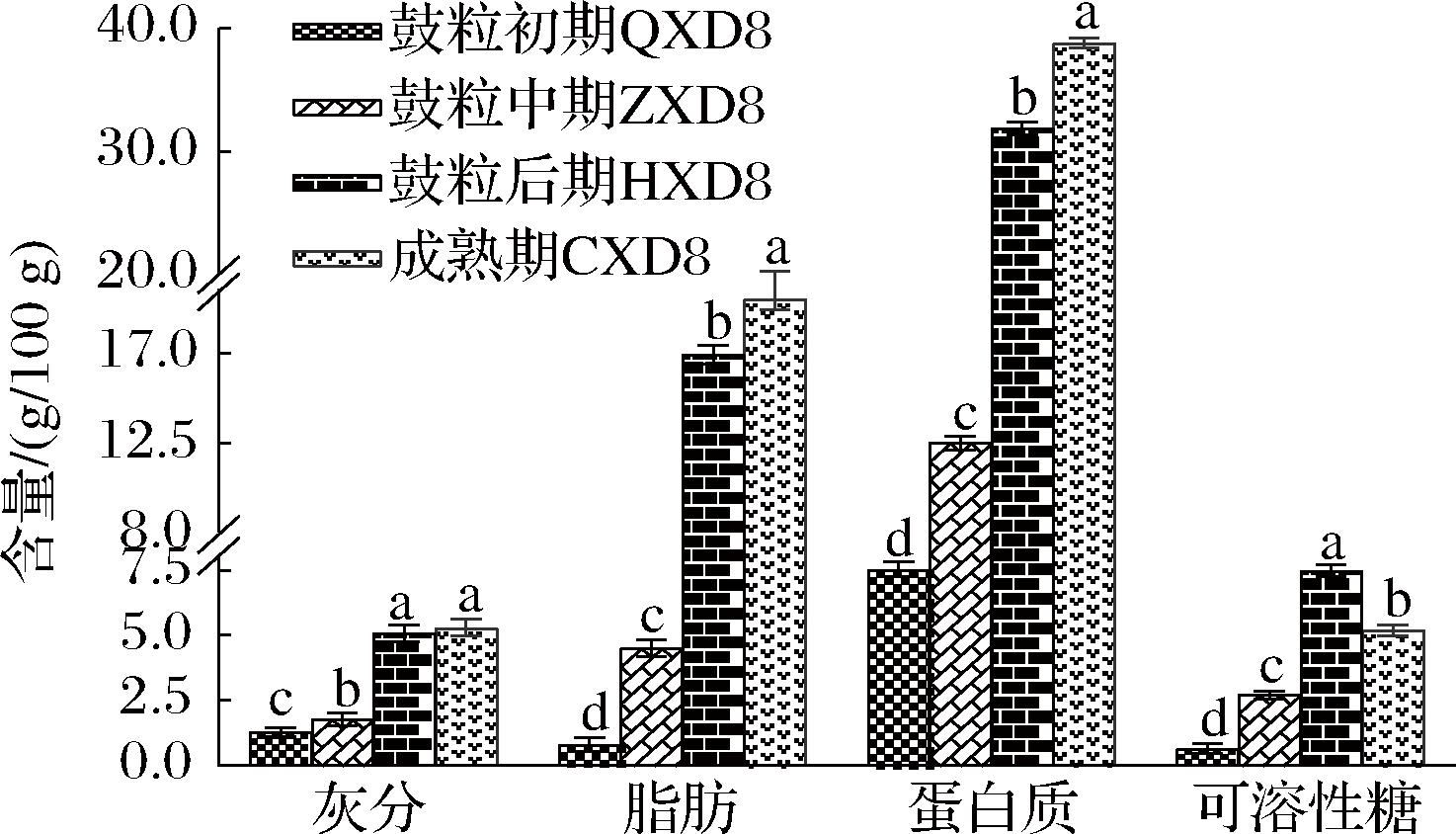
图2 大豆生长发育过程中营养指标含量变化
Fig.2 Changes of nutritional indices during soybean growth and development
2.1.3 大豆生长发育过程中脂肪酸含量变化分析
大豆不同生长发育期过程中脂肪酸含量见图3,5种脂肪酸含量在4个不同生长发育期存在显著性差异(P<0.05),含量均表现为先上升后下降趋势。5种脂肪酸在鼓粒后期均达到最高峰值,在此时期5种脂肪酸含量均值依次排序为亚油酸>油酸>棕榈酸>硬脂酸>α-亚麻酸,含量分别为1.277、0.597、0.302、0.133和0.088 g/100 g,亚油酸均值含量显著高于其余4种脂肪酸(P<0.05),α-亚麻酸积累量从鼓粒初期开始上升,进入鼓粒后期达到峰值为0.088 g/100 g,成熟期开始降低到与鼓粒中期含量相近保持不变,与徐杰等[26]等研究结果一致。大豆籽粒脂肪酸组分积累在各生长发育期受自然环境影响,米景春等[27]研究表明,大豆籽粒脂肪酸组分积累在干旱条件下不同程度降低。与前人研究相比,为保证生长条件一致,本研究采用室外大田种植,实验过程中田土以混合均匀等量自然土作营养基质,水分等量浇灌,温度光照与自然条件相同,温度、光照均为自然条件,避免人为因素影响。
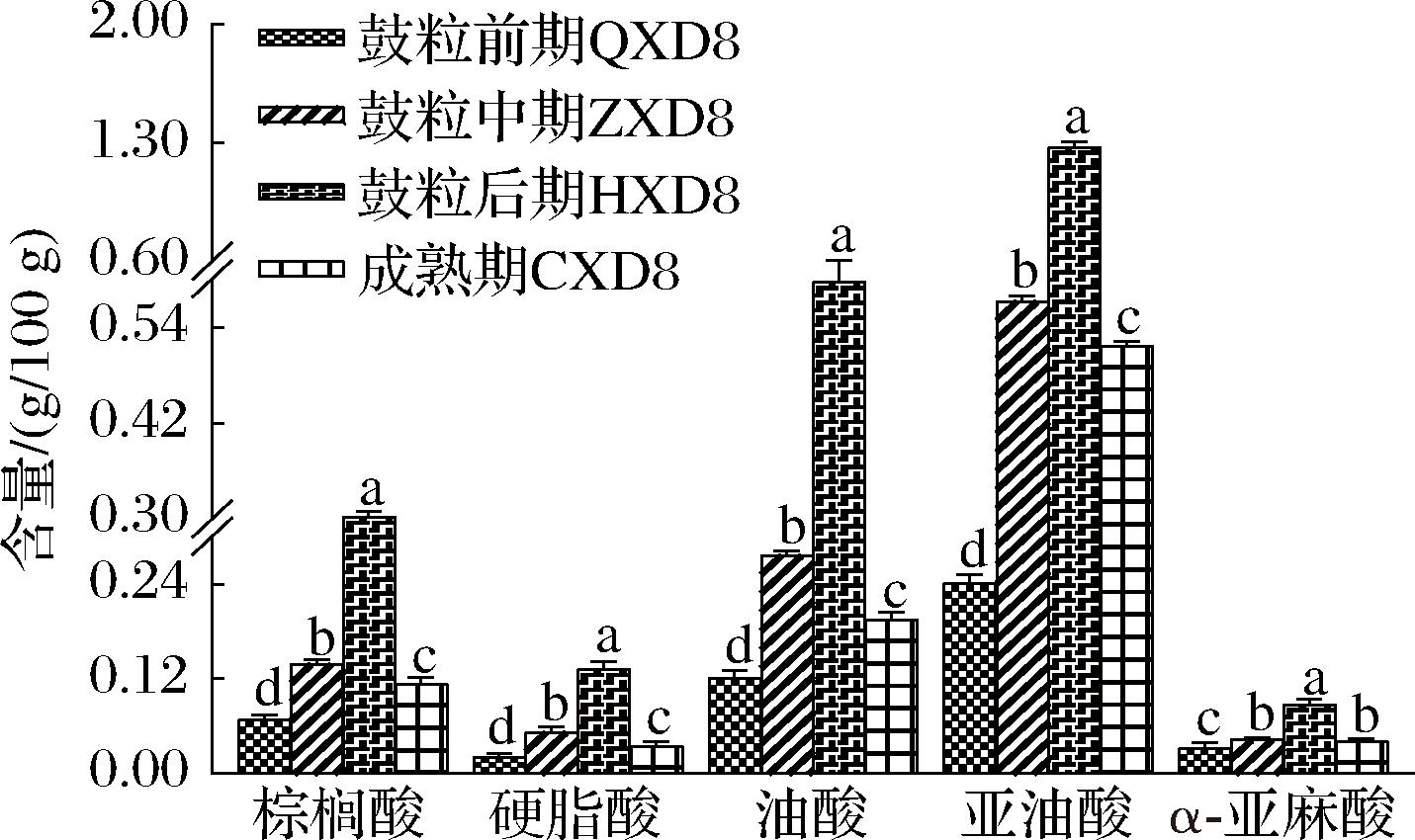
图3 大豆生长发育过程中脂肪酸含量变化
Fig.3 Changes of fatty acid content in soybean during growth and development
2.1.4 大豆生长发育过程中氨基酸含量变化分析
大豆中氨基酸组分较丰富,生长发育过程中共检测出16种氨基酸,其中含有苏氨酸、缬氨酸、蛋氨酸、异亮氨酸、亮氨酸、苯丙氨酸、赖氨酸、组氨酸等8种人体必需氨基酸。如图4、图5所示,各时期大豆游离氨基酸积累主要集中在前3阶段中,到成熟期含量趋于稳定。必需氨基酸总含量从鼓粒初期的2.88 g/100 g到鼓粒中期的4.00 g/100 g,再到鼓粒后期增长至12.07 g/100 g,直至成熟期下降为11.44 g/100 g,呈现出先上升后下降的趋势,4个时期含量均存在显著性差异(P<0.05),苏氨酸、异亮氨酸和赖氨酸成熟期的含量与鼓粒后期差异不显著(P>0.05),这一结果表明,在这2个阶段中,这3种必需氨基酸的含量保持相对稳定,未发生显著变化,组氨酸含量在鼓粒前期和鼓粒中期变化稳定,到第3阶段含量才出现明显增长,其余必需氨基酸含量均表现为先上升后下降的趋势,且4个时期间含量差异显著(P<0.05)。在大豆生长发育过程中,谷氨酸在鼓粒后期的含量显著高于同一时期其他非必需氨基酸的含量为6.41 g/100 g,甘氨酸、酪氨酸和精氨酸在后两个阶段间的含量差异不显著(P>0.05),但各非必需氨基酸组分含量在鼓粒后期积累达到峰值,整体表现为先上升后轻微下降的动态规律,鼓粒后期非必需氨基酸总量最高为20.76 g/100 g,鼓粒初期含量则最低为4.70 g/100 g,与必需氨基酸相比,非必需氨基酸含量占比显著高于必需氨基酸(P<0.05)。
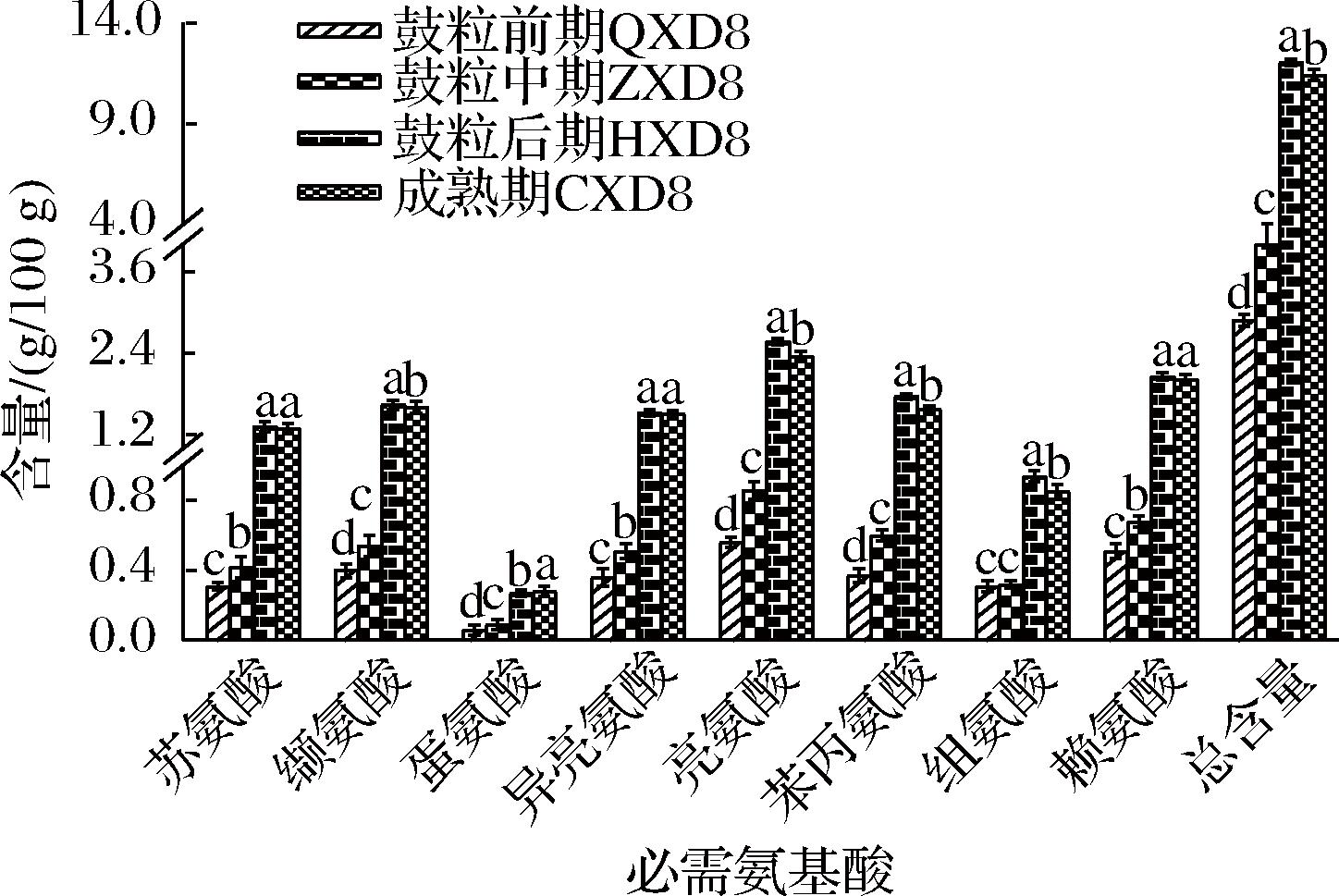
图4 大豆生长发育过程中必需氨基酸含量变化
Fig.4 Changes of essential amino acid contents during soybean growth and development
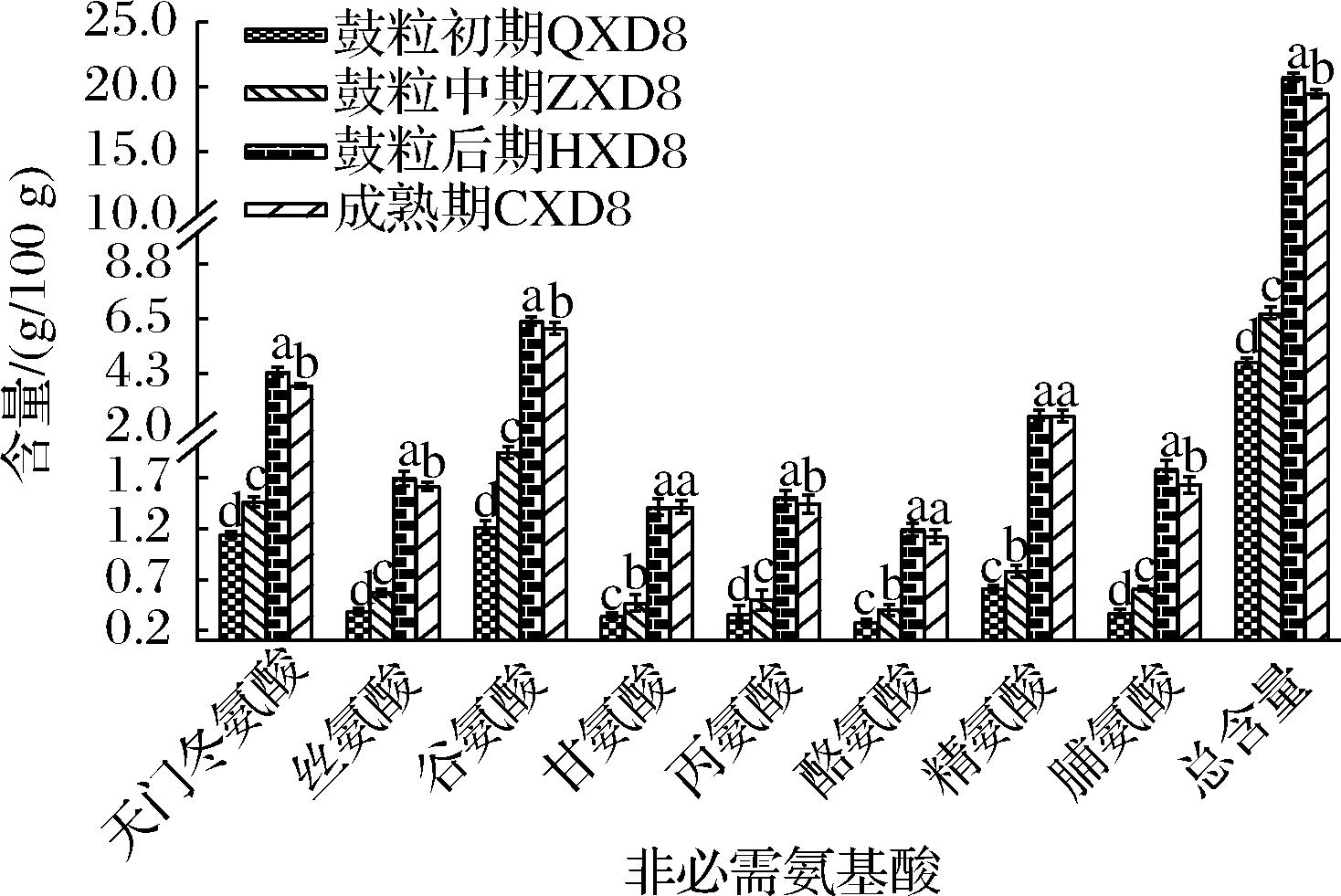
图5 大豆生长发育过程中非必需氨基酸含量变化
Fig.5 Changes of non-essential amino acids during soybean growth and development
2.1.5 大豆生长发育过程中异黄酮含量变化分析
由图6可知,在4个生长发育阶段,大豆籽粒内部大豆异黄酮含量积累动态呈现显著差异。其中,异黄酮总含量在成熟期达到峰值为4.48 mg/g,在鼓粒后期和成熟期2个阶段增长趋势较大;大豆苷、黄豆黄苷和染料木苷呈现出先轻微下降后直线上升趋势,染料木苷增长幅度最大,其成熟期含量占总含量的55%,在鼓粒中期积累最少,含量最低为0.006 mg/g;但黄豆黄素、染料木素在鼓粒后期都出现下降趋势,在成熟期含量分别下降至0.57、0.12 mg/g;本研究发现,在鼓粒前期,黄豆黄素的积累量远高于染料木素的积累量,说明黄豆黄素在鼓粒初期就开始大量形成,这与王静等[28]研究结果一致。郭远等[29]研究表明,异黄酮含量随着种子的发育进程逐渐增加,生育期较短的品种,十月前成熟收获,可获得相对较高的异黄酮,生育期较长品种在十月后完成成熟,异黄酮含量则有降低趋势,表明虽然异黄酮含量与生育期无关,但是如生育期较长,成熟后期受气候等因素的影响仍有含量降低的可能,还表明种子发育前期大豆苷的合成和积累早于染料木素,而发育后期染料木素的合成积累增加迅速,成熟时种子中染料木素含量超过大豆苷元含量,因此种子中染料木素含量一般高于大豆苷元含量。但在本研究中,染料木素含量在成熟期显著低于大豆苷含量此种情况可能是由于大豆品种的原因导致。

图6 大豆生长发育过程中大豆异黄酮含量变化
Fig.6 Changes in soybean isoflavone content during 0 soybean growth and development
2.2 大豆生长发育过程中代谢物动态变化规律分析
2.2.1 大豆生长发育过程中代谢物的主成分分析和分层聚类分析
PCA揭示组间整体代谢的差异和组内变异。图7-A第1主成分解释了总方差的39.90%,第2主成分解释了总方差的24.00%。各组间代谢物分布紧密,各时期间代谢物分离情况较为明显,说明此次分析模型良好,可进行后续其他分析。值得注意的是,QXD组与CXD组空间距离最远,表明2组间差异较大;HDX组和ZDX组在PC1上的分布比QXD组更接近,这表明HDX组和ZDX组的代谢物组成差异较小,并且随着大豆籽粒的成熟差异逐渐减小。各时期样本的PCA图分析表明,大豆的QXD、HXD、ZXD和CXD存在显著差异。
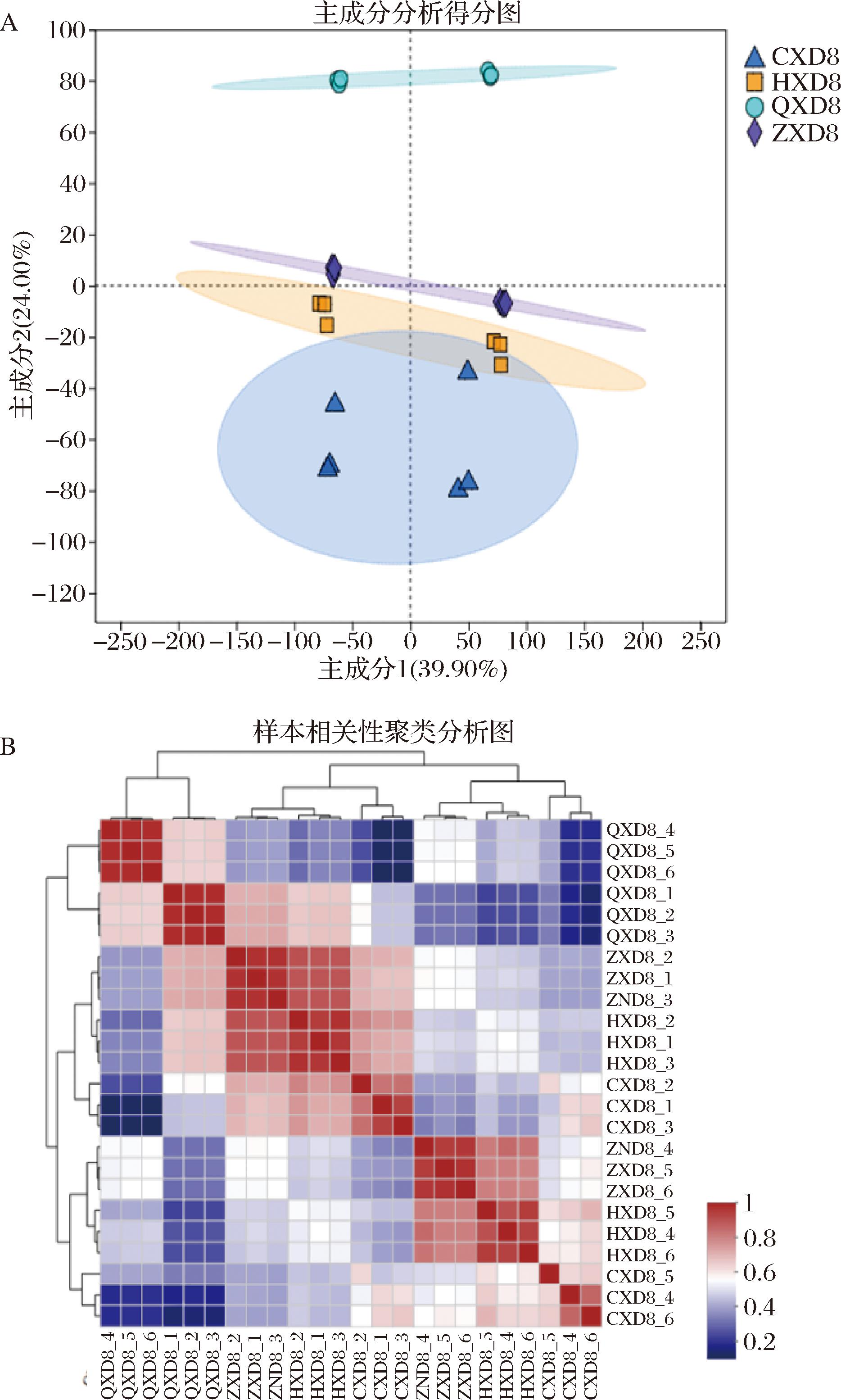
A-4个生长发育阶段大豆样本PCA总得分图;B-4个生长发育阶段大豆样本聚类分析图
图7 不同生长发育期大豆样本的PCA得分图及分层聚类分析图
Fig.7 PCA score plot (A) and hierarchical cluster analysis plot (B) of soybean samples at different growth and development stages
为了进一步确定代谢差异物,采用有监督的方法,即聚类分析。分层聚类分析见图7-B,红色表示表达含量高,蓝色表示表达含量低,从热图上可以判断,总代谢物含量的QXD组与HXD组、ZXD组、CXD组具有显著的差距,且相对含量较高的代谢物数量占优。此外,分层聚类分析的结果与PCA的结果相似,即ZXD组与CXD组的代谢物含量种类均比较接近,因此被聚为一类,同时两者与HXD组也较为接近,被聚为一大类;而QXD单独聚为另一类,与CXD差异最大。大豆籽粒中化合物在不同时期存在显著差异,这些代谢物的差异和变化对阐明大豆不同时期的发育过程具有重要意义。
2.2.2 代谢物检测结果和注释
为了更加清楚地了解在不同生长发育期中大豆中代谢物变化的规律,通过UHPLC-QTOF-MS平台非靶向代谢组技术对样品中的初生代谢物和次生代谢物进行鉴定。对数据预处理后发现,共鉴定到1 397种代谢物,其中172种为极显著差异代谢物(VIP>1.5,P<0.01,|log2(FC)|>0.1)。通过人类代谢组学数据库(human metabolome database,HMDB)和KEGG数据库鉴定、分类注释,代谢化合物二级分类见图8,可分为羧酸及其衍生物308种,有机氧化合物177种,孕烯醇酮脂类176种,脂肪酰基类151种,类黄酮化合物131种,类固醇及其衍生物77种,苯及其衍生物70种,甘油磷脂类40种等二十类化合物。
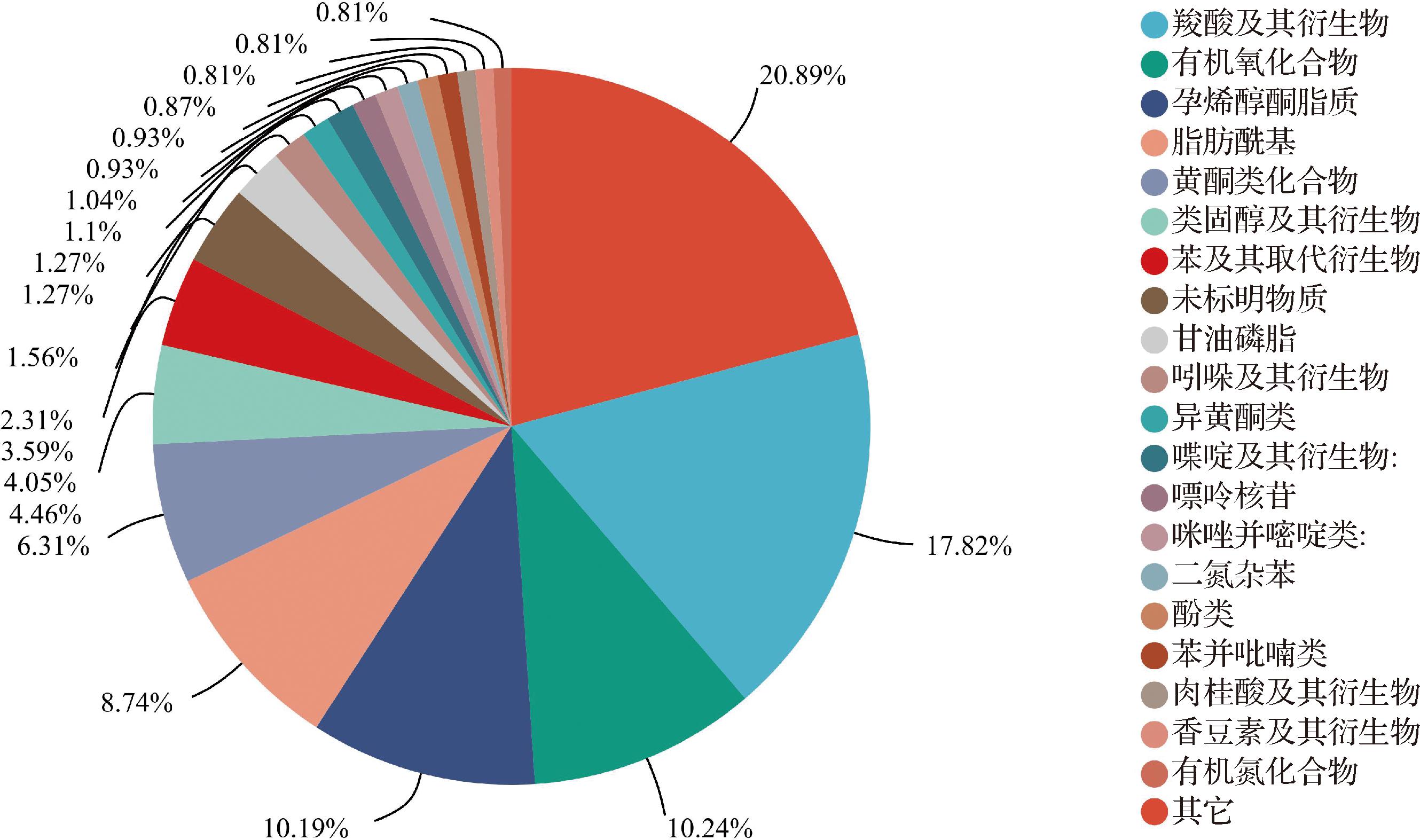
图8 大豆生长发育过程中代谢化合物二级分类图
Fig.8 Secondary classification map of metabolic compounds during soybean growth and development
2.2.3 大豆生长发育过程中差异代谢物的筛选
采用PCA和OPLS-DA对比不同生长发育期大豆籽粒的组间代谢差异,模型参数如表2所示。如图9-A、图9-B所示,CXD8组与QXD8组在PCA评分图上有显著差异(P<0.05),正离子模式下主成分1贡献率为46.00%,主成分2贡献率为27.30%,累积贡献率73.30%;负离子模式下主成分1贡献率为40.50%,主成分2贡献率为37.80%,累积贡献率为78.30%。2组间OPLS-DA模型得分如图9-C和图9-D所示,OPLS-DA模型成功区分了2组,2组之间的样本呈现出更高的聚类趋势。经交叉验证得到的模型评价参数(R2Y,Q2)列于表2。OPLS-DA的累积解释率(R2Y,cum)和预测能力值(Q2,cum)在正离子模式下分别为0.991和0.972,在负离子模式下分别为0.977和0.965。为了避免在建模过程中出现监督模型的过拟合,使用置换检验对模型进行评价。如图9-E、图9-F所示,随机模型的R2Y和Q2随着置换保留度的逐渐降低而逐渐减小,说明模型构建有效,预测准确性高,能够进行差异代谢物的筛选。
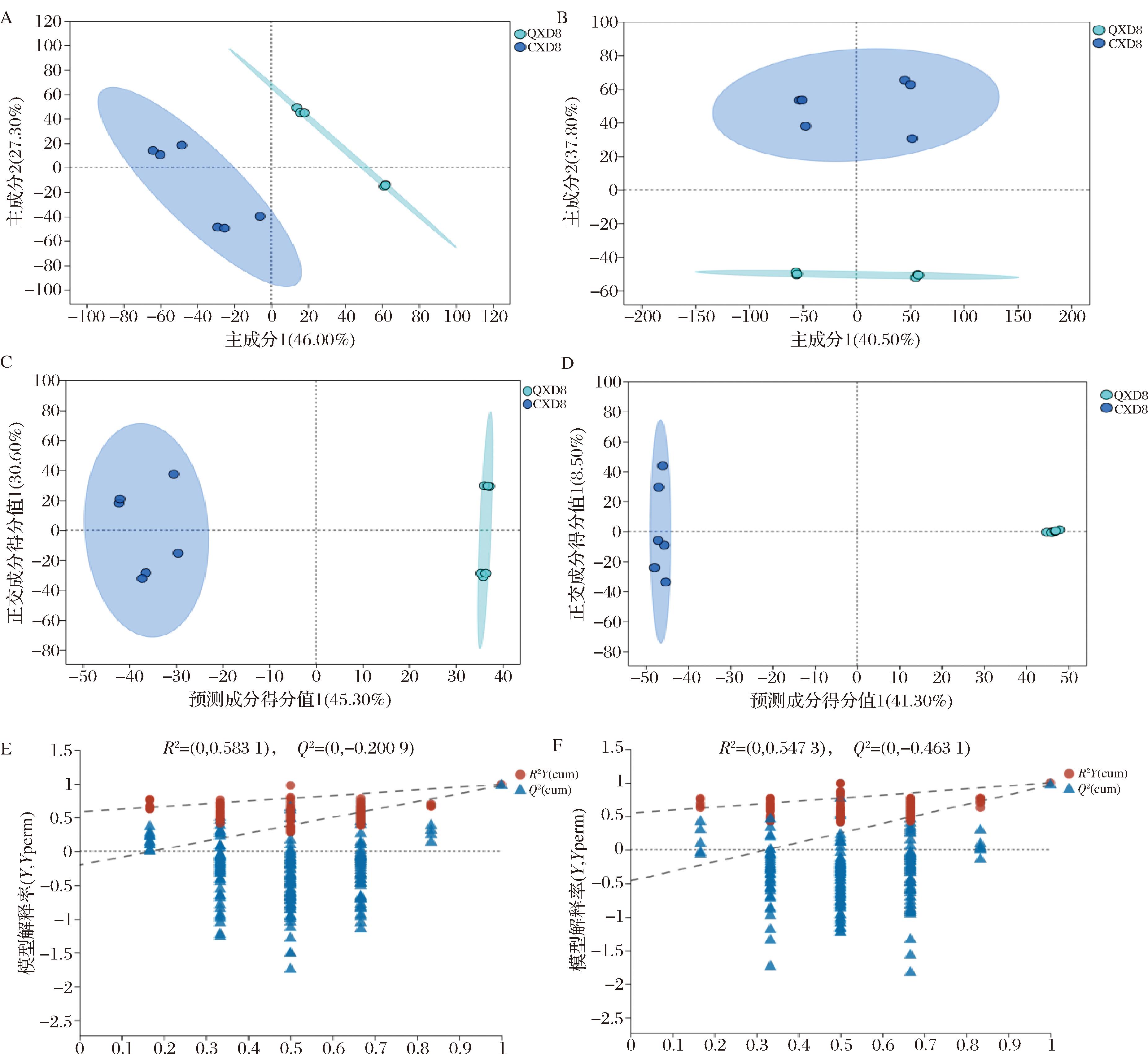
A-CXD8组-QXD8组PCA(正离子模式)得分图;B-CXD8组-QXD8组PCA(负离子模式)得分图;C-CXD8组-QXD8组OPLS-DA(正离子模式)得分图;D-CXD8组-QXD8组OPLS-DA(负离子模式)得分图;E-CXD8组-QXD8组OPLS-DA(正离子模式)模型置换检验图;F-CXD8组-QXD8组OPLS-DA(负离子模式)模型置换检验图
图9 不同生长发育期大豆籽粒间的OPLS-DA得分图和模型置换检验图
Fig.9 OPLS-DA score plot and model permutation test plot of soybean grains at different growth and development stages
表2 正交偏最小二乘判别分析模型参数
Table 2 New soybean No.8 in different growth stages of mineral element content summary table
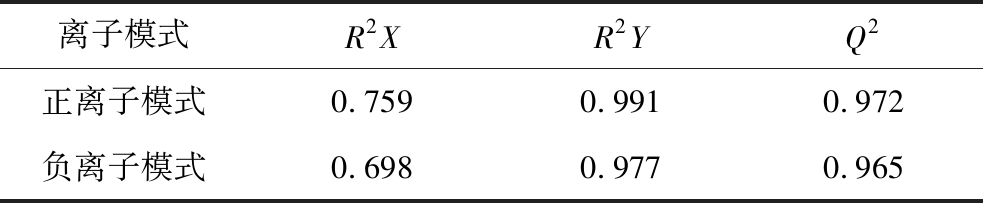
注:R2Y和Q2越接近1表明模型越稳定可靠。
离子模式R2XR2YQ2正离子模式0.7590.9910.972负离子模式0.6980.9770.965
2.2.4 大豆生长发育过程中差异代谢物的分析
经过筛选和统计分析,研究QXD8组和CXD8组在正负离子模式下的差异代谢物(图10),以OPLS-DA模型VIP值>1和P值<0.05作为鉴别差异显著代谢物的筛选标准,结果显示两组间共检测到614种化学组分,其中正离子模式中上调个数为193个,下调个数96个;负离子模式中上调个数为116个,下调个数为109个。对2个组别的差异代谢物进行大致分类,主要集中在类黄酮、氨基酸及其衍生物、脂质等代谢物。
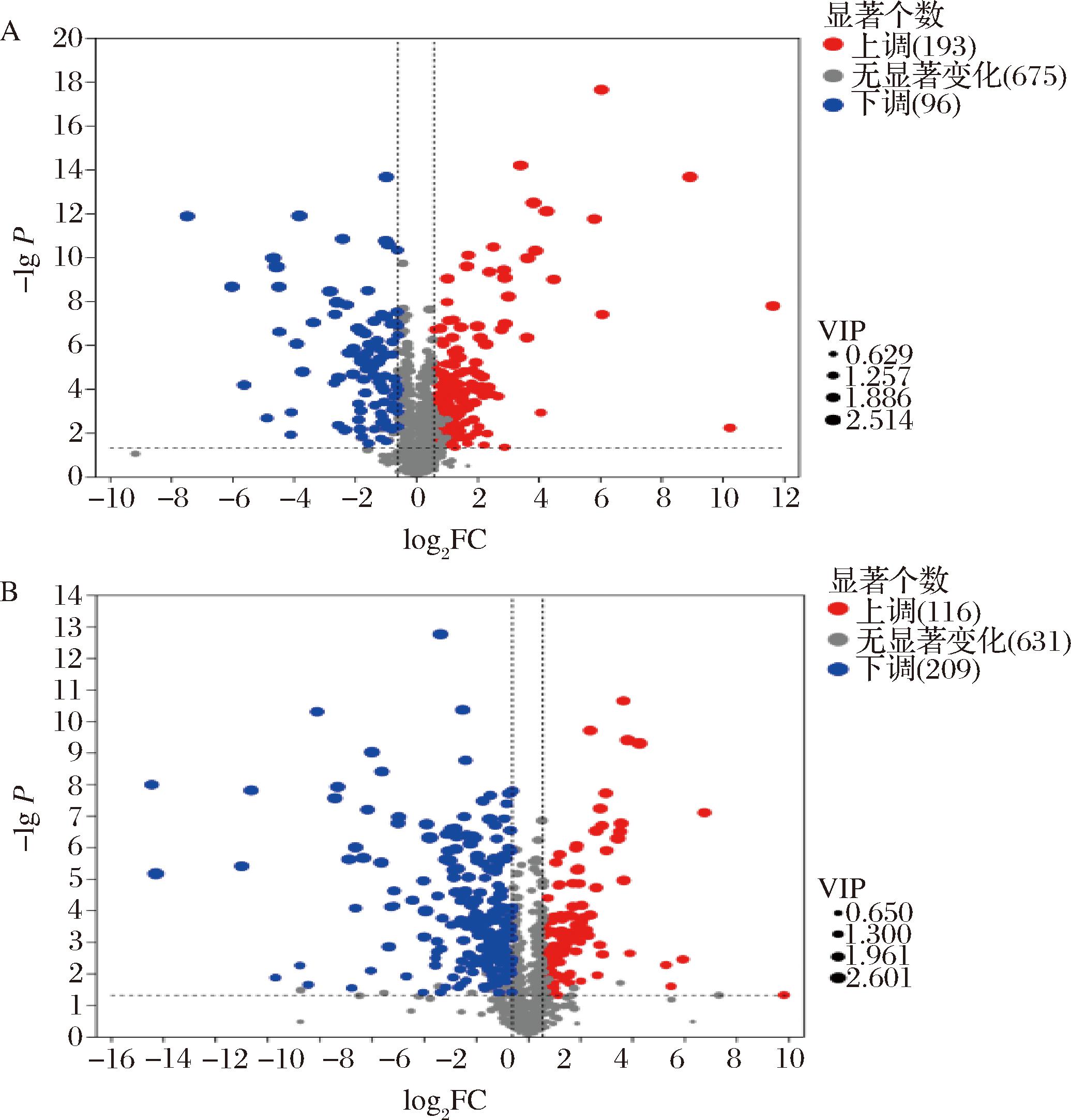
A-CXD8组-QXD8组(正离子模式)差异代谢物火山图;B-CXD8组-QXD8组(负离子模式)差异代谢物火山图
图10 大豆籽粒鼓粒前期与成熟期组间差异代谢物火山图
Fig.10 Volcano plot of differential metabolites between groups at predrum and mature stages of soybean grain
2.2.5 大豆生长发育过程中差异代谢物聚类及代谢通路分析
随着大豆的成熟,大豆的理化性质和品质也会产生明显的改变,这是一个非常复杂的、具有自我调控功能的、动态的、具有持续调控作用的代谢过程。将筛选出的QXD8和CXD8组间差异代谢物进行聚类分析(图11),图中每列代表一个样本,每行代表一个代谢物,颜色表示在组中表达的代谢物的相对量,红色表示代谢产物高水平表达,绿色表示低水平表达。结果表明有4簇QXD8组有多个代谢物的相对表达量明显高于CXD8组,即相对含量增加,包括6-乙酰氨基己酸、1-(羧乙基硫代)十四烷、苯丙氨酸-脯氨酸-精氨酸等;有6簇CXD8组多个代谢物的相对表达量明显高于QXD8组,包括3,4′,7-三羟基黄酮、大黄素、二萜酸A等。通过KEGG数据库对主要差异代谢物进行通路富集分析,QXD8与CXD8之间存在显著差异的代谢物涉及64条代谢途径,其中以下5条代谢途径存在显著差异(P<0.05):类黄酮生物合成,苯丙烷生物合成,α-亚麻酸代谢、花生四烯酸代谢、酪氨酸代谢。差异丰度评分如图12所示,可清晰看出酪氨酸代谢、类黄酮生物合成等代谢通路都分布在中轴左侧,表明此通路整体情况倾向于下调;α-亚麻酸代谢等通路分布在中轴右侧,表明该通路整体情况倾向于上调。基于差异代谢物及其代谢途径分析,本研究绘制了大豆生长发育过程中差异代谢物涉及的可能与其相关的代谢途径网络图,类黄酮生物合成代谢、脂类代谢、氨基酸代谢依次为图13、图14、图15,图中红色、黑色字体分别表示样品中检测到的代谢物、在2个及以上生长阶段具有显著差异的代谢物、可能存在于生长发育过程的代谢物,实线和虚线分别表示直接和间接代谢途径。

图11 大豆籽粒鼓粒前期与成熟期组间差异代谢物聚类热图
Fig.11 Clustering heat map of differential metabolites between groups at pre-grain filling and maturity stages of soybean
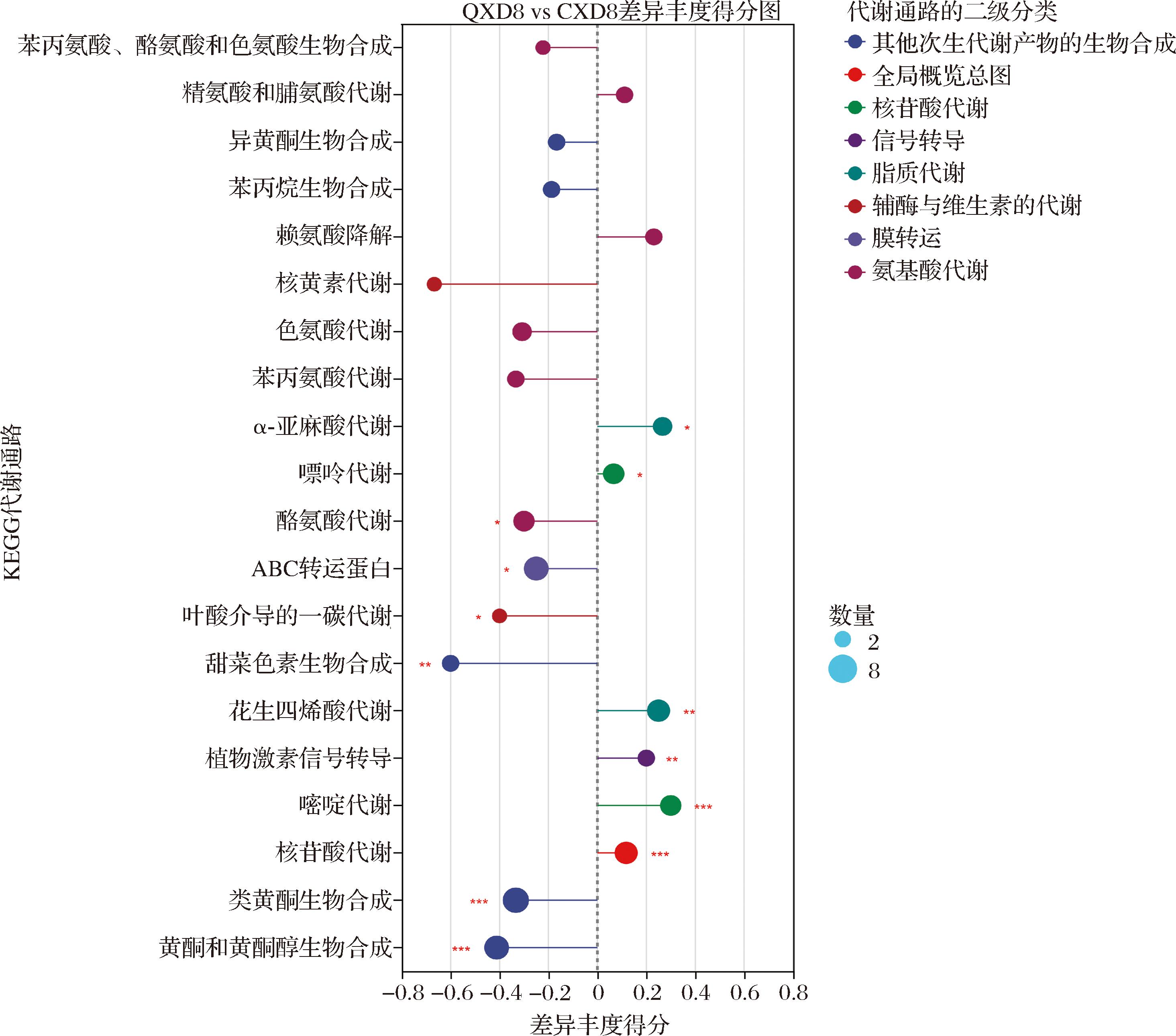
图12 大豆籽粒鼓粒前期与成熟期组间KEGG通路差异丰度得分图
Fig.12 Score map of KEGG pathway difference abundance between groups at pre-drumming stage and maturity stage of soybean grain
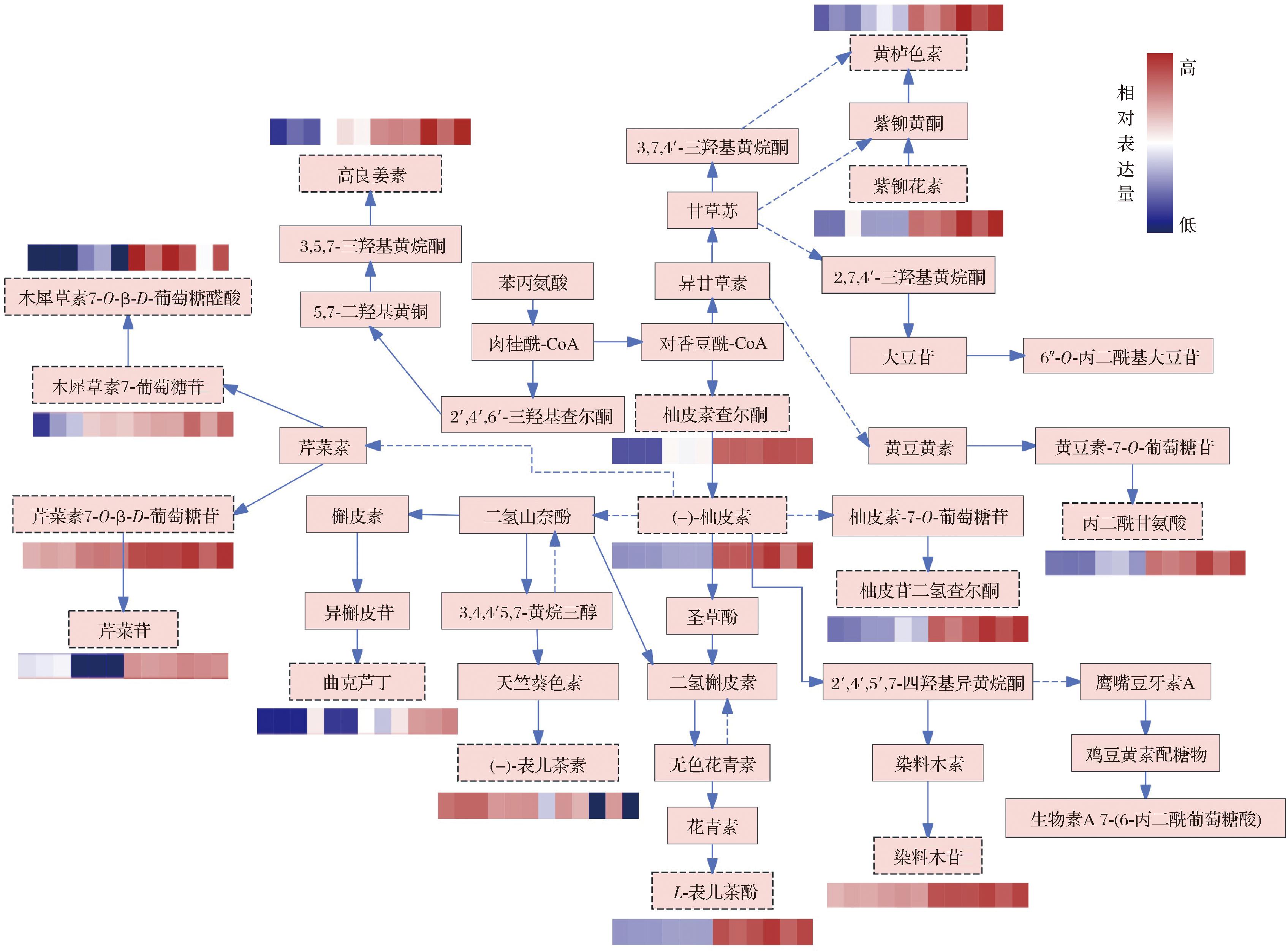
图13 大豆生长发育过程中与类黄酮代谢有关的代谢物和部分代谢途径
Fig.13 Metabolites and some metabolic pathways related to flavonoid metabolism during soybean growth and development
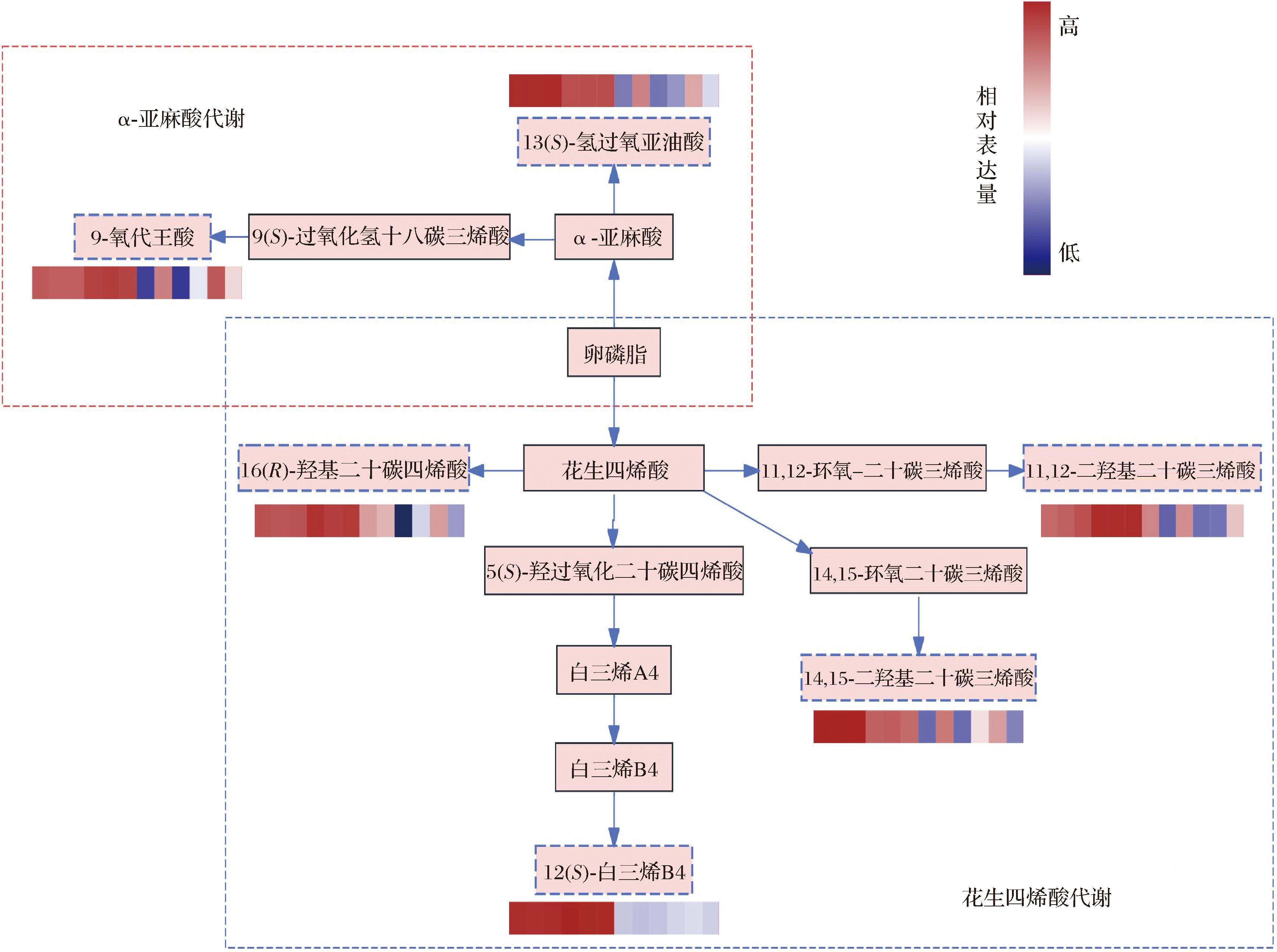
图14 大豆生长发育过程中与α-亚麻酸、花生四烯酸代谢有关的代谢物和部分代谢途径
Fig.14 Metabolites and some metabolic pathways related to α-linolenic acid and arachidonic acid metabolism during soybean growth and development

图15 大豆生长发育过程中与酪氨酸代谢有关的代谢物和部分代谢途径
Fig.15 Metabolites and some metabolic pathways related to tyrosine metabolism during soybean growth and development
2.2.5.1 类黄酮生物合成代谢通路分析
大豆中类黄酮物质的代谢途径是植物苯丙烷代谢途径中的一个小分支,该途径在整个植物界广泛存在[30]。类黄酮物质的代谢主要是植物体内的各种生物活性物质次级代谢,苯丙氨酸作为苯丙烷生物合成途径的起始分子[31],直接影响苯丙烷的代谢,而类黄酮代谢产物则通过苯丙烷的代谢途径合成。具体代谢途径如图13所示,柚皮素查尔酮、(-)-柚皮素、紫铆花素、L-表儿茶酚、高良姜素、芹菜苷、木犀草素7-葡萄糖苷等物质代谢在QXD8~HXD8时期增加,到CXD8时期缓慢减少。柚皮素代谢为表儿茶素和表儿茶酚,L-表儿茶酚的相对表达量从鼓粒前期(QXD8)的0.113显著上升到成熟期(CXD8)的2.511,其组间差异情况表现为极显著(P<0.001),而(-)-表儿茶素与之呈相反趋势,相对表达量由鼓粒前期的2.414降低到成熟期的1.159,表现为显著下降。在大豆中,大豆黄素、黄豆黄素和染料木素3种苷元型大豆异黄酮由植物苯丙氨酸途径直接合成的,染料木苷作为糖苷型异黄酮则是由苷元型异黄酮染料木素与UDP-葡萄糖苷结合生成[32]。在本研究中,染料木苷的相对丰度在QXD8~HXD8时期增加,到CXD8期略微下降,结合前期的定量分析结果,染料木苷在QXD8时期含量为0.011 mg/g,到ZXD8时期含量下降至0.006 mg/g,然后又开始上升,其含量浓度的变化可能与大豆在生长发育过程中活性物质的代谢动态变化及外界环境因素有关。种子发育中的环境温度是决定异黄酮含量的主要外界因素[33],而且大豆的生长过程中,水分胁迫不仅可以导致大豆籽粒中异黄酮含量的降低,并且影响大豆异黄酮的存在形式;土壤是植株生长发育过程中主要吸取养分的途径,因此土壤中的有机肥和微量元素也会对异黄酮积累产生影响[34]。因此,今后分析大豆不同生育时期多个异黄酮生物活性物质的合成表达情况显得十分重要。
2.2.5.2 α-亚麻酸和花生四烯酸代谢通路分析
α-亚麻酸(α-lipoic acid,ALA)是一种ω-3结构的必需脂肪酸,具有维持机体正常生理活动、降低血脂和血压、改善心血管疾病等功能[35]。花生四烯酸(arachidonic acid,ARA)是ω-6族中一种长链多元,且在人体中含量较高、分布较广泛的多不饱和脂肪酸[36]。脂类与碳水化合物和氨基酸代谢不同,脂类代谢相关的物质变化相对较小。由图14可知,卵磷脂分别显著代谢为α-亚麻酸和花生四烯酸,共有6个差异代谢物富集到2条代谢通路中,包括9-氧代壬酸、13(S)-氢过氧亚油酸、11,12-二羟基二十碳三烯酸、16(R)-羟基二十碳四烯酸、12(S)-白三烯B4和14,15-二羟基二十碳三烯酸,其中,2条通路整体在代谢转换中其相关物质相对表达量表现为下降变化。α-亚麻酸代谢通路中,卵磷脂经转化酶生成α-亚麻酸,其再代谢合成为9-氧代壬酸和13(S)-氢过氧亚油酸,代谢组学分析显示,随着大豆生长发育期的推移,α-亚麻酸相对含量呈下降趋势,9-氧代壬酸相对表达量由鼓粒前期的2.444降低到成熟期的0.801,13(S)-氢过氧亚油酸则由鼓粒初期的2.311下降至成熟期的0.714,均表现为显著下降,这与本研究中ALA含量测定的结果一致;在花生四烯酸代谢途通路中,一部分卵磷脂经转化酶生成花生四烯酸,花生四烯酸经逐步代谢为11,12-二羟基二十碳三烯酸、16(R)-羟基二十碳四烯酸、12(S)-白三烯B4和14,15-二羟基二十碳三烯酸,其中相对表达量下降最显著的为12(S)-白三烯B4,由鼓粒初期的2.795显著下降到成熟期的0.262。大豆中不饱和脂肪酸以亚油酸为主约占55%,而亚麻酸的高度不饱和性易使大豆在后续贮存和加工中氧化,是产生豆腥味的主要成分之一[37],有研究表明,通过对不同生育期大豆脂肪酸代谢途径筛选与不饱和脂肪酸代谢相关的基因,分析其表达模式,发现油酸含量在不同环境中存在稳定差异的2个大豆品种,其油酸的上游合成途径到下游的代谢利用方式也有所不同[38]。
2.2.5.3 酪氨酸代谢通路分析
酪氨酸(tyrosine,Tyr),是一种对人生长发育和新陈代谢起着重要作用的芳香族氨基酸,也是植物多种代谢产物的前体[39]。酪氨酸代谢途径是植物产生多种天然化合物的起点,如大豆中的生育酚[40]、甜菜中的甜菜碱[41]等,如图15所示,酪氨酸在酪氨酸羟化酶作用下羟化生成中间体,主要包括多巴胺、去甲肾上腺素和肾上腺素等物质的合成,再经相关酶的作用下生成了色素、草醛等物质。酪氨酸代谢途径中包含了多巴胺的生物合成,多巴胺作为一种神经递质,其合成与代谢影响后续去甲肾上腺素和肾上腺素等物质的生成。本研究发现,除去马来酸外,其余酪氨酸经酶羟化后生成的代谢物呈现整体上调趋势。
3 结论
本研究通过测定新大豆8号百粒重、灰分、脂肪、蛋白质等9项品质指标,研究了其不同生长发育期品质指标的含量变化,结果表明,同一测定指标含量在不同生长发育阶段存在显著性差异(P<0.05)。大豆籽粒营养物质积累的过程中,其百粒鲜重呈抛物线式变化,百粒干重呈S型曲线变化,鼓粒中期至鼓粒后期大豆籽粒重量变化显著;蛋白质含量和脂肪含量则明显上升;可溶性糖含量先增加后降低;脂肪酸含量到鼓粒后期大幅度增加,成熟期含量下降;测定的16种游离氨基酸中,除缬氨酸和赖氨酸外,其余氨基酸含量均呈现先升后降的规律变化;黄豆黄素和染料木素在成熟期含量下降。研究发现,除百粒重外,其余所测营养物质自鼓粒后期含量开始迅速积累,说明鼓粒后期是大豆营养物质积累调控的关键阶段。采用非靶向代谢组学研究新大豆8号4个生长发育阶段的代谢物情况,经多元统计分析,4个发育阶段大豆籽粒的代谢物具有显著性差异(P<0.05)。研究共检测到1 397种代谢物,其中172种为极显著差异代谢物(P<0.01),鼓粒前期∶成熟期(QXD8∶CXD8)差异代谢物最多,其中类黄酮生物合成、酪氨酸代谢先下调后上调,而α-亚麻酸代谢和花生四烯酸代谢则表现为下调。本研究进一步解析和推测了新大豆8号籽粒发育过程中的通路,可为解析大豆生长发育过程中的代谢机制提供理论依据。综上所述,该研究从营养品质和植物代谢组学角度初步揭示了不同生长发育期新大豆8号的营养品质含量变化及代谢产物差异性,为大豆后续深入研究提供了一定的理论基础。
[1] 韩天富, 周新安, 关荣霞, 等.大豆种业的昨天、今天和明天[J].中国畜牧业, 2021(12):29-34.HAN T F, ZHOU X A, GUAN R X, et al.Past, now and future of soybean seed industry[J].China Animal Industry, 2021(12):29-34.
[2] 何进尚. 大豆发展历史及其栽培技术研究进展[J].甘肃农业, 2009(4):89-91.HE J S.Development history of soybean and research progress of its cultivation techniques[J].Gansu Agriculture, 2009(4):89-91.
[3] 张海波. 浅析大豆的营养价值及其加工利用[J].山西农业科学, 2009, 37(5):73-75.ZHANG H B.Preliminary review on the nutritional value of soybean and its processing and utilization[J].Journal of Shanxi Agricultural Sciences, 2009, 37(5):73-75.
[4] ARIYANI W, KOIBUCHI N.The effect of soy isoflavones in brain development:The emerging role of multiple signaling pathways and future perspectives[J].Endocrine Journal, 2024, 71(4):317-333.
[5] 孙铭忆. 大豆维生素E与籽粒中异黄酮、脂肪和蛋白质的相关性分析[D].哈尔滨:东北农业大学, 2022.SUN M Y.Correlation analysis of soybean vitamin E with isoflavones, fats and protein in grains[D].Harbin:Northeast Agricultural University, 2022.
[6] DENG L L.Current progress in the utilization of soy-based emulsifiers in food applications—A review[J].Foods, 2021, 10(6):1354.
[7] SIVRIKOZ O N, KECECI S D, SANAL S M, et al.Changes in ki-67 and bcl-2 expression in rat gastric mucosa secondary to soybean feeding:An assessment of proliferative and apoptotic activity of flavonoids[J].Journal of Nutritional Biology, 2018, 4(2):196-202.
[8] 刘原媛. 大豆发酵食品对机体的保健作用[J].食品与发酵科技, 2020, 56(4):65-68;132.LIU Y Y.The health function of fermented soybean food to the body[J].Food and Fermentation Sciences &Technology, 2020, 56(4):65-68;132.
[9] 郑祖庭. 2023年国内外大豆市场回顾及2024年展望[J].黑龙江粮食, 2024(2):23-26;12.ZHENG Z T.Review of soybean market at home and abroad in 2023 and prospect in 2024[J].Heilongjiang Grain, 2024(2):23-26;12.
[10] 何梓彬, 何龙, 黄惠绿, 等.不同菜用大豆品种产量与外观品质分析[J].黑龙江农业科学, 2023(7):7-13;19.HE Z B, HE L, HUANG H L, et al.Analysis of yield and appearance quality of different vegetable soybean varieties[J].Heilongjiang Agricultural Sciences, 2023(7):7-13;19.
[11] 兰静, 王冰, 李宛, 等.黑龙江省主栽大豆品种品质优势分析[J].大豆科学, 2022, 41(1):107-113.LAN J, WANG B, LI W, et al.Analysis on quality advantages of main soybean cultivars in Heilongjiang Province[J].Soybean Science, 2022, 41(1):107-113.
[12] 张秋英, 李彦生, 刘长锴, 等.菜用大豆食用品质关键组分及其积累动态研究[J].作物学报, 2015, 41(11):1692-1700.ZHANG Q Y, LI Y S, LIU C K, et al.Key components of eating quality and their dynamic accumulation in vegetable soybean varieties [Glycine max(L.) merr.[J].Acta Agronomica Sinica, 2015, 41(11):1692-1700.
[13] ESCAMILLA D M, XAVIER A, VUONG T D, et al.An assessment of the interaction between sucrose content and seed quality traits in soybeans[J].Crop Science, 2023, 63(5):2650-2664.
[14] 张恒善, 梁振富, 杨玉环, 等.大豆种子脂肪和蛋白质形成及积累规律的初步研究[J].大豆科学, 1990, 9(3):191-197.ZHANG H S, LIANG Z F, YANG Y H, et al.A preliminary study on the law of formation and accumulation of oil and protein of soybean seed[J].Soybean Science, 1990, 9(3):191-197.
[15] 张丽媛, 代安娜, 于润众, 等.基于代谢组学的黑龙江省不同产地大豆的代谢产物分析[J].现代食品科技, 2021, 37(6):287-295;319.ZHANG L Y, DAI A N, YU R Z, et al.Analysis of metabolites of soybeans from different producing origins in Heilongjiang Province based on metabonomics[J].Modern Food Science and Technology, 2021, 37(6):287-295;319.
[16] SHAN L Y, TYAGI A, CHEN X Q, et al.Potential anti-obesity effect of fermented adzuki beans and their untargeted metabolomics using UHPLC-QTOF-MS[J].Food Bioscience, 2023, 52:102380.
[17] ZHANG L L, WU J L, XU P, et al.Soy protein degradation drives diversity of amino-containing compounds via Bacillus subtilis natto fermentation[J].Food Chemistry, 2022, 388:133034.
[18] 胡悦, 任保青, 陈陆琴, 等.基于LC-MS代谢组学技术的丽豆-大豆差异代谢物比较研究[J].广西植物, 2023, 43(12):2245-2255.HU Y, REN B Q, CHEN L Q, et al.Comparative analysis of differential metabolites between Calophaca sinica and Glycine max based on LC-MS metabolomics technology[J].Guihaia, 2023, 43(12):2245-2255.
[19] CAO S, ZHANG Z J, SUN Y H, et al.Profiling of widely targeted metabolomics for the identification of secondary metabolites in heartwood and sapwood of the red-heart Chinese fir (Cunninghamia lanceolata)[J].Forests, 2020, 11(8):897.
[20] 宋雯雯. 中国大豆功能性成分地理分布规律及环境影响因素分析[D].北京:中国农业科学院, 2018.SONG W W.Geographical distribution of soybean functional components and analysis of environmental influencing factors in China[D].Beijing:Chinese Academy of Agricultural Sciences, 2018.
[21] 倪资园, 蔡丽, 谢皓, 等.大豆籽粒发育过程中营养物质的积累动态分析[J].北京农学院学报, 2011, 26(2):1-3;9.NI Z Y, CAI L, XIE H, et al.Analysis of dynamic accumulation on nutrients during maturing process in soybean seed[J].Journal of Beijing University of Agriculture, 2011, 26(2):1-3;9.
[22] 吴润之. 不同大豆品种鼓粒期主要品质动态研究[D].淮安:淮阴工学院, 2021.WU R Z.Dynamic study on main quality of different soybean varieties during grain filling stage [D].Huaian:Huaiyin Institute of Technology, 2021.
[23] 王春雨, 李彦生, 刘长锴, 等.不同粒重大豆籽粒蛋白质、脂肪及可溶性糖积累动态[J].新疆农业科学, 2021, 58(1):56-64.WANG C Y, LI Y S, LIU C K, et al.Seed protein, oil and free soluble sugar accumulation during seed fillingin soybean cultivars with different seed size[J].Xinjiang Agricultural Sciences, 2021, 58(1):56-64.
[24] 赵晋忠, 吴慎杰, 杜维俊, 等.不同生育期大豆品种蛋白质、脂肪积累的变化规律及其与品质的关系[J].华北农学报, 2004, 19(4):33-35.ZHAO J Z, WU S J, DU W J, et al.The relationship between variation and quality and the accumulation of protein and fat with different-maturing soybean cultivars[J].Acta Agriculturae Boreali—Sinica, 2004, 19(4):33-35.
[25] 刘业丽, 栾怀海, 何琳, 等.大豆可溶性糖积累规律研究[J].黑龙江农业科学, 2014(5):45-48.LIU Y L, LUAN H H, HE L, et al.Study on accumulation regularity of soluble sugar in soybean[J].Heilongjiang Agricultural Sciences, 2014(5):45-48.
[26] 徐杰, 胡国华, 张大勇, 等.大豆籽粒发育过程中脂肪酸组分的累积动态[J].作物学报, 2006, 32(11):1759-1763.XU J, HU G H, ZHANG D Y, et al.Dynamic accumulation of fatty acids in grain maturing process of soybean[J].Acta Agronomica Sinica, 2006, 32(11):1759-1763.
[27] 米景春, 刘丽君.干旱对大豆发育种子油脂脂肪酸形成的调节[J].种子世界, 1993(2):20-21;18.MI J C, LIU L J.Regulation of drought on fatty acid formation of soybean seed oil[J].Seed World, 1993(2):20-21;18.
[28] 王静, 李冬梅, 黄月明, 等.大豆籽粒中异黄酮及底物含量动态变化研究[J].大豆科学, 2014, 33(5):697-700.WANG J, LI D M, HUANG Y M, et al.Dynamic change of soybean isoflavone and its synthetic substrate during seeds developing[J].Soybean Science, 2014, 33(5):697-700.
[29] 郭远, 杨柳, 王园清, 等.大豆种子发育过程中异黄酮含量的动态分析[J].农学学报, 2012, 2(11):1-5;36.GUO Y, YANG L, WANG Y Q, et al.The dynamic analysis of isoflavone during seed development in soybean[J].Journal of Agriculture, 2012, 2(11):1-5;36.
[30] 商炳哲. 高异黄酮大豆种质鉴定与外源MeJA对异黄酮积累的影响[D].杨凌:西北农林科技大学, 2023.SHANG B Z.Identification of soybean germplasm with high isoflavone content and the effect of exogenous MeJA on isoflavone accumulation[D].Yangling:Northwest A &F University, 2023.
[31] 谢倩, 江来, 贺进, 等.不同鲜食品质橄榄果实转录组测序及酚类代谢途径相关调控基因挖掘[J].生物技术通报, 2024, 40(3):215-228.XIE Q, JIANG L, HE J, et al.Regulatory genes mining related to transcriptome sequencing and phenolic metabolism pathway of Canarium album fruit with different fresh food quality[J].Biotechnology Bulletin, 2024, 40(3):215-228.
[32] 赵艳妹, 刘林娅, 鲁明秋, 等.异黄酮生物合成通路及关键酶研究进展[J].食品与发酵工业, 2024, 50(2):343-353.ZHAO Y M, LIU L Y, LU M Q, et al.Advances on pathway of isoflavone biosynthesis and relevant key enzymes[J].Food and Fermentation Industries, 2024, 50(2):343-353.
[33] AZAM M, ZHANG S R, QI J, et al.Effect of origin, seed coat color, and maturity group on seed isoflavones in diverse soybean germplasm[J].Plants, 2024, 13(13):1774.
[34] KUROSAKI H, KOYANO S, AOYAMA S.Effects of shading, soil moisture, fertilizations and sowing time on isoflavone content of soybean seed in Hokkaido[J].Plant Production Science, 2023, 26(4):364-377.
[35] 陈福妮, 王卫飞, 穆利霞, 等.6种富含α-亚麻酸食用油脂的主要组成成分及消化特征研究进展[J].中国油脂, 2024, 49(1):60-66.CHEN F N, WANG W F, MU L X, et al.Progress on composition and digestive characteristics of 6 kinds of edible oils rich in α-linolenic acid[J].China Oils and Fats, 2024, 49(1):60-66.
[36] LIU M, DU X F, CHEN H F, et al.Systemic investigation of di-isobutyl phthalate (DIBP) exposure in the risk of cardiovascular via influencing the gut microbiota arachidonic acid metabolism in obese mice model[J].Regenerative Therapy, 2024, 27:290-300.
[37] 李文滨, 冯雷, 宋伟, 等.大豆脂肪酸含量积累动态及亚麻酸代谢候选基因筛选[J].东北农业大学学报, 2017, 48(11):1-8.LI W B, FENG L, SONG W, et al.Accumulation dynamics of fatty acid in soybean seed and screening of candidate gene related to linolenic acid metabolism[J].Journal of Northeast Agricultural University, 2017, 48(11):1-8.
[38] 刘骏麒. 利用转录组分析揭示大豆籽粒油酸含量的调控网络和枢纽基因[D].昆明:云南大学, 2022.LIU J Q.Revealing the regulatory network and key genes of oleic acid content in soybean seeds by transcriptome analysis[D].Kunming:Yunnan University, 2022.
[39] 张琴, 董晓庆, 林欣, 等.基于UPLC-MS/MS的不同产地蜂糖李果实初生代谢差异分析[J].食品科学, 2023, 44(8):284-292.ZHANG Q, DONG X Q, LIN X, et al.Ultra-high performance liquid chromatography-tandem mass spectrometry-based metabolomic analysis of primary metabolites in’Fengtang’Plum fruits from different geographical origins[J].Food Science, 2023, 44(8):284-292.
[40] 秦宁, 李俊茹, 李文龙, 等.大豆籽粒生育酚及其组分含量鉴定与优异种质筛选[J].作物杂志, 2021(3):34-39.QIN N, LI J R, LI W L, et al.Screening of elite germplasms and identification of seed tocopherol and its component contents in soybean[J].Crops, 2021(3):34-39.
[41] 杨家琪, 韩广源, 刘乃新, 等.甜菜酪氨酸代谢途径关键酶的生物信息学研究[J].中国农学通报, 2024, 40(9):124-131.YANG J Q, HAN G Y, LIU N X, et al.A bioinformatics study on key enzymes involved in tyrosine metabolism in beet[J].Chinese Agricultural Science Bulletin, 2024, 40(9):124-131.