黄原胶(xanthan gum,XG)是由黄单胞杆菌发酵产生的微生物阴离子多糖,黄原胶分子的基本结构由重复的五糖单元组成:D-葡萄糖以β-1,4-糖苷键连接形成类纤维素结构的主链和由D-甘露糖和D-葡萄糖醛酸交替的三糖单元连接构成的侧链[1],分子质量为2×106~5×107 Da[2]。黄原胶在分子间和分子内可通过氢键等作用力形成双螺旋结构,以多重双螺旋聚合体状态存在[3-4],侧链围绕主链的结构使得黄原胶具有增稠[5]、耐温[6]、耐酸碱等稳定性质。黄原胶分子具有大量的羟基、羧基等亲水基团,表现出良好的亲水性,通常作为助悬剂、增稠剂、稳定剂等在食品、化工、石油开采等领域得以广泛应用并被大量生产[7]。黄原胶生产工艺成熟[1],具有产量高、价格低的优势,以黄原胶为基质,开发新型黄原胶,赋予其抑菌特性能够拓宽其在食品工业中饮料生产、焙烤、粮食加工、乳制品以及调味品生产中的应用[8],增加黄原胶产品附加值,有望助推黄原胶产品产业的新发展。
目前关于黄原胶改性的研究主要通过物理和化学方法改变黄原胶的分子结构[9],调节其黏度,实现不同应用领域对黄原胶流变性能的需求[10]。物理改性主要是通过超声波降解[11]、辐射降解、机械降解等使黄原胶分子链断开,降低黄原胶分子质量,达到改变其黏度的目的[12];化学改性则是通过醚化反应、醛基取代反应[13]、酯化反应[14]等方法,改变黄原胶分子间作用力,降低胶体黏度,调整其流体力学性能[13]。高碘酸钠能够特异性氧化糖单元2、3位的邻羟基生成双醛结构[15],醛基带有正电荷的碳与带孤对电子的氨基(—NH2,细菌蛋白质的氨基)或细菌酶系统的巯基(—SH)等发生亲核加成反应,使细菌失去复制能力,引起代谢系统紊乱,达到杀菌抑菌的目的[16]。研究高碘酸钠特异性氧化过程对双醛黄原胶醛基含量和分子质量的影响,获得双醛黄原胶的制备工艺。以大肠杆菌与金黄色葡萄球菌为样本研究双醛黄原胶对革兰氏阴性菌和革兰氏阳性菌的抑菌特性[17],在增强食品稳定性、延长食品货架期、功能食品开发等方面,具有巨大的潜在市场价值[18]。
1 材料与方法
1.1 材料与试剂
黄原胶,内蒙古鄂尔多斯中轩生化股份有限公司;高碘酸钠、盐酸羟胺,上海阿拉丁生化科技股份有限公司;无水乙醇,天津市鑫铂特化工有限公司;氢氧化钠,天津市凯通化学试剂有限公司;盐酸,成都市科隆化学品有限公司;乙二醇,天津市风船化学试剂科技有限公司。
1.2 仪器与设备
陶瓷面板磁力加热搅拌器、Nicolet iS5傅里叶红外光谱仪、Thermo Scientific Apreo 2C扫描电子显微镜,赛默飞世尔科技公司;MQD-B2T叠加式振荡培养箱,上海旻泉器械有限公司;HH-B11电热恒温培养箱,上海跃进医疗器械有限公司;W-CJ-1FD单人单面(垂直)净化工作台,江苏通净净化设备有限公司;QUINTIX313-1CN精密天平,赛多利斯;SX-700 Tomy立式压力蒸汽灭菌锅,Tomy Digital Biology公司;P4紫外-可见分光光度计,上海美谱达仪器有限公司;Rigaku Ultima Ⅳ型X-射线衍射仪,日本理学公司;Waters Ultrahydrogel色谱柱,沃特世公司。
1.3 实验方法
1.3.1 双醛黄原胶的制备
将烘干至恒重的黄原胶溶于400 mL去离子水中,在45 ℃下搅拌30 min成均相后升温至50 ℃糊化30 min,冷却后称取一定量高碘酸钠溶于100 mL去离子水加入其中,一定温度下反应数小时后,加入5 mL乙二醇搅拌10 min终止反应,加入3倍体积无水乙醇絮凝,4 500 r/min,离心20 min,弃去上清液,固相装入500 Da的透析袋透析2 d,每12 h更换一次去离子水,将透析后的黄原胶取出烘干后用球磨机粉碎,得到双醛黄原胶(dialdehyde xanthan gum,DXG)。
1.3.2 黄原胶与高碘酸钠反应单因素条件设定
反应氧化剂用量设定:取5 g黄原胶,黄原胶与高碘酸钠摩尔比为1∶1、1∶1.25、1∶1.5、1∶1.75、1∶2,反应温度和时间设为45 ℃和3 h。
反应温度设定:取5 g黄原胶,反应温度分别设为35、40、45、50、55 ℃,黄原胶与高碘酸钠摩尔比为1∶1.75,反应时间为3 h。
反应时间设定:取5 g黄原胶,反应时间分别设为2、2.5、3、3.5、4 h,黄原胶与高碘酸钠摩尔比为1∶1.75,反应温度为45 ℃。
1.3.3 醛基含量测定
由于特异性氧化生成黄原胶双醛结构,因而其氧化程度可以用醛基含量来表示,实验中醛基含量的测定方法采用盐酸羟胺法。其具体操作过程如下:称取150 mg黄原胶和双醛黄原胶分别溶解在30 mL去离子水中,调节pH值到5.0。然后取10 mL待测液加入10 mL浓度为0.72 mol/L的盐酸羟胺溶液(保证过量)。混合物在磁力搅拌下于40 ℃的水浴中反应4 h,反应结束后用0.02 mol/L的NaOH滴定反应体系中生成的盐酸使总体系的pH值达到5.0,并记录NaOH的消耗量。实验重复3次,结果值算数平均值。醛基含量(AC) 按公式(1)计算:
(1)
式中:CNaOH,用于滴定反应的NaOH的物质的量浓度,即0.02 mol/L;m,双醛黄原胶的质量,g;Vc,用于滴定双醛黄原胶时NaOH的消耗量,L;Vb,用于滴定相同质量的黄原胶时NaOH 的消耗量,L;239,双醛黄原胶中重复单元的分子质量。
1.3.4 正交试验
以单因素结果为依据建立因素水平表(表1),以双醛黄原胶醛基含量为评判指标,按照L9(33)正交表来进行试验优化方案的设计。
表1 正交试验因素水平设计表
Table 1 Orthogonal experimental factor level design for the preparation process of dialdehyde xanthan gum

水平因素氧化剂比例(摩尔比)反应温度/℃反应时间/h11∶2402.521∶1.7545331∶1.5503.5
1.3.5 双醛黄原胶的结构表征
1.3.5.1 傅里叶红外光谱分析分子结构变化
采用傅里叶红外光谱仪验证改性前后黄原胶分子结构的变化。样品干燥至恒重后,分别取大约2 mg的样品与200 mg的KBr置入玛瑙研钵中研磨成均匀贴壁的粉末后,装入清洁后的模具,用压片机压制成半透明的薄片。取出薄片装入傅里叶变换红外光谱仪进行检测。设置测试波数范围为450~4 000 cm-1,带宽为4 cm-1。
1.3.5.2 X-射线衍射分析晶型变化
X-射线衍射(X-ray diffraction,XRD)图谱采用X-射线衍射仪测定。测试条件:样品干燥至恒重后置入玛瑙研钵中研磨成均匀贴壁的粉末后,放入模具中压平,使用铜靶X射线(λKα=0.154 nm),衍射角2θ的衍射范围设置为5°~550°,扫描速率为2°/min[19]。
1.3.5.3 高效液相色谱测定分子质量
分子质量校正曲线的绘制:分别称取适量已知分子质量的聚乙二醇标准品,用流动相溶解,配成10 mg/mL的溶液,用0.45 μm滤器过滤后,吸取40 μL进样,用高效液相色谱以保留时间与分子质量的对数作分子质量校正曲线。
样品分子质量及分子质量分布的测定:用流动相配制10 mg/mL的黄原胶纯水溶液,搅拌溶解4.0 h,过滤(孔径0.45 μm),取滤液过Waters高效液相色谱,根据分子质量校正曲线以及黄原胶的保留时间(排阻体积)求出其各组分的分子质量及分子质量分布。
仪器工作条件:Waters Ultrahydrogel TM120 TM250 TM500 水溶性凝胶柱6 μm,7.8 mm×300 mm三柱串联,柱温40 ℃,流动相为0.1 mol/L的Na2SO3 溶液,流速为1 mL/min[20-21]。
1.3.5.4 场发射扫描电镜观察微观形貌
用扫描电子显微镜(scanning electron microscope,SEM)观察黄原胶与氧化黄原胶的微观形貌。将样品分散于无水乙醇中,然后将其滴于导电胶上,红外灯下干燥后喷金,最后使用扫描电子显微镜观察样品的微观形貌。设置仪器操作电压为5 kV。倍数100 X、500 X、1 000 X[22]。
1.3.5.5 抑菌圈、最小抑菌浓度和最小杀菌浓度测定
最小抑菌浓度(minimum inhibitory concentration,MIC)测定方法:选取了大肠杆菌(Escherichia coli, CICC 10389)和金黄色葡萄球菌(Staphylococcus aureus, CICC 21600)作为模式菌株。采用倍半稀释法控制孔板中的样品浓度,将2种菌在三角瓶中培养至对数期,并使其在孔板中的浓度为~107CFU/mL。将各孔板在37 ℃的恒温培养箱中培养24 h。样品对应的MIC值即为肉眼观察未见混浊的最小样品浓度。之后,将100 μL不混浊的混合液用灭菌后的LB培养基稀释至10 mL。然后取出100 μL稀释的细菌悬浮液,迅速涂布在琼脂平板上,在37 ℃培养24 h。最小杀菌浓度(minimum bactericidal concentration,MBC)是没有观察到平板上有细菌生长的样品的最小浓度。
抑菌圈测定方法:用打孔器将滤纸打成直径7 mm的圆滤纸片,与营养琼脂培养基一同在121 ℃条件下灭菌20 min。制作培养基平皿,用无菌移液枪吸取菌悬液,涂布均匀。将灭菌后的滤纸片浸入最小抑菌浓度5 mg/mL双醛黄原胶溶液(以5 mg/mL黄原胶为空白对照组)中30 min,用无菌镊子取出,晾干,平铺于含有涂布细菌的凝固培养基中,倒置放在37 ℃恒温培养箱中培养24 h。观察测量抑菌圈的直径。
2 结果与分析
2.1 醛基含量测定
2.1.1 黄原胶与高碘酸钠摩尔比对双醛化反应结果的影响
醛基含量一定程度上能够体现氧化程度和醛基抑菌的功能性,因而对醛基含量的测定十分必要。当氧化剂用量为1∶1、1∶1.25、1∶1.5、1∶1.75、1∶2(摩尔比)时,通过盐酸羟胺法测定双醛黄原胶的醛基含量,考察不同氧化剂用量对黄原胶分子的作用,结果如图1所示。随着氧化剂用量的减少,双醛黄原胶的醛基含量先升高后降低,在氧化剂用量为1∶1.75时达到最高,这是由于氧化剂高于1∶1.75时,过度氧化严重破坏了黄原胶的分子结构,链段长度降低,分子链发生断裂,损失率升高;在氧化剂用量低于1∶1.75时,黄原胶反应不完全,醛基含量减少。因此确定反应氧化剂用量取1∶1.75为最佳反应条件。
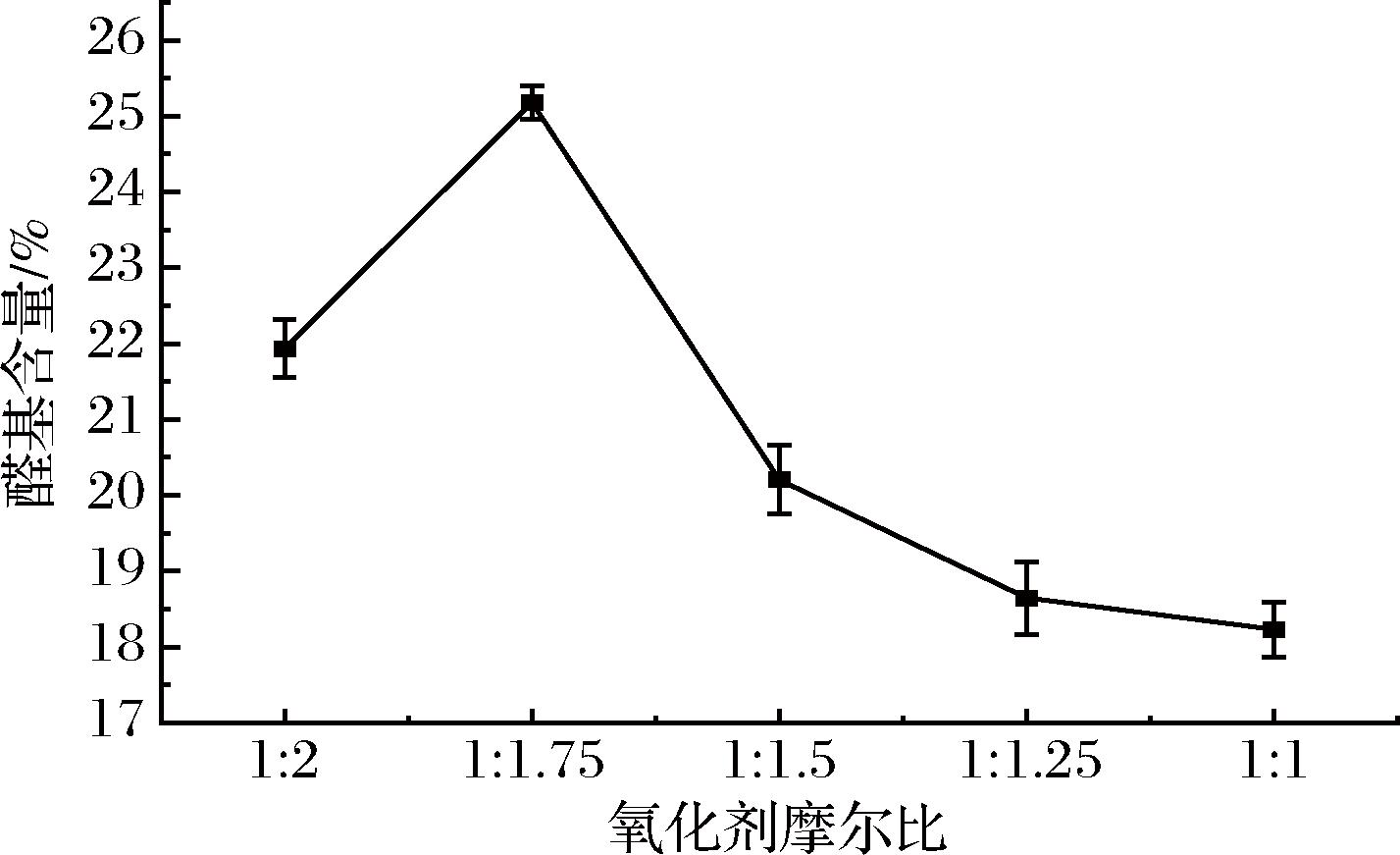
图1 不同氧化剂用量对黄原胶氧化度的影响
Fig.1 Effect of different oxidant dosage on the oxidation degree of xanthan gum
高碘酸钠能够与组成黄原胶的糖单元中2、3位的邻羟基发生反应生成不稳定的高碘酸酯,高碘酸酯水解后即形成双醛结构。但过量的高碘酸钠又会作用于糖苷键,使多糖分子断链。
2.1.2 反应温度对双醛化反应结果的影响
当反应温度为35、40、45、50、55 ℃时,对双醛黄原胶的醛基含量滴定结果如图2所示。
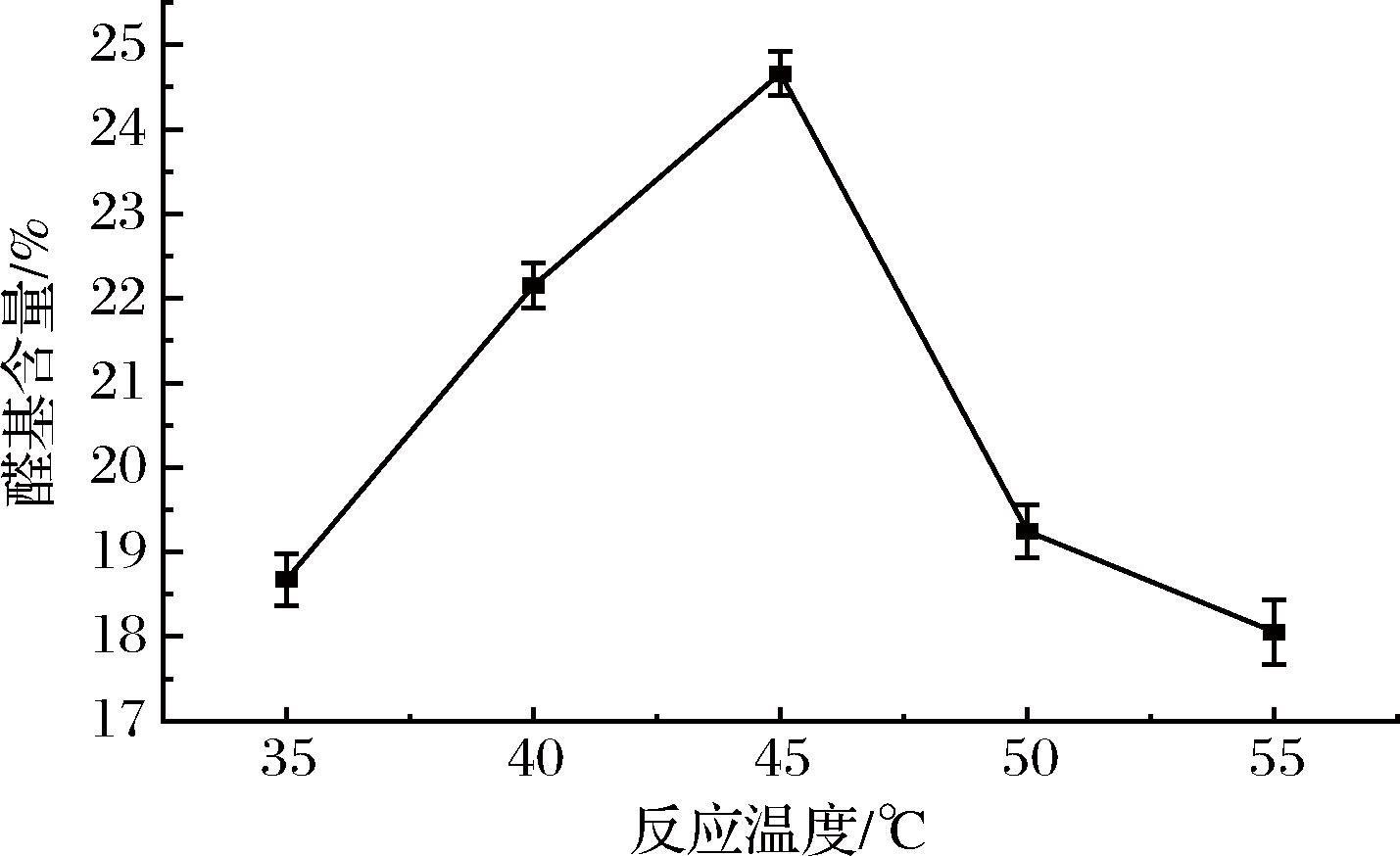
图2 不同反应温度对黄原胶氧化度的影响
Fig.2 Effect of different reaction temperatures on the oxidation degree of xanthan gum
如图2所示,生成的双醛黄原胶的醛基含量随着反应温度的升高先增多后减少。这是由于反应温度影响了反应产物活性,随着反应温度的升高,黄原胶与氧化剂分子的无规则运动加剧,分子间的碰撞几率增加,反应更为完全;但当反应温度过高时,黄原胶分子的双螺旋结构解旋逐渐变成单链,并由于存在剪切作用,导致分子链断裂,过度氧化提高了损失率;当反应温度低于45 ℃时,黄原胶与氧化剂分子运动缓慢,双醛化反应不充分导致醛基含量减少。因此确定反应45 ℃为最佳反应温度。
2.1.3 反应时间对双醛化反应结果的影响
当反应时间为2、2.5、3、3.5、4 h时,对双醛黄原胶的醛基含量滴定结果如图3所示,随着反应时间的延长,黄原胶分子与氧化剂分子碰撞几率增加,反应变得充分;而随着反应时间的继续延长,分子链在长时间的氧化作用下解旋断裂,断链作用使得产物的醛基间发生大量的半缩醛反应,含量开始下降。由此确定反应3 h为最佳反应时间。
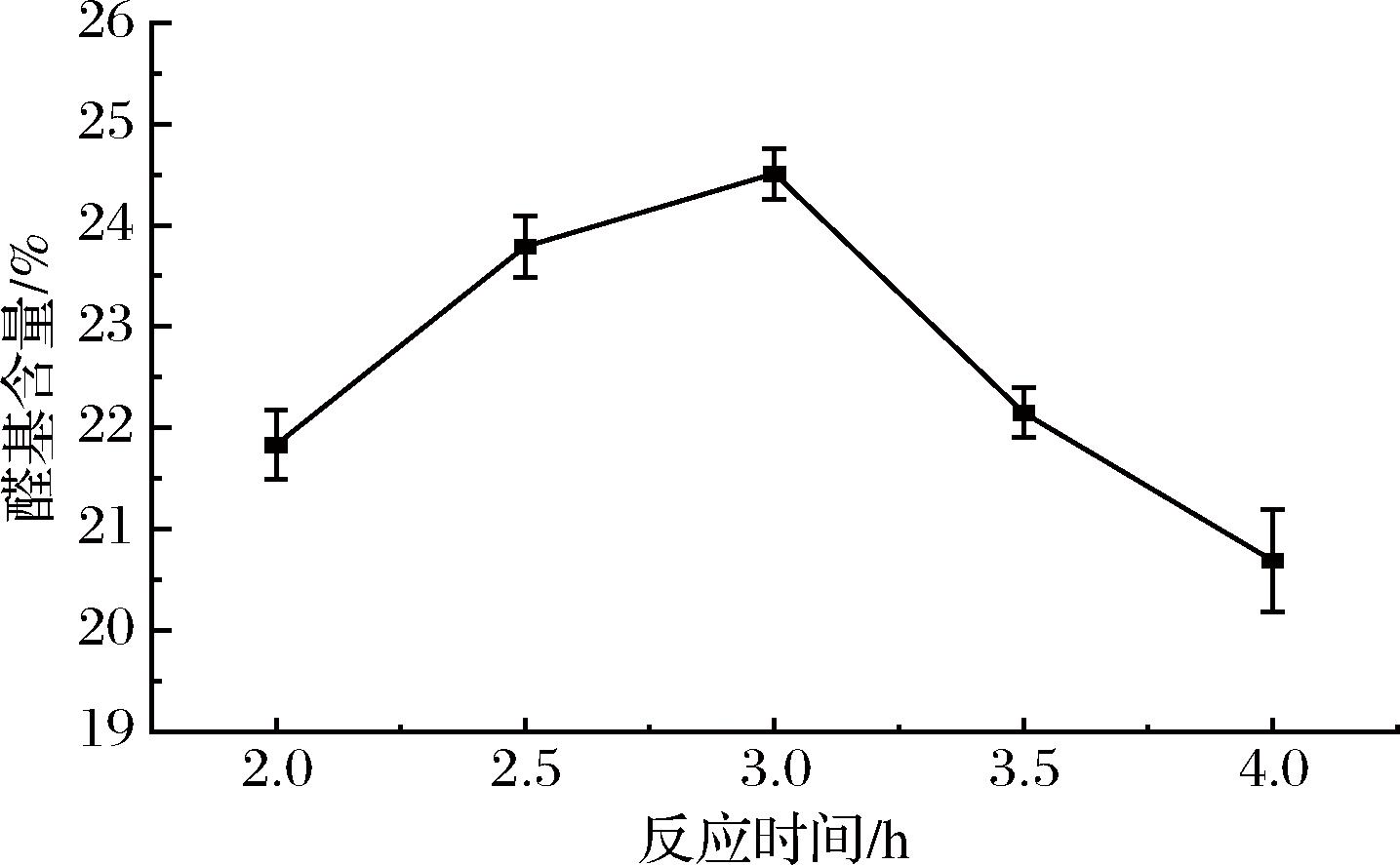
图3 不同反应时间对黄原胶氧化度的影响
Fig.3 Effect of different reaction times on the oxidation degree of xanthan gum
综上所述,通过单因素试验结果,确定氧化剂用量摩尔比1∶1.75、反应温度45 ℃、反应时间3 h条件下反应制得的黄原胶氧化度最高。根据醛基含量趋势初步判断,各因素按影响力强弱排序为:氧化剂用量>反应时间>反应温度。
2.2 正交试验
根据单因素试验,选取了氧化剂比例、反应温度、反应时间3个因素,进行三因素三水平的正交试验,结果如表2所示。3个因素对双醛黄原胶醛基含量影响大小顺序为:氧化剂比例>反应温度>反应时间。最优条件组合为A2B2C2,即最佳反应条件为氧化剂比例1∶1.75、反应温度45 ℃、反应时间3 h,按照最优条件进行验证试验,测得双醛黄原胶醛基含量为25.68%,高于表2中各组合的双醛黄原胶醛基含量,说明了该方法可靠,因此可用于优化双醛黄原胶制备的最佳反应条件。
表2 双醛黄原胶醛基含量正交试验结果
Table 2 Results of dialdehyde xanthan gum orthogonal test
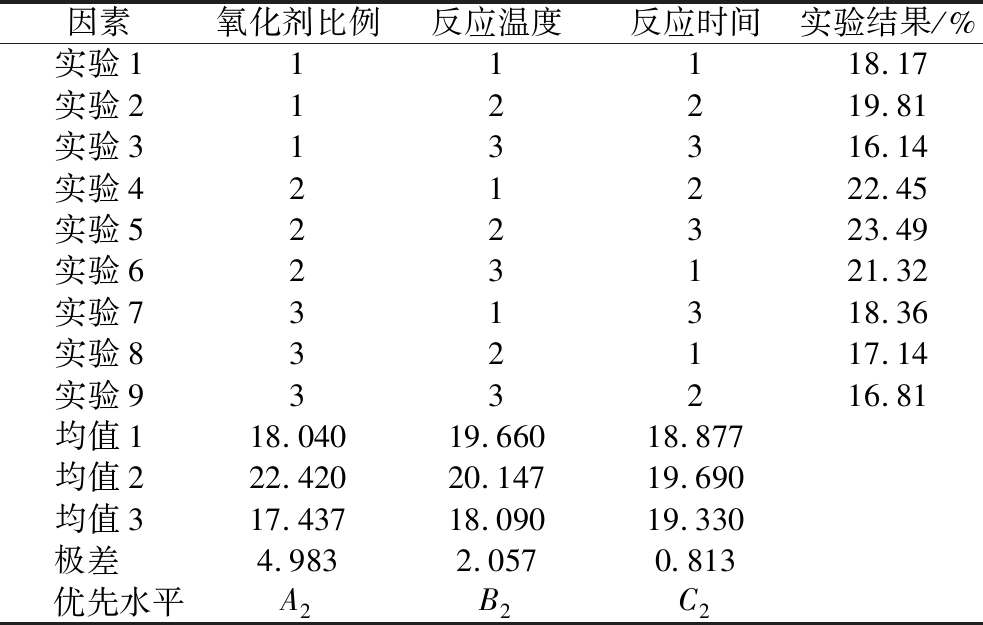
注:主次因素A>B>C。
因素氧化剂比例反应温度反应时间实验结果/%实验111118.17实验212219.81实验313316.14实验421222.45实验522323.49实验623121.32实验731318.36实验832117.14实验933216.81均值118.04019.66018.877均值222.42020.14719.690均值317.43718.09019.330极差 4.9832.0570.813 优先水平A2B2C2
2.3 双醛黄原胶的结构分析与抑菌性测定
2.3.1 双醛黄原胶的结构分析
对比黄原胶和双醛黄原胶的傅里叶红外光谱,通过其特征峰的变化情况分析双醛黄原胶的分子结构。图4中,双醛黄原胶在1 727 cm-1处的醛基特征峰面积面积明显大于黄原胶,证实了特异性氧化增加黄原胶的醛基含量。
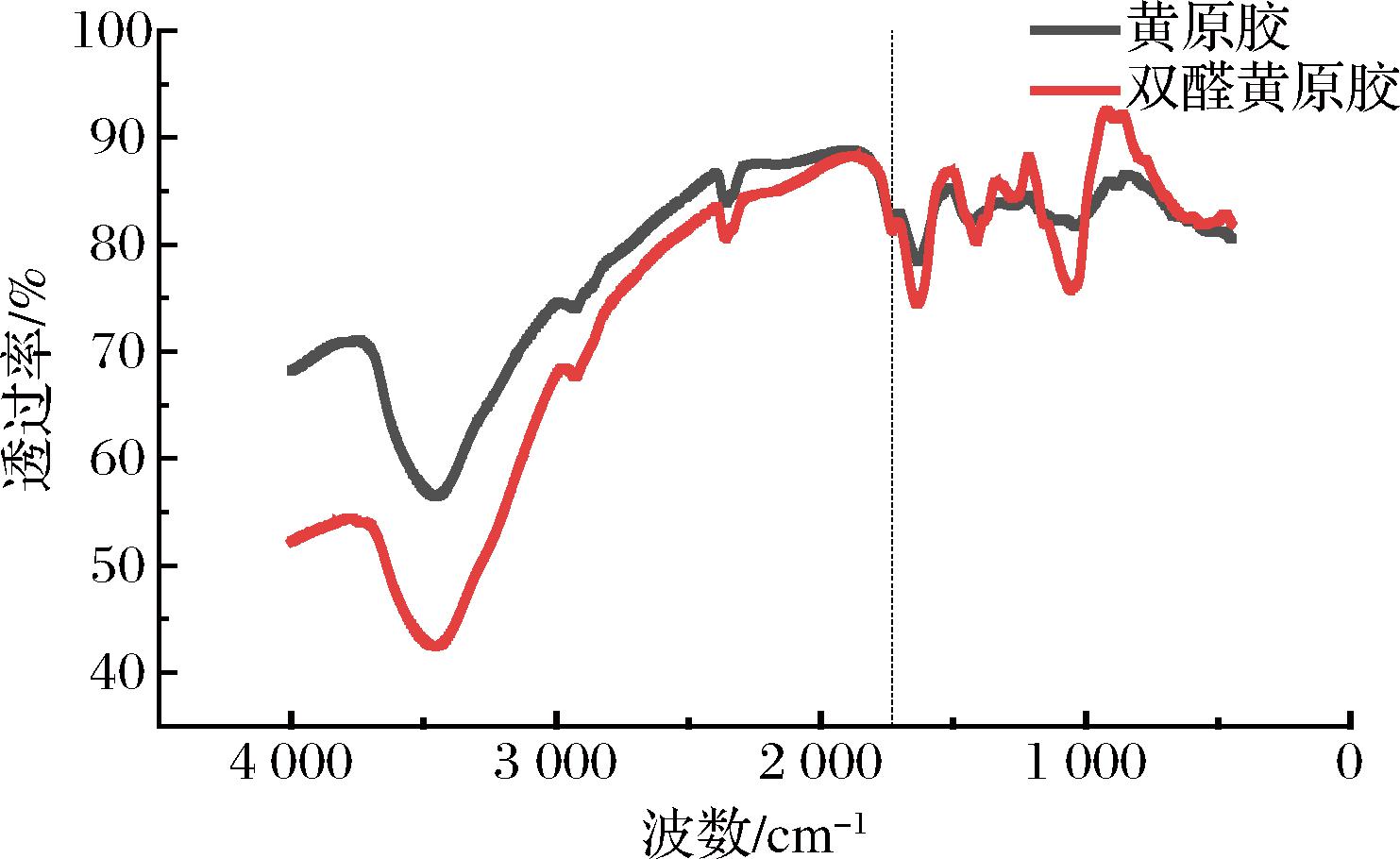
图4 黄原胶与双醛黄原胶的红外谱图
Fig.4 Fourier transform infrared spectroscopy of xanthan gum and dialdehyde xanthan gum
X射线衍射法是表征高聚物颗粒晶体结构的一种常用方法。天然的黄原胶分子中存在结晶区和无定形区,由图5可知,黄原胶和双醛黄原胶的完全无定性特征,且衍射曲线基本相似,说明两者的基本结构相似。黄原胶在2θ=19.8°、2θ=31°处的特征峰均保留。但氧化后的双醛黄原胶峰型变缓,结果表明黄原胶在氧化后分子结构发生了变化,甚至部分发生了断链,导致原本规整的晶体结构变得不十分规整,衍射峰变缓,这与文献[23]报道的多糖氧化前后分子晶体结构变化的情况类似。
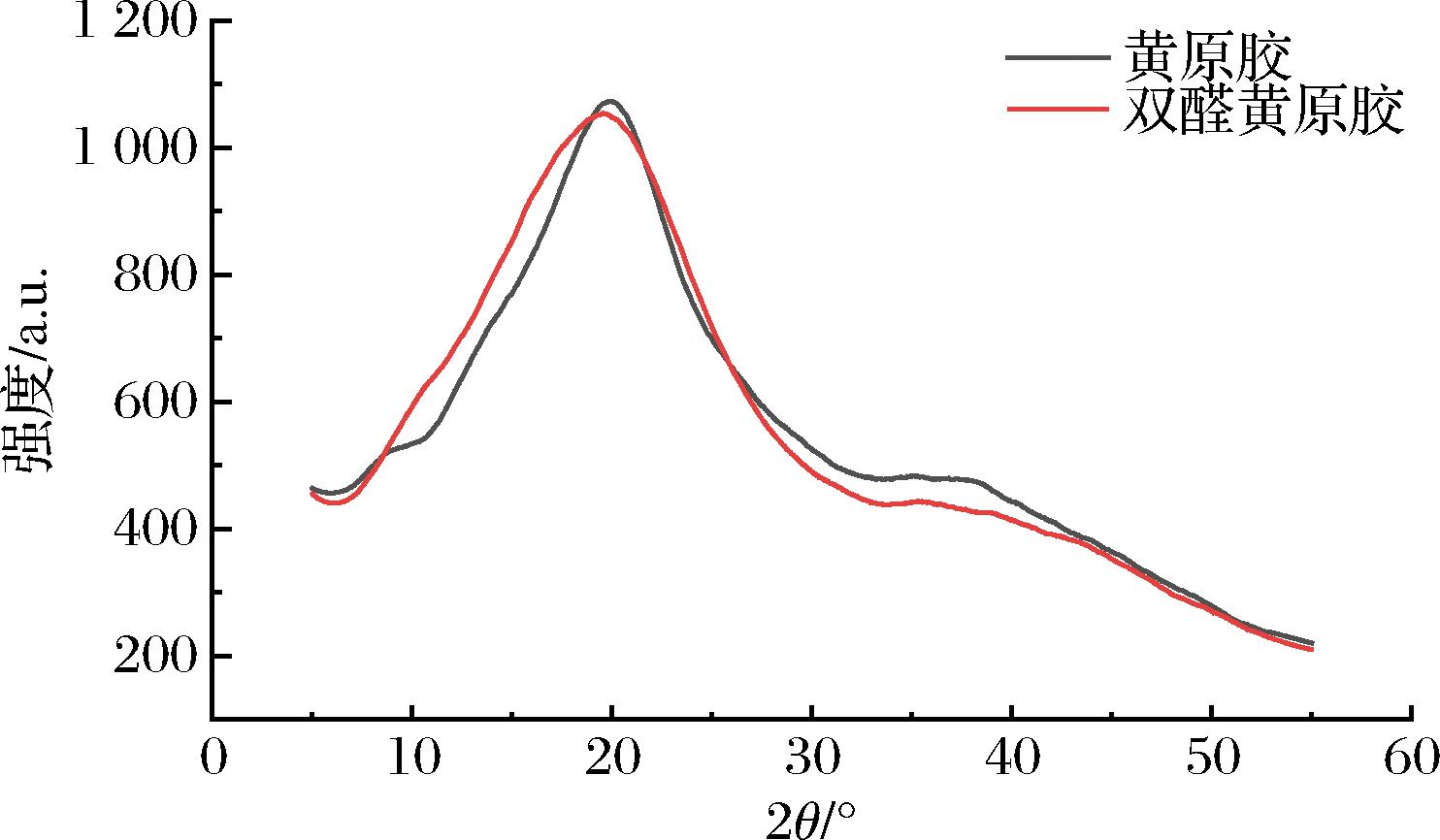
图5 黄原胶与双醛黄原胶的X-射线衍射谱图
Fig.5 X-ray diffraction spectrum of xanthan gum and dialdehyde xanthan gum
2.3.2 分子质量分布的测定
通过HPLC测试分子的保留时间估算其分子质量的大小。分子质量大的保留时间短,分子质量小的保留时间长。以不同聚合度的聚乙二醇为标准品,根据保留时间分析黄原胶与氧化黄原胶的分子质量。图7表明黄原胶经氧化后,分子保留时间变长,黄原胶经氧化后分子质量变小。
结合图6、图7和表3,得出黄原胶和双醛黄原胶的分子质量分别为2.3×106 Da、1.5×106 Da,得出结论黄原胶经氧化后,分子质量变小,这是由于氧化过程中分子断链形成的,与预期实验结果一致,证实氧化过程在形成双醛结构的同时能够减小黄原胶的分子质量,较小分子质量的黄原胶有利于更好地与微生物细胞膜结合,实现抑菌作用。
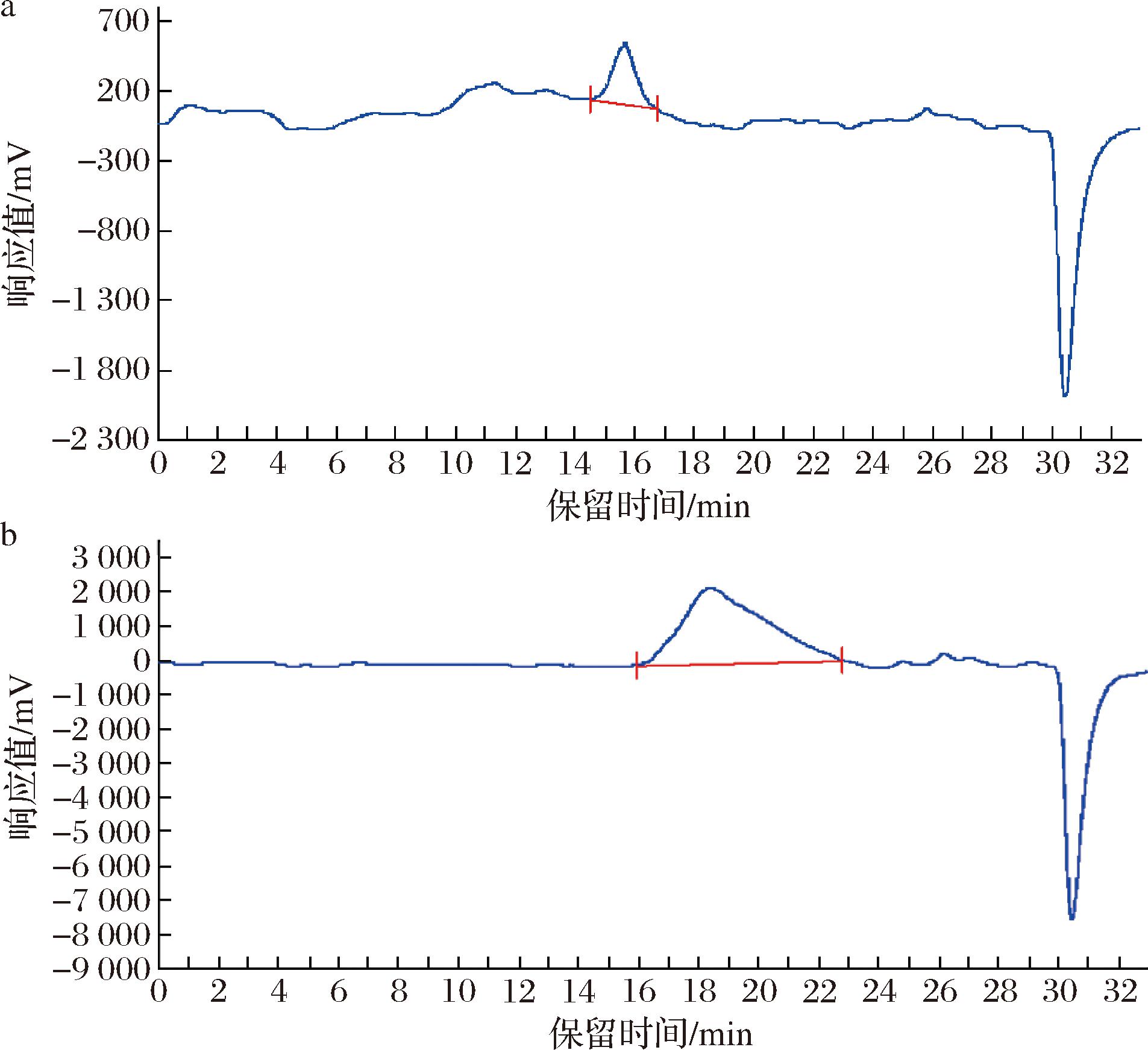
a-黄原胶;b-双醛黄原胶
图6 黄原胶和双醛黄原胶的保留时间曲线图
Fig.6 Discharge curve of xanthan gum and dialdehyde xanthan gum
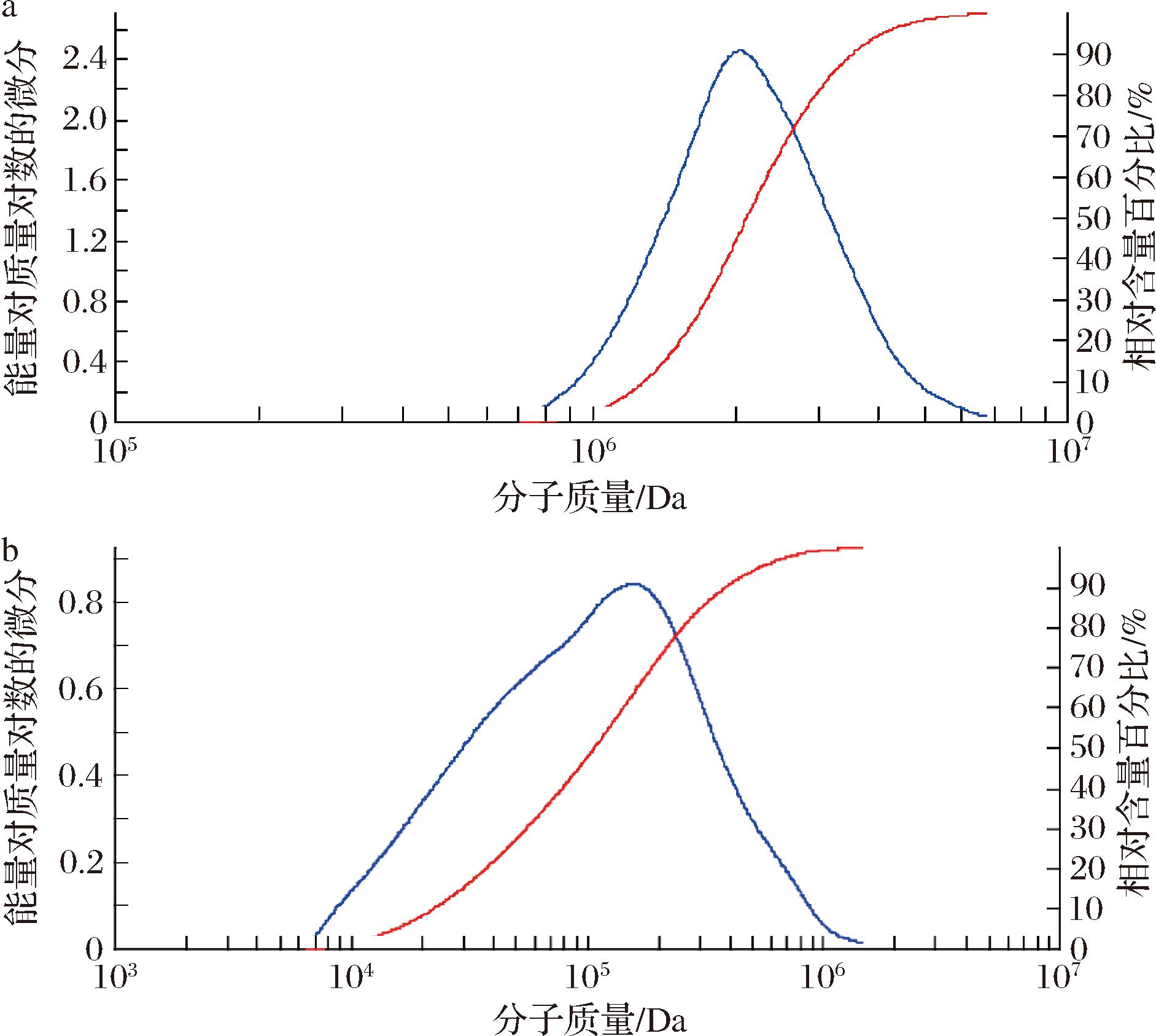
a-黄原胶;b-双醛黄原胶
图7 黄原胶和双醛黄原胶的分子质量分布曲线
Fig.7 Molecular weight distribution curve of xanthan gum and dialdehyde xanthan gum
表3 黄原胶和双醛黄原胶分子质量统计结果
Table 3 Molecular weight statistical results of XG and DXG
物质Mp/DaMn/DaMw/DaMz/DaMz+1/DaMv/DaPDXG2 050 6821 949 4102 262 7572 629 9893 045 8712 212 2181.160 74DXG164 86650 556151 118339 564554 385130 4522.989 12
2.3.3 场发射电镜扫描
将最佳反应条件下制得的双醛黄原胶用于扫描电镜,结果如图8所示。黄原胶的微观形貌为表面不光滑的片状,而经特异化改性的双醛黄原胶的其微观形貌更加光滑,呈现出颗粒状。这是由于氧化作用破坏了黄原胶的晶体结构,且部分黄原胶分子断链,在干燥后形成光滑的微观形貌,进一步映证了X射线衍射和分子质量分布的测定结果。

a-黄原胶;b-双醛黄原胶
图8 黄原胶和双醛黄原胶的扫描电镜图
Fig.8 Scanning electron microscope image of xanthan gum and dialdehyde xanthan gum
注:每张图右上角为放大细节。
2.3.4 抑菌性实验结果分析
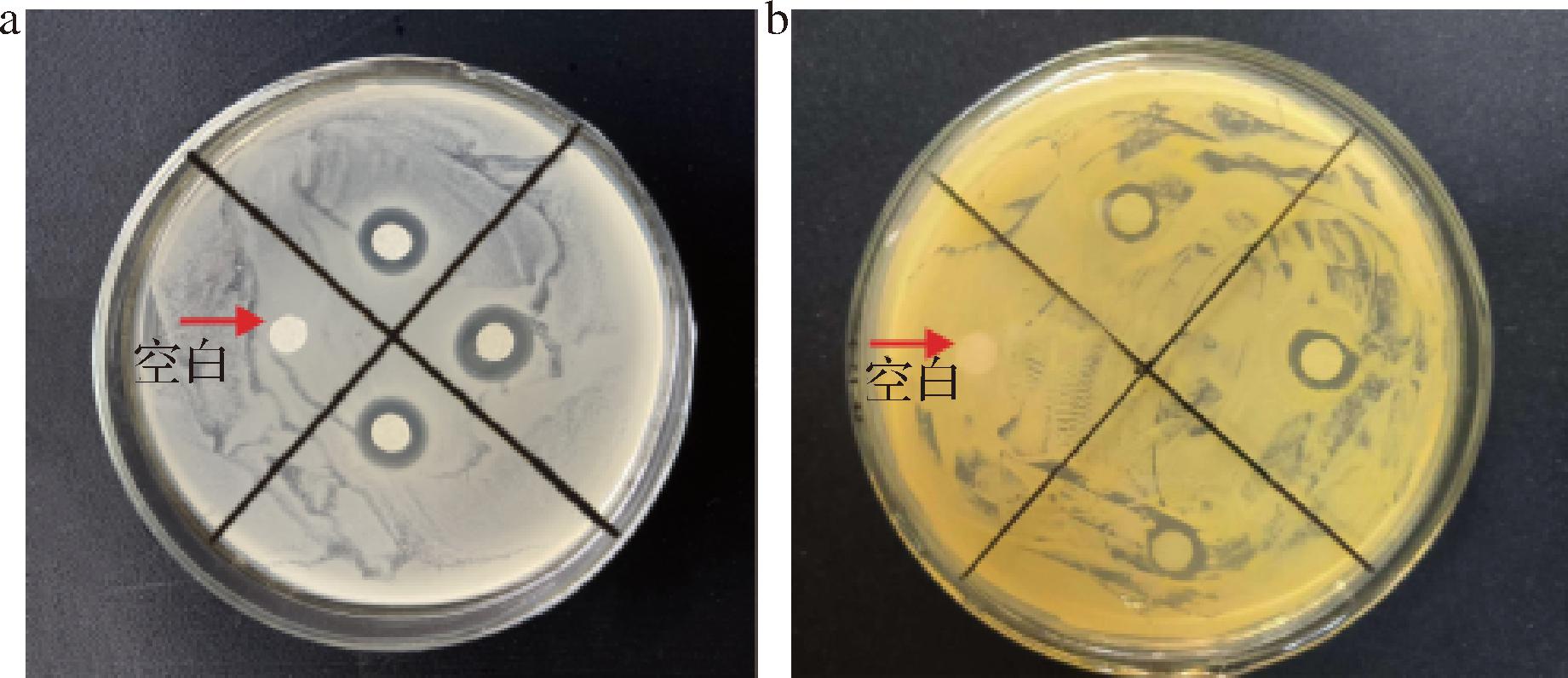
以大肠杆菌和金黄色葡萄球菌为模式菌株测试双醛黄原胶的最小抑菌浓度,结果如图9所示。C行和F行的空白对照组全部呈现浑浊状态,按照B4B3B2B1A4A3A2A1和E4E3E2E1D4D3D2D1的顺序采用倍半稀释法在孔板内加入样品,目测在B1孔开始出现澄清,同时对A4孔溶液进行培养未发现微生物菌落,测得双醛黄原胶对大肠杆菌的MIC值与MBC值分别为1.25、5 mg/mL;目测在E2孔开始出现澄清的同时对A4孔溶液进行培养未发现微生物菌落,测得双醛黄原胶对大肠杆菌对金黄色葡萄球菌的MIC值与MBC值分别为5、10 mg/mL,证实了双醛黄原胶较未改性的黄原胶具有更良好的抑菌性。需要说明的是,随着双醛多糖浓度的增大,其在溶液中呈现混浊的悬浮液,镜检证实并染菌。通过观察双醛黄原胶水溶液的抑菌圈进一步考察其抑菌效果,结果如图10所示。双醛黄原胶对大肠杆菌的抑菌效果明显优于金黄色葡萄球菌,在5 mg/mL时大肠杆菌抑菌圈直径分别为(11±0.5) mm,对金黄色葡萄球菌的抑制效果则次之, 为(9±0.5) mm。与文献报道的双醛κ-卡拉胶的MIC(10 mg/mL)相比[24],双醛黄原胶具有更低的最小抑菌浓度,且黄原胶的价格远低于κ-卡拉胶,更具有工业化价值。

a-大肠杆菌;b-金黄色葡萄球菌
图9 最小抑菌浓度测试
Fig.9 MIC of bialdehyde xanthan gum for Escherichia coli and Staphylococcus aureus
a-大肠杆菌;b-金黄色葡萄球菌
图10 双醛黄原胶对大肠杆菌和金黄色葡萄球菌的抑菌效果
Fig.10 Bacteriostatic effect of bialdehyde xanthan gum on Escherichia coli and Staphylococcus aureus
3 讨论
双醛黄原胶对革兰氏阴性菌和革兰氏阳性菌均具有较好的抑菌效果,这是由于醛基(—CHO)的极性效应使醛基碳带正电荷,醛基氧带负电荷,醛通过带正电荷的碳与带孤对电子的氨基(—NH2,细菌蛋白质的氨基)或细菌酶系统的巯基(—SH)等发生亲核加成反应,使细菌失去复制能力,引起代谢系统紊乱,达到杀菌抑菌的目的。本研究根据黄原胶糖单元具有邻羟基的结构特点,使用高碘酸钠作为氧化剂对其进行氧化,通过控制氧化剂的用量、反应时间和反应温度3个因素,对黄原胶进行氧化改性得到双醛黄原胶,结果表明氧化剂的用量对氧化过程影响明显,这是由于高碘酸钠的氧化效率相对较高,因而反应受反应时间和反应温度的影响相对较小。微观形貌和分子质量的测定结果表明氧化过程造成了部分黄原胶分子的断链,使其分子质量降低,这在一定程度提高了其通过扩散作用到达微生物细胞膜表面的速率,增强黄原胶的抑菌性,开发了黄原胶应用的新途径,扩展了改性黄原胶的新思路,填补了黄原胶在食品[8]、医疗的行业的空白[25]。
4 结论
本文采用高碘酸钠醛基化黄原胶中的羧基,以制备双醛黄原胶,并通过单因素以及正交试验得出0.1 g/mL黄原胶溶液,在黄原胶与高碘酸钠摩尔比1∶1.75、反应温度45 ℃、反应3 h 条件下,生成的双醛黄原胶醛基含量最高。经XRD和SEM分析可知双醛黄原胶构型由片状聚合成块状。探究双醛黄原胶对大肠杆菌和金黄色葡萄球菌的抑菌效果,结果表明双醛黄原胶对革兰氏阴性菌和革兰氏阳性菌均有较好的抑菌性。双醛黄原胶对大肠杆菌的抑菌圈直径为(11±0.5) mm明显大于金黄色葡萄球菌的(9±0.5) mm,这说明大肠杆菌比金黄色葡萄球菌对双醛黄原胶更敏感。双醛黄原胶的最低抑菌浓度测定试验得出对大肠杆菌的MIC为1.25 μg/mL,对金黄色葡萄球菌的MIC为5 μg/mL。将96孔板中不浑浊的液体涂布在LB固体培养基上测得对大肠杆菌的MBC为5 mg/mL,对金黄色葡萄球菌的MBC为10 mg/mL。
双醛黄原胶具有良好的抑菌性能,相比其他食品添加剂,其本身的多糖特性使其几乎没有细胞毒性[26],大分子结构使其可以较为稳定地分布在食品中,不存在小分子抑菌剂的逸出失效的问题,有望成为食品、医疗等行业的新型抑菌剂。
[1] LI P Y, LI T, ZENG Y, et al.Biosynthesis of xanthan gum by Xanthomonas campestris LRELP-1 using kitchen waste as the sole substrate[J].Carbohydrate Polymers, 2016, 151:684-691.
[2] ZHANG C, ZHANG L Z, WAN K X, et al.Effects of enhanced starch-xanthan gum synergism on their physicochemical properties, functionalities, structural characteristics, and digestibility[J].International Journal of Biological Macromolecules, 2023, 241:124646.
[3] 吴君波, 王珂, 杨光, 等.改善吞咽功能食品增稠剂的研究[J].工业微生物, 2019, 49(3):38-45.WU J B, WANG K, YANG G, et al.Food thickener for improving swallowing function[J].Industrial Microbiology, 2019, 49(3):38-45.
[4] WU Y, LIU Y L, JIA H P, et al.Effect of in situ biochemical modification on the synthesis, structure, and function of xanthan gum based bacterial cellulose generated from Tieguanyin oolong tea residue hydrolysate[J].Food Chemistry, 2024, 432:137133.
[5] HASSABO A, MOHAMED N, ABD EL-SALAM N, et al.Application of modified xanthan as thickener in the printing of natural and synthetic fabrics[J].Journal of Textiles, Coloration and Polymer Science, 2023, 20(1):41-56.
[6] LAN Y C, LAI L S.Pasting and rheological properties of water caltrop starch as affected by the addition of konjac glucomannan, guar gum and xanthan gum[J].Food Hydrocolloids, 2023, 136:108245.
[7] 熊晓兰, 郑媛媛.黄原胶的性质及其在医药领域的研究[J].化工管理, 2017(32):171-175.XIONG X L, ZHENG Y Y.Properties of xanthan gum and its application in medicine[J].Chemical Engineering Management, 2017(32):171-175.
[8] JIANG H T, ZHANG W L, CHEN L Y, et al.Recent advances in guar gum-based films or coatings:Diverse property enhancement strategies and applications in foods[J].Food Hydrocolloids, 2023, 136:108278.
[9] BHAT I M, WANI S M, AHMAD MIR S, et al.Advances in xanthan gum production, modifications and its applications[J].Biocatalysis and Agricultural Biotechnology, 2022, 42:102328.
[10] SAFDAR B, PANG Z H, LIU X Q, et al.Structural characterization, physicochemical and rheological characteristics of flaxseed gum in comparison with gum Arabic and xanthan gum[J].Journal of Food Measurement and Characterization, 2023, 17(3):2193-2203.
[11] SALEH H M, ANNUAR M S M, SIMARANI K.Ultrasound degradation of xanthan polymer in aqueous solution:Its scission mechanism and the effect of NaCl incorporation[J].Ultrasonics Sonochemistry, 2017, 39:250-261.
[12] RASCHIP I E, DARIE-NITA R N, FIFERE N, et al.Correlation between mechanical and morphological properties of polyphenol-laden xanthan gum/poly(vinyl alcohol) composite cryogels[J].Gels, 2023, 9(4):281.
[13] SU L, JI W K, LAN W Z, et al.Chemical modification of xanthan gum to increase dissolution rate[J].Carbohydrate Polymers, 2003, 53(4):497-499.
[14] LI X K, WANG M Y, LIU Z L, et al.Alleviation of the plastic deformation of gel ink under strong stress through an esterification of xanthan gum reinforcing its double helix structure[J].Chinese Journal of Chemical Engineering, 2024, 67:49-57.
[15] IVANOVSKA A, ![]() J, et al.A step towards tuning the jute fiber structure and properties by employing sodium periodate oxidation and coating with alginate[J].International Journal of Biological Macromolecules, 2024, 257:128668.
J, et al.A step towards tuning the jute fiber structure and properties by employing sodium periodate oxidation and coating with alginate[J].International Journal of Biological Macromolecules, 2024, 257:128668.
[16] 聂臻,姚占力, 牛自得, 等.油田注水用杀菌剂在我国的应用及发展[J].石油与天然气化工, 1999, 28(4):72.NIE Z, YAO Z L, NIU Z D, et al.Bactericides for oil-field injection water uses and developments in our country[J].Chemical Engineering of Oil &Gas, 1999, 28(4):72.
[17] SANTOSHI KUMARI A, AYODHYA D, PRADEEP KUMAR D, et al.Xanthan gum mediated monowave synthesis of silver nanoparticles:Characterization, anticancer, antimicrobial, antioxidant and catalytic studies[J].Results in Chemistry, 2023, 5:100930.
[18] PEREIRA J F, MARIM B M, SIM ES B M, et al.Hydrogels based on gelatin, xanthan gum, and cellulose obtained by reactive extrusion and thermopressing processes[J].Preparative Biochemistry &Biotechnology, 2023, 53(8):942-953.
ES B M, et al.Hydrogels based on gelatin, xanthan gum, and cellulose obtained by reactive extrusion and thermopressing processes[J].Preparative Biochemistry &Biotechnology, 2023, 53(8):942-953.
[19] 刘静鸿, 桂琴, 欧阳健明.海藻多糖中硫酸基含量对抑制草酸钙晶体形成和修复受损伤肾小管上皮细胞的影响[J].无机化学学报, 2023, 39(3):465-474.LIU J H, GUI Q, OUYANG J M.Effect of seaweed polysaccharides with different sulfate group contents on crystal growth of calcium oxalate and on the repair of damaged renal epithelial cells[J].Chinese Journal of Inorganic Chemidtry, 2023, 39(3):465-474.
[20] 石雪萍. 葱白多糖的分离纯化及分子量分布研究[J].中国调味品, 2013, 38(9):41-44.SHI X P.Study on the separation, purification and molecular weight distribution of Allium schoenprasum L.polysaccharides[J].China Condiment, 2013, 38(9):41-44.
[21] KAAR W E, COOL L G, MERRIMAN M M, et al.The complete analysis of wood polysaccharides using HPLC[J].Journal of Wood Chemistry and Technology, 1991, 11(4):447-463.
[22] 张凌会. 艾蒿多糖对肉仔鸡免疫和抗氧化功能的影响及其机理研究[D].呼和浩特:内蒙古农业大学, 2021.ZHANG L H.Study on the effects of Artemisia argyi polysaccharide on immune and antioxidant functions in broilers and the underlying mechanism[D].Hohhot:Inner Mongolia Agricultural University.2021.
[23] XU Y B, ZI Y X, LEI J F, et al.pH-Responsive nanoparticles based on cholesterol/imidazole modified oxidized-starch for targeted anticancer drug delivery[J].Carbohydrate Polymers, 2020, 233:115858.
[24] ZHU M J, GE L M, LYU Y B, et al.Preparation, characterization and antibacterial activity of oxidized κ-carrageenan[J].Carbohydrate Polymers, 2017, 174:1051-1058.
[25] JADAV M, POOJA D, ADAMS D J, et al.Advances in xanthan gum-based systems for the delivery of therapeutic agents[J].Pharmaceutics, 2023, 15(2):402.
[26] LI D F, YE Y X, LI D R, et al.Biological properties of dialdehyde carboxymethyl cellulose crosslinked gelatin-PEG composite hydrogel fibers for wound dressings[J].Carbohydrate Polymers, 2016, 137:508-514.