姜黄素是从姜科植物根茎中分离的一种具有二酮结构的多酚化合物,是一种广泛使用的天然活性物质之一[1]。作为一种食品添加剂,姜黄素还具有抗炎、抗癌、抗菌、抗糖尿、抗氧化等多种生物活性功能[2]。因副作用小、价格低且容易获得,姜黄素在食品营养及医药方面的重要性逐渐凸显出来,它的生物学作用成为近年来的研究热点之一,其中最受关注的是抗氧化作用。然而,姜黄素的水溶性低,生物利用度差,极大限制了其在功能性食品和营养保健品配方中的应用,姜黄素的稳定性和生物利用度可以通过将其负载在封装系统中得到改善,将姜黄素乳化包埋,不仅可以解决其溶解性的问题,还可以减少其在制备和贮藏过程中的降解和损失,提高生物利用率,增加开发价值[3]。
构建姜黄素纳米颗粒递送体系能够有效提高姜黄素的水溶性、稳定性以及生物活性。构建姜黄素纳米颗粒递送体系的载体来源广泛,除了一些合成的高分子材料外,食物中的生物大分子(如蛋白质、脂质、多糖等)因具有生物相容性好、安全性高、易降解等诸多优点,是构建该递送体系更为理想的载体[4]。蛋白质是一种具有多种基团的生物大分子,具有化学结构及物理空间结构多样性的特点,能够同多种食品功能因子发生作用。因此,蛋白质是食品活性成分(如姜黄素)递送的优良载体,也是近年来食品胶体递送体系研究的热点材料。吕思伊等[5]利用大豆分离蛋白等水解物充当载体可改善姜黄素的溶解度和生物利用度。LIU等[6]研究表明,将姜黄素溶解于大豆油制得的水包油型纳米乳液,可以提高姜黄素乳液的稳定性。WU等[7]研究结果表明,姜黄素可以很好地封装在肉蛋白中,并保持良好的稳定性和生物利用率。石丽双[3]利用大豆油负载姜黄素,研究了姜黄素活性成分对肌原纤维蛋白乳化凝胶功能特性、消化特性和稳定性的影响,并探究了复合体系对乳化肠品质的影响。
肌原纤维蛋白(myofibrillar proteins, MPs)是畜禽肌肉中含量最高的一种蛋白,占肌肉总蛋白的55%~60%,主要由肌动蛋白和肌球蛋白所构成,是乳化肉制品制作过程中不可缺少的主要成分[8],MPs的一个重要特性就是在热加工过程中能形成乳化凝胶,对肉制品的保水性、质构和感官等起着至关重要的作用[9]。因此MPs很大程度上决定着乳化肉制品的质构、风味等品质特性。然而MPs在运输、贮存以及加工过程中易受到外力的影响,导致其物理化学和结构性质的变化,从而降低其乳化性能,影响产品的质量[10]。部分学者研究了蛋白质种类[11]、离子强度[12]、蛋白质溶解度[13]、pH[14]等影响因素对蛋白乳化能力的影响。姜黄素在肉制品中常作为制品加工色素用途,目前未见氧化条件下植物多酚姜黄素与肉肌原纤维蛋白互作及氧化体系对蛋白乳化特性的影响。本研究以猪肉肌原纤维蛋白为研究对象,创建Fenton氧化体系模拟肉制品的氧化环境,基于荧光猝灭法探究不同浓度水平姜黄素与氧化肌原纤维蛋白互作及对蛋白乳化特性的影响,并阐明相关机理,为天然多酚类物质在肉制品中应用提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
新鲜猪背最长肌(重庆市南岸区四公里永辉超市),剔除可见的脂肪组织后,顺着肌纤维方向切成100 g左右的小块,真空密封包装后,贮存于4 ℃下备用(48 h内)。一级大豆油(食品级,天津中粮佳悦有限公司),重庆市南岸区五公里人人乐超市。姜黄素(纯度≥97%),上海阿拉丁生化科技股份有限公司。
CuSO4·5H2O,广东光华科技股份有限公司;Na2HPO4·12H2O、MgCl2、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、Na3PO4、NaCl,成都市科龙化工试剂厂;乙二醇二乙醚二胺四乙酸(ethylene glycol tetraacetic acid,EGTA)、牛血清蛋白(bovine serum albumin,BSA,纯度96%)、酒石酸甲钠(NaKC4H4O6)、L-抗坏血酸、哌嗪-1,4-二乙磺酸(1,4-piperazinediethanesulfonic acid,PIPES)、水溶性维生素E(Trolox,纯度97%),上海阿拉丁生化科技股份有限公司;FeCl3、H2O2,上海阿达玛斯试剂有限公司。所有试剂均为分析纯。
1.2 仪器与设备
MARS40(哈克)旋转流变仪,赛默飞世尔科技有限公司;F-7000荧光分光光度计,日本日立公司;S3500激光粒度仪,美国Microtrac公司;TGL-20高速冷冻离心机,四川蜀科仪器有限公司;LM-861多功能破壁机,广东顺德多蒙电器有限公司;DGG-9076A电热恒温鼓风干燥箱,上海齐欣科学仪器有限公司;LGJ-10冷冻干燥机,北京松源华兴科技发展有限公司;Ultra-Turrax T25高速均质匀浆机,德国IKA-WERKE;V2000可见分光光度计,上海舜宇恒平科学仪器有限公司;UV-1900紫外可见分光光度计,上海翱艺仪器有限公司;TDZ5-WS多管架自动平衡离心机,长沙湘仪离心机仪器有限公司;FA2004电子天平,上海舜宇恒平科学仪器有限公司。
1.3 实验方法
1.3.1 肌原纤维蛋白提取
以猪背最长肌为原材料,参照CAO等[15]的方法提取肌原纤维蛋白:将冷藏备用的肉切成小块置于绞肉机中并加入4倍体积的肌原纤维蛋白提取液(10 mmol/L磷酸钠、0.1 mol/L NaCl、2 mmol/L MgCl2和1 mmol/L EGTA,pH=7.0)于点动式模式下运行30 s,再于长动模式下运行1 min,匀浆后经冷冻离心(8 000×g,10 min,4 ℃),倾去上清液,所得沉淀再加入4倍体积的肌原纤维蛋白提取液,重复提取3次,最后将所得沉淀加入4倍体积的0.1 mol/L NaCl溶液,搅拌均匀并3层纱布过滤以除去残余的结缔组织,用0.1 mol/L HCl调节pH值为6.25后离心(8 000×g,10 min,4 ℃),所得白色膏状沉淀即为肌原纤维蛋白。整个提取过程在0~4 ℃条件下进行,蛋白膏于4 ℃下保存并48 h内使用。采用双缩脲法测定蛋白浓度,以牛血清蛋白作为标准蛋白,制作蛋白质的标准曲线。
1.3.2 姜黄素与肌原纤维蛋白作用及氧化体系确立
参照熊杰[16]的样品处理方法并稍作修改。准确称取1 g上述所提取的蛋白膏于50 mL的离心管中,分别添加不同体积的姜黄素(5 μmol/mL,溶于氧化体系溶液:30 μmol/L FeCl3、100 μmol/L抗坏血酸、5 mmol/L H2O2),使得添加姜黄素的试管中姜黄素最后浓度为5、10、15、20 μmol/L,最后用氧化体系定容至25 mL,使得MPs蛋白膏质量浓度稀释为40 mg/mL,同时制作1 g蛋白膏和24 mL氧化体系的氧化对照管记作ox(氧化对照组),1 g蛋白膏和24 mL 15 mmol/L PIPES缓冲液作为空白对照管,记作blank(空白对照组)。所有制作的样品,均质后于4 ℃氧化12 h后添加1 mL Trolox(25.2 mmol/L,溶于15 mmol/L PIPES缓冲溶液)终止氧化。各组样品添加详细如表1所示。
表1 实验样品设置
Table 1 Experimental samples

组别空白对照组氧化对照组ox+c5ox+c10ox+c15ox+c20蛋白膏/g1111115 μmol/mL姜黄素添加量/μL0025507510015 mmol/L PIPES缓冲溶液/mL2400000氧化体系/mL02423.97523.9523.92523.904 ℃下氧化12 h,添加1 mL 25.2 mmol/L Trolox,终止氧化
1.3.3 姜黄素对MPs荧光猝灭作用
a)荧光强度测定
采用江友娅等[17]研究的方法并稍作修改,用PIPES缓冲溶液将各个处理组的MPs蛋白液稀释至0.4 mg/mL,吸取300 uL释液于96孔微孔板中,每个样品做3个平行,分别在299.15、304.15、309.15 K 3个温度下避光孵育30 min,283 nm作为激发波长,激发波长狭缝宽度为5 nm,扫描各个样品在300~450 nm处的荧光光谱,从而查找出最强荧光强度。
b)姜黄素对MPs荧光猝灭机理的推断
一般情况下荧光猝灭包括静态猝灭和动态猝灭2种,可以通过测定猝灭常数和温度之间的关系进行区分。一般情况下温度升高猝灭常数增加的是静态猝灭,反之则是动态猝灭。姜黄素和MPs相互作用后,肌原纤维蛋白荧光强度可以由Stern-Volmer方程[18]进行计算,如公式(1)所示:
(1)
式中:F0为MPs蛋白液在不加姜黄素的情况下的荧光强度;F为MPs蛋白液在加入姜黄素后的荧光强度;Kq为猝灭过程中的速率常量,L/(mol·s);τ0为姜黄素不存在时,荧光分子的平均寿命(10-8 s);[Q]为姜黄素的浓度,μmol/L;Ksv为荧光猝灭常数,L/mol。
c)姜黄素与MPs结合常数和结合位点数
如果猝灭类型为静态猝灭,假设一个MPs分子上有n个独立的结合位点与小分子相互作用,则其结合常数、荧光强度、猝灭剂浓度和结合位点数之间的关系可以用Lineweaver-Burk静态猝灭公式[19]计算,如公式(2)所示:
(2)
式中:F0为MPs蛋白液在不加姜黄素的情况下的荧光强度;F为蛋白液在加入姜黄素后的荧光强度;Ka为猝灭过程中,复合物形成的结合常数,L/mol;n为猝灭过程中结合位点数;[Q]为姜黄素的浓度,μmol/L。
1.3.4 氧化介导的姜黄素-肌原纤维蛋白乳液的制备
姜黄素-MPs-大豆油乳液的制备方法参照CAO等[20]的描述,并稍作修改,用PIPES缓冲液将MPs溶液稀释为10 mg/mL,与大豆油(4∶1,体积比)混匀,再用均质机以1 000 r/min匀浆2次,每次30 s,现制现用。
1.3.5 乳液乳化活性和乳化稳定性测定
乳液乳化活性及稳定性测定方式参考CHENG等[21]描述的方法测量乳液在0和10 min处的浊度,用于计算其乳液的乳化活性和乳化稳定性,即取刚制备好的乳液0.05 mL备用,再用1 mg/mL SDS溶液稀释至5 mL,采用紫外可见分光光度计测其波长为500 nm的吸光值,以SDS溶液作为空白调零,10 min时乳液的浊度亦是如此,乳化活性及乳化稳定性的计算如公式(3)和公式(4)所示:
(3)
(4)
式中:A0为稀释乳浊液0 min时所测吸光值;A10为稀释乳浊液10 min时所测吸光值;C为蛋白质量浓度,g/mL;φ为乳化液中油的体积分数。
1.3.6 乳液贮存稳定性
乳液贮存稳定性参照LI等[12]所述,将上述1.3.4节中所制得的乳液立即均分成管,每个样品3管,在4 ℃下分别贮存2 h和4 h,在贮存过程中拍照记录其分层状态。
1.3.7 乳液粒度的测定
乳液粒度采用激光粒度分析仪测定,按照HU等[22]的方法并加以修改:待激光粒度仪清洗校正调零后,将配成的蛋白乳化液加入激光粒度分析仪的微量检测皿中,待浓度达到正常则开始测试,记录其体积等效平均粒度值[D(4,3)]和表面积等效平均粒度值[D(3,2)]。
1.3.8 乳液流变学测定
MPs乳液的振动频率扫描和振荡温度扫描测试使用动态流变仪测定,具体操作按照ZHAO等[14]的描述并稍作修改,安装p60/Ti-01210736型转子,仪器自动调零后,将均质且脱气后的乳化液用钥匙均匀涂布于测试平台上,然后药匙擦边、硅油封边,开始测试。振荡频率扫描相关操作参数:最大应力为5%、上下板间距为1 mm,记录0.1~100 rad/s的频率曲线图,测定指标为储能模量(G′)和损耗模量(G″),每个样品重复操作3次;振荡温度扫描参数:振荡频率为0.1 Hz,最大应力为2%,上下板狭缝为1 mm,以2.1 ℃/min的升温速度加热样品,在此过程中同样记录G′和G″的值。
1.4 数据分析及处理
每组样品设置3个平行组,实验测试重复3次,所有数据用“平均值±标准误差”表示,利用SPSS 23.0 ANOVA进行误差及显著性分析(其中P<0.05为有统计学意义),用Origin 2018软件作图。
2 结果与分析
2.1 姜黄素对肌原纤维蛋白荧光猝灭作用
2.1.1 荧光猝灭机理的推断
荧光光谱峰的强度会受到温度的影响,一般情况下包括2种猝灭机制[23]:a)静态猝灭,静态猝灭一般是由于猝灭剂与荧光基团发生了结合反应,生成了不产生荧光的物质,而当温度升高,体系紊流程度便会增加,配合物的稳定度下降,导致猝灭常数减小[24-25];b)动态猝灭,动态猝灭主要原因是猝灭剂与荧光基团发生碰撞,从而使荧光强度降低,随着温度的升高,体系紊流增加,使各部分的碰撞增强,因而猝灭常数增大。因此可以根据随着温度的变化,猝灭常数的变化来辨别荧光猝灭机制。如图1所示,不同浓度姜黄素在不同温度下对MPs猝灭的Stern-Volmer方程曲线图,显然F0/F和姜黄素浓度呈现出良好的线性关系,随着温度的升高,曲线的斜率下降。根据荧光猝灭Stern-Volmer曲线得出的速率常量Kq和猝灭常数KSV如表2所示,随着温度的升高,猝灭常数有减小的趋势,由此可以说明姜黄素对MPs荧光强度的猝灭属于静态猝灭。同时在299.15、304.16、309.15 K温度下猝灭过程中的速率常数Kq分别是5.598×1012、3.57×1012、3.071×1012 L/(mol·s),远大于生物分子的最大碰撞扩散速率常数[2.0×1010 L/(mol·s)],而相关文献报道速率常数大于最大碰撞扩散速率常数即为静态猝灭[26],且随着温度的增加Kq有减小的趋势进一步说明为静态猝灭,因此可以进一步说明姜黄素与MPs相互作用,形成了无荧光或者荧光强度相对较弱的复合物。
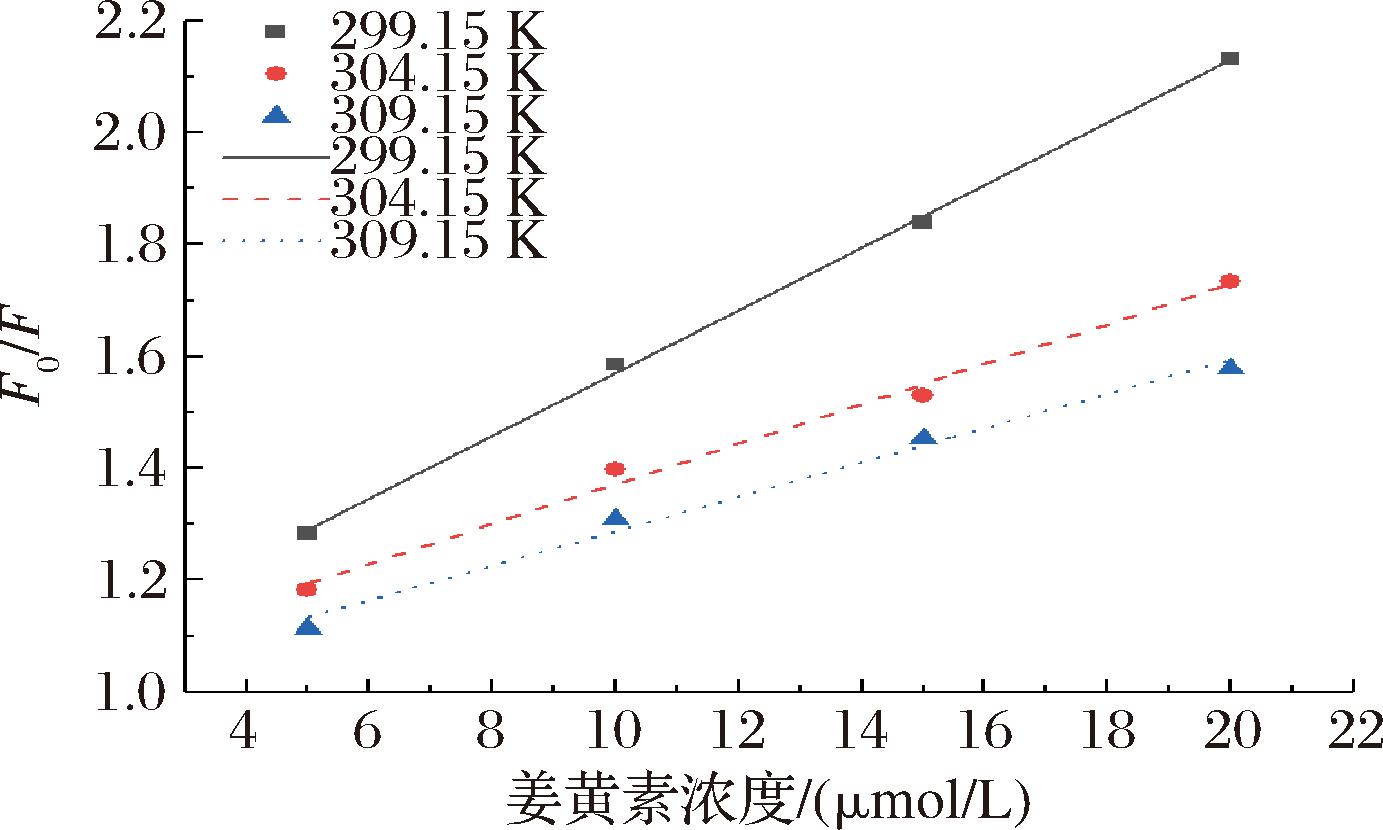
图1 不同温度下姜黄素对MPs的荧光猝灭Stern-Volmer曲线
Fig.1 Stern-Volmer curve of fluorescence quenching of MPs by curcumin at different temperatures
表2 不同温度下姜黄素与MPs相互作用的相关参数
Table 2 Related parameters of interaction between curcumin and MPs at different temperatures

T/KR2KSV/(104 L/mol)Kq/[1012 L/(mol·s)]299.150.998 95.5985.598304.150.992 83.5703.570309.150.988 93.0713.071
2.1.2 姜黄素与MPs结合常数和结合位点数
小分子与大分子物质之间的结合常数和结合位点数一般用于表征两者之间的结合亲和力的大小[27],图2是不同温度下姜黄素与MPs相互作用后,![]() 与lg[Q]的双对数图,进行线性拟合之后,可以根据公式(2)计算出两者之间的结合常数Ka和结合位点数n。其中直线斜率为结合位点数,纵轴的截距表示结合常数的对数值,相关拟合参数如表3所示,拟合得到的不同温度下的线性相关系数均在0.98以上,说明修正后的Stern-Volmer方程适用于分析姜黄素与MPs之间的相互作用。随着温度的增加,姜黄素与MPs之间的结合常数逐渐变小,说明温度的升高会导致某些不稳定的化合物的形成,不利于两者之间的结合[28],但是在3种温度下,姜黄素与MPs的结合位点数均接近1,没有较大的差别。这与WANG等[29]的研究结果一致,他们认为辛酸乙酯对肌原纤维蛋白的荧光猝灭机制也属于静态猝灭,在303、313 K下两者的结合位点数均接近1,没有较大的区别。因此综合结合常数和结合位点数可以得出,温度的升高不利于姜黄素与MPs两者之间的结合。
与lg[Q]的双对数图,进行线性拟合之后,可以根据公式(2)计算出两者之间的结合常数Ka和结合位点数n。其中直线斜率为结合位点数,纵轴的截距表示结合常数的对数值,相关拟合参数如表3所示,拟合得到的不同温度下的线性相关系数均在0.98以上,说明修正后的Stern-Volmer方程适用于分析姜黄素与MPs之间的相互作用。随着温度的增加,姜黄素与MPs之间的结合常数逐渐变小,说明温度的升高会导致某些不稳定的化合物的形成,不利于两者之间的结合[28],但是在3种温度下,姜黄素与MPs的结合位点数均接近1,没有较大的差别。这与WANG等[29]的研究结果一致,他们认为辛酸乙酯对肌原纤维蛋白的荧光猝灭机制也属于静态猝灭,在303、313 K下两者的结合位点数均接近1,没有较大的区别。因此综合结合常数和结合位点数可以得出,温度的升高不利于姜黄素与MPs两者之间的结合。
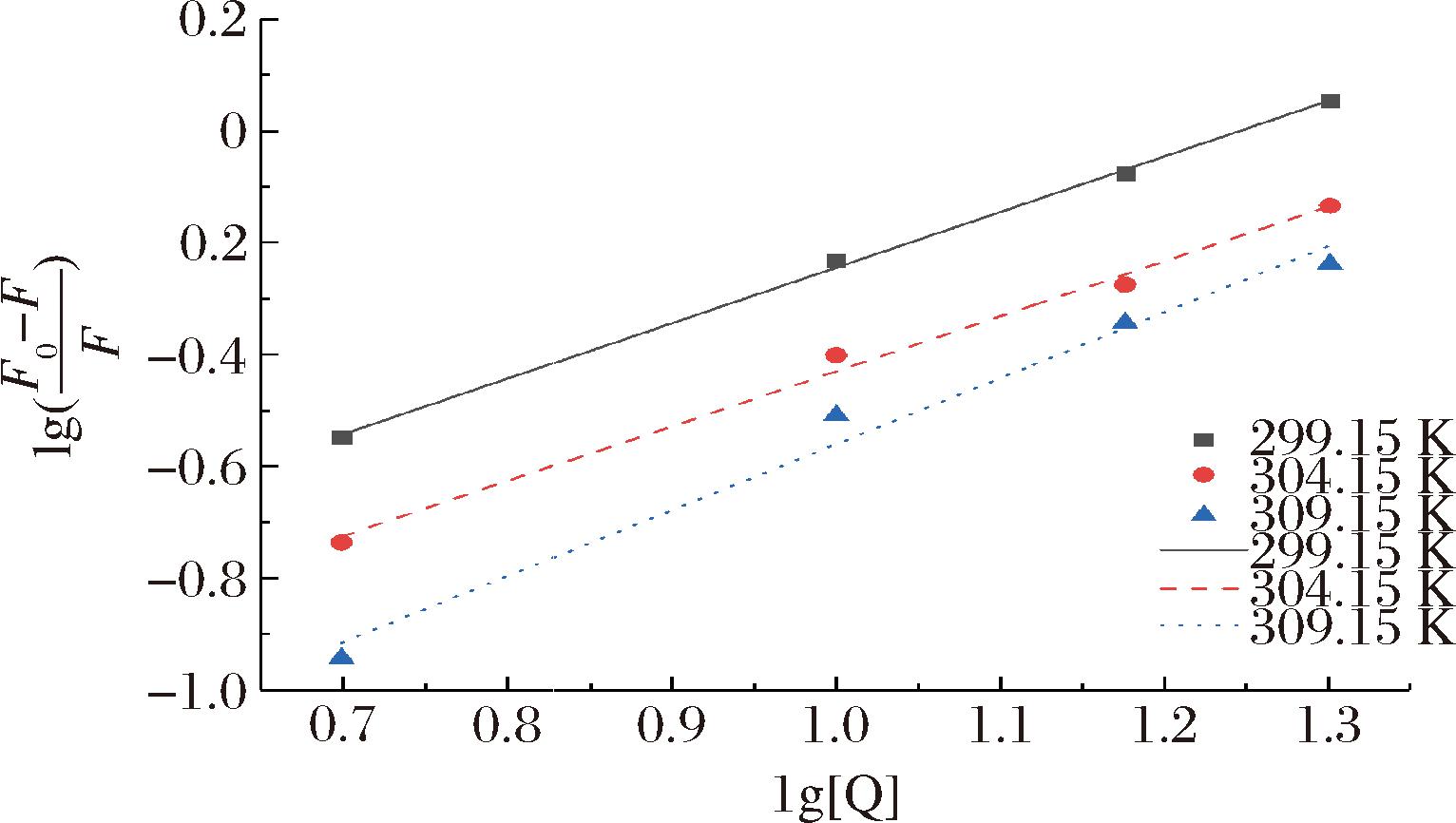
图2 姜黄素对MPs荧光猝灭的双对数图
Fig.2 Logarithmic diagram of MPs fluorescence quenching by curcumin
表3 不同温度下姜黄素与MPs相互作用双对数方程参数
Table 3 Parameters of logarithmic equation of interaction between curcumin and MPs at different temperatures

T/KR2Ka/(104 L/mol)n299.150.998 95.7800.993 43304.150.993 63.8700.982 27309.150.984 21.8191.178 96
2.2 乳液乳化活性和乳化稳定性
乳化活性和乳化稳定性是衡量乳化能力优劣的重要参数,如图3所示肌原纤维蛋白氧化后不论是乳化活性还是乳化稳定性均显著下降(P<0.05),这可能是因为蛋白质遭到氧化后,蛋白质变性严重,大量聚集,导致蛋白质的溶解度降低,从而使得蛋白质在乳化过程中不能伸展,无法形成蛋白包裹油脂的稳定界面,进而导致其较低的乳化活性和乳化稳定性。于晶超[30]研究了羟自由基体系对蛋白乳化能力的影响发现,低浓度(0.05~1 mmol/L H2O2)氧化条件下,有利于提高蛋白乳化特性,但高氧化浓度(5~10 mmol/L H2O2)下会导致蛋白质过度交联聚集,降低其乳化特性。添加姜黄素后,乳化活性和乳化稳定性均在氧化对照组的基础上显著性增加,说明姜黄素的添加可以缓解MPs的氧化损伤,增加MPs的溶解性,让更多的蛋白参与其乳化过程,形成稳定的蛋白界面膜,5 μmol/L姜黄素处理后,MPs乳化活性最强,随后稍有降低且趋于稳定,这可能是因为5 μmol/L姜黄素未将所有的羟自由基反应完全,此时MPs可能仍处于低氧化状态,使蛋白质处于良性的氧化状态,而有研究表明适当的氧化条件下,可以促进蛋白质结构的展开,亲水基团和亲油基团的暴露可以提高蛋白质的乳化特性[31]。随着姜黄素浓度的增加,MPs乳化稳定性也呈上升趋势,说明姜黄素可以使乳化过程中形成的蛋白界面膜更加稳定,对MPs乳化有促进作用。
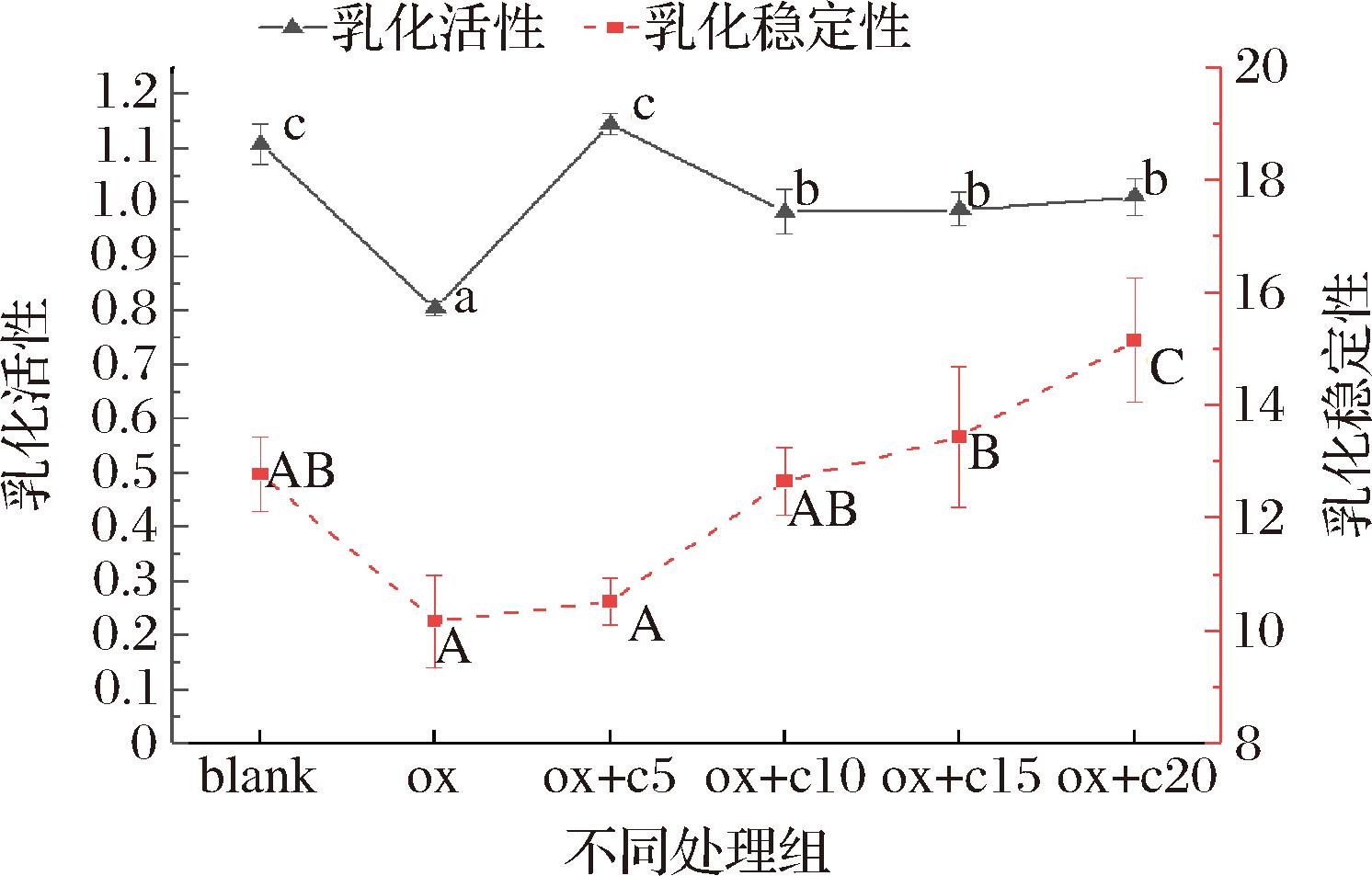
图3 不同处理组对MPs乳液乳化活性和稳定性的影响
Fig.3 Effects of different treatment groups on emulsification activity and stability of MPs emulsion
注:大写字母或小写字母不同表示差异显著(P<0.05);blank:空白对照组(未氧化);ox:氧化对照组;ox+c5:氧化体系中姜黄素浓度5 μmol/L;ox+c10:氧化体系中姜黄素浓度10 μmol/L;ox+c15:氧化体系中姜黄素浓度15 μmol/L;ox+c20:氧化体系中姜黄素浓度20 μmol/L(下同)。
2.3 乳液贮存稳定性
图4显示了不同处理方式的MPs在4 ℃下贮存2 h和4 h后的稳定乳液图像,显然不管是贮存2 h还是4 h后,氧化对照组的分层现象都最为明显,说明氧化会降低MPs的乳化能力与2.2节中所研究的结果一致。2 h时,5 μmol/L处理组分层现象远不及空白对照组,而4 h时却出现5 μmol/L姜黄素处理组的分层现象明显于4 h的空白对照组,这再次说明了当5 μmol/L姜黄素处理MPs初期,蛋白质处于良性的氧化状态,有利于蛋白质的乳化,但随着贮存时间的延长,乳液体系中的蛋白质、脂肪等会发生链式氧化反应,产生更多的氧化自由基,破坏了原有的稳定体系,蛋白质大量聚集,蛋白质的乳化功能遭到破坏[32],从而出现了图4所示的现象。10、15、20 μmol/L姜黄素处理后的MPs乳液分层现象明显小于氧化对照组,说明了姜黄素的添加对MPs的乳化作用呈正面作用。

a-贮存2 h;b-贮存4 h
图4 不同处理方式对MPs乳液贮存稳定性的影响
Fig.4 Effects of different treatment methods on storage stability of MPs emulsion
2.4 乳液粒度
乳液粒度的大小也是评价乳化液稳定性的一个重要指标,一般情况下乳液粒度越小乳液则越稳定。如图5所示,氧化对照组与空白对照组相比,氧化对照组的体积等效平均粒度值[D(4, 3)]和表面积等效平均粒度值[D(3, 2)]均大于空白对照组,且分别增加了14.67%、18.6%,说明氧化导致蛋白质的过度变性聚集,而过度聚集会蛋白界面的吸附能力减弱,会促进蛋白界面层的破坏[13],使得乳液粒度变大,这也说明了乳液乳化稳定性的大小与乳液粒度的大小存在一定的关系。添加姜黄素后,乳液粒度均有变小,且随着姜黄素浓度的提高,MPs乳液粒度均越来越小,说明姜黄素的加入有利于提高MPs乳液的乳化特性,和2.2节中所论一致,这可能存在以下2点原因:a)姜黄素的添加可以缓解蛋白质的氧化,阻止其氧化变性,增强MPs的溶解度,从而使得在乳化过程中有更多的蛋白质参与其中,形成蛋白质界面膜,进而乳化体系更加稳定、均一,乳液粒度较小;b)可能姜黄素与蛋白质发生共价作用,形成了更加亲水亲油的复合物质,ZHAO等[11]曾研究发现,肉桂醛可以与蛋白质发生共价结合,可以提高蛋白质稳定油水界面的能力。
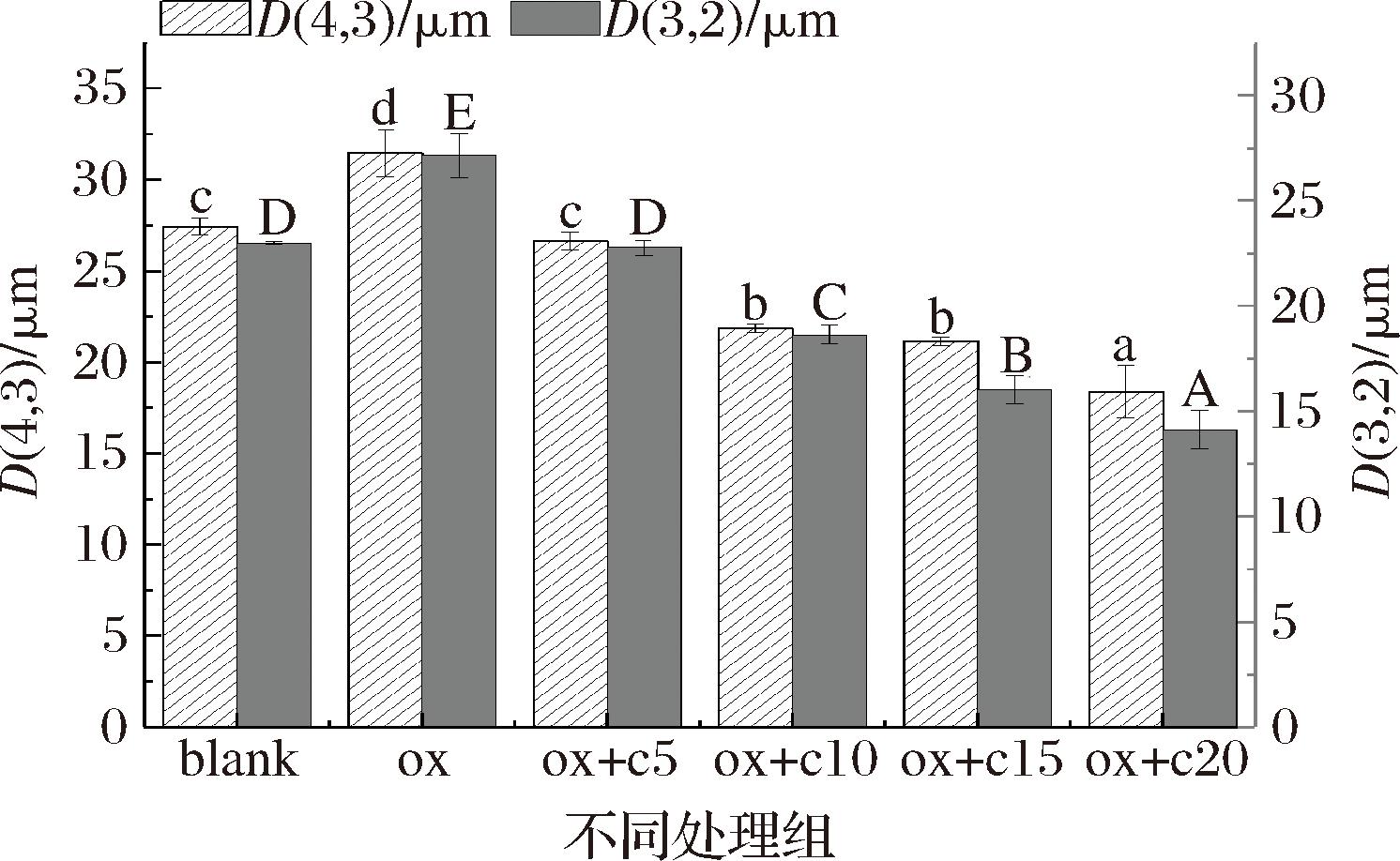
图5 不同处理方式对MPs乳液粒度的影响
Fig.5 Effects of different treatment methods on particle size of MPs emulsion
2.5 乳液流变学特性
流变学是研究物质流动性质的一门科学,由于流动特性常与产品的质量、稳定性和功能特性等紧密联系在一起,在乳液流变方面的研究更多应用于化妆品领域、洗涤用品配方及其制备工艺,同时在肉制品行业的研究也较为广泛[33]。图6和图7是不同方式处理后MPs乳液在频率扫描和温度扫描下的储能模量(G′)和损耗模量(G″)变化。图6-A和图6-B的G′和G″出现了同样的变化趋势,随着角频率的增加,储能模量和损耗模量均出现缓慢上升的现象,而G′的增高速率明显高于G″,同时当频率较小时,G′大于G″,随着角频率的增大,两者之间的差距越来越小,说明低角频率时乳液形成了有序的且具有弹性的凝胶结构,而高角频率下乳液形成无序的且黏性较大的凝胶结构,这些观察结果与LI等[12]的研究结果一致。此外不管是G′还是G″,氧化对照组均低于空白对照组,而添加5、10、15 μmol/L姜黄素后,两者均显著升高,而添加20 μmol/L姜黄素后,又出现下降的趋势,说明在一定的浓度下姜黄素的添加有利于乳液凝胶网状结构的形成,且与浓度呈正相关,但高浓度则会降低这种作用,这可能是因为蛋白质溶解度、分子大小、或者是蛋白质暴露的疏水性残基等有关,参与反应的蛋白质越多、分子质量越小,形成了乳化更加稳定致密,进而得到更高的G′和G″,20 μmol/L姜黄素处理后,可能是由于此时蛋白质的表面疏水性过低,而出现部分蛋白质相互作用,分子质量变大,故而较添加15 μmol/L姜黄素组稍有下降[34]。
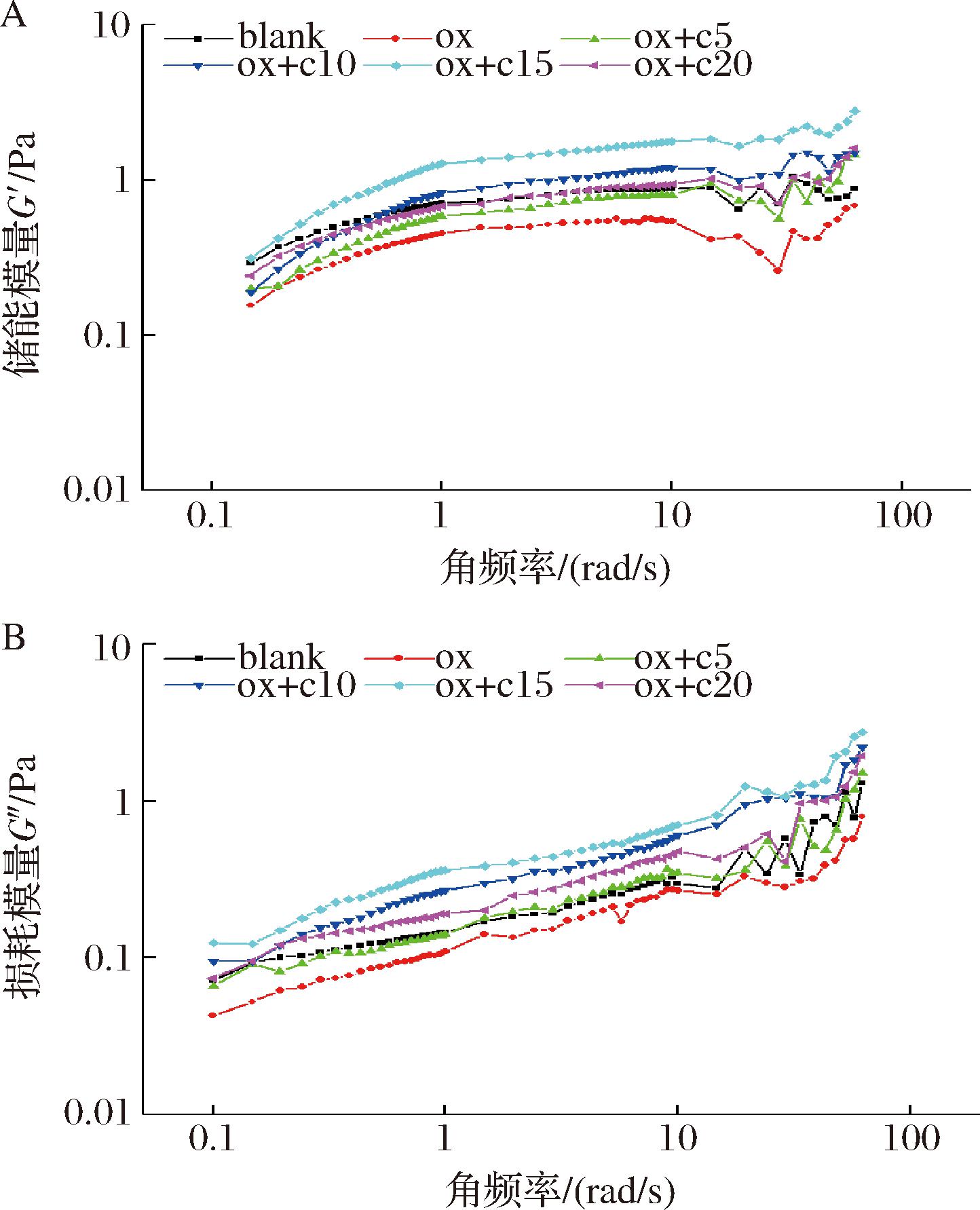
A-储能模量;B-损耗模量
图6 在频率扫描模式下不同处理方式对MPs乳液的储能模量(G′)和损耗模量(G″)的影响
Fig.6 Effects of different treatment methods on storage modulus (G′) and loss modulus (G″)of MPs emulsion in frequency scanning mode
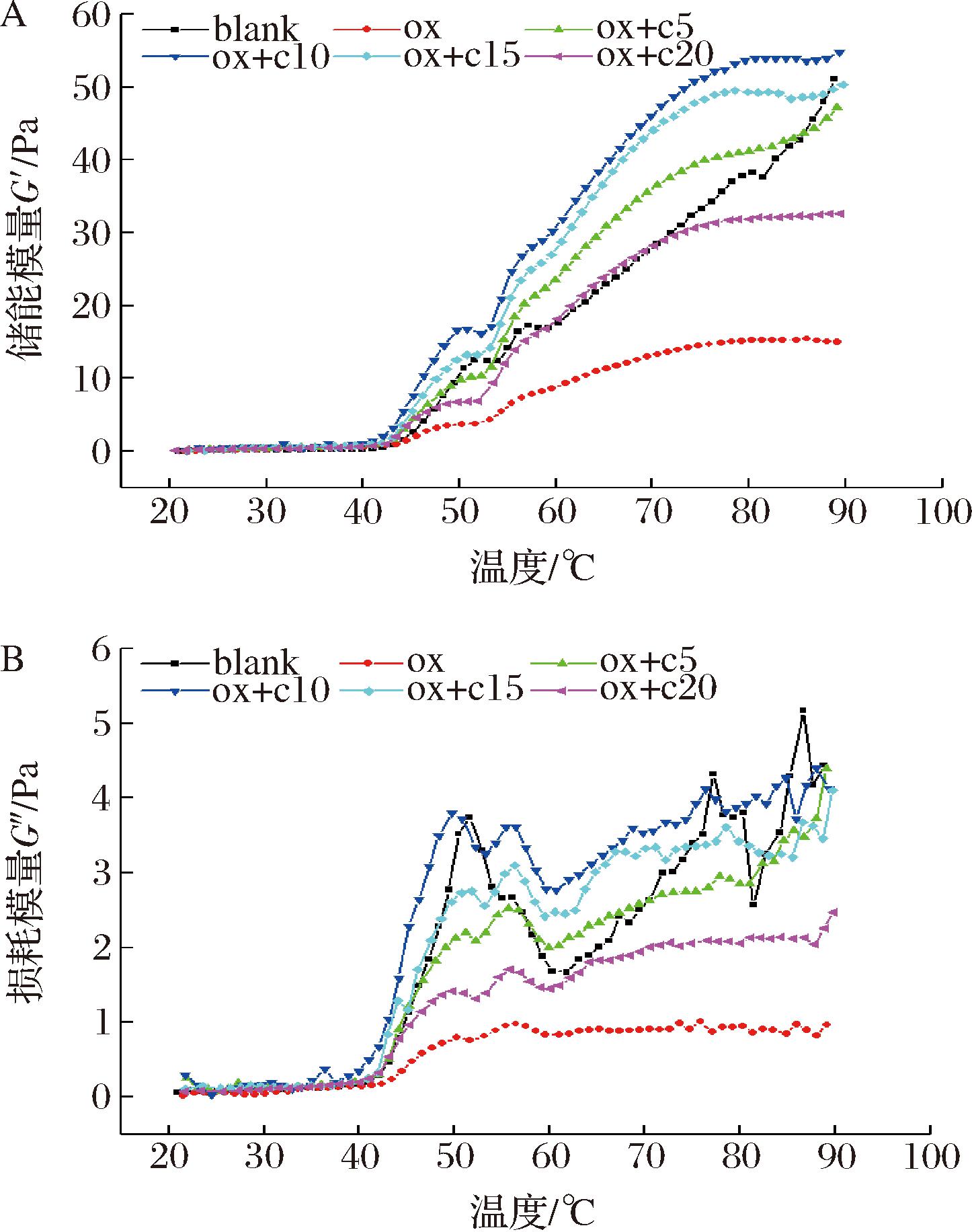
A-储能模量;B-损耗模量
图7 温度扫描模式下不同处理方式对MPs乳液的储能模量(G′)和损耗模量(G″)的影响
Fig.7 Effects of different treatment methods on storage modulus (G′) and loss modulus (G″)of MPs emulsion in frequency scanning mode
图7-A和图7-B显示了不同处理方式下乳液在20~90 ℃升温过程中G′和G″的变化,G′在前20~40 ℃表现出较为平稳的波动,然后迅速升高到第1个峰值(约50 ℃),接着稍有下降后又进一步升高,直至90 ℃,同时G′和G″均出现氧化对照组低于空白对照组,可能是因为乳液中含有大量的大豆油,增加了乳液中的氧化链式反应,加速了乳液的氧化,而过度氧化情况下会导致蛋白质的大量聚集,使参与形成凝胶的蛋白质量大量减少,从而出现较低的G′和G″现象[35]。而与氧化对照组相比添加姜黄素的实验组均高于它,同时由低到高的顺序为ox、ox+c20、ox+c5、ox+c15、ox+c10,添加姜黄素后,G′和G″先升高后降低,但均高于氧化对照组,说明姜黄素有利于提高乳液的特性,而该研究结果显示10 μmol/L的姜黄素更利于乳液流变的G′和G″的提高。同时从温度振动扫描结果中可以看出,G′始终远远大于G″值,且随着温度的升高,两者之间的差距越来越大,说明随着温度的升高,蛋白乳液形成了更具有弹性结构更加稳定的乳液凝胶[14]。
3 结论
通过荧光技术探究姜黄素与MPs相互作用机制发现姜黄素对MPs荧光猝灭类型为静态猝灭,且温度升高不利于两者形成稳定的复合物质。氧化后蛋白乳液的乳化活性及稳定性均显著性降低,5 μmol/L的姜黄素添加量对MPs乳化活性的提高效果最显著,20 μmol/L姜黄素添加时MPs的乳化稳定性最好;氧化后,蛋白乳液粒度增大,随着姜黄素浓度的增加蛋白乳液粒度尺寸逐渐减小,姜黄素可以使蛋白乳液更加的均匀稳定,有利于蛋白乳液的形成。氧化后无论是乳液的频率扫描还是温度扫描的G′和G″均显著性降低,随着姜黄素浓度的增加,频率扫描和温度扫描下G′和G″均出现先增加后降低的趋势,同时15 μmol/L姜黄素下,频率扫描下乳液可以获得最好的G′和G″,10 μmol/L姜黄素下,温度扫描下蛋白乳液表现出最高的G′和G",说明通过添加适量的姜黄素可以使得乳液凝胶网络结构更加稳定致密,对肌原纤维蛋白乳化特性的提高具有良好的促进作用。
[1] GOEL A, KUNNUMAKKARA A B, AGGARWAL B B.Curcumin as “curecumin”:From kitchen to clinic[J].Biochemical Pharmacology, 2008, 75(4):787-809.
[2] 黄浩河, 黄崇杏, 张霖雲, 等.姜黄素在食品保鲜中应用的研究进展[J].食品工业科技, 2020, 41(7):320-324, 331.HUANG H H, HUANG C X, ZHANG L Y, et al.Research progress of curcumin in food preservation application[J].Science and Technology of Food Industry, 2020, 41(7):320-324;331.
[3] 石丽双. 姜黄素对肌原纤维蛋白乳化凝胶体系稳定性及消化性影响[D].沈阳:沈阳农业大学, 2022.SHI L S.Effects of curcumin on the stability and digestibility of myofibrin emulsion gel system[D].Shenyang:Shenyang Agricultural University, 2022.
[4] ZHANG L L, LIN W F, ZHANG Y, et al.New insights into the NaCl impact on emulsifying properties of globular proteins[J].Food Hydrocolloids, 2022, 124:107342.
[5] 吕思伊, 卢琪, 潘思轶.包封姜黄素的果胶-核桃蛋白复合物乳液稳定性及体外消化[J].食品科学, 2021, 42(8):1-9.LYU S Y, LU Q, PAN S Y.Stability and in vitro digestion of pectin-walnut proteins stabilized emulsions encapsulating curcumin[J].Food Science, 2021, 42(8):1-9.
[6] LIU C H, WANG R C, HE S H, et al.The stability and gastro-intestinal digestion of curcumin emulsion stabilized with soybean oil bodies[J].LWT, 2020, 131:109663.
[7] WU C L, LI L Y, ZHONG Q X, et al.Myofibrillar protein-curcumin nano complexes prepared at different ionic strengths to improve oxidative stability of marinated chicken meat products[J].LWT, 2019, 99:69-76.
[8] 常海军, 周文斌.畜禽肉制品加工工艺与技术[M].哈尔滨:哈尔滨工程大学出版社, 2018.CHANG H J, ZHOU W B.Processing Technology and Technology of Livestock and Poultry Products[M].Harbin:Harbin Engineering University Press, 2018.
[9] CEN K Y, YU X, GAO C C, et al.Effects of quinoa protein Pickering emulsion on the properties, structure and intermolecular interactions of myofibrillar protein gel[J].Food Chemistry, 2022, 394:133456.
[10] LV Y Q, XU L L, SU Y J, et al.Effect of soybean protein isolate and egg white mixture on gelation of chicken myofibrillar proteins under salt/-free conditions[J].LWT, 2021,149:111871.
[11] ZHAO R N, FU W T, CHEN Y J, et al.Structural modification of whey protein isolate by cinnamaldehyde and stabilization effect on β-carotene-loaded emulsions and emulsion gels[J].Food Chemistry, 2022, 366:130602.
[12] LI K, FU L, ZHAO Y Y, et al.Use of high-intensity ultrasound to improve emulsifying properties of chicken myofibrillar protein and enhance the rheological properties and stability of the emulsion[J].Food Hydrocolloids, 2020, 98:105275.
[13] GAO T X, ZHAO X, LI R, et al.Synergistic effects of polysaccharide addition-ultrasound treatment on the emulsified properties of low-salt myofibrillar protein[J].Food Hydrocolloids, 2022, 123:107143.
[14] ZHAO X, WU T, XING T, et al.Rheological and physical properties of O/W protein emulsions stabilized by isoelectric solubilization/precipitation isolated protein:The underlying effects of varying protein concentrations[J].Food Hydrocolloids, 2019, 95:580-589.
[15] CAO Y G, MA W H, HUANG J R, et al.Effects of sodium pyrophosphate coupled with catechin on the oxidative stability and gelling properties of myofibrillar protein[J].Food Hydrocolloids, 2020, 104:105722.
[16] 熊杰. 鼠曲草提取物对猪肉肌原纤维蛋白氧化、结构及凝胶特性影响研究[D].重庆:重庆工商大学, 2022.XIONG J.Study on the effect of the extract of gnaphalium affine on the oxidation, structure and gel properties of pork myofibrillar proteins[D].Chongqing:Chongqing Technology and Business University, 2022.
[17] 江友娅, 陈琦, 张露, 等.芫花素对α-葡萄糖苷酶的抑制作用[J].食品工业科技, 2021, 42(15):43-47.JIANG Y Y, CHEN Q, ZHANG L, et al.Inhibitory effect of genkwanin on α-glucosidase[J].Science and Technology of Food Industry, 2021, 42(15):43-47.
[18] PRAGNA LAKSHMI T, MONDAL M, RAMADAS K, et al.Molecular interaction of 2,4-diacetylphloroglucinol (DAPG) with human serum albumin (HSA):The spectroscopic, calorimetric and computational investigation[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 2017, 183:90-102.
[19] 周香菊, 陈雨琴, 尹忠平, 等.柚皮素对α-葡萄糖苷酶的抑制作用及其机制[J].食品工业科技, 2022, 43(8):157-164.ZHOU X J, CHEN Y Q, YIN Z P, et al.Inhibitory effect of naringin on α-glucosidase and its mechanism[J].Science and Technology of Food Industry, 2022, 43(8):157-164.
[20] CAO M M, ZHANG X C, ZHU Y Q, et al.Enhancing the physicochemical performance of myofibrillar gels using Pickering emulsion fillers:Rheology, microstructure and stability[J].Food Hydrocolloids, 2022, 128:107606.
[21] CHENG J R, ZHU M J, LIU X M.Insight into the conformational and functional properties of myofibrillar protein modified by mulberry polyphenols[J].Food Chemistry, 2020, 308:125592.
[22] HU H, CHEUNG I W Y, PAN S Y, et al.Effect of high intensity ultrasound on physicochemical and functional properties of aggregated soybean β-conglycinin and glycinin[J].Food Hydrocolloids, 2015, 45:102-110.
[23] 张晓凡. 含苯并咪唑基稀土配合物的设计合成及其与牛血清白蛋白作用的研究[D].武汉:湖北大学, 2021.ZHANG X F.Studies on design, synthesis and application on the binding of benzimidazole rare earth complexes with bovine serum albumin[D].Wuhan:Hubei University, 2021.
[24] RHODES A A, SWARTZ B L, HOSLER E R, et al.Static quenching of tryptophan fluorescence in proteins by a dioxomolybdenum (VI) thiolate complex[J].Journal of Photochemistry and Photobiology A:Chemistry, 2014, 293:81-87.
[25] KUMAR R, UPPAL S, KAUR K, et al.Curcumin nanoemulsion as a biocompatible medium to study the metal ion imbalance in a biological system[J].Journal of Molecular Liquids, 2020, 314:113611.
[26] LIAO W, ELAISSARI A, DUMAS E, et al.Effect of trans-cinnamaldehyde or citral on sodium caseinate:Interfacial rheology and fluorescence quenching properties[J].Food Chemistry, 2023, 400:134044.
[27] CAMARGO C R, CARUSO  P, GUTIERREZ S J C, et al.Spectral and computational features of the binding between riparins and human serum albumin[J].Spectrochimica Acta. Part A, Molecular and Biomolecular Spectroscopy, 2018, 190:81-88.
P, GUTIERREZ S J C, et al.Spectral and computational features of the binding between riparins and human serum albumin[J].Spectrochimica Acta. Part A, Molecular and Biomolecular Spectroscopy, 2018, 190:81-88.
[28] ABOUDIAB B, TEHRANI-BAGHA A R, PATRA D.Curcumin degradation kinetics in micellar solutions:Enhanced stability in the presence of cationic surfactants[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2020, 592:124602.
[29] WANG H T, GUAN H N, ZHANG H W, et al.Elucidation of interaction mechanisms between myofibrillar proteins and ethyl octanoate by SPME-GC-MS, molecular docking and dynamics simulation[J].LWT, 2022, 154:112787.
[30] 于晶超. 阿魏酸低聚糖对肌原纤维蛋白结构和功能特性的调控机理研究[D].烟台:烟台大学, 2021.YU J C.The mechanism of feruloylated oligosaccharides on the structure and functional properties of myofibrillar protein[D].Yantai:Yantai University, 2021.
[31] 吴菊清. 猪肉肌原纤维蛋白乳化特性研究[D].南京:南京农业大学, 2015.WU J Q.Emulsifying properties of myofibrillar protein of pork[D].Nanjing:Nanjing Agricultural University, 2015.
[32] 张桂艳. 食盐和加热对肌原纤维蛋白与Ⅰ型胶原蛋白乳化特性的影响[D].郑州:河南农业大学, 2022.ZHANG G Y.Effects of NaCl and heating on emulsifying properties of myofibrillar protein and type I collagen[D].Zhengzhou:Henan Agricultural University, 2022.
[33] 张志秋. 基于不同结构乳化剂的活性原油界面性能及流变性能研究[D].大庆:东北石油大学, 2020.ZHANG Z Q.Interface properties and rheological properties of active crude oil based on emulsifiers with different structures[D].Daqing:Northeast Petroleum University, 2020.
[34] LIN D Q, KELLY A L, MIAO S.Formation and creaming stability of alginate/micro-gel particle-induced gel-like emulsions stabilized by soy protein isolate[J].Food Hydrocolloids, 2021, 121:107040.
[35] LIAO G M, ZHANG H P, JIANG Y R, et al.Effect of lipoxygenase-catalyzed linoleic acid oxidation on structural and rheological properties of silver carp (Hypophthalmichthys molitrix) myofibrillar protein[J].LWT, 2022, 161:113388.