芸豆(Phaseolus vulgaris L.),别名芸扁豆、四季豆,豆科菜豆属植物。我国芸豆主要在黑龙江、四川、内蒙古、吉林等地种植,据统计我国在2019年芸豆出口量达17.19 t,占食用豆总出口量44.55%[1]。芸豆中含有多种活性物质,如多肽、抗性淀粉和多酚类化合物,具有防止胃损伤、糖尿病和肠癌等功效[2]。蓝靛果(Lonicera caerulea L.),忍冬科忍冬属植物,又称山茄子、黑瞎子果等。蓝靛果耐高温且高度抗寒,果实略带苦涩[3]。蓝靛果出汁率较高,适于果汁饮料的加工,具有“第三代水果”之称[4]。蓝靛果除富含糖类、有机酸、矿物质外,黄酮、多酚、花色苷等活性物质含量也很高,极具营养与保健价值[5]。植物发酵液是以一种或多种新鲜蔬果、豆谷类等植物为原料,经多种益生菌发酵制得的富含酶、矿物质等营养成分的功能性微生物发酵产品[6]。选择复合原料发酵可以改善原料的结构特性,增加介质传递,提高微生物对原料的利用率[7]。复合植物发酵液不仅含有原料本身的营养成分,在发酵过程中还会产生的次生代谢产物,如黄酮类化合物、有机酸、超氧化物歧化酶(superoxide dismutase,SOD)等生物活性物质[8],具有抗氧化和调节肠道菌群[9]等功效。WANG等[10]通过鼠李糖乳酪杆菌217-1发酵葛根、忍冬和山楂混合物,制备了一种可以调节肠道菌群的复合发酵液,肠道菌群分析表明,发酵液可增加乳酸菌丰度,减少革兰氏阴性菌的产生,可积极调节肠道菌群。
大量研究证明肠道菌群是调节宿主新陈代谢和免疫系统的重要“器官”[11]。本研究采用复配乳酸菌分别制备芸豆发酵液、蓝靛果发酵液和芸豆-蓝靛果复合发酵液,探究不同原料发酵液的基础理化性质、生物活性成分及抗氧化性能,利用体外发酵模型研究其对肠道菌群的调节作用,评估不同原料发酵液对肠道菌群多样性及菌种丰度的影响,为芸豆及蓝靛果相关发酵产品的开发与利用提供理论依据。
1 材料与方法
1.1 材料与试剂
芸豆,黑龙江省;FR-3蓝靛果,峰然蓝靛果苗木研发基地;耐高温α-淀粉酶(20 000 U/mL)、糖化酶(10 000 U/mL)、果胶酶(500 U/g)、黄酮标准品、单宁酸标准品、DPPH,上海源叶生物科技有限公司;白糖,市售;植物乳植杆菌(Lactiplantibacillus plantarum, LP),东北农业大学菌库;嗜酸乳杆菌(Lactobacillus acidophilus, LA),中国微生物菌种保藏中心;偏磷酸,上海麦克林生化科技股份有限公司;Omega-soil DNA试剂盒,Omega bio-tek公司。
1.2 仪器与设备
BS224S电子天平,塞多利斯科学仪器有限公司;HCP-A7多功能料理机,海蒂诗国际集团;pHS-3C型pH计,力辰仪器专营店;Victor Nivo酶标仪,美国PerkinElmer公司;HH-6电热恒温水浴锅,常州荣华仪器制造有限公司;LAI-3T-N厌氧培养箱,上海龙跃仪器设备有限公司。
1.3 实验方法
1.3.1 发酵液制备
芸豆汁制备:芸豆与水按料液比1∶10(g∶mL)打浆,调节pH值为6.0,加入高温α-淀粉酶(200 μL/100 mL),97 ℃水浴搅拌20 min。取出芸豆汁恢复至室温,调节pH值为4.5,加入糖化酶(200 μL/100 mL),水浴搅拌30 min,细网滤网过滤后待用。
蓝靛果汁制备:蓝靛果添加40%(体积分数)蒸馏水打浆,添加2.5 g/100 mL果胶酶,搅拌均匀后室温静置30 min,细网滤网过滤后待用。
芸豆-蓝靛果混合汁(kidney bean-haskap compound juice, KBH)制备:将上述制备好的芸豆汁与蓝靛果汁按1∶1体积比混合。
调节上述芸豆汁、蓝靛果汁及KBH的pH值为5.0,糖添加量为4 g/100mL,80 ℃灭菌10 min后,按4%(体积分数)接种LP与LA(1∶1,体积比),在35 ℃摇床培养16 h,分别制备芸豆-蓝靛果复合发酵液(kidney bean-haskap compound fermentation broth, FKBH)、芸豆发酵液(kidney bean fermentation broth, FKB)和蓝靛果发酵液(haskap fermentation broth, FH)。
1.3.2 pH值及可溶性固形物测定
利用pH计测定不同发酵液pH值。利用手持折光仪测定不同发酵液可溶性固形物。
1.3.3 黄酮含量的测定
采用NaNO2-Al(NO3)3方法测定黄酮的含量[12]。发酵液在5 000 r/min的条件下离心10 min,收集上清液备用。将1 mL上清液样液与0.50 mL 5 g/100 mL NaNO2混合,室温下孵育6 min,然后加入0.5 mL 10 g/100 mL Al(NO3)3混合后孵育6 min,然后加入4 mL 4 g/100 mL NaOH溶液,甲醇定容至10 mL后在510 nm处测量吸光度。黄酮含量根据芦丁的标准曲线计算,得到回归方程y=0.041 3x+0.034 9,R2=0.999 4。
1.3.4 单宁含量的测定
参考候曼玲[13]的检测方法稍作改动。发酵液在2 000 r/min条件下离心10 min,收集上清液备用。在离心管中依次加入1 mL上清液样液,0.85 mL 75%无水乙醇,0.05 mL偏磷酸,12.5 mL去离子水,1.25 mL F-D(Folin-Denis)试剂,5 mL无水碳酸钠溶液,振荡混匀后,在30 ℃下暗反应1.5 h后在680 nm处测定吸光值。根据单宁酸的标准曲线计算,得到回归方程y=1.124 9x+0.076 5,R2=0.994 4。
1.3.5 DPPH自由基清除率测定
用无水乙醇配制DPPH溶液0.2 mmol/L,避光保存。取2 mL待测溶液于试管中,加入2 mL的DPPH溶液并摇匀,在室温避光反应30 min,在517 nm下测其吸光度为A1,用2 mL无水乙醇代替DPPH溶液,测其吸光度为A2,用2 mL蒸馏水代替待测溶液,测其吸光度为A0。DPPH自由基清除率的计算如公式(1)所示:
DPPH自由基清除率![]()
(1)
式中:A0表示空白组的吸光值;A1表示发酵液的吸光值;A2表示对照组的吸光值。
1.3.6 体外发酵
1.3.6.1 粪便菌悬液的制备
新鲜粪便样本取自2~3名正常体重的健康志愿者,年龄为20~25岁,身体质量指数(body mass index, BMI)在正常范围内(18.5~23.9)。所有志愿者在采集粪便样本前3个月内均无代谢及肠道疾病,无抗生素、益生菌服用史,均签署了知情同意书。采集新鲜粪便样本,1 g粪便样本中加入9 mL pH值7.0的无菌PBS缓冲液混合均匀,均质10 min,粪便混合液在1 000 r/min的条件下离心10 min,去除杂质,留取上清浑浊液为粪便发酵液备用。
1.3.6.2 发酵生长培养基的制备及体外发酵模型构建
参考LIANG等[14]方法稍作改动。制备发酵生长培养基NaCl 0.1 g,K2HPO4 0.04 g,KH2PO4 0.04 g,MgSO4 0.01 g,CaCl2 0.01 g,NaHCO3 2 g,蛋白胨2.5 g,酵母提取物4 g,黏蛋白2 g,胆盐0.5 g,Cysteine HCl 0.46 g,Tween-80 2 mL,混合后用0.5 mol/L HCl将pH值调至7.0,121 ℃、15 min高压灭菌,冷却后备用。将粪便发酵液与发酵培养基按1∶4的体积比混合,将FKBH、FKB、FH按2 g/100 mL分别添加到混合培养基中,不加入发酵液样品为对照组(Control),在37 ℃厌氧条件下分别培养24 h后,在12 000 r/min下离心10 min,上清液和沉淀物分别保存于-80 ℃,用于后续实验分析。
1.3.7 16S rRNA基因高通量测序
取出保存在-80 ℃的粪便沉淀物,进行DNA提取和16S rRNA高通量测序。使用上游引物338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和下游引物806R(5′-GGACTACHVGGGTWTCTAAT-3′)对16S rRNA基因的V3~V4可变区进行PCR扩增。使用Illumina HiSeq 2500平台进行测序。基于上海美吉生物医药科技有限公司I-sanger生信云平台(http://www.isanger.com/index.html)进行数据处理和生物信息分析,使用R语言工具分别分析各组不同水平的肠道菌群组成;用线性判别分析[LDA(linear discriminant analysis) effect size,LEfSe]分析(LDA>4,P<0.05)确定不同组间从门水平到属水平丰度显著差异的细菌类群。
1.4 数据处理
上述试验均重复3次,数据结果表示为平均值±标准差(standard deviation, SD),采用SPSS 25进行单因素方差分析(analysis of variance, ANOVA)。使用Graph Pad Prism 10软件作图。P<0.05为具有统计学意义。
2 结果与分析
2.1 不同发酵液pH值及可溶性固形物的影响
pH值及可溶性固形物是评价发酵液品质的重要指标。图1为不同发酵液pH值及可溶性固形物的对比结果。如图1-a所示,FKB和FH的pH值显著高于FKBH,FKBH的pH值显著低于KBH,表明FKBH的发酵效果更显著(P<0.05)。研究表明发酵可以充分利用糖原产生有机酸、乳酸等酸性代谢产物,引起发酵液pH值降低[15]。可溶性固形物可直观反映发酵液品质,若含量过高,发酵体系渗透压升高易破坏发酵菌种细胞壁及细胞膜特性,导致生长周期停滞或凋亡;含量过低,发酵液口感变酸,影响风味[16]。如图1-b所示,FKBH组可溶性固形物显著低于FKB组且显著高于FH组(P<0.05),推测FKBH组可溶性固形物含量适中,发酵体系环境适宜,适宜微生物发酵。
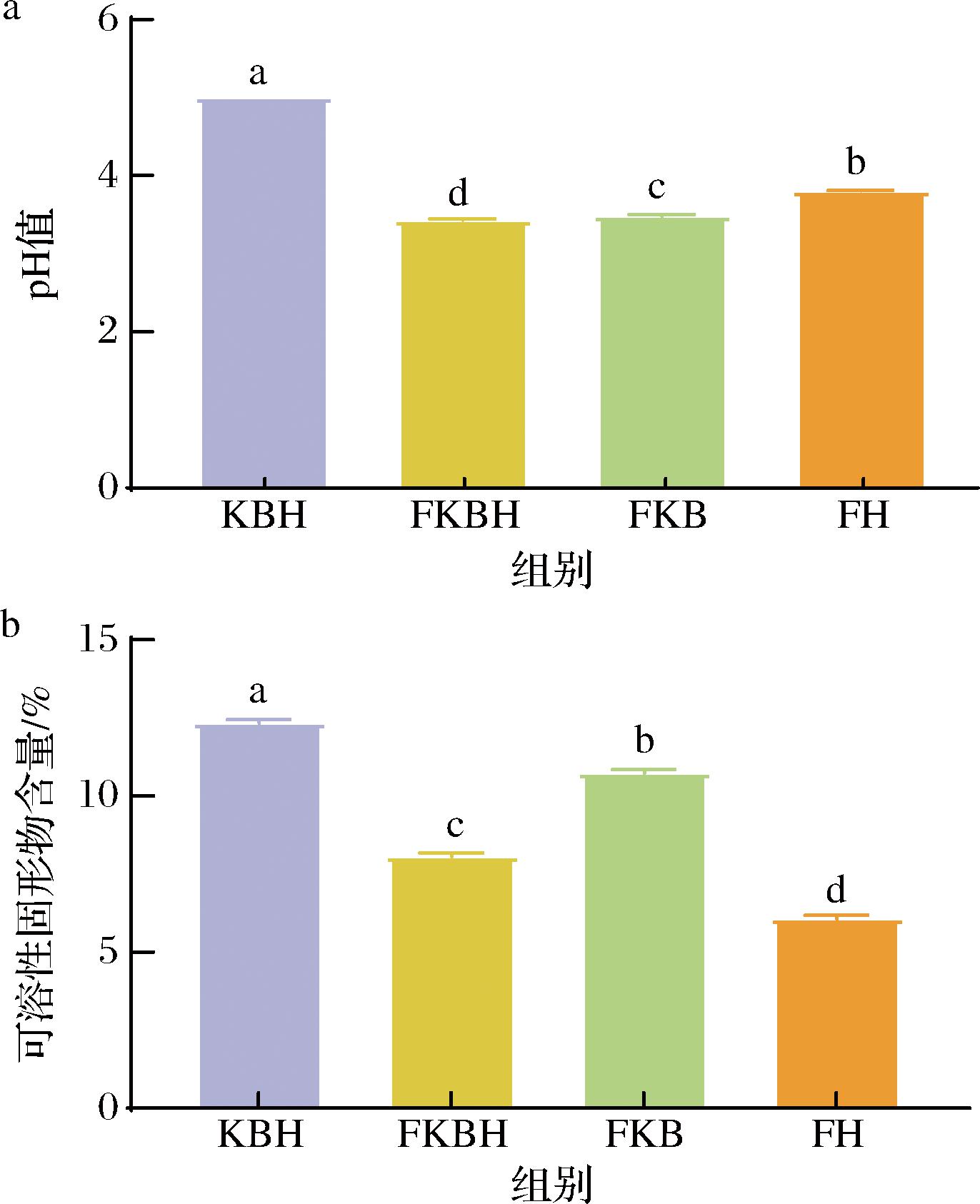
a-pH值;b-可溶性固形物含量
图1 不同发酵液理化性质测定
Fig.1 Determination of physicochemical properties of different fermentation broth
注:不同小写字母表示差异显著(P<0.05)(下同)。
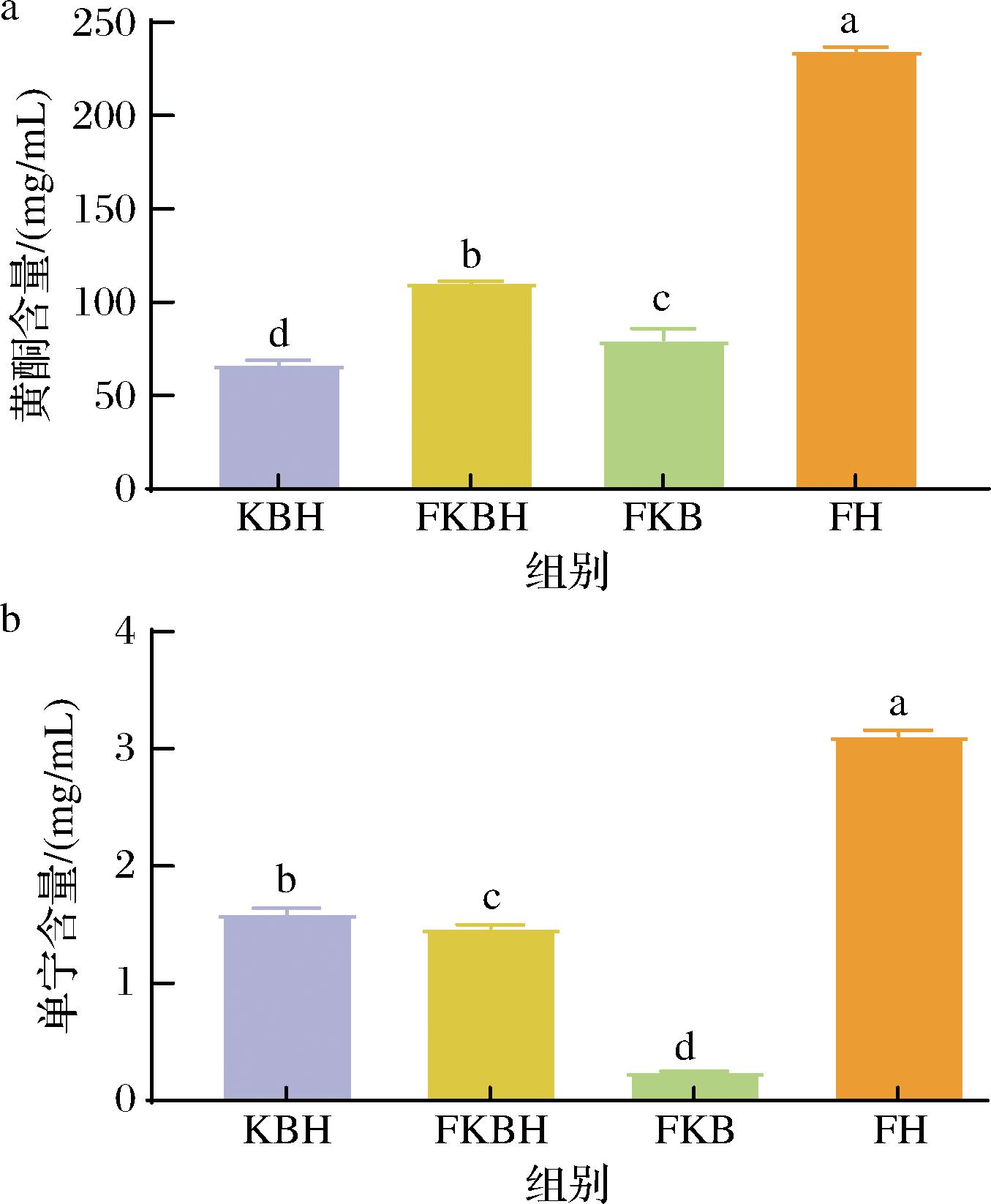
a-黄酮含量;b-单宁含量
图2 不同发酵液生物活性物质含量测定
Fig.2 Determination of bioactive substances in different fermentation broth
2.2 不同发酵液黄酮及单宁的影响
图2为不同发酵液黄酮及单宁含量的检测结果。由图2-a可知,FKBH组黄酮含量显著高于KBH组与FKB组(P<0.05),但显著低于FH组(P<0.05),其中FKBH组的黄酮含量是FKB组的1.48倍。蓝靛果为野生小浆果,原料自身含有大量多酚、黄酮类物质,与芸豆复配发酵后改善了芸豆发酵液黄酮含量较低的不足。图2-b中FKBH组单宁含量显著高于FKB组(P<0.05),是FKB组的6.21倍,但整体显著低于KBH组和FH组(P<0.05)。单宁具有防治腹泻改善机体肠道功能的优点,并且单宁含有的邻位酚羟基是一种优良的氢供体,对羟自由基等氧自由基有明显的清除能力,可提高发酵液的抗氧化性能[17],但是单宁又会给发酵液带来苦涩味[18]。本研究选用芸豆与蓝靛果复合发酵既可以提高复合发酵液的生物活性成分,又可以中和发酵液中的苦涩味。
2.3 不同发酵液DPPH自由基清除率的影响
图3为不同发酵液的DPPH自由基清除率。由图3可知,FKBH组DPPH自由基清除率显著高于KBH组与FKB组(P<0.05)。研究证明微生物发酵可提高植物原料中的有机酸含量,并且将原料中的结合酚转化为游离酚,进而提高发酵液中的抗氧化性能[19]。推测芸豆与蓝靛果复合发酵有利于原料中总酚、黄酮类物质的增加,进而有效提升发酵液的抗氧化活性。
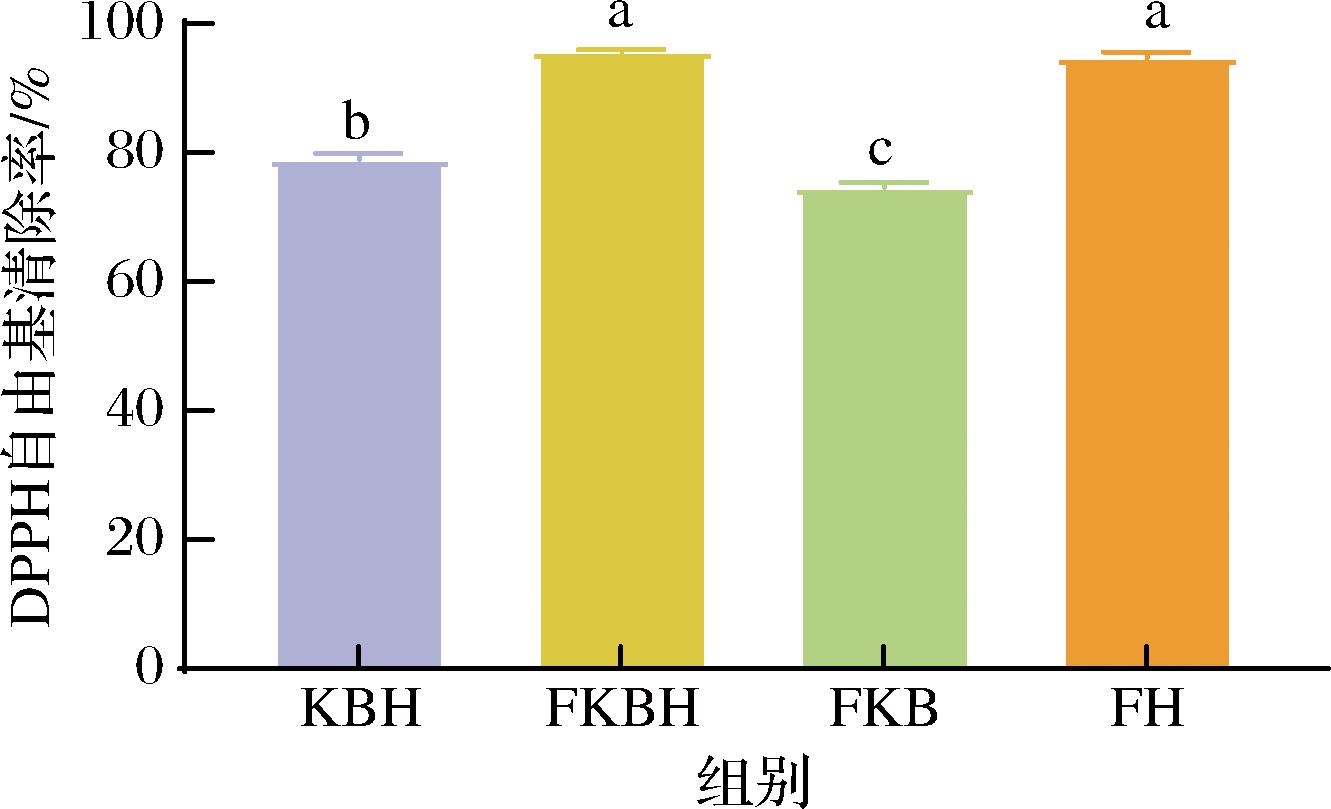
图3 不同发酵液DPPH自由基清除率测定
Fig.3 Determination of DPPH free radical clearance in different fermentation broth
2.4 不同发酵液对肠道菌群的调节作用
2.4.1 测序数据处理及OTU(operational taxonomic units,操作分类单元)分析
本实验的12份样本经测序后,共获得847 786优化序列,总长度355 569 612 bp,序列长度集中于400~440 bp之间。
Venn图可统计各组中OTU组成的相似性及重叠情况[20]。由图4可知,Control组与FKBH组、FKB组和FH组共有OTUs为159种;Control组、FKBH组、FKB组、FH组的OTU数目分别为236种、290种、302种、279种。FKBH组、FKB组和FH组均高于Control组,表明FKBH可提升肠道菌群的物种丰富度。
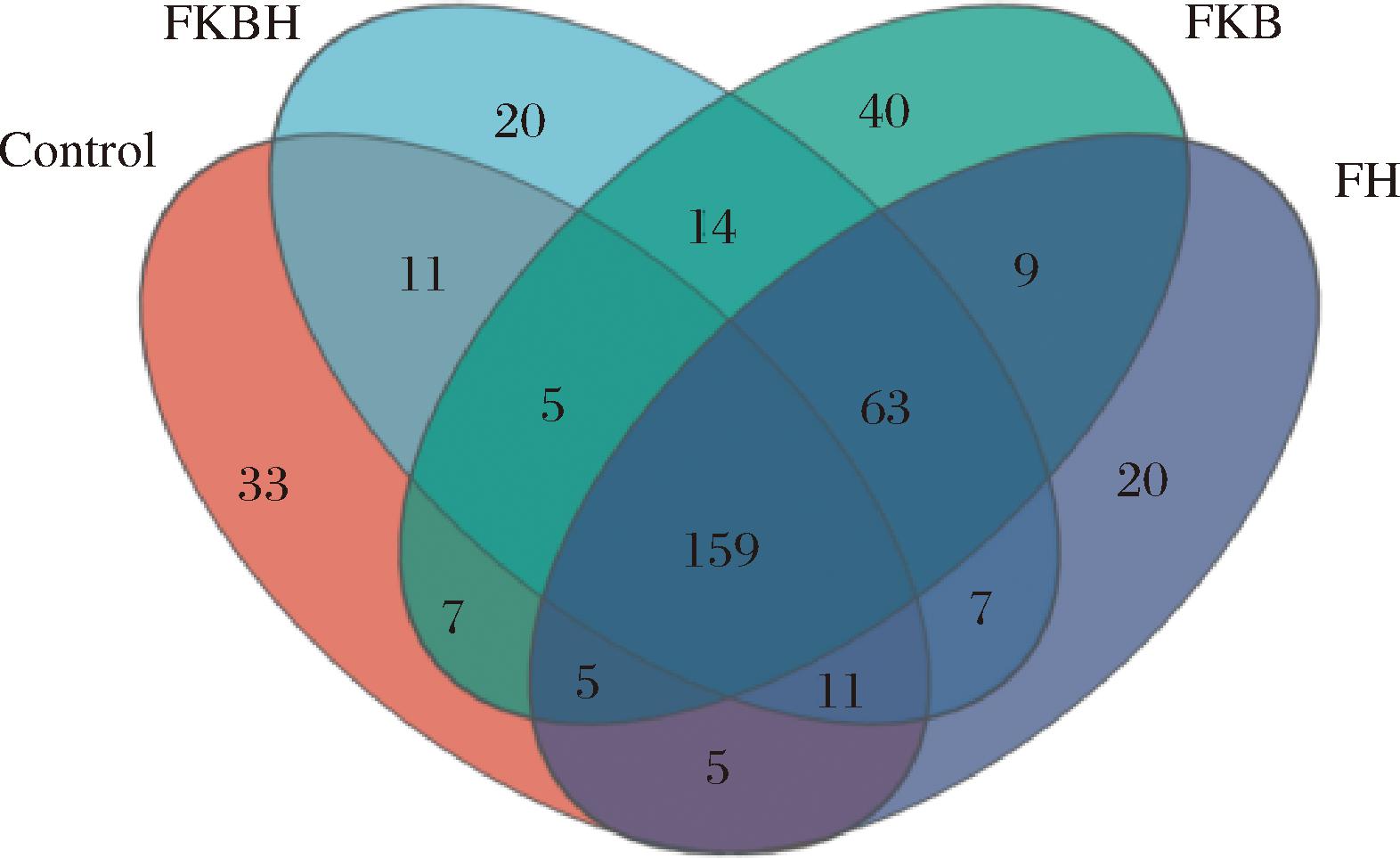
图4 Venn图
Fig.4 Venn diagram
2.4.2 α多样性分析
α多样性反映了微生物群落的丰富度与多样性。其中Chao指数反映了微生物群落丰富度,Shannon指数反映了群落均匀度。如图5-a所示,FKBH组、FKB组和FH组体外发酵后Chao指数显著高于Control组(P<0.05)。如图5-b所示,FKBH组、FKB组和FH组体外发酵后Shannon指数显著高于Control组(P<0.05)。以上结果表明,FKBH经体外发酵后可提高肠道菌群物种的丰富度与均匀度。
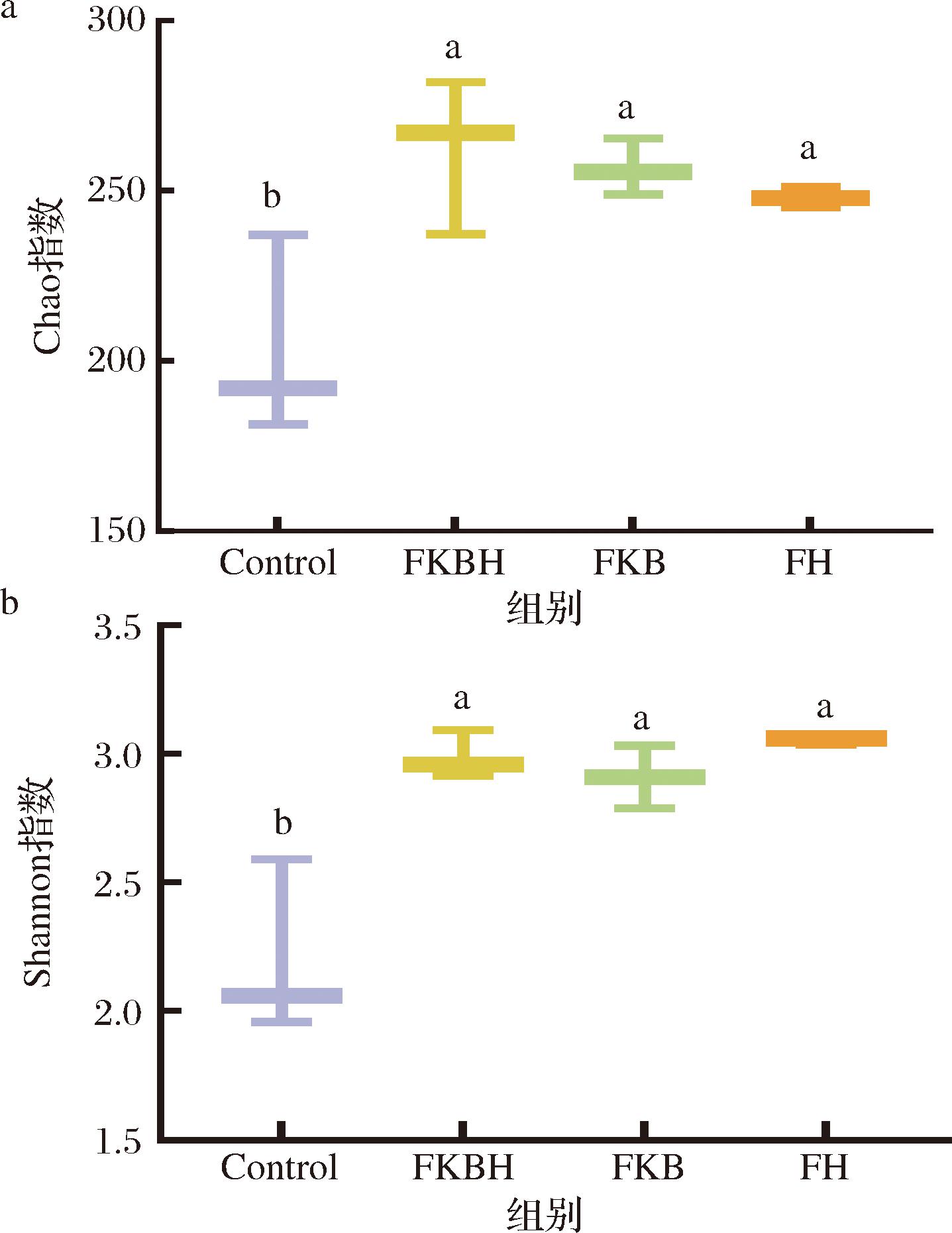
a-Chao指数;b-Shannon指数
图5 α多样性分析
Fig.5 α diversity analysis
注:两指数基于OTU水平。
2.4.3 β多样性分析
β多样性是评价不同样品间的菌群结构相似度的主要指标,主坐标分析(principal coordinates analysis, PCoA)可以较好地体现个体间的菌群结构差异大小。基于OTU水平的PCoA分析如图6所示,其中FKBH组、FKB组和FH组与Control组距离较远,分布明显不同,说明各组的肠道菌群均发生改变且差异明显。
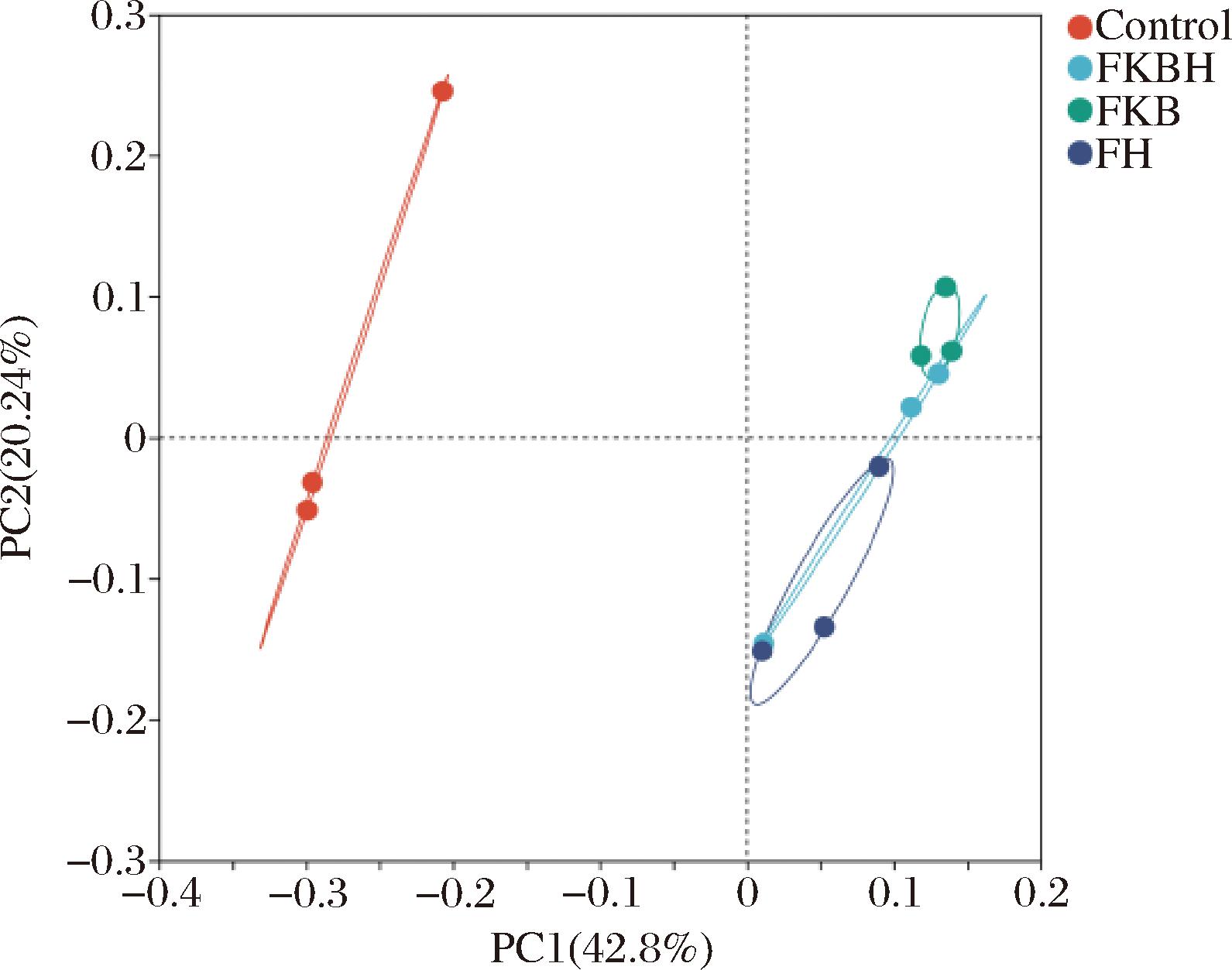
图6 PCoA分析
Fig.6 PCoA analysis
2.4.4 基于门水平的优势肠道菌群分析
图7-a为4组样本在体外发酵后肠道菌群门水平相对丰度分析,包括厚壁菌门(Firmicutes)、放线菌门(Actinobacteriota)、变形菌门(Proteobacteria)、拟杆菌门(Bacteroidota)、蓝细菌门(Cyanobacteria)、疣状菌门(Verrucomicrobiota)、脱硫杆菌门(Desulfobacterota)、unclassified_k__norank_d__Bacteria和Synergistota共9种主要菌门。
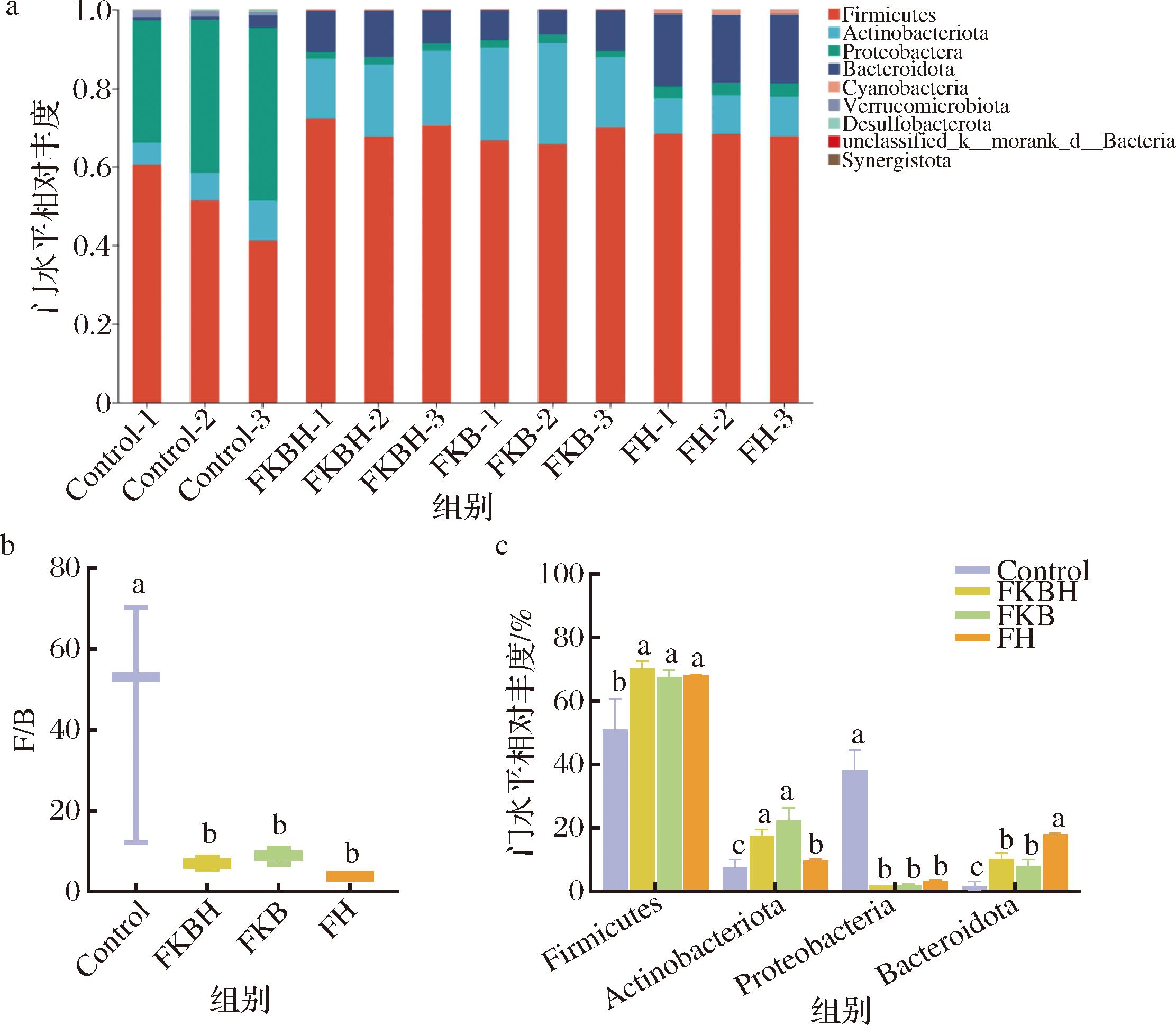
a-门水平相对丰度;b-F/B值;c-优势菌门相对丰度
图7 门水平肠道菌群相对丰度分析
Fig.7 Relative abundance analysis of gut microbiota on phylum level
有研究表明,肥胖与F/B(Firmicutes/Bacteroidota)之间存在相关性,F/B的降低会减少热量摄入,有利于降低肥胖的风险[21]。如图7-b所示,与Control组相比,FKBH组、FKB组及FH组均显著降低了F/B值(P<0.05)。图7-c为门水平前4种优势菌群的相对丰度分析。FKBH组、FKB组及FH组的Firmicutes相对丰度均显著高于Control组(P<0.05)。研究表明Firmicutes可以利用多糖产生短链脂肪酸(short-chain fatty acids, SCFAs),有助于抑制病原菌的增长[22],因此推测FKBH可减少肠道菌群中的有害菌生长;FKBH组的Actinobacteriota相对丰度显著高于FH组,且与FKB组无显著差异(P<0.05),Actinobacteriota可通过产生醋酸盐以保护人体免受肠道致病菌的感染[23];FKBH组、FKB组及FH组Proteobacteria相对丰度显著低于Control组(P<0.05),Proteobacteria易导致人体肠道菌群失调,有研究表明Proteobacteria与炎症和糖尿病等慢性病呈正相关,进而影响机体健康[24]。以上结果表明,FKBH经体外发酵后有助于调节门水平肠道微生物群落,推测芸豆与蓝靛果复合发酵可改善人体胃肠道功能。
2.4.5 基于属水平的优势肠道菌群分析
图8-a为4组样本在体外发酵后肠道菌群属水平相对丰度分析,4组样本的肠道菌群主要有乳酸菌属(Lactobacillus)、双歧杆菌属(Bifidobacterium)、粪杆菌属(Faecalibacterium)、Escherichia-Shigella、巨型球菌属(Megasphaera)、拟杆菌属(Bacteroides)和无花杆菌属(Agathobacter)等。由图8-b可知,FKBH组肠道菌群中Lactobacillus和Bifidobacterium的相对丰度显著高于FH组(P<0.05),与FH组相比分别增长了10.66%和10.22%。有研究表明,Lactobacillus及Bifidobacterium是肠道内重要的益生菌,可降低肠道脂多糖的合成、增加肠道屏障功能、降低炎症及肥胖风险[25]。肥胖或2型糖尿病患者的肠道菌群多样性较低,而Faecalibacterium是被发现存在差异的群落成员之一[26]。有研究表明,Faecalibacterium水平与BMI之间呈现负相关[27]。本研究中FKBH组、FKB组及FH组的Faecalibacterium相对丰度显著高于Control组(P<0.05),其中FKBH组较FKB组的Faecalibacterium相对丰度高10.97%。表明FKBH可通过调节肠道菌群中Faecalibacterium相对丰度降低人体BMI。Shigella又叫痢疾杆菌,是人体肠道感染的主要病菌之一,对人体有很高的感染性。全球肠道多中心研究(Global Enteric Multicenter Study, GEMS)表明,Shigella是2~5名腹泻儿童中最常见的病因[28]。Control组中Escherichia-Shigella相对丰度显著低于FKBH组、FKB组及FH组(P<0.05),且FKBH组、FKB组和FH组间无显著性差异(P<0.05)。已有研究证明Escherichia-Shigella是肠道菌群失调的相关因素,可促进肠道损伤并影响氨基酸代谢[29]。Bacteroides是革兰氏阴性、厌氧杆状细菌,为人类常驻菌群。有研究表明,Bacteroides可消化不易被结肠上皮细胞所吸收的长链多糖及低聚糖,增强机体肠道消化能力[30]。本研究证明FKBH组、FKB组与FH组中Bacteroides相对丰度显著高于Control组(P<0.05)。以上结果表明,FKBH对肠道菌群中有益菌丰度有促进作用,对有害菌丰度有抑制作用。
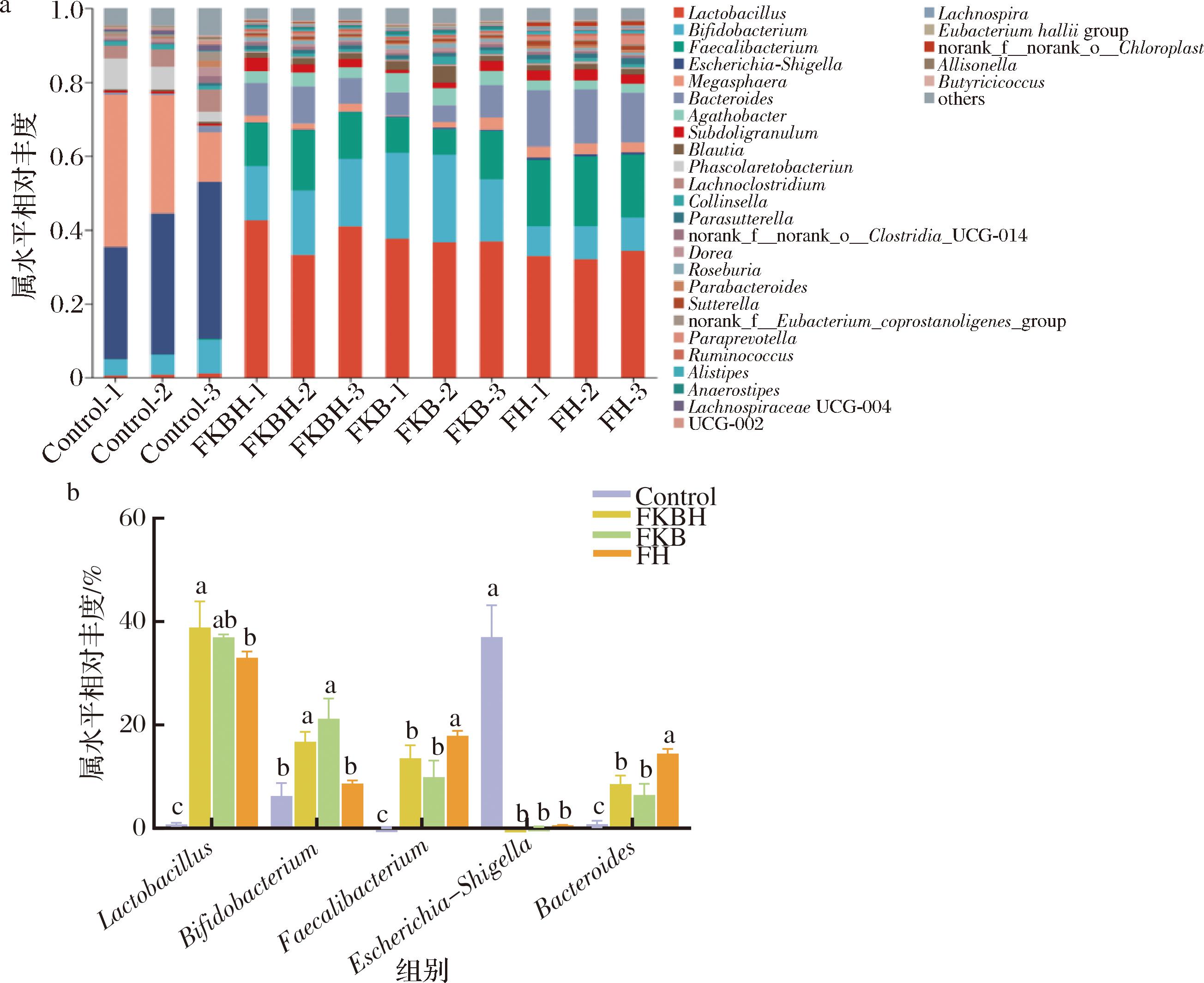
a-属水平相对丰度;b-优势菌属相对丰度
图8 属水平肠道菌群相对丰度分析
Fig.8 Relative abundance analysis of gut microbiota on genus level
2.4.6 物种分类差异分析
LEfSe分析可进行多组间比较,从而找到组间在丰度上有显著差异的物种并评估差异显著物种的影响力。如图9所示,Control组中对群落结构影响较大的物种有肠杆菌科(Enterobacteriaceae)、γ变形菌纲(Gammaproteobacteria)、Proteobacteria、肠杆菌目(Enterobacterales)、Escherichia-Shigella、葡聚糖杆菌属(Phascolarctobacterium)等;FKBH组中对群落结构影响较大的物种有乳杆菌科(Lactobacillaceae)、乳酸杆菌目(Lactobacillales)、Lactobacillus和杆菌纲(Bacilli);FKB组中对群落结构影响较大的物种有Actinobacteriota、放线菌纲(Actinobacteria)、Bifidobacterium、Agathobacter和链杆菌属(Catenibacillus);FH组中对群落结构影响较大的物种有瘤胃球菌科(Ruminococcaceae)、摇旋菌目(Oscillospirales)、Faecalibacterium、Bacteroides和梭菌纲(Clostridia)等。其中,FKBH组中特征性肠道菌群种属为Lactobacillus,与图8结果相一致,也是FKBH中的优势菌属。
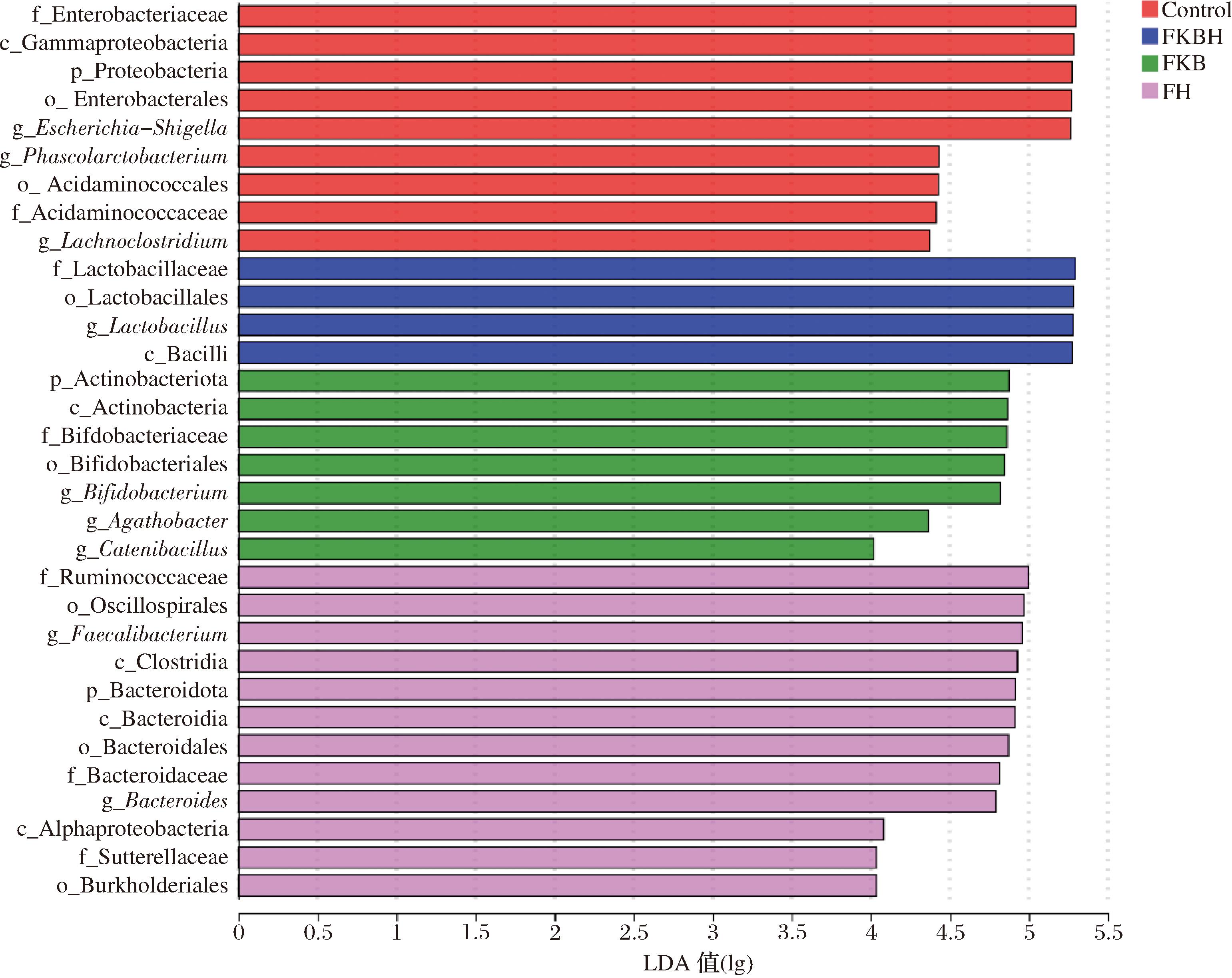
图9 LDA值分布柱状图
Fig.9 Histogram of LDA value distribution
3 结论
本实验以芸豆及蓝靛果为原料,探究芸豆、蓝靛果单一发酵与复合发酵的区别。首先研究了不同原料发酵液的基础理化性质与抗氧化性能,随后通过体外发酵模型分别评估其对肠道菌群的调节作用。结果表明FKBH可显著增加黄酮和单宁含量,提高抗氧化性。经体外发酵实验证明,FKBH可增加肠道菌群中的Lactobacillus及Bifidobacterium有益菌的相对丰度,降低有害菌Escherichia-Shigella的相对丰度,LEfSe分析显示,FKBH的优势菌属和特征性肠道菌群是Lactobacillus,具有良好的肠道菌群调节作用。本研究可为深入研究芸豆及蓝靛果的综合利用及其在肠道功能的应用实践提供理论依据。
[1] 钱静斐, 张蕙杰.中国食用豆贸易演变特征及现状分析[J].中国食物与营养, 2021, 27(2):20-25.QIAN J F, ZHANG H J.Analysis on the characteristics and current situation of China’s edible beans trade[J].Food and Nutrition in China, 2021, 27(2):20-25.
[2] REDDY C K, SURIYA M, HARIPRIYA S.Physico-chemical and functional properties of Resistant starch prepared from red kidney beans (Phaseolus vulgaris.L) starch by enzymatic method[J].Carbohydrate Polymers, 2013, 95(1):220-226.
[3] 李圣桡, 李若萌, 陈博朴, 等.蓝靛果的营养价值与加工技术研究进展[J].农产品加工, 2020(2):68-73.LI S R, LI R M, CHEN B P, et al.Research progress on nutritional value and processing technology of blue rime fruit[J].Farm Products Processing, 2020(2):68-73.
[4] 臧丹丹, 范丽莉, 邵玲玲, 等.蓝靛果忍冬资源的研究现状与利用对策[J].土壤与作物, 2020, 9(2):203-209.ZANG D D, FAN L L, SHAO L L, et al.Utilization status of germplasm resources, existing problems and countermeasures for Lonicera caerulea[J].Soils and Crops, 2020, 9(2):203-209.
[5] 张龄予, 潘丽佳, 侯苏芯, 等.蓝靛果多酚对免疫抑制小鼠调节肠道微生态的作用机制[J].食品科学, 2023, 44(15):147-155.ZHANG L Y, PAN L J, HOU S X, et al.Mechanism of action of Lonicera caerulea berry polyphenols in regulating intestinal microecology in immunosuppressive mice[J].Food Science, 2023, 44(15):147-155.
[6] 赵芳芳, 莫雅雯, 蒋增良, 等.功能性微生物酵素产品的研究进展[J].食品与发酵工业, 2016, 42(7):283-287.ZHAO F F, MO Y W, JIANG Z L, et al.Research progress on functional microbial ferment product[J].Food and Fermentation Industries, 2016, 42(7):283-287.
[7] 包怡红, 赵鑫磊, 唐妍, 等.蓝靛果米糠酵素发酵工艺优化及其代谢产物变化分析[J].中南林业科技大学学报, 2022, 42(2):147-158.BAO Y H, ZHAO X L, TANG Y, et al.The optimization of fermentation technology and the changes of metabolites of Lonicera caerulea rice bran enzyme[J].Journal of Central South University of Forestry &Technology, 2022, 42(2):147-158.
[8] 程勇杰, 陈小伟, 王珍珍, 等.树莓酵素与蓝莓酵素有机酸分析及其体外抗氧化性能[J].食品工业科技, 2017, 38(20):141-145;165.CHENG Y J, CHEN X W, WANG Z Z, et al.Analysis of organic acids and in vitro antioxidant activity of raspberry-ferment and blueberry-ferment[J].Science and Technology of Food Industry, 2017, 38(20):141-145;165.
[9] TANG S Y, LUO N, ZENG Q Z, et al.Lychee pulp phenolics fermented by mixed lactic acid bacteria strains promote the metabolism of human gut microbiota fermentation in vitro[J].Food &Function, 2023, 14(16):7672-7681.
[10] WANG T, WANG Z, YANG Z P, et al.Effect of the fermentation broth of the mixture of Pueraria lobata, Lonicera japonica, and Crataegus pinnatifida by Lactobacillus rhamnosus 217-1 on liver health and intestinal flora in mice with alcoholic liver disease induced by liquor[J].Frontiers in Microbiology, 2021, 12:722171.
[11] 杨雪菲, 漆艳娥, 太珍珍, 等.肠道菌群在机体免疫调节功能中的作用[J].中国微生态学杂志, 2016, 28(8):979-983.YANG X F, QI Y E, TAI Z Z, et al.The role of intestinal flora in immune regulation[J].Chinese Journal of Microecology, 2016, 28(8):979-983.
[12] 周海龙, 崔江明, 马利华.萌发及甜醅发酵处理对燕麦营养品质、淀粉体外消化能力及抗氧化性的影响[J].中国粮油学报, 2021, 36(9):82-86.ZHOU H L, CUI J M, MA L H.Effects of germination and sweet fermented grains fermentation on nutritional quality, starch digestion in vitro and antioxidant properties of oat[J].Journal of the Chinese Cereals and Oils Association, 2021, 36(9):82-86.
[13] 侯曼玲. 食品分析[M].北京:化学工业出版社, 2004.HOU M L.Food Analysis[M].Beijing:Chemical Industry Press, 2004.
[14] LIANG X Y, LIU H C, WEI Z N, et al.Modulation of gut flore by dietary fibers from Pyrus bretschneideri Rehd.:Evaluation of fermentation characteristics using a colonic in vitro fermentation model[J].Journal of Functional Foods, 2023, 102:105466.
[15] XU Y, JIN Y M, SU J J, et al.Changes in the nutritional value, flavor, and antioxidant activity of brown glutinous rice during fermentation[J].Food Bioscience, 2021, 43:101273.
[16] 吕慧威, 孙玉梅, 卢明春, 等.自选酵母菌株草莓酒发酵特性比较[J].食品科学, 2010, 31(11):197-201.LYU H W, SUN Y M, LU M C, et al.Comparison on fermentation characteristics of strawberry wine by self-selected yeasts[J].Food Science, 2010, 31(11):197-201.
[17] 贾晓燕, 胡朋朋, 王佩欣, 等.覆盆子单宁富集组分消化稳定性及对肠道菌群的调节作用[J].食品科学, 2023, 44(9):104-113.JIA X Y, HU P P, WANG P X, et al.Digestive stability of Tannin-enriched fraction of Rubus chingii Hu fruits and its regulatory effect on the intestinal microflora[J].Food Science, 2023, 44(9):104-113.
[18] 刘晓燕, 谢丹, 马立志, 等.刺梨果渣发酵前后活性成分及抗氧化能力的比较研究[J].食品科技, 2021, 46(2):16-24.LIU X Y, XIE D, MA L Z, et al.Comparative study on active components and antioxidant capacity of Rosa roxburghii Tratt.fruit residue before and after fermentation[J].Food Science and Technology, 2021, 46(2):16-24.
[19] HU X, ZENG J R, SHEN F, et al.Citrus pomace fermentation with autochthonous probiotics improves its nutrient composition and antioxidant activities[J].LWT, 2022, 157:113076.
[20] FOUTS D E, SZPAKOWSKI S, PURUSHE J, et al.Next generation sequencing to define prokaryotic and fungal diversity in the bovine rumen[J].PLoS One, 2012, 7(11):e48289.
[21] DOU Z M, CHEN C, HUANG Q, et al. In vitro digestion of the whole blackberry fruit: Bioaccessibility, bioactive variation of active ingredients and impacts on human gut microbiota[J].Food Chemistry, 2022, 370:131001.
[22] BENSCH H M, TOLF C, WALDENSTRÖM J, et al.Bacteroidetes to Firmicutes:Captivity changes the gut microbiota composition and diversity in a social subterranean rodent[J].Animal Microbiome, 2023, 5(1):9.
[23] TUOHY.Diet-Microbe Interactions in the Gut[M].Elsevier:Academic Press, 2015.
[24] SHIN N R, WHON T W, BAE J W.Proteobacteria:Microbial signature of dysbiosis in gut microbiota[J].Trends in Biotechnology, 2015, 33(9):496-503.
[25] LI M J, DING J H, STANTON C, et al.Bifidobacterium longum subsp.infantis FJSYZ1M3 ameliorates DSS-induced colitis by maintaining the intestinal barrier, regulating inflammatory cytokines, and modifying gut microbiota[J].Food &Function, 2023, 14(1):354-368.
[26] MART N R, RIOS-COVIAN D, HUILLET E, et al.Faecalibacterium:A bacterial genus with promising human health applications[J].FEMS Microbiology Reviews, 2023, 47(4):fuad039.
N R, RIOS-COVIAN D, HUILLET E, et al.Faecalibacterium:A bacterial genus with promising human health applications[J].FEMS Microbiology Reviews, 2023, 47(4):fuad039.
[27] NAVAB-MOGHADAM F, SEDIGHI M, KHAMSEH M E, et al.The association of type Ⅱ diabetes with gut microbiota composition[J].Microbial Pathogenesis, 2017, 110:630-636.
[28] LIU J, PLATTS-MILLS J A, JUMA J, et al.Use of quantitative molecular diagnostic methods to identify causes of diarrhoea in children:A reanalysis of the GEMS case-control study[J].The Lancet, 2016, 388(10051):1291-1301.
[29] YANG L, XIANG Z, ZOU J M, et al.Comprehensive analysis of the relationships between the gut microbiota and fecal metabolome in individuals with primary sjogren’s syndrome by 16S rRNA sequencing and LC-MS-based metabolomics[J].Frontiers in Immunology, 2022, 13:874021.
[30] ZAFAR H, JR S M H.Gut Bacteroides species in health and disease[J].Gut Microbes, 2021, 13(1):1-20.