随着特色乳产业的快速发展,马奶作为一种草原资源,其营养价值逐渐被发现和认可[1]。马奶中含有丰富的乳铁蛋白,这种糖蛋白有助于人体对铁的吸收,除可以增强免疫功能外,还具有抗菌、抗氧化和抗炎等多种生理功能[2]。在营养结构上,马奶比牛奶更接近人奶,有利于消化吸收。有研究表明出生15~35 d的婴儿食用马奶可提高生长速度和增强免疫力[3]。酸马奶是以新鲜马乳为原料,在乳酸菌、酵母菌等有益微生物共同作用下,自然发酵而成的一种乳白色略带淡青的低乙醇含量的发酵饮料[4],且发酵马奶中乳糖被降解,更适于乳糖不耐受患者饮用[5]。因此酸马奶中的营养特性也发生了一定的变化,其富含多种营养物质,如糖类、蛋白质、脂肪、乳糖、维生素、矿物质等[6],并参与人体新陈代谢,调节生理功能,增强免疫力,在预防疾病方面发挥作用[7];有研究表明饮用酸马奶能够有效调节慢性萎缩性胃炎患者的肠道代谢[8]。但在这些作用中所调控的小分子代谢物的研究鲜有报道。
代谢组学是继基因组学、转录组学和蛋白质组学之后又一个蓬勃发展的组学领域,是系统生物学的重要组成部分。代谢物是复杂的细胞调控网络的产物,可以通过反馈回路影响甚至改变调控。全面分析代谢物可以直接了解代谢过程、代谢通路及作用[9]。XIA等[10]通过非靶向代谢组学的方法发现,马奶发酵成酸马奶的过程中有8种代谢5物[对丙酮酸、20-羟基二十碳四烯酸(20-hydroxyeicosatetraenoic acid,20-HETE)等]浓度发生显著变化。更深研究发现,与发酵前相比后,酸马奶中上调了43种代谢物,其中N-乙酰基-D-葡萄糖胺、吡哆醇及腺嘌呤等有增强机体免疫力的功效;下调了31代谢物,其中尿嘧啶已被证明是酸马奶发酵过程中的关键差异代谢物,并对多种肿瘤产生影响[11]。因此,本研究以ICR(institute of cancer research)小鼠为研究对象,探究灌喂酸马奶对小鼠免疫指标、抗氧化指标及血浆代谢的影响,并筛选出相关的差异代谢物和代谢通路,为马奶在功能性食品开发方面提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 实验动物及饲养方案
选择4周龄无特定病原体(specific pathogen free,SPF)级ICR小鼠16只(购自新疆医科大学动物实验中心)。适应性饲养7 d后,随机分成2组(对照组、酸马奶组),每组8只。酸马奶组每只小鼠每天灌喂10 mL/kg体重(body weight,BW)酸马奶,对照组每只小鼠每天灌喂10 mL/kg BW生理盐水,试验期间小鼠自由采食和饮水,持续灌胃28 d。
1.1.2 奶样来源
鲜马奶来自新疆塔城市恰合吉牧场,酸马奶由同一批次鲜马奶经过滤后冷却至20 ℃左右,放入装有剩余酸马奶的容器中进行自然发酵,发酵温度控制在20 ℃左右,发酵48 h后置于-20 ℃保存使用。
1.1.3 主要试剂
小鼠γ干扰素(interferon-γ,IFN-γ)试剂盒、小鼠IL-10试剂盒、小鼠IL-6试剂盒,江苏酶免实业有限公司;丙二醛(malondialdehyde,MDA)测定试剂盒、总抗氧化能力(total antioxidant capacity,T-AOC)测定试剂盒,江苏艾迪生生物科技有限公司;BCA蛋白浓度试剂盒,碧云天生物技术有限公司。
1.2 实验方法
1.2.1 样本采集
在第28天饲喂结束后,禁食不禁水24 h,在第29天摘取小鼠眼球采血样,立即进行3 500 r/min离心15 min,取血浆于1 mL冻存管,液氮保存,用于血浆代谢组检测。血样采集后,小鼠颈椎脱臼致死,采集肝脏样本,用生理盐水冲洗后放入冻存管液氮保存,用于免疫及抗氧化指标检测。
1.2.2 肝脏免疫及抗氧化指标测定
取肝脏匀浆,采用BCA蛋白浓度试剂盒测定蛋白质浓度;采用ELISA法测定IFN-γ、IL-10、IL-6浓度;采用ELISA法测定T-AOC、MDA浓度。所有操作按照试剂盒说明书进行。
1.2.3 血浆代谢组检测
将所有待测样本于室温条件下解冻后,取100 μL样本置于EP管中,加入400 μL的80%(体积分数)甲醇水溶液,涡旋振荡,冰浴静置5 min,15 000×g、4 ℃离心20 min;取一定量的上清液加质谱级水稀释至甲醇含量为53%;15 000×g、4 ℃离心20 min,收集上清液,进样LC-MS进行分析。色谱条件:色谱柱为HypersilGoldcolumn(C18),流速为0.2 mL/min,柱温为40 ℃。梯度洗脱程序见表1。
表1 梯度洗脱程序
Table 1 Gradient elution program
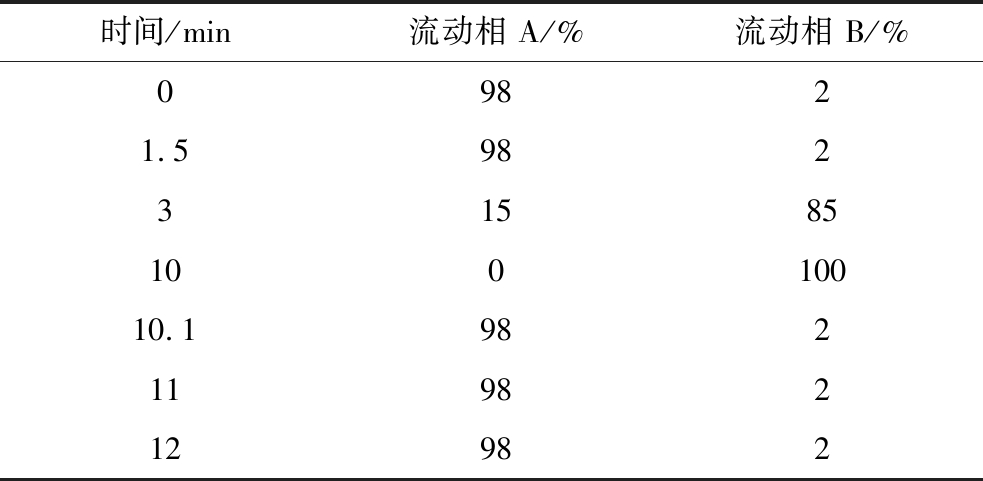
注:正离子模式下,流动相A为0.1%甲酸,流动相B为甲醇;负离子模式下,流动相A相为5 mmol/L醋酸铵(pH值9.0),流动相B为甲醇。
时间/min流动相 A/%流动相 B/%09821.59823158510010010.19821198212982
1.3 数据分析
Excel对原始数据进行预处理,SPSS 26.0进行独立样本T检验。结果以“平均值±标准误”表示,P<0.05表示差异显著,P<0.01表示差异极显著,P>0.05表示差异不显著。
下机原始数据使用CD 3.3软件进行数据预处理。首先通过保留时间、质荷比等参数简单筛选,同时对峰面积进行定量。使用KEGG数据库、HMDB数据库和LIPIDMaps数据库对鉴定到的代谢物进行注释。多元统计分析部分,使用代谢组学数据处理软件metaX对数据进行转换后进行主成分分析(principal component analysis,PCA)和偏最小二乘法判别分析(partial least squares discriminant analysis,PLS-DA),进而得到个代谢物的变量投影重要性(variable importance in the projection,VIP)值。单变量分析部分,基于t检验来计算各代谢物在2组间统计学显著性(P值),并计算代谢物在2组间的差异倍数(fold change,FC),FC值。以VIP>1,FC>1.2或FC<0.833且P<0.05的标准进行差异代谢物的筛选及聚类分析和KEGG富集分析。
2 结果与分析
2.1 酸马奶对小鼠肝脏免疫及抗氧化指标的影响
由表2可知,在免疫指标中,酸马奶组小鼠肝脏中IFN-γ含量极显著(P<0.01)低于对照组;与对照组相比,酸马奶组小鼠肝脏中IL-10含量极显著(P<0.01)提高,IL-6含量极显著(P<0.01)降低。在抗氧化指标中,酸马奶组小鼠总蛋白含量极显著(P<0.01)高于对照组;与对照组相比,酸马奶组小鼠肝脏T-AOC活力提升但差异不显著(P>0.05),与MDA含量极显著(P<0.01)降低。
表2 酸马奶对小鼠肝脏免疫及抗氧化指标的影响
Table 2 Effects of koumiss on liver immunity and antioxidant indexes in mice
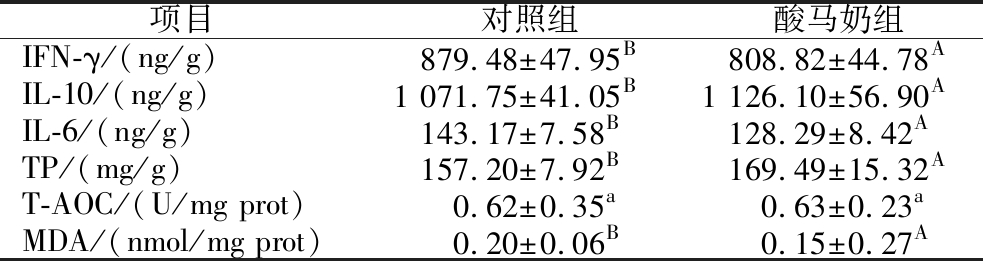
注:同行不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01)。
项目对照组酸马奶组IFN-γ/(ng/g)879.48±47.95B808.82±44.78AIL-10/(ng/g)1 071.75±41.05B1 126.10±56.90AIL-6/(ng/g)143.17±7.58B128.29±8.42ATP/(mg/g)157.20±7.92B169.49±15.32AT-AOC/(U/mg prot)0.62±0.35a0.63±0.23aMDA/(nmol/mg prot)0.20±0.06B0.15±0.27A
2.2 代谢物主成分分析
通过LC-MS分析对酸马奶组与对照组小鼠血浆进行代谢组学分析,使用PCA的方法观察2组样本之间的总体趋势,结果如图1所示。在正离子模式下,其PC1为27.76%,PC2为19.40%,PC3为8.23%;在负离子模式下,其PC1为32.46%,PC2为16.22%,PC3为11.52%。以上结果表明,酸马奶组与对照组之间产生了明显的分离现象,表明酸马奶组与对照组之间代谢物产生了明显差异。
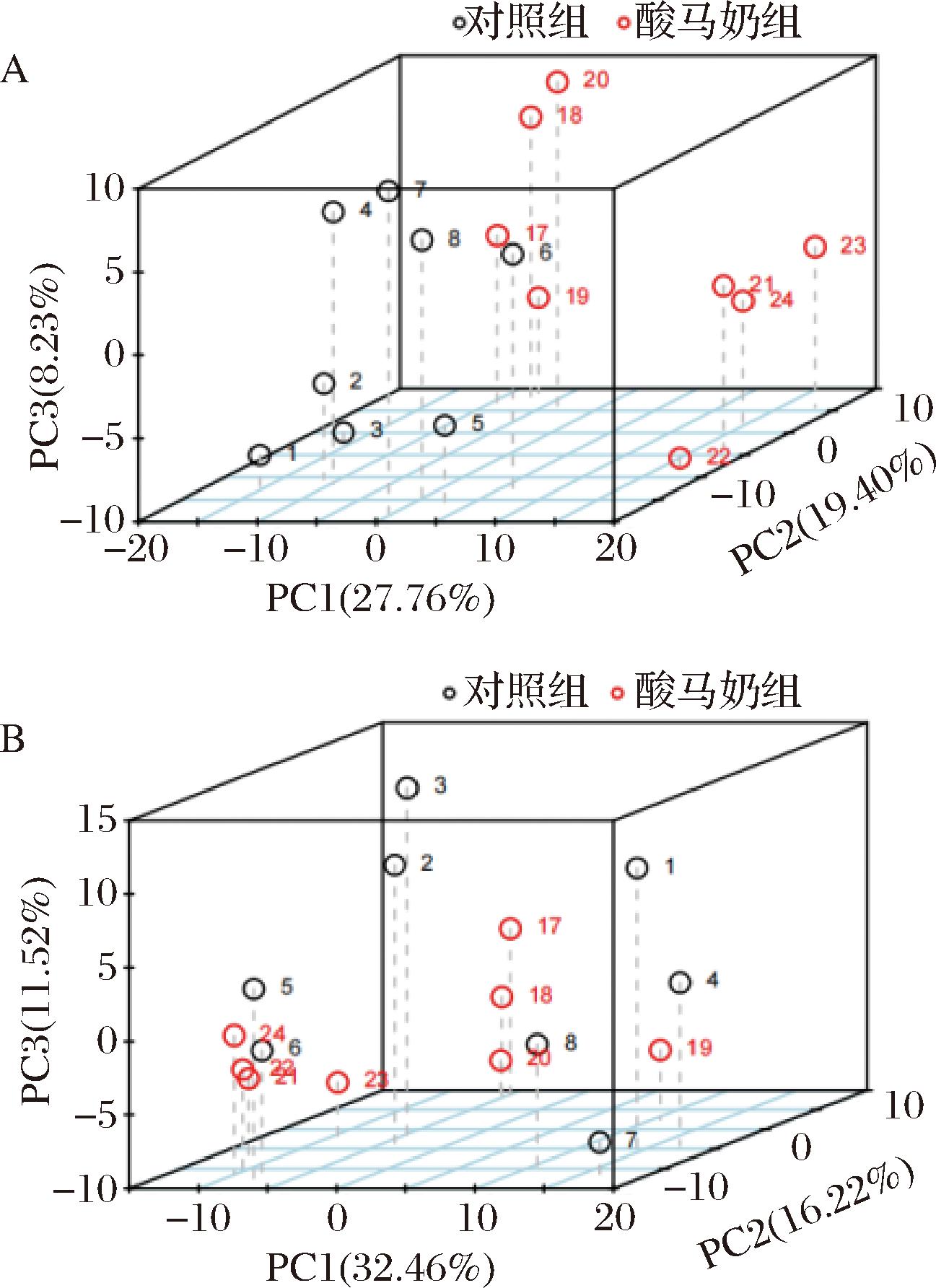
A-正离子模式;B-负离子模式
图1 代谢物主成分分析
Fig.1 Metabolite principal component analysis

A-正离子模式分析;B-负离子模式分析;C-正离子模式检验;D-负离子模式检验
图2 代谢物偏最小二乘判别法分析
Fig.2 PLS-DA of metabolites
2.3 代谢物PLS-DA
本研究采用PLS-DA来确定模型的稳定可靠性。结果如图2所示,酸马奶组和对照组之间样本能显著分离,未产生重叠现象,结果如图2所示。在正离子模式下PLS-DA得到R2Y=0.98,Q2Y=0.79(图2-A);负离子模式下PLS-DA得到R2Y=0.88,Q2Y=0.57(图2-B)。模型中R2Y均大于0.5,接近于1,表明模型稳定。为了判断模型的稳定性,继续对以上模型的R2和Q2进行置换检验(图2-C、图2-D),检验是否“过拟合”,结果显示Q2与Y轴的截距均小于0,表明拟合的模型稳定性较好,未出现“过拟合”现象。
2.4 代谢差异物筛选
本研究中共注释到833种代谢物,其中正离子模式注释到503种代谢物,负离子模式注释到330种代谢物。对于注释到的代谢物设置2种差异代谢物筛选标准:VIP>1.0且FC>1.2或FC<0.833且P<0.05,共得到152种差异代谢物,如附表1和附表2所示(https://doi.org/10.13995/j.cnki.11-1802/ts.038895)。正离子模式下共筛选出98种差异代谢物,例如L-谷氨酸、L-组氨酸、L-精氨酸等,其中与酸马奶组相比,对照组共有93种显著上调差异代谢物和5种显著下调差异代谢物;负离子模式下共筛选出54种差异代谢物,例如琥珀酸、柠檬酸、异柠檬酸等,与酸马奶组相比,对照组共有42种显著上调差异代谢物和12种显著下调差异代谢物。
2.5 代谢差异物通路富集分析
为研究差异代谢物所涉及的代谢途径,对所筛选的152种差异代谢物进行通路富集分析,结果见表3。在所富集到的通路中,共有8条通路的P值<0.1,其中正离子模式下的通路有3条,分别为赖氨酸降解、谷胱甘肽代谢和卟啉与叶绿素代谢,负离子模式下的通路有5条,分别为二羧酸代谢、柠檬酸循环、碳代谢、2-氧代羧酸代谢和氨基酸的生物合成。所有富集到的通路基本信息见表5。正负离子模式下分别选取P值由小到大的前20条通路绘制气泡图(图3)。

A-正离子模式下的气泡图;B-负离子模式下的气泡图
图3 差异代谢物代谢KEGG通路富集气泡图
Fig.3 Bubble chart of KEGG pathway enrichment of differential metabolites
表3 关键代谢通路分析
Table 3 Analysis of key metabolic pathways
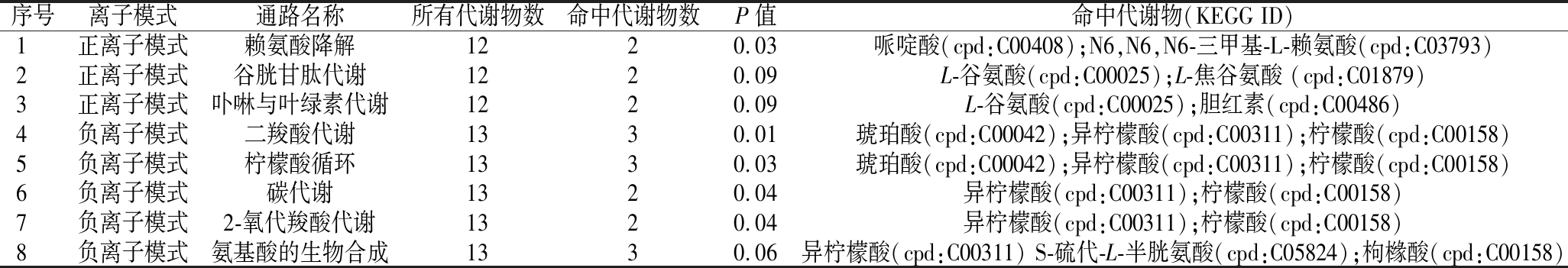
序号离子模式通路名称所有代谢物数命中代谢物数P值命中代谢物(KEGG ID)1正离子模式赖氨酸降解1220.03哌啶酸(cpd:C00408);N6,N6,N6-三甲基-L-赖氨酸(cpd:C03793)2正离子模式谷胱甘肽代谢1220.09L-谷氨酸(cpd:C00025);L-焦谷氨酸 (cpd:C01879)3正离子模式卟啉与叶绿素代谢1220.09L-谷氨酸(cpd:C00025);胆红素(cpd:C00486)4负离子模式二羧酸代谢1330.01琥珀酸(cpd:C00042);异柠檬酸(cpd:C00311);柠檬酸(cpd:C00158)5负离子模式柠檬酸循环1330.03琥珀酸(cpd:C00042);异柠檬酸(cpd:C00311);柠檬酸(cpd:C00158)6负离子模式碳代谢1320.04异柠檬酸(cpd:C00311);柠檬酸(cpd:C00158)7负离子模式2-氧代羧酸代谢1320.04异柠檬酸(cpd:C00311);柠檬酸(cpd:C00158)8负离子模式氨基酸的生物合成1330.06异柠檬酸(cpd:C00311) S-硫代-L-半胱氨酸(cpd:C05824);枸橼酸(cpd:C00158)
3 讨论
3.1 酸马奶对小鼠肝脏免疫及抗氧化指标的影响
细胞因子是与体内免疫调节相关的一种免疫因子,是由免疫细胞和一些非特异性免疫细胞产生并合成的蛋白质或小分子肽。细胞因子参与体液免疫的不同阶段,可能促进免疫细胞进一步分化成熟,在免疫反应过程中发挥一定的调节作用[12]。IFN-γ、IL-6属于促炎因子,IL-10属于炎症抑制因子和免疫抑制因子,且IL-10可抑制T细胞产生IFN-γ、IL-6产生,从而降低促炎因子的含量能够保护组织免于过度的炎症反应,发挥着免疫调节作用。结果表明,灌胃酸马奶极显著提高小鼠肝脏中的抗炎因子IL-10的含量,降低促炎因子IFN-γ、IL-6的含量,这可能与发酵后马奶中的益生菌相关,益生菌及其代谢产物不仅可以提高特异性免疫,还可以调节肠道菌群平衡[13],有研究中发现益生菌能够提高小鼠抗炎因子IL-10水平[14],酸马奶能够促进抗炎因子IL-10的分泌[15];且马奶中溶菌酶和乳铁蛋白均具有抗菌抗炎作用,乳铁蛋白还能改善淋巴细胞的功能增强免疫能力[16]。从而说明酸马奶有助于改善机体免疫调节能力,提高机体免疫力。
肝脏是动物机体内营养代谢和氧化还原反应的重要场所。过多的自由基会破坏氧化平衡,引起肝脏的过氧化损伤和功能障碍。机体可通过摄入天然的抗氧化剂,改善氧化应激对机体的影响[17]。本试验研究结果显示,灌胃酸马奶可降低小鼠MDA含量,提升T-AOC水平。MDA是膜脂质过氧化过程中最重要的产物之一,具有毒性。其产生会加剧膜损伤,引起蛋白质、核酸等高分子的交联聚合,引起细胞代谢和功能紊乱。T-AOC是测定各类抗氧化物质的抗氧化总水平,所以T-AOC水平越高,其肝脏的抗氧化能力就越强。相关研究发现马奶能调解小鼠的免疫系统[18],与本研究结果类似;马奶中富含的酪蛋白、乳清蛋白、乳铁蛋白和维生素C均具有抗氧化能力[19],马奶中乳清蛋白提取出的抗氧化肽能够降低机体MDA的含量,提高机体抗氧化能力和清除自由基的作用[20]。从而说明灌胃酸马奶能够提高小鼠抗氧化能力,可降低小鼠肝脏脂质过氧化程度,从而使机体内环境稳定。
3.2 酸马奶对小鼠血浆代谢的影响
有研究表明,胆红素能发挥免疫调节作用,减少产生IL-17的CD4+T细胞数量,提高IL-22、TNF-α、IL-6和IL-1的水平,增加表达IL-10的CD4+T细胞比例,促进Treg的再生[21],还被证实其对Th17细胞免疫反应具有抗炎作用[22]。查干其其格等[15]研究发现,酸马奶组能够促进抗炎因子IL-10的分泌,显示酸马奶对提高机体的免疫力具有一定促进作用。本研究结果表明,对比对照组与酸马奶组,对照组血浆中胆红素含量显著下降,且酸马奶组中IL-10的含量极显著上升。这与前人的研究结果相似,表明灌胃酸马奶能够提高小鼠血浆胆红素的含量,进而调节IL-10含量,从而提高了小鼠的免疫能力。另外,有研究表明血清胆红素与促炎因子IL-6呈负相关[23],本研究显示酸马奶组较对照组显著降低,这与该研究结果一致,也反映出酸马奶在提高机体免疫方面的促进作用。此外,胆红素作为一种强效的内源性抗氧化剂,可以通过清除活性氧表现出抗氧化活性[24],抑制活性氧参与炎症等过程[25],从而表现出一定的免疫性[26],这也可能是酸马奶具有免疫作用的原因之一。粪胆素作用与胆红素[27]类似,也是通过向自由基物质提供氢原子而充当抗氧化剂[28],从而表现出一定的免疫作用。本研究结果显示,酸马奶组中粪胆素显著下调,表明酸马奶对粪胆素的调节也可能是其具有免疫作用的潜在原因。另外,通路富集分析显示,胆红素显著富集到卟啉代谢途径,表明酸马奶可能是通过调节卟啉代谢途径中的胆红素来对机体免疫作用产生调节。由于胆红素代谢调控和分布涉及到机体多个方面,因此,还需要相关临床与机理性研究探索其影响机制。
在动物机体中,L-哌啶酸主要通过2种途径合成:Δ1-piperideine-6-carboxylate(P6C途径)和Δ1-piperideine-2-carboxylate(P2C途径)[29],且研究中发现L-哌啶酸会在线粒体中发生氧化,并在氧化应激过程中促进细胞存活[30]。YUAN等[31]研究发现,通过使用L-哌啶酸可显著降低结肠炎小鼠结肠及血液中的炎症因子,减轻肠道炎症情况。本研究结果显示,与酸马奶组相比,对照组哌啶酸含量下调,表明酸马奶可能通过对哌啶酸的调节达到提高免疫的效果。另外,通路富集分析结果显示,哌啶酸被显著富集到赖氨酸降解途径中。哌啶酸是赖氨酸重要的代谢产物[32],而赖氨酸作为一种必需氨基酸,需要从体外摄取。有研究表明让大鼠摄入缺乏赖氨酸的蛋白质,将会导致大鼠体重减轻抗氧化能力减弱[33],另外赖氨酸日粮对羔羊免疫功能有所提升[34],这显示出食物中赖氨酸含量较高时有利于提高机体的免疫能力。酸马奶中赖氨酸含量较高[35],这可能是其能够提高机体免疫功能的原因之一。
4 结论
本实验通过对灌喂酸马奶小鼠的免疫指标、抗氧化指标及血浆代谢物进行分析发现,灌喂酸马奶极显著提高小鼠肝脏中的抗炎因子IL-10的含量,降低促炎因子IFN-γ、IL-6的含量,增强免疫能力,还能够极显著降低小鼠MDA含量,提升T-AOC水平,增强抗氧化能力;对照组与酸马奶组的小鼠血浆中共鉴定出152种差异代谢物。差异代谢物通路富集分析得到8条关键代谢通路,这些代谢途径与卟啉代谢以及氨基酸代谢有关,表明了酸马奶对机体的免疫、抗氧化具有积极的促进作用。本研究可为酸马奶对于机体影响的潜在标志性代谢物研究提供理论依据,为马奶在功能性食品开发方面提供参考。
[1] 刘亚东, 宋秋, 霍贵成.马奶和母乳的营养成分比较分析[J].食品工业, 2012, 33(11):156-158.LIU Y D, SONG Q, HUO G C.Comparison of nutrient components in human milks and mare milk[J].The Food Industry, 2012, 33(11):156-158.
[2] 布仁巴雅尔, 赵建军, 乔晓宏.马奶营养及其保健作用[J].当代畜禽养殖业, 2023(3):43-44;47.BU R B Y E, ZHAO J J, QIAO X H.Horse milk nutrition and its health benefits[J].Modern Animal Husbandry, 2023(3):43-44;47.
[3] SALIMEI E, FANTUZ F.Equid milk for human consumption[J].International Dairy Journal, 2012, 24(2):130-142.
[4] 高茜. 传统酸马奶中乳酸菌与酵母的共生关系及其在马乳发酵中的应用[D].昆明:昆明理工大学, 2021.GAO Q.Symbiosis between lactic acid bacteria and yeast in traditional sour horse milk and its application in horse milk fermentation[D].Kunming:Kunming University of Science and Technology, 2021.
[5] 陆东林, 刘朋龙.酸马奶的营养价值和医疗保健作用[J].新疆畜牧业, 2018, 33(6):4-10.LU D L, LIU P L.Nutritional value and healthcare benefits of sour horse milk[J].Livestock husbandry in Xinjiang, 2018, 33(6):4-10.
[6] 曹恺欣, 武俊瑞, 李煜, 等.酸马奶中抗结核菌功效成分研究进展[J].中国乳品工业, 2022, 50(10):34-40.CAO K X, WU J R, LI Y, et al.Research progress on the mechanism of koumiss in treating tuberculosis[J].China Dairy Industry, 2022, 50(10):34-40.
[7] LI H B, WANG Y, ZHANG T Q, et al.Comparison of backslopping and two-stage fermentation methods for koumiss powder production based on chemical composition and nutritional properties[J].Journal of the Science of Food and Agriculture, 2020, 100(4):1822-1826.
[8] 刘秀芳. 酸马奶对慢性萎缩性胃炎患者的粪便代谢和肠道免疫影响[D].呼和浩特:内蒙古农业大学, 2020.LIU X F.Effect of koumiss on the fecal metabolism and intestinal immunity in patients with chronic atrophic gastritis[D].Hohhot:Inner Mongolia Agricultural University, 2020.
[9] REN J L, ZHANG A H, KONG L, et al.Advances in mass spectrometry-based metabolomics for investigation of metabolites[J].RSC Advances, 2018, 8(40):22335-22350.
[10] XIA Y N, YU J Q, MIAO W G, et al.A UPLC-Q-TOF-MS-based metabolomics approach for the evaluation of fermented mare’s milk to koumiss[J].Food Chemistry, 2020, 320:126619.
[11] XIA Y N, OYUNSUREN E, YANG Y, et al.Comparative metabolomics and microbial communities associated network analysis of black and white horse-sourced koumiss[J].Food Chemistry, 2022, 370:130996.
[12] 王宇, 王涵, 齐雅清, 等.蓝刺头黄酮对小鼠血清免疫指标和抗氧化指标的影响[J].饲料研究, 2023, 46(20):89-92.WANG Y, WANG H, QI Y Q, et al.Effect of Echinops latifolius Tausch flavonoids on serum immune and antioxidant indexes in mice[J].Feed Research, 2023, 46(20):89-92.
[13] HOU Q C, LI C K, LIU Y H, et al.Koumiss consumption modulates gut microbiota, increases plasma high density cholesterol, decreases immunoglobulin G and albumin[J].Journal of Functional Foods, 2019, 52:469-478.
[14] DI GIACINTO C, MARINARO M, SANCHEZ M, et al.Probiotics ameliorate recurrent Th1-mediated murine colitis by inducing IL-10 and IL-10-dependent TGF-β-bearing regulatory cells[J].Journal of Immunology, 2005, 174(6):3237-3246.
[15] 查干其其格, 锡林其其格, 文娟, 等.马奶和酸马奶来源外秘体的分离及其对RAW264.7细胞细胞因子的作用[J].临床和实验医学杂志, 2017, 16(24):2397-2402.CHA G Q Q G, XI L Q Q G, WEN J, et al.Isolation of mare’s milk &koumiss-derived exosomes and its effect on cytokines of RAW264.7[J].Journal of Clinical and Experimental Medicine, 2017, 16(24):2397-2402.
[16] HABIB H M, IBRAHIM W H, SCHNEIDER-STOCK R, et al.Camel milk lactoferrin reduces the proliferation of colorectal cancer cells and exerts antioxidant and DNA damage inhibitory activities[J].Food Chemistry, 2013, 141(1):148-152.
[17] LIMA C F, ANDRADE P B, SEABRA R M, et al.The drinking of a Salvia officinalis infusion improves liver antioxidant status in mice and rats[J].Journal of Ethnopharmacology, 2005, 97(2):383-389.
[18] LI N, XIE Q G, CHEN Q X, et al.Cow, goat, and mare milk diets differentially modulated the immune system and gut microbiota of mice colonized by healthy infant feces[J].Journal of Agricultural and Food Chemistry, 2020, 68(51):15345-15357.
[19] KHAN M Z, XIAO J X, MA Y L, et al.Research development on anti-microbial and antioxidant properties of camel milk and its role as an anti-cancer and anti-hepatitis agent[J].Antioxidants, 2021, 10(5):788.
[20] WAILI Y, GAHAFU Y, AOBULITALIFU A, et al.Isolation, purification, and characterization of antioxidant peptides from fresh mare’s milk[J].Food Science &Nutrition, 2021, 9(7):4018-4027.
[21] ROCUTS F, ZHANG X Y, YAN J, et al.Bilirubin promotes de novo generation of T regulatory cells[J].Cell Transplantation, 2010, 19(4):443-451.
[22] LONGHI M S, VUERICH M, KALBASI A, et al.Bilirubin suppresses Th17 immunity in colitis by upregulating CD39[J].JCI Insight, 2017, 2(9):e92791.
[23] YOSHINO S, HAMASAKI S, ISHIDA S, et al.Relationship between bilirubin concentration, coronary endothelial function, and inflammatory stress in overweight patients[J].Journal of Atherosclerosis and Thrombosis, 2011, 18(5):403-412.
[24] TOMARO M L, BATLLE A M D C.Bilirubin:Its role in cytoprotection against oxidative stress[J].The International Journal of Biochemistry &Cell Biology, 2002, 34(3):216-220.
[25] BATTY M, BENNETT M R, YU E.The role of oxidative stress in atherosclerosis[J].Cells, 2022, 11(23):3843.
[26] INOGUCHI T, SONODA N, MAEDA Y.Bilirubin as an important physiological modulator of oxidative stress and chronic inflammation in metabolic syndrome and diabetes:A new aspect on old molecule[J].Diabetology International, 2016, 7(4):338-341.
[27] NAKAMURA T, SATO K, AKIBA M, et al.Urobilinogen, as a bile pigment metabolite, has an antioxidant function[J].Journal of Oleo Science, 2006, 55(4):191-197.
[28] MÖLZER C, HUBER H, STEYRER A, et al.In vitro antioxidant capacity and antigenotoxic properties of protoporphyrin and structurally related tetrapyrroles[J].Free Radical Research, 2012, 46(11):1369-1377.
[29] FUJII T, ARITOKU Y, AGEMATU H, et al.Increase in the rate of L-pipecolic acid production using lat-expressing Escherichia coli by lysP and yeiE amplification[J].Bioscience, Biotechnology, and Biochemistry, 2002, 66(9):1981-1984.
[30] NATARAJAN S K, MUTHUKRISHNAN E, KHALIMONCHUK O, et al.Evidence for pipecolate oxidase in mediating protection against hydrogen peroxide stress[J].Journal of Cellular Biochemistry, 2017, 118(7):1678-1688.
[31] YUAN X M, CHEN B Q, DUAN Z L, et al.Depression and anxiety in patients with active ulcerative colitis:Crosstalk of gut microbiota, metabolomics and proteomics[J].Gut Microbes, 2021, 13(1):1987779.
[32] CHANG F M.Update current understanding of neurometabolic disorders related to lysine metabolism[J].Epilepsy &Behavior, 2023, 146:109363.
[33] YAMASHITA K, ASHIDA K.Lysine metabolism in rats fed lysine-free diet[J].The Journal of Nutrition, 1969, 99(3):267-273.
[34] GEBEYEW K, YANG C, HE Z X, et al.Low-protein diets supplemented with methionine and lysine alter the gut microbiota composition and improve the immune status of growing lambs[J].Applied Microbiology and Biotechnology, 2021, 105(21-22):8393-8410.
[35] TEICHERT J, ![]() D, BIELSKA P, et al.Milk fermentation affects amino acid and fatty acid profile of mare milk from Polish Coldblood mares[J].International Dairy Journal, 2021, 121:105137.
D, BIELSKA P, et al.Milk fermentation affects amino acid and fatty acid profile of mare milk from Polish Coldblood mares[J].International Dairy Journal, 2021, 121:105137.