柠檬苦素也被称为黄柏内酯或吴茱萸内酯,是主要存在于芸香科(Rutaceae)及楝科(Meliaceae Juss.)等植物中的天然四环三萜化合物,具有多种生理活性,如抗氧化、抗肿瘤、抗肥胖、抗病毒和消炎镇痛等[1]。但柠檬苦素的结构稳定性差,易受环境因素影响而发生不同程度的降解,随着环境温度升高(20~40 ℃),柠檬苦素部分发生降解,当温度超过60 ℃时,其结构稳定性显著降低,降解率增大;此外,柠檬苦素在太阳光照和室内光照下均会发生降解,并且太阳光照下的降解程度远大于室内光照下的降解程度,光照及空气接触时间越长其稳定性越差等,从而限制了柠檬苦素的广泛应用[2]。随着研究的不断深入,构建负载柠檬苦素体系可以有效改善其结构稳定性差的问题,如微胶囊负载体系[3]、脂质负载体系[4]、乳液负载体系[5]和水凝胶负载体系[6]等,而蛋白质作为天然生物大分子,本身具有安全性和生物相容性等特点,在构建负载天然活性成分体系上具有得天独厚的优势。但目前关于蛋白基负载柠檬苦素体系的研究报道相对较少,BAUTISTA等[7]以玉米醇溶蛋白-海藻酸钠复合物为乳液稳定剂,制备了负载柠檬苦素的纳米乳液微粒,该纳米乳液在环境温度(27.4 ℃)和冷藏条件(4 ℃)下贮存100 d后,柠檬苦素的保留率仅小幅度降低等。
乳清蛋白(whey protein, WP)是牛乳中存在的一类优质蛋白,具有诸多出色的功能特性,可以作为食品稳定剂、乳化剂以及疏水活性成分的负载基质等[8]。玉米醇溶蛋白(zein)因其结构中亲疏水性氨基酸含量不均匀,不能有效地吸附在油水界面上,玉米醇溶蛋白与其他蛋白结合能调节其表面的湿润性和电荷,提高玉米醇溶蛋白颗粒在乳液中的稳定性和分散性[9],付思晗等[10]发现玉米醇溶蛋白与乳清蛋白纤维核发生复合后,其乳化性显著提高等。研究表明,与单一蛋白乳液相比,双蛋白复合物乳液作为负载天然活性物质体系时,在结构稳定性和抵抗环境压力方面更具优势,而复合蛋白乳液相对于单一蛋白乳液也更适用于天然活性物质在人体消化道内的释放和吸收等[11-13]。通常将分散相体积≥74%的乳液称为高内相乳液,高内相乳液在物理和化学方面表现出了优越的稳定性,因此其在食品、石油、生命科学和化妆品等许多领域上有非常广阔的应用前景[14-16]。而高内相乳液在食品中的一个广泛应用是负载和传递天然活性成分,而天然活性物质经高内相乳液负载后,可以有效避免其在光照或高温等环境下发生过度降解[16],吴滋灵[17]以玉米醇溶蛋白-果胶复合纳米颗粒为高内相乳液的稳定剂,制备了负载姜黄素的高内相乳液,高内相乳液负载体系显著提高了姜黄素的抗紫外辐照能力等。目前关于双蛋白复合物高内相乳液的研究报道相对较少,WANG等[18]采用pH循环法制备核桃蛋白-大米蛋白复合纳米颗粒,并用双蛋白复合纳米颗粒来稳定高内相乳液,发现该双蛋白高内相乳液具有良好的热稳定性和贮藏稳定性等。pH循环法是制备双蛋白纳米颗粒的常用方法之一,WEI等[19]通过该法制备了乳清分离蛋白-玉米醇溶蛋白复合纳米颗粒,发现该双蛋白纳米颗粒具有良好的物理稳定性,但是低水平的乳清分离蛋白不能平衡高水平的玉米醇溶蛋白等。
因此,本研究先基于pH循环法制备乳清蛋白-玉米醇溶蛋白复合纳米颗粒,再以双蛋白复合纳米颗粒为高内相乳液的稳定剂,制备负载柠檬苦素的双蛋白高内相乳液,并对该高内相乳液进行表征,最后探究光照处理和热处理下,双蛋白复合物高内相乳液负载体系对柠檬苦素结构稳定性的影响,以期为进一步应用和开发柠檬苦素提供实验基础。
1 材料与方法
1.1 材料与试剂
柠檬苦素(≥98%)、乳清蛋白(≥80%)、玉米醇溶蛋白(BR,92%),上海源叶生物科技有限公司;氢氧化钠(AR)、1,2-丙二醇(AR)、甲醇(色谱级)、尼罗红(≥98%)、大豆油(生物试剂),上海麦克林生化科技股份有限公司;浓盐酸(AR),西陇科学股份有限公司。
1.2 仪器与设备
DF-101S型恒温加热磁力搅拌器,郑州长城科工贸有限公司;LC-pH-3 W型台式pH计,上海力辰科技有限公司;T25型高速剪切机,德国IKA公司;LC-20AT型高效液相色谱仪,日本岛津公司;Nano ZS90型纳米粒度电位仪,英国马尔文公司;Bettersise2600型激光粒度分布仪,辽宁丹东百特科技有限公司;MARS Ⅲ型哈克流变仪,德国哈克公司;Olympus FV10i型智能激光扫描共聚焦显微镜,日本OLYMPUS公司。
1.3 实验方法
1.3.1 双蛋白复合纳米颗粒的制备
参考WEI等[19]方法并稍加改进,准确称取不同量(1.9、1.8、1.7、1.6、1.5、1.4 g)的乳清蛋白溶于100 mL去离子水中,磁力搅拌2.0 h使其充分溶解;然后使用4 mol/L NaOH调节乳清蛋白溶液至pH=12.0,平衡10 min后,再加入不同量(0.1、0.2、0.3、0.4、0.5、0.6 g)的玉米醇溶蛋白,得到最终蛋白浓度为20 g/L的混合液。混合液继续搅拌2.0 h后,在连续搅拌下使用1 mol/L HCl将其pH调节至7.0,最后再以7 200 r/min离心30 min除去不溶物,上层液即为乳清蛋白-玉米醇溶蛋白复合物溶液,将该双蛋白复合物溶液置于4 ℃冰箱中保存备用。
1.3.2 制备负载柠檬苦素的双蛋白复合物乳液
首先准确称取一定质量的柠檬苦素粉末置于棕色玻璃瓶中,并加入适量大豆油,磁力搅拌2.0 h使其充分溶解,最终得到柠檬苦素含量为250 mg/L的大豆油作为油相;双蛋白复合物溶液作为水相;以贮藏稳定性(4 ℃冰箱保存72 h)为主要参考依据,确定负载柠檬苦素的双蛋白乳液的油相体积分数(Φ),即将水相和油相按不同体积分数混合,再通过高速剪切机以12 000 r/min剪切3 min得到负载柠檬苦素的双蛋白乳液,其中Φ值分别为20%、30%、40%、50%、60%、70%、75%和80%。
1.3.3 粒径及Zeta电位测定
用去离子水将乳清蛋白-玉米醇溶蛋白复合物溶液稀释100倍后,利用纳米粒度电位仪测定复合蛋白颗粒的平均粒径、多分散系数(polydispersity index,PDI)及其Zeta电位,测定前平衡时间为120 s;双蛋白乳液采用激光粒度分布仪测定其乳滴粒径,使用体积平均直径D(4,3)和表面积平均直径D(3,2)来表示,颗粒吸收率为0.000 1,折光率控制在8%~15%,大豆油和去离子水的折射率分别设定为1.470和1.330,仪器自动测量3次。
1.3.4 激光共聚焦显微镜观察乳液微观结构
取1 mL乳液样品加入40 μL染料,混合均匀并避光染色1.0 h,染料为0.1%的尼罗红溶液,染料溶剂为1,2-丙二醇,染色结束后通过智能激光扫描共聚焦显微镜观察其乳液微观结构,其中目镜放大10倍,物镜(油镜)放大60倍,扫描像素为1 024×1 024,乳液的油相荧光信号显示颜色设置为绿色[20]。
1.3.5 流变学特性测定
在25 ℃下使用MARS Ⅲ型哈克流变仪对乳液的流变特性进行表征。平行板直径为25 mm,间隙1.0 mm,选用旋转连续扫描模式,测定乳液的表观剪切黏度(η)随着剪切速率的变化,剪切速率为0.1~100 s-1;选用振幅频率扫描模式,测定乳液的弹性模量(G′)和黏性模量(G″)随着频率的变化,扫描频率范围设定为0.1~10 Hz,应力固定在1 Pa。
1.3.6 柠檬苦素包埋率测定
准确称取一定量的柠檬苦素溶于甲醇中,超声充分溶解后制得200 mg/L的母液,将母液稀释成5、10、20、50、100 mg/L系列溶液,采用高效液相色谱法绘制柠檬苦素标准曲线[21],色谱条件为C18分析柱(2.1 mm×100 mm, 1.7 μm),流动相V(水)∶V(乙腈)=45∶55,等度洗脱。流速设置成0.3 mL/min,进样量:10 μL;柱温30 ℃,检测波长210 nm,根据峰面积及浓度关系得到柠檬苦素标准曲线为Y=6 353.6X+1 752.6,R2=0.999 9。
柠檬苦素包埋率测定方法参考文献[22]并稍加改进,具体操作为:取适量乳液于3 000 r/min条件下离心5 min,离心后上层是负载柠檬苦素的乳液,下层是受重力作用沉降出来的未被包埋进乳液的柠檬苦素,然后取1 mL上层乳液,加入5 mL甲醇,进行漩涡振荡及超声破乳,将乳液中的柠檬苦素提取出来,最后再次进行离心,取离心上清液过0.22 μm滤膜并测定甲醇中的柠檬苦素含量,包埋率的计算如公式(1)所示:
(1)
式中:EE为包埋率,%;C0为制备乳液时的柠檬苦素总加入含量(mg/L);C1为新鲜乳液中的柠檬苦素含量(mg/L)。
1.3.7 热处理对乳液稳定性的影响
将制备好的新鲜乳液装进棕色玻璃瓶中,再置于70 ℃下水浴处理30 min,加热结束后立即放入冰水浴中冷却至室温,先按照1.3.5节方法观察其微观结构,再测定热处理后柠檬苦素的含量,计算柠檬苦素保留率,柠檬苦素保留率的计算如公式(2)所示:
(2)
式中:R为保留率,%;C2为乳液热处理后的柠檬苦素含量(mg/L)。
1.3.8 光照处理对乳液稳定性的影响
将制备好的新鲜乳液装入透明玻璃瓶,再置于室外下光照8 h,光照结束后观察其乳液微观结构并测定柠檬苦素保留率。
1.3.9 乳液贮藏稳定性
将制备好的新鲜乳液装入棕色玻璃瓶,再置于4 ℃冰箱中贮藏21 d,贮藏结束后观察其乳液微观结构并测定柠檬苦素保留率。
1.4 数据处理与分析
利用Excel 2016软件进行数据统计分析;利用SPSS Statistics 26软件进行单因素方差分析(ANOVA),然后进行显著性检验,P<0.05认为具有显著性差异;利用Origin 2021等软件进行图表绘制。
2 结果与分析
2.1 双蛋白复合纳米粒的平均粒径和Zeta分析
由表1可知,随着玉米醇溶蛋白的质量增加,双蛋白复合物的平均粒径呈现先显著降低再显著增大的趋势,即双蛋白复合纳米粒的平均粒径先从(173.80±1.41) nm降低至(137.77±1.29) nm,再增加至(145.33±1.27) nm,而呈现这种变化规律的主要原因有两方面,一是乳清蛋白与少量的玉米醇溶蛋白发生相互作用后,可以形成更紧凑的核壳结构,促使双蛋白复合物纳米颗粒的平均粒径显著降低;二是中性环境下的玉米醇溶蛋白稳定性差,容易形成聚集物,低水平的乳清蛋白不能稳定高水平的玉米醇溶蛋白颗粒,玉米醇溶蛋白比例越高,越容易生成聚集物,导致双蛋白复合物纳米颗粒的平均粒径显著增加,这与WEI等[19]研究结论一致。
表1 双蛋白复合纳米粒的平均粒径、PDI及Zeta电位
Table 1 The average particle size, PDI, and Zeta potential of the double-protein composite nanoparticles
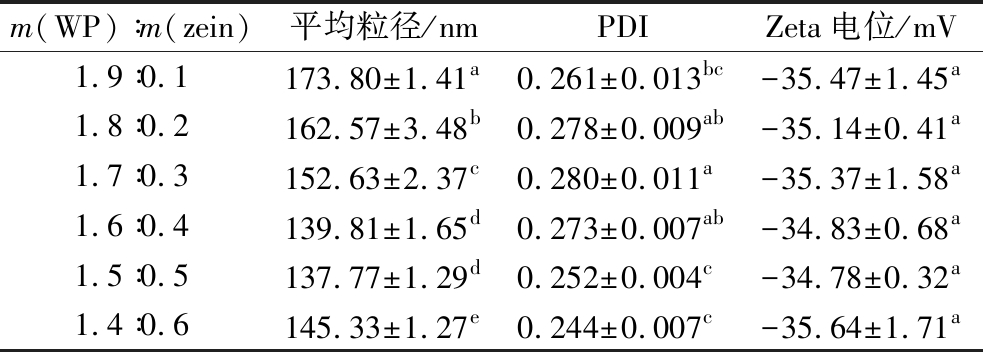
注:同一列上标字母不同表示差异显著(P<0.05)(下同)。
m(WP)∶m(zein)平均粒径/nmPDIZeta电位/mV1.9∶0.1173.80±1.41a0.261±0.013bc-35.47±1.45a1.8∶0.2162.57±3.48b0.278±0.009ab-35.14±0.41a1.7∶0.3152.63±2.37c0.280±0.011a-35.37±1.58a1.6∶0.4139.81±1.65d0.273±0.007ab-34.83±0.68a1.5∶0.5137.77±1.29d0.252±0.004c-34.78±0.32a1.4∶0.6145.33±1.27e0.244±0.007c-35.64±1.71a
研究表明,PDI值越小,说明粒径分布范围越窄,即体系中粒子的粒径具有较好的规整度,当颗粒的PDI值<0.5时,该颗粒在溶液中具有较好的分散性和稳定性[23-24]。由表1可知,不同质量比的双蛋白复合纳米颗粒的PDI值均小于0.3,说明不同质量比的双蛋白复合纳米颗粒溶液稳定性及分散性良好。此外,不同质量比的双蛋白复合纳米颗粒的Zeta电位值均稳定在-35 mV左右,并未出现显著变化,这与WEI等[19]研究结论一致,而Zeta电位绝对值越大,静电排斥作用越强,颗粒对聚集的抵抗力越大,表明该体系的溶液稳定性越好。
2.2 确定负载柠檬苦素的双蛋白乳液Φ值
由图1可知,当Φ值为20%~70%时,随着Φ值的增大,可被分散的油相增加,负载柠檬苦素的乳液乳化层相应增高,分层现象越来越不明显,这是由于乳液桥联絮凝的特性,乳液在放置一段时间后会发生分层,形成均一外观的乳液需要进一步提高其Φ值;当Φ值增加至75%时,乳液呈现均一黏稠的奶油状,乳液并未发生分层破乳现象;但进一步增加Φ值至80%时,乳液发生了明显破乳分层现象,说明该浓度下的双蛋白复合颗粒不足以完全覆盖油滴,类似的规律现象同样发生在花生蛋白-多糖复合颗粒稳定的乳液上[25]。此外,在核桃蛋白-大米蛋白复合纳米颗粒稳定的高内相乳液(Φ值=75%)研究中,也发现了该双蛋白复合物稳定的高内相乳液外观呈现均一黏稠的奶油状乳液[26],所以,固定Φ值为75%以进行后续实验。

图1 不同Φ值的双蛋白乳液贮藏稳定性
Fig.1 Storage stability of double protein emulsion with different Φ values
2.3 负载柠檬苦素的双蛋白高内相乳液粒径分析
D(3,2)反映了乳液的乳化能力,D(4,3)则反映了乳液的乳化稳定性,其值越小,说明性能越好[27]。由表2可知,负载柠檬苦素的双蛋白高内相乳液粒径均属于微米级,并且随着玉米醇溶蛋白质量的增加,该高内相乳液的粒径呈现先显著降低再显著增大的趋势,即D(3,2)从(25.01±0.93) μm显著降低至(13.55±2.02) μm,再显著增大至(17.01±0.98) μm,D(4,3)从(161.77±3.71) μm显著降低至(136.13±0.93) μm,再显著增大至(141.37±1.51) μm,说明高内相乳液粒径变化趋势和双蛋白纳米颗粒平均粒径变化趋势一样,双蛋白纳米颗粒平均粒径越小,其颗粒表面积也越小,和油相混合后,经高速剪切形成的乳液粒径也越小。
表2 负载柠檬苦素的双蛋白高内相乳液的D(3,2)值和D(4,3)值
Table 4 D(3,2) and D(4,3) values of limonin-loaded double-protein high intrinsic emulsion
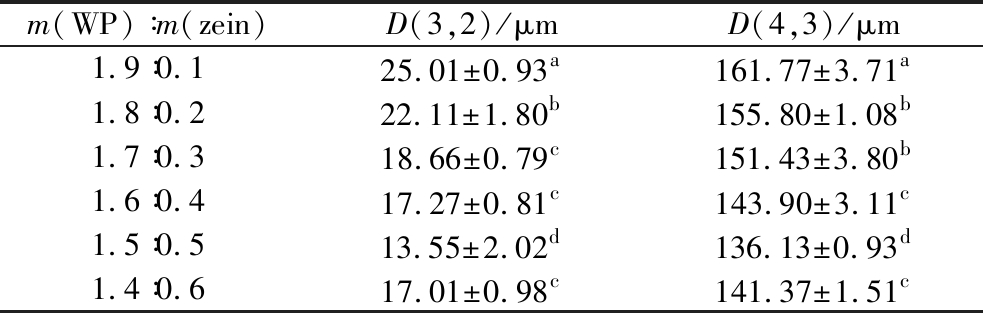
m(WP)∶m(zein)D(3,2)/μmD(4,3)/μm1.9∶0.125.01±0.93a161.77±3.71a1.8∶0.222.11±1.80b155.80±1.08b1.7∶0.318.66±0.79c151.43±3.80b1.6∶0.417.27±0.81c143.90±3.11c1.5∶0.513.55±2.02d136.13±0.93d1.4∶0.617.01±0.98c141.37±1.51c
2.4 负载柠檬苦素的双蛋白高内相乳液激光共聚焦观察分析
激光共聚焦显微镜能够清楚地观察到乳液的微观结构,负载柠檬苦素的双蛋白高内相乳液经激光扫描共聚焦显微镜观察结果如图2所示,该高内相乳液以紧密相连的球形紧密堆积,随着玉米醇溶蛋白质量的增加,其球形液滴大小尺寸逐渐减小,球形液滴大小尺寸趋于均一,球形液滴更加分散,与乳液的D(3,2)、D(4,3)的变化趋势一致,并且所有乳液均未观察到破乳现象,说明负载柠檬苦素的双蛋白高内相乳液制备成功。该高内相乳液在激光共聚焦显微镜观察下,发现由大小不一的液滴组成,可能是因为制备乳液方法所致,一步法和两步法是制备高内相乳液的常用方法,其中一步法操作比较简便,耗能较少,但是容易照成高速剪切乳液不均匀,难以形成统一液滴大小的乳液[16]。

A-m(WP)∶m(zein)=1.9∶0.1;B-m(WP)∶m(zein)=1.8∶0.2;C-m(WP)∶m(zein)=1.7∶0.3;D-m(WP)∶m(zein)=1.6∶0.4;E-m(WP)∶m(zein)=1.5∶0.5;F-m(WP)∶m(zein)=1.4∶0.6
图2 负载柠檬苦素的双蛋白高内相乳液激光共聚焦
Fig.2 Laser confocal diagram of a double-protein high intrinsic emulsion loaded with limonin
2.5 负载柠檬苦素的双蛋白高内相乳液流变特性分析
由图3-A可知,随着剪切速率的增加,负载柠檬苦素的不同质量比双蛋白高内相乳液的表观剪切黏度(η)均逐渐降低,表明本实验中的所有高内相乳液均表现出剪切稀化的假塑性流动行为,产生这种行为是因为高剪切速率下油滴会聚集絮凝,导致聚集致密的乳液发生变形,从而使得乳液稀化。随着玉米醇溶蛋白质量的增加,其乳液表观黏度逐渐减小,可能与乳液粒径及其液滴大小变化趋势有关,粒径逐渐变小,液滴逐渐趋于均一,流动阻力减小,使得表观剪切黏度减小。

A-η变化;B-G′和G″变化
图3 负载柠檬苦素的双蛋白高内相乳液流变学特性
Fig.3 Rheological properties of limonin-loaded double-protein high intrinsic emulsion
由图3-B可知,负载柠檬苦素的不同质量比双蛋白高内相乳液的G′和G″随着频率的升高而升高,并且G′均大于G″(G′在G″的上方),G′和G″之间没有交叉,表明本实验中的所有高内相乳液都表现出以凝胶态为主的的流变性,即本实验中的所有高内相乳液都形成了以弹性为主的凝胶状网络结构。此外,随着玉米醇溶蛋白质量的增加,其乳液的G′和G″都表现出减小的趋势,表明乳液的凝胶状网络结构越疏松,反之,随着乳清蛋白比重的增加,其乳液的G′和G″都表现出增加的趋势。在绿豆蛋白-乳清蛋白双蛋白纳米颗粒稳定的乳液研究中,也发现了随着乳清蛋白比重的增加,其复合蛋白乳液的G′也表现出增加的变化趋势[28],可能是由于乳清蛋白结构本身弹性较好,使得其他蛋白再与乳清蛋白发生结合后,所稳定的复合蛋白乳液弹性模量也随着增加所致[29]。
2.6 柠檬苦素包埋率分析
由图4可知,随着玉米醇溶蛋白质量的增加,其乳液包埋柠檬苦素的效率也随之增加,并且所有包埋率均超过86%,包埋率依次分别为(86.60±0.72)%、(89.54±0.45)%、(91.46±1.05)%、(92.91±0.65)%、(93.79±0.78)%和(92.56±0.99)%。所有乳液中的柠檬苦素包埋率均低于100%,主要是柠檬苦素结构稳定性易受环境(温度、室内光照、与空气接触时间等)因素影响而发生不同程度的降解,导致柠檬苦素在乳液制备过程中出现部分损失;而柠檬苦素的包埋率随着玉米醇溶蛋白质量的增加而增加,可能有两方面原因,一是制备乳液时,部分柠檬苦素附着在球形液滴表面,未被完全包埋在球形液滴里面,经过离心后沉淀在离心管底部,导致包埋率降低;二是乳液离心过程中,液滴会因为重力原因发生变形或使液滴更加紧凑,液滴发生变形容易导致被完全包埋的柠檬苦素游离至液滴表面,液滴越小越均一,离心后液滴越不容易发生变形,所以柠檬苦素包埋率变化趋势与乳液粒径大小及其液滴大小趋势一致。隋心等[30]在研究负载三萜化合物藜麦皂苷的荞麦蛋白基高内相乳液时,也发现了其乳液粒径越小,藜麦皂苷包埋率越高的规律。
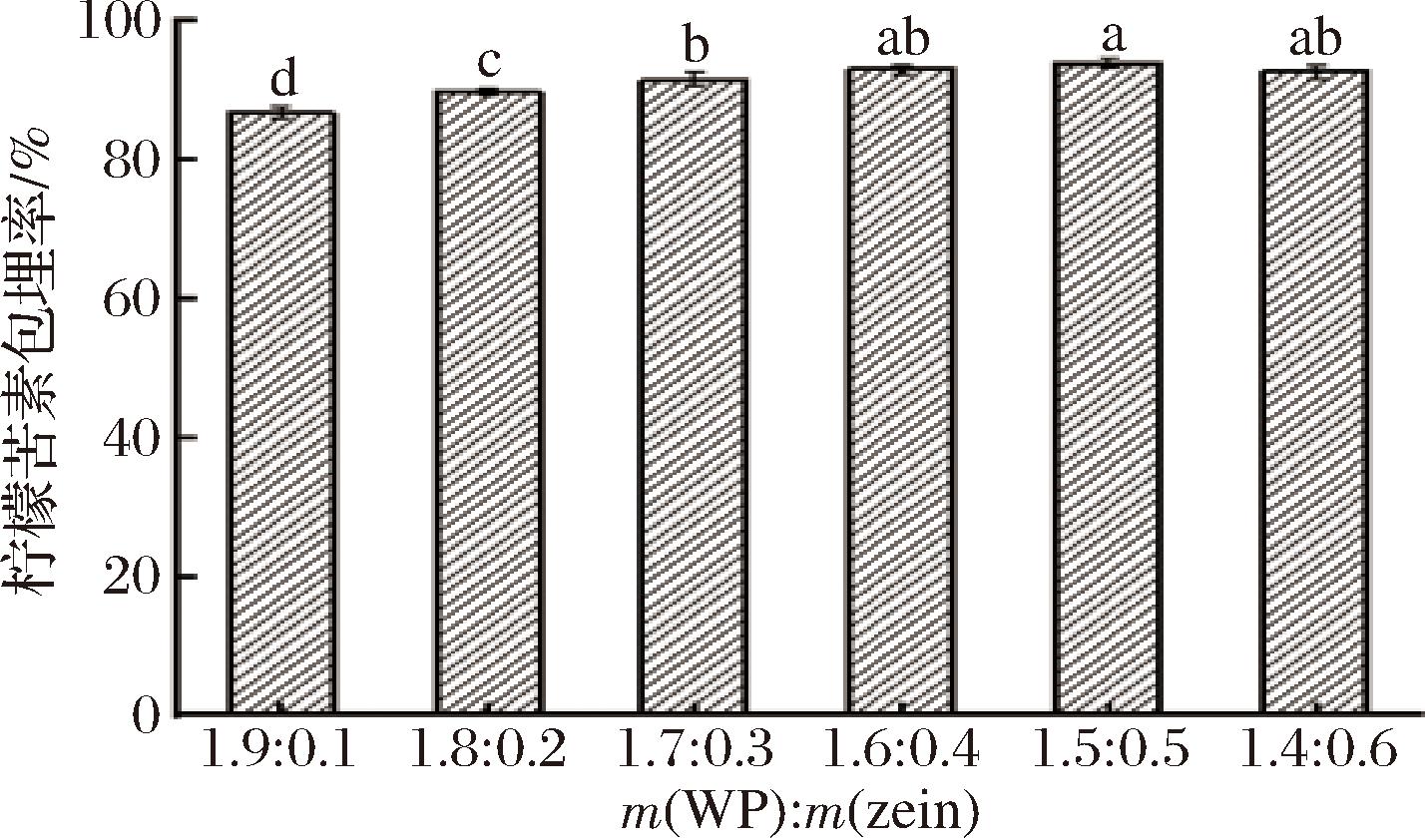
图4 柠檬苦素包埋率
Fig.4 Embedding efficiency of limonin
注:不同的字母表示具有显著差异(P<0.05)(下同)。
2.7 热稳定性分析
乳液经过热处理后,所有乳液均未出现破乳现象,其微观结构变化结果如图5-A所示,热处理后的乳液液滴基本保持球形,但是乳液液滴尺寸变大,一小部分液滴发生聚集(如图5-A红色方框所示),可能是因为热处理导致液滴相对运动更加剧烈,增加了液滴之间碰撞的机会,液滴发生聚集所致,但并未发生破乳分层现象,荞麦蛋白基高内相乳液经过热处理后也出现相类似的情况[22]。
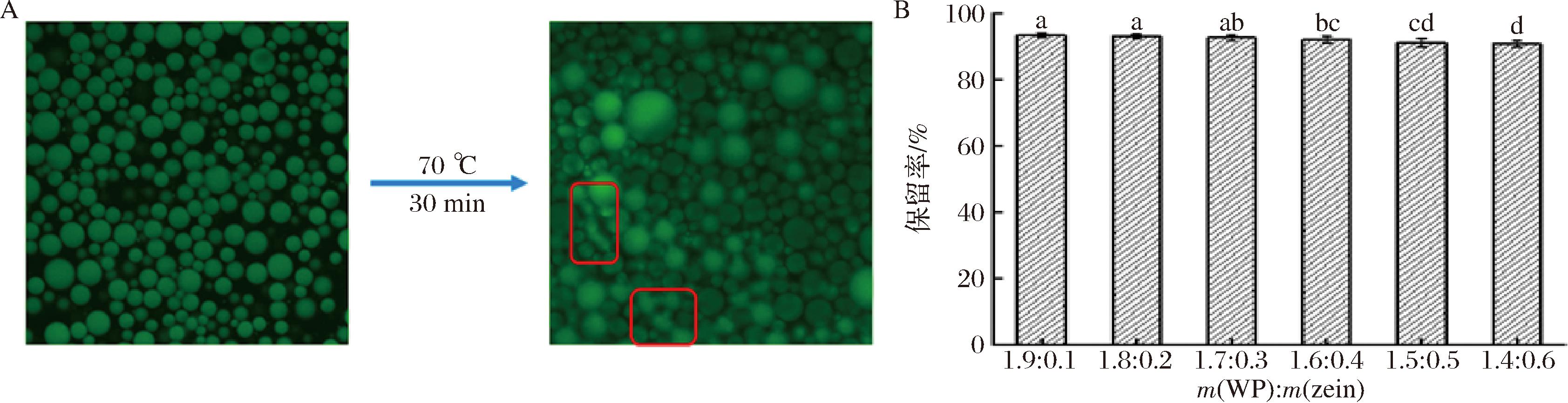
A-乳液热处理后的微观变化;B-柠檬苦素保留率
图5 乳液热处理后的微观变化及柠檬苦素保留率
Fig.5 Microscopic changes of emulsion after heat treatment and retention rate of limonin
研究表明,柠檬苦素结构稳定性对温度变化非常敏感,将柠檬苦素溶液置于70 ℃环境下存放3.0 h后,其降解率可达27%左右[2]。由图5-B可知,经双蛋白高内相乳液包埋后,热处理(70 ℃水浴处理30 min)下的柠檬苦素保留率均大于90%,降解率均不超过10%,但随着玉米醇溶蛋白质量的增加,柠檬苦素保留率显著降低,其保留率依次为(93.46±0.68)%、(93.01±0.54)%、(92.58±0.74)%、(91.97±0.90)%、(91.14±1.35)%和(90.71±1.04)%。一方面高内相乳液没有完全隔绝热传导的能力,高温处理下,柠檬苦素依旧会发生部分降解;另一方面,由前面结论可知,随着玉米醇溶蛋白质量的增加,其高内相乳液的粒径越小,相同热处理条件下,液滴粒径越小其相对运动越快越频繁,柠檬苦素游离至液滴表面的机会越大,离心后沉淀至离心管底部的柠檬苦素越多,导致包埋率显著降低。张亚杰等[3]发现柚皮苷/柠檬苦素混合物微胶囊化后,柚皮苷/柠檬苦素热稳定性显著增加,该微胶囊粉末于90 ℃环境下存放12 h后,柚皮苷/柠檬苦素的保留率依旧还有86.7%。综上所述,构建负载柠檬苦素的体系可以有效改善其结构热不稳定性,而相较于微胶囊负载技术,一步法制备负载柠檬苦素的蛋白基高内相乳液具有载体安全性高、操作简单和成本低等优势。
2.8 光照稳定性分析
研究表明,柠檬苦素光照稳定性差,室外室内光照下均会发生不同程度的降解,柠檬苦素溶液置于室外光照8 h后,其保留率低于50%等[2]。由图6-A可知,经过室外光照处理后,球形液滴均完整,未观察到聚结、破乳现象,仅有少部分液滴尺寸变大,可能是光照射下,乳液的温度升高,液滴相对运动加快,部分小液滴相互碰撞形成更大尺寸的液滴,表明该乳液具有良好的光照稳定性。

A-乳液光照处理后的微观变化;B-柠檬苦素保留率
图6 乳液光照处理后的微观变化及柠檬苦素保留率
Fig.6 Microscopic changes of emulsion after light treatment and retention rate of limonin
由图6-B可知,经室外光照处理后,柠檬苦素保留率均大于72%,但随着玉米醇溶蛋白质量增加,柠檬苦素保留率显著降低,依次为(76.47±0.95)%、(75.42±0.70)%、(75.22±0.81)%、(73.97±1.15)%、(73.53±0.51)%和(72.21±0.80)%。究其原因,可能与乳液流变特性有关,乳液的凝胶状网络结构越紧密,阻碍阳光直接照射到柠檬苦素上的能力越强,而随着玉米醇溶蛋白质量的增加,其乳液的凝胶状网络结构越疏松,阻碍光直接照射到柠檬苦素上的能力越弱,所以柠檬苦素保留率显著性降低。此外,高内相乳液保护天然活性成分的效果还与液滴大小尺寸及粒径大小有关,乳液液滴尺寸越大,粒径越大,将照射光线的分散能力越强,保护效果越强,而随着玉米醇溶蛋白质量的增加,乳液液滴大小尺寸逐渐变小,粒径逐渐变小,导致柠檬苦素保留率显著降低。所以,构建负载柠檬苦素的高内相乳液体系可以有效改善其结构光照不稳定性,避免了柠檬苦素在光照环境下发生过度降解等。
2.9 贮藏稳定性分析
负载柠檬苦素的双蛋白高内相乳液经4 ℃下贮藏21 d后,乳液微观变化情况如图7-A所示,乳液中的球形液滴均完整,未观察到聚结、破乳现象,仅有少部分液滴尺寸变大,表明其具有良好的贮藏稳定性。而柠檬苦素保留率情况结果如图7-B所示,柠檬苦素的保留率基本维持在90%左右,包埋的柠檬苦素出现损失导致包埋率降低的原因可能是乳液贮藏过程中,乳液中的部分液滴缓慢进行着相对运动,导致被包埋在液滴里面的柠檬苦素游离至液滴表面,后续受离心作用下,这些柠檬苦素沉淀至离心底部,导致保留率下降。总体而言,将柠檬苦素进行高内相乳液体系负载后,贮藏条件下其结构稳定性依旧良好,未发生大范围降解,这对于进一步应用柠檬苦素具有积极意义。

A-乳液贮藏后的微观变化;B-柠檬苦素保留率
图7 乳液贮藏后的微观变化及柠檬苦素保留率
Fig.7 Microscopic changes in emulsion after storage and retention rate of limonin
3 结论
本研究利用乳清蛋白-玉米醇溶蛋白复合纳米颗粒为高内相乳液稳定剂,构建了负载柠檬苦素的双蛋白高内相乳液,并研究了高内相乳液负载体系对柠檬苦素结构稳定性的影响。结果表明:负载柠檬苦素的双蛋白高内相乳液呈现假塑性流动行为,并形成了以弹性为主的凝胶状网络结构,而微观结构观察到乳液液滴分布相对均匀,形态呈球形状,球形液滴大小尺寸趋于均一。此外,负载柠檬苦素的高内相乳液具有良好的热稳定性、光照稳定性和贮藏稳定性,而柠檬苦素经双蛋白高内相乳液体系负载后,有效避免其结构在高温或光照环境下发生过度降解,提高了柠檬苦素的结构热稳定性和光照稳定性,该乳液经贮藏后的柠檬苦素保留率依旧维持在90%左右。本研究结果表明,构建负载柠檬苦素的双蛋白复合物高内相乳液负载体系,可以为进一步应用和开发柠檬苦素提供理论依据。
[1] 晏敏, 周宇, 贺肖寒, 等.柑橘籽中柠檬苦素及类似物的生物活性研究进展[J].食品与发酵工业, 2018, 44(2):290-296.YAN M, ZHOU Y, HE X H, et al.Research progress on the bioactivity of limonin and its analogues in citrus[J].Food and Fermentation Industries, 2018, 44(2):290-296.
[2] 曹园园. 柠檬皮渣中苦素的提取分离及微胶囊化研究[D].天津:天津科技大学, 2017.CAO Y Y. Study on extraction, separation and microencapsulation of bitumen from lemon peel residue[D]. Tianjin: Tianjin University of Science &Technology, 2017.
[3] 张亚杰, 徐金帅, 邹波, 等.柚皮苷/柠檬苦素微胶囊的制备、结构分析及特性研究[J].食品工业科技, 2021, 42(18):209-217.ZHANG Y J, XU J S, ZOU B, et al.Preparation, structural analysis and properties of naringin/limonin microcapsules[J].Science and Technology of Food Industry, 2021, 42(18):209-217.
[4] 李思敏, 吴文瀚, 高丽娜, 等.柠檬苦素脂质体的制备和制剂学评价[J].中草药, 2019, 50(24):5957-5962.LI S M, WU W H, GAO L N, et al.Preparation and pharmaceutical valuation of limonin-loaded liposomes[J].Chinese Traditional and Herbal Drugs, 2019, 50(24):5957-5962.
[5] LI Y, GUO L, ZHOU Z Q.Exploring the antifungal mechanism of limonin-loaded eugenol emulsion against Penicillium italicum:From the perspective of microbial metabolism[J].Postharvest Biology and Technology, 2021, 182:111704.
[6] CHANG L M, CHANG R X, SHEN J F, et al.Self-healing pectin/cellulose hydrogel loaded with limonin as TMEM16A inhibitor for lung adenocarcinoma treatment[J].International Journal of Biological Macromolecules, 2022, 219:754-766.
[7] BAUTISTA G F M, VIDALLON M L P, SALAMANEZ K C, et al.Nanodelivery system based on zein-alginate complexes enhances in vitro chemopreventive activity and bioavailability of pomelo[Citrus maxima (Burm.) Merr.] seed limonoids[J].Journal of Drug Delivery Science and Technology, 2019, 54:101296.
[8] 杨敏, 王裕成, 季伟, 等.乳清蛋白与黄豆苷元/葛根素相互作用及复合物性质研究[J].食品与发酵工业, 2023, 49(13):200-208.YANG M, WANG Y C, JI W, et al.Interaction between daidzein or puerarin and whey protein and the characteristics of their complexes[J].Food and Fermentation Industries, 2023, 49(13):200-208.
[9] 王文莉, 柴向华, 范宇婷, 等.基于玉米醇溶蛋白纳米颗粒稳定的Pickering乳液研究进展[J].食品与发酵工业, 2021, 47(18):301-307.WANG W L, CHAI X H, FAN Y T, et al.Advances of Pickering emulsion stabilized by zein-based complex nanoparticles[J].Food and Fermentation Industries, 2021, 47(18):301-307.
[10] 付思晗, 齐玉堂, 张维农, 等.玉米醇溶蛋白/乳清蛋白纤维核复合纳米粒稳定Pickering乳液的制备与性质[J].中国油脂, 2022, 47(1):43-47.FU S H, QI Y T, ZHANG W N, et al.Preparation and property of zein/whey protein fiber core complex nanoparticle stabilized Pickering emulsions[J].China Oils and Fats, 2022, 47(1):43-47.
[11] 林琼妮, 陈艾霖, 刘嘉怡, 等.罗非鱼蛋白-乳清蛋白复合乳液负载β-胡萝卜素的研究[J].食品研究与开发, 2022, 43(20):19-28.LIN Q N, CHEN A L, LIU J Y, et al.Load of β-carotene in tilapia protein-whey protein composite emulsion[J].Food Research and Development, 2022, 43(20):19-28.
[12] QIAN C, DECKER E A, XIAO H, et al.Physical and chemical stability of β-carotene-enriched nanoemulsions:Influence of pH, ionic strength, temperature, and emulsifier type[J].Food Chemistry, 2012, 132(3):1221-1229.
[13] DIMA  , DIMA C, IORD
, DIMA C, IORD CHESCU G.Encapsulation of functional lipophilic food and drug biocomponents[J].Food Engineering Reviews, 2015, 7(4):417-438.
CHESCU G.Encapsulation of functional lipophilic food and drug biocomponents[J].Food Engineering Reviews, 2015, 7(4):417-438.
[14] 魏孔菊, 董同珺, 朱国花, 等.天然生物大分子稳定高内相Pickering乳液及其在食品中的应用[J].食品科学, 2023, 44(23):270-281.WEI K J, DONG T J, ZHU G H, et al.High internal phase Pickering emulsion stabilized by natural biomacromolecules and its application in foods[J].Food Science, 2023, 44(23):270-281.
[15] 陈阳, 梁勋, 张亚丽, 等.蛋白质稳定高内相Pickering乳液及在食品中的应用研究进展[J].食品科技, 2020, 45(7):27-32.CHEN Y, LIANG X, ZHANG Y L, et al.Development of protein-based Pickering high internal phase emulsions and its application in food[J].Food Science and Technology, 2020, 45(7):27-32.
[16] 卫姣, 陈雨露, 高彦祥, 等.高内相乳液的制备及在食品中的应用[J].中国食品学报, 2022, 22(4):418-429.WEI J, CHEN Y L, GAO Y X, et al.Preparation of high internal emulsion and its application in food[J].Journal of Chinese Institute of Food Science and Technology, 2022, 22(4):418-429.
[17] 吴滋灵. 玉米醇溶蛋白胶体颗粒稳定的高内相Pickering乳液制备及其营养输送特性研究[D]. 广州: 华南理工大学, 2018.WU Z L. Preparation of high internal phase Pickering emulsion stabilized by zein colloidal particles and its nutrient delivery characteristics[D]. Guangzhou: South China University of Technology, 2018.
[18] WANG T, LI F S, ZHANG H, et al.Plant-based high internal phase emulsions stabilized by dual protein nanostructures with heat and freeze-thaw tolerance[J].Food Chemistry, 2022, 373:131458.
[19] WEI Y, ZHAN X Y, DAI L, et al.Formation mechanism and environmental stability of whey protein isolate-zein core-shell complex nanoparticles using the pH-shifting method[J].LWT, 2021, 139:110605.
[20] ZENG T, WU Z L, ZHU J Y, et al.Development of antioxidant Pickering high internal phase emulsions (HIPEs) stabilized by protein/polysaccharide hybrid particles as potential alternative for PHOs[J].Food Chemistry, 2017, 231:122-130.
[21] 刘吉凯, 王仁才, 邓子牛, 等.湖南不同柑橘品种果实柠檬苦素含量分析[J].湖南农业科学, 2013(5):111-113.LIU J K, WANG R C, DENG Z N, et al.Analysis of limonin content in fruits from different citrus varieties[J].Hunan Agricultural Sciences, 2013(5):111-113.
[22] 隋心. 负载藜麦皂苷Pickering乳液的制备及其性质研究[D].长春:吉林农业大学食品科学, 2023.SUI X.Preparation and properties of Pickering emulsion loaded with quinoa saponins[D].Changchun:Jilin Agricultural University, 2023.
[23] RUOZI B, TOSI G, FORNI F, et al.Atomic force microscopy and photon correlation spectroscopy:Two techniques for rapid characterization of liposomes[J].European Journal of Pharmaceutical Sciences, 2005, 25(1):81-89.
[24] CHEN Z, CUI B, GUO X H, et al.Fabrication and characterization of Pickering emulsions stabilized by desalted duck egg white nanogels and sodium alginate[J].Journal of the Science of Food and Agriculture, 2022, 102(3):949-956.
[25] 焦博. 花生蛋白—多糖Pickering乳液的制备及稳定机理研究[D].北京:中国农业科学院, 2018.JIAO B.Preparation and stabilizing mechanism of peanut protein-polysaccharide composite particles stabilized Pickering emulsions[D].Beijing:Chinese Academy of Agricultural Sciences, 2018.
[26] 李方斯. 大米蛋白与核桃蛋白异源共架体的构建及其在高内相乳液制备中的应用[D].无锡:江南大学, 2021.LI F S. Construction of heterogeneous co-frame of rice protein and walnut protein and its application in preparation of high internal phase emulsion[D]. Wuxi: Jiangnan University, 2021.
[27] LI X Y, FANG Y P, AL-ASSAF S, et al.Complexation of bovine serum albumin and sugar beet pectin:Stabilising oil-in-water emulsions[J].Journal of Colloid and Interface Science, 2012, 388(1):103-111.
[28] 王浩宇, 张舒, 冯玉超, 等.双蛋白纳米颗粒Pickering乳液的构建及稳定性研究[J].中国粮油学报, 2024, 39(3):98-109.WANG H Y, ZHANG S, FENG Y C, et al.Construction and stability study of Pickering emulsion with dual protein nanoparticles[J].Journal of the Chinese Cereals and Oils Association, 2024, 39(3):98-109.
[29] 李良, 张小影, 朱建宇, 等.大豆-乳清混合蛋白对O/W乳液稳定性及流变性的影响[J].农业机械学报, 2019, 50(12):372-379.LI L, ZHANG X Y, ZHU J Y, et al.Effect of soybean-whey mixed protein on stability and rheological properties of O/W emulsion[J].Transactions of the Chinese Society for Agricultural Machinery, 2019, 50(12):372-379.
[30] 隋心, 宋士新, 陶立, 等.负载藜麦皂苷Pickering乳液的制备、性质表征和体外消化特性[J].中国食品添加剂, 2024, 35(2):79-87.SUI X, SONG S X, TAO L, et al.Preparation, characterization and in vitro digestion properties of Pickering emulsion loaded with quinoa saponin[J].China Food Additives, 2024, 35(2):79-87.