茶在中国古代被誉为“国饮”,因茶叶中富含生物活性成分,近年来被广泛报道具有保健功能[1-2]。目前根据茶叶的化学组成成分,主要分为绿茶、蓝茶、红茶、白茶、黑茶和黄茶等类别,并对其相关功能进行研究。其中,红茶作为茶叶的一种主要类型,不仅拥有独特的口感和香气,更具备潜在的健康功效。尤其令人关注的是,与其他茶叶不同,红茶经全发酵处理后茶多酚会氧化形成更多的茶黄素,在多种疾病中发挥抗氧化和抗炎等作用[3],现已成为健康饮食的一部分。
然而,尽管红茶的健康效益已经在体外和体内研究中得到初步证实[4-5],但其对胃生物节律的影响仍未得到充分探讨。胃的生物节律是一种复杂的生理过程,涉及胃肠道神经调控、激素分泌、肌肉收缩等多个方面,对维持胃功能的正常运作至关重要。随着人们对饮食健康的关注日益增加,了解红茶对胃生物节律的影响,对于揭示其健康效益的机制和临床应用具有重要意义。
本研究旨在探讨红茶灌胃后对小鼠胃生物节律的影响,并进一步阐明红茶在这一过程中的作用机制。通过对红茶灌胃后小鼠胃的转录组学和代谢数据进行分析,为红茶作为一种潜在的胃保护剂的临床应用提供科学依据,并为进一步研究茶叶在胃肠道健康中的作用提供参考。
1 材料与方法
1.1 实验动物
雄性C57BL/6 SPF级小鼠,6周龄,广州有度生物科技有限公司(2021—0025),分为饱腹+生理盐水组(6只,NC)、饱腹+红茶组(6只,RED)、空腹+生理盐水组(6只,ENC)和空腹+红茶组(6只,ERED),共计24只,体重(23±1.68) g。饱腹组小鼠正常饮食,空腹组小鼠禁食不禁水12 h,饲养在福建中医药大学动物实验中心[SYXK(闽)2020—0002]层流架,温度(26±2) ℃,12 h交替光照,湿度40%~70%,适应性喂养1周,实验动物均严格按照实验动物福利伦理进行实验(动物伦理实验编号:FJTCMIACUC1N2023029)。
1.2 实验预处理
1.2.1 红茶干预方案
红茶取自福建武夷山国家级自然保护区正山茶业有限公司(10年水仙),干预组给予红茶(质量浓度450 mg/kg)50 μL灌胃,对照组给予等量生理盐水灌胃30 min后取材。
1.2.2 样本采集
采用异氟烷气体麻醉后脱颈致死,取小鼠胃组织,置于RNA保护液中防止降解,6 h后放置于-20 ℃,送检。
1.3 高通量RNA测序检测差异表达基因及潜在信号通路
1.3.1 RNA测序步骤
采用Trizol法提取各组小鼠胃组织RNA:将TRIzol®Reagent加入各组小鼠胃组织,加入氯仿静置后提取上层水层(含RNA),进一步用异丙醇沉淀出RNA,洗去DNA或蛋白质等杂质,得到总RNA,对总RNA进行质量检测,质控范围为:RNA integrity number(RIN)≥ 7.0,28S∶18S ≥ 1.5。取各组小鼠2 μg胃组织总RNA进行文库构建:首先按照试剂盒说明书步骤去除rRNA,将RNA进一步片段化到目标长度范围;其次进行1st Strand cDNA和2nd Strand cDNA合成后ds cDNA进行尾端修复并添加A尾。测序适配体连接:对所得产物进行测序适配体连接、PCR扩增,最后上机测序:将以上所得文库按照Illumina HiSeq测序仪操作步骤进行测序。
1.3.2 测序数据处理
从测序仪上得到Fastq原始测序数据,并处理成基因表达矩阵。然后利用R语言中的edgeR包(https://bioconductor.org/packages/release/bioc/html/edgeR.html)进行差异分析得到差异基因。差异基因的功能性和通路分析在软件KOBAS 3.0(http://bioinfo.org/kobas)中进行。
1.4 非靶向代谢组学分析鉴定差异代谢物及功能预测分析
1.4.1 样本处理
首先对样本进行提取,从-80 ℃冰箱中取出样本放在冰上解冻(后续所有操作在冰上进行);称量样本(20±1) mg到对应编号离心管中;加入70(体积分数)%甲醇水内标提取液400 μL,涡旋3 min;冰水浴中超声10 min,取出样本继续涡旋1 min,-20 ℃冰箱中静置30 min;在4 ℃条件下,12 000 r/min离心10 min,移取上清液300 μL到另一对应编号离心管中;在4 ℃条件下,12 000 r/min 再离心3 min,移取上清液200 μL到对应进样瓶内衬管中。然后进行色谱质谱采集,参数设置为:色谱柱:Waters ACQUITY Premier HSS T3 Column 1.8 μm,2.1 mm×100 mm;流动相A:0.1%(体积分数)甲酸/水;流动相B:0.1% 甲酸/乙腈;仪器柱温40 ℃;流速0.4 mL/min;进样量4 μL。最后将以上所得材料送去质谱上机。
1.5 数据处理
首先通过ProteoWizard将质谱下机原始数据转换为mzXML格式,而后利用XCMS程序进行峰提取、对齐和保留时间校正。并完成过滤缺失值>50的峰、KNN填充空白值和峰面积校正。然后综合实验室自建数据库、公共数据库、预测库等资源,对筛选校正后的峰进行代谢物鉴定。最后提取鉴定综合打分0.5分以上且QC样本CV值<0.3的物质,再进行正、负模式合并(保留定性等级最高且CV值最小的物质),得到包含所有样本代谢物含量的原始数据文件。然后对数据进行质控,后续的数据分析全部基于R软件(www.r-project.org/)进行差异代谢物筛选及代谢途径解析。
2 结果与分析
2.1 RNA测序检测饱腹状态下红茶对RED组胃组织差异基因和通路富集的影响
为探讨红茶对胃组织的作用,采用RNA测序观察红茶干预后胃组织中差异基因表达情况。如图1-A所示,红茶灌胃30 min后,RED组与NC组相比,基于筛选条件为Fold Change>2且P<0.05,统计发现共有1 717个基因发生改变,其中上调基因907个,下调基因810个。

A-差异表达基因;B-富集通路
图1 RNA测序检测饱腹状态下红茶对胃组织中差异表达基因和富集通路分析
Fig.1 Detect different genes expression and pathway enrichment in satiated group of black tea treatment by RNA sequencing

A-差异表达基因;B-富集通路
图2 RNA 测序检测空腹状态下红茶对胃组织中差异表达基因和富集通路分析
Fig.2 Detect different genes expression and pathway enrichment in fasting group of black tea treatment by RNA sequencing
为进一步研究红茶对胃组织的具体作用机制,本研究通过对差异基因进行KEGG pathway分析,寻找红茶干预对胃组织潜在通路的调控作用。如图1-B所示,RED组与NC组小鼠胃组织中差异基因被显著富集的相关通路包括生物节律、亚油酸代谢、血清素能突触、其他聚糖降解和脂肪酸延伸等代谢相关通路。
2.2 RNA测序检测空腹状态下红茶干预对胃组织差异表达基因和富集通路的影响
为了进一步探讨红茶干预对空腹胃组织的调控作用,采用RNA测序观察红茶对空腹小鼠胃组织差异基因表达变化。如图2-A所示,与ENC组相比,基于筛选条件Fold Change>2且P<0.05,统计发现,共有1 612个基因发生改变,其中上调基因748个,下调基因864个。对空腹小鼠差异基因进行KEGG通路富集。如图2-B所示,ERED组与ENC组小鼠胃组织中差异表达基因富集相关通路中,生物节律、脂代谢、糖代谢等通路被显著富集。
2.3 非靶向代谢组学分析饱腹状态下红茶对胃内容物代谢及通路变化的影响
为探讨红茶处理后胃内容物中代谢物的差异变化情况,采用非靶向代谢组学分析红茶干预后胃内容物中的代谢物进行鉴定分析。如图3-A所示,NC组共有3 413种代谢物发生改变,其中上调代谢物1 393种,下调代谢物1 355种[筛选条件为P<0.05,变量投影重要性(variable importance in projection,VIP)>1]。进一步对所有的差异代谢物的含量进行聚类(图3-B)发现,与大多数氨基酸及其代谢物、激素和激素相关化合物、酒精和胺类等代谢物在空腹NC组中的高含量相比,类黄酮在RED组中明显高度富集。
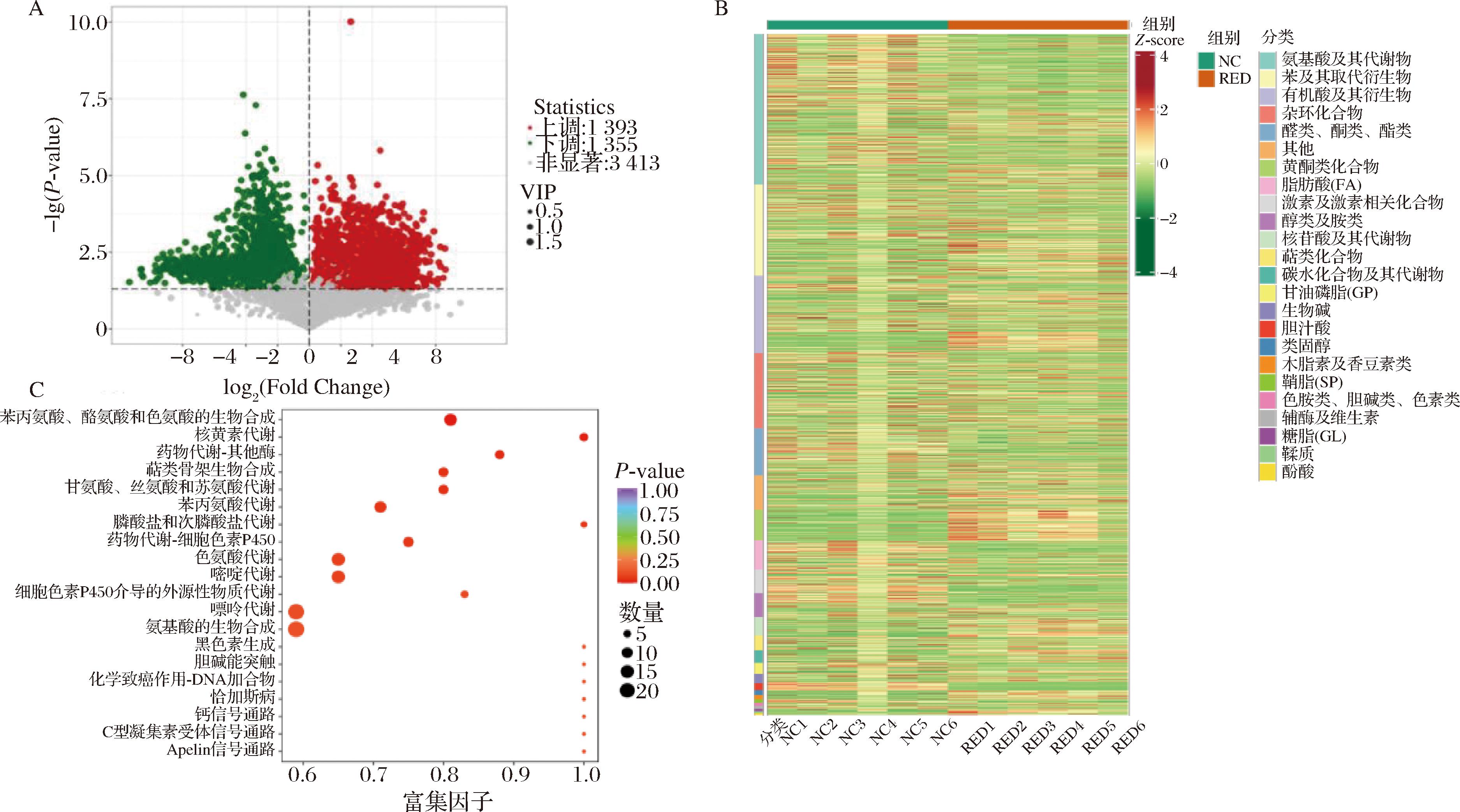
A-差异代谢物火山图;B-差异代谢物定量热图;C-差异代谢物富集通路点图
图3 饱腹状态下NC组和RED组小鼠胃内容物差异代谢物含量和富集通路分析
Fig.3 Analysis of differential metabolite contents and enrichment pathway analysis in gastric contents between NC group and RED group mice under satiety
根据差异代谢物分析结果,对红茶干预下的饱腹组小鼠胃内容物中差异代谢物进行KEGG通路富集分析,结果显示(图3-C),RED组差异代谢物被显著富集到苯丙氨酸、酪氨酸和色氨酸的生物合成通路、药物代谢、萜类骨架生物合成、嘌呤代谢、氨基酸生物合成通路等。
2.4 非靶向代谢组学分析空腹状态下红茶对胃内容物代谢及通路变化的影响
为探讨空腹状态下胃组织代谢物的变化情况,采用非靶向代谢组学对红茶干预后小鼠胃内容物中的代谢物进行鉴定分析。如图4-A所示,ERED组对比ENC组共有3 559种代谢物发生改变,其中上调代谢物1 278种,下调代谢物1 324种(筛选条件为P<0.05,VIP>1)。对所有的差异代谢物进行聚类(图4-B),发现大多数氨基酸及其代谢物在ENC组中含量较高,而其余诸如苯及其衍生物、杂环化合物、有机酸及其衍生物、醛酮、酯类、激素和激素相关化合物、酒精和胺类、类黄酮、核苷酸及其代谢物、萜类化合物、碳水化合物及其代谢物、生物碱、类固醇、胆汁酸、木脂素和香豆素、辅酶和维生素、酚酸、羧酸及其衍生物、丹宁酸等物质在ERED组中高度富集。
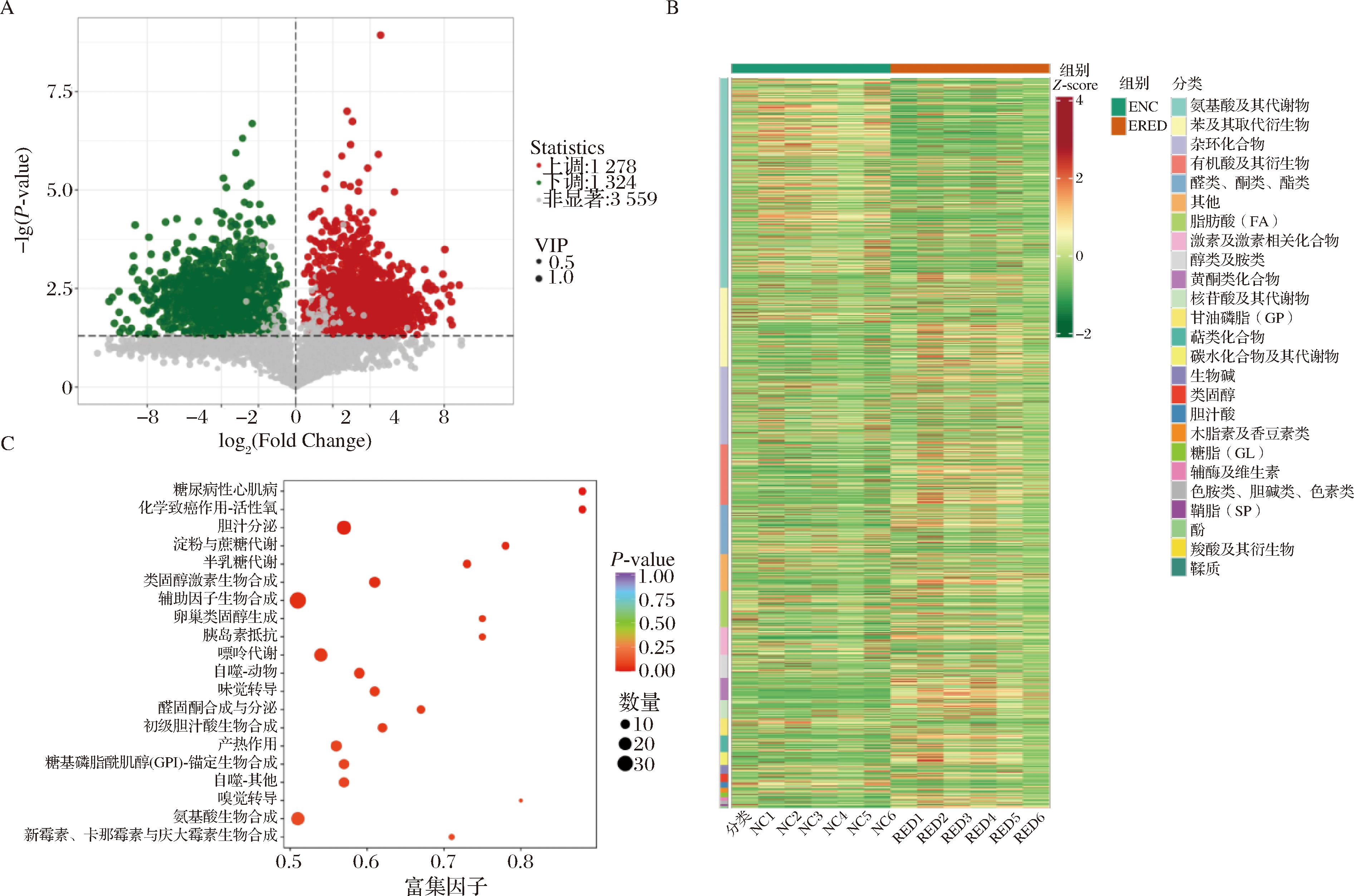
A-差异代谢物火山图;B-差异代谢物定量热图;C-差异代谢物富集通路点图
图4 空腹状态下ENC组和ERED组小鼠胃内容物差异代谢物及富集通路分析
Fig.4 Analysis of differential metabolites and enrichment pathway analysis in gastric contents between ENC group and ERED group mice in fasting state
根据差异代谢物结果,对红茶干预下的空腹组小鼠胃内容物中差异代谢物进行KEGG通路富集,结果显示(图4-C),空腹状态下的红茶组差异代谢物被显著富集到糖尿病性心肌病、淀粉和蔗糖代谢、半乳糖代谢、类固醇激素生物合成、嘌呤代谢、氨基酸生物合成通路等通路。
2.5 红茶对胃生物节律相关基因及氨基酸生物合成途径的影响
既往研究表明,生物节律对胃肠道功能、脂代谢及糖代谢具有重要调控作用。研究发现,在2个比较组的差异基因富集的差异通路中,生物节律通路显著富集,进一步对差异基因在红茶干预下的小鼠胃组织中表达情况进行分析,发现红茶干预能够显著调控饱腹小鼠胃组织Nr1d2、Per2、Per3、Arntl及空腹小鼠胃组织Per2、Arntl生物节律相关基因表达(图5)。
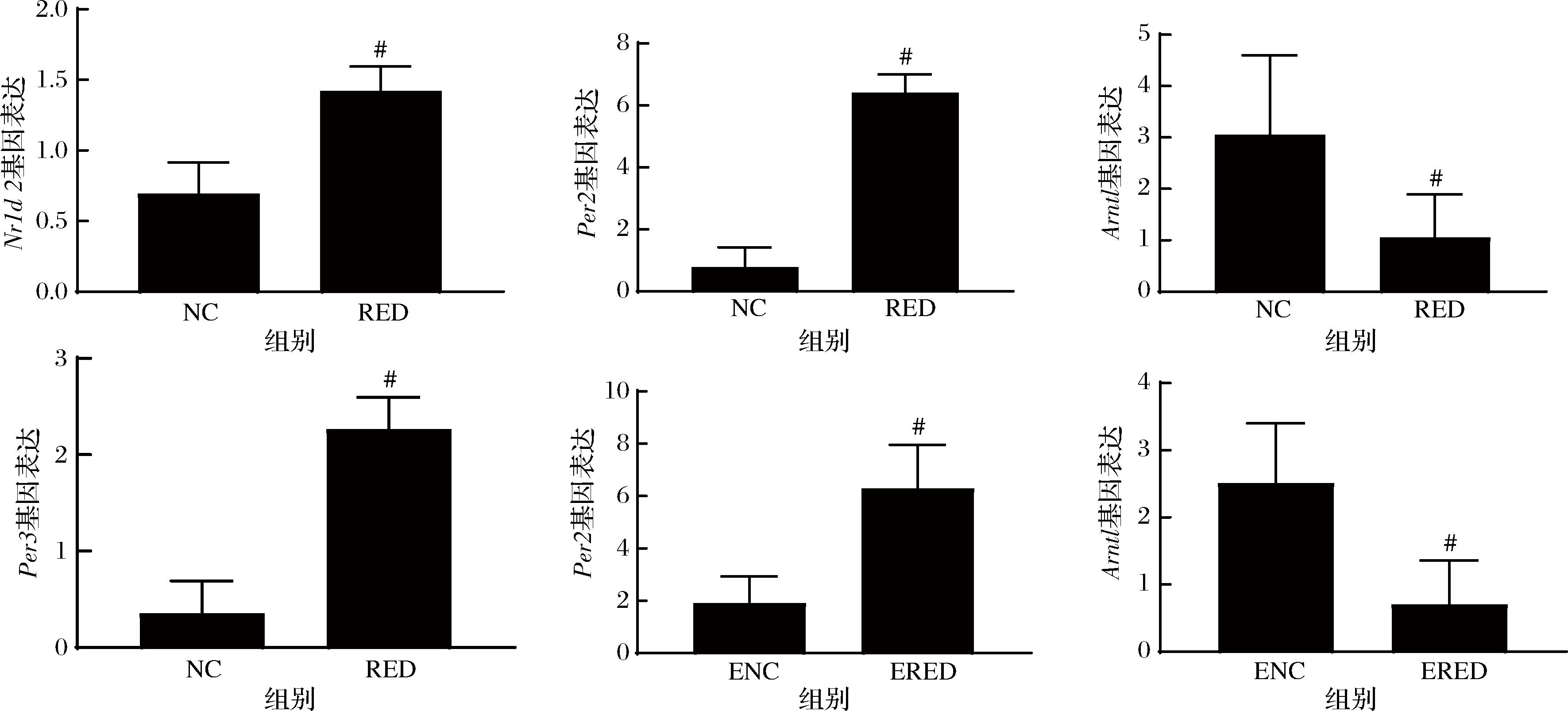
图5 红茶干预下的生物节律相关基因表达情况
Fig.5 Biorhythm related gene expression with black tea treatment
注:#P<0.05。
代谢物在生物体内相互作用,形成不同的通路。本研究发现无论是饱腹还是空腹状态下,红茶干预后的胃差异代谢物均显著富集氨基酸生物合成途径,如图6所示,大量红茶干预后的差异代谢物被检测到参与氨基酸生物合成途径。有研究表明,氨基酸含量及其代谢途径与生物节律关系非常密切,是调控生物节律的关键小分子代谢物和信号分子。
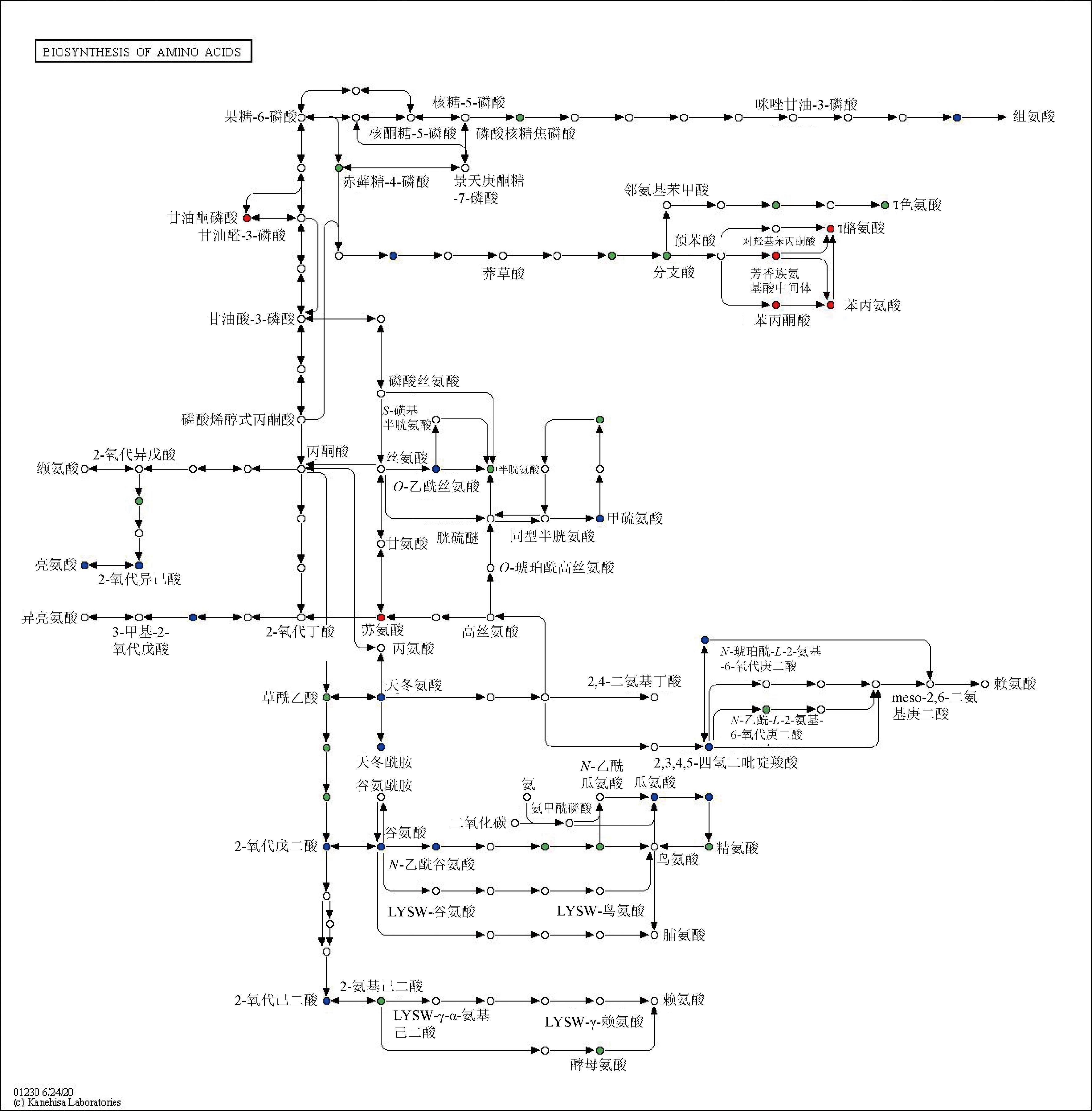
图6 氨基酸生物合成途径通路示意图
Fig.6 Schematic diagram of amino acid biosynthesis pathway
注:红色表示代谢物含量在NC组中显著上调,蓝色代表该代谢物未发生显著变化,绿色表示代谢物含量在红茶干预组显著上调。
3 讨论
3.1 茶的健康功效组分
目前,研究已经明确茶中茶多酚、茶色素和咖啡碱等成分在药理方面发挥了重要作用。茶多酚(茶叶中多种多酚类物质及其衍生物的总称)作为一种有效的抗氧化剂,具有预防和治疗癌症、炎症损伤、细菌感染和心脑血管疾病和糖尿病等方面的作用[6];茶色素是由茶叶中儿茶素和其他多酚类及其氧化衍生物混合而成的一种混合物,主要由茶红素类、茶黄素类等构成,它具有多种药理作用,如抗菌、抗氧化、抗肿瘤以及预防和治疗心血管疾病等[7];茶叶中的主要生物碱是咖啡碱,其含量通常为2%~4%,具有神经兴奋作用,能提升思维敏捷度,治疗高血压、头痛,并刺激肠胃分泌促进消化等功效[8]。
3.2 红茶养胃及其他功效
胃肠道是消化系统的重要组成部分,与人体的许多生理功能密切相关,除了消化和吸收功能外,还具有免疫、内分泌和屏障功能。研究发现因为茶本身性寒,但经过发酵处理后茶汤变为红色,滋味变得温和,这就是常说的“红茶性温”[9]。红茶含有丰富的茶黄素、维生素和氨基酸,可改善肠道菌群、保护胃肠黏膜、调节消化吸收和预防胃肠道疾病[10-12],但其具体机制尚未见相关研究。
数据统计显示,全球茶叶消费大约78%集中在红茶[13],作为备受欢迎的饮品,红茶引起了越来越多人的兴趣。根据其关键成分,红茶可以分为两类:一类是正常人体所必需的重要营养成分,另一类为非正常生理所必需,但在特定情况下服用红茶有助于有效恢复人体健康,通常将这些成分称为具体的药效成分[14]。据研究发现,红茶在前列腺癌、子宫癌和直肠癌的发生过程中具有化学预防的作用[15]。TERAMOTO等[16]从流行病学角度研究发现,饮用红茶可以降低心血管疾病的发生率;在抗炎方面同样发现,红茶能够有效地减轻和右旋糖酐硫酸盐导致的结肠炎[17];同时还发现其在防治肥胖和防治神经退行性疾病中同样发挥重要作用[18-19]。
3.3 茶叶与生物节律的调控关系
转录组数据分析结果显示,无论是饱腹或者空腹小鼠给予红茶干预后与生物节律相关的通路被显著富集,可见生物节律可能是红茶调控胃功能的重要通路。研究表明生物节律是生命的重要特征之一,影响着所有生命活动,特别是对胃肠道功能的调节。消化道与脑之间存在多种交流途径,如迷走神经、单胺神经调节、免疫系统和细菌代谢产物等[20]。宿主生物节律对肠道菌群的组成和功能产生影响,而微生物节律则调控着消化系统中的生物节律,这2个系统的正常运作是维持宿主代谢动态平衡的重要因素[21]。
人们的作息不规律,例如熬夜和深夜进食,会对微生物群和宿主昼夜节律产生影响,从而改变新陈代谢,导致稳态受损。因此,调整昼夜节律对于维持胃肠道功能正常至关重要。先前的研究已经发现乌龙茶干预8周可以使小鼠肠道菌群多样性以及和节律性种下单元(operational taxonomic unit,OTU)的数量得到改善,并且提高了小鼠肝脏中具有节律性的基因数量并改善了肝脏时钟基因的表达水平[22]。生物节律的改变对糖代谢、脂代谢等具有重要调控作用。本研究也发现红茶干预不仅对生物节律有调控作用,对代谢的调控也显著富集。因此推测红茶可能是通过调节生物节律进一步调控代谢从而促进胃功能,但后续需要进一步更加深入的实验验证。
3.4 氨基酸生物合成与生物节律的关系
代谢物定量分析结果显示,红茶干预下的小鼠中,类黄酮含量较高,且无论是饱腹还是空腹状态下的小鼠,在对差异代谢物分别富集分析时也发现,这些差异代谢物主要集中在嘌呤代谢、氨基酸生物合成等途径。且饱腹状态下时,还对药物代谢通路有显著富集,这提示红茶可能通过调节糖酵解等过程发生从而影响药物代谢途径。正常情况下,生物体的生物钟始终处于一个相对稳定的状态,从而保证生物体生命活动有条不紊的进行。而包括营养胁迫在内的多种压力能够扰乱甚至破坏生物体的节律性行为和生理活动。
有研究表明氨基酸是重要的小分子代谢物和信号分子,氨基酸含量及其代谢信号通路可以调控生物钟系统。例如有文献研究发现GCN2/CPC-3信号通路感受氨基酸饥饿压力胁迫,诱导转录因子CPC-1大量表达,通过募集组蛋白乙酰转移酶GCN-5促进生物钟核心基因frq的乙酰化修饰,进而促进转录因子WCC节律性激活frq基因的转录,维持生物钟的运转和相关代谢基因的节律性表达[23]。因此推测红茶可能通过调控胃部的氨基酸生物合成途径来改变生物节律,但该结论还需进一步的实验验证。
3.5 红茶参与调控生物节律相关基因
在本研究中,Nr1d2、Per2、Per3基因在红茶干预下的小鼠胃组织中的表达呈显著上调趋势,Arntl基因表达则是相反,为显著下调。Per2、Per3是周期昼夜蛋白同源物,Nr1d2是核受体家族成员之一,被认为是昼夜节律的关键调节因子,是形成昼夜节律钟核心组成部分的转录因子。Arntl又称Bmal1,是转录激活因子,构成生物钟的核心组成部分。过往研究表明,PER2/3和CRY1/2形成反馈回路的负端,与clock/NPAS2-BMAL1/BMAL2异源二聚体相互作用,抑制其活性,从而负向调节自身的表达。这与本研究一致。氨基酸是调控昼夜节律的关键小分子代谢物和信号分子[24],且红茶干预后,氨基酸生物合成途径被显著富集。因此推测,红茶通过影响氨基酸生物合成从而调控Nr1d2、Per2/3和Arntl基因的表达继而参与调控生物节律。
4 结论
红茶灌胃改变饱、空腹状态下小鼠胃组织的转录组和代谢组,表现为生物钟基因Nr1d2、Per2和Per3的表达上调,Arntl基因的表达下调,进而参与调节胃生物节律。本研究提示红茶可能通过调节胃生物节律发挥保健作用,但其确切作用机制仍需进一步深入研究和验证。
[1] KHAN N, MUKHTAR H.Tea polyphenols in promotion of human health[J].Nutrients, 2018, 11(1):39.
[2] TANG G Y, MENG X, GAN R Y, et al.Health functions and related molecular mechanisms of tea components:An update review[J].International Journal of Molecular Sciences, 2019,20(24):6196.
[3] BRODY H.Tea[J].Nature, 2019,566(7742):S1.
[4] SOSA P M, DE SOUZA M A, MELLO-CARPES P B.Green tea and red tea from Camellia sinensis partially prevented the motor deficits and striatal oxidative damage induced by hemorrhagic stroke in rats[J].Neural Plasticity, 2018(1), 2018:5158724.
[5] KIM S, PARK T H, KIM W I, et al.The effects of green tea on acne vulgaris:A systematic review and meta-analysis of randomized clinical trials[J].Phytotherapy Research, 2021,35(1):374-383.
[6] 刘晴.浅谈茶多酚的药理作用[J].福建茶叶,2021,43(1):22-24.LIU Q.Discussion on pharmacological action of tea polyphenols[J].Tea in Fujian, 2021, 43(1):22-24.
[7] 吕虎,华萍,余继红,等.茶色素药理作用研究进展[J].中国新药与临床杂志,2005,24 (9):745-749.LYU H, HUA P, YU J H, et al.Progress of study on tea pigment pharmacological activity[J].Chinese Journal of New Drugs and Clinical Remedies, 2005, 24(9):745-749.
[8] 张欢,黄友谊,王成柳,等.茶叶厌氧发酵中咖啡碱的降解途径研究[J].食品安全质量检测学报,2024,15(4):226-233.ZHANG H, HUANG Y Y, WANG C L, et al.Degradation pathway of caffeine in tea anaerobic fermentation[J].Journal of Food Safety and Quality, 2024, 15(4):226-233.
[9] 艾煊.茶性[J].饮食科学,2022(6):62-63.AI X.The nature of tea[J].Diet Science, 2022(6):62-63.
[10] PéREZ-BURILLO S, NAVAJAS-PORRAS B, LóPEZ-MALDONADO A, et al.Green tea and its relation to human gut microbiome[J].Molecules, 2021,26(13):3907.
[11] WU Z H, HUANG S M, LI T T, et al.Gut microbiota from green tea polyphenol-dosed mice improves intestinal epithelial homeostasis and ameliorates experimental colitis[J].Microbiome, 2021,9(1):184.
[12] UCHIYAMA S, TANIGUCHI Y, SAKA A, et al.Prevention of diet-induced obesity by dietary black tea polyphenols extract in vitro and in vivo[J].Nutrition, 2011, 27(3):287-292.
[13] LI S M, LO C Y, PAN M H, et al.Black tea:Chemical analysis and stability[J].Food &Function, 2013, 4(1):8-10.
[14] 李占霞,赵杰荣.论红茶的保健医疗作用[J].福建茶叶,2018,40(7):26.LI Z X, ZHAO J R.On the health care and medical function of black tea[J].Tea in Fujian, 2018, 40(7):26.
[15] KUMAR N B, HOGUE S, POW-SANG J, et al.Effects of green tea catechins on prostate cancer chemoprevention:The role of the gut microbiome[J].Cancers, 2022,14(16):3988.
[16] TERAMOTO M, YAMAGISHI K, MURAKI I, et al.Coffee and green tea consumption and cardiovascular disease mortality among people with and without hypertension[J].Journal of the American Heart Association, 2023,12(2):e026477.
[17] SONG Y A, PARK Y L, KIM K Y, et al.Black tea extract prevents lipopolysaccharide-induced NF-κB signaling and attenuates dextran sulfate sodium-induced experimental colitis[J].BMC Complementary Alternative Medicine, 2011,11:91.
[18] NISHIUMI S, BESSYO H, KUBO M, et al.Green and black tea suppress hyperglycemia and insulin resistance by retaining the expression of glucose transporter 4 in muscle of high-fat diet-fed C57BL/6 J mice[J].Journal of Agricultural and Food Chemistry, 2010,58(24):12916-12923.
[19] GRELLE G, OTTO A, LORENZ M, et al.Black tea theaflavins inhibit formation of toxic amyloid-β and α-synuclein fibrils[J].Biochemistry, 2011,50(49):10624-10636.
[20] 颜秀娟.消化系统疾病伴生物节律紊乱的临床管理专家共识[J].胃肠病学,2021,26(10):611-621.YAN X J.Expert consensus on clinical management of digestive system diseases associated with biorhythm disorders[J].Chinese Journal of Gastroenterology, 2021, 26(10):611-621.
[21] VEETTIL S K, WONG T Y, LOO Y S, et al.Role of diet in colorectal cancer incidence:Umbrella review of meta-analyses of prospective observational studies[J].JAMA Network Open, 2021, 4(2):e2037341.
[22] 郭彤彤. 乌龙茶多酚对肠道菌群和肝脏基因昼夜节律作用研究[D].宁波:宁波大学,2020.GUO T T.The modulatory effect of oolong tea polyphenols on circadian rhythm of intestinal microbiome and liver genes[D].Ningbo:Ningbo University, 2020.
[23] LIU X L, YANG Y L, HU Y, et al.The nutrient-sensing GCN2 signaling pathway is essential for circadian clock function by regulating histone acetylation under amino acid starvation[J].elife, 2023,12:e85241.
[24] AL-NUAIMI Y, HARDMAN J A, B R
R T, et al.A meeting of two chronobiological systems:Circadian proteins Period1 and BMAL1 modulate the human hair cycle clock[J].Journal of Investigative Dermatology, 2014,134(3):610-619.
T, et al.A meeting of two chronobiological systems:Circadian proteins Period1 and BMAL1 modulate the human hair cycle clock[J].Journal of Investigative Dermatology, 2014,134(3):610-619.