青脆李(Prunus salicina L.)是蔷薇科李属植物,因其独特的外观、香气和风味而深受消费者的青睐[1]。重庆是青脆李的重要发源地及种植地,且由于重庆气候湿润,水热资源丰富,有利于果实着色和糖分积累,从而出现了一系列极富地域特色的脆李品种。但是青脆李是一种典型的呼吸跃变型水果[2],多成熟在夏季高温高湿时节[3],耐寒和贮藏能力差,因此采摘后果实的新鲜度会迅速下降,出现质地软化或腐败等品质劣变现象[4],从而影响果实的长途运输和市场推广,使得鲜果货架供应期较短,销售范围受限。
研究表明,采后果蔬的衰老与能量代谢途径有关[5],而呼吸代谢则是植物组织中进行能量代谢的基本过程。呼吸作用既包括糖酸类底物的降解,又包括为植物体提供能量的酶促反应[6],从而成为植物代谢的中心[7]。果实采后的衰老与软化腐烂常与能量供应不足或ATP生成速率降低有关。当贮藏条件适宜时,青脆李果实细胞的ATP合成量足以供给果实正常的代谢活动,果实便会保持新鲜状态。但是当贮藏条件不适或者受到逆境胁迫时,青脆李果实细胞ATP供给不足或者合成速率降低,就会导致细胞的呼吸速率发生改变,从而加速果实的衰老[8-10]。
而细胞的呼吸速率受到呼吸代谢途径的影响。糖酵解途径(embden-meyerhof-parnas pathway,EMP)和三羧酸循环(tricarboxylic acid cycle, TCA)是最基本的呼吸途径,葡萄糖通过EMP被氧化为丙酮酸,又通过TCA被彻底氧化分解放出大量能量并形成ATP[11-13],若丙酮酸过量积累则会产生乙醇和乙醛,导致果实生理代谢紊乱、有机物消耗增加、能量供应不足而加速果实衰老[14]。磷酸戊糖途径(pentose phosphate pathway, PPP)是植物的又一重要的呼吸途径,相较于EMP和TCA,PPP则属于呼吸代谢途径的支路[9]。磷酸果糖激酶(phosphofructokinase, PFK)、异柠檬酸脱氢酶(isocitrate dehydrogenase, IDH)、葡萄糖-6-磷酸脱氢酶(glucose-6- phosphate dehydrogenase, G6PDH)和6-磷酸葡萄糖酸脱氢酶(6-phosphogluconate dehydrogenase,6PGDH)等是这3个呼吸代谢过程的关键酶和限速酶[15],影响着呼吸代谢的类型和速度。同时,果实细胞中的吡啶核苷酸如烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide, NAD)、烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate, NADP),以及它们的还原型(NADH、NADPH),均参与呼吸代谢和电子转移过程[16],其中NAD和NADH与EMP和TCA密切相关,而NADP和NADPH参与PPP[17]。呼吸代谢途径与果实的糖酸代谢和能量代谢密切相关,影响着采后果实品质的优劣和贮藏时间的长短。
阿拉伯半乳聚糖(arabinogalactan, AG)是一种高分支、高分子质量的中性多糖[18],是阿拉伯半乳聚糖蛋白(arabinogalactan proteins,AGP)的重要组成部分。有研究发现,AGP不仅对细胞壁的构建产生作用,同时还参与细胞壁的构成[19],而果实变软过程与细胞壁结构的变化有着紧密联系[20]。同时发现,AGP与包括番茄、苹果在内的多种水果的成熟老化程度存在关联[21]。课题组前期研究[22]表明,使用5 g/L AG处理可以减缓青脆李果实采摘后的颜色转变,防止果实变软,并大幅度降低采摘后果实的呼吸速率,延缓果实常温贮藏过程中的衰老进程,但其延缓青脆李果实成熟衰老进程的机制尚不明确。
基于此,本实验拟通过研究5 g/LAG处理对青脆李果实采后糖酸含量、ATP、ADP、AMP和能荷、NAD和NADPH、呼吸代谢相关酶的活性以及相关基因表达量的影响,初步说明AG处理延缓采后青脆李果实衰老与糖酸代谢和能量代谢的关系,为控制采后青脆李果实衰老、延长果实保鲜期提供理论参考。
1 材料与方法
1.1 材料与试剂
供试青脆李果实于重庆市巫山县采摘。挑选色泽一致、大小均匀、无病虫害、无机械损伤,外观品质基本一致的成熟果实,除去田间热后放置在室温条件下贮藏备用。
阿拉伯半乳聚糖(食品级),上海源叶生物科技有限公司;甲醇,天津四友精细化学品有限公司;核糖醇、甲酸、氨水、乙酸铵,美国Sigma公司;吡啶,上海国药集团化学试剂有限公司;双(三甲基硅基)三氟乙酰胺,梯希爱(上海)化成工业发展有限公司;乙腈,德国Merck公司,以上试剂均为色谱纯。丙酮酸脱羧酶试剂盒、磷酸果糖激酶试剂盒、乙醇脱氢酶试剂盒,苏州格锐思生物科技有限公司。
1.2 仪器与设备
3H16R1冷冻离心机,湖南赫西仪器装备有限公司;ZLS-1真空离心浓缩机,上海精密科学仪器有限公司;DZF-6051真空干燥箱,上海齐欣有限公司;DB-5MS气相色谱柱,安捷伦科技有限公司;QP2010PLUS气相色谱-质谱联用仪(GC-MS),日本SHIMADZU公司;SYNERGYH1全自动酶标仪,美国伯腾仪器有限公司;QTRAP 6500+液相色谱质谱仪,上海SCIEX爱博才思分析仪器贸易有限公司;5424R离心机,德国艾本德股份公司;MM400球磨仪,德国莱驰公司;KQ5200DE超声清洗仪,昆山仪器有限公司。
1.3 实验方法
1.3.1 果实处理及取样
果实处理及取样参考曾昌平等[23]的方法,将果实随机分为CK、AG两组,每组用果300个。AG组经质量浓度为5 g/L的 AG 溶液浸泡10 min,CK组用清水浸泡相同时间作为对照。果实晾干后放置在20 ℃、相对湿度为80%~90%的环境中贮藏。入库贮藏后分别于0、3、6、9、12 d进行取样。果实经去皮、切块、液氮冷冻后,放置在-80 ℃冰箱中保存,用于后续相关指标的测定。课题组前期实验数据表明,在贮藏第6天和第12天,对照组青脆李果实有明显的成熟或衰老表型,因此,后续指标重点关注0 d、6 d和12 d的变化。
1.3.2 糖酸组分及含量的测定
糖酸组分的测定参考计楠等[24]的方法,取1 g青脆李果实冻样在液氮中研磨成粉末,提取果实中的糖酸成分并进行衍生化,使用GC-MS来分析鉴定果实中的糖酸组分,利用核糖醇作为内标物对各组分进行半定量分析。
GC-MS条件如下:使用DB-5MS气相色谱柱(30 m×0.25 mm×0.25 μm,Agilent);样品进样量为1 μL,分流比为10∶1;载气使用纯度为99.999%的氦气,流速设置为1.0 mL/min;进样口温度为250 ℃,离子源温度为230 ℃,接口温度为250 ℃;扫描范围:45~600 m/z。升温程序设定如表1所示。
表1 GC-MS升温程序
Table 1 Heating procedure of the GC-MS
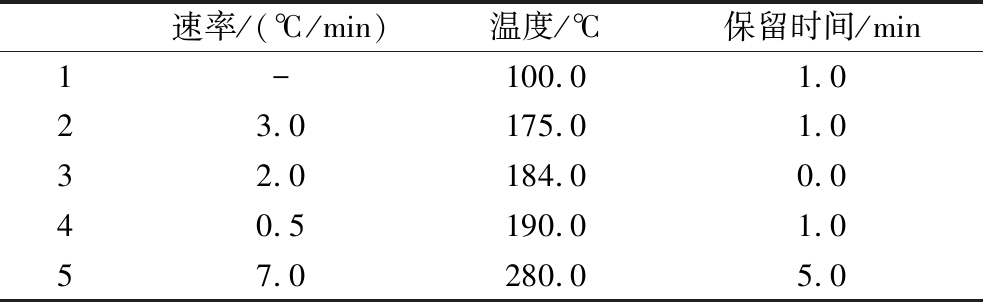
注:-表示设备初始升温速率。
速率/(℃/min)温度/℃保留时间/min1-100.01.023.0175.01.032.0184.00.040.5190.01.057.0280.05.0
1.3.3 ATP、ADP、AMP、NAD、NADPH的测定
相关指标测定委托武汉迈特维尔生物科技有限公司进行。将青脆李果实冻样用液氮研磨成粉末,加入70%(体积分数)甲醇水溶液提取后并进行前处理操作,采用高效液相色谱和串联质谱进行相关指标的测定与分析。
液相条件主要包括:色谱柱为ACQUITY UPLC BEH Amide柱(1.7 μm,100 mm×2.1 mm i,d.);流动相A为超纯水(10 mmol/L乙酸铵,0.3%氨水),流动相B为V(乙腈)∶V(水)=90∶10;流速为0.4 mL/min,柱温为40 ℃,进样量为2 μL;流动相梯度为0~1.2 min V(A)∶V(B)=5∶95,1.3~8 min V(A)∶V(B)= 30∶70,9~11 min V(A)∶V(B)=50∶50,11.1~15 min V(A)∶V(B)=5∶95。
结果分析:首先使用标准品构建出MWDB(Metware Database)数据库,对质谱检测所得数据进行定性分析与计算;然后利用三重四级杆质谱的多反应监测模式(multiple reaction monitoring,MRM)对色谱峰进行积分计算,并借助标准曲线完成定量分析,以此获得数据结果。
1.3.4 相关酶活性的测定
根据试剂盒的方法对丙酮酸脱羧酶(pyruvate decarboxylase, PDC)、乙醇脱氢酶(alcohol dehydrogenase, ADH)和果糖-6-磷酸激酶(6-phosphofructokinase, PFK)的活性进行测定。将青脆李果实冻样用液氮研磨成粉末,称取0.1 g果肉加入1 mL提取缓冲液,冰浴研磨成匀浆,并于12 000 r/min,4 ℃条件离心10 min,收集上清液冰浴保存备用。参照试剂盒操作进行测定,结果的计算和表示均根据说明书进行,重复测定3次。酶活单位表示为nmol/(min·g)。
1.3.5 基因表达量的测定
前期试验结果表明,在贮藏第6天时,对照组青脆李果实有明显的成熟表型出现[23]。因此,提取贮藏时间为0 d、3 d和6 d的青脆李果实样本的RNA进行转录组测序。转录组测序委托广州基迪奥生物科技有限公司进行。本研究中参考基因组为Prunus salicina Sanyueli Whole Genome v2.0 Assembly &Annotation,采用DESeq2软件进行差异基因分析,以|log2 (Fold Change)|>1且P <0.05作为筛选差异基因的标准。
1.4 数据处理
以上所有实验均重复进行3次。用Excel 2019对所得数据进行统计,用GraphPad Prism 8.0对相关图表进行绘制,用SPSS Statistics 27中的独立样本t检验法对数据进行方差分析,差异水平均为P<0.05。
2 结果与分析
2.1 AG处理对采后青脆李果实糖酸代谢的影响
2.1.1 AG处理对采后青脆李果实可溶性糖含量的影响
采后青脆李果实的主要可溶性糖包括葡萄糖、果糖和蔗糖。可溶性糖是青脆李果实的重要构成部分,不仅影响采后果实品质的优劣[25],也参与糖酵解等途径氧化释放能量以满足果实正常的生命活动,保持果实的品质[26]。在贮藏期间,果实的呼吸作用不断加强,导致可溶性糖含量不断下降,使果实品质劣变。
如图1-a所示,在贮藏期间,AG组和CK组青脆李果实葡萄糖含量未发生显著变化,但在贮藏第6天AG组果实葡萄糖含量增加且高于CK组果实,但差异不显著(P>0.05)。如图1-b所示,在贮藏期间,果糖含量总体呈现下降趋势,但CK组果实果糖含量在第12天略有上升趋势(P<0.05)。如图1-c所示,AG组果实蔗糖含量呈现下降趋势,且AG组蔗糖含量下降速度低于CK组果实。在贮藏第12天,AG组果实蔗糖含量比CK组高38.80%(P<0.05)。
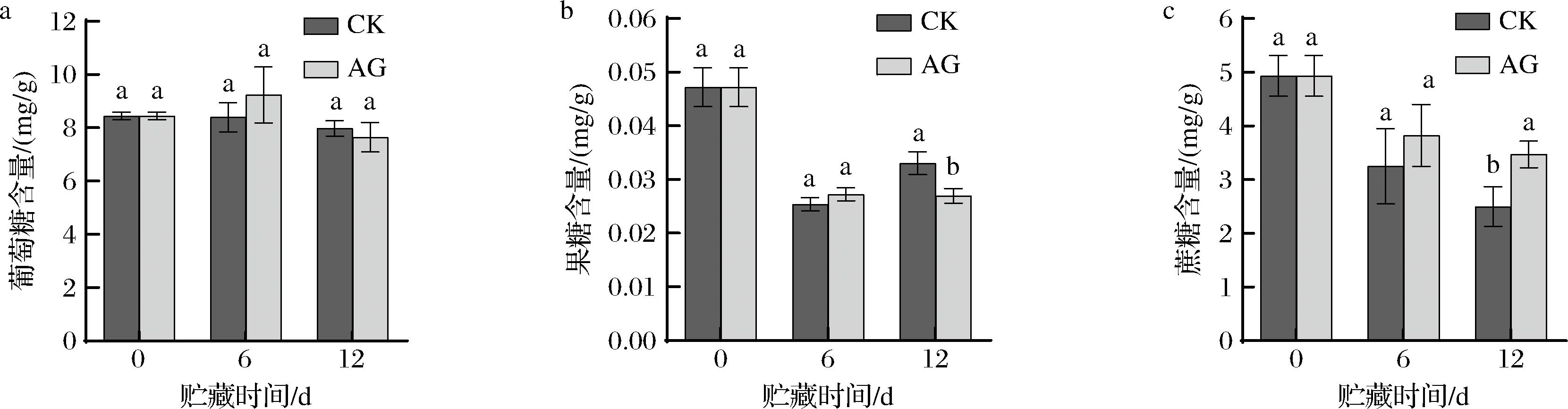
a-葡萄糖含量;b-果糖含量;c-蔗糖含量
图1 AG处理对青脆李果实可溶性糖含量的影响
Fig.1 Effect of AG treatment on soluble sugars of Qingcui plum fruit
注:对于同一指标、同一贮藏时间下的不同字母表示不同处理间存在显著性差异(P<0.05)(下同)。
以上结果说明,AG处理对采后青脆李的葡萄糖和果糖含量无明显影响,但是可以减慢蔗糖含量降低的速度,使采后青脆李果实的可溶性糖含量维持在相对较高的水平,保持采后果实的品质。
2.1.2 AG处理对采后青脆李果实酸含量的影响
丙酮酸、柠檬酸、异柠檬酸、α-酮戊二酸、琥珀酸以及苹果酸是参与糖酵解和三羧酸循环的重要有机酸[27]。
如图2-a所示,在贮藏期间,青脆李果实中苹果酸含量呈现下降趋势。但相比于CK组,AG处理可延缓苹果酸含量下降速度,在贮藏第12天,AG组苹果酸含量显著高于CK组(P<0.05)。如图2-b、图2-c所示,柠檬酸、异柠檬酸含量在贮藏期间急剧下降,贮藏第12天较贮藏第6天有回升趋势。AG组果实柠檬酸、异柠檬酸含量在贮藏第6天比CK组果实低,但在贮藏第12天比CK组果实高。在贮藏第12天AG处理的果实异柠檬酸含量比CK组高40.60%(P<0.05)。如图2-d所示,CK组和AG组琥珀酸含量均呈现先下降后上升的趋势。在贮藏第12天,CK组琥珀酸含量骤然增加,是AG组的5.92倍(P<0.05),推测可能原因是CK组琥珀酸脱氢酶的活性显著低于AG组,进而阻止琥珀酸脱氢形成延胡索酸而造成琥珀酸堆积。如图2-e所示,在贮藏期间α-酮戊二酸含量无显著变化但略有波动。在同一贮藏时间,CK组果实α-酮戊二酸含量均高于AG组,在贮藏第12天CK组α-酮戊二酸含量比AG组高18.16%(P<0.05)。如图2-f所示,丙酮酸含量在贮藏第6天急剧下降但在第12天含量增加且比0 d高。在同一贮藏时间,CK组和AG组丙酮酸含量差异不显著(P>0.05)。
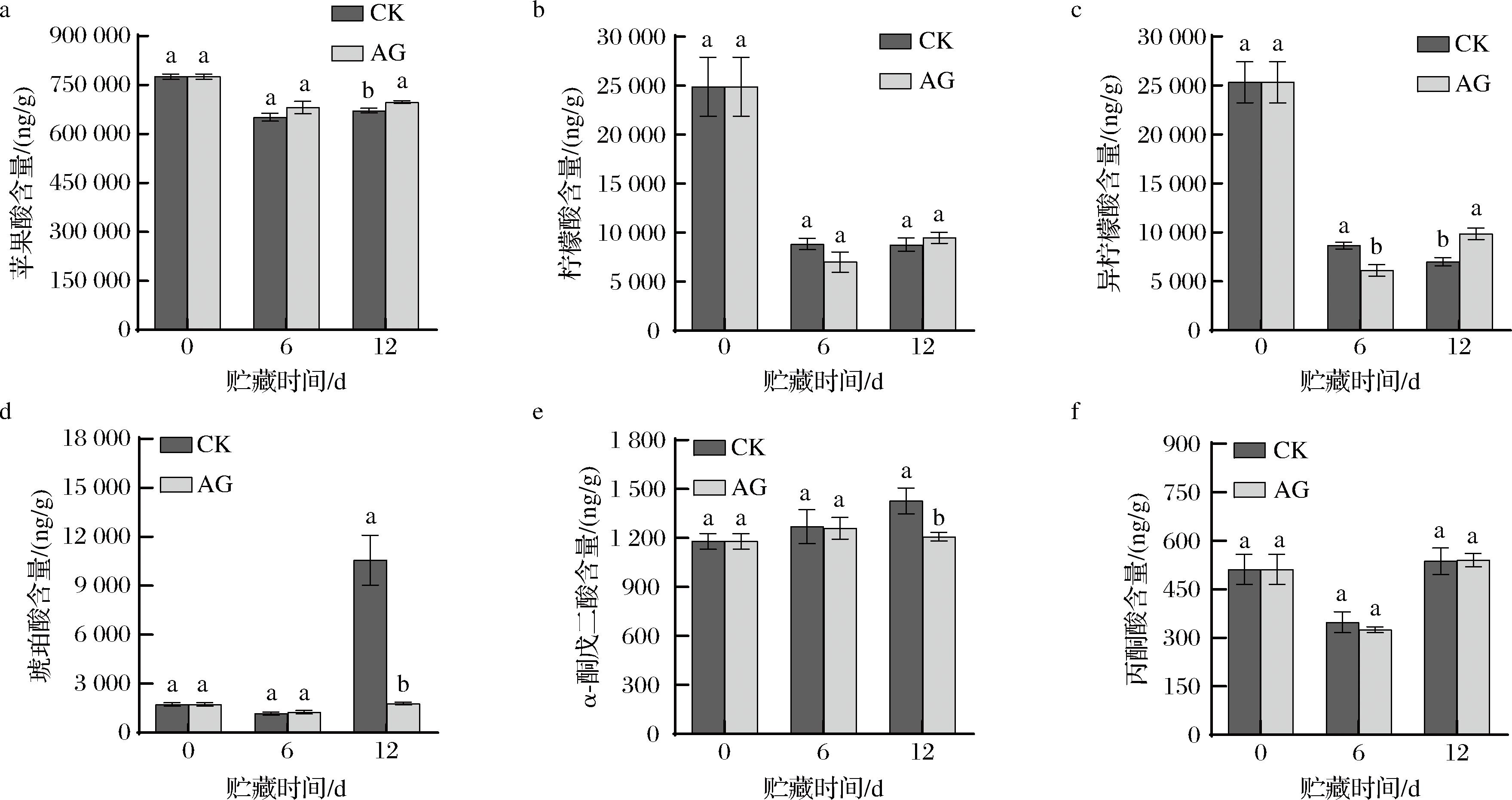
a-苹果酸含量;b-柠檬酸含量;c-异柠檬酸含量;d-琥珀酸含量;e-α-酮戊二酸含量;f-丙酮酸含量
图2 AG处理对青脆李果实有机酸含量的影响
Fig.2 Effect of AG treatment on organic acids of Qingcui plum fruit
以上结果表明,AG处理能延缓贮藏期间苹果酸、柠檬酸和异柠檬酸含量的下降,对琥珀酸、α-酮戊二酸和丙酮酸无显著影响。
2.2 AG处理对采后青脆李果实ATP、ADP、AMP以及能荷的影响
能荷是指在总的腺苷酸系统中(即ATP、ADP和AMP浓度之和)所负荷的高能磷酸基数量,表示细胞中可利用能量的一个量化指标。有研究表明,果实采后的ATP含量和能荷与成熟衰老水平呈负相关[28],即ATP含量和能荷越高,果实成熟衰老水平越低。
由图3-a可知,CK组和AG组果实在贮藏期间的ATP含量变化基本一致,总体呈上升趋势。AG处理可明显促进青脆李果实ATP的积累,在贮藏第6天和第12天,AG组果实ATP含量分别比CK高3.12%(P>0.05)和29.96%(P<0.05)。由图3-b可知,在贮藏期间,CK组和AG组ADP含量均有所上升。在贮藏第6天,AG组果实ADP含量略高于CK组果实(P>0.05);但在贮藏第12天,AG组果实ADP含量比CK组果实低47.59%,差异显著(P<0.05)。由图3-c可知,CK组和AG组果实AMP含量变化趋势均为先下降后上升。在贮藏第6天,AG组果实AMP含量略高于CK组果实,但差异不显著(P>0.05);但在贮藏第12天,AG组果实ADP含量比CK组果实低65.37%(P<0.05)。由图3-d可知,贮藏期间,能荷无明显变化但略有波动。在贮藏第12天,AG组果实能荷比CK组果实高16.70%(P<0.05)。上述结果表明,AG处理能有效提高采后青脆李果实ATP的含量、抑制果实ADP、AMP含量的增加,并且能够抑制果实能荷的下降,延缓果实的衰老。
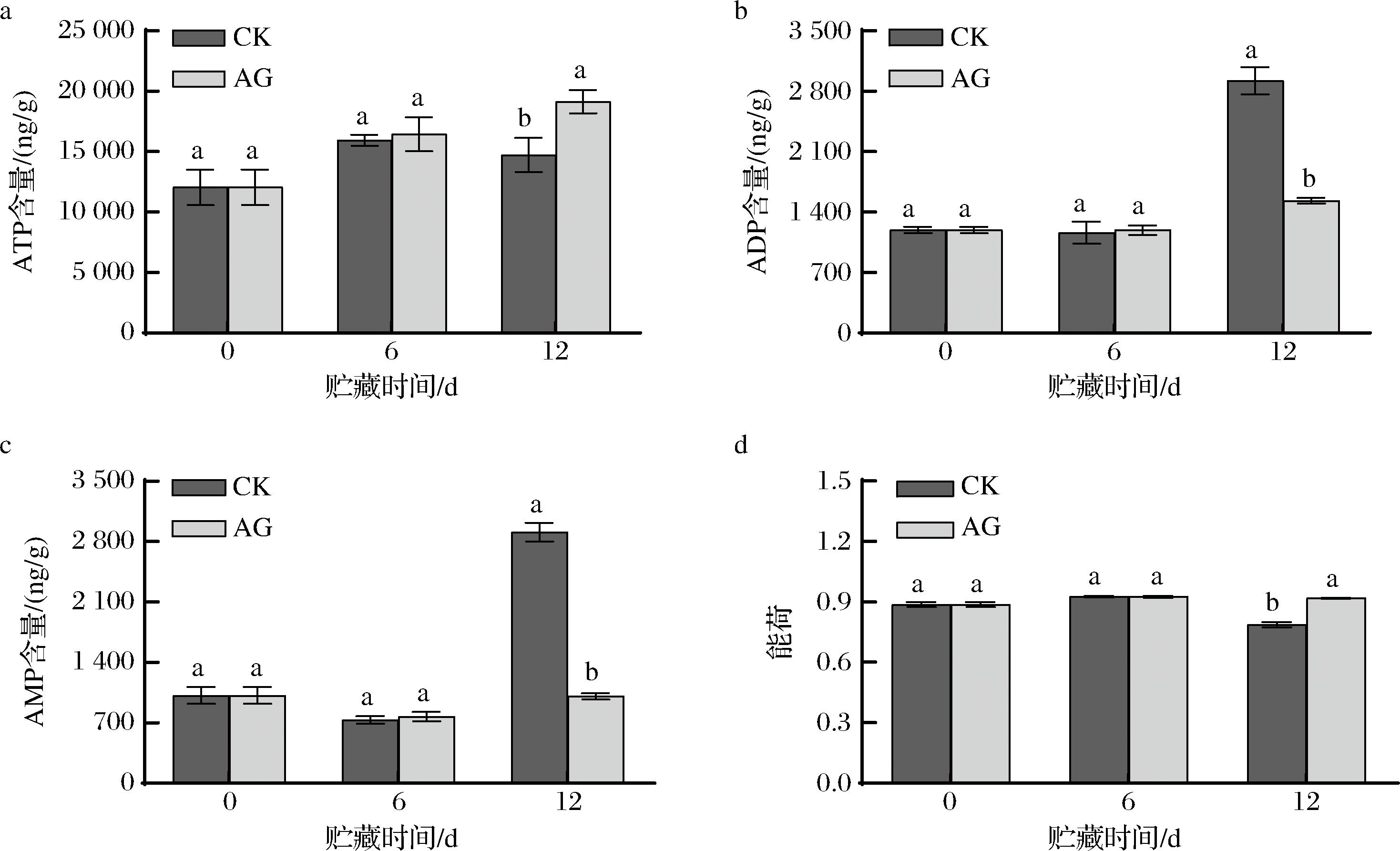
a-ATP含量;b-ADP含量;c-AMP含量;d-能荷
图3 AG处理对青脆李果实ATP、ADP、AMP以及能荷的影响
Fig.3 Effect of AG treatment on ATP, ADP, AMP, and energy charge of Qingcui plum fruit
2.3 AG处理对采后青脆李果实NAD和NADPH的影响
NAD可参与EMP和TCA,而NADPH则是NADP参与PPP的产物,其含量的高低和比例可能改变采后果实呼吸代谢的途径,从而改变呼吸速率和能量代谢[28],进而影响果实的贮藏寿命。
如图4-a所示,贮藏期间CK组和AG组NAD含量均呈上升趋势,但AG处理抑制了青脆李果实的NAD积累,在贮藏第12天CK组NAD含量比AG组高52.14%(P<0.05)。如图4-b所示,贮藏期间,青脆李果实中NADPH含量逐渐降低,同一贮藏时间AG处理后的青脆李果实NADPH含量均高于CK组,但差异不显著(P>0.05)。
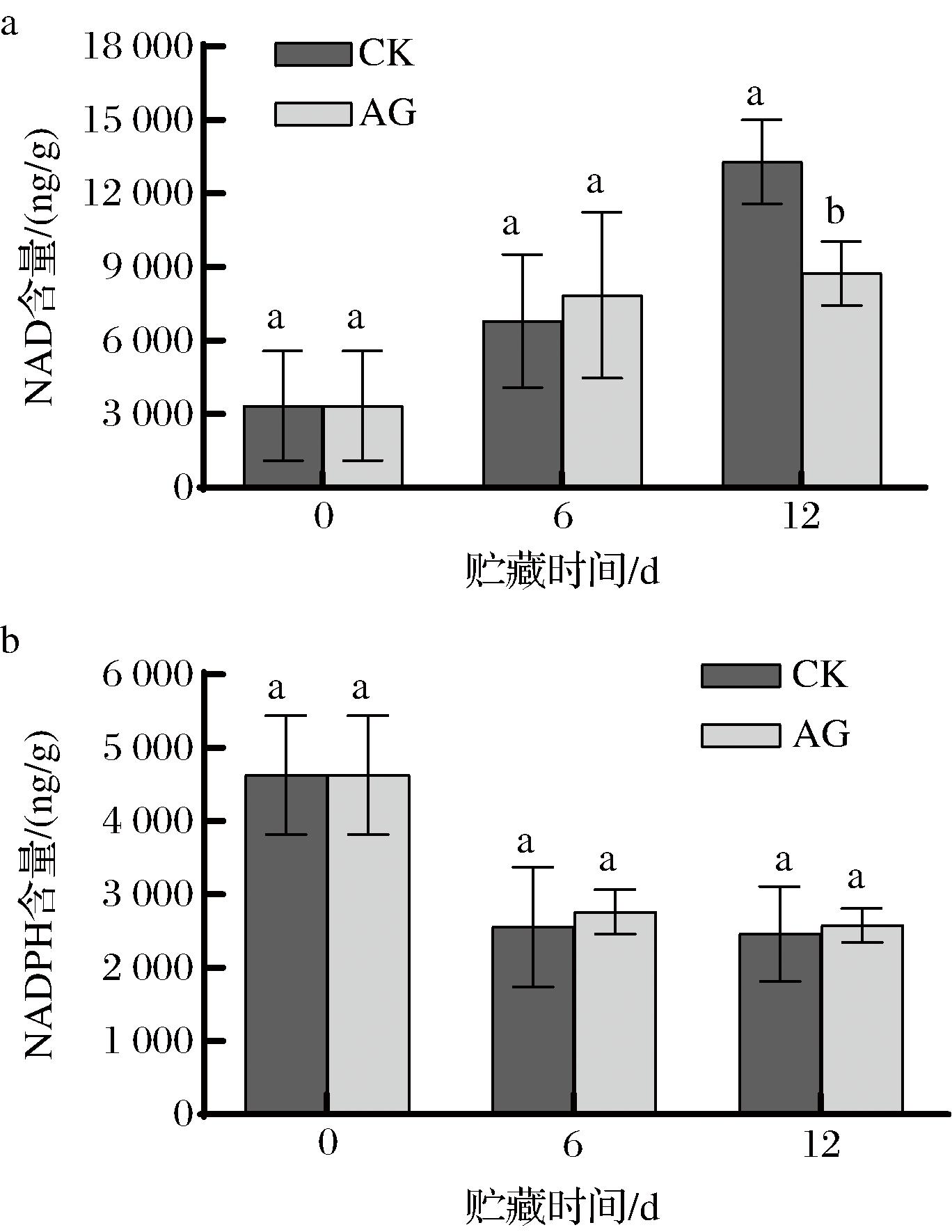
a-NAD含量;b-NADPH含量
图4 AG处理对青脆李果实NAD、NADPH含量的影响
Fig.4 Effect of AG treatment on NAD and NADPH contents of Qingcui plum fruit
以上结果说明,AG处理可降低采后青脆李果实的NAD含量,同时减慢NADPH降低的速度。表明AG处理会抑制EMP和TCA循环而使得NAD含量保持在较低水平,并且促进PPP使生成的NADPH增加。而PPP属于呼吸代谢的支路,该途径在总呼吸代谢中所占比例增大,则EMP和TCA所占比例降低,最终导致呼吸速率降低,呼吸底物消耗减少,从而延长果实的贮藏寿命。
2.4 AG处理对采后青脆李果实PDC、ADH、PFK酶活性的影响
PDC催化丙酮酸脱羧生成乙醛,乙醛进一步通过ADH的催化生成乙醇,PDC和ADH酶活性的升高使无氧呼吸加剧,消耗更多呼吸底物但提供较少能量,也使乙醇和乙醛等代谢产物的积累[14],导致果实生理失调,加速果实变质和衰老。PFK是EMP中最重要的调控酶和限速酶,其催化果糖-6-磷酸转变成果糖-1,6-二磷酸是EMP中最重要的调节步骤,当PFK活性降低可抑制EMP从而减少呼吸底物的消耗[15]。
如图5-a所示,在贮藏期间AG组和CK组果实PDC酶活性变化趋势一致,总体呈下降趋势,但第6天CK组果实酶活性略有上升。在贮藏各个时间,CK组PDC酶活性均高于AG组,差异显著(P<0.05)。其中贮藏第3天时CK组酶活性是AG组的2.23倍(P<0.05)。如图5-b所示,在贮藏期间AG组和CK组果实ADH酶活性变化趋势一致,均为先下降后上升。在贮藏各个时间,CK组ADH酶活性均高于AG组,差异显著(P<0.05)。酶活性均在贮藏第6天达到最低水平,分别为2.34、3.25 nmol/(min·g)。如图5-c所示,在贮藏期间AG组和CK组果实PFK酶活性变化趋势一致,均呈下降趋势,但略有波动。在贮藏各个时间,CK组PFK酶活性均高于AG组,差异显著(P<0.05)。其中贮藏第3天时CK组酶活性是AG组的2.07倍(P<0.05)。
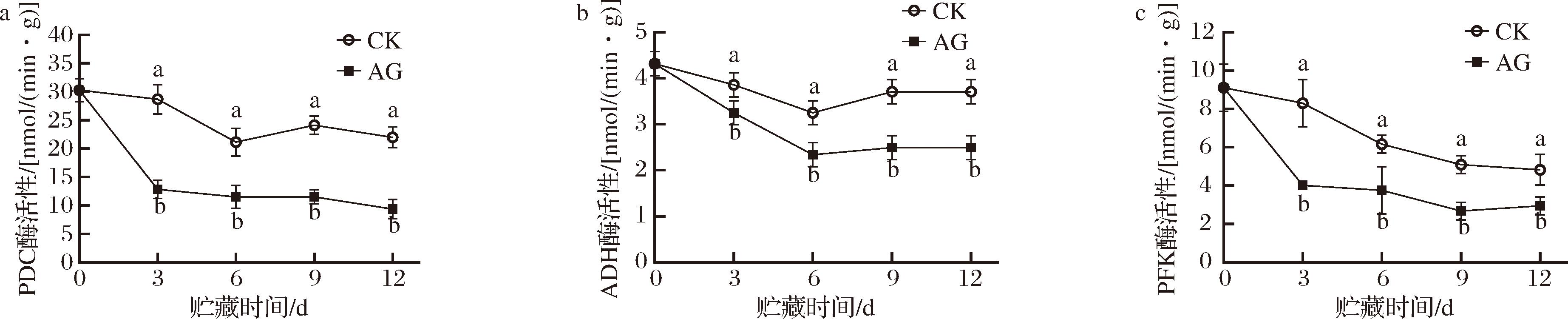
a-PDC酶活性;b-ADH酶活性;c-PFK酶活性
图5 AG处理对青脆李果实PDC、ADH、PFK酶活性的影响
Fig.5 Effect of AG treatment on the enzyme activities of PDC, ADH, and PFK of Qingcui plum fruit
由此可见,AG处理可显著降低PDC、ADH和PFK酶活性,从而抑制EMP和TCA,降低呼吸底物的消耗速率,延缓采后青脆李的成熟和衰老。
2.5 AG处理对采后青脆李果实基因表达量的影响
AG处理对青脆李果实中与能量代谢有关酶的影响可能是通过相关基因调控的,因此,本研究进一步在转录组数据中关注了PDC、ADH、PFK的基因表达量的变化。如图6-a、图6-b所示,CK组果实PDC基因表达量和ADH基因表达量呈现先上升后下降的趋势,而AG组果实基因表达量则一直处于较高水平。在贮藏第6天,经过AG处理后的果实的基因表达量显著高于CK组(P<0.05)。出现该结果的原因可能是PDC、ADH酶活性受到多个基因的调控,从而表现出与酶活性结果不一致的现象。如图6-c所示, CK组果实PFK基因表达量呈现先下降后上升的趋势,而AG组果实基因表达量则呈现下降趋势。在贮藏同一时间,AG处理后果实的基因表达量显著低于CK组果实(P<0.05),在贮藏第6天,CK组PFK基因表达量是AG组的1.76倍(P<0.05),表明AG处理能影响相关基因表达量而降低与糖酵解限速酶PFK的活性,进而抑制糖酵解过程而延缓果实的成熟衰老。
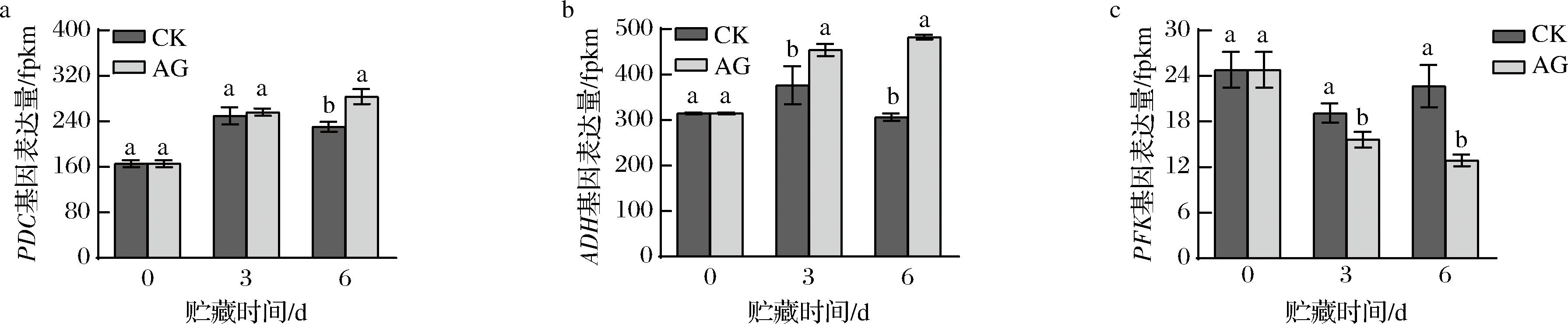
a-PDC基因表达量;b-ADH基因表达量;c-PFK基因表达量
图6 AG处理对青脆李果实PDC、ADH和PFK基因表达量的影响
Fig.6 Effect of AG treatment on gene expression of Qingcui plum fruit
3 结论与讨论
课题组前期研究表明,5 g/L AG处理可延缓采后青脆李果实颜色的改变以及抑制青脆李果实的软化,尤其是可以显著降低采后青脆李果实的呼吸速率,说明5 g/L AG处理可能通过降低贮藏期间青脆李果实的呼吸速率,有效延缓采摘后青脆李果实成熟衰老的进程,减少青脆李果实在贮藏过程中的品质劣变现象[23]。
在果蔬的贮藏过程中,呼吸底物、能量物质和吡啶核苷酸的含量会发生明显变化,同时相关酶活性也会改变,进而影响果蔬成熟衰老进程。植物组织中进行能量代谢的基本过程是呼吸代谢,而糖酸含量不仅与果蔬风味密切相关,还参与果实的基础代谢进行能量供给[26]。葡萄糖、果糖、蔗糖作为其直接或主要底物参与PPP、EMP和TCA,而丙酮酸、柠檬酸、苹果酸是参与EMP和TCA的重要有机酸[27],其含量的高低会影响呼吸代谢的强度。本实验研究发现,AG处理能够降低采后青脆李果实的可溶性糖和有机酸的降解速率,保持果实采后的品质,同时呼吸底物的消耗减少,果实呼吸强度较低。
在果蔬的贮藏过程中,能量物质的产生速度和含量会发生明显变化,衰老与能量物质密切相关[5],ATP合成量不足以维持果实正常的代谢活动,果实就会衰老,而ATP含量保持在较高水平,便可延缓衰老进程。能荷表示细胞中可利用能量的一个量化指标,其值越高果实成熟衰老水平越低。本实验中,AG处理促进采后青脆李果实ATP含量的上升并抑制果实能荷的下降,这可能是因为AG处理降低了果实的呼吸强度,呼吸速率减弱,但是同时消耗ATP的过程也减少,最终导致ATP的积累,果实中较高的ATP含量满足贮藏过程中青脆李的能量供应,保持青脆李果实良好的品质。吡啶核苷酸在果实中参与电子传递以及呼吸代谢途径的调节,其含量高低与果实的成熟衰老密切相关。NAD参与EMP和TCA而得到电子形成NADH,NADP在PPP中得到电子形成NADPH。NAD与NADP含量的改变会导致果实所参与呼吸代谢途径的占比不同[29]。在本实验中,AG处理可降低采后青脆李果实的NAD含量,同时减慢NADPH降低的速度,推测AG处理会抑制EMP和TCA,并且促进PPP的进行。而PPP属于呼吸代谢的支路,其呼吸强度会比以EMP和TCA为主要途径的低,使呼吸速率降低,呼吸底物消耗减少,从而延长果实的贮藏寿命。
PDC、ADH和PFK是EMP和TCA过程的关键酶和限速酶,影响着呼吸代谢的类型和速度。本实验中,AG处理能够显著降低PDC、ADH和PFK的活性,而PDC和ADH活性的升高,常伴随着乙醇和乙醛的积累[14],AG处理后则抑制了丙酮酸向乙醇、乙醛的转化;PFK活性的降低进一步抑制了EMP,呼吸底物的消耗速率降低,延缓了果实的成熟和衰老。而酶活性的调控受到基因的控制,进而分析相关基因表达量,得到AG处理降低了PFK基因的表达量进而降低PFK的酶活性,从而抑制EMP和TCA而延缓果实的成熟衰老。
上述结果表明,AG主要通过控制果实呼吸代谢途径中可溶性糖和有机酸的降解速度、ATP合成速率和能荷高低、NAD和NADPH含量以及相关酶活性和有关基因表达量的高低,以此维持青脆李果实内部较高的糖酸含量和能量供应,从而延缓青脆李果实的成熟衰老进程,延长果实的贮藏期和货架期。
[1] 冯志宏, 李建华, 张立新, 等. 贮藏温度和包装对青脆李保鲜效果的影响[J]. 保鲜与加工, 2010, 10(4): 25-27.FENG Z H, LI J H, ZHANG L X, et al. Effects of different temperatures and film packaging on storability of Prunus americana[J]. Storage and Process, 2010, 10(4): 25-27.
[2] 陈鸥, 吴雪莹, 邓丽莉, 等. 1-甲基环丙烯处理对采后李果实硬度变化的影响机制[J]. 食品科学, 2020, 41(3): 185-191.CHEN O, WU X Y, DENG L L, et al. Effect of 1-methylcyclopropene treatment on firmness change of postharvest plum fruit and underlying mechanism[J]. Food Science, 2020, 41(3): 185-191.
[3] USENIK V, STAMPAR F, KASTELEC D. Indicators of plum maturity: When do plums become tasty?[J]. Scientia Horticulturae, 2014, 167: 127-134.
[4] 陈力维, 令阳, 邓丽莉, 等. L-半胱氨酸处理对采后青脆李果实苯丙烷代谢的影响[J]. 农业工程学报, 2020, 36(13): 257-263.CHEN L W, LING Y, DENG L L, et al. Effects of L-cysteine treatment on phenylpropanoid metabolism of postharvest “Qingcui” plum fruit[J]. Transactions of the Chinese Society of Agricultural Engineering, 2020, 36 (13): 257-263.
[5] JIANG Y M, JIANG Y L, QU H X, et al. Energy aspects in ripening and senescence of harvested horticulturalcrops[J]. Stewart Postharvest Review, 2007, 3(2): 1-5.
[6] SUN B L, KUANG X Y, LIN H T, et al. The role of respiratory metabolism in chilling injury development of Chinese olive fruit during cold storage[J]. Postharvest Biology and Technology, 2023, 205: 112489.
[7] 刘佳, 薛惠云, 李倩, 等. 不同年代小麦品种根系形态差异性分析[J]. 山东农业科学, 2021, 53(3): 15-21.LIU J, XUE H Y, LI Q, et al. Difference analysis of root morphology of wheat varieties among different eras[J]. Shandong Agricultural Sciences, 2021, 53(3): 15-21.
[8] 陈莲, 王璐璐, 林河通, 等. 1-MCP延缓采后台湾青枣果实衰老及其与能量代谢的关系[J]. 热带作物学报, 2017, 38(1): 175-182.CHEN L, WANG L L, LIN H T, et al. Delaying senescence of harvested Ziziphus mauritiana Lamk fruit by postharvest 1-methylcyclopropene (1-MCP) treatment and its relation to energy metabolism[J]. Chinese Journal of Tropical Crops, 2017, 38(1): 175-182.
[9] 李辉, 林毅雄, 林河通, 等. 1-MCP延缓采后“油木奈”果实衰老及其与能量代谢的关系[J]. 现代食品科技, 2015, 31(4): 121-127.LI H, LIN Y X, LIN H T, et al. Delayed senescence in harvested ‘Younai’ plums induced by 1-MCP treatment and its relation to energy metabolism[J]. Modern Food Science and Technology, 2015, 31(4): 121-127.
[10] 吕国昊, 赵杰堂. 采后果蔬能量状态的调控措施研究进展[J]. 农产品加工, 2021(15):59-64.LYU G H, ZHAO J T. Progress in the regulation of energy status of postharvest fruits and vegetables[J]. Farm Products Processing, 2021(15): 59-64.
[11] HOWELL D P G, LEVIN E A, SPRINGER A L, et al. Mapping a common interaction site used by Plasmodium falciparum Duffy binding-like domains to bind diverse host receptors[J]. Molecular Microbiology, 2008, 67(1): 78-87.
[12] 于乔乔. 低温胁迫下玉米幼苗光合及呼吸代谢特性的研究[D]. 哈尔滨:东北农业大学,2021. YU Q Q. Study on the Characteristics of photosynthesis and respiratory metabolism of maize seedlings under low temperature stress[D]. Harbin: Northeast Agricultural University, 2021.
[13] 于超, 李国龙, 孙亚卿, 等. 甜菜块根生长发育中呼吸代谢的特性研究[J]. 作物学报, 2023, 49(12): 3377-3386.YU C, LI G L, SUN Y Q, et al. Characteristics of respiratory metabolism in growth and development of sugar beet taproot[J]. Acta Agronomica Sinica, 2023, 49(12): 3377-3386.
[14] 王晶, 洪敏, 冯雨, 等. 外源褪黑素对'爱媛38号'柑橘品质和乙醇代谢的影响[J]. 食品与发酵工业, 2019, 45(21): 147-154.WANG J, HONG M, FENG Y, et al. Effects of exogenous melatonin treatment on fruit quality and ethanol metabolism of ‘Aiyuan 38’ citrus[J]. Food and Fermentation Industries, 2019, 45(21): 147-154.
[15] 刘竟运, 林育钊, 范中奇, 等. 活性氧在采后果蔬品质劣变中的作用及其控制技术研究进展[J]. 亚热带农业研究, 2020, 16(1): 52-59.LIU J Y, LIN Y Z, FAN Z Q, et al. Research progress on the role of reactive oxygen species in quality deterioration of harvested fruits and vegetables and its control technologies[J]. Subtropical Agriculture Research, 2020, 16(1): 52-59.
[16] 陈梦茵, 林河通, 洪延康, 等. DNP和ATP对Phomopsis longanae Chi侵染的龙眼果实病害发生、能荷状态和呼吸代谢的调控[J]. 现代食品科技, 2015, 31(5): 49-58;89.CHEN M Y, LIN H T, HONG Y K, et al. Regulation of 2,4-dinitrophenol and adenosine triphosphate on disease development, energy status, and respiratory metabolism of Phomopsis longanae Chi-infected longan fruit[J]. Modern Food Science and Technology, 2015, 31(5): 49-58;89.
[17] LIN Y X, LIN Y F, CHEN Y H, et al. Hydrogen peroxide induced changes in energy status and respiration metabolism of harvested longan fruit in relation to pericarp browning[J]. Journal of Agricultural and Food Chemistry, 2016, 64(22): 4627-4632.
[18] 秦丽霞, 李学宝, 许文亮. 植物阿拉伯半乳聚糖蛋白AG糖链的合成[J]. 植物生理学报, 2018, 54(8): 1263-1271.QIN L X, LI X B, XU W L. Biosynthesis of arabinogalactan (AG) polysaccharides of arabinogalactan-proteins in plants[J]. Plant Physiology Journal, 2018, 54(8): 1263-1271.
[19] LESZCZUK A, CYBULSKA J, SKRZYPEK T, et al. Properties of arabinogalactan proteins (AGPs) in apple (Malus × Domestica) fruit at different stages of ripening [J]. Biology, 2020, 9(8): 225.
[20] SHI Y N, LI B J, SU G Q, et al. Transcriptional regulation of fleshy fruit texture[J]. Journal of Integrative Plant Biology, 2022, 64(9): 1649-1672.
[21] 潘越, 李婷婷, 吴彩娥. 低温等离子体处理对小白杏细胞壁代谢及软化特性的影响[J]. 食品科学, 2024, 45(8):168-175.PAN Y, LI T T, WU C E. Effect of low-temperature plasma on cell wall metabolism and softening characteristics of xiaobai apricot[J]. Food Science, 2024, 45(8):168-175.
[22] LESZCZUK A, SZCZUKA E, WYDRYCH J, et al. Changes in arabinogalactan proteins (AGPs) distribution in apple (Malus x domestica) fruit during senescence[J]. Postharvest Biology and Technology, 2018, 138: 99-106.
[23] 曾昌平, 汪于波, 李佳艳, 等. 阿拉伯半乳聚糖处理对采后青脆李果实贮藏特性的影响[J]. 食品工业科技, 2023, 44(17): 383-391.ZENG C P, WANG Y B, LI J Y, et al. Effects of arabinogalactan treatment on storage characteristic of postharvest Qingcui plum[J]. Science and Technology of Food Industry, 2023, 44(17): 383-391.
[24] 计楠, 曾凯芳, 邓丽莉. 塔罗科血橙果肉色素及糖酸分布规律及其关联关系分析[J]. 食品与发酵工业, 2023, 49(13): 230-238.JI N, ZENG K F, DENG L L. Regularities of distribution and association relationships of pigment, sugar, and acid in pulp of Tarocco blood orange[J]. Food and Fermentation Industries, 2023, 49(13): 230-238.
[25] 潘俨. 库尔勒香梨果实发育及采后糖代谢与呼吸代谢关系的研究[D]. 乌鲁木齐:新疆农业大学, 2016.PAN Y. Study on the relationship between fruit development, postharvest sugar metabolism and respiratory metabolism of Korla fragrant pear[D]. Urumqi: Xinjiang Agricultural University, 2016.
[26] GROSS K C, PHARR D M. Cucumber fruit sucrose synthase isozymes[J]. Phytochemistry, 1982, 21(6): 1241-1244.
[27] WANG Y, ZHAO Y X, WANG B, et al. Soluble sugars, organic acids and energy metabolism involved in the wound healing of muskmelons elicited by benzothiadiazole[J]. Postharvest Biology and Technology, 2023, 199: 112277.
[28] 林丽莎. 1-MCP处理延缓采后芙蓉李果实后熟衰老及其生理机制研究[D]. 福州: 福建农林大学, 2015.LIN L S. Study on 1-MCP treatment delaying postharvest senescence of Hibiscus plum fruit and its physiological mechanism[D]. Fuzhou: Fujian Agriculture and Forestry University, 2015.
[29] 顾采琴, 朱冬雪, 李棋. 草莓果实采后NAD激酶活性与NAD(H)、NADP(H)含量及活性氧代谢的关系[J].中国农业科学, 2007, 40(2):352-357.GU C Q, ZHU D X, LI Q. Relationship between NAD kinase and NAD(H), NADP(H) and active oxygen during ripening and senescence of postharvested strawberry fruit[J]. Scientia Agricultura Sinica, 2007, 40(2):352-357.