D-阿洛酮糖(D-allulose)是D-果糖C3位置的差向异构体,甜度仅为蔗糖的70%,热量仅为0.4 kcal/g[1],具有改善脂肪堆积[2]、预防糖尿病[3]、调节血脂[4]等功效,在食品中进行添加可以改善食品风味或产品特性。目前,D-阿洛酮糖主要通过周期短、成本低、易分离、污染小的生物转化法进行生产[5-6],该法利用D-阿洛酮糖3-差向异构酶(D-allulose 3-epimerase,DAE)纯酶或产DAE工程菌通过全细胞催化从D-果糖到D-阿洛酮糖的转化反应。其中,使用全细胞催化转化反应能够简化生产步骤,降低生产成本。但DAE催化转化D-阿洛酮糖的反应温度普遍较高[5],且DAE在较高温度下容易失活,难以重复利用[7]。而固定化细胞技术可通过化学或物理手段构建固定化体系,为菌体细胞及其中包含的DAE提供保护,改善其稳定性,提高重复利用能力[8-9],降低D-阿洛酮糖生产成本。
在目前的固定化相关研究中,海藻酸钠、壳聚糖、硅藻土等常见的固定化材料都存在制备复杂耗时、所得固定化酶或固定化细胞活性回收率低等弊端,而使用沸石咪唑骨架-8(zeolitic imidazolate frameworks-8, ZIF-8)材料则有可能解决上述问题。ZIF-8是由Zn2+和2-甲基咪唑配位形成的金属-有机多孔纳米材料[10-12],具有孔隙多、易于制备、稳定性高、生物相容性高、毒性低等优势[13-14],能够同时保证生物催化剂的稳定性和生物活性。目前,已有一些关于ZIF-8用于脂肪酶、淀粉酶等食品工业中常见酶固定化的相关研究,但将其用于固定化细胞的研究较少。梁鑫等[15]使用ZIF-8材料原位自封装皱褶假丝酵母源脂肪酶制备固定化脂肪酶,在保持较高催化活性的同时显著提高了脂肪酶的温度稳定性;芦瑜涵等[16]利用ZIF-8作为固定化材料,利用原位自封装法制备得到固定化米根霉源脂肪酶发现,制备的固定化酶由于ZIF-8所具有的疏水性和多级孔特性而表现出比纯米根霉源脂肪酶更高的酶活力及更好的碱稳定性、温度稳定性和贮藏能力。![]() 等[17]以ZIF-8作为固定化材料制备固定化α-淀粉酶,发现与游离酶相比,制备的固定化酶具有较高的pH值稳定性、热稳定性和可重复性,并拥有优异的长期贮存稳定性。
等[17]以ZIF-8作为固定化材料制备固定化α-淀粉酶,发现与游离酶相比,制备的固定化酶具有较高的pH值稳定性、热稳定性和可重复性,并拥有优异的长期贮存稳定性。
本文以提高重组工程菌参与全细胞催化反应的稳定性及重复利用性为研究目标,以ZIF-8为固定化载体,对实验室前期构建的符合食品安全要求的产DAE重组枯草芽孢杆菌(Bacillus subtilis)进行固定化研究,通过单因素/正交试验对固定化细胞的制备条件进行优化,以提高产DAE重组B.subtilis的催化反应稳定性,得到具有良好重复利用性的固定化细胞B.subtilis-DAE@ZIF-8,可为D-阿洛酮糖工业化生产与重组工程菌的固定化提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
实验菌株为本实验室构建的重组枯草芽孢杆菌WB600-pMA5-CcDAE菌株,所表达DAE来自Clostridium cellulolyticum H10,Genbank登录号:NC_011898。
1.1.2 培养基
LB培养基(g/L):胰蛋白胨 10、酵母浸粉 5、氯化钠 10,pH值自然。
LB+Kan+培养基(g/L):在LB培养基的基础上加入硫酸卡那霉素,终质量浓度为50 mg/L。
发酵培养基(g/L):蔗糖30,玉米浆干粉54,磷酸氢二钾(K2HPO4)3,Ca2+ 0.5 mmol/L,pH值7.0。
以上培养基灭菌条件为121 ℃,20 min。
1.2 仪器与设备
Agilent 1200高效液相色谱仪,Agilent;5 L自动控制发酵罐,上海百仑生物科技有限公司;Sugar-Pak I Column色谱柱,Waters公司;LS-B50 L 立式蒸汽压力锅,上海华线医用核子仪器有限公司;场发射扫描电子显微镜FEI Apreo,Thermo Fisher公司;多晶粉末X射线衍射仪TD-3500,丹东通达科技有限公司;傅里叶红外光谱仪IS50,Nicolet公司。
1.3 实验方法
1.3.1 菌株培养方法
1.3.1.1 菌种活化及种子培养
将保藏在-80 ℃的重组B.subtilis接种于LB+Kan+液体培养基,37 ℃培养12 h,转接于LB+Kan+固体平板,37 ℃静置培养12 h。
将平板活化后的重组B.subtilis挑取单菌落,接种于10 mL LB+Kan+培养基中,37 ℃、200 r/min过夜培养,得到一级种子液。
将一级种子液按照10%(体积分数)接种量,转接至200 mL种子培养基(LB+Kan+培养基),37 ℃、200 r/min培养至对数期,得到二级种子液。
1.3.1.2 5 L发酵罐发酵
利用5 L发酵罐进行发酵,接种量为10%(体积分数)。发酵条件为:温度37 ℃;溶氧40%,转速与溶氧联动以确保溶氧保持在设定值;pH值7.0,通过流加13%氨水和13%乙酸使pH值保持在设定值,连续发酵24 h,离心,洗涤细胞,回收菌体。
1.3.2 B.subtilis-DAE@ZIF-8的制备
重组B.subtilis离心收集菌体(10 000 r/min,4 ℃,10 min),磷酸缓冲液(pH值7.0,50 mmol/L)洗涤3次。向10 mL 240 mmol/L 2-甲基咪唑中加入适量湿菌体,混匀后加入10 mL 80 mmol/L乙酸锌溶液,混匀后室温静置1 h,离心回收。利用上述相同方法制备未固定重组B.subtilis的纯ZIF-8材料作为对照。
1.3.3 B.subtilis-DAE@ZIF-8制备条件对催化活性的影响
以未固定化的游离菌体比酶活为100%,分别设置不同的Zn2+与2-甲基咪唑摩尔浓度比(1∶1、1∶2、1∶3、1∶4、1∶5、1∶10)、包埋不同菌体量(5、15、25、50、100 g/L)、静置不同合成时间(10、20、30、60、120 min,分别置于室温与低温环境下进行试验),比较各组制备B.subtilis-DAE@ZIF-8的比酶活与活性回收率。
1.3.4 B.subtilis-DAE@ZIF-8制备条件正交试验优化
在确定各制备条件对B.subtilis-DAE@ZIF-8催化活性的影响后,利用正交试验对B.subtilis-DAE@ZIF-8的制备条件进一步进行优化。Zn2+与2-甲基咪唑摩尔浓度比、菌体添加量、静置合成时间3个因素较优区域中各选取3个水平,以活性回收率为指标,采用L9(34)正交试验设计考察上述3个因素对固定化细胞B.subtilis-DAE@ZIF-8催化活性的影响。各因素实验水平见表1。
表1 固定化细胞B.subtilis-DAE@ZIF-8制备条件优化正交试验水平
Table 1 Orthogonal test level of immobilized cell B.subtilis-DAE@ZIF-8 preparation process
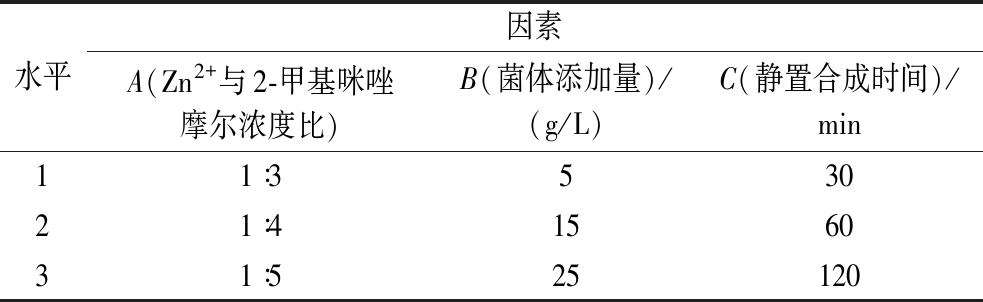
水平因素A(Zn2+与2-甲基咪唑摩尔浓度比)B(菌体添加量)/(g/L)C(静置合成时间)/min11∶353021∶4156031∶525120
1.3.5 B.subtilis-DAE@ZIF-8表征方法
样品准备:分别用PB缓冲液(pH值7.0 100 mmol/L)对游离细胞和B.subtilis-DAE@ZIF-8洗涤3次,利用2.5%(体积分数)戊二醛固定样品8 h。PB缓冲液洗去戊二醛后,使用50%~90%(体积分数)的乙醇溶液对样品进行逐级脱水,干燥至恒重。
检测方法:使用扫描电子显微镜(scanning electron microscope,SEM)分析样品形貌;傅里叶红外光谱(Fourier transform infrared,FT-IR)分析结构组成,扫描范围为400~3 000 cm-1;X-射线衍射(X-ray diffraction,XRD)对样品进行分析,扫描范围为5°~40°,扫描时间0.02 s。
1.3.6 B.subtilis-DAE@ZIF-8催化性质研究
a)温度对B.subtilis-DAE@ZIF-8催化性质影响与温度稳定性研究:分别取等量游离细胞与B.subtilis-DAE@ZIF-8在不同温度(45~70 ℃)下进行转化反应,比较二者的比酶活与活性回收率。分别在50、60、70 ℃条件下,取等量游离菌体与B.subtilis-DAE@ZIF-8保温10 h,在不同时间点取样,比较各组不同保温时间的相对酶活。
b)pH值对B.subtilis-DAE@ZIF-8催化性质影响与pH值稳定性研究:分别取等量的游离菌体和B.subtilis-DAE@ZIF-8在不同pH值(3.0~9.0)的果糖反应体系中进行转化反应,比较二者的比酶活与酶活力回收率。在pH值5.5、7.5、9.5缓冲液中分别取等量游离菌体与B.subtilis-DAE@ZIF-8,4 ℃下保存10 h,在不同时间点取样,比较各组不同保存时间的相对酶活。
1.3.7 B.subtilis-DAE@ZIF-8重复利用性研究
取适量B.subtilis-DAE@ZIF-8与等量游离菌体分别催化转化反应。每次反应结束后,用蒸馏水清洗B.subtilis-DAE@ZIF-8和游离细胞3次,连续进行转化反应10次,以首次反应的酶活力为100%,分别计算每一批次的活性回收率。
1.3.8 指标检测方法
酶活力测定:离心回收固定化细胞,用PB缓冲液(50 mmol/L,pH=7)洗涤,将收集的固定化细胞加入预热后的反应体系中进行酶促反应。
酶促反应体系:果糖终质量浓度为500 g/L;pH=7的磷酸缓冲液终浓度50 mmol/L;Co2+终浓度1 mmol/L。在55 ℃下预热反应体系,预热后的酶促反应体系中加入干重0.1 g固定化细胞,55 ℃反应10 min。之后沸水浴10 min终止反应。反应液低温离心(4 ℃,10 000 r/min,10 min)取上清液,稀释后进行HPLC检测。
D-阿洛酮糖HPLC检测方法:反应液样品低温离心(10 000 r/min,4 ℃,10 min),取上清液,稀释20倍后进行HPLC检测。采用液相色谱柱(Sugar-Pak I Column 色谱柱,Waters);流动相为超纯水,流速为0.6 mL/min;柱温80 ℃,检测器为示差折光检测器。
酶活力定义:在55 ℃反应条件下,1 min内催化D-果糖产生1 μmol的D-阿洛酮糖所需要的酶量定义为1个酶活力单位。固定化细胞的比酶活力按照式(1)计算:
比酶活![]()
(1)
式中:A为固定化细胞中DAE的酶活力,U;mi为固定化细胞干重,g。
1.3.9 活性回收率与相对酶活计算
B.subtilis-DAE@ZIF-8的活性回收率按照式(2)计算:
酶活回收率![]()
(2)
式中:Ai为B.subtilis-DAE@ZIF-8比酶活,U/g;As为等量游离细胞比酶活,U/g。
B.subtilis-DAE@ZIF-8的相对酶活按照式(3)计算:
相对酶活![]()
(3)
式中:Aht为保温时间为ht时的样品比酶活,U/g;Aht0为保温时间为0时的样品比酶活,U/g。
1.4 数据处理与统计分析
实验重复3次,数据以“平均值±标准偏差”(standard deviation, SD)表示。使用SPSS中的Duncan方法对数据进行方差分析与多重测试分析,检验水准为0.05。
2 结果与分析
2.1 B.subtilis-DAE@ZIF-8的制备与表征
利用共沉淀法制备ZIF-8材料与重组枯草芽孢杆菌复合体B.subtilis-DAE@ZIF-8[13, 15-17]。将重组细胞与2-甲基咪唑混匀后,加入乙酸锌,体系中迅速出现白色沉淀,即B.subtilis-DAE@ZIF-8复合体。随着静置时间延长,该复合体会逐步沉降于容器底部。为确定该沉淀是ZIF-8与菌体结合成B.subtilis-DAE@ZIF-8,对制备得到的复合体沉淀利用SEM、FT-IR和XRD进行表征分析。
2.1.1 B.subtilis-DAE@ZIF-8 SEM观察
使用SEM对B.subtilis-DAE@ZIF-8的形态进行观察,结果如图1所示。
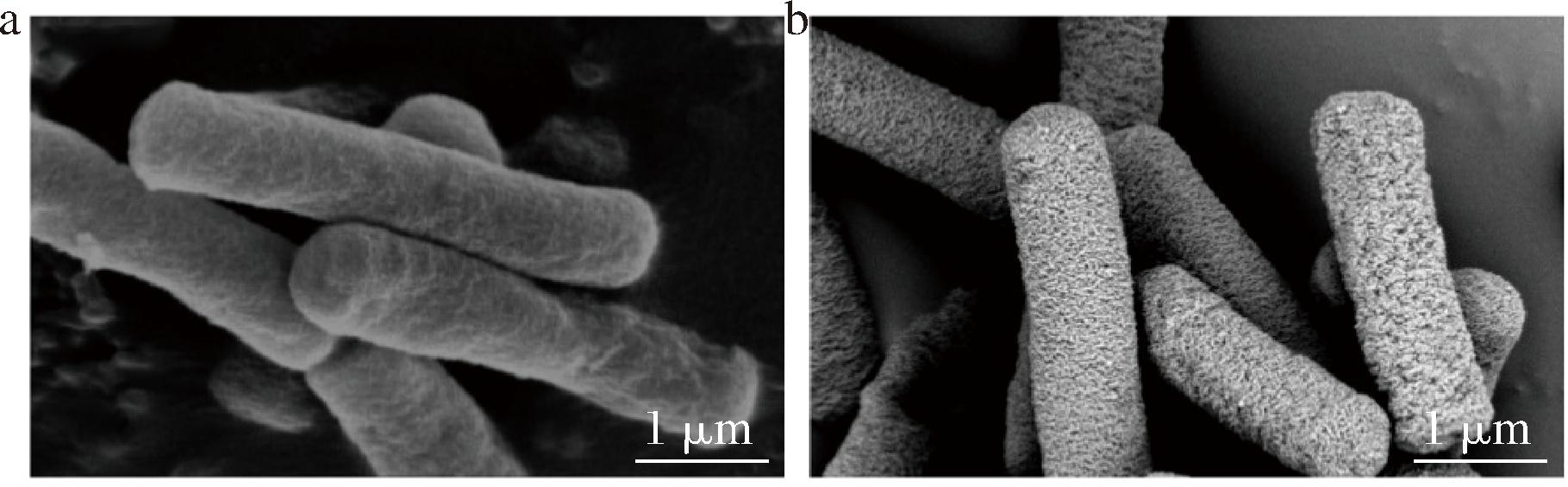
a-重组B.subtilis SEM图;b-固定化细胞SEM图
图1 重组枯草芽孢杆菌与固定化细胞SEM图
Fig.1 SEM images of B.subtilis-DAE and B.subtilis-DAE@ZIF-8
与未固定的重组B.subtilis(图1-a)相比,制备得到的B.subtilis-DAE@ZIF-8(图1-b)表面明显可见沉积涂覆上的粗糙ZIF-8材料层,说明乙酸锌和2-甲基咪唑成功合成了ZIF-8多孔框架材料并涂覆在菌体表面得到了B.subtilis-DAE@ZIF-8。
2.1.2 B.subtilis-DAE@ZIF-8 FT-IR分析
利用FT-IR对纯ZIF-8材料、重组B.subtilis和B.subtilis-DAE@ZIF-8进行检测,结果如图2所示。
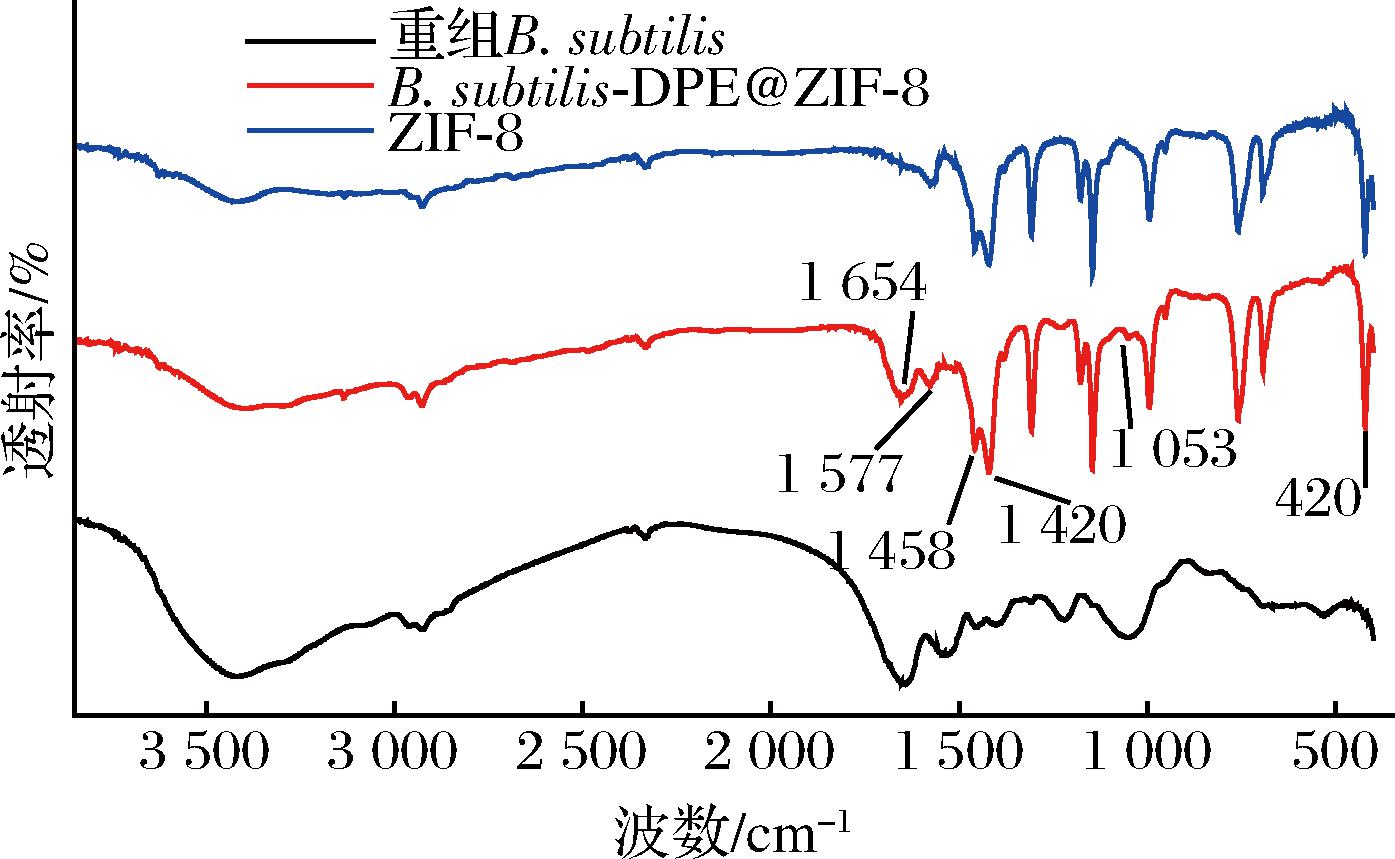
图2 重组枯草芽孢杆菌、B.subtilis-DAE@ZIF-8和ZIF-8 FT-IR分析图谱
Fig.2 FT-IR spectra of B.subtilis-DAE, B.subtilis-DAE@ZIF-8, and ZIF-8
固定化细胞B.subtilis-DAE@ZIF-8在420 cm-1处出现ZIF-8中具有代表性的Zn-N键伸缩振动吸收峰;在1 458 cm-1和1 420 cm-1处出现了与咪唑环拉伸相关的特征吸收峰;在1 577 cm-1处出现了C![]() N伸缩振动吸收峰,在1 053 cm-1附近有醚键伸缩振动峰,在1 654 cm-1处有—O
N伸缩振动吸收峰,在1 053 cm-1附近有醚键伸缩振动峰,在1 654 cm-1处有—O![]() C—C—NH中C
C—C—NH中C![]() O伸缩振动吸收峰(图2)。这些特征吸收峰出现的位置和文献中所示ZIF-8和B.subtilis特征吸收峰出现位置基本相同[18-19]。结合SEM表征结果(图1),证明成功制备了包覆有ZIF-8的固定化细胞B.subtilis-DAE@ZIF-8。
O伸缩振动吸收峰(图2)。这些特征吸收峰出现的位置和文献中所示ZIF-8和B.subtilis特征吸收峰出现位置基本相同[18-19]。结合SEM表征结果(图1),证明成功制备了包覆有ZIF-8的固定化细胞B.subtilis-DAE@ZIF-8。
2.1.3 B.subtilis-DAE@ZIF-8 XRD分析
利用XRD对单一ZIF-8和B.subtilis-DAE@ZIF-8样品进行分析,结果如图3所示。
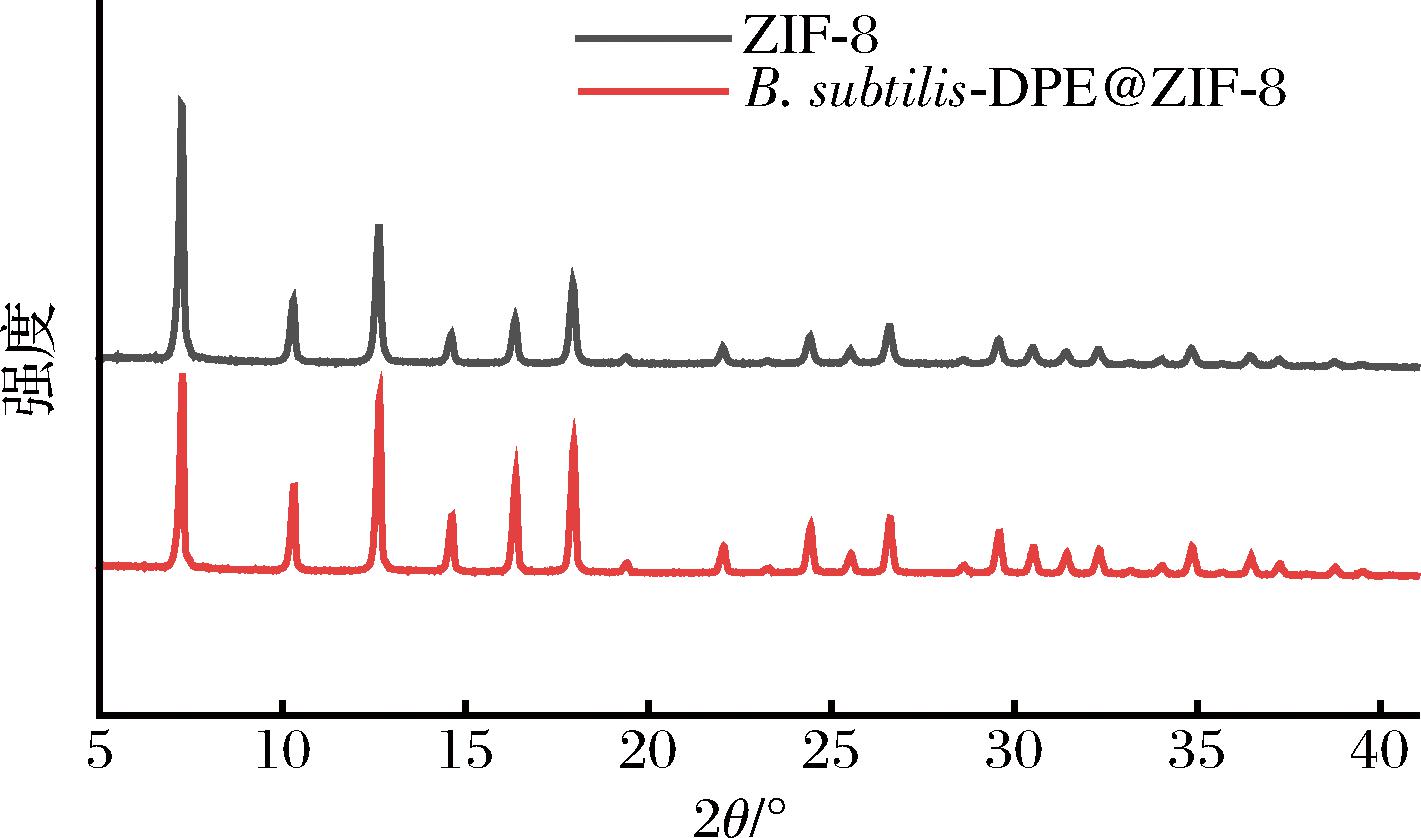
图3 ZIF-8和B.subtilis-DAE@ZIF-8 XRD分析图
Fig.3 XRD patterns of ZIF-8 and B.subtilis-DAE@ZIF-8
被ZIF-8多孔框架材料包裹的重组B.subtilis细胞在2θ=7.26°、10.32°、12.66°、17.96°处有4个明显的衍射峰,这些衍射峰分别对应于(011)、(112)、(022)和(222)点的晶面,这与文献中报道的ZIF-8的标准XRD图谱基本一致,说明利用该方法可以成功合成ZIF-8材料[20]。将B.subtilis-DPE@ZIF-8的XRD图谱与制备的纯ZIF-8材料进行比对发现,在相同散射角下的衍射峰与纯ZIF-8一致,再结合SEM照片(图1),说明制备的B.subtilis-DAE@ZIF-8表面包覆的材料确为ZIF-8材料,且B.subtilis-DAE@ZIF-8表面晶体结构与纯ZIF-8高度一致。
2.2 固定化条件对B.subtilis-DAE@ZIF-8催化活性的影响
利用1.3.2节方法制备固定化细胞,测定其比酶活为273.68 U/g,以游离细胞的全细胞催化比酶活为100%,B.subtilis-DAE@ZIF-8活性回收率为61.71%,证明利用ZIF-8材料对重组B.subtilis菌体进行包覆固定化后仍然能够保留菌体全细胞的催化活性。为进一步提高B.subtilis-DAE@ZIF-8在全细胞转化中的催化活性,对B.subtilis-DAE@ZIF-8的制备条件进行优化研究。
2.2.1 Zn2+与2-甲基咪唑摩尔浓度比对B.subtilis-DAE@ZIF-8催化活性影响
在制备过程中设置不同的Zn2+与2-甲基咪唑摩尔浓度比,测定不同Zn2+与2-甲基咪唑摩尔浓度比之下B.subtilis-DAE@ZIF-8的全细胞酶活与酶活力回收率。结果如图4所示。
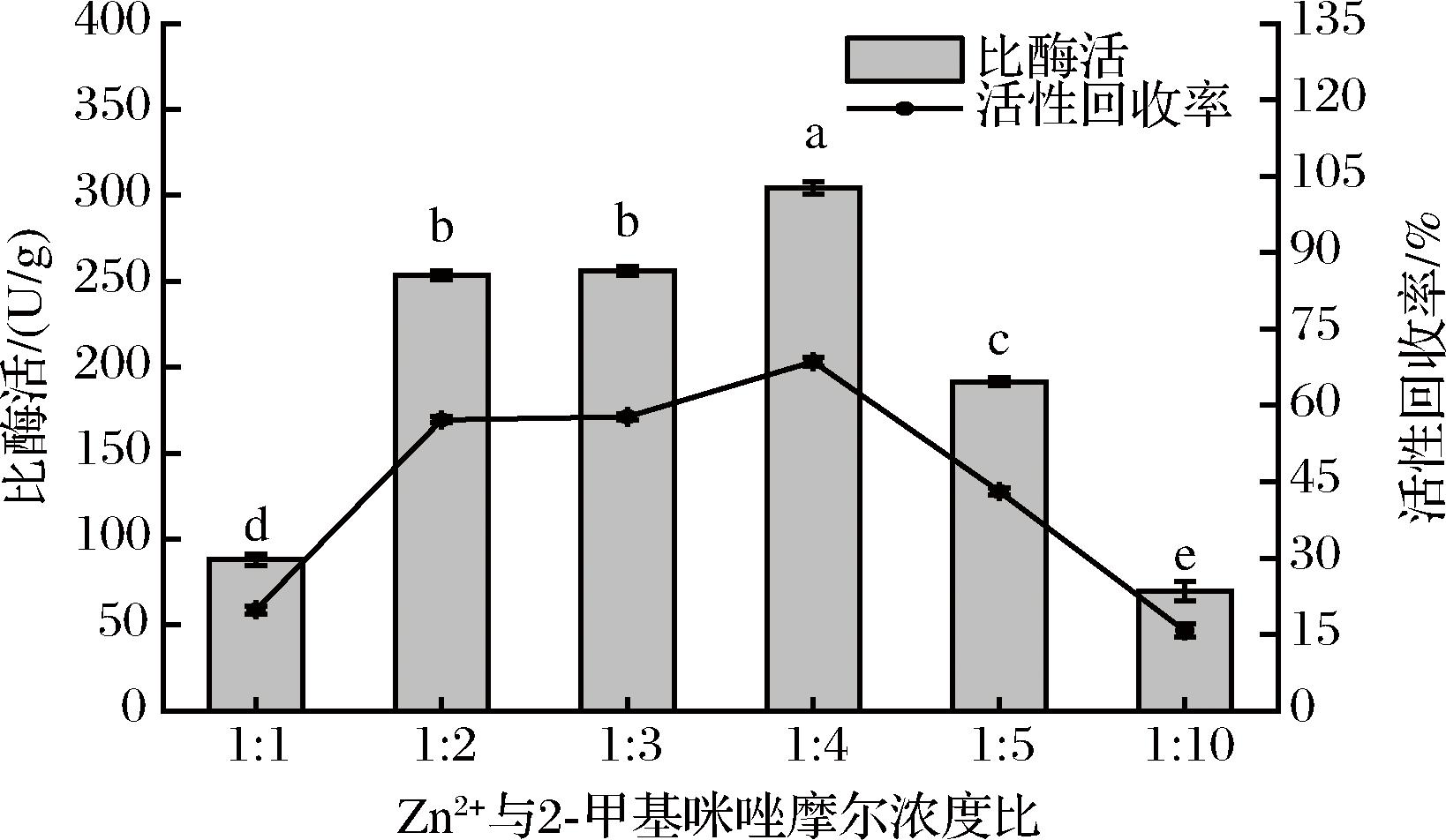
图4 Zn2+与2-甲基咪唑摩尔浓度比对B.subtilis-DAE@ZIF-8催化活性影响
Fig.4 Effect of molar concentration ratio of Zn2+ and 2-methylimidazole on catalytic activity in B.subtilis-DAE@ZIF-8
注:不同小写字母代表差异显著(P<0.05),相同代表差异不显著(P>0.05)(下同)。
由图4可知,Zn2+与2-甲基咪唑摩尔浓度比为1∶4时,B.subtilis-DAE@ZIF-8比酶活达到最大304.24 U/g,此时活性回收率为68.60%。当Zn2+与2-甲基咪唑摩尔浓度比大于或小于1∶4时,B.subtilis-DAE@ZIF-8比酶活与活性回收率显著降低。ZIF-8晶体的形成主要分为成核阶段和晶体生长阶段。首先,过量的2-甲基咪唑去质子化与Zn2+配位形成ZIF-8晶核,然后,晶核迅速增长形成ZIF-8纳米晶体颗粒,最后中性的2-甲基咪唑与带正电的ZIF-8颗粒结合终止反应[21]。Zn2+与2-甲基咪唑摩尔浓度比较小时,产生的晶核较少,2-甲基咪唑过量,阻止ZIF-8晶体生长,导致孔隙率增加、包覆不完整;Zn2+与2-甲基咪唑摩尔浓度比较大时,产生晶核较多,2-甲基咪唑相对不足,晶体相互聚集,包覆不均匀[22]。因此,过小或过大的Zn2+与2-甲基咪唑摩尔浓度比均不利于ZIF-8固定化细胞的形成。
2.2.2 菌体添加量对B.subtilis-DAE@ZIF-8催化活性的影响
在制备过程中添加不同量的菌体,研究不同的菌体添加量对固定化细胞B.subtilis-DAE@ZIF-8的比酶活与活性回收率的影响,结果如图5所示。
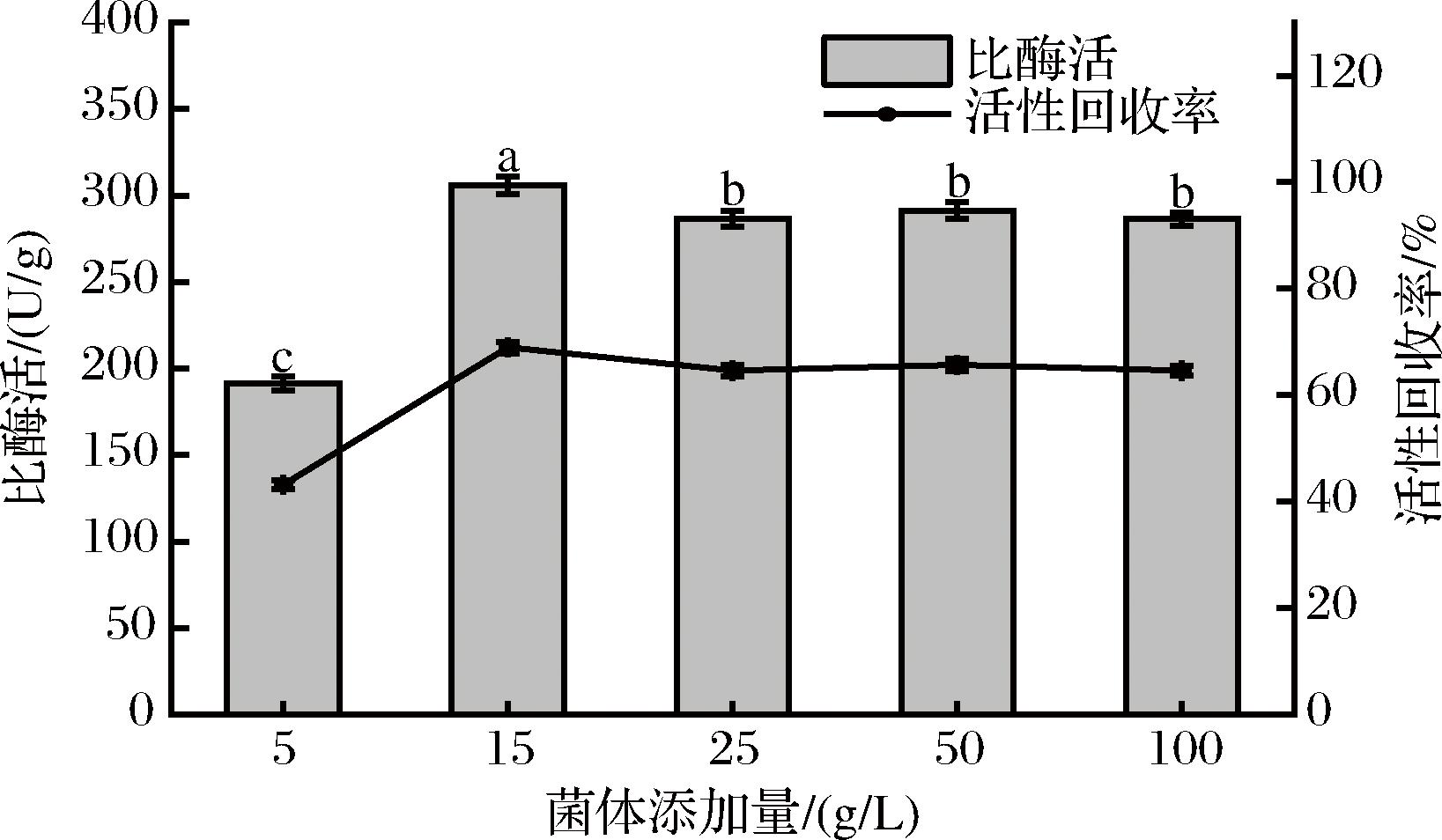
图5 菌体添加量对B.subtilis-DAE@ZIF-8催化活性影响
Fig.5 Effect of the quantity of bacteria introduced on the catalytic activity in B.subtilis-DAE@ZIF-8
B.subtilis-DAE@ZIF-8在菌体添加量为15 g/L时,其比酶活达到305.90 U/g,此时活性回收率为68.97%(图5)。继续添加菌体,B.subtilis-DAE@ZIF-8比酶活与活性回收率均无显著变化。菌体添加量影响ZIF-8材料对菌体的包覆。当菌体较少时,ZIF-8相对过量,包覆过于致密,不利于物质进出;当菌体较多时,ZIF-8不足,导致包覆不完整,保护效果下降。因此,过小或过大的细胞添加量均不利于形成包覆完整、通透性好的ZIF-8涂层。由实验结果可得,当菌体添加量为15 g/L时,包覆效果最好,固定化细胞的比酶活最大。
2.2.3 ZIF-8合成时间与温度对B.subtilis-DAE@ZIF-8催化活性的影响
研究了低温(4 ℃)与室温(24 ℃)条件下,加入2-甲基咪唑与乙酸锌后的静置时间对B.subtilis-DAE@ZIF-8比酶活与活性回收率的影响,结果如图6所示。
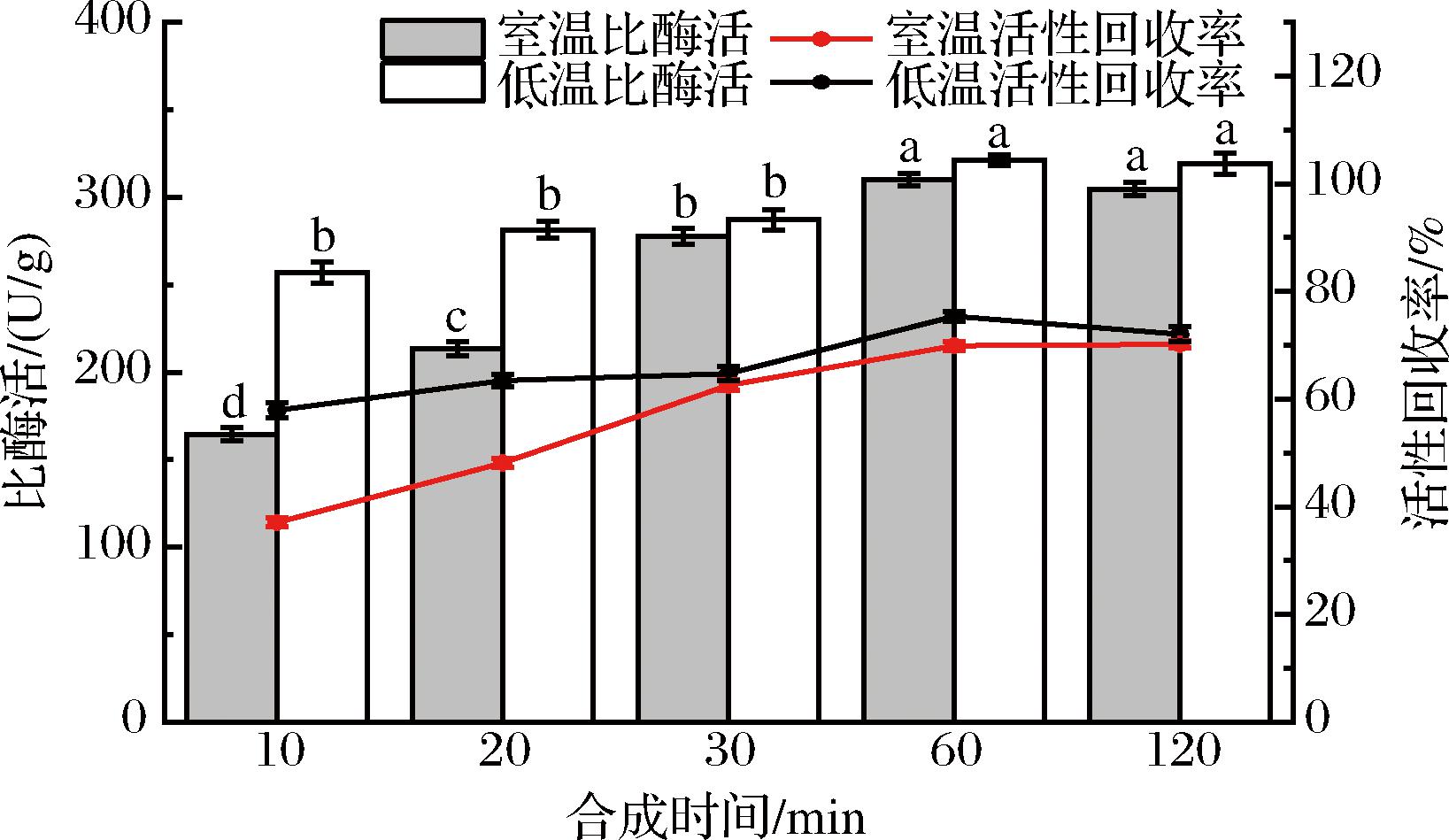
图6 不同静置温度与静置时间对B.subtilis-DAE@ZIF-8催化活性的影响
Fig.6 Effect of different temperatures and settling time on catalytic activity in B.subtilis-DAE@ZIF-8
低温与室温条件下制备的B.subtilis-DAE@ZIF-8比酶活与活性回收率都在1 h时达到最高,但低温条件下制备的B.subtilis-DAE@ZIF-8比酶活与活性回收率均高于室温条件下制备的B.subtilis-DAE@ZIF-8。合成时间与温度会影响固定化材料ZIF-8的粒径,进而影响B.subtilis-DAE@ZIF-8的比酶活与活性回收率。相关研究指出,合成的初始10 min为ZIF-8晶体的成核阶段,约60 min时结晶度最大;合成时间继续延长,ZIF-8的结晶速度不变,粒径稳定增加[21]。时间与温度延长ZIF-8材料的形成与包覆。本研究低温沉淀(4 ℃)制备的ZIF-8固定化细胞比酶活高于室温沉淀(24 ℃)制备的固定化细胞,这可能是由于温度较低时更有利于形成均一稳定的ZIF-8涂层[22-23]。另外,ZIF-8晶核的形成、生长和包覆需要一定时间,当完成ZIF-8涂层对细胞的包覆后,延长时间并不能增加催化效果。本研究发现,4 ℃下沉淀60 min可使比酶活和酶活回收率达到最大。
2.3 B.subtilis-DAE@ZIF-8制备工艺正交试验优化
针对Zn2+与2-甲基咪唑摩尔浓度比、菌体添加量、合成时间3个因素的单因素实验结果,利用正交试验设计对B.subtilis-DAE@ZIF-8制备工艺进一步进行优化。正交试验设计及结果如表2所示。
表2 B.subtilis-DAE@ZIF-8制备条件正交试验结果
Table 2 Orthogonal test results of preparation conditions of B.subtilis-DAE@ZIF-8
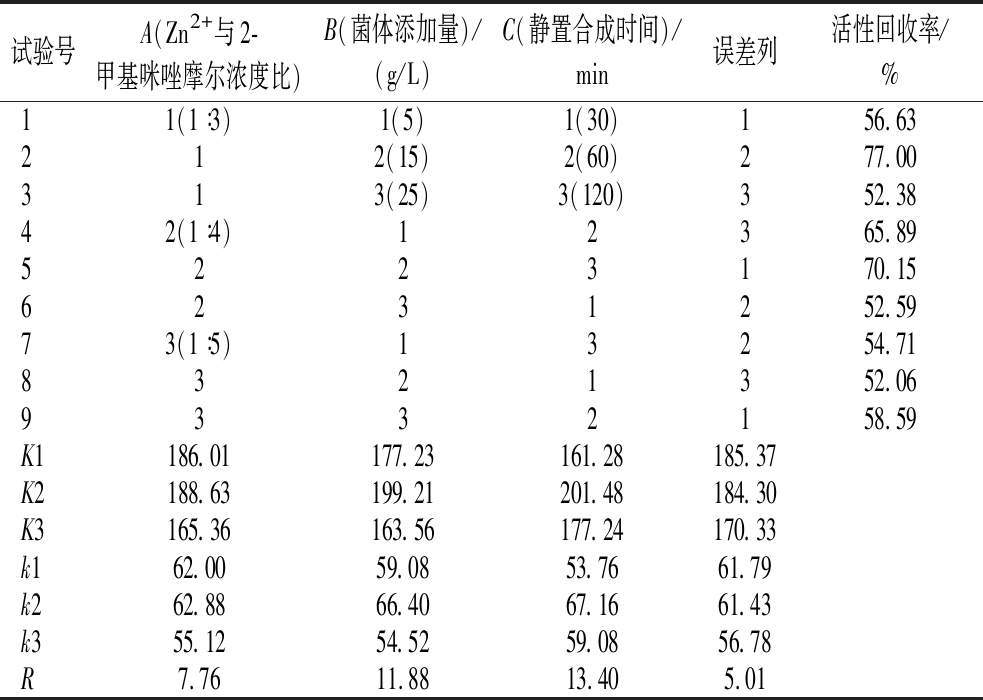
试验号A(Zn2+与2-甲基咪唑摩尔浓度比)B(菌体添加量)/(g/L)C(静置合成时间)/min误差列活性回收率/%11(1∶3)1(5)1(30)156.63212(15)2(60)277.00313(25)3(120)352.3842(1∶4)12365.895223170.156231252.5973(1∶5)13254.718321352.069332158.59K1186.01177.23161.28185.37K2188.63199.21201.48184.30K3165.36163.56177.24170.33k162.0059.0853.7661.79k262.8866.4067.1661.43k355.1254.5259.0856.78R7.7611.8813.405.01
根据正交试验结果,各因素对B.subtilis-DAE@ZIF-8的活性回收率影响主次顺序为C(静置合成时间)>B(菌体添加量)>A(Zn2+与2-甲基咪唑摩尔浓度比),最优水平组合为A2B2C2。对最优组合进行验证,比酶活为344.81 U/g,活性回收率为77.75%,由此确定最佳B.subtilis-DAE@ZIF-8制备条件为:Zn2+与2-甲基咪唑摩尔浓度比为1∶4,菌体添加量15 g/L,4 ℃静置60 min。同未优化条件制备的B.subtilis-DAE@ZIF-8相比,酶活力提高了25.99%。
2.4 B.subtilis-DAE@ZIF-8催化性质研究
2.4.1 pH值对B.subtilis-DAE@ZIF-8和游离细胞催化活性及稳定性的影响
研究了pH值对B.subtilis-DAE@ZIF-8催化活性、D-阿洛酮糖转化率和催化稳定性的影响,结果如图7所示。
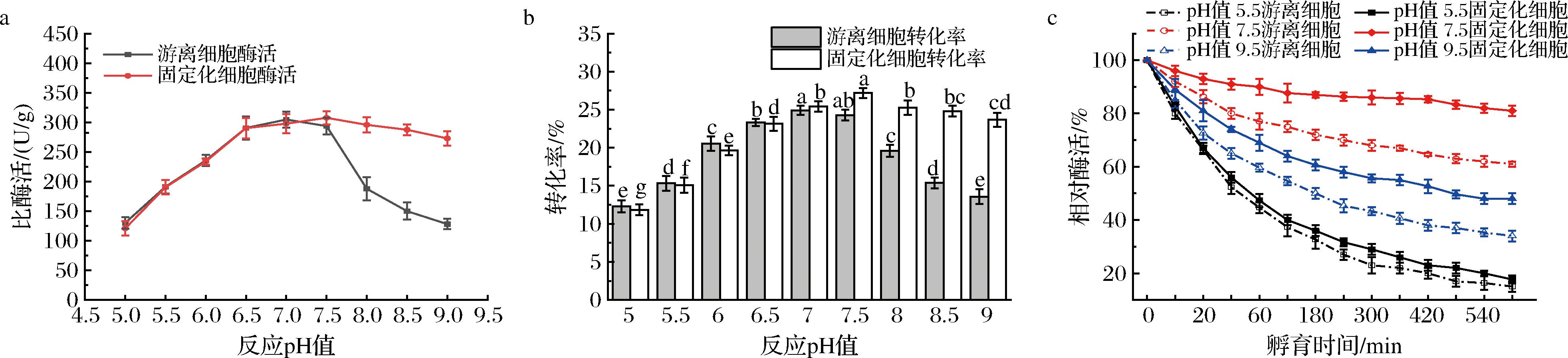
a-不同反应pH下固定化细胞与游离细胞的比酶活;b-不同反应pH值固定化细胞与游离细胞的转化率;c-固定化细胞与游离细胞pH稳定性
图7 固定化细胞与游离细胞最适反应pH值与pH稳定性
Fig.7 The optimal reaction pH value and pH stability of B.subtilis-DAE@ZIF-8 and free cells.
固定化细胞B.subtilis-DAE@ZIF-8在pH值为7.5时达到最高比酶活307.64 U/g,此时转化率为27.20%,D-阿洛酮糖产量达到136.06 g/L。由图7-a、图7-b可得,最佳反应pH值比游离细胞提高了0.5,可能原因是ZIF-8材料的包覆增强了B.subtilis在弱碱性条件中的稳定性。图7-c结果表明,最适pH值下B.subtilis-DAE@ZIF-8的比酶活可长时间保持在80%以上,而同pH值下游离细胞的活性回收率仅有60%左右。在pH值为9.5时,固定化细胞可保留50%左右的比酶活,而游离细胞仅剩约30%。固定化细胞B.subtilis-DAE@ZIF-8在碱性环境中表现出更好的稳定性,而同一范围内游离细胞由于没有ZIF-8材料的保护,难以耐受逐渐增加的碱性环境,其比酶活和转化率显著下降。而在pH值5.5条件下进行培养,二者的催化活性均难以保持,培养10 h后固定化细胞和游离细胞比酶活均仅剩不到20%。在酸性条件下,环境中的H+可能会与ZIF-8有机配体2-甲基咪唑中的氮原子结合,引发2-甲基咪唑质子化,导致ZIF-8中的金属离子与有机配体之间的配位键受到破坏,造成菌体细胞表面的ZIF-8包覆层破损[10, 21-22],影响ZIF-8的保护作用。实验说明,ZIF-8固定化材料对细胞在碱性条件下具有良好的保护作用,且可有效拓宽全细胞反应pH值耐受范围。
2.4.2 温度对B.subtilis-DAE@ZIF-8催化活性及稳定性的影响
研究了反应温度对B.subtilis-DAE@ZIF-8反应活性、D-阿洛酮糖转化率及催化稳定性的影响,结果如图8所示。
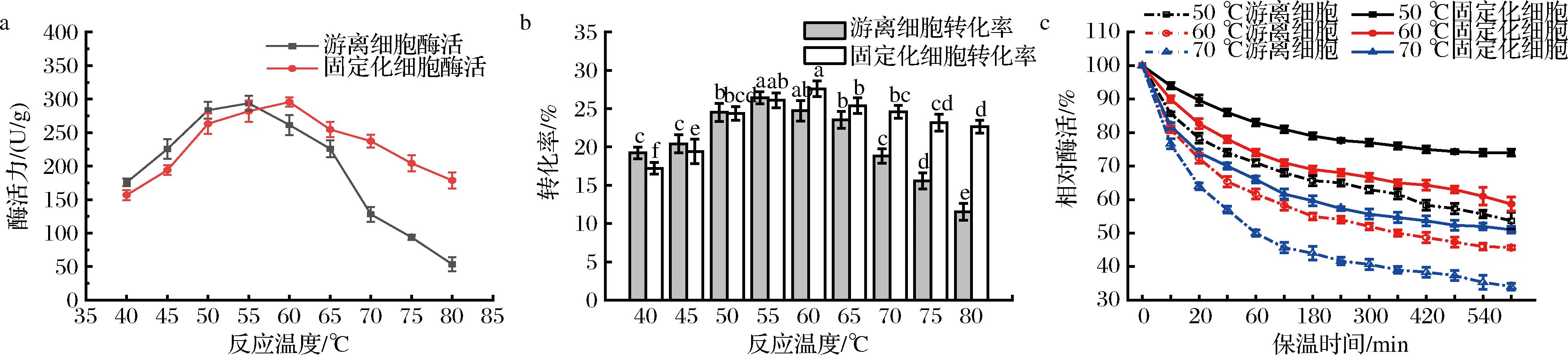
a-不同反应温度下固定化细胞与游离细胞的比酶活;b-不同反应温度下固定化细胞与游离细胞的转化率;c-固定化细胞与游离细胞温度稳定性
图8 固定化细胞与游离细胞最适反应温度与温度稳定性
Fig.8 The optimal reaction temperature and temperature stability of B.subtilis-DAE@ZIF-8 and free cells
由图8-a、图8-b固定化细胞B.subtilis-DAE@ZIF-8与游离细胞的比酶活随温度的升高呈现先升后降的趋势,游离细胞的最佳反应温度为55 ℃,而固定化细胞则因为有ZIF-8框架材料提供保护,最佳反应温度提升了5 ℃,达到60 ℃,此时其比酶活为295.63 U/g,转化率为27.59%,此时D-阿洛酮糖的产量为137.59 g/L。ZIF-8多孔框架材料包覆菌体细胞后,ZIF-8包覆层为菌体细胞及细胞中的DAE营造了一个相对隔离的环境,可以使得菌体细胞结构避免被高温破坏,同时减少了外部环境(如温度剧烈变化、剪切力等)对菌体细胞及其中DAE的直接冲击;此外,ZIF-8的包覆还保证了细胞内部环境的稳定,从而使菌体细胞内部的DAE保持良好的活性与稳定性。同时,ZIF-8多孔框架材料具有良好的热稳定性,其热分解温度可高达600 ℃左右,使得升温过程中,ZIF-8材料可以持续发挥保护作用。由图8-c可知,在固定化细胞的最佳反应温度下保温10 h,仍可保留58.70%的催化活性,而同温度下游离细胞在保温10 h后比酶活仅剩余45.67%;50 ℃时,B.subtilis-DAE@ZIF-8的相对酶活在10 h内均可保持在70%以上,而在同温度下,游离细胞的相对比酶活为53.67%。温度升高到70 ℃,固定化细胞B.subtilis-DAE@ZIF-8和游离细胞的催化活性均有明显下降,但固定化细胞的活性回收率依然明显高于游离细胞。50、60、70 ℃下,游离细胞酶活半衰期分别为10.15、7.34和1.54 h,而B.subtilis-DAE@ZIF-8的酶活力半衰期则达到14.93、10.75、9.66 h,分别为游离细胞的1.47、1.46和6.27倍。以上结果表明,ZIF-8包覆可以大幅提升重组B.subtilisDAE的耐热性。
2.4.3 B.subtilis-DAE@ZIF-8重复利用性
为探讨B.subtilis-DAE@ZIF-8进行工业化应用的潜力,对B.subtilis-DAE@ZIF-8重复使用过程中活性回收率和转化率进行研究,结果如图9所示。
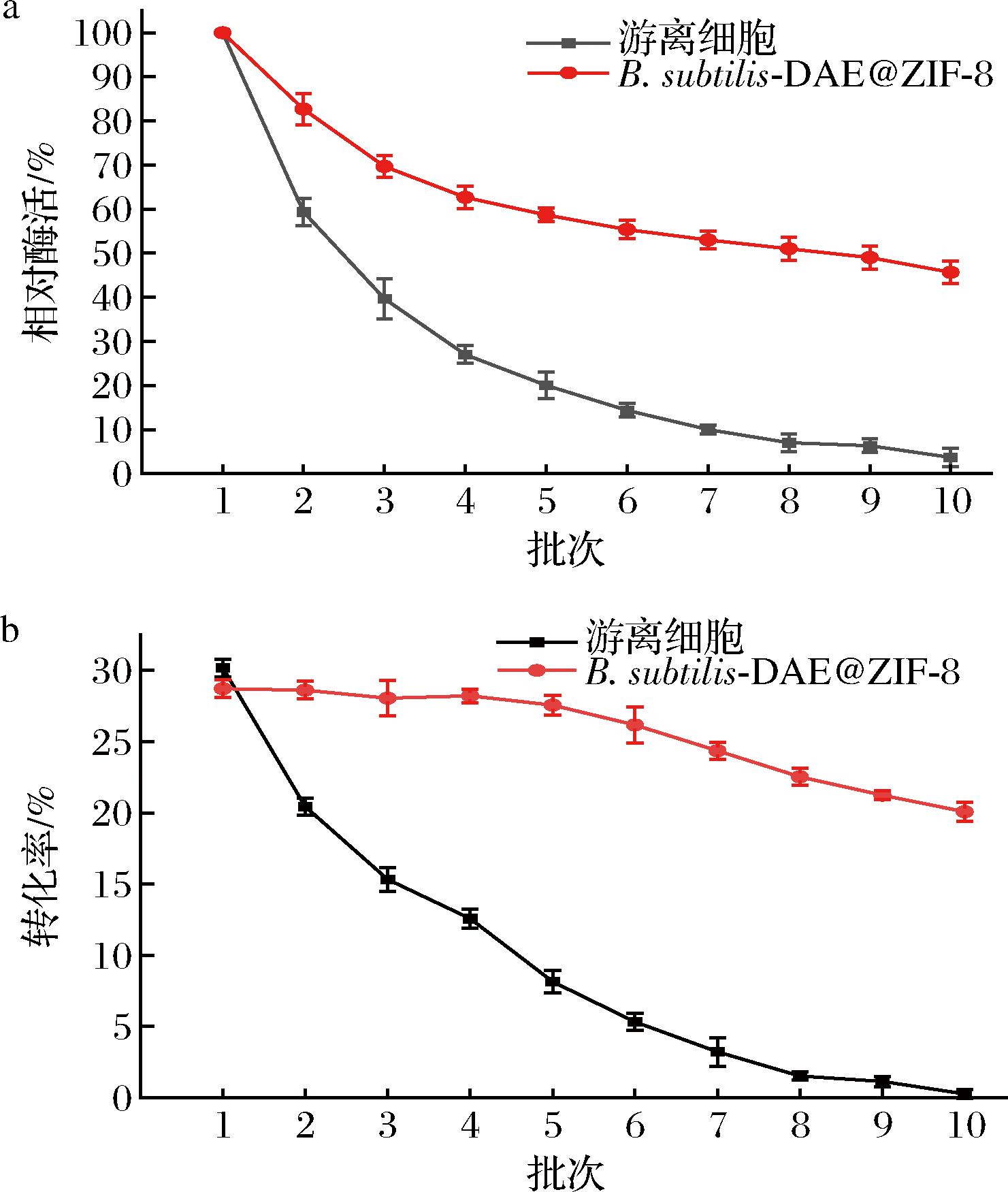
a-固定化细胞与游离细胞不同使用批次的相对酶活;b-固定化细胞与游离细胞不同使用批次的转化率
图9 B.subtilis-DAE@ZIF-8与游离细胞操作稳定性
Fig.9 Operational stability of B.subtilis-DAE@ZIF-8 and free cells
由图9可知,相较于游离细胞,固定化细胞B.subtilis-DAE@ZIF-8的重复利用性得到明显改善。初次进行催化反应时,游离细胞的全细胞催化转化率达到30.17%,D-阿洛酮糖产量为147.83 g/L,固定化细胞B.subtilis-DAE@ZIF-8的催化转化率28.72%,D-阿洛酮糖产量为140.73 g/L。固定化细胞B.subtilis-DAE@ZIF-8重复使用5批次后仍能保留约60%的催化活性,转化率为27.56%,D-阿洛酮糖产量为137.80 g/L,而同样使用5批次的游离细胞的催化活性仅保留20.00%,转化率仅为8.15%,D-阿洛酮糖产量为40.68 g/L。重复使用10批次,固定化细胞B.subtilis-DAE@ZIF-8的相对酶活为45.67%,转化率为20.08%,D-阿洛酮糖产量为100.41 g/L,该转化率可以达到本文中固定化细胞最高转化率的69.92%。而游离细胞在使用10批次后仅剩不足5%的催化活性,D-阿洛酮糖转化率接近0。
国内外相关研究指出,全细胞催化的D-阿洛酮糖转化率略低,其最大值一般为26%~30%,利用固定化细胞或固定化酶催化的D-阿洛酮糖转化率低于全细胞催化的转化率,最高一般为25%~28%[24-26]。本文利用全细胞进行转化,游离细胞催化的D-阿洛酮糖转化率最大为30.17%,固定化细胞B.subtilis-DAE@ZIF-8催化的D-阿洛酮糖转化率最大为28.72%。在底物浓度、反应时间、反应温度、反应pH值及菌体添加量等反应条件均相同的情况下,随着使用批次的增加,ZIF-8材料对菌体细胞及细胞中包含的DAE的保护作用逐渐突显出来。在重复使用过程中,游离细胞长期暴露在高浓度底物中,菌体细胞极易自溶破裂,造成细胞内的酶和其他物质流失,使得游离细胞难以重复使用。而B.subtilis-DAE@ZIF-8由于有ZIF-8多孔固定化材料的包覆,使其免受外部环境影响,提高了B.subtilis-DAE@ZIF-8的重复利用性。上述实验结果表明,得益于ZIF-8框架材料的保护作用,B.subtilis-DAE@ZIF-8的连续催化能力显著好于游离细胞。
3 结论
为提高产DAE重组工程菌在全细胞转化过程中的稳定性与重复利用性,本研究利用ZIF-8材料对产DAE的重组B.subtilis进行了固定化研究,经SEM、FT-IR和XDR等手段表征证明,成功表面包覆有ZIF-8纳米多孔骨架材料的固定化细胞B.subtilis-DAE@ZIF-8。利用单因素实验研究了底物比例、细胞添加量以及静置时间等制备条件对B.subtilis-DAE@ZIF-8催化活性的影响,通过正交试验对固定化条件进行优化,得到了最佳固定化条件:Zn2+与2-甲基咪唑摩尔浓度比为1∶4,菌体添加量15 g/L,低温静置时间1 h;在此条件下,B.subtilis-DAE@ZIF-8比酶活达到344.81 U/g,活性回收率为77.75%。对B.subtilis-DAE@ZIF-8催化条件与特性进行研究发现,B.subtilis-DAE@ZIF-8的最适反应pH值为7.5,比游离细胞升高了0.5,最适反应温度为60 ℃,相较于游离细胞提高了0.5 ℃,且pH值稳定性与温度稳定性均得到显著改善。此外,B.subtilis-DAE@ZIF-8重复使用性能得到明显改善,重复使用10批次后,仍能保持45.67%的DAE活性,D-阿洛酮糖转化率为20.08%,而同条件下游离细胞的活性回收率仅为3.67%,D-阿洛酮糖转化率仅为0.26%,基本丧失转化能力。本研究利用ZIF-8材料对产DAE工程菌进行固定化,成功提高了工程菌全细胞转化产D-阿洛酮糖的反应稳定性和重复利用性,为D-阿洛酮糖的工业化生产提供了参考。
[1] PATEL S N, SHARMA M, LATA K, et al.Improved operational stability of D-psicose 3-epimerase by a novel protein engineering strategy, and D-psicose production from fruit and vegetable residues[J].Bioresource Technology, 2016, 216:121-127.
[2] ZHANG W L, CHEN D, CHEN J J, et al.D-allulose, a versatile rare sugar:Recent biotechnological advances and challenges[J].Critical Reviews in Food Science and Nutrition, 2023,63(22):5661-5679.
[3] HOSSAIN M A, KITAGAKI S, NAKANO D, et al.Rare sugar D-psicose improves insulin sensitivity and glucose tolerance in type 2 diabetes Otsuka Long-Evans Tokushima Fatty (OLETF) rats[J].Biochemical and Biophysical Research Communications, 2011, 405(1):7-12.
[4] WEN X, LIN H B, TESFAY M A, et al.Bioproduction of high-allulose-fructose syrup from D-glucose catalyzed by recombinant E.coli co-expressing glucose isomerase and D-allulose 3-epimerase[J].Food Bioscience, 2023, 56:103222.
[5] GUAN L J, ZHU L, WANG K L, et al.Biochemical characterization, structure-guided mutagenesis, and application of a recombinant D-allulose 3-epimerase from Christensenellaceae bacterium for the biocatalytic production of D-allulose[J].Frontiers in Bioengineering and Biotechnology, 2024, 12:1365814.
[6] WANG Q Y, WANG H Y, ZHANG W G, et al.Economical one-pot synthesis of isoquercetin and D-allulose from quercetin and sucrose using whole-cell biocatalyst[J].Enzyme and Microbial Technology, 2024, 176:110412.
[7] 孙帆, 宿玲恰, 张康, 等.D-阿洛酮糖3-差向异构酶在枯草芽孢杆菌中的高效表达及固定化细胞研究[J].中国生物工程杂志, 2018, 38(7):83-88.SUN F, SU L Q, ZHANG K, et al.D-psicose 3-epimerase gene overexpression in Bacillus subtilis and immobilization of cells[J].China Biotechnology, 2018, 38(7):83-88.
[8] 孙帆. 解纤维梭菌D-阿洛酮糖3-差向异构酶在枯草芽孢杆菌中的重组表达、应用及固定化研究[D]. 无锡: 江南大学, 2018.SUN F. Recombinant expression, application and immobilization of Clostridium cellulosum D- psicose 3- epimerase in Bacillus subtilis[D]. Wuxi: Jiangnan University, 2018.
[9] 李晓波. D-阿洛酮糖3-差向异构酶的表达及其固定化转化D-阿洛酮糖的研究[D]. 天津: 天津科技大学, 2013.LI X B. Study on the expression of D-psicose 3-epimerase and its immobilized transformation into D-psicose[D]. Tianjin: Tianjin University of Science &Technology, 2013.
[10] 刘亚, 王雨, 陈莹莹, 等. MOF-5吸附姜黄素及在胃肠中的消化研究[J]. 食品科学技术学报, 2017, 35(5):46-52.LIU Y, WANG Y, CHEN Y Y, et al. Study on MOF-5 adsorption curcumin and digestion in gastrointestinal tract[J]. Journal of Food Science and Technology, 2017, 35(5):46-52.
[11] LEE Y R, JANG M S, CHO H Y, et al.ZIF-8:A comparison of synthesis methods[J].Chemical Engineering Journal, 2015, 271:276-280.
[12] SADEGH N, DEHCHESHMEH I M, SADEGH F.Review of zeolitic imidazolate framework/graphene oxide:A synergy of synthesis, properties and function for multifaceted applications in nanotechnology[J].FlatChem, 2024, 44:100618.
[13] 张营康,程婷,赵飞扬,等.基于金属有机沸石咪唑骨架的固定化细胞的制备及其在丙谷二肽制备中的应用[J].生物工程学报, 2023, 39(3):1131-1141.ZHANG Y K, CHENG T, ZHAO F Y, et al.Immobilizing engineered Escherichia coli cells into zeolitic imidazolate framework 8 for efficient biosynthesis of Ala-Gln[J].Chinese Journal of Biotechnology, 2023,39(3):1131-1141.
[14] TIAN F C, ZHOU Y M, MA Z Q, et al.Organismal function enhancement through biomaterial intervention[J].Nanomaterials, 2024, 14(4):377.
[15] 梁鑫, 张成楠, 周威, 等.ZIF-8原位自封装固定化脂肪酶的研究[J].食品研究与开发, 2021, 42(5):1-8.LIANG X, ZHANG C N, ZHOU W, et al.Study on immobilization of lipase by in-situ encapsulation in ZIF-8[J].Food Research and Development, 2021, 42(5):1-8.
[16] 芦瑜涵, 张成楠, 李秀婷, 等.基于无定形沸石-咪唑框架-8材料固定米根霉源脂肪酶研究[J].食品科学技术学报, 2023, 41(6):39-51.LU Y H, ZHANG C N, LI X T, et al.Immobilization of lipase derived from Rhizopus oryzae based on amorphous zeolitic imidazolate framework-8 material[J].Journal of Food Science and Technology, 2023, 41(6):39-51.
[17] ![]() A, MAHMUT Ö.Immobilization of α-amylase enzyme on a protein @metal-organic framework nanocomposite:A new strategy to develop the reusability and stability of the enzyme[J].Food Chemistry, 2021, 349:129127.
A, MAHMUT Ö.Immobilization of α-amylase enzyme on a protein @metal-organic framework nanocomposite:A new strategy to develop the reusability and stability of the enzyme[J].Food Chemistry, 2021, 349:129127.
[18] LYU F J, ZHANG Y F, ZARE R N, et al.One-pot synthesis of protein-embedded metal-organic frameworks with enhanced biological activities[J].Nano Letters, 2014, 14(10):5761-5765.
[19] HOWARTH A J, PETERS A W, VERMEULEN N A, et al.Best practices for the synthesis, activation, and characterization of metal-organic frameworks[J].Chemistry of Materials, 2017, 29(1):26-39.
[20] VAIDYA L B, NADAR S S, RATHOD V K.Entrapment of surfactant modified lipase within zeolitic imidazolate framework (ZIF)-8[J].International Journal of Biological Macromolecules, 2020, 146:678-686.
[21] SALIBA D, AMMAR M, RAMMAL M, et al.Crystal growth of ZIF-8, ZIF-67, and their mixed-metal derivatives[J].Journal of the American Chemical Society, 2018, 140(5):1812-1823.
[22] HOU S Y, ZHANG M, HOU Y Q, et al.Mechanistic insight into the removal of aqueous Cd using an immobilized ZIF-8 and microflora cooperative composite[J].Chemosphere, 2022, 293:133582.
[23] PANG S H, HAN C, SHOLL D S, et al.Facet-specific stability of ZIF-8 in the presence of acid gases dissolved in aqueous solutions[J].Chemistry of Materials, 2016, 28(19):6960-6967.
[24] ZHANG W L, CHEN D, CHEN J J, et al.D-allulose, a versatile rare sugar:Recent biotechnological advances and challenges[J].Critical Reviews in Food Science and Nutrition, 2023,63(22):5661-5679.
[25] 黄月园,徐铮,徐虹.生物法生产D-阿洛酮糖的研究进展[J].生物加工过程,2021,19(6):581-588.HUANG Y Y, XU Z, XU H.Progress in biological production of D-psicose[J].Chinese Journal of Bioprocess Engineering, 2021, 19(6):581-588.
[26] FU G, ZHANG S B, DONG H N, et al.Enhanced production of D-psicose 3-epimerase in Bacillus subtilis by regulation of segmented fermentation[J].Biotechnology and Applied Biochemistry, 2020, 67(5):812-818.