茶多糖是存在于茶叶和茶花中的一种具有抗氧化、抗肿瘤、抗衰老等多种功效的生物活性成分,通常由鼠李糖(Rha)、阿拉伯糖(Ara)、葡萄糖(Glc)、半乳糖(Gal)、木糖(Xyl)、甘露糖(Man)、岩藻糖(Fuc)、半乳糖醛酸(GalA)等十多种单糖组成。受不同茶源、不同加工工艺和分离方法等多种因素的影响,其相对分子质量分布为1.02~4 940 kDa[1]。多糖的结构通常对其生物活性有较大影响,而提取方法是影响多糖结构的重要因素。热水萃取因其成本效益和易用性,是实验室和工业应用中最常用的提取多糖的方法,但由于糖苷键断裂和加热降解,多糖的相对分子质量会在热水萃取期间降低[2]。螯合剂法通常选用反式环己烷-1,2-二胺四乙酸(trans-cyclohexane-1, 2-diamine tetraacetic acid,CDTA)、乙二胺四乙酸(ethylenediamine tetraacetic acid,EDTA)、草酸铵等为溶剂,通过破坏细胞壁中与多糖交联的钙桥,进行多糖的提取[3]。VITYAZEV等[4]使用不同方法进行黑萝卜果胶的提取,其中螯合剂法的提取得率高,并使用该方法得到了具有鼠李半乳糖醛酸聚糖Ⅰ型(rhamnogalacturonan-Ⅰ,RG-I)和同型半乳糖醛酸聚糖(homogalacturonan,HG)。碱液可以破坏细胞壁中纤维素和半纤维素之间的氢键[5],加速细胞内多糖的释放,孙玉姣等[6]研究发现,与水提法相比,碱法提取能够显著提高多糖得率,且碱提多糖的糖醛酸含量更高,能在较低浓度时表现出良好的抗氧化作用。通常情况下采用单一提取方法并不能将所有多糖提取出来,而将多种方法联合进行顺序提取则可以从同一原料中得到不同的多糖组分[7]。
香茶,是通过对传统绿茶炒青工艺改进而形成的一种新型绿茶[8],最初起源于浙江丽水,随着茶叶加工规模的不断扩大,目前已发展了120多个产茶乡镇。香茶中含有茶多糖、茶多酚、茶皂素、咖啡碱、黄酮醇、茶氨酸等生物活性物质,其中茶多糖是一种结合了蛋白质的酸性复合多糖,具有极大的开发潜力。目前,已有研究对红茶[9]、黄茶[10]、黑茶[11]中的茶多糖结构进行详细表征,并取得了一定进展。但未见香茶多糖相关报道。茶多糖是香茶细胞壁的一种重要组成部分,主要包含于初生细胞壁层和胞间层,会与纤维素和半纤维素发生交联,增加了果胶提取的难度。因此,为了高效提取香茶中的多糖组分并进行解析,通过热水、草酸铵和NaOH对香茶多糖浸提,分级醇沉后对各组分的基本理化指标、相对分子质量、单糖组成、连接方式进行测定,并选取糖酸酸含量较高的组分通过核磁共振波谱对其精细结构进行分析。本研究结果可用于提高香茶的综合利用价值,并为与之相关功能产品的开发提供数据参考。
1 材料与方法
1.1 材料与试剂
香茶,浙江仙叶农业科技有限公司;标准单糖(L-鼠李糖、L-阿拉伯糖、D-木糖、D-甘露糖、D-葡萄糖、D-半乳糖、D-葡萄糖醛酸和D-半乳糖醛酸),Sigma-Aldrich(中国北京);甲醇、无水乙醇、苯酚、二甲基亚砜(dimethyl sulfoxide,DMSO)、三氟乙酸(trifluoroacetic acid,TFA)、二氯甲烷、冰乙酸,天津江天化工有限公司;重水(deuterium oxide,D2O)、碘甲烷,安徽泽升科技有限公司;1-环己基-2-吗啉乙基碳二亚胺对甲苯磺酸盐(1-cyclohexyl-2-morpholine ethylcarbodiimide p-toluene sulfonate,CMC),上海阿拉丁生化科技股份有限公司;福林酚,天津泰进科技有限公司。
1.2 仪器与设备
LC-20A高效凝胶排阻色谱(high pressure size exclusion chromatography,HPSEC),日本岛津公司;ICS-5000+离子色谱仪,美国戴安公司;IS50傅里叶红外光谱仪,尼高利公司;Agilent 6890 N气质联用仪,安捷伦科技有限公司;AVANCE NEO 600M核磁共振(nuclear magnetic resonance spectroscopy,NMR)波谱仪,德国Bruker公司;Infinite 200 Pro酶标仪,瑞士TECAN公司;高速大容量冷冻离心机,长沙高新技术产业开发区湘仪离心机仪器有限公司。
1.3 实验方法
1.3.1 香茶多糖提取
将香茶粉碎,过40目筛,按照料液比1∶5(g∶mL)加入无水乙醇,常温搅拌48 h,去除色素等杂质,4 000 r/min离心15 min,沉淀自然风干,得到香茶粉原料。将干燥的香茶粉按照料液比1∶20(g∶mL)加入到70 ℃热水中提取2 h,收集上清液,重复提取1次,合并提取液,减压浓缩后按照体积比1∶3加入无水乙醇,静置过夜,4 000 r/min离心30 min,沉淀复溶,蒸馏水透析(8 000~14 000 Da)48 h,真空冷冻干燥,得到水提香茶多糖(water-extracted Xiangcha tea polysaccharide,WTP)。热水浸提后的残渣按照料液比1∶20(g∶mL)与0.05 mol/L草酸铵溶液混合,提取分离条件同上,得到草酸铵提香茶多糖(ammonium oxalate-extracted Xiangcha tea polysaccharide,OTP)。收集经草酸铵浸提后的残渣,以0.1 mol/L NaOH+20 mmol/L NaBH4为溶剂,按照料液比1∶20(g∶mL)进行碱溶性多糖组分的提取,25 ℃搅拌1 h后,4 000 r/min离心30 min,重复提取2次后,合并上清液,调节pH至4,4 ℃放置12 h,4 000 r/min离心30 min,上清经浓缩、醇沉、透析、冻干后,得到碱提香茶多糖(alkali-extracted of Xiangcha tea polysaccharides,ATP)。
1.3.2 香茶多糖纯化
采用分级醇沉的方法对多糖进行纯化[12]。将多糖样品配制成质量浓度为1 g/L的水溶液,加入无水乙醇,使体系中乙醇体积分数为5%,4 ℃下静置12 h后,8 000 r/min、4 ℃离心30 min,收集沉淀得到乙醇体积分数为5%的组分,分别命名为WTP-5、OTP-5、ATP-5。向离心后的上清液中继续加入无水乙醇使乙醇体积分数增加5%,重复上述操作;依次得到乙醇体积分数为10%、15%...65%、70%的多糖组分。
1.3.3 化学组成测定
采用苯酚-硫酸法,按照标准回归方程(y=12.107x+0.105 1,R2=0.999 2)对总糖含量进行测定[13]。采用考马斯亮蓝试剂盒,按照标准回归方程(y=2.121x+0.518 1,R2=0.992 5)对蛋白含量进行测定[14]。采用间羟基联苯法结合标准回归方程(y=4.380 1x+0.053 8,R2=0.996 2)进行糖醛酸含量的测定[15]。采用福林酚法结合标准回归方程(y=0.360 1x+0.032 6,R2=0.994 1)测定总酚含量[16]。
1.3.4 相对分子质量测定
采用HPSEC进行多糖各组分的相对分子质量的测定[12]。
1.3.5 单糖组成
使用采用离子色谱法对香茶多糖的单糖组成进行定性和定量分析[17]。
1.3.6 傅里叶红外光谱(Fourier transform infrared spectroscopy,FTIR)测定
将样品与KBr按照1∶150(质量比)混合,快速研磨并压制成半透明薄片,以4 cm-1的分辨率在4 000~400 cm-1频率范围内扫描16次采集多糖光谱。酯化度(degree of esterification,DE)的计算如公式(1)所示:
(1)
式中:Abs1 740和Abs1 636分别代表样品在1 740 cm-1和1 636 cm-1处的峰面积。
1.3.7 甲基化测定
甲基化前需要先将糖醛酸残基还原为中性糖,使用先前发表的方法进行甲基化[18],充分干燥后的多糖经TFA水解,NaBD4还原以及乙酰化后,使用GC-MS对香茶多糖连接方式进行测定。
1.3.8 部分酸水解
参考ZHU等[19]的方法并稍作修改,将OTP-60经0.05 mol/L TFA水解后,减压浓缩并加入甲醇除去多余的TFA,蒸馏水透析(3 500 Da)48 h,收集透析袋内样品(retention components of ammonium oxalate-extracted Xiangcha tea polysaccharide at 60% ethanol concentration,OTP-60 N),透析袋外的液体冻干(exudate components of ammonium oxalate-extracted Xiangcha tea polysaccharide at 60% ethanol concentration,OTP-60 W)。
1.3.9 NMR分析
向25 mg充分干燥后的OTP-60N加入1 mL D2O,完全溶解后冻干,反复冻溶3次,使用Bruker 600 MHz核磁共振仪,对OTP-60N的1H和13C NMR波谱、同核化学位移相关谱(correlation spectroscopy,COSY)、异核单量子相关谱(heteronuclear single quantum correlation,HSQC)、异核多键相关谱(heteronuclear multiple bond connectivity,HMBC)、总相关谱(total correlated spectroscopy,TOCSY)进行测定。
1.4 数据处理
所得数据以“平均值±标准偏差”表示,采用SPSS 25.0、Origin 2019软件进行数据统计分析与作图,采用MestReNova 12.0软件分析核磁谱图。
2 结果与分析
2.1 香茶多糖提取、纯化及基本理化性质分析
不同提取方法的多糖得率见表1,多糖得率随提取次序依次递减,其中水提的得率最高,为3.33%;草酸铵提取的得率次之,为2.50%;碱提的得率最低,为1.65%。通过分级醇沉对3种粗提组分进行纯化,不同乙醇浓度沉淀组分相对分子质量分布如图1所示。水提多糖的相对分子质量最低,碱提多糖的相对分子质量最高。这是由于果胶结构较为致密,热水浸提过程中细胞壁结构松动越少,果胶增溶程度越小。因此热水只能提取出结合松散且易于释放的部分,致使水提组分的相对分子质量较小。然而,在经过热水和草酸铵处理后,原料的细胞壁已被破坏,再使用极性较强的碱性溶剂进行提取时,高相对分子质量的多糖片段则更易溶出。OTP经纯化后得到了相对分子质量为870 kDa的单一组分OTP-60,而WTP和ATP即使经过纯化后仍具有2个相对分子质量的信号峰,这表明它们含有两部分相对分子质量相差较大的多糖片段。根据相对分子质量分布情况选择WTP-40、ATP-40和OTP-60进行后续基本理化性质的测定。由各组分的化学组成可知(表1),香茶多糖为酸性多糖。3种提取方法中,螯合剂可以通过松动同半乳糖醛酸和钙复合物形成的卵盒结构来溶解细胞壁中Ca2+离子连接形成的果胶[20],因此OTP-60具有较高的糖醛酸含量(87.33%)。碱法可以更好地提取出含有丰富中性糖侧链的RG-I区域[21],因而碱提香茶多糖的总糖含量较高。
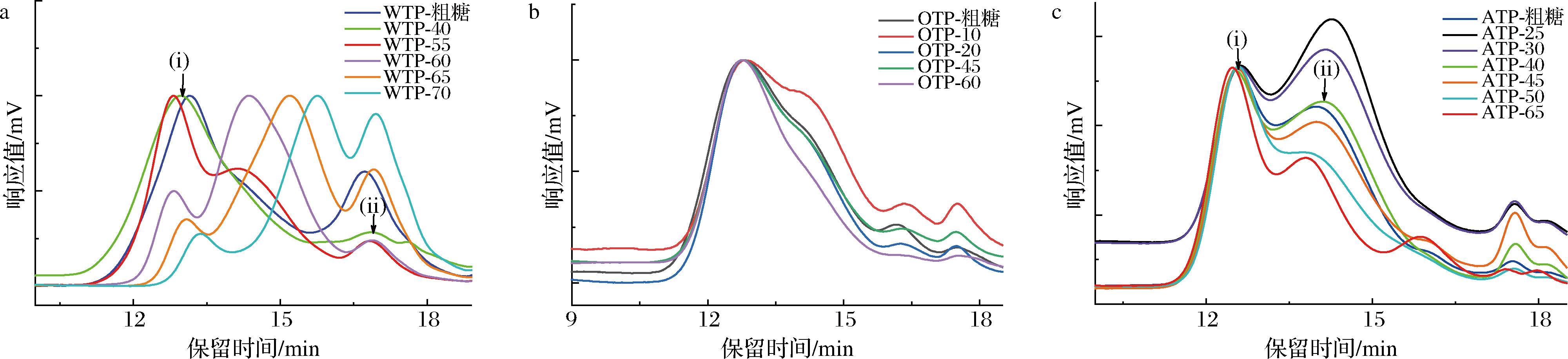
a-水提茶多糖组分;b-螯合剂提多糖组分;c-碱提多糖组分
图1 分级醇沉各组分的相对分子质量分布
Fig.1 Molecular weight distribution of components of graded alcohol precipitation
表1 WTP-40、OTP-60和ATP-40的化学组成和分子特征
Table 1 Chemical compositions and molecular characterization of WTP-40、OTP-60 and ATP-40
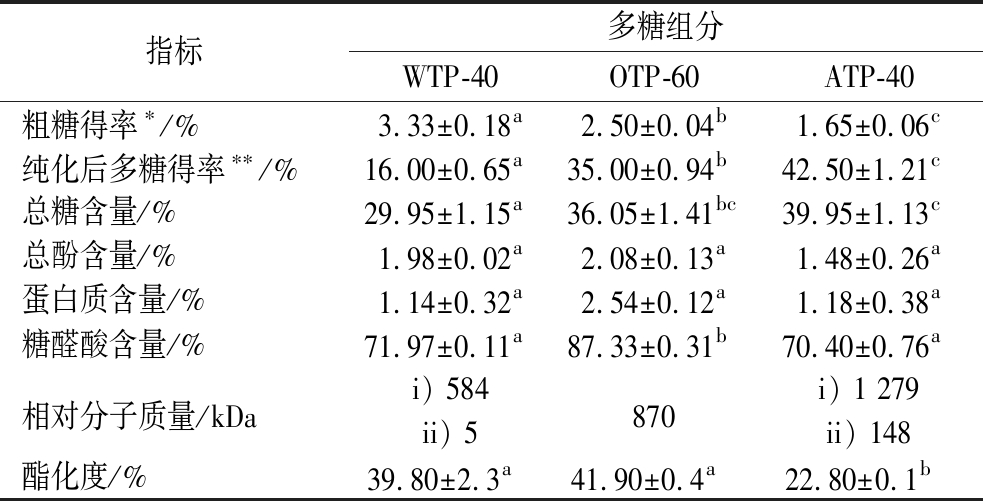
注:同一行中不同字母表示差异显著(P<0.05);*:以原料为基准计算粗提物占比;**:以粗提物质量为基准计算纯化后组分的占比;i:相对分子质量1;ii:相对分子质量2。
指标多糖组分WTP-40OTP-60ATP-40粗糖得率∗/%3.33±0.18a2.50±0.04b1.65±0.06c纯化后多糖得率∗∗/%16.00±0.65a35.00±0.94b42.50±1.21c总糖含量/%29.95±1.15a36.05±1.41bc39.95±1.13c总酚含量/%1.98±0.02a2.08±0.13a1.48±0.26a蛋白质含量/%1.14±0.32a2.54±0.12a1.18±0.38a糖醛酸含量/%71.97±0.11a87.33±0.31b70.40±0.76a相对分子质量/kDai) 584870i) 1 279ii) 5ii) 148酯化度/%39.80±2.3a 41.90±0.4a 22.80±0.1b
2.2 单糖组成
表2为香茶多糖各组分的单糖组成,GalA是WTP-40、OTP-60和ATP-40中占比最高的单糖,这和糖醛酸测定结果相吻合,且各组分的中性糖主要为Ara和Gal,这表明香茶多糖具有果胶多糖的典型特征。据已有文献报道,果胶通常由HG线性聚合物、RG-I、鼠李半乳糖醛酸聚糖II(rhamngalacturonan II,RG-II)和木糖半乳糖醛酸聚糖(xylogalacturonan,XG)4种结构域按照不同比例连接而成[22]。通过单糖组成可以简单计算不同结构域在多糖中的摩尔比[23]。其中WTP-40和ATP-40主要以RG-I结构域为主,RG-I在两者中占比分别为62.10%和57.13%。OTP-60中HG和RG-I的占比为46.36%和43.61%,2种结构域的比例近似为1∶1。由此可以推断,香茶多糖是一种由HG和RG-I组成的酸性果胶多糖。
表2 WTP-40、ATP-40和OTP-60的单糖组成
Table 2 Monosaccharide composition of WTP-40、ATP-40 and OTP-60
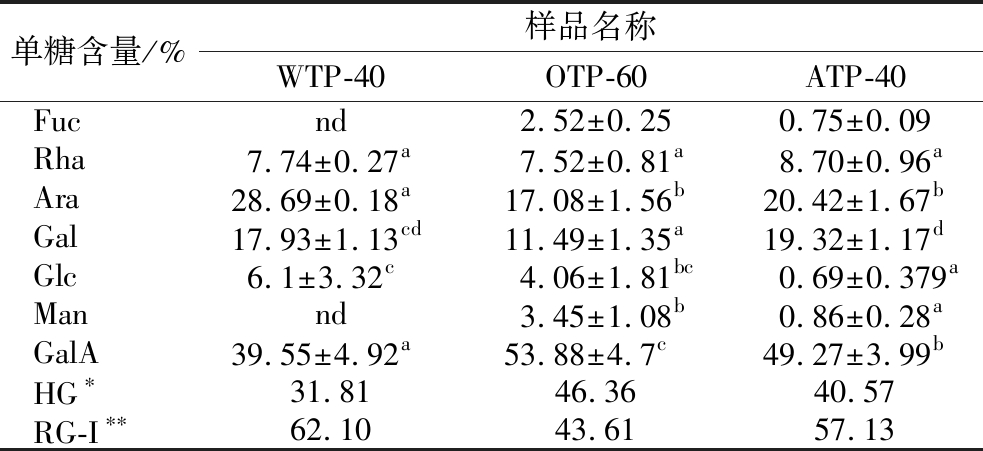
注:同一行中不同字母表示差异显著(P<0.05);*:HG=GalA-Rha;**:RG-I=[GalA-HG]+Rha+Ara+Gal;nd表示低于检出限。
单糖含量/%样品名称WTP-40OTP-60ATP-40Fucnd2.52±0.250.75±0.09Rha7.74±0.27a7.52±0.81a8.70±0.96aAra28.69±0.18a17.08±1.56b20.42±1.67bGal17.93±1.13cd11.49±1.35a19.32±1.17dGlc6.1±3.32c4.06±1.81bc0.69±0.379aMannd3.45±1.08b0.86±0.28aGalA39.55±4.92a53.88±4.7c49.27±3.99bHG∗31.8146.3640.57RG-I∗∗62.1043.6157.13
2.3 FTIR分析
采用FTIR比较了不同方法提取的香茶多糖的结构特征。图2为WTP-40、OTP-60和ATP-40的红外光谱图。3种多糖均具有多糖的特征吸收峰,其中-OH的拉伸振动特征峰出现在3 420 cm-1附近,2 925 cm-1附近的信号是由不对称的C—H伸缩振动引起的。不同提取方式提取多糖的差别主要集中在1 740 cm-1和1 636 cm-1处,1 740 cm-1处的吸光度峰值主要与甲基酯化羧基中的C![]() O拉伸振动有关。而1 636 cm-1是由羧酸离子(COO—)中C
O拉伸振动有关。而1 636 cm-1是由羧酸离子(COO—)中C![]() O的振动产生的吸收峰[24],3种提取方法对香茶多糖的主要官能团均无明显的影响。此外,可以通过对样品在1 740 cm-1和1 636 cm-1处的峰面积进行积分得到果胶的酯化度[25],经计算3种组分均属低甲氧基果胶。其中酯化度最高的是草酸铵提组分OTP-60,其DE为41.9%,碱提组分ATP-40的酯化度最低为22.8%,这可能由于在碱萃取过程部分甲酯键的断裂导致果胶的脱酯化[26],水提组分WTP-40酯化度居中,其DE为39.8%。
O的振动产生的吸收峰[24],3种提取方法对香茶多糖的主要官能团均无明显的影响。此外,可以通过对样品在1 740 cm-1和1 636 cm-1处的峰面积进行积分得到果胶的酯化度[25],经计算3种组分均属低甲氧基果胶。其中酯化度最高的是草酸铵提组分OTP-60,其DE为41.9%,碱提组分ATP-40的酯化度最低为22.8%,这可能由于在碱萃取过程部分甲酯键的断裂导致果胶的脱酯化[26],水提组分WTP-40酯化度居中,其DE为39.8%。
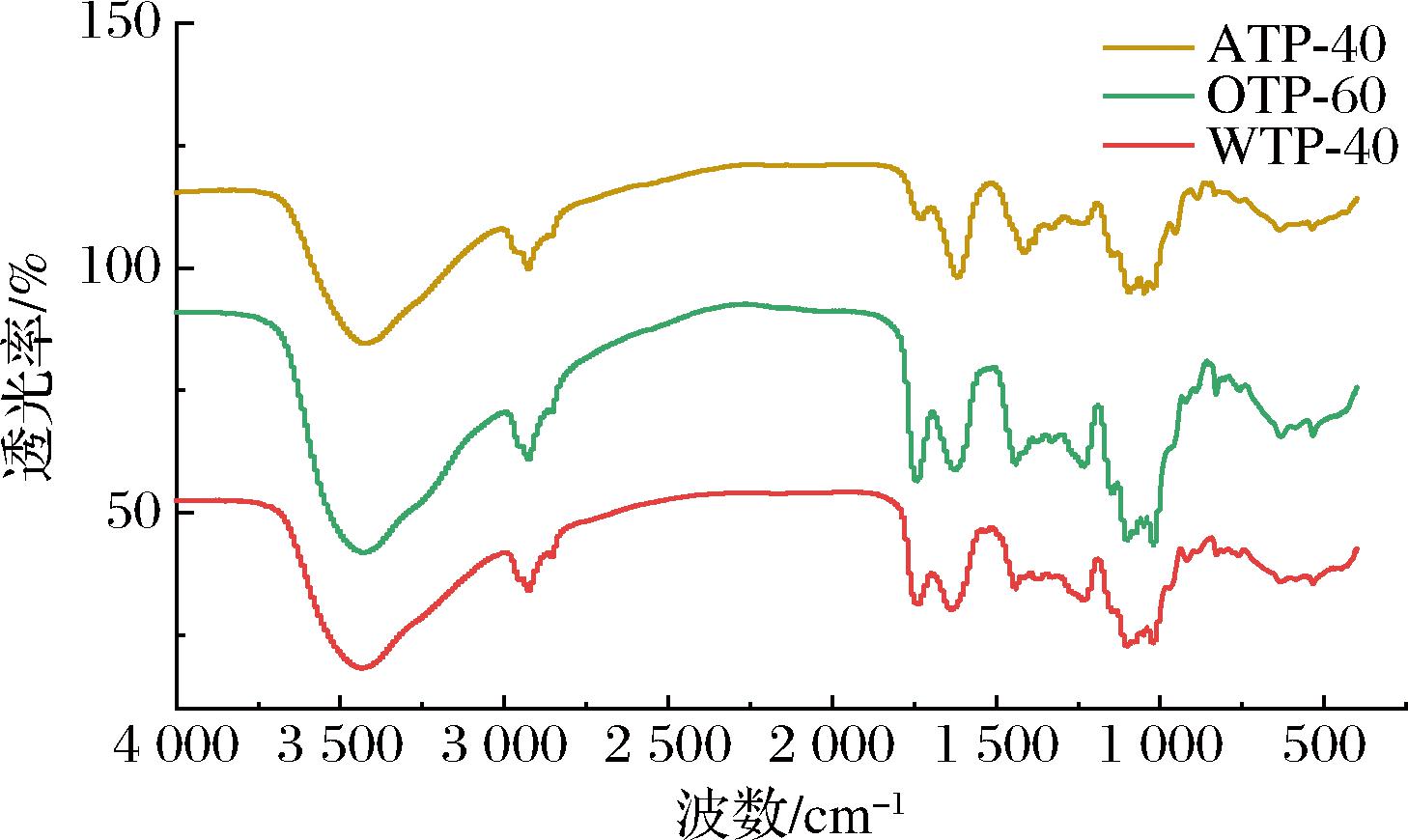
图2 WTP-40、OTP-60、ATP-40的傅里叶红外光谱图
Fig.2 FT-IR spectrum of WTP-40、OTP-60、ATP-40
2.4 甲基化分析
为了确定不同的提取方法得到的香茶多糖的连接方式是否存在差异,通过GC-MS对经甲基化处理后的WTP-40、OTP-60和ATP-40的糖苷键类型进行研究。甲基化结果如表3所示。GalA在3种组分中均是以→4)-GalpA-(1→和T-GalpA-(1→的形式存在,且各组分→4)-GalpA-(1→与→2)-Rhap-(1→的比值远大于1,表明存在较高含量的线性HG区域。各组分中均存在少量的Rhap-(1→、→2)-Rhap-(1→和→2, 4)-Rhap-(1→,这表明可能存在一个较小的RG-Ⅰ的主链,→6)-D-Galp-(1→,Galp-(1→、Araf-(1→等残基通常来源于AG-I侧链[27]。检测到→3)-Galp-(1→、Galp-(1→的存在说明样品中含有AG-II侧链[28],残基→3)-Araf-(1→、→5)-Araf-(1→和→3, 5)-Araf-(1→组成了RG-I结构域中的阿拉伯聚糖侧链[22]。各组分中Rha残基的数量相对较低,但是Ara和Gal残基数量相对较高,由此可以推断出各样品中均存在一个高度分支的RG-I结构域。就侧链数量来说,OTP-60的侧链数量低于WTP-40和ATP-40。综合看来,不同提取方式并未对香茶多糖的主要糖苷键类型产生影响,但是会不同程度影响各种连接方式之间的比例。
表3 WTP-40、ATP-40和OTP-60的连接方式分析
Table 3 Linkage analysis of WTP-40、ATP-40 and OTP-60
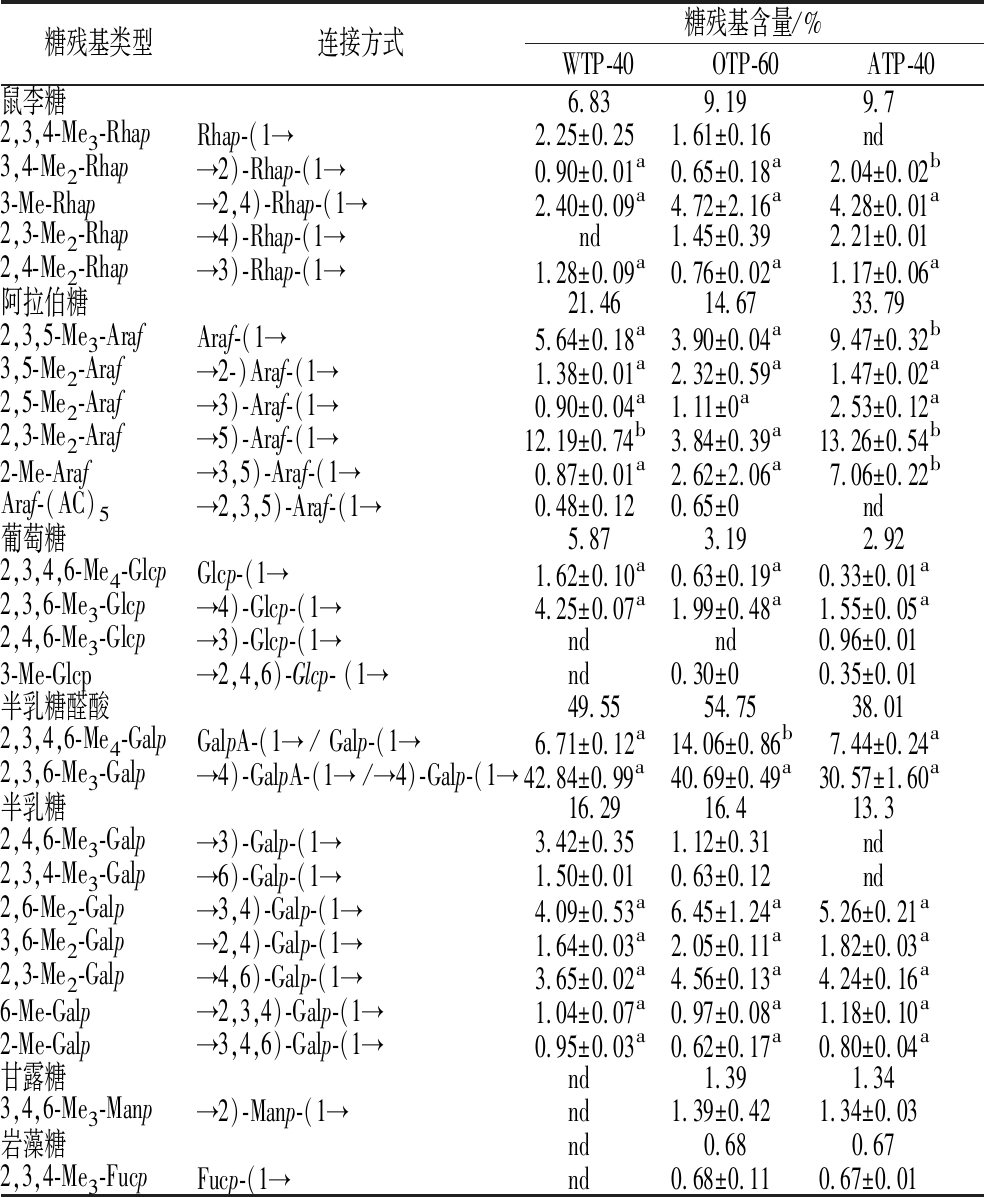
注:同一行中不同字母表示差异显著(P<0.05);nd:低于检出限。
糖残基类型连接方式糖残基含量/%WTP-40OTP-60ATP-40鼠李糖 6.83 9.19 9.72,3,4-Me3-RhapRhap-(1→ 2.25±0.251.61±0.16 nd3,4-Me2-Rhap→2)-Rhap-(1→ 0.90±0.01a0.65±0.18a 2.04±0.02b3-Me-Rhap→2,4)-Rhap-(1→ 2.40±0.09a4.72±2.16a 4.28±0.01a2,3-Me2-Rhap→4)-Rhap-(1→ nd1.45±0.39 2.21±0.012,4-Me2-Rhap→3)-Rhap-(1→ 1.28±0.09a0.76±0.02a 1.17±0.06a阿拉伯糖 21.46 14.67 33.792,3,5-Me3-ArafAraf-(1→ 5.64±0.18a3.90±0.04a 9.47±0.32b3,5-Me2-Araf→2-)Araf-(1→ 1.38±0.01a2.32±0.59a 1.47±0.02a2,5-Me2-Araf→3)-Araf-(1→ 0.90±0.04a1.11±0a 2.53±0.12a2,3-Me2-Araf→5)-Araf-(1→12.19±0.74b3.84±0.39a13.26±0.54b2-Me-Araf→3,5)-Araf-(1→ 0.87±0.01a2.62±2.06a 7.06±0.22bAraf-(AC)5→2,3,5)-Araf-(1→ 0.48±0.120.65±0 nd葡萄糖 5.87 3.19 2.922,3,4,6-Me4-GlcpGlcp-(1→ 1.62±0.10a0.63±0.19a0.33±0.01a2,3,6-Me3-Glcp→4)-Glcp-(1→ 4.25±0.07a1.99±0.48a1.55±0.05a2,4,6-Me3-Glcp→3)-Glcp-(1→ nd nd0.96±0.013-Me-Glcp→2,4,6)-Glcp- (1→ nd0.30±00.35±0.01半乳糖醛酸 49.55 54.75 38.012,3,4,6-Me4-GalpGalpA-(1→ / Galp-(1→ 6.71±0.12a14.06±0.86b 7.44±0.24a2,3,6-Me3-Galp→4)-GalpA-(1→ /→4)-Galp-(1→42.84±0.99a40.69±0.49a30.57±1.60a半乳糖 16.29 16.4 13.32,4,6-Me3-Galp→3)-Galp-(1→ 3.42±0.351.12±0.31 nd2,3,4-Me3-Galp→6)-Galp-(1→ 1.50±0.010.63±0.12 nd2,6-Me2-Galp→3,4)-Galp-(1→ 4.09±0.53a6.45±1.24a5.26±0.21a3,6-Me2-Galp→2,4)-Galp-(1→ 1.64±0.03a2.05±0.11a1.82±0.03a2,3-Me2-Galp→4,6)-Galp-(1→ 3.65±0.02a4.56±0.13a4.24±0.16a6-Me-Galp→2,3,4)-Galp-(1→ 1.04±0.07a0.97±0.08a1.18±0.10a2-Me-Galp→3,4,6)-Galp-(1→ 0.95±0.03a0.62±0.17a0.80±0.04a甘露糖 nd 1.39 1.343,4,6-Me3-Manp→2)-Manp-(1→ nd1.39±0.421.34±0.03岩藻糖 nd 0.68 0.672,3,4-Me3-FucpFucp-(1→ nd0.68±0.110.67±0.01
2.5 OTP-60结构分析
2.5.1 OTP-60 N和OTP-60 W分析
由于OTP-60的相对分子质量较大难以对其精细结构进行分析,所以对OTP-60进行降解。对OTP-60水解后的2种组分,即OTP-60 N(OTP-60经酸水解后透析袋内的产物)和OTP-60 W(OTP-60经酸水解后透析袋外的产物)的单糖组成进行了测定。结果如表4所示,OTP-60 N组分中的单糖主要是GalA和Rha,其含量分别为78.52%和12.38%,而Gal和Ara是OTP-60 W中的主要组成成分,其含量分别为34.29%和40.97%。这是由于TFA主要作用于多糖的侧链结构,而Gal和Ara是RG-I侧链的主要成分,因而在经TFA处理后Gal和Ara更容易从整个结构中脱落下来。
表4 OTP-60 N和OTP-60 W的单糖组成
Table 4 The monosaccharide compositions of OTP-60 N和OTP-60 W
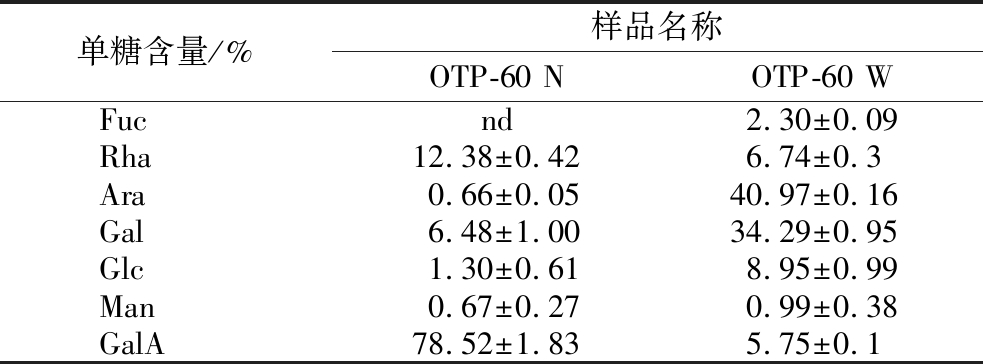
注:nd表示低于检出限。
单糖含量/%样品名称OTP-60 NOTP-60 WFucnd2.30±0.09Rha12.38±0.426.74±0.3Ara0.66±0.0540.97±0.16Gal6.48±1.0034.29±0.95Glc1.30±0.618.95±0.99Man0.67±0.270.99±0.38GalA78.52±1.835.75±0.1
2.5.2 OTP-60 N甲基化分析
对OTP-60 N进行了甲基化分析,结果见表5。与OTP-60相比(表3),OTP-60 N中→4)-GalpA-(1→、→2)-Rhap-(1→和→2,4)-Rhap-(1→糖苷键含量升高,而Ara和部分Gal 糖残基含量降低。这可能是由于→4)-GalpA-(1→可能来源于HG/RG-I 骨架,→2)-Rhap-(1→通常来源于RG-Ⅰ主链,不易被降解,而Ara和Gal位于RG-Ⅰ支链部分,在酸性条件下容易被打断导致含量降低,这也和OTP-60 N的单糖结果一致。
表5 OTP-60 N的连接方式分析
Table 5 Linkage analysis of OTP-60 N
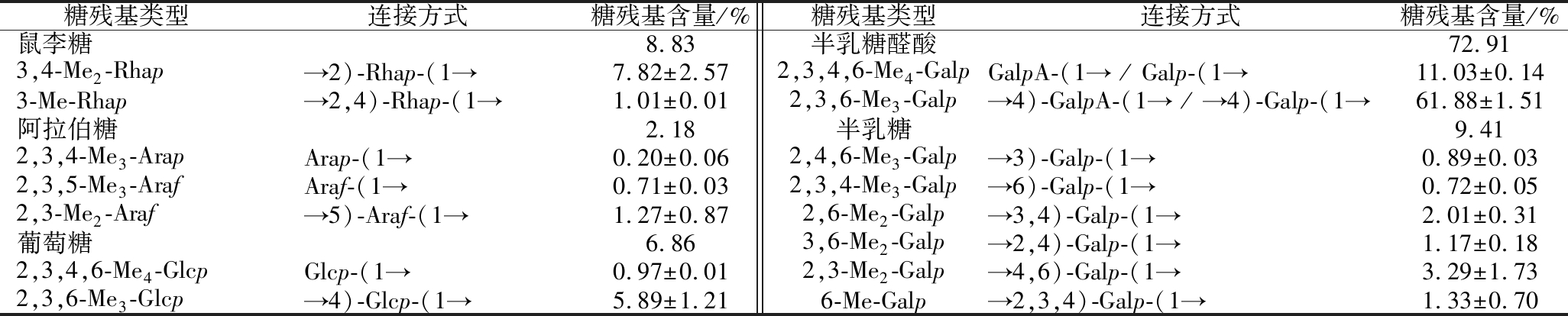
糖残基类型连接方式糖残基含量/%糖残基类型连接方式糖残基含量/%鼠李糖8.83半乳糖醛酸72.913,4-Me2-Rhap→2)-Rhap-(1→7.82±2.572,3,4,6-Me4-GalpGalpA-(1→ / Galp-(1→11.03±0.143-Me-Rhap→2,4)-Rhap-(1→1.01±0.012,3,6-Me3-Galp→4)-GalpA-(1→ / →4)-Galp-(1→61.88±1.51阿拉伯糖2.18半乳糖9.412,3,4-Me3-ArapArap-(1→0.20±0.062,4,6-Me3-Galp→3)-Galp-(1→0.89±0.032,3,5-Me3-ArafAraf-(1→0.71±0.032,3,4-Me3-Galp→6)-Galp-(1→0.72±0.052,3-Me2-Araf→5)-Araf-(1→1.27±0.872,6-Me2-Galp→3,4)-Galp-(1→2.01±0.31葡萄糖6.863,6-Me2-Galp→2,4)-Galp-(1→1.17±0.182,3,4,6-Me4-GlcpGlcp-(1→0.97±0.012,3-Me2-Galp→4,6)-Galp-(1→3.29±1.732,3,6-Me3-Glcp→4)-Glcp-(1→5.89±1.216-Me-Galp→2,3,4)-Galp-(1→1.33±0.70
2.6 NMR分析
有研究表明,糖醛酸含量较高的多糖通常具有更高的活性[29]。由于OTP-60的峰形较为单一且糖醛酸含量较高,因此对其精细结构进行鉴定。图3-a为OTP-60和OTP-60 N的1H-NMR图谱,由于OTP-60的相对分子质量大且结构较为复杂,它的1H图谱中异头区信号峰重叠严重,信息提供量较少,无法完整解析出一级结构。因此通过1H-NMR(图3-a)和13C-NMR(图3-b),以及COSY(图3-c)、HSQC(图3-d)、HMBC(图3-e)和TOCSY(图3-f)对部分酸水解所得到的主链部分OTP-60 N的精细结构进行鉴定。

a-OTP-60和OTP-60 N的1H图谱;b-OTP-60 N的13C图谱;c-OTP-60 N的COSY图谱;d-OTP-60 N的HSQC图谱;e-OTP-60 N的HMBC图谱;f-OTP-60 N的TOCSY光谱
图3 OTP-60 N的核磁图谱
Fig.3 NMR spectra of OTP-60 N
在HSQC图谱异头区域可以观察到在5.05/100.01和4.96/100.42存在2个强度较高的信号,由甲基化结果可知OTP-60 N中→4)-GalpA-(1→含量最高,因此这2处的交叉峰分别分配到→4)-α-GalpA-(1→(A)和→4)-α-GalpA-6-O-Me-(1→(B)的C-1/H-1残基,A和B的H-2到H-5信号可利用COSY进行归属(表6),在COSY谱上,A的H-2至H-5的耦合信号分别为δ 5.05/3.74(H-1/H-2)、δ 3.74/4.01(H-2/H-3)、δ 4.01/4.46(H- 3/H-4)和δ 4.46/4.82(H-4/H-5)。根据得到的H-1到H-5化学位移,可以在HSQC谱中归属13C的化学位移,对应的C-1、C-2、C-3和C-4的耦合信号分别在δ 100.01、67.87、68.04、和78.80处。同时,这些信号可以在TOCSY中得以分辨。B的H-2到H-4的信号与A相同,此外,在HSQC谱中可以观察到甲氧基在δ 3.80/52.67处的耦合信号,并且在HMBC图谱中发现了δ 3.80/170.73处的耦合信号,该信号源于B的C-6/HOMe,这表明GalA的O-6位点发生了甲酯化。由此可以推断OTP-60 N中存在由→4)-α-GalpA-(1→和→4)-α-GalpA-6-O-Me-(1→组成的HG结构域。结合OTP-60的酯化度结果可知,两者在HG中的比例为3∶2。另外,将5.08/99.92处的交叉峰归属为α-GalpA-(1→(C)的H-1/C-1,并通过相同的方法推断出其完整化学位移。
表6 OTP-60 N的1H和13C核磁共振归属信息
Table 6 Attribution information in 1H and 13C NMR spectrum of OTP-60 N
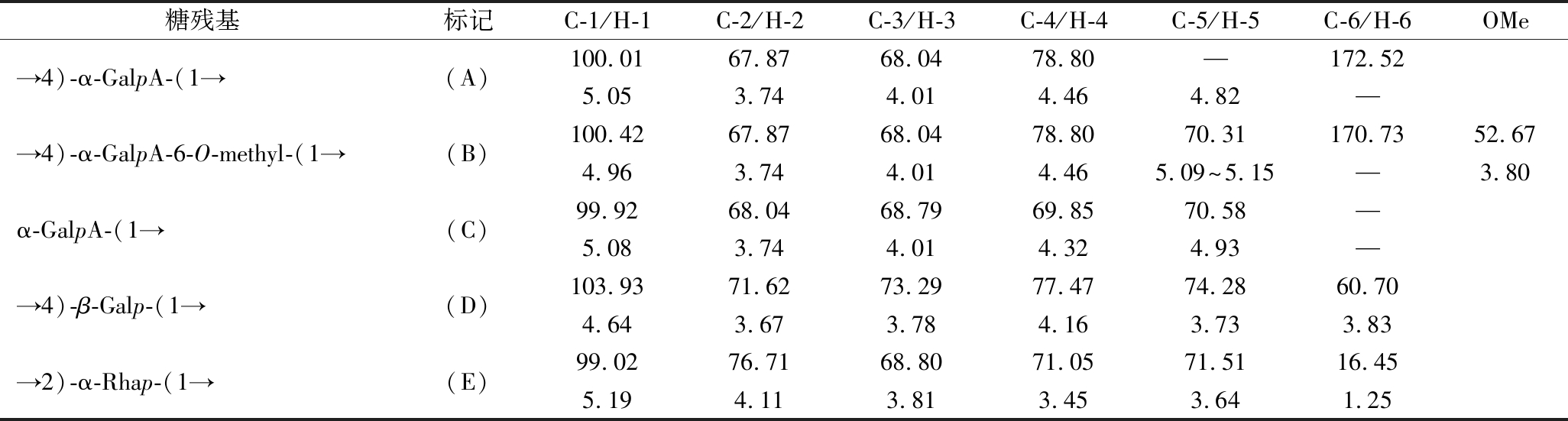
注:—表示未检测到相关信号。
糖残基标记C-1/H-1C-2/H-2C-3/H-3C-4/H-4C-5/H-5C-6/H-6OMe→4)-α-GalpA-(1→(A)100.0167.8768.0478.80—172.525.053.744.014.464.82—→4)-α-GalpA-6-O-methyl-(1→(B)100.4267.8768.0478.8070.31170.7352.674.963.744.014.465.09~5.15—3.80α-GalpA-(1→(C)99.9268.0468.7969.8570.58—5.083.744.014.324.93—→4)-β-Galp-(1→(D)103.9371.6273.2977.4774.2860.704.643.673.784.163.733.83→2)-α-Rhap-(1→(E)99.0276.7168.8071.0571.5116.455.194.113.813.453.641.25
由于鼠李糖是一种特殊的甲基戊糖,所以它的H-1和H-6信号较为清晰。鼠李糖端基氢H-1化学位移为5.24,具有α型糖环构型。根据以往研究[30],将HSQC谱中1.27/16.45处的信号分配给→2)-α-Rhap-(1→(E)的H-6/C-6。通过COSY(图3-a)和TOCSY(图3-b)谱对E的完整质子化学位移进行归属,结合HSQC谱得到了对应的13C信号,C的完整化学位移见表6。结合单糖组成分析可以推测出,OTP-60 N中存在一个较小的且高度分支的RG-Ⅰ部分。
半乳糖残基主要以→4)-β-Galp-(1→(D)的连接方式存在。其13C/1H化学信号被指定为δ 103.93/4.64,标记在HSQC谱的异位区域。此外,通过一维和二维核磁共振谱鉴定了Galp残基的其他质子和碳化学位移。此外,在甲基化分析中检测到→4)-Glcp-(1→,但由于含量较少,以及核磁分析过程中相关吸收峰的重叠,导致这部分单糖残基的碳、氢归属难度较高,因而在核磁分析过程中并未将其次相关化学位移列出。
3 结论
本文从香茶中分离出3种多糖组分,经分级醇沉纯化后,选取纯化得率较高的WTP-40和ATP-40以及峰形较为单一的OTP-60进行基本理化指标的分析。结果发现3种组分的糖醛酸含量均高于70%,单糖测定结果表明,半乳糖醛酸是各组分中的主要单糖。同时,WTP-40、ATP-40以及OTP-60的红外谱图均呈现出多糖的特征吸收峰,表明不同提取方式并未对多糖的主要官能团产生影响,3种组分均属于低酯果胶,其中OTP-60的酯化度最高。此外,通过甲基化结合二维核磁的方式对OTP-60的精细结构进行表征。核磁和甲基化结果显示OTP-60是由HG和RG-I的2种结构域组成,其中HG由→4)-α-GalpA(1→和→4)-α-GalpA-6-O-Me-(1→按照3∶2的比例连接而成,RG-I的主链较短,主要由→4)-α-GalpA(1→和→2)-α-Rhap-(1→连接而成,侧链由→5)-Araf-(1→、→6)-Galp-(1→、→3)-Galp-(1→连接而成。综上,研究结果发现香茶多糖是一种酸性杂多糖,具有果胶的典型特征,本研究丰富了茶多糖的结构解析的数据库,同时为茶多糖活性研究以及构效关系的建立提供了结构参考。
[1] HU T, WU P, ZHAN J F, et al.Structure variety and its potential effects on biological activity of tea polysaccharides[J].Food Science and Human Wellness, 2022, 11(3):587-597.
[2] YANG X P, YU A Q, HU W J, et al.Extraction, purification, structural characteristics, health benefits, and application of the polysaccharides from lonicera japonica thunb:A review[J].Molecules, 2023, 28(12):4828.
[3] YU C X, AHMADI S, SHEN S H, et al.Structure and fermentation characteristics of five polysaccharides sequentially extracted from sugar beet pulp by different methods[J].Food Hydrocolloids, 2022, 126:107462.
[4] VITYAZEV F V, GOLOVCHENKO V V, PATOVA O A, et al.Pectic polysaccharides of black radish taproots:Extraction, structural characterization[J].Food Chemistry, 2024, 436:137692.
[5] SOWINSKI E E, GILBERT S, LAM E, et al.Linkage structure of cell-wall polysaccharides from three duckweed species[J].Carbohydrate Polymers, 2019, 223:115119.
[6] 孙玉姣, 马芸皓, 王凡, 等.不同提取方法对茯茶多糖理化性质和抗氧化作用的影响[J].陕西科技大学学报, 2021, 39(5):31-38.SUN Y J, MA Y H, WANG F, et al.Influence of different extraction methods on physicochemical properties and antioxidant effects of Fu Brick tea polysaccharides[J].Journal of Shaanxi University of Science and Technology, 2021, 39(5):31-38.
[7] LI Q Q, LI J, LI H, et al.Physicochemical properties and functional bioactivities of different bonding state polysaccharides extracted from tomato fruit[J].Carbohydrate Polymers, 2019, 219:181-190.
[8] 朱彩虹. 加快遂昌香茶产业可持续发展的对策和建议[J].中国茶叶, 2018, 40(7):54-56.ZHU C H.Countermeasures and suggestions for accelerating the sustainable development of Suichang Xiangcha tea industry[J].China Tea, 2018, 40(7):54-56.
[9] SCOPARO C T, SOUZA L M, DARTORA N, et al.Chemical characterization of heteropolysaccharides from green and black teas (Camellia sinensis) and their anti-ulcer effect[J].International Journal of Biological Macromolecules, 2016, 86:772-781.
[10] WU Z, ZENG W Z, ZHANG X, et al.Characterization of acidic tea polysaccharides from yellow leaves of Wuyi rock tea and their hypoglycemic activity via intestinal flora regulation in rats[J].Foods, 2022, 11(4):617.
[11] LIU M, GONG Z, LIU H, et al.Structural characterization and anti-tumor activity in vitro of a water-soluble polysaccharide from dark brick tea[J].International Journal of Biological Macromolecules, 2022, 205(Suppl C):615-625.
[12] KANG J, HUANG-FU Z Y, TIAN X N, et al.Arabinoxylan of varied structural features distinctively affects the functional and in vitro digestibility of wheat starch[J].Food Hydrocolloids, 2023, 140:108615.
[13] DUBOIS M, GILLES K A, HAMILTON J K, et al.Colorimetric method for determination of sugars and related substances[J].Analytical chemistry, 1956, 28(3):350-354.
[14] SEDMAK J J, GROSSBERG S E.A rapid, sensitive, and versatile assay for protein using Coomassie brilliant blue G250[J].Analytical Biochemistry, 1977, 79(1-2):544-552.
[15] BLUMENKRANTZ N, ASBOE-HANSEN G.New method for quantitative determination of uronic acids[J].Analytical Biochemistry, 1973, 54(2):484-489.
[16] YU L L, HALEY S, PERRET J, et al.Free radical scavenging properties of wheat extracts[J].Journal of Agricultural and Food Chemistry, 2002, 50(6):1619-1624.
[17] KANG J, YUE H X, LI X X, et al.Structural, rheological and functional properties of ultrasonic treated xanthan gums[J].International Journal of Biological Macromolecules, 2023, 246(15):125650.
[18] GUO Q B, DU J H, JIANG Y, et al.Pectic polysaccharides from hawthorn:Physicochemical and partial structural characterization[J].Food Hydrocolloids, 2019, 90:146-153.
[19] ZHU J X, CHEN Z Y, CHEN L, et al.Comparison and structural characterization of polysaccharides from natural and artificial Se-enriched green tea[J].International Journal of Biological Macromolecules, 2019, 130:388-398.
[20] BABBAR N, ROY S V, WIJNANTS M, et al.Effect of extraction conditions on the saccharide (neutral and acidic) composition of the crude pectic extract from various agro-industrial residues[J].Journal of Agricultural and Food Chemistry, 2016, 64(1):268-276.
[21] BONNINA E, BRUNEL M, GOUY Y, et al.Aspergillus niger I-1472 and Pycnoporus cinnabarinus MUCL39533, selected for the biotransformation of ferulic acid to vanillin, are also able to produce cell wall polysaccharide-degrading enzymes and feruloyl esterases[J].Enzyme and Microbial Technology, 2001, 28(1):70-80.
[22] JIN M Y, LI M Y, HUANG R M, et al.Structural features and anti-inflammatory properties of pectic polysaccharides:A review[J].Trends in Food Science &Technology, 2021, 107:284-298.
[23] KEN H B, JOLIE R P, FRAEYE I, et al.Comparative study of the cell wall composition of broccoli, carrot, and tomato:Structural characterization of the extractable pectins and hemicelluloses[J].Carbohydrate Research, 2011, 346(9):1105-1111.
[24] XU M, QI M Y, GOFF H D, et al.Polysaccharides from sunflower stalk pith:Chemical, structural and functional characterization[J].Food Hydrocolloids, 2020, 100:105082.
[25] ZHANG Z, LIN R, CHEN M M, et al.Valorization of pectic polysaccharides from Gardenia jasminoides Ellis flower:Physicochemical, structural, rheological, and functional properties[J].Arabian Journal of Chemistry, 2023, 16(10):105116.
[26] ZHANG H, CHEN J L, LI J H, et al.Extraction and characterization of RG-I enriched pectic polysaccharides from mandarin citrus peel[J].Food Hydrocolloids, 2018, 79(1):579-586.
[27] HONG T, ZHAO J Y, YIN J Y, et al.Structural characterization of a low molecular weight HG-type pectin from gougunao green Tea[J].Frontiers in Nutrition, 2022,9:878249.
[28] WU C F, PAN L L, NIU W Y, et al.Modulation of gut microbiota by low methoxyl pectin attenuates type 1 diabetes in non-obese diabetic mice[J].Frontiers in Immunology, 2019(10):1733.
[29] YANG Y M, QIU Z C, LI L Y, et al.Structural characterization and antioxidant activities of one neutral polysaccharide and three acid polysaccharides from Ziziphus jujuba cv.Hamidazao:A comparison[J].Carbohydrate Polymers, 2021, 261:117879.
[30] ZHAO J Y, HONG T, HOU Y J, et al.Comparison of structures and emulsifying properties between water-extracted pectins from Fructus aurantii[J].International Journal of Biological Macromolecules, 2023, 242(3):125005.