黄酒是我国历史悠久的传统发酵酒种,与葡萄酒、啤酒并称世界三大古酒[1]。按产品风格不同,分为传统型黄酒、清爽型黄酒、特型黄酒;按含糖量(以葡萄糖为计量)不同,分为干黄酒(<15 g/L)、半干黄酒(16~40 g/L)、半甜黄酒(40~100 g/L)和甜黄酒(>100 g/L);按原料不同,分为糯米黄酒、黍米黄酒、大米黄酒等;按酒曲不同,分为麦曲黄酒、红曲黄酒、小曲黄酒;按生产工艺不同,分为摊饭酒、淋饭酒、喂饭酒[2]。我国黄酒品种、产业地域分布广泛,以秦岭淮河线为界,主要分为南方黄酒和北方黄酒两大派系,分布于浙江、江苏、上海、福建、山东、山西、陕西、湖北、台湾等多个地区[3]。
黄酒起源于谷物酿酒,通过独特的双边发酵制成,即多种产酶微生物的糖化过程与酵母菌的发酵产酒过程同时进行,一般生产过程如图1所示,相较于啤酒和葡萄酒等单边发酵过程效率低、过程复杂、产酒率低、周期长,但酒体丰富、有层次感[4]。黄酒富含种类多样的氨基酸、有机酸、无机盐、维生素和微量元素等营养成分,并含有丰富的活性多糖、功能性低聚糖、生物活性肽、酚类、萜烯类、吡嗪类、γ-氨基丁酸等功能因子[5]。其中,黄酒肽含量远高于其他发酵酒类,约为葡萄酒的24倍,清酒的15倍[6]。目前,已鉴定出500多种具有不同功能作用的黄酒多肽[7],如风味调节、抗氧化、血管紧张素I转换酶(angiotensin converting enzyme,ACE)抑制、降血糖、降血脂、免疫活性、抗菌和抗肿瘤等[8]。整体来讲,在酿造酒领域,生物活性肽的研究正在成为行业热点,黄酒肽具有重要的感官活性和生理活性,但复杂酒体基质中肽的分离鉴定仍然面临挑战,此外,不同地区、不同原料、不同工艺黄酒肽的组成、特性和功能存在较大差异,仍有许多潜在的生物活性肽有待发现。本文从近年来黄酒多肽在分离纯化、鉴定方法、功能活性等方面的主要研究进展进行综述和总结,并对黄酒多肽未来的研究方向进行展望,旨在归纳整理黄酒肽的整体科研进展,为了解传统黄酒的保健养生机理以及高品质黄酒开发提供理论与实践指导。
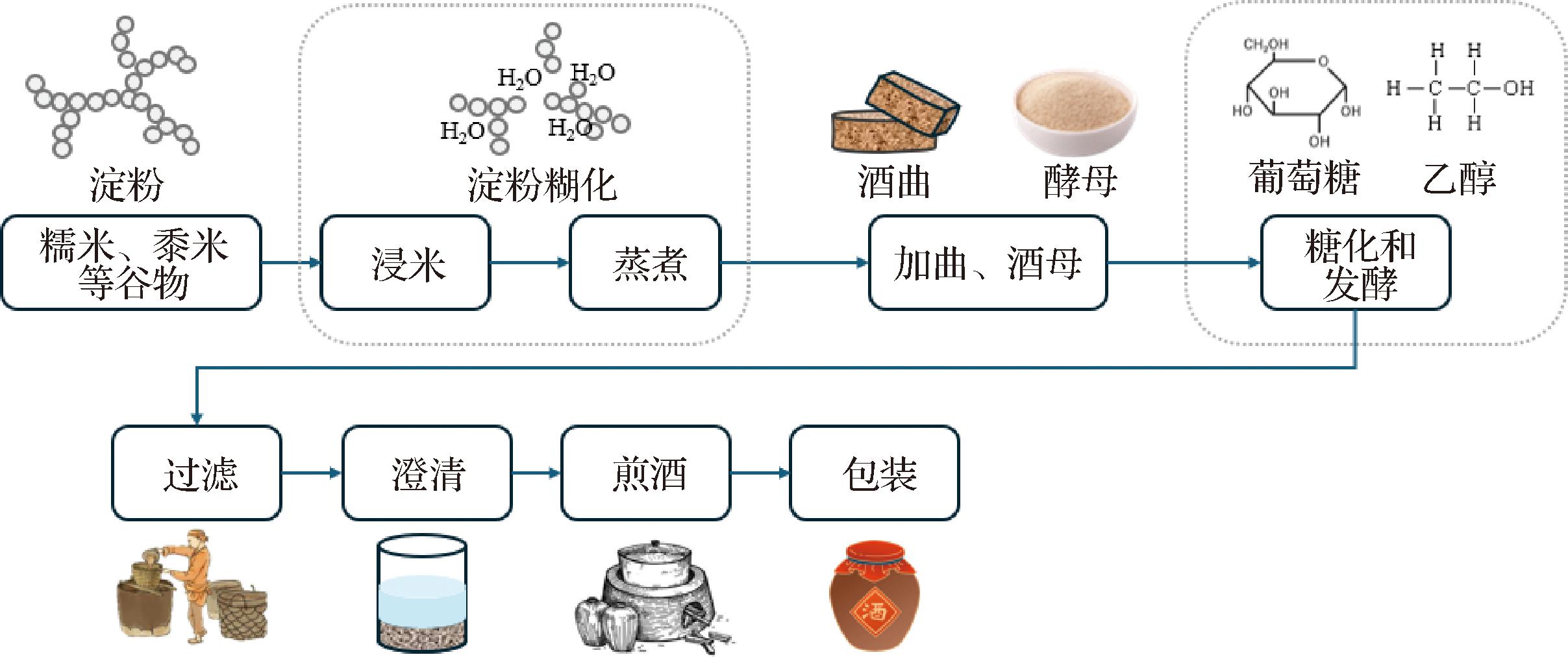
图1 黄酒酿造工艺
Fig.1 The traditional brewing process of Huangjiu
1 黄酒肽分离纯化技术
黄酒肽分离纯化是多肽结构鉴定和活性表征的基础,通常根据多肽的分子质量、等电点、疏水性等不同性质选择合适的分离纯化方法。目前常用的分离纯化技术有膜过滤、色谱、层析、电泳等,膜过滤和柱色谱是应用最广泛的技术手段。值得注意的是,黄酒体系极为复杂,单一技术已不能完全满足高效分离纯化的要求,因此通常采用一些多方法组合技术以取得理想的分离纯化效果。此外,随着技术的不断进步,一些新型的分离纯化技术有望应用于黄酒多肽的研究中,如分子印迹膜、磁性纳米颗粒、毛细管电色谱技术等。表1总结了近年来一些常用的传统方法以及有望应用于黄酒肽分离纯化的新方法。
表1 黄酒多肽分离纯化技术及其优缺点
Table 1 Separation and purification of Huangjiu polypeptides and its advantages and disadvantages

分离方法分离依据优点缺点参考文献超滤分子质量可以起到脱盐、分级纯化的效果,操作简单、分离范围广、选择性好膜污染、限制流量、分离效果差[9-18]大孔吸附树脂分子质量、极性选择性好、操作简便溶剂使用量大、维护成本高[11-12,14-17,19-20]凝胶层析分子质量、形状不易破坏生物大分子、分离效率高分辨率低、分离时间长[9,11,13-14,20]高效液相色谱分子质量、极性、结构分离效率高、可自动化、检测灵敏度高、样品用量少成本高、操作要求高、填料寿命短[7,13,20-21]离子交换色谱电荷分辨率高、灵活性好、适用性广泛操作较复杂、易受杂质影响、效率低、耗时长[9,20]聚丙烯酰胺凝胶电泳电荷、分子质量、形状分离效果好、操作简单、灵敏度好、定量方便不适合大规模分析、分辨率有限、可能会破坏多肽结构[18]分子印迹膜结构、形状能够特异性识别、选择性好、可再生、适用范围广制备工艺复杂[22]毛细管电色谱技术电荷、分子质量、结构分辨率高、分离速度快、样品消耗少成本较高、样品预处理较复杂[23]磁性纳米颗粒技术磁性特性、结构高效快速、可重复适用、适用范围广成本较高、样品需要预处理[24]
1.1 传统分离技术
黄酒多肽的分离纯化技术主要包括超滤、树脂吸附、凝胶过滤层析和高效液相色谱等,由于这些技术的机理已有详尽报道,本文不再赘述。黄酒中富含蛋白质、多糖等大分子物质,而活性肽的分子质量通常低于3 kDa[25],超滤技术常被用于初步去除大分子杂质。例如,HAN等[10]使用截留分子质量为3 kDa的聚醚砜超滤膜处理绍兴黄酒以除去酒体中蛋白质、多糖、核酸等大分子化合物;GUO等[12]使用超滤膜将陈酿5年的广东黄酒分为分子质量>3 kDa和<3 kDa2种组分,并比较了两者的抗氧化能力和ACE抑制活性。此外,大孔树脂吸附和凝胶过滤层析因为其选择性好、操作简便、分离效率高等独特优势,常被应用于超滤后黄酒多肽的进一步纯化。大孔树脂具有高比表面积和强吸附能力,使用不同洗脱溶剂可以除去残留的多糖等杂质,实现黄酒肽的高效分离,成本低廉并且不会影响其生物活性[26]。ZHENG等[19]比较了AB-8、D101和X-5三种大孔树脂对黄酒多肽的提取和富集能力,通过对比静态吸附和解吸效果,非极性大孔树脂X-5表现出最佳的黄酒肽分离纯化能力,这是由于大孔树脂X-5具有均匀的孔径和较高的比表面积,使得对多肽的吸附更为有效。而AB-8具有弱极性和较大的孔径,更适用于吸附各类具有一定疏水性的中药成分,如黄酮类、生物碱类等,D101则因其非极性和大孔结构,对不带极性或弱极性的有机化合物普遍吸附能力强,特别适用于皂甙类、黄酮类和生物碱等物质的分离和纯化。凝胶过滤层析法通过分子质量差异实现肽的分级纯化,溶剂污染少,预处理简便,但分辨率低、分离时间长。这些技术各有特点,适用于不同的应用场景和需求,往往需要采取多方法组合使用以达到最佳的分离纯化效果。SHI等[14]通过凝胶过滤色谱和大孔树脂对黄酒多肽进行逐级纯化,得到了YVKV、LFW和FLF 3种具有降血脂功能的生物活性肽。YU等[13]通过超滤结合Sephadex G-15凝胶过滤色谱以及高效液相色谱成功从绍兴黄酒中分离出了一种苦味肽。LU等[21]通过溶剂萃取辅助味觉引导结合固相萃取和半制备高效液相色谱从黄酒样品中分离出了16个具有苦味的亚组分。值得注意的是,传统分离纯化多方法联用可以实现黄酒肽的逐级纯化,但仍然存在较多局限,如步骤多、损失大、溶剂耗费等,亟需开发更高灵敏度、更高选择性以及更高效率的新策略来弥补这些问题,以确保黄酒分离纯化过程的效率和目标肽的质量。
1.2 新型分离技术
1.2.1 分子印迹膜
分子印迹膜(molecularly imprinted membrane,MIM)结合了分子印迹技术与膜分离,是一种新型膜分离技术,具有特异性的识别位点,能对特定物质进行选择性分离、纯化、富集。在生物医药、食品、污水处理等领域均具有广泛应用[22]。目前分子印迹膜的分离机制可以分为2种,延迟渗透模型和促进渗透模型,即模板分子的传质速度低于和高于非模板分子2种情况。延迟渗透模型则是指当MIM孔径较大时,由于膜内孔径通道的壁面上存在空腔及识别点位,模板分子在通过膜层时会被识别点位所结合,使得模板分子的传质过程受到阻滞,导致传质速率低于非模板分子的现象。在PILETSKY等提出的“门”效应中,MIM膜层上的通道孔径与印迹空腔的尺寸相近,模板分子与空腔及对应的识别点位相互作用,在一定的浓度推动力作用下,可顺利通过膜层,而非模板分子则难以通过,因此就形成了促进渗透模型[27]。使用分子印迹膜对黄酒肽进行分离时,在制备得到的膜中具有特定肽分子模板的孔道,肽分子与分子印迹膜中的特异孔道发生相互作用,从而实现黄酒肽的分离纯化。不少研究证明,分子印迹膜法在黄酒肽的分离纯化中表现出了巨大潜力。OKUTUCU等[28]以肌肽和铜-肌肽配合物为模板分子,以4-乙烯基吡啶和乙二醇二甲基丙烯酸酯为单体和交联剂制备得到了一种对含铜和不含铜的咪唑肽具有特异识别性的分子印迹膜,能够很好地分离目标肽。BUI等[29]综述了自90年代以来分子印迹膜在蛋白质分离纯化上的研究,发现选择最佳肽抗原是多肽与蛋白分离的关键。ZHANG等[30]制备了一种以含谷氨酸低聚肽为交联剂的分子印迹膜,发现由于肽段的引入使分子印迹聚合物的印迹腔形状易于记忆,能够更好地吸附牛血清蛋白,从而高效且有选择性地对牛血清蛋白进行分离。因此,通过选择合适的交联剂和肽受体制备分子印迹膜,能对黄酒多肽高效且特异性的进行分离。
1.2.2 毛细管电色谱技术
毛细管电色谱技术(capillary electrochromatography,CEC)结合了毛细管电泳和液相色谱技术并同时保留了两者的优点[31]。CEC柱内部填充有固定材料,通常是具有吸附和分离性能的小颗粒,利用分子与固定相之间的相互作用来实现分离,通过选择不同的固定相材料可以达到不同的分离效果。CEC中还存在电解质缓冲液,通过施加电场在柱中建立电渗流,正负极性的电场会引导待分离物质在柱中移动,待分离样品中的化合物在固定相表面发生吸附和解吸过程,从而实现分离。在此过程中由于待分离物质中不同组分与固定相之间的静电作用、氢键、疏水作用等相互作用不同,导致分子在柱中的速度和迁移时间也会不同,而进一步分离。CEC常被分为三类:填充床柱、开管柱和整体柱,在蛋白质和肽分离中应用最多的是开管柱CEC[31-32]。SUN等[23]制备得到了一种能够高效分离肽的以二甲丙烯酸乙酯为交联剂的开管毛细管柱,对5种标准肽进行了试验,表现出良好的组内和组间分离效率,验证了该开管柱对肽的分离效果。NAITHANI等[33]则采用功能化偶氮引发剂4,4′-偶氮(4-氰戊烷氯)原位聚合法制备了与聚苯乙烯磺酸共价的开管毛细管电色谱柱,并通过对3种多肽(血管紧张素I、脑啡肽和二肽)的分离试验证明该开管柱在肽分离、肽组学方面具有良好的应用前景。尽管毛细管电色谱技术还未应用于黄酒肽的分离纯化当中,但其体积小、分离效率高、分离速度快等优势,在与质谱的联用进行多肽以及蛋白质组学的研究中越来越受到关注。
1.2.3 磁性纳米颗粒技术
磁性纳米颗粒是一种具有诱导磁矩特性且无毒、负载效率高、生物相容性好的一种纳米颗粒。近年来由于磁性纳米颗粒在合成上取得的巨大进展,在各个领域的应用也越来越受到人们的关注。目前制备的磁性纳米颗粒通常由纯金属、金属合金、金属氧化物或铁氧体组成,应用最为广泛的是铁氧化物纳米颗粒[34]。用磁性纳米颗粒技术进行多肽的分离和纯化时,通常会将具有特定亲和力的配体(如抗体、亲和标记物等)与磁性纳米颗粒表面功能化。将样品与功能化的磁性纳米颗粒混合,配体能特异性与目标多肽结合,施加外加磁场就可以实现目标多肽的高效吸附和分离。在分离过程中,非目标物质被洗脱,目标多肽则保留在磁性纳米颗粒上。随后,可以通过改变条件(例如pH值、离子强度等),使用洗脱缓冲液来解离目标多肽与磁性纳米颗粒之间的相互作用,实现目标多肽的纯化[35-36]。FENG等[24]以Fe3O4为原料制备磁性纳米颗粒,用于分离纯化裙带菜蛋白水解物中的ACE抑制肽,成功分离得到了一种新的ACE抑制肽KNFL。LU等[37]则以FeCl2·4H2O磁性纳米颗粒为原料,结合十六烷基亚氨基二乙酸和FeCl3·6H2O制备了一种金属亲和固定磁性脂质体(metal affinity immobilized magnetic liposomes,MA-IML),发现该MA-IML能够便捷高效地对蜥蜴鱼蛋白水解物中的ACE抑制肽进行分离提纯。磁性纳米颗粒制备简单、成本低、分离效果好,在各种食品原料蛋白质水解物的肽提纯中都显示了良好的分离性状,运用磁性纳米颗粒技术有望实现黄酒中各种功能活性肽的高选择性识别和捕获,从而避免非特异性吸附和分离,另外可以通过外加磁场实现对其的回收和再利用,从而减少材料的消耗和成本,具有广阔的应用前景。
2 黄酒多肽的鉴定
黄酒中存在着复杂的蛋白质、多肽系统,且富含各种生物活性肽。不同氨基酸组成、折叠方式的肽往往具备不同的功能。了解黄酒中肽的结构有利于进一步对黄酒肽进行开发利用。多肽的鉴定有多种方法,包括质谱分析、核磁共振,以及红外光谱、紫外光谱、圆二色谱辅助解析方法等,其中液质联用是最常用的方法之一。样品中的肽段经过液相色谱分离后在质谱分析仪中被离子化成带电离子;带电离子进入质谱仪,经过高能碰撞或激光辐射等作用,发生碎裂,形成碎片离子;碎片离子的质荷比(m/z)通过质谱仪检测并记录,然后通过从头合成的方法手动测序或从数据库中识别序列即可实现对肽段的鉴定。
2.1 从头测序
从头测序是肽鉴定最早使用的方法之一,传统方法是利用Edman降解进行测序,但该方法灵敏度低、效果差,因此目前常采用串联质谱的方法进行从头测序。相较于比库的方法而言,从头合成的肽序列鉴定不受数据库收录信息的影响,对于一些数据库比对无法鉴定的肽序列突变,例如蛋白质序列变体、剪接异构体、延伸肽序列以及含有非蛋白质或化学修饰氨基酸的修饰肽,从头合成都有较好的效果[38]。其原理是通过将串联质谱二次获取的肽片段离子的m/z值和强度记录下来,利用蛋白质组学中的自动化过程进行分析确定肽序列[39]。当肽离子经历碎片化以进行分析时,可以产生不同的碎片离子系列,并记录下来。因此,正确识别碎片离子的类型并提高前体离子和碎片离子的质量精度,对于准确的从头测序至关重要[40]。常见的电离技术有电子轰击离子化、化学离子化、大气压化学电离、场解析离子化等,而随着基质辅助激光解吸/电离和电喷雾电离等新型电离技术的发展,大大提高了前体离子和碎片离子的质量精度,促进从头测序的进一步应用[41]。好的鉴定结果离不开自动化的序列分析算法,目前常见从头测序的算法有PEAKS、Lutefisk、Novor和PepNovo等。不同的算法都有其各自的优缺点,鉴定肽序列时应多种方法进行综合比较,例如PepNovo对于短肽具有较好的预测和鉴定效果,但不适合较长的肽,而Novor和PEAKS则在检索正确的肽标签时,在碰撞诱导解离和高能碰撞诱导解离方面的表现比PepNovo好[42]。ZHANG等[43]建立了一种简单有效的非同量肽末端标记辅助的从头测序策略NIPTLNovo,其根据N端和C端掺入的不同质量标签,可以清楚地区分肽的y系列离子和b系列离子,提高了肽测序的准确性和测序速度,该方法样品的定量分析可以与从头测序同时进行且可通过与基于质量缺陷的同位素标记相结合来发现具有潜在突变位点的肽。
2.2 数据库比对
从头测序的发展使越来越多的肽序列被记录下来形成了一个丰富的肽数据库,通过数据库比对,可以更加高效快捷进行肽鉴定。数据库比对是一种常见的基于质谱学分析方法的肽鉴定手段,通过将获得的质谱数据和已知肽或蛋白质序列数据库对比,利用生物信息学软件分析,能得到一个或多个可能的肽段鉴定结果[44]。目前常用于模拟蛋白质水解过程的软件有BIOPEP和ExPASy-PeptideCutter,这2个软件均能提供带有裂解位点的蛋白质序列信息,为进一步的肽分析提供帮助[45]。除此之外,还有许多的蛋白质和肽数据库(如BIOPEP:https://biochemia.uwm.edu.pl/;Uniprot:https://www.uniprot.org/;NCBI(National Center of Biotechnology Information):https://www.ncbi.nlm.nih.gov/;RCSB PDB:https://www.rcsb.org/)能够与从LC-MS或毛细管色谱-质谱联用获得的数据进行比对,快速鉴定出待测多肽[46]。之后再利用一些生物信息学手段就能对肽的三维结构和生物活性进行预测,例如PEP-FOLD程序能够对抗病毒肽的3D结构进行建模,更好的了解相关抗病毒肽的结构[47]。GUO等[12]采用带有C18反相色谱柱的组合型四极杆Orbitrap质谱仪对广东糯米黄酒中的肽段进行分析,利用UniProt蛋白质数据库进行比对鉴定,共鉴定出76个未修饰组的肽序列。YU等[13]采用超高效液相色谱-四极杆飞行时间质谱对通过凝胶过滤色谱分级后苦味最强的黄酒肽的分子质量和结构进行了表征,在Masslynx中针对Biolynx自动搜索肽序列,最终鉴定出一种分子质量为508.5 Da的苦味肽序列,即LPTL。然而,数据库比对的方法只有在处理具有完整的蛋白质数据库和已知的酶裂解规则的肽段时才能非常成功。而在大多数情况下,一些食品中蛋白使用的酶位点不是特异性的,不仅识别过程需要更长的时间来计算结果,而且与肽识别相关的概率也可能较低。这些问题对于非测序生物体来说尤其受到限制。
3 黄酒多肽的功能研究进展
据研究报道黄酒中存在丰富的鲜味肽、苦味肽、甜味肽等多肽,能对黄酒的风味口感起修饰作用,使黄酒的口感更加丰富醇厚。此外,黄酒中还富含具有抗氧化、抗炎、免疫活性、ACE抑制活性、抗菌活性的生物活性肽,能起到降血压、降血脂、增强机体免疫力等作用。表2总结了近年来发现的不同功能的黄酒多肽。
表2 近年来从黄酒中鉴定出的多肽及其功能
Table 2 Polypeptides and their functions identified from Huangjiu in recent years

结构功能参考文献DWDPHGL、VPEPEPH、LTPEPEH、GANQLDPR、FREE、LDFR、QEGW、RDH具有鲜味[9] DTYNPR、TYNPR、SYNPR、RFRQGD、NFHHGD、FHHGD、TYNPR、SYNPR、NFHHGD、FHHGD、TVDGPSH具有鲜味、鲜味增强[17]LPTL具有苦味[13]PGP具有苦味[21]QSGPACE活性抑制[15]VLSGA、VISGA、MGKAA、GHVAAACE抑制,抗氧化[12]含Arg、Leu、Lys的肽抗氧化[20]SSLFR、QFTPR、FTYPRα-葡萄糖苷酶抑制和抗氧化活性[19]CGSP胆固醇溶解,自由基清除[10]YVKV、LFW、FLF降血脂[14]多产地黄酒的特征肽(主要有VYVPPE)降血糖[7] 绍兴黄酒中的43种功能肽感官、生物活性[10]
3.1 黄酒多肽的风味修饰作用
黄酒因其独特的柔和且层次丰富的口感,在酒类中独树一帜,受到广泛喜爱。与高度蒸馏的白酒和浓烈的红酒相比,黄酒展现出更为圆润的酒体,并带有微妙的甜味或苦味,无过度刺激感。近年来的研究表明,黄酒中存在鲜味肽和苦味肽,能够使黄酒酒体口感更加丰富、复杂。此外,还存在一些甜味肽、咸味肽和醇厚感肽等风味肽有待研究。
鲜味肽,作为发酵食品中的关键鲜味物质,通过激活T1R1/T1R3异二聚体鲜味受体,刺激大脑味觉中枢产生鲜味感知,其作用机制如图2所示。至今,已鉴定出300余种鲜味肽,但黄酒中的报道相对较少[48]。CHANG等[9]利用超滤、离子交换、凝胶层析和纳米高效液相色谱-质谱联用技术从绍兴黄酒中分离鉴定出8种鲜味肽DWDPHGL、VPEPEPH、LTPEPEH、GANQLDPR、FREE、LDFR、QEGW和RDH,并通过DoT因子发现RDH可能是黄酒中关键鲜味肽之一,分子对接发现该鲜味肽能与T1R1-T1R3关键活性残基结合,通过氢键和疏水力形成稳定的配合物。该研究者还通过肽组学的方法对4 158个鲜味肽进行了鉴定,利用虚拟筛选、分子对接和感官验证等方法筛选出了5个鲜味增强肽TYNPR、SYNPR、NFHHGD、FHHGD和TVDGPSH,并通过分子对接发现T1R3在鲜味增强肽的识别中也起着不可缺少的作用[17]。
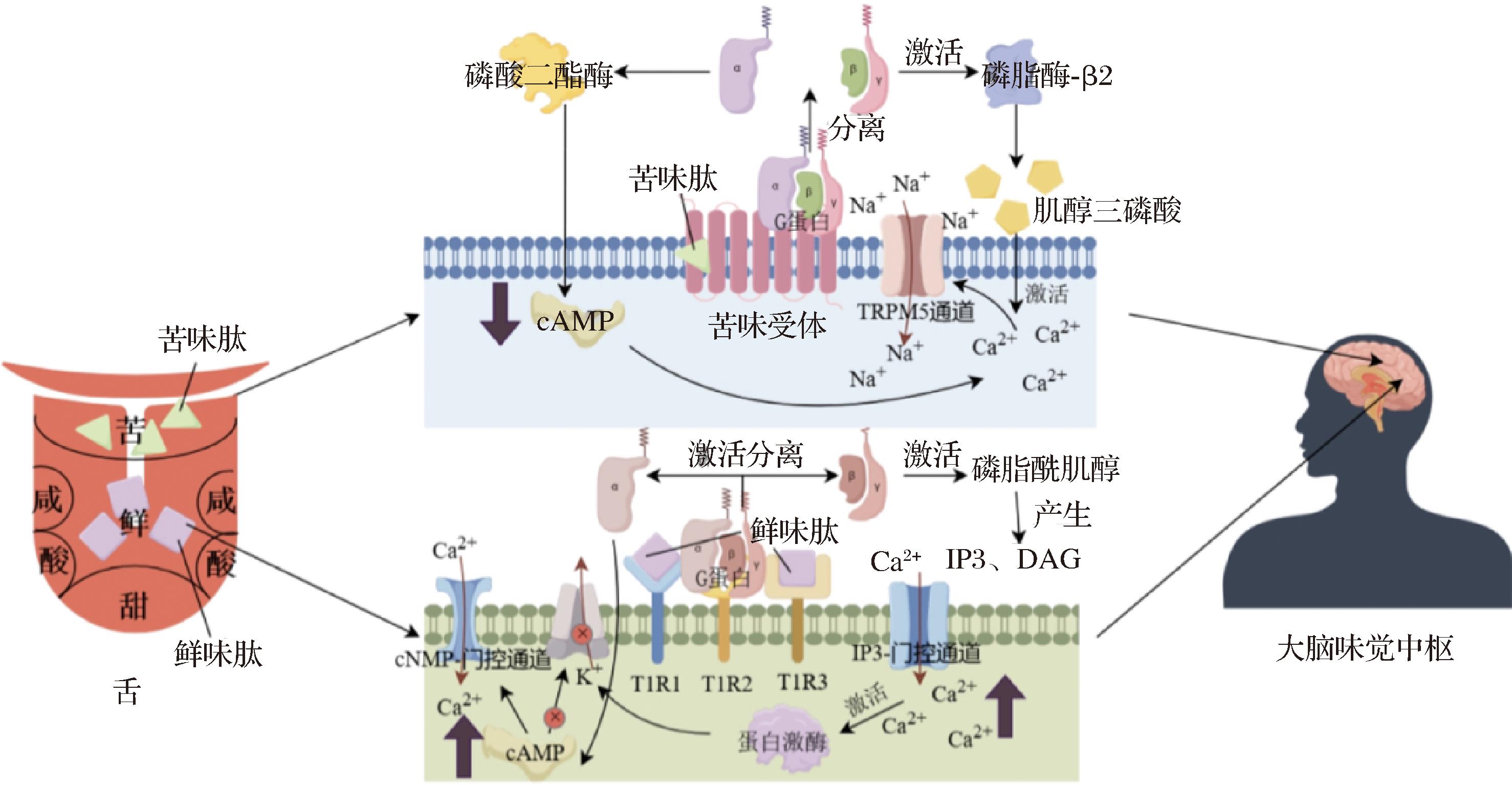
图2 黄酒多肽部分苦味和鲜味呈味机理[49-50]
Fig.2 Mechanism of bitter and umami flavors in Huangjiu peptides[49-50]
黄酒中的苦味肽可以增添黄酒的层次感和口感,使酒液更加丰富和饱满。苦味肽通过与味觉细胞上苦味受体结合,促使G蛋白偶联受体分离,激活磷酸二酯酶或磷脂酶-β2通路,刺激大脑味觉中枢产生苦味(图2),这种苦味则往往被视为一种独特的韵味[49]。YU等[13]采用超滤、凝胶过滤色谱和高效液相色谱-四极杆飞行时间质谱分离出口感功效最高的苦味肽LPTL,发现当LPTL在绍兴黄酒重组模型中的添加量达到320 μg/mL时,黄酒模型就会出现苦味,说明LPTL对黄酒的苦味起重要作用。除了上述已鉴定出的鲜味肽和苦味肽,黄酒中还存在许多亟待发掘的呈味肽,它们一起组成了黄酒独特的口感和滋味。
3.2 抗氧化作用
由于细胞氧化呼吸和外界刺激机体无时无刻在发生各种各样的氧化还原反应,产生大量的自由基。在自由基含量较低时,对细胞反应和免疫功能具有一定的促进作用;而一旦机体内的自由基含量过高,将会导致与内源性抗氧化系统之间不平衡而产生氧化应激反应。目前的实验证据表明过量的氧化应激会诱导细胞结构改变,导致许多病理生理障碍,包括糖尿病、炎症和免疫系统失调等疾病[51]。因此,抗氧化物质可以帮助解决体内自由基过量而导致的氧化应激问题。多项证据表明,黄酒多肽具有良好的抗氧化活性,能清除机体内产生的过量自由基,激活Nrf2-ARE信号通路,其部分抗氧化机理如图3所示。
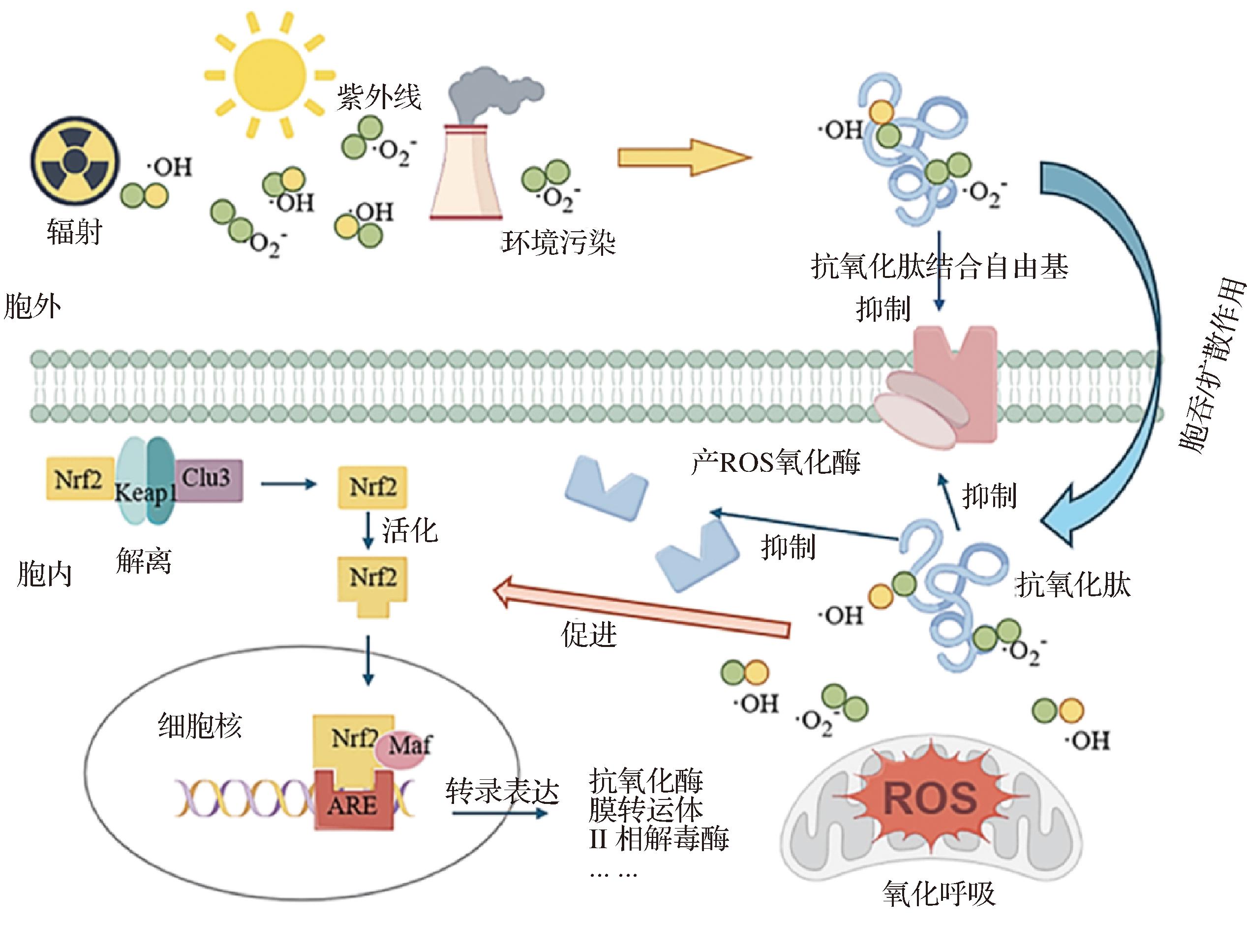
图3 黄酒多肽部分抗氧化机理[53]
Fig.3 Antioxidative mechanism of Huangjiu polypeptide[53]
GUO等[12]通过超滤和反相高效液相色谱从广东黄酒中分离出4个具有潜在抗氧化活性的肽段:VLSGA、VISGA、MGKAA和GHVA,并通过DPPH自由基、ABTS阳离子自由基清除实验和细胞抗氧化活性实验验证了4种黄酒多肽的抗氧化能力,发现4种多肽的EC50值分别为0.054、0.027、0.118、0.056 mg/mL,且4种肽均能有效地避免细胞的氧化损伤。ZHENG等[19]利用大孔树脂吸附层析分离出苏州黄酒中的3种新型抗氧化肽SSLFR、QFTPR和FTYPR,这些肽可以通过氢键、π键和范德华力与ABTS阳离子自由基、DPPH自由基的活性位点结合,有效地清除ABTS阳离子自由基、DPPH自由基,具有良好的抗氧化活性。黄酒多肽的抗氧化作用主要是通过抑制生物大分子的过氧化物或清除体内羟自由基、超氧阴离子自由基等,阻断或终止细胞内自由基链反应,从而保护细胞免受损伤[52]。
3.3 ACE抑制活性
随着生活习惯的改变,高血压等心血管疾病成为了人们常见的健康问题。血管紧张素是一种在肾脏中的酶(ACE)作用下产生的肽类激素,与心血管疾病的产生息息相关[54]。它在体内具有多种生理活性,包括调节血压和水-电解质平衡[55]。血管紧张素能够刺激平滑肌细胞收缩,导致血管收缩和血压升高。这是因为血管紧张素原能激活血管收缩素-血管紧张素系统(renin-angiotensin system,RAS),促使肾脏释放肾素,进而启动一系列的酶反应,在ACE的作用下使肾素转化为血管紧张素Ⅱ,而血管紧张素Ⅱ通过结合血管紧张素受体,刺激血管平滑肌收缩,引起血管阻力的增加,导致血压升高[56],其部分机理如图4所示。血管紧张素还参与调节水钠平衡,通过促进肾小球滤过率的增加,导致体液潴留,血容量增加,增加血管压力,使血压升高[57]。
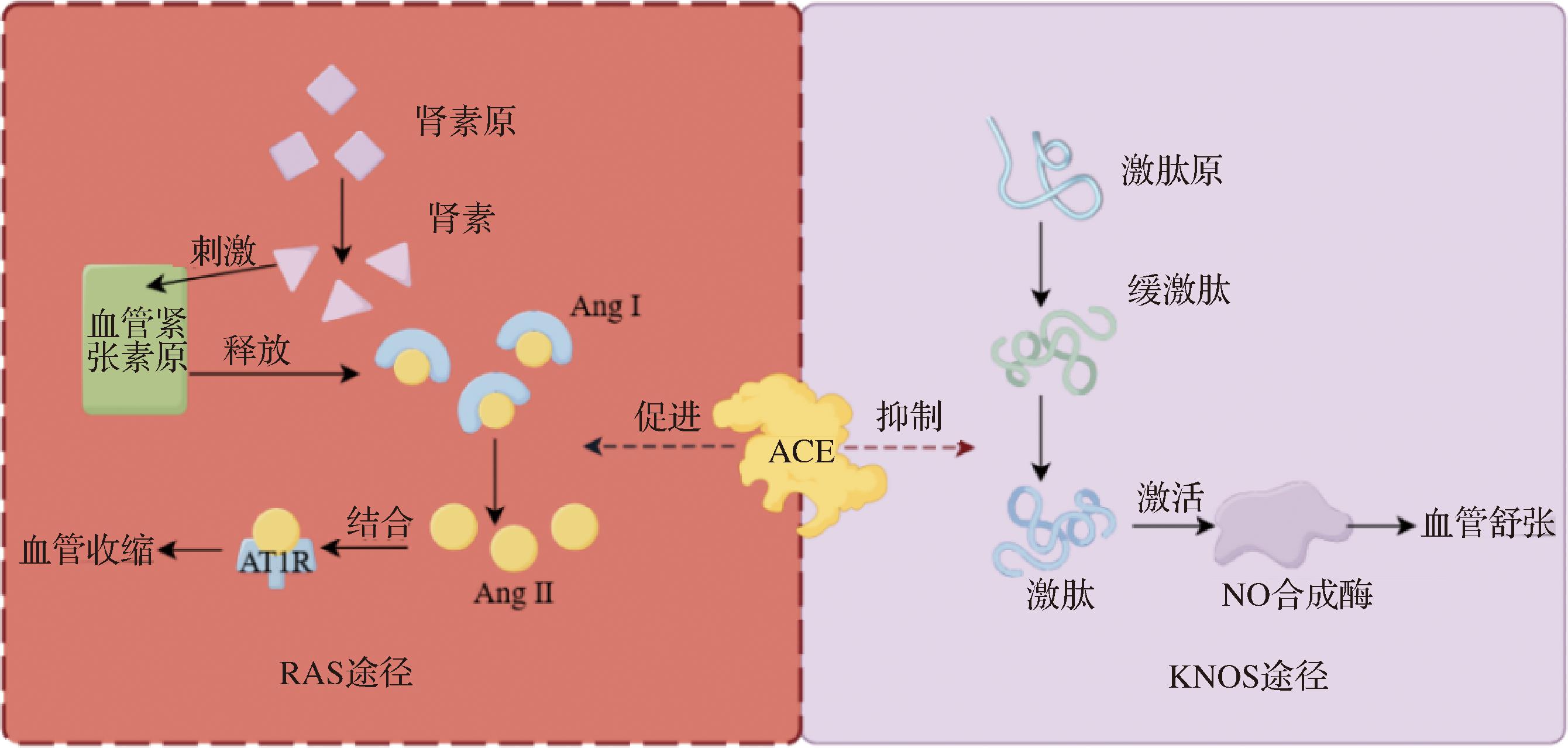
图4 ACE促进血管收缩机理[58]
Fig.4 Mechanism of ACE promoting vascular constriction[58]
而黄酒多肽被证实具有良好的ACE抑制活性,能有效调节血压。GUO等[12]发现的4个新黄酒多肽除了氧化活性还具有良好的ACE抑制活性。而早在1996年,张钰[59]就从福建老酒中分离出了具有ACE抑制活性的2个多肽组分,其活性抑制率分别为34.5%和33.8%。此后,戴军等[15]也通过高效液相色谱-电喷雾电离质谱联用分析法从绍兴黄酒中分离鉴定出出一种ACE活性抑制肽QSGP,并通过实验证明绍兴黄酒中含有的肽成分具有显著的ACE抑制活性,其活性肽的产生主要归因于黄酒酿制过程中所用原料,如糯米、麦曲和酒药中多种特有微生物和酶的作用。
3.4 抗菌活性
抗菌肽是一类生物相容性良好,能降低细菌耐药概率,抑制细菌生长繁殖的多肽,也是生物抵御外来病原体入侵免疫防御机制的重要组成部分。但是由于市面上大多抗菌肽存在结构复杂、提取或合成成本高、易被清除和产生不良反应等问题,寻找新的易于提取和工业化生产的抗菌肽迫在眉睫[60]。人们最早是从小麦及其近缘胚乳中发现的天然抗菌肽,于是将目光投向了植物抗菌肽的提取和合成中,目前已发现大约250种天然植物抗菌肽被登记在抗菌肽数据库中,而随着进一步的发展,人们发现其他日常食品中也存在大量抗菌肽[61]。抗菌肽的抑菌机制主要体现为破坏细菌细胞膜完整性或干扰细胞壁生物合成、蛋白质合成、DNA复制、RNA转录和脂肪酸生物合成,从而杀死细菌或抑制细菌生长繁殖[62],其中破坏细菌细胞膜完整性被认为是抗菌肽的主要作用模式,抗菌肽与细胞膜的相互主要有“桶壁模型”、“环形孔隙模型”和“地毯模型”(图5)。从构效关系上来看,抗菌肽的抑菌效果则主要是取决于净正电荷(肽链中酸性残基上过量的赖氨酸和精氨酸)和疏水性残基(通常含有大约50%的疏水残基)。而目前鉴定出的黄酒多肽中许多肽段都含有赖氨酸和精氨酸[7],人们发现黄酒中的发酵产物也具有良好的抑菌效果。例如杨慧[63]在体外模拟胃消化体系研究了黄酒对大肠杆菌的抑菌率和抗菌性能,发现当人们适量饮入黄酒时能有效抑制大肠杆菌的生长繁殖,降低被感染的风险。然而,关于黄酒中抗菌多肽的具体研究还相对较少,需要更多的科学实验和分析来确定其种类和活性。
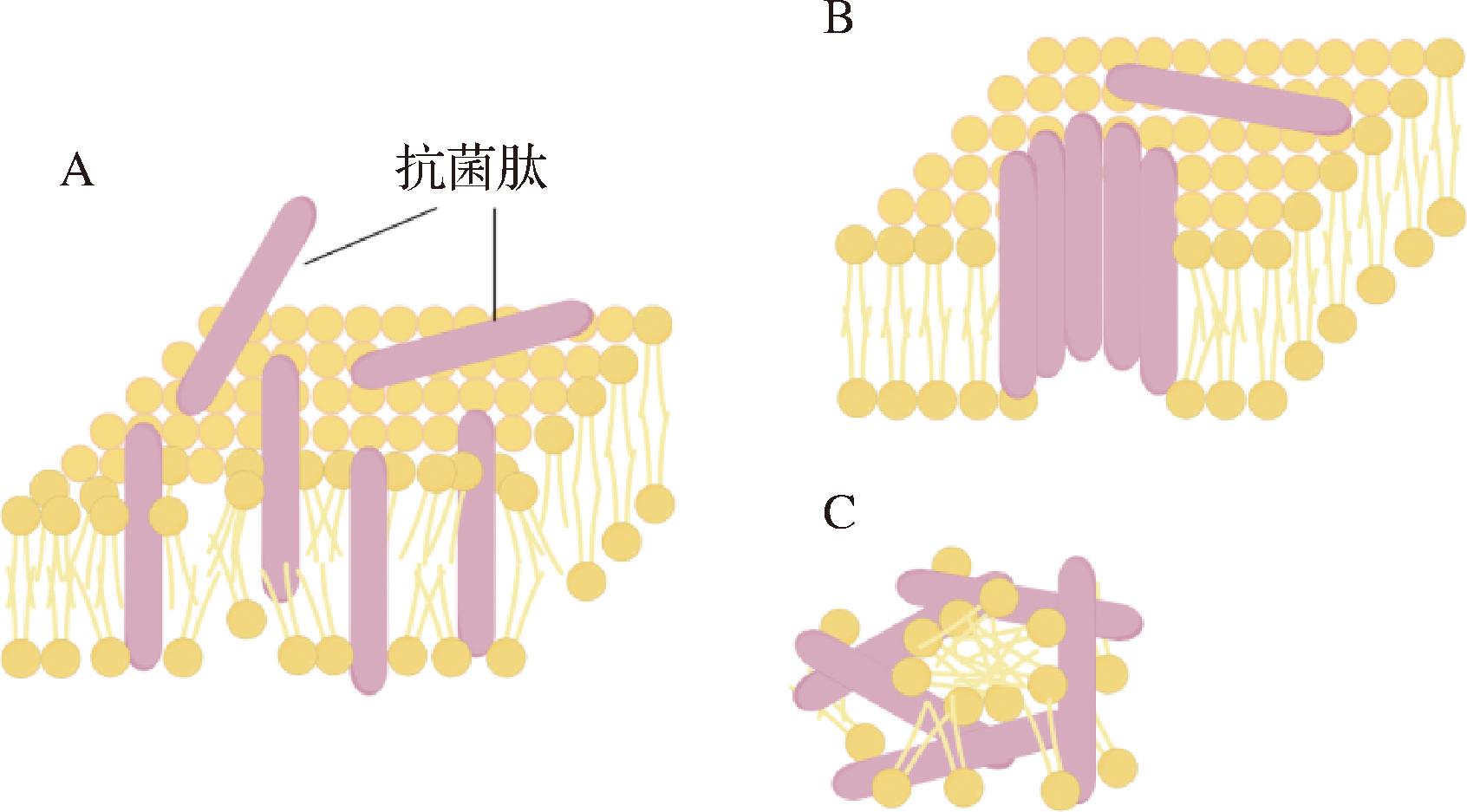
A-桶壁模型; B-环形孔隙模型; C-地毯模型
图5 抗菌肽与细菌细胞膜的部分相互作用模型[64]
Fig.5 Partial interaction model between antimicrobial peptides and bacterial cell membrane[64]
3.5 其他活性
除上述几种功能,黄酒多肽还具有免疫调节、抗炎、降胆固醇、二肽基肽酶IV(dipeptidyl peptidase IV,DPP-IV)抑制等作用,总结黄酒肽的功能如图6所示。HAN等[10]使用超高效液相色谱-电喷雾电离-串联质谱对绍兴黄酒中的低分子质量肽进行鉴定,发现了43种存在潜在生物活性的肽,其中YGGEG具有免疫调节作用,YPR具有降胆固醇的作用;DLNP具有抗高血压的作用,LLP、LPFR和VFGPR具有DPP-IV抑制的作用。冯瑞雪等[65]通过大孔树脂吸附和凝胶色谱等方法对黄酒中的多肽组分进行分级纯化得到黄酒多肽SJ组分,发现黄酒多肽SJ组分质量浓度为0.3、0.6、1.2和2.5 mg/mL时能明显抑制小鼠巨噬细胞RAW264.7释放NO(抑制率分别为20.85%、36.42%、68.58%和95.01%),说明黄酒多肽对RAW264.7细胞炎症具有保护作用,促使巨噬细胞发挥免疫作用。王正元[11]等通过凝胶过滤色谱和反高效液相色谱对黍米黄酒中的多肽进行分离纯化,发现氨基酸序列为CGSP的四肽具有良好的胆固醇溶解抑制率和较高的自由基清除率。黄酒中的多肽组分含量高、种类复杂,除了已发现的活性功能外,还有许多潜在生物活性肽待挖掘,如抗疲劳、抗衰老、抗血栓、促进生长发育、降血糖等活性肽,仍需对其有效成分和作用机制方面进行更进一步的系统研究。
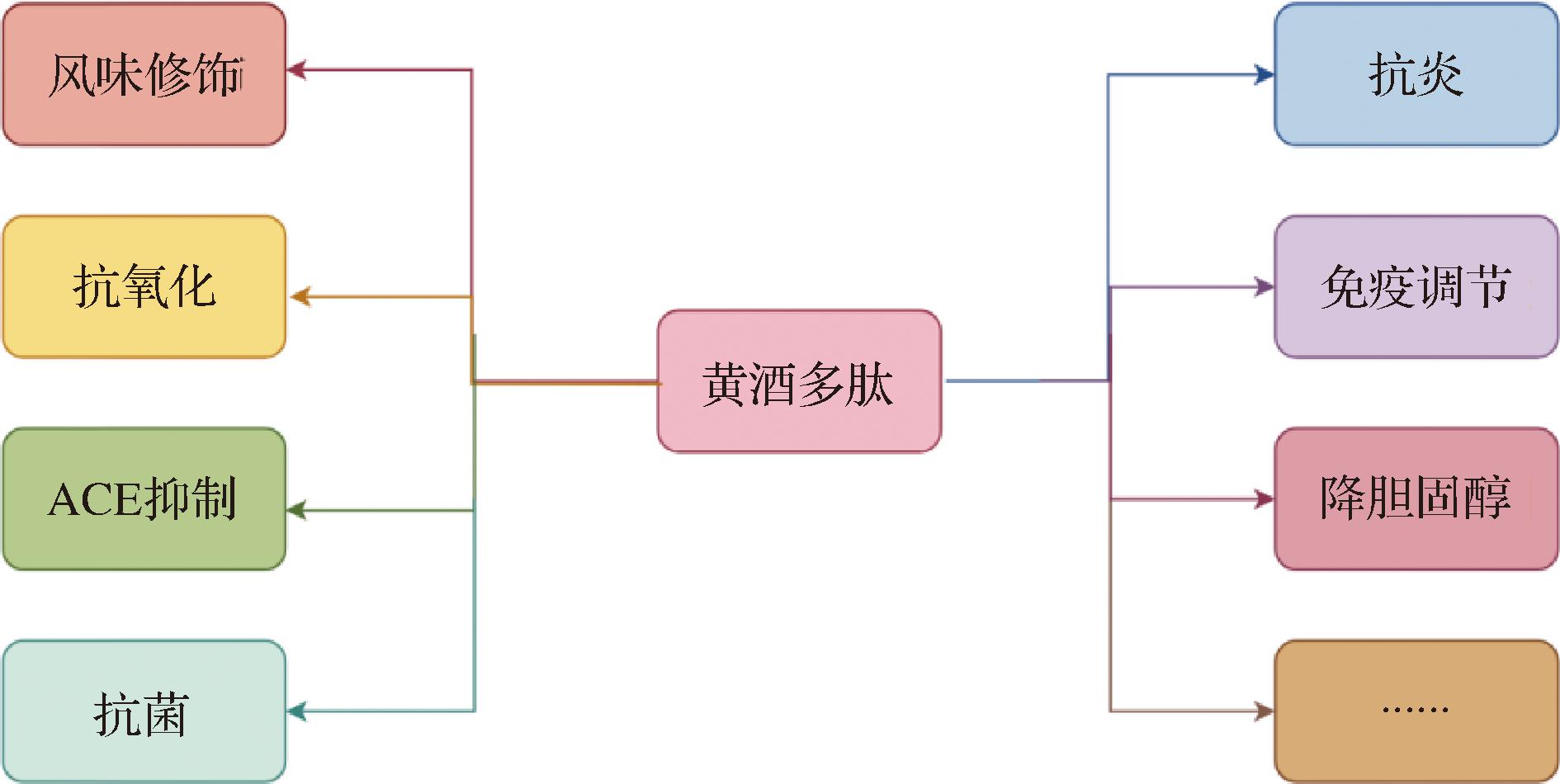
图6 黄酒多肽功能总结
Fig.6 Summary of polypeptide function of Huangjiu
4 总结与讨论
黄酒中多肽含量丰富,种类复杂,具有良好的生物和感官活性,对黄酒的品质和保健功能都具有较大影响。然而,黄酒多肽的分离纯化和功效研究仍然面临着诸多挑战和机遇。在分离纯化方面,需要进一步改进和优化传统方法,引入新型技术以提高效率和纯度。在活性肽的鉴定方面,需要加强质谱分析等手段,确保鉴定精确。另外,还需要加强黄酒多肽在原料溯源方面的研究,了解各类功能肽的来源,有助于改良产品生产工艺,生产更加高品质的黄酒。此外,黄酒多肽的功能性研究报道虽然已经很多,但产业化研究寥寥无几。因此,还需加强黄酒多肽的产业化应用,将其潜在的健康功能转化为实际效益,促进产业发展和经济增长。
[1] 于抗非, 毛青钟, 裘哲灵, 等.小米黄酒酿造工艺及体外抗氧化活性研究[J].酿酒, 2024, 51(1):87-94.YU K F, MAO Q Z, QIU Z L, et al.Study on brewing technology and antioxidant activity in vitro of millet Huangjiu[J].Liquor Making, 2024, 51(1):87-94.
[2] 阮凤喜. 半干型客家黄酒工艺优化及风味物质的研究[D].广州:仲恺农业工程学院, 2022.RUAN F X.Research on process optimization and flavor compounds of semi-dry Hakka Huangjiu[D].Guangzhou:Zhongkai University of Agriculture and Engineering, 2022.
[3] 汪江波, 王浩, 孔博, 等.黄酒酿造技术研究进展[J].酿酒, 2020, 47(6):26-30.WANG J B, WANG H, KONG B, et al.Recent advances in Huangjiu fermentation technology[J].Liquor Making, 2020, 47(6):26-30.
[4] 毛青钟, 宣贤尧.绍兴黄酒的酿造特点[J].中国酿造, 2006,25(4):5-8.MAO Q Z, XUAN X Y.Brewing characteristics of Shaoxing Huangjiu[J].China Brewing, 2006,25(4):5-8.
[5] 罗浩怡, 曾林, 张雅琦, 等.黄酒中多肽的研究进展[J].现代食品, 2021, 27(2):85-88.LUO H Y, ZENG L, ZHANG Y Q, et al.Research progress of peptides in Huangjiu[J].Modern Food, 2021, 27(2):85-88.
[6] LU Q Y, LEE R P, HUANG J J, et al.Quantification of bioactive constituents and antioxidant activity of Chinese yellow wine[J].Journal of Food Composition and Analysis, 2015, 44:86-92.
[7] 周梦洁. 黄酒肽的分离纯化、结构鉴定及其降血糖活性研究[D].杭州:浙江大学, 2021.ZHOU M J.Studies on the purification, identification, and hypoglycemic activity of peptides from Chinese rice wine[D].Hangzhou:Zhejiang University, 2021.
[8] 谢广发, 戴军, 赵光鳌, 等.科学认识黄酒的保健养生功能[J].中国酿造, 2004,23(1):30-31.XIE G F, DAI J, ZHAO G A, et al.Understanding scientifically the health-protect function of rice wine[J].China Brewing, 2004,23(1):30-31.
[9] CHANG R, ZHOU Z L, DONG Y, et al.Ion-exchange purification, nano-HPLC-MS/MS identification and molecular dynamics simulation of novel umami peptides from fermented grain wine (Huangjiu)[J].Journal of Food Composition and Analysis, 2024, 125:105822.
[10] HAN F L, XU Y.Identification of low molecular weight peptides in Chinese rice wine (Huang Jiu) by UPLC-ESI-MS/MS[J].Journal of the Institute of Brewing, 2011, 117(2):238-250.
[11] 王正元. 黍米黄酒生物活性肽的分离鉴定及功能性研究[D].郑州:河南工业大学, 2015.WANG Z Y. Isolation, identification and functional study of bioactive peptides from millet rice wine[D]. Zhengzhou: Henan University of Technology, 2015.
[12] GUO J B, LU A C, SUN Y N, et al.Purification and identification of antioxidant and angiotensin converting enzyme-inhibitory peptides from Guangdong glutinous rice wine[J].LWT, 2022, 169:113953.
[13] YU H Y, WANG X Y, XIE J R, et al.Isolation and identification of bitter-tasting peptides in Shaoxing rice wine using ultra-performance liquid chromatography quadrupole time-of-flight mass spectrometry combined with taste orientation strategy[J].Journal of Chromatography A, 2022, 1676:463193.
[14] SHI Y, FENG R X, MAO J Q, et al.Structural characterization of peptides from Huangjiu and their regulation of hepatic steatosis and gut microbiota dysbiosis in hyperlipidemia mice[J].Frontiers in Pharmacology, 2021, 12:689092
[15] 戴军, 谢广发, 陈尚卫, 等.绍兴黄酒中一种ACE活性抑制肽的分离和鉴定[J].食品与发酵工业, 2005, 31(5):98-101.DAI J, XIE G F, CHEN S W, et al.Isolation and identification of inhibitory peptides for angiotensin converting enzyme in Shaoxing rice wine[J].Food and Fermentation Industries, 2005, 31(5):98-101.
[16] 李燕, 陆丽利, 郑校先, 等.大孔树脂吸附黄酒中活性肽的研究[J].化学研究与应用, 2010, 22(10):1272-1277.LI Y, LU L L, ZHENG X X, et al.Study on the separation of peptides from Chinese rice wine by macroporous resin[J].Chemical Research and Application, 2010, 22(10):1272-1277.
[17] CHANG R, ZHOU Z L, DONG Y, et al.Sensory-guided isolation, identification, and active site calculation of novel umami peptides from ethanol precipitation fractions of fermented grain wine (Huangjiu)[J].Foods, 2023, 12(18):3398.
[18] ZHANG B, GUAN Z B, CAO Y, et al.Secretome of aspergillus oryzae in Shaoxing rice wine koji[J].International Journal of Food Microbiology, 2012, 155(3):113-119.
[19] ZHENG X Q, CHI H, MA S, et al.Identification of novel α-glucosidase inhibitory peptides in rice wine and their antioxidant activities using in silico and in vitro analyses[J].LWT-Food Science and Technology, 2023, 178:114629.
[20] 孟如杰. 黄酒中抗氧化活性物质的研究[D].无锡:江南大学, 2008.MENG R J. Study on antioxidant active substances in yellow rice wine[D]. Wuxi: Jiangnan University, 2008.
[21] LU Z D, XIE G F, WU D H, et al.Isolation and identification of the bitter compound from Huangjiu[J].Food Chemistry, 2021, 349:129133.
[22] YANG H, LIU H B, TANG Z S, et al.Synthesis, performance, and application of molecularly imprinted membranes:A review[J].Journal of Environmental Chemical Engineering, 2021, 9(6):106352.
[23] SUN G L, LU Y.A novel one-pot strategy of preparation of N-phenylacrylamide-styrene co-polymer open tubular capillary column for peptides separation[J].Journal of Separation Science, 2020, 43(24):4461-4468.
[24] FENG X Z, LIAO D K, SUN L X, et al.Affinity purification of angiotensin converting enzyme inhibitory peptides from wakame (Undaria Pinnatifida) using immobilized ACE on magnetic metal organic frameworks[J].Marine Drugs, 2021, 19(3):177.
[25] CAI H Y, ZHANG Q, SHEN L Z, et al.Phenolic profile and antioxidant activity of Chinese rice wine fermented with different rice materials and starters[J].LWT-Food Science and Technology, 2019, 111:226-234.
[26] WANG H, LIU R R, LIU Y F, et al.Investigation on adsorption mechanism of peptides with surface-modified super-macroporous resins[J].Langmuir, 2019, 35(13):4471-4480.
[27] ULBRICHT M.Membrane separations using molecularly imprinted polymers[J].Journal of Chromatography B, 2004, 804(1):113-125.
[28] OKUTUCU B, ZIHNIOGLU F.Different approaches to synthesize carnosine selective imprinted polymers[J].Materials Science and Engineering:C, 2012, 32(5):1174-1178.
[29] BUI B T S, MIER A, HAUPT K.Molecularly imprinted polymers as synthetic antibodies for protein recognition:The next generation[J].Small, 2023, 19(13):2206453.
[30] ZHANG M Y, WANG Y F, HU K L, et al.Molecularly imprinted polymer with high capacity and selectivity for separation of bovine serum albumin[J].ACS Applied Polymer Materials, 2023, 5(12):9751-9760.
[31] GUMMADI S, KANDULA V N.A review on electrophoresis, capillary electrophoresis and hyphenations[J].International Journal of Pharmaceutical Sciences and Research, 2020, 11(12):6038-6056.
[32] ALI F, ALOTHMAN Z A, AL-SHAALAN N H.Mixed-mode open tubular column for peptide separations by capillary electrochromatography[J].Journal of Separation Science, 2021, 44(13):2602-2611.
[33] NAITHANI V, CHEDDAH S, YANG K G, et al.Preparation of open tubular capillary column covalently coated with polystyrene sulfonate with 4,4′-Azobis(4-cyanopentanoyl chloride) as polymerization initiator for electrochromatographic separation of alkaloids, sulfonamides, and peptides[J].Journal of Separation Science, 2023, 46(10):2200711.
[34] MITTAL A, ROY I, GANDHI S.Magnetic nanoparticles:an overview for biomedical applications[J].Magnetochemistry, 2022, 8(9):107.
[35] EIVAZZADEH-KEIHAN R, BAHREINIZAD H, AMIRI Z, et al.Functionalized magnetic nanoparticles for the separation and purification of proteins and peptides[J].TrAC Trends in Analytical Chemistry, 2021, 141:116291.
[36] WANG J D, HAN Q, WANG K, et al.Recent advances in development of functional magnetic adsorbents for selective separation of proteins/peptides[J].Talanta, 2023, 253:123919.
[37] LU Y, WU Y J, HOU X H, et al.Separation and identification of ACE inhibitory peptides from lizard fish proteins hydrolysates by metal affinity-immobilized magnetic liposome[J].Protein Expression and Purification, 2022, 191:106027.
[38] ZHANG Y Y, LIU L H, ZHANG M, et al.The research progress of bioactive peptides derived from traditional natural products in China[J].Molecules, 2023, 28(17):6421.
[39] MUTH T, HARTKOPF F, VAUDEL M, et al.A potential golden age to come: Current tools, recent use cases, and future avenues for de novo sequencing in proteomics[J].Proteomics, 2018, 18(18):e1700150.
[40] NG C C A, ZHOU Y, YAO Z P.Algorithms for de-novo sequencing of peptides by tandem mass spectrometry:A review[J].Analytica Chimica Acta, 2023, 1268:341330.
[41] MEDZIHRADSZKY K F, CHALKLEY R J.Lessons in de novo peptide sequencing by tandem mass spectrometry[J].Mass Spectrometry Reviews, 2015, 34(1):43-63.
[42] ALLMER J.Algorithms for the de novo sequencing of peptides from tandem mass spectra[J].Expert Review of Proteomics, 2011, 8(5):645-657.
[43] ZHANG S, SHAN Y C, ZHANG S R, et al.NIPTL-Novo:Non-isobaric peptide termini labeling assisted peptide de novo sequencing[J].Journal of Proteomics, 2017, 154:40-48.
[44] ASHBY M, PETKOVA A, GANI J, et al.Use of peptide libraries for identification and optimization of novel antimicrobial peptides[J].Current Topics in Medicinal Chemistry, 2017, 17(5):537-553.
[45] AGYEI D, TSOPMO A, UDENIGWE C C.Bioinformatics and peptidomics approaches to the discovery and analysis of food-derived bioactive peptides[J].Analytical and Bioanalytical Chemistry, 2018, 410(15):3463-3472.
[46] DU Z J, COMER J, LI Y H.Bioinformatics approaches to discovering food-derived bioactive peptides:Reviews and perspectives[J].TrAC Trends in Analytical Chemistry, 2023, 162:117051.
[47] L PEZ-MART
PEZ-MART NEZ R, LIZBETH RAM
NEZ R, LIZBETH RAM REZ-SALINAS G, CORREA-BASURTO J, et al. Inhibition of influenza A virus infection in vitro by peptides designed in silico[J]. PLoS One, 2013, 8(10): e76876.
REZ-SALINAS G, CORREA-BASURTO J, et al. Inhibition of influenza A virus infection in vitro by peptides designed in silico[J]. PLoS One, 2013, 8(10): e76876.
[48] ZHUANG M Z, ZHAO M M, LIN L Z, et al.Macroporous resin purification of peptides with umami taste from soy sauce[J].Food Chemistry, 2016, 190:338-344.
[49] 黄岩, 史伊格, 梁莉, 等.食品中苦味物质的感知与调控研究进展[J].食品科学, 2023, 44(11):185-195.HUANG Y, SHI Y G, LIANG L, et al.Research progress on perception and regulation of bitter compounds in foods[J].Food Science, 2023, 44(11):185-195.
[50] 徐亚光, 杜传来.鲜味和鲜味肽的研究进展[J].赤峰学院学报(自然科学版), 2024, 40(2):6-13.XU Y G, DU C L.Research progress of umami taste and umami peptides[J].Journal of Chifeng University (Natural Science Edition), 2024, 40(2):6-13.
[51] GURDA D, KIETRYS A M, SZOPA A, et al.Life with oxidative stress[J].Chemical and Process Engineering, 2012, 33(4):509-528.
[52] GULCIN ![]() and antioxidant methods:An updated overview[J].Archives of Toxicology, 2020, 94(3):651-715.
and antioxidant methods:An updated overview[J].Archives of Toxicology, 2020, 94(3):651-715.
[53] 张红玉, 李会珍, 张天伟, 等.抗氧化肽作用机制研究进展[J].食品安全质量检测学报, 2022, 13(12):3981-3988.ZHANG H Y, LI H Z, ZHANG T W, et al.Research progress on the mechanism of antioxidant peptides[J].Journal of Food Safety and Quality, 2022, 13(12):3981-3988.
[54] NORAMBUENA-SOTO I, LOPEZ-CRISOSTO C, MARTINEZ-BILBAO J, et al.Angiotensin-(1-9) in hypertension[J].Biochemical Pharmacology, 2022, 203:115183.
[55] ZIAJA M, URBANEK K A, KOWALSKA K, et al.Angiotensin II and angiotensin receptors 1 and 2-multifunctional system in cells biology, what do we know?[J].Cells, 2021, 10(2):381.
[56] MARTYNIAK A, TOMASIK P J.A new perspective on the renin-angiotensin system[J].Diagnostics, 2022, 13(1):16.
[57] GIANI J F, VEIRAS L C, SHEN J Z Y, et al.Novel roles of the renal angiotensin-converting enzyme[J].Molecular and Cellular Endocrinology, 2021, 529:111257.
[58] 王宝贝, 张慧, 刘宇松, 等.食源性多肽的降血压作用及其机制研究进展[J].食品与机械, 2024, 40(3):217-224.WANG B B, ZHANG H, LIU Y S, et al.Research progress on the mechanism of food-derived antihypertensive peptides[J].Food and Machinery, 2024, 40(3):217-224.
[59] 张钰. 柽柳提取物对小鼠酒精性肝损伤的保护作用及其作用机制研究[D].济南:济南大学, 2017.ZHANG Y.Study on the protective effect and mechanism of tamarisk extract on alcoholic liver injury in mice[D] Jinan:Jinan University, 2017.
[60] YAN Y H, LI Y Z, ZHANG Z W, et al.Advances of peptides for antibacterial applications[J].Colloids and Surfaces B:Biointerfaces, 2021, 202:111682.
[61] CIULLA M G, GELAIN F.Structure-activity relationships of antibacterial peptides[J].Microbial Biotechnology, 2023, 16(4):757-777.
[62] DI SOMMA A, MORETTA A, CANè C, et al.Antimicrobial and antibiofilm peptides[J].Biomolecules, 2020, 10(4):652.
[63] 杨慧.黄酒对大肠杆菌的抗菌活性研究[D].洛阳:河南科技大学, 2011.YANG H.Study on the antibacterial activity of Huangjiu against Escherichia coli[D] Luoyang:Henan University of Science and Technology, 2011.
[64] 杨晨远, 于子川, 秦迪, 等.抗菌肽的结构分析、抗菌机制及改造应用的研究进展[J].微生物学报, 2024, 64(7):2242-2259.YANG C Y, YU Z C, QIN D, et al.Research progress in structures, mechanisms, and modification of antimicrobial peptides[J].Acta Microbiologica Sinica, 2024, 64(7):2242-2259.
[65] 冯瑞雪, 史瑛, 姬中伟, 等.黄酒多肽的多级分离纯化及其对小鼠巨噬细胞免疫调节的影响[J].食品工业科技, 2020, 41(13):289-295.FENG R X, SHI Y, JI Z W, et al.Multistep separation and purification of Huangjiu peptides and its effects on the immune regulation of macrophage in mice[J].Science and Technology of Food Industry, 2020, 41(13):289-295.