牛樟芝(Antrodia cinnamomea或Taiwanofungus camphoratus)是我国台湾地区特有的珍稀食药两用蕈菌,又称樟芝、牛樟菇、血灵芝等,属于担子菌亚门、多孔菌科、薄孔菌属。目前,人们已从牛樟芝子实体、菌丝体及其发酵液中分离鉴定出多种活性成分,包括三萜、多糖、固醇、腺苷及不饱和脂肪酸等,这些活性物质具有抗癌[1]、消炎[2]、保肝[3]、抗病毒[4]、免疫调节[5]、抗氧化[6]、抗疲劳[3]和抑菌[7]等生物活性,在治疗肿瘤、糖尿病、肝脏疾病及心血管疾病等领域有着潜在的应用价值。牛樟树(Cinnamomum kanehirai Hay)是野生牛樟芝唯一的天然寄主,通常生长于我国台湾省海拔450~2 000 m、幽暗、潮湿且温度稍低的海岸山脉阔叶林区内[8]。牛樟树中也含有多种活性物质,如芝麻素、苯甲酸-2-甲基丙酯、芫花素、香豆素、类固醇、木脂素等[9-11],这些活性物质具有抑菌[12]、驱虫[13]、抗癌[9]等作用。
由于食源性病原体对公共卫生的威胁,使得食品安全作为一个全球性问题受到越来越广泛的关注和严峻的挑战。因此,需要不断开发新型的抗菌剂或干预方法来控制食源性病原体,特别是针对那些对常规抗菌剂耐药的病原体。近来,真菌成为用于食品保藏和食品安全控制抗菌剂越来越重要的来源[14],人们已从真菌中分离到多种抑菌物质并开发成抗菌剂[15]。其中一些大型真菌是食药两用的,具有很高的烹饪、营养和药用特性,其产生的许多次级或特异性代谢物具有优异的抗菌、抗氧化和抗炎功能[16]。例如,灵芝作为研究最多的食药用菌之一,含有丰富的单/三萜类化合物、多糖、生物碱、脂肪酸、麦角甾醇、甘露醇等生物活性化合物[17-18],其中,三萜和多糖具有较好的抗病毒、抗细菌和抗真菌等生物活性[19-20];此外,有研究人员发现双孢蘑菇(Agaricus bisporus)中富含的皂苷和生物碱等活性物质,对白色念珠菌(Candida albicans)和金黄色葡萄球菌(Staphylococcus aureus,以下简称为“金葡”)有显著抑制作用[21];还有研究人员发现姬松茸(Agaricus blazei Murrill)中的亚油酸、油酸甘油单宁和邻苯二甲酸二丁酯等物质对红色毛藓菌(Trichophyton rubrum)和白色念珠菌等真菌具有显著抑制作用[22]。
目前关于牛樟芝的综述文献主要集中在樟芝的发酵生产、活性物质分离及药用活性(如抗癌、抗炎、抗肿瘤、抗氧化)等方面,而关于牛樟芝在抑制食源性致病菌方面的综述文献却尚未见报道。因此,本文系统地总结和分析了关于牛樟芝及其宿主对食源性致病细菌和真菌抑制活性的现有报道,为研究者们进一步深入研究牛樟芝及其宿主的抑菌活性提供重要依据和参考,也为开发新型食品抑菌剂提供新思路。
1 牛樟芝活性物质抑菌性能研究进展
1.1 多糖类化合物
在牛樟芝子实体中,多糖是仅次于三萜的主要活性物质;而在樟芝深层发酵生产中,多糖是最主要的活性物质,尤其是胞外多糖,产量较高。FAN等[23]通过微粒强化培养(microparticle-enhanced cultivation,MPEC)技术促进牛樟芝深层发酵生产胞外多糖(exopolysaccharides,EPS),并比较了经过Al2O3处理(EPS-Al)和未经Al2O3处理的多糖(EPS)结构。结果显示,EPS-Al的抗菌活性较EPS更强,且对大肠杆菌(Escherichia coli,以下简称为“大肠”)和金葡均有显著的抑制作用。此外,EPS-Al的抑菌机制主要是改变细菌细胞形态,破坏细胞壁和细胞膜的完整性,导致细胞内物质渗漏,降低细胞代谢活性,最终抑制细菌的生长。
1.2 三萜类化合物
三萜类化合物作为一类具有重要生理活性的天然产物,常见于一些药食同源的真菌中,如灵芝中就含有丰富的羊毛甾烷骨架三萜类化合物,而牛樟芝中的三萜类化合物不仅含量较灵芝更高,种类也更为丰富多样[24]。目前在牛樟芝中发现的数十种三萜类化合物,主要包括羊毛甾烷和麦角甾烷2种结构,如methyl antcinate A、B、G、H、K、N,antcins A-D、H、I、K、N及zhankuic acid D、E等[25],其抑菌作用如表1所示。
表1 牛樟芝三萜类化合物抑菌作用
Table 1 Antibacterial effect of triterpenes from A.cinnamomea

物质来源提取剂抑菌谱(抑菌性能)文献methyl antcinate B、antcins K、antcins A子实体正己烷和三氯甲烷幽门螺杆菌(浓度为0.2 mmol/L时具有显著抑制作用,抑菌圈直径分别为13.0、12.0、10.0 mm)[7]总三萜固态发酵菌丝体无水乙醇(超声辅助提取)大肠、金葡、枯草[当总三萜质量浓度为25.0 mg/mL时,3种菌的抑菌圈直径分别为(10.1±0.3)、(12.5±0.2)、(9.2±0.3) mm][26]
GEETHANGILI等[7]研究发现,用正己烷和三氯甲烷从牛樟芝子实体中分离得到13种化学成分,发现methyl antcinate B、antcins K和antcins A对幽门螺杆菌(Helicobacter pylori)具有显著抑制作用。此外,杨开等[26]通过超声处理从固态培养的樟芝菌丝体中提取总三萜并进行体外抑菌活性测试,结果显示,经超声处理提取的牛樟芝三萜对大肠、金葡及枯草芽孢杆菌(Bacillus subtilis,以下简称为“枯草”)均表现出显著的抑制作用,尤其对金葡的抑制效果最为显著。
1.3 醌类化合物
来自牛樟芝的辅酶Q0具有多种生物活性,如抑菌、抗肿瘤[27]、抗炎[28]、抗血管生成[29]等,本文主要关注其抑菌活性。牛樟芝辅酶Q0对多种革兰氏阳性菌有显著抑制效果,包括耐甲氧西林金黄色葡萄球菌(methicillin-resistant Staphylococcus aureus,MRSA)[30]、阪崎肠杆菌(Cronobacter sakazakii,以下简称为“阪崎”)[31-33]、单增李斯特菌(Listeria monocytogenes,以下简称为“李斯特”)[33-35]和金葡[33, 36]等,它们的最小抑菌浓度(minimal inhibitory concentration,MIC)分别为7.8、0.1、25.0、7.8 μg/mL;此外,牛樟芝辅酶Q0还能有效抑制革兰氏阴性菌,如副溶血性弧菌(Vibrio parahaemolyticus,以下简称为“副溶”)[33, 37]、大肠[33, 38]、鼠伤寒沙门氏菌(Salmonella Typhimurium,以下简称为“沙门”)[33, 39-40]和小肠结肠炎耶尔森氏菌(Yersinia enterocolitica)[41]等,且MIC分别为4.0 μg/mL、0.1、0.1、0.1 mg/mL。牛樟芝辅酶Q0的抑菌机制主要是降低细胞内ATP浓度,使细胞膜超极化并破坏细胞壁和细胞膜的完整性,导致细胞内物质流出,并抑制相关毒力基因的转录以及蛋白质的合成[31-32, 34-35, 37-41]。对于MRSA,辅酶Q0则是通过抑制其DNA聚合酶和拓扑异构酶表达来实现抑菌效果的[30]。
ZHANG等[42]使用乙酸乙酯从樟芝深层发酵液中分离到一种叫5-甲基-苯并[1,3]-二氧杂环戊烯-4,7-二醇(5-methyl-benzo[1,3]-dioxole-4,7-diol,MBBD)的醌类化合物,并测试了其对食源性致病菌的抑制效果,发现其可显著抑制溶血性葡萄球菌(Staphylococcus haemolyticus,以下简称为“葡萄球菌”)及蜡样芽孢杆菌(Bacillus cereus,以下简称为“蜡样”)等,且MIC分别为12.5、25.0 μg/mL;同时,还能显著抑制鲍曼不动杆菌(Acinetobacter baumannii,以下简称为“鲍曼”)、金葡和大肠等耐药性致病菌,且MIC为0.1~0.3 mg/mL。此外,YANG等[43]用95%(体积分数)乙醇从牛樟芝皿式培养菌丝体中分离到7个组分,并用MRSA检测其抗菌活性,结果发现其中的2,4-二甲氧基-6-甲基-苯-1,3-二醇(2,4-dimethoxy-6-methylbenzene-1,3-diol,DMD)对MRSA的抑制效果明显优于其他化合物,MIC仅为78.1 μg/mL。进一步研究发现,DMD的抑菌机制主要是通过捕获DNA回旋酶和拓扑异构酶并扰乱DNA复制,干扰ssDNA的结合能力,从而产生不稳定的聚合酶-DNA复合物,使目标菌DNA复制效率降低,从而达到抑制效果。醌类化合物的抑菌作用如表2所示。
表2 牛樟芝醌类化合物抑菌作用
Table 2 Antibacterial effect of quinone compounds from A.cinnamomea
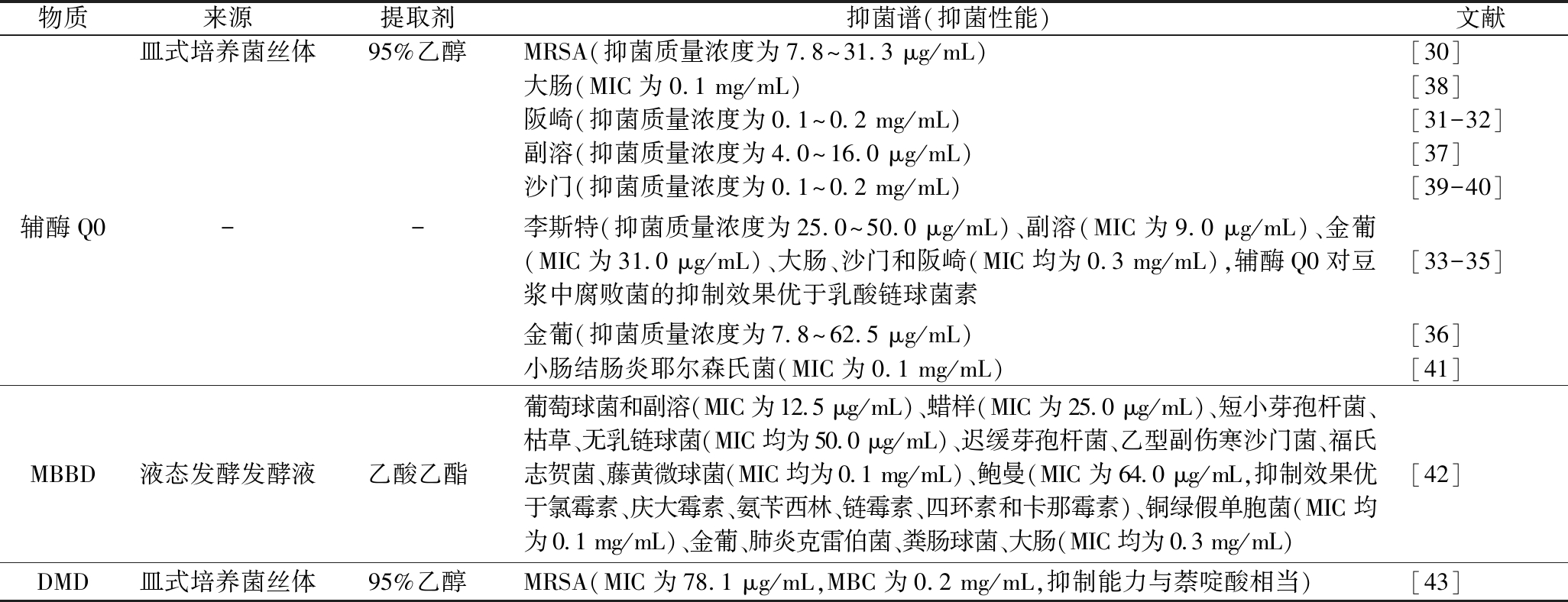
物质来源提取剂抑菌谱(抑菌性能)文献皿式培养菌丝体95%乙醇MRSA(抑菌质量浓度为7.8~31.3 μg/mL)[30]大肠(MIC为0.1 mg/mL)[38]阪崎(抑菌质量浓度为0.1~0.2 mg/mL)[31-32]副溶(抑菌质量浓度为4.0~16.0 μg/mL)[37]沙门(抑菌质量浓度为0.1~0.2 mg/mL)[39-40]辅酶Q0--李斯特(抑菌质量浓度为25.0~50.0 μg/mL)、副溶(MIC为9.0 μg/mL)、金葡(MIC为31.0 μg/mL)、大肠、沙门和阪崎(MIC均为0.3 mg/mL),辅酶Q0对豆浆中腐败菌的抑制效果优于乳酸链球菌素[33-35]金葡(抑菌质量浓度为7.8~62.5 μg/mL)[36]小肠结肠炎耶尔森氏菌(MIC为0.1 mg/mL)[41]MBBD液态发酵发酵液乙酸乙酯葡萄球菌和副溶(MIC为12.5 μg/mL)、蜡样(MIC为25.0 μg/mL)、短小芽孢杆菌、枯草、无乳链球菌(MIC均为50.0 μg/mL)、迟缓芽孢杆菌、乙型副伤寒沙门菌、福氏志贺菌、藤黄微球菌(MIC均为0.1 mg/mL)、鲍曼(MIC为64.0 μg/mL,抑制效果优于氯霉素、庆大霉素、氨苄西林、链霉素、四环素和卡那霉素)、铜绿假单胞菌(MIC均为0.1 mg/mL)、金葡、肺炎克雷伯菌、粪肠球菌、大肠(MIC均为0.3 mg/mL)[42]DMD皿式培养菌丝体95%乙醇MRSA(MIC为78.1 μg/mL,MBC为0.2 mg/mL,抑制能力与萘啶酸相当)[43]
1.4 粗提物
1.4.1 牛樟芝菌丝体或发酵液粗提物抑菌作用
王娟娟[44]和陆春雷等[45]采用不同有机溶剂萃取牛樟芝深层发酵液中活性物质并检测其对食源性致病弧菌(副溶、霍乱弧菌、河流弧菌、创伤弧菌、最小弧菌、哈氏弧菌、河流弧菌)和非弧菌(金葡、大肠、蜡样、沙门、阪崎)的抑制效果,结果发现牛樟芝发酵液氯仿萃取物(Antrodia cinnamomea chloroform extracts,ACCE)对上述非弧菌均具有显著抑制作用,且MIC均为1.6 mg/mL;牛樟芝发酵液石油醚萃取物(Antrodia cinnamomea petroleum ether extracts,ACPE)仅对金葡、大肠、沙门和阪崎有抑制效果,且MIC均为12.5 mg/mL;牛樟芝发酵液乙酸乙酯萃取物(Antrodia cinnamomea ethyl acetate extracts,ACEE)对上述弧菌的抑制效果比较显著,MIC均为1.6 mg/mL;ACEE对金葡、蜡样和沙门等非弧菌也有一定抑制作用,MIC均为3.1 mg/mL。同时,李娟等[46]也发现ACEE对鲍曼有显著的抑制效果,且MIC为6.3 mg/mL;赵能等[47]也发现ACEE对藤黄微球菌(Micrococcus luteus)有显著抑制效果,MIC为66.5 μg/mL。此外,张伟鑫等[48]和张振宇等[49]采用乙醇、酸化萃取的方法,从牛樟芝发酵液中提取出醇溶酸性组分(ethanol-soluble acid components,ESAC)并进行抑菌性能测试,结果显示,ESAC对金葡和枯草均具有显著抑制作用,且随着浓度的增加,ESAC的抑制效果显著增强。随后,作者通过GC-MS对ESAC挥发性物质进一步分析和研究后发现,ESAC中的有效抑菌成分很可能是5-氧-四氢呋喃-2-甲酸。
LIEN等[50]发现牛樟芝皿式培养菌丝体氯仿提取物对牙龈卟啉单胞菌(Porphyromonas gingivalis)和变形链球菌(Streptococcus mutans)等牙齿细菌有较为显著的抑制效果,MIC分别为4.0、8.0 μg/mL。汪雯翰等[51]发现牛樟芝固态发酵菌丝体氯仿提取物对金葡也有较好的抑制效果;李华祥等[52]发现牛樟芝液态发酵菌丝体甲醇提取物(Antrodia cinnamomea methyl alcohol extracts,ACME)对金葡、副溶、蜡样等均具有较好的抑制效果,其中对金葡的抑制率高达92.1%;同时,KIM等[53]也证实了牛樟芝皿式培养菌丝体甲醇提取物对金葡具有显著的抑制作用,其抑菌机制是通过干扰微生物中完整的MAPK(mitogen-activated protein kinase)抗氧化信号系统,从而发挥抑菌作用。从以上研究结果来看,李华祥等[52]和KIM等[53]的研究结果显示牛樟芝皿式培养和液态发酵菌丝体甲醇提取物都具有显著的抑菌效果,且都对金葡的抑制效果最佳。此外,LEE等[54]研究了牛樟芝固态培养菌丝体水提物对鸡粪便中大肠的抑制活性,结果显示牛樟芝固态培养菌丝体水提物能使鸡粪便中大肠数量显著减少,表明牛樟芝固态培养菌丝体水提物对大肠具有显著的抑制作用;同时,LIEN等[50]还证实牛樟芝菌丝体水提物对牙龈卟啉单胞菌和变形链球菌同样有显著抑制作用,且MIC约为2.0 mg/mL。LIEN等[50]还用50%和95%的乙醇分别提取牛樟芝液态发酵菌丝体中的活性物质,结果发现,95%的乙醇提取物对牙龈卟啉单胞菌和变形链球菌的抑菌效果更好。
刘琳等[55]采用微波辅助双相萃取、水蒸气蒸馏、索式提取和微波辅助提取等技术提取牛樟芝发酵液中的挥发油,并检测了其对红色毛癣菌(Trichophyton rubrum)及絮状表皮癣菌(Epidermophyton floccosum)等菌的抑制效果,结果发现采用不同提取方法获得的挥发油对测试菌的抑制效果存在显著差异。其中,微波双相萃取技术提取的牛樟芝挥发油对测试菌的抑制效果最好,MIC为5.0~20.0 mL/L。此外,马刚等[56]发现用水蒸汽蒸馏法提取的牛樟芝发酵液挥发油对植物病原真菌中的棉花枯萎病菌(Fusrium oxsyporum)具有显著抑制效果,且最佳质量浓度为15.0 mg/mL;此外,该牛樟芝挥发油对食源性致病菌也有良好的抑制效果,其中,对沙门的抑菌效果最为显著。菌丝体粗提物的抑菌作用如表3所示。
表3 牛樟芝菌丝体粗提物抑菌作用
Table 3 Antibacterial effect of crude mycelium extract from A.cinnamomea
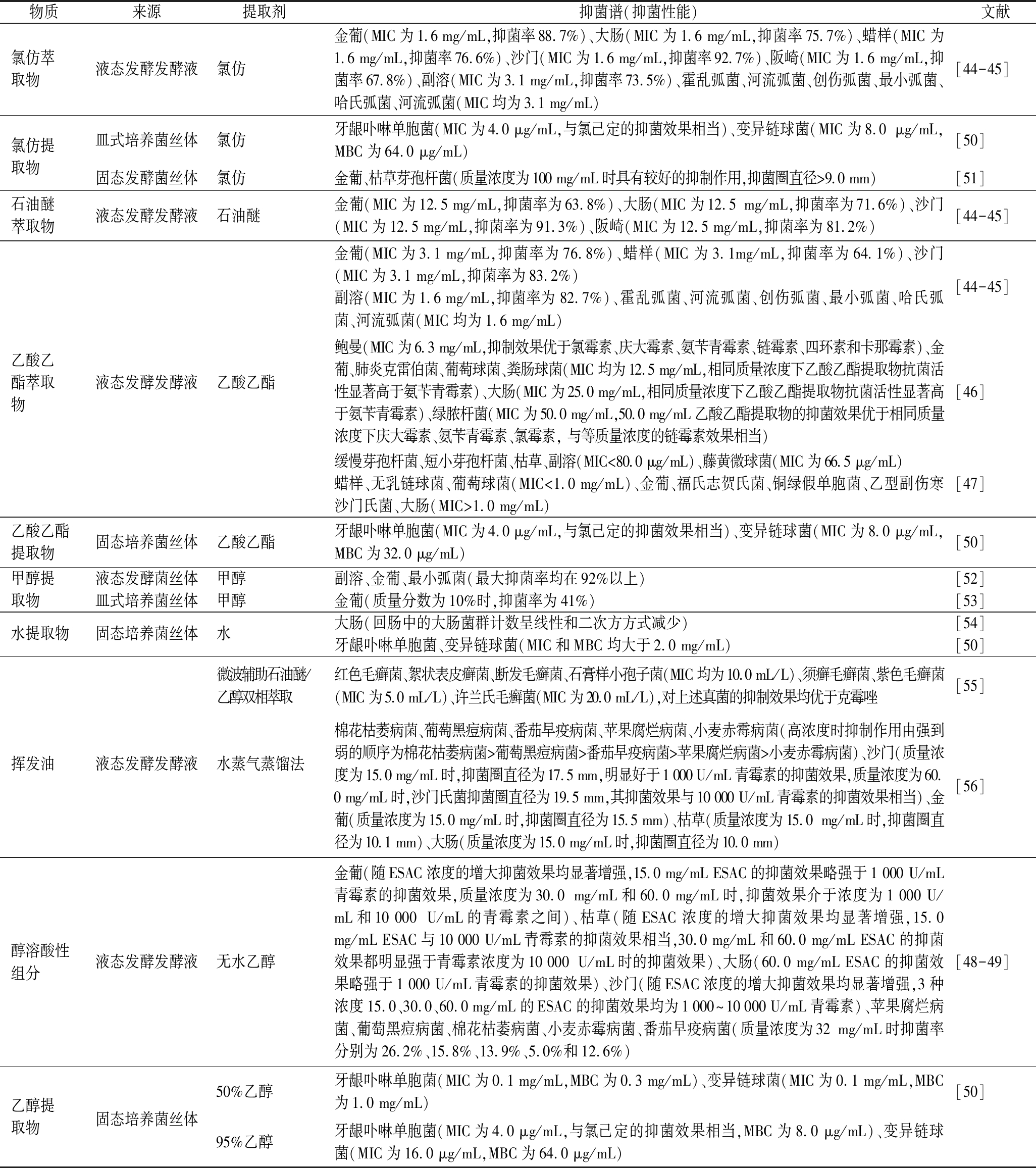
物质来源提取剂抑菌谱(抑菌性能)文献氯仿萃取物液态发酵发酵液氯仿金葡(MIC为1.6 mg/mL,抑菌率88.7%)、大肠(MIC为1.6 mg/mL,抑菌率75.7%)、蜡样(MIC为1.6 mg/mL,抑菌率76.6%)、沙门(MIC为1.6 mg/mL,抑菌率92.7%)、阪崎(MIC为1.6 mg/mL,抑菌率67.8%)、副溶(MIC为3.1 mg/mL,抑菌率73.5%)、霍乱弧菌、河流弧菌、创伤弧菌、最小弧菌、哈氏弧菌、河流弧菌(MIC均为3.1 mg/mL)[44-45]氯仿提取物皿式培养菌丝体氯仿牙龈卟啉单胞菌(MIC为4.0 μg/mL,与氯己定的抑菌效果相当)、变异链球菌(MIC为8.0 μg/mL,MBC为64.0 μg/mL)[50]固态发酵菌丝体氯仿金葡、枯草芽孢杆菌(质量浓度为100 mg/mL时具有较好的抑制作用,抑菌圈直径>9.0 mm)[51]石油醚萃取物 液态发酵发酵液石油醚金葡(MIC为12.5 mg/mL,抑菌率为63.8%)、大肠(MIC为12.5 mg/mL,抑菌率为71.6%)、沙门(MIC为12.5 mg/mL,抑菌率为91.3%)、阪崎(MIC为12.5 mg/mL,抑菌率为81.2%)[44-45]乙酸乙酯萃取物液态发酵发酵液乙酸乙酯金葡(MIC为3.1 mg/mL,抑菌率为76.8%)、蜡样(MIC为3.1mg/mL,抑菌率为64.1%)、沙门(MIC为3.1 mg/mL,抑菌率为83.2%)副溶(MIC为1.6 mg/mL,抑菌率为82.7%)、霍乱弧菌、河流弧菌、创伤弧菌、最小弧菌、哈氏弧菌、河流弧菌(MIC均为1.6 mg/mL)[44-45]鲍曼(MIC为6.3 mg/mL,抑制效果优于氯霉素、庆大霉素、氨苄青霉素、链霉素、四环素和卡那霉素)、金葡、肺炎克雷伯菌、葡萄球菌、粪肠球菌(MIC均为12.5 mg/mL,相同质量浓度下乙酸乙酯提取物抗菌活性显著高于氨苄青霉素)、大肠(MIC为25.0 mg/mL,相同质量浓度下乙酸乙酯提取物抗菌活性显著高于氨苄青霉素)、绿脓杆菌(MIC为50.0 mg/mL,50.0 mg/mL乙酸乙酯提取物的抑菌效果优于相同质量浓度下庆大霉素、氨苄青霉素、氯霉素, 与等质量浓度的链霉素效果相当)[46]缓慢芽孢杆菌、短小芽孢杆菌、枯草、副溶(MIC<80.0 μg/mL)、藤黄微球菌(MIC为66.5 μg/mL)蜡样、无乳链球菌、葡萄球菌(MIC<1.0 mg/mL)、金葡、福氏志贺氏菌、铜绿假单胞菌、乙型副伤寒沙门氏菌、大肠(MIC>1.0 mg/mL)[47]乙酸乙酯提取物固态培养菌丝体乙酸乙酯牙龈卟啉单胞菌(MIC为4.0 μg/mL,与氯己定的抑菌效果相当)、变异链球菌(MIC为8.0 μg/mL,MBC为32.0 μg/mL)[50]甲醇提液态发酵菌丝体甲醇副溶、金葡、最小弧菌(最大抑菌率均在92%以上)[52]取物皿式培养菌丝体甲醇金葡(质量分数为10%时,抑菌率为41%)[53]水提取物固态培养菌丝体水大肠(回肠中的大肠菌群计数呈线性和二次方方式减少)[54]牙龈卟啉单胞菌、变异链球菌(MIC和MBC均大于2.0 mg/mL)[50]微波辅助石油醚/乙醇双相萃取红色毛癣菌、絮状表皮癣菌、断发毛癣菌、石膏样小孢子菌(MIC均为10.0 mL/L)、须癣毛癣菌、紫色毛癣菌(MIC为5.0 mL/L)、许兰氏毛癣菌(MIC为20.0 mL/L),对上述真菌的抑制效果均优于克霉唑[55]挥发油液态发酵发酵液水蒸气蒸馏法棉花枯萎病菌、葡萄黑痘病菌、番茄早疫病菌、苹果腐烂病菌、小麦赤霉病菌(高浓度时抑制作用由强到弱的顺序为棉花枯萎病菌>葡萄黑痘病菌>番茄早疫病菌>苹果腐烂病菌>小麦赤霉病菌)、沙门(质量浓度为15.0 mg/mL时,抑菌圈直径为17.5 mm,明显好于1 000 U/mL青霉素的抑菌效果,质量浓度为60.0 mg/mL时,沙门氏菌抑菌圈直径为19.5 mm,其抑菌效果与10 000 U/mL青霉素的抑菌效果相当)、金葡(质量浓度为15.0 mg/mL时,抑菌圈直径为15.5 mm)、枯草(质量浓度为15.0 mg/mL时,抑菌圈直径为10.1 mm)、大肠(质量浓度为15.0 mg/mL时,抑菌圈直径为10.0 mm)[56]醇溶酸性组分液态发酵发酵液无水乙醇金葡(随ESAC浓度的增大抑菌效果均显著增强,15.0 mg/mL ESAC的抑菌效果略强于1 000 U/mL青霉素的抑菌效果,质量浓度为30.0 mg/mL和60.0 mg/mL时,抑菌效果介于浓度为1 000 U/mL和10 000 U/mL的青霉素之间)、枯草(随ESAC浓度的增大抑菌效果均显著增强,15.0 mg/mL ESAC与10 000 U/mL青霉素的抑菌效果相当,30.0 mg/mL和60.0 mg/mL ESAC的抑菌效果都明显强于青霉素浓度为10 000 U/mL时的抑菌效果)、大肠(60.0 mg/mL ESAC的抑菌效果略强于1 000 U/mL青霉素的抑菌效果)、沙门(随ESAC浓度的增大抑菌效果均显著增强,3种浓度15.0、30.0、60.0 mg/mL的ESAC的抑菌效果均为1 000~10 000 U/mL青霉素)、苹果腐烂病菌、葡萄黑痘病菌、棉花枯萎病菌、小麦赤霉病菌、番茄早疫病菌(质量浓度为32 mg/mL时抑菌率分别为26.2%、15.8%、13.9%、5.0%和12.6%)[48-49]乙醇提取物固态培养菌丝体50%乙醇牙龈卟啉单胞菌(MIC为0.1 mg/mL,MBC为0.3 mg/mL)、变异链球菌(MIC为0.1 mg/mL,MBC为1.0 mg/mL)[50]95%乙醇牙龈卟啉单胞菌(MIC为4.0 μg/mL,与氯己定的抑菌效果相当,MBC为8.0 μg/mL)、变异链球菌(MIC为16.0 μg/mL,MBC为64.0 μg/mL)
1.4.2 牛樟芝子实体粗提物抑菌作用
目前,关于牛樟芝子实体活性物质抑菌的研究报道比樟芝菌丝体相对较少。现有研究多采用石油醚、乙醇、氯仿等不同有机溶剂提取牛樟芝子实体中的抑菌活性物质,并用大肠、金葡及枯草等常见食源性致病菌检测提取物的抑菌效果[51, 57](表4)。如朱大伟[57]使用乙醇和石油醚提取牛樟芝子实体中的活性物质并测试了抑菌效果,结果显示,用上述2种有机溶剂提取的物质对大肠和枯草有较好的抑制效果,MIC均为2.0 mg/mL;对于金葡而言,乙醇提取物的抑制效果最好,MIC为2.0 mg/mL,而石油醚提取物的抑制效果稍差,MIC为4.0 mg/mL。同时,汪雯翰等[51]也用石油醚提取了牛樟芝子实体中的抑菌活性物质,抑菌测试结果显示,石油醚提取物对枯草的抑制效果较好,对金葡的抑制效果较差,此结果与朱大伟的研究结果一致。但是,汪雯翰等[51]还检测了牛樟芝子实体氯仿和正丁醇提取物对金葡和枯草均有显著的抑制效果,并发现氯仿提取物的抑菌效果较正丁醇提取物更佳。此外,朱大伟[57]还研究了牛樟芝子实体水提物对大肠、金葡和枯草的抑制效果,这是其他文献没有提到的,并证实牛樟芝水提物的抑菌效果较有机溶剂差。
表4 牛樟芝子实体粗提物抑菌作用
Table 4 Antibacterial effect of crude extract from A.cinnamomea
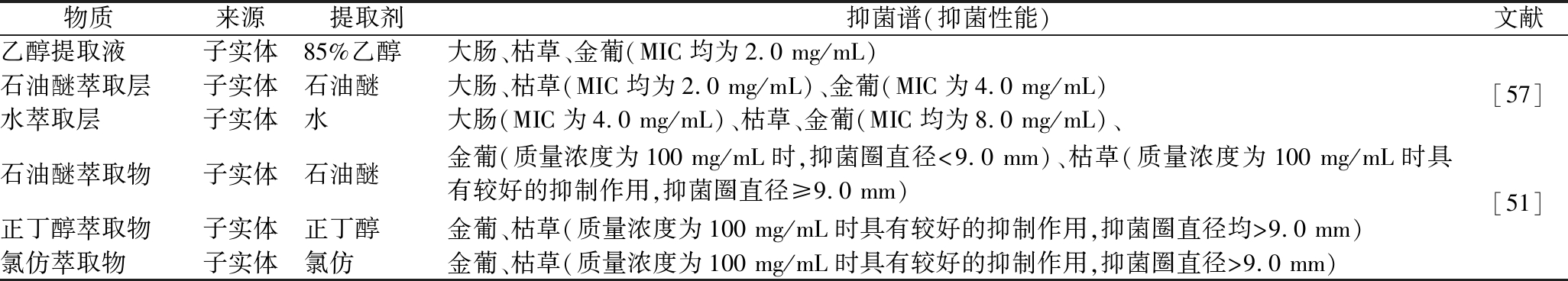
物质来源提取剂抑菌谱(抑菌性能)文献乙醇提取液子实体85%乙醇大肠、枯草、金葡(MIC均为2.0 mg/mL)[57]石油醚萃取层子实体石油醚大肠、枯草(MIC均为2.0 mg/mL)、金葡(MIC为4.0 mg/mL)水萃取层子实体水大肠(MIC为4.0 mg/mL)、枯草、金葡(MIC均为8.0 mg/mL)、石油醚萃取物子实体石油醚金葡(质量浓度为100 mg/mL时,抑菌圈直径<9.0 mm)、枯草(质量浓度为100 mg/mL时具有较好的抑制作用,抑菌圈直径≥9.0 mm)[51]正丁醇萃取物子实体正丁醇金葡、枯草(质量浓度为100 mg/mL时具有较好的抑制作用,抑菌圈直径均>9.0 mm)氯仿萃取物子实体氯仿金葡、枯草(质量浓度为100 mg/mL时具有较好的抑制作用,抑菌圈直径>9.0 mm)
2 牛樟树活性物质的抑菌性能研究进展
牛樟树是一种属于樟科、樟属的常绿阔叶乔木,也是野生牛樟芝的唯一寄主,具有多种生物活性,其提取物的抑菌作用如表5所示。石瑀等[12]利用不同溶剂(甲醇、乙酸乙酯和水)提取牛樟树椴木木屑中的活性物质,并测试了各提取物的抑菌性能。结果表明,牛樟树木屑甲醇提取物抑菌范围最广,抑菌效果最好,其对金葡、大肠、蜡样、沙门等表现出显著的抑制效果,且MIC均为0.8 mg/mL;牛樟树木屑乙酸乙酯提取物对金葡、大肠和沙门也有显著抑制效果,尤其对大肠的抑制效果最佳,抑菌率可达92.3%;牛樟树木屑水提物也有较为广泛的抑菌谱,其对金葡、大肠、沙门的抑制效果较甲醇提取物稍差,但对副溶、霍乱等弧菌的抑制效果较好。此外,LI等[58]使用水和不同浓度的乙醇对牛樟树树叶进行提取,并测试了各提取物的抑菌活性,结果表明,50%和80%的乙醇提取物仅对蜡样具有显著抑制效果,而95%的乙醇提取物则对白色念珠菌、大肠和蜡样均表现出较高的抑菌活性,说明不同浓度乙醇提取到活性物质在种类和浓度上均有较大差异。
表5 牛樟树提取物抑菌作用
Table 5 Antibacterial effect of crude extract from C.kanehirai Hay
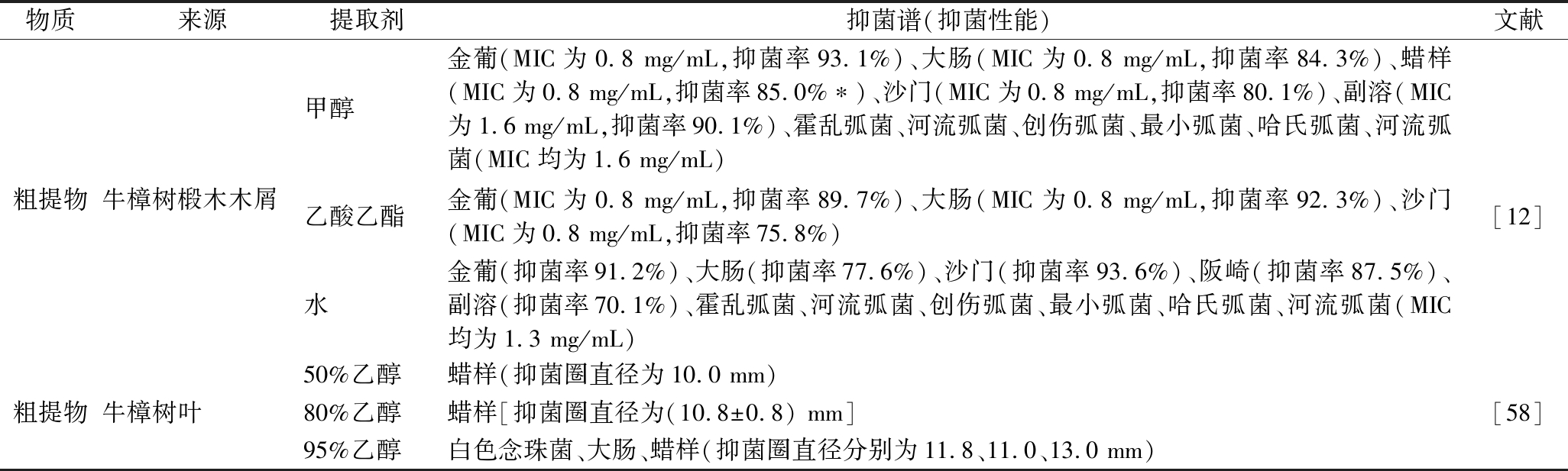
注:*此处原文给出的数据是8.5%,但从文中的结果分析来看,应该是作者笔误。因为作者说抑菌率均在84%以上。因此,猜测此数据可能为85%。
物质来源提取剂抑菌谱(抑菌性能)文献甲醇金葡(MIC为0.8 mg/mL,抑菌率93.1%)、大肠(MIC为0.8 mg/mL,抑菌率84.3%)、蜡样(MIC为0.8 mg/mL,抑菌率85.0%∗)、沙门(MIC为0.8 mg/mL,抑菌率80.1%)、副溶(MIC为1.6 mg/mL,抑菌率90.1%)、霍乱弧菌、河流弧菌、创伤弧菌、最小弧菌、哈氏弧菌、河流弧菌(MIC均为1.6 mg/mL)粗提物牛樟树椴木木屑乙酸乙酯金葡(MIC为0.8 mg/mL,抑菌率89.7%)、大肠(MIC为0.8 mg/mL,抑菌率92.3%)、沙门(MIC为0.8 mg/mL,抑菌率75.8%)[12]水金葡(抑菌率91.2%)、大肠(抑菌率77.6%)、沙门(抑菌率93.6%)、阪崎(抑菌率87.5%)、副溶(抑菌率70.1%)、霍乱弧菌、河流弧菌、创伤弧菌、最小弧菌、哈氏弧菌、河流弧菌(MIC均为1.3 mg/mL)50%乙醇蜡样(抑菌圈直径为10.0 mm)粗提物牛樟树叶80%乙醇蜡样[抑菌圈直径为(10.8±0.8) mm][58]95%乙醇白色念珠菌、大肠、蜡样(抑菌圈直径分别为11.8、11.0、13.0 mm)
3 展望
近年来,食品安全问题频发,严重威胁到人们健康,因此,利用安全无毒的天然代谢产物来控制食品中的致病菌和腐败菌被认为是一种新型高效的抗菌策略。牛樟芝作为一种珍贵的药食用真菌,有着丰富多样的生物活性,在开发安全高效、功能多样的新型食品抑菌剂方面有着巨大的潜力和价值。大量研究已证实牛樟芝及其宿主(牛樟树)提取物具有良好的抑菌活性,但其中具体的抑菌物质和作用机制尚不完全清楚。造成这种困境的一个主要因素是,研究人员在测试抑菌效果时往往采用粗提物或粗分组分,而非纯的化合物,从而无法确定具体何种化合物发挥了抑菌作用。天然生物活性物质的综合作用包括协同作用、拮抗作用和独立作用。其中,拮抗作用尤为显著,指的是这些混合物中可能存在的非活性化合物可能诱发不良或有害的副作用。为了更深入地探究这些化合物的作用机制,从牛樟芝中分离并鉴定更多纯化合物显得尤为重要,这一步骤不仅有助于揭示化合物作用的本质,还能为牛樟芝功能化合物在药物或功能食品研发及实际应用中的有效利用提供重要的指导,从而改善其应用效果。
其次,由于致病细菌和真菌的致病类型不同,导致牛樟芝活性成分对不同菌株的抑制效果存在差异,致病细菌大多引起炎症反应,而真菌除了炎症反应外,还会导致局部出现过敏反应(如皮肤藓病)等,因此,在选用测试菌时应尽量全面,尽可能涵盖病原细菌及真菌,以便更好的测试提取物的抑菌效果,为相关疾病的治疗提供新的方向。
展望未来,牛樟芝研究领域将在种质资源保护与创新、人工栽培技术优化、新化合物发掘、基因功能解析以及药物研发等多个维度实现显著进展。这些突破不仅将促进牛樟芝产业的规范化与市场化,而且有望在人类疾病的预防与治疗及人类健康促进与保健中发挥举足轻重的作用,从而在全球范围内推动牛樟芝产业的健康可持续发展。
[1] HO C L, WANG J L, LEE C C, et al.Antroquinonol blocks Ras and Rho signaling via the inhibition of protein isoprenyltransferase activity in cancer cells[J].Biomedicine &Pharmacotherapy, 2014, 68(8):1007-1014.
[2] SHEN Y C, CHOU C J, WANG Y H, et al.Anti-inflammatory activity of the extracts from mycelia of Antrodia camphorata cultured with water-soluble fractions from five different Cinnamomum species[J].FEMS Microbiology Letters, 2004, 231(1):137-143.
[3] 刘燕隔. 牛樟芝菌株培养条件优化、抗疲劳及保肝作用研究[D].长春:吉林大学, 2016.LIU Y G.Study on culture condition optimization, anti-fatigue and hepatoprotective effect of Antrodia cinnamomea[D].Changchun:Jilin University, 2016.
[4] LEE I H, HUANG R L, CHEN C T, et al.Antrodia camphorata polysaccharides exhibit anti-hepatitis B virus effects[J].FEMS Microbiology Letters, 2002, 209(1):61-65.
[5] LIU Y G, YANG A H, QU Y D, et al.Ameliorative effects of Antrodia cinnamomea polysaccharides against cyclophosphamide-induced immunosuppression related to Nrf2/HO-1 signaling in BALB/c mice[J].International Journal of Biological Macromolecules, 2018, 116:8-15.
[6] WU M D, CHENG M J, WANG W Y, et al.Antioxidant activities of extracts and metabolites isolated from the fungus Antrodia cinnamomea[J].Natural Product Research, 2011, 25(16):1488-1496.
[7] GEETHANGILI M, FANG S H, LAI C H, et al.Inhibitory effect of Antrodia camphorata constituents on the Helicobacter pylori-associated gastric inflammation[J].Food Chemistry, 2010, 119(1):149-153.
[8] 胡鸥, 张君逸, 卢喜.樟芝及其研究开发概况[J].福建热作科技, 2006, 31(4):40-42.HU O, ZHANG J Y, LU X.A summary of development and utilization of Antrodia camphorata[J].Fujian Science &Technology of Tropical Crops, 2006, 31(4):40-42.
[9] LIU Y K, CHEN K H, LEU Y L, et al.Ethanol extracts of Cinnamomum kanehirai Hayata leaves induce apoptosis in human hepatoma cell through caspase-3 cascade[J].OncoTargets and Therapy, 2014, 8:99-109.
[10] LIN C L, KAO C L, LI W J, et al.Secondary metabolites from the stems of Cinnamomum kanehirai[J].Chemistry of Natural Compounds, 2018, 54(4):762-763.
[11] LI H T, YEH H C, CHEN C Y.Secondary metabolites of the leaves of Cinnamomum kanehirai[J].Chemistry of Natural Compounds, 2016, 52(6):1143-1144.
[12] 石瑀, 张雨佳, 任怡琳, 等.牛樟树提取物对食源性致病菌的抑制效果[J].食品科技, 2021,46(4):168-172;179.SHI Y, ZHANG Y J, REN Y L, et al.Antibacterial effect of Cinnamomum kanehirae Hay extract on food-borne pathogens[J].Food Science and Technology, 2021, 46(4):168-172;179.
[13] CHANG S T, CHEN P F, WANG S Y, et al.Antimite activity of essential oils and their constituents from Taiwania cryptomerioides[J].Journal of Medical Entomology, 2001, 38(3):455-457.
[14] SHEN H S, SHAO S Q, CHEN J C, et al.Antimicrobials from mushrooms for assuring food safety[J].Comprehensive Reviews in Food Science and Food Safety, 2017, 16(2):316-329.
[15] ALVES M J, FERREIRA I C F R, DIAS J, et al.A review on antimicrobial activity of mushroom (Basidiomycetes) extracts and isolated compounds[J].Planta Medica, 2012, 78(16):1707-1718.
[16] ZJAWIONY J K.Biologically active compounds from Aphyllophorales (polypore) fungi[J].Journal of Natural Products, 2004, 67(2):300-310.
[17] BOH B, BEROVIC M, ZHANG J S, et al.Ganoderma lucidum and its pharmaceutically active compounds[J].Biotechnology Annual Review, 2007, 13:265-301.
[18] YANG Y L, ZHANG H N, ZUO J H, et al.Advances in research on the active constituents and physiological effects of Ganoderma lucidum[J].Biomedical Dermatology, 2019, 3(1):6.
[19] RAI M K, GAIKWAD S, NAGAONKAR D, et al.Current advances in the antimicrobial potential of species of genus Ganoderma (higher basidiomycetes) against human pathogenic microorganisms (review)[J].International Journal of Medicinal Mushrooms, 2015, 17(10):921-932.
[20] GAO Y H, TANG W B, GAO H, et al.Antimicrobial activity of the medicinal mushroom Ganoderma[J].Food Reviews International, 2005, 21(2):211-229.
[21] KRISHNAMOORTHI R, SRINIVASH M, MAHALINGAM P U, et al.Dietary nutrients in edible mushroom, Agaricus bisporus and their radical scavenging, antibacterial, and antifungal effects[J].Process Biochemistry, 2022, 121:10-17.
[22] YU R R, LI X J, YI P, et al.Isolation and identification of chemical compounds from Agaricus blazei Murrill and their in vitro antifungal activities[J].Molecules, 2023, 28(21):7321.
[23] FAN J H, XIONG L Q, HUANG W, et al.Exopolysaccharides produced by Antrodia cinnamomea using microparticle-enhanced cultivation:Optimization, primary structure and antibacterial property[J].International Journal of Biological Macromolecules, 2024, 259:128872.
[24] LU M C, EL-SHAZLY M, WU T Y, et al.Recent research and development of Antrodia cinnamomea[J].Pharmacology &Therapeutics, 2013, 139(2):124-156.
[25] 张远腾, 李晓波.牛樟芝化学成分及其药理作用研究进展[J].中草药, 2016, 47(6):1034-1042.ZHANG Y T, LI X B.Research progress on active components of Antrodia cinnamomea and their pharmacological effects[J].Chinese Traditional and Herbal Drugs, 2016, 47(6):1034-1042.
[26] 杨开, 徐梦婷, 王玏萦, 等.牛樟芝总三萜超声提取及体外活性研究[J].核农学报, 2018, 32(1):112-122.YANG K, XU M T, WANG L Y, et al.Ultrasonic-assisted extraction and in vitro activity evaluation of total triterpenoids from Antrodia camphorata[J].Journal of Nuclear Agricultural Sciences, 2018, 32(1):112-122.
[27] HSEU Y C, THIYAGARAJAN V, TSOU H T, et al. In vitro and in vivo anti-tumor activity of CoQ0 against melanoma cells:Inhibition of metastasis and induction of cell-cycle arrest and apoptosis through modulation of Wnt/β-catenin signaling pathways[J].Oncotarget, 2016, 7(16):22409-22426.
[28] YANG H L, LIN M W, KORIVI M, et al.Coenzyme Q0 regulates NFκB/AP-1 activation and enhances Nrf2 stabilization in attenuation of LPS-induced inflammation and redox imbalance:Evidence from in vitro and in vivo studies[J].Biochimica et Biophysica Acta, 2016, 1859(2):246-261.
[29] YANG H L, KORIVI M, LIN M W, et al.Anti-angiogenic properties of coenzyme Q0 through downregulation of MMP-9/NF-κB and upregulation of HO-1 signaling in TNF-α-activated human endothelial cells[J].Biochemical Pharmacology, 2015, 98(1):144-156.
[30] CHOU W L, LEE T H, HUANG T H, et al.Coenzyme Q0 from Antrodia cinnamomea exhibits drug-resistant bacteria eradication and keratinocyte inflammation mitigation to ameliorate infected atopic dermatitis in mouse[J].Frontiers in Pharmacology, 2019, 10:1445.
[31] GUO D, WANG S, LI J H, et al.The antimicrobial activity of coenzyme Q0 against planktonic and biofilm forms of Cronobacter sakazakii[J].Food Microbiology, 2020, 86:103337.
[32] GUAN N, SHI Y Q, TONG H Y, et al.Inhibition of Cronobacter sakazakii biofilm formation and expression of virulence factors by coenzyme Q0[J].Foodborne Pathogens and Disease, 2023, 20(10):442-452.
[33] 樊秋霞, 张艳艳, 华姿, 等.辅酶Q0的抑菌作用及稳定性研究[J].食品工业科技, 2017,38(24):38-43.FAN Q X, ZHANG Y Y, HUA Z, et al.Antimicrobial effect and stability of coenzyme Q0[J].Science and Technology of Food Industry, 2017, 38(24):38-43.
[34] FAN Q X, ZHANG Y Y, YANG H, et al.Effect of Coenzyme Q0 on biofilm formation and attachment-invasion efficiency of Listeria monocytogenes[J].Food Control, 2018, 90:274-281.
[35] 樊秋霞. 辅酶Q0对单增李斯特菌细胞膜、生物膜及毒力因子表达的影响[D].杨凌:西北农林科技大学,2018.FAN Q X.Effects of coenzyme Q0 on cell membrane, biofilm and virulence factor expression of Listeria monocytogenes[D].Yangling:Northwest A &F University, 2018.
[36] FAN Q X, YAN C H, SHI C, et al.Inhibitory effect of coenzyme Q0 on the growth of Staphylococcus aureus[J].Foodborne Pathogens and Disease, 2019, 16(5):317-324.
[37] ZHENG X Y, GUO J L, RAO H S, et al.Antibacterial and antibiofilm activity of coenzyme Q0 against Vibrio parahaemolyticus[J].Food Control, 2020, 109:106955.
[38] WANG R X, LI J H, QU G R, et al.Antibacterial activity and mechanism of coenzyme Q0 against Escherichia coli[J].Foodborne Pathogens and Disease, 2021, 18(6):398-404.
[39] YANG Z K, MA X Y, LI Y, et al.Antimicrobial activity and antibiofilm potential of coenzyme Q0 against Salmonella typhimurium[J].Foods, 2021, 10(6):1211.
[40] YANG Y P, LI J H, YIN Y, et al.Antibiofilm activity of coenzyme Q0 against Salmonella typhimurium and its effect on adhesion-invasion and survival-replication[J].Applied Microbiology and Biotechnology, 2019, 103(20):8545-8557.
[41] 李振业, 王灏然, 孟欣茹, 等.辅酶Q0对小肠结肠炎耶尔森氏菌的抑杀作用及对菌体细胞膜的影响[J].中国食品学报, 2022,22(11):47-56.LI Z Y, WANG H R, MENG X R, et al.The antibacterial effect of coenzyme Q0 against Yersinia enterocolitica and its influence on the membrane of bacterial somatic cells[J].Journal of Chinese Institute of Food Science and Technology, 2022, 22(11):47-56.
[42] ZHANG Y D, LIU L Y, WANG D, et al.Isolation and identification of bioactive compounds from Antrodia camphorata against ESKAPE pathogens[J].PLoS One, 2023, 18(10):e0293361.
[43] YANG S C, HUANG T H, CHIU C H, et al.The atopic dermatitis-like lesion and the associated MRSA infection and barrier dysfunction can be alleviated by 2, 4-dimethoxy-6-methylbenzene-1, 3-diol from Antrodia camphorata[J].Journal of Dermatological Science, 2018, 92(2):188-196.
[44] 王娟娟. 牛樟树提取物促进樟芝深层发酵无性产孢及发酵液抑菌作用[D].扬州:扬州大学,2023.WANG J J.Cinnamomum kanehirae Hay extracts promoting asexual sporulation of Antrodia cinnamomea in submerged fermentation and effect of broth on antibacterial[D].Yangzhou:Yangzhou University, 2023.
[45] 陆春雷, 赵雨菡, 姜金源, 等.樟芝深层发酵液萃取物对食源性致病菌的抑制效果[J].中国食用菌, 2021, 40(6):69-73,79.LU C L, ZHAO Y H, JIANG J Y, et al.The antibacterial effect of submerged fermentation broth extracts from Antrodia camphorata on food-borne pathogens[J].Edible Fungi of China, 2021, 40(6):69-73,79.
[46] 李娟, 王毅, 樊丽, 等.牛樟芝发酵液提取物抗耐药性细菌活性研究[J].福建师范大学学报(自然科学版), 2019, 35(1):96-101.LI J, WANG Y, FAN L, et al.Antimicrobial studies on Antrodia cinnamomea against multi-drug resistant human pathogenic bacteria[J].Journal of Fujian Normal University (Natural Science Edition), 2019, 35(1):96-101.
[47] 赵能, 原晓龙, 陈剑, 等.牛樟芝发酵液提取物抗菌活性研究[J].广西植物, 2017, 37(8):1068-1073.ZHAO N, YUAN X L, CHEN J, et al.Antibacterial activity of mycelial culture from Antrodia cinnamomea[J].Guihaia, 2017, 37(8):1068-1073.
[48] 张伟鑫, 张振宇, 马刚, 等.樟芝发酵液醇溶酸性组分分析及抗菌活性研究[J].中国食用菌, 2011,30(4):46-50.ZHANG W X, ZHANG Z Y, MA G, et al.Chemical and antimicrobial analysis of ethanol-soluble acid component of the submerged fermentation liquid of Taiwanofungus camphoratus[J].Edible Fungi of China, 2011, 30(4):46-50.
[49] 张振宇, 张伟鑫, 马刚, 等.樟薄孔菌菌丝体醇溶组分分析及其抗菌活性的研究[J].广东农业科学, 2011, 38(10):66-68;78.ZHANG Z Y, ZHANG W X, MA G, et al.Chemical and antimicrobial analysis of ethanol-soluble component of the mycelium of Taiwanofungus camphoratus[J].Guangdong Agricultural Sciences, 2011, 38(10):66-68;78.
[50] LIEN H M, TSENG C J, HUANG C L, et al.Antimicrobial activity of Antrodia camphorata extracts against oral bacteria[J].PLoS One, 2014, 9(8):e105286.
[51] 汪雯翰, 孙太萍, 杨海芮, 等.樟芝子实体和菌丝体萃取物的抑菌及抗氧化活性[J].食用菌学报, 2016, 23(2):79-83.WANG W H, SUN T P, YANG H R, et al.Antibacterial and anti-oxidant properties of extracts derived from fruit bodies and mycelia of Taiwanofungus camphoratus[J].Acta Edulis Fungi, 2016, 23(2):79-83.
[52] 李华祥, 石瑀, 蒋文浩, 等.樟芝深层发酵菌丝体提取物对食源性致病菌的抑制作用[J].中国食品学报, 2022, 22(3):47-52.LI H X, SHI Y, JIANG W H, et al.The antibacterial effect of extracts from Antrodia camphorata mycelium by submerged fermented on food-borne pathogens[J].Journal of Chinese Institute of Food Science and Technology, 2022, 22(3):47-52.
[53] KIM J H, TAM C C, CHAN K L, et al.Antimicrobial efficacy of edible mushroom extracts:Assessment of fungal resistance[J].Applied Sciences, 2022, 12(9):4591.
[54] LEE M T, LIN W C, WANG S Y, et al.Evaluation of potential antioxidant and anti-inflammatory effects of Antrodia cinnamomea powder and the underlying molecular mechanisms via Nrf2-and NF-κB-dominated pathways in broiler chickens[J].Poultry Science, 2018, 97(7):2419-2434.
[55] 刘琳, 陈慧黠, 郭立忠.樟芝挥发油的微波辅助双液相萃取及其抗菌活性研究[J].生物技术通报, 2015,31(12):122-130.LIU L, CHEN H X, GUO L Z.The microwave-assisted two-phase solvent extraction of essential oil from Taiwanofungus camphoratus and its antifungal activity[J].Biotechnology Bulletin, 2015,31(12):122-130.
[56] 马刚, 田雪梅, 张振宇, 等.樟芝挥发油的提取及其GC-MS分析与抑菌作用的研究[J].西南农业学报, 2011,24(3):970-973.MA G, TIAN X M, ZHANG Z Y, et al.Extraction and GC-MS analysis of volatile oil from Antrodia camphorata with bacteriostatic effects[J].Southwest China Journal of Agricultural Sciences, 2011, 24(3):970-973.
[57] 朱大伟. 人工培养牛樟芝子实体化学成分研究[D].天津:天津工业大学, 2019.ZHU D W.Study on the chemical composition of fruiting bodies of artificially cultured Antrodia cinnamomea[D].Tianjin:Tianjin Polytechnic University, 2019.
[58] LI P H, SHIH Y J, LU W C, et al.Antioxidant, antibacterial, anti-inflammatory, and anticancer properties of Cinnamomum kanehirae Hayata leaves extracts[J].Arabian Journal of Chemistry, 2023, 16(7):104873.