研究表明,长时间或高强度的运动会大量消耗机体能量,进而导致身体疲劳和运动表现下降[1]。运动表现受到能量物质减少、代谢物(如血乳酸和尿素氮)积累、骨骼肌代谢改变以及运动动机变化等多重因素的影响[2]。通过科学的营养补充策略,个体能够最大程度地优化身体素质和运动技能。在竞技体育中,卓越的运动表现对于个体在赛场上的竞争力和最终成就至关重要。因此,基于膳食干预提升运动表现和减轻运动疲劳,受到了广泛关注[3]。
姜黄素是一种源自姜黄根茎的天然多酚类化合物,具备多重生理活性[4]。研究表明,姜黄素展现出显著的抗氧化、抗炎及抗癌功效。此外,其独特的调节肌肉疲劳与恢复能力,有助于缓解运动导致的肌肉损伤与炎症,进而提升肌肉的耐力和力量[5]。值得注意的是,姜黄素在维护肠道健康方面也表现出积极作用,能有效改善肠道菌群组成以及肠屏障功能[6]。尽管姜黄素对肠道菌群及其代谢物的影响已有所揭示,但其如何通过调节肠道菌群进而提高运动表现的作用机制,仍待深入研究。
肠道菌群与人体健康息息相关,对于运动员的健康状况和运动表现同样具有重要影响。研究表明,运相较于久坐人群,运动人群展现出更高的肠道菌群alpha多样性及短链脂肪酸(short-chain fatty acids, SCFAs)产生菌的丰度,有助于增加能量摄入,提升机体代谢效率[7]。此外,肠道菌群的代谢物在调节运动表现中发挥着关键作用。肠道菌群产生的SCFAs通过调节乳酸代谢,促进骨骼肌糖原合成[8],并改善肠道屏障功能,进而提升运动表现。同时,肠道菌群产生的脂肪酸酰胺(fatty acid amide, FAA)能够下调纹状体中单胺氧化酶水平,增加纹状体多巴胺含量,从而提高运动动机和表现[9]。为深入探究姜黄素在提高运动表现中的作用机制,本研究将对姜黄素在小鼠模型中的运动表现、血清与肌肉代谢以及肠道菌群及其代谢产物的影响进行全面分析。
1 材料与方法
1.1 材料与试剂
姜黄素,上海创赛科技有限公司;氯化钠,无水硫酸钠,无水乙醚,国药集团化学试剂有限公司;肝/肌糖原测定试剂盒(比色法),南京建成生物工程研究所;环保型肌肉固定液,赛维尔生物科技有限公司。
1.2 仪器与设备
高速冷冻离心机,德国Eppendorf公司;数字切片扫描仪,匈牙利3DHISTECH公司;气相色谱-质谱联用仪,日本岛津公司;超高效液相色谱-高分辨质谱联用仪,美国赛默飞世尔科技公司;疲劳转棒仪,上海欣软信息科技有限公司;抓握力仪,济南益延科技有限公司;AU5800全自动生化分析仪,贝克曼仪器有限公司;SCIENTZ-48高通量组织研磨器,宁波新芝生物科技股份有限公司。
1.3 实验方法
1.3.1 动物实验方法
实验采用30只无特定病原体(specific pathogen free, SPF)雄性ICR小鼠,6周龄,购买于北京维通利华实验动物技术有限公司。饲养于江南大学实验动物中心SPF级屏障中(温度21~26 ℃,湿度40%~70%,噪声≤60 dB,动物照度15~20 LX)。所有组的小鼠自由摄食和饮水,随机分为3组,每组10只,所有操作均按照《江南大学实验动物管理办法》执行,所有动物伦理均通过江南大学实验动物伦理委员会批准(JN.No20230615i1500901[288])。
实验共计8周,第1周为小鼠适应期,在小鼠适应期结束后,随机分为空白组、模型组、姜黄素组;第2周~第8周,空白组和模型组每天灌胃0.2 mL的无菌生理盐水,干预组灌胃姜黄素,灌胃剂量为100 mg/kg;从第5周开始,除空白组以外,各组小鼠连续2周每天进行30 min无负重游泳运动训练;第8周后一周进行运动表现测量,实验结束前,收集小鼠的粪便,进行宏基因组测序。实验期间,每周测量1次小鼠的体重。处死小鼠前,除空白组,各组小鼠均进行力竭游泳时间测定,力竭运动完,摘除小鼠眼球进行取血,并收集相应组织进行后续测量。具体动物实验方案见图1。
图1 动物实验方案
Fig.1 Design for animal experiments
1.3.2 运动表现测量
1.3.2.1 力竭游泳时间测定
除空白组小鼠外,其余各组小鼠在最后一次灌胃后休息30 min,随后进行负重游泳力竭时间的测定。实验过程中,小鼠尾根部负重为其体重的5%,游泳水温控制在(25±1) ℃。当小鼠出现后肢运动迟缓、游泳范围缩小,且头部在3 s内无法自行浮出水面时,即判定为力竭状态。
1.3.2.2 疲劳转棒时间测定
第8周测定小鼠疲劳转棒时间。将小鼠放在疲劳转棒仪上训练3次,然后再开始测定。训练结束后,转速选择为30 r/min,用来记录小鼠从转棒仪上掉下来的时间。
1.3.2.3 前肢抓力测定
第8周使用抓握力计测试小鼠的前肢抓力。将小鼠前肢水平置于抓力杆上,抓住尾部,水平缓慢拉动小鼠,该试验重复5次,最后取其最大值。
1.3.3 组织糖原测定
小鼠安乐死后,收集肝脏和左侧腓肠肌组织。收集到的组织用PBS洗涤,立即用液氮冷冻。肝脏和肌肉糖原含量遵循制造商的说明,使用试剂盒进行测定。
1.3.4 血清生化指标测定
力竭游泳之后,摘除小鼠眼球取血,血液静置1 h后,4 ℃,3 000 r/min离心15 min获得血清。将血清仔细吸入无酶离心管中,使用自动生化分析仪测定血乳酸(blood lactic acid, BLA)、乳酸脱氢酶(lactic dehydrogenase, LDH)、血尿素氮(blood urea nitrogen, BUN)和肌酸激酶(creatine kinase, CK)水平。
1.3.5 小鼠组织病理学分析
小鼠安乐死之后,小心取出小鼠右侧腓肠肌、肝脏组织在4%(体积分数)多聚甲醛中浸泡24 h。通过石蜡包埋、苏木精和伊红(hematoxylin-eosin, H&E)染色,制成切片。使用数字切片扫描仪扫描切片。
1.3.6 小鼠粪便肠道菌群代谢物测定
1.3.6.1 短链脂肪酸测定方法
将大约50 mg的粪便样品加入到2 mL离心管,随后加入500 μL饱和氯化钠溶液,使用组织破碎仪在60 Hz条件下破碎30 s,此步骤重复3~5次,直至无大颗粒。转移至通风橱中,加入1 mL乙醚萃取,涡旋振动30 s混匀,在12 000 r/min,4 ℃条件下离心15 min后,小心吸取乙醚层至提前准备的装有0.25 g无水硫酸钠的离心管中,放于4 ℃冰箱,静置15 min,再以上述相同条件离心,吸取上清液,有机相滤膜过滤后,转移至液相小瓶,等待上样[10]。使用Rtx-Wax色谱柱对化合物进行分离,气相色谱-质谱联用仪(GCMS-QP2010 ultra system)对样品进行检测。载气为N2,流速为1 mL/min;进样体积为1 μL,分流比为10∶1;初始柱温为100 ℃,以7.5 ℃/min升温速率升温至140 ℃,再以60 ℃/min升温至200 ℃。在200 ℃保持3 min,进样温度为240 ℃,电离温度为220 ℃。
1.3.6.2 脂肪酸酰胺测定方法
将金属珠(0.5 cm)加入小鼠盲肠内容物的离心管中,涡旋5 min,直到内容物完全均匀。之后加入1 mL超纯水,样品涡旋2 min,然后加入1 mL氯仿,溶液再涡旋2 min,收集氯仿层,蒸发样品。干燥完的样品在-20 ℃下保存,测量前用乙腈∶甲醇=7∶1(体积比)溶液复溶,离心后得到上清液进行油酰乙醇胺(oleoylethanolamide, OEA)、苯乙胺(phenethylamine, PEA)和N-花生四烯酰多巴胺(N-arachidonoyl dopamine, NADA)含量的检测。使用ACQUIRE UPLC BEH C18色谱柱对化合物进行分离,使用液相-质谱联用仪进行检测。流动相A相为0.1%甲酸乙腈溶液,B相为0.1%甲酸水溶液。洗脱梯度:0~2 min,5% A;2~14 min,5%~95% A;14~15 min,95% A;15~16 min,5% A。进样体积5 μL。正、负离子模式检测条件,电喷雾离子源,质量扫描范围100~1 200 m/z[9]。
1.3.7 小鼠粪便肠道菌群宏基因组测定
将收集到的小鼠粪便样品,通过北京诺禾致源科技股份有限公司DNBSEQ-T7平台PE150进行宏基因组测序。对获得的原始测序数据进行质量控制,对质控后的基因序列利用MetaPhlAn3和HUMAnN3进行物种和功能注释。利用MetaPhlAn3将各个样本的物种丰度信息进行合并,获得多个样本的物种丰度信息表[11]。
1.4 统计与分析
文中数据以“平均值±标准差”表示,使用Graphpad Prism(version 8.4.3)进行单因素方差分析(one-way ANOVA)。P<0.05表示数据具有显著差异,其中*表示P<0.05,**表示P<0.01,***表示P<0.001,****表示P<0.000 1。使用微科盟生科云网站(https://www.bioincloud.tech/)对肠道菌群的多样性、主坐标分析(principal co-ordinates analysis, PCoA)以及线性判别分析(the linear discriminant analysis effect size, LEfSe)进行分析以及可视化。
将样本中相对丰度总和>0.1%的菌种以及肠道菌群代谢物浓度与运动表现相关生理指标进行Spearman关联分析,筛选出相关系数绝对值|R|>0.3且P<0.05的菌属。Spearman相关性采用R语言的corr.test函数进行计算,并用pheatmap函数进行可视化。
2 结果与分析
2.1 姜黄素提高小鼠运动表现
实验过程中,各组小鼠的行为活动、腺体分泌、排泄物等均未出现异常,成活率达100%。实验小鼠的体重如图2-a所示,各组小鼠的初始体重、最终体重均没有显著差异,表明各组干预对小鼠的生长情况没有影响,也没产生毒副作用。
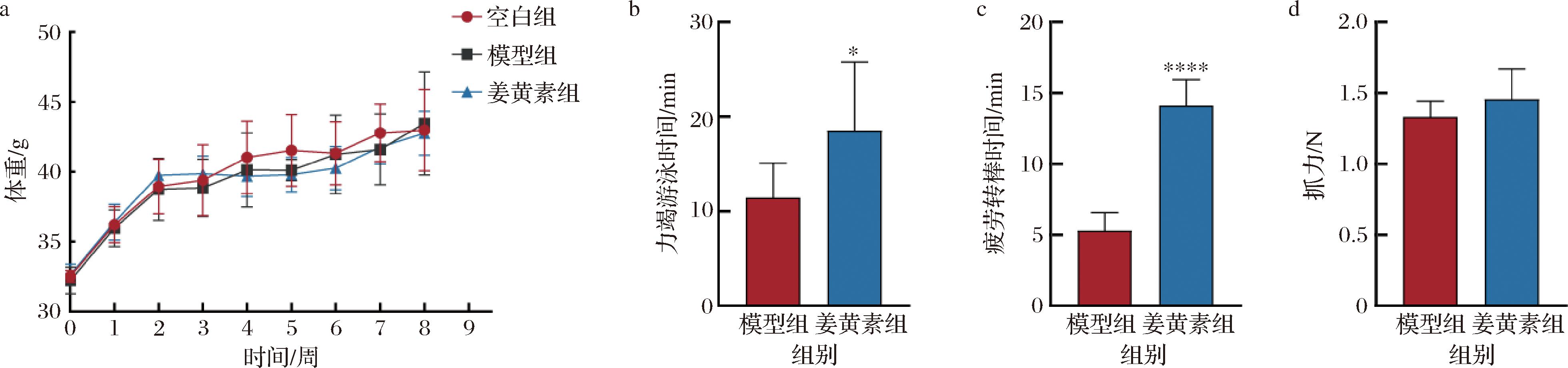
a-小鼠体重变化;b-力竭游泳时间;c-疲劳转棒时间;d-前肢抓力
图2 姜黄素对小鼠运动表现的影响
Fig.2 Effect of curcumin on exercise performance in mice
为了深入探究姜黄素对运动表现的影响,本文对小鼠进行了为期6周的姜黄素灌胃处理,并在2周的游泳运动训练后测量了小鼠力竭游泳时间、疲劳转棒时间和前肢抓力(图2-b~图2-d)。力竭游泳时间和疲劳转棒时间能表明小鼠的抗疲劳能力。与模型组[(11.43±3.34) min]相比,姜黄素[(18.53±6.81) min]显著增加了小鼠力竭游泳时间(P<0.05)。与模型组[(5.31±1.63) min]相比,姜黄素[(14.11±1.73) min]同样显著增加了小鼠疲劳转棒时间(P<0.000 1)。前肢抓力是小鼠力量的一个重要表征,与模型组[(1.31±0.10) N]相比,姜黄素[(1.43±0.20) N]并未对小鼠前肢抓力产生显著影响。对于运动表现指标的测量,本文发现姜黄素能提高小鼠的运动表现,对运动耐力产生积极的影响。
2.2 姜黄素改善小鼠血清以及肌肉代谢
血清以及肌肉生化指标常作为运动疲劳的一个评价方面,本文进一步对运动疲劳相关血清生化以及肌肉代谢指标进行测量。在长期或高强度运动中,BLA的产生超过了细胞内的缓冲能力,导致BLA水平急剧上升,直接影响肌肉的性能[12]。LDH是调控乳酸代谢过程的关键酶之一,在运动过程中发挥着至关重要的作用,其活性水平的调节直接影响着乳酸的产生与清除速率,进而影响着肌肉疲劳程度和运动表现[13]。此外,过量运动造成的蛋白质分解也会增加BUN水平,对肌肉的收缩和力量产生负面影响,加重疲劳[14]。CK活性的变化也是肌肉损伤和营养不良的重要指标[14]。因此,有效清除这些代谢产物,恢复肌肉组织的正常功能,是减轻运动后疲劳的关键。如图3-a~图3-d所示,实验结果表明力竭游泳之后,与空白组相比,模型组血清疲劳相关指标均显著增加。与模型组相比,姜黄素的干预显著降低了小鼠BLA含量(P<0.05),BUN含量(P<0.05),CK含量(P<0.001),同时对运动造成的血清LDH含量增加具有缓解作用。
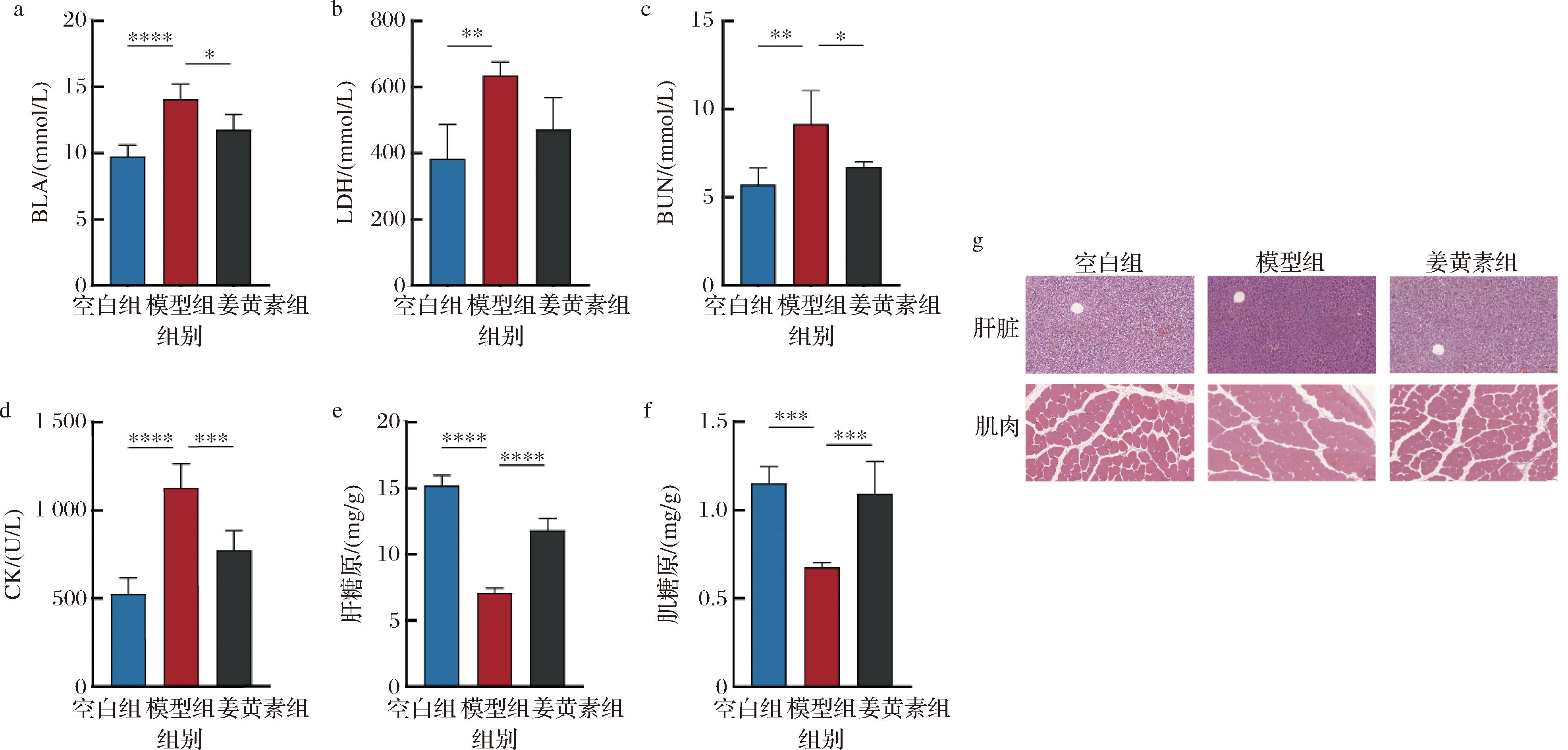
a-BLA含量;b-血清LDH含量;c-BUN含量;d-血清CK含量;e-肝糖原含量;f-肌糖原含量;g-肝脏及肌肉切片(放大倍数:×200)
图3 姜黄素对小鼠血清以及肌肉代谢的影响
Fig.3 Effect of curcumin on serum and muscle metabolism in mice
糖原在运动表现中扮演关键角色。充足的糖原储备能提供长时间持久的耐力运动所需能量,同时在高强度、短时爆发力运动中支持肌肉迅速释放能量[15]。如图3-e~图3-f所示,模型组与空白组相比显著降低肌糖原以及肝糖原的储备,而与模型组相比姜黄素的干预均显著恢复了小鼠肝糖原(P<0.000 1)以及肌糖原的含量(P<0.001)。当糖原消耗殆尽,使机体血糖水平无法维持时,生物体就可能出现血糖过低的症状,从而产生疲劳感,使运动强度无法维持[16]。结果表明,姜黄素可能通过降低小鼠血清乳酸、尿素氮和肌酸激酶含量,增加小鼠肝脏和肌肉的糖原含量,使小鼠具备更强的耐力表现和抗疲劳能力。
如图3-g所示,本文发现各组的肝脏、肌肉组织之间组织病理学均没有显著差异,并且各干预组对实验小鼠的肝脏、肌肉组织均没有毒副作用。
2.3 姜黄素改善小鼠肠道微生态失调
越来越多的研究证实了肠道菌群在改善骨骼肌代谢、促进骨骼健康和提高运动表现中的作用[17]。为了探究姜黄素作用于肠道菌群改善运动表现的可能机制,本文对小鼠粪便菌群进行宏基因测序。肠道菌群分析中的alpha多样性和beta多样性是2个关键指标,用于揭示微生物群落内部多样性和不同样本之间的差异,反映了肠道菌群的整体情况。alpha反映了微生物种类丰富度和相对丰度的情况,结果表明,空白组、模型组和姜黄素组3种alpha多样性指数(Shannon、Simpson和Pielou指数)均无显著差异(图4-a);而beta多样性则用来揭示了不同环境或生态系统中微生物群落结构的多样性。使用基于bray curtis距离的主坐标分析来评估干预后的小鼠肠道菌群的beta多样性,结果表明3组之间无显著差异(图4-b)。以上研究表明,姜黄素对运动小鼠肠道菌群整体的结构影响较小。
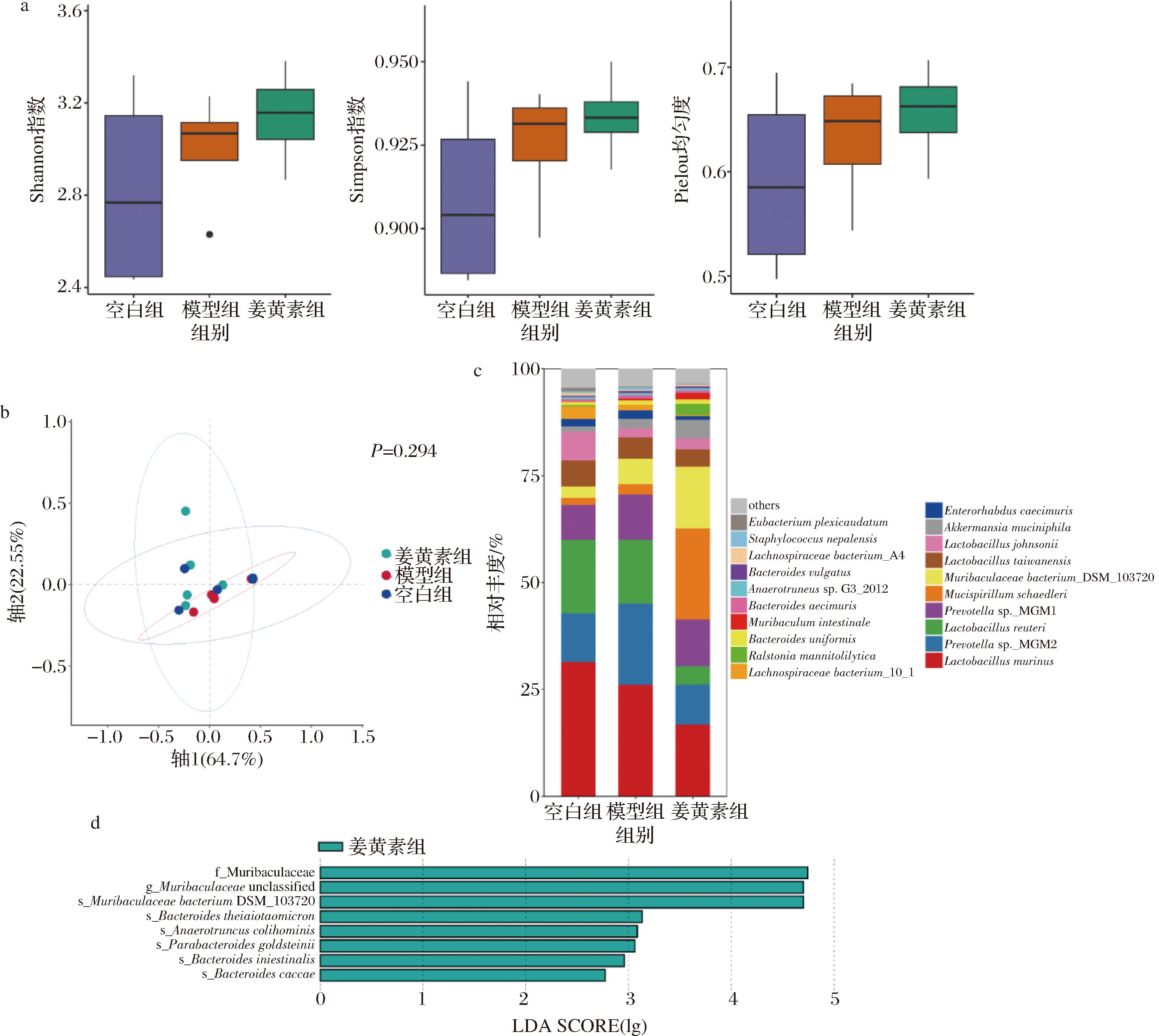
a-alpha多样性;b-beta多样性;c-物种丰度堆积图;d-模型组与姜黄素组之间物种水平LEfSe分析
图4 姜黄素对小鼠肠道菌群的影响
Fig.4 Effect of curcumin on gut microbiota in mice
如图4-c所示,对物种丰度排名前20的丰度堆积图,表明了姜黄素的干预对小鼠的菌种组成产生了影响。基于LEfSe分析(LDA>2),进一步探究姜黄素组小鼠和模型组小鼠之间的差异肠道菌种。与模型组相比,姜黄素干预显著增加了Muribaculaceae bacterium DSM103720、Bacteroides thetaiotaomicron、Anaerotruncus colihominis、Parabacteroides goldsteinii、Bacteroides intestinalis和Bacteroides caccae的相对丰度(图4-d)。KRYPOTOU等[18]的研究表明B.thetaiotaomicron是人类肠道中最丰富的细菌种类之一,通常存在于瘦削和健康的个体当中,能降低血清中谷氨酸的浓度,加快脂肪细胞的分解,降低脂肪堆积,延缓体重的增长。LAI等[19]发现P.goldsteinii通过增加脂肪组织的产热,增强线粒体和核糖体活性,进而降低炎症和胰岛素抵抗水平。YASUMA等[20]发现B.intestinalis可以诱导IL-1β的转录来增强宿主的免疫功能。以上结果表明,姜黄素提高了运动小鼠肠道菌群有益菌种B.thetaiotaomicron、P.goldsteinii和B.intestinalis的丰度,推测姜黄素可能通过改善肠道菌群,促进肠道菌群有益菌种丰度进而提高小鼠运动表现。
2.4 姜黄素提高小鼠有益肠道菌群代谢物的浓度
为了进一步揭示姜黄素促进小鼠运动表现的作用机制,对小鼠粪便中的SCFAs和盲肠内容物中FAA的含量进行测量。肠道菌群产生的SCFAs可通过影响乳酸代谢,提供能量,增加骨骼肌糖原的合成,改善肠屏障[21],进而提升运动表现。如图5-a~图5-c所示,与空白组相比模型组乙酸(P<0.000 1)、丙酸(P<0.001)和丁酸(P<0.001)含量显著降低,这可能是由于高强度的运动导致了肠道内SCFAs含量的降低。但是姜黄素的干预改善了SCFAs含量的降低。与模型组相比姜黄素的口服摄入增加了小鼠粪便中乙酸(P<0.05)和丁酸(P<0.01)的含量。以上的结果表明姜黄素能促进3种常见的SCFAs含量的增加。SCHEIMAN等[22]基于马拉松运动员宏基因组数据,发现韦荣球菌属能通过甲基丙二酰辅酶A通路将乳酸代谢为丙酸,进而提高运动表现。肠道中产生的SCFAs可以进入体内循环,通过增加肌肉细胞表面乳酸载体MCT1和MCT4的表达,促进乳酸快速转运至周围组织,减少肌肉中乳酸的堆积[23]。SCFAs能激活AMPK通道,促进骨骼肌GLUT4蛋白的表达[24],增加肌肉细胞对葡萄糖的摄入,并且结合G蛋白偶联受体FFAR2和FFAR3,活化糖原合酶,进而提高肌肉中糖原含量[25]。由此推测姜黄素可能通过促进肠道中SCFAs的产生,促进疲劳后肌肉内的乳酸代谢,提高糖原含量,进而提高运动表现。
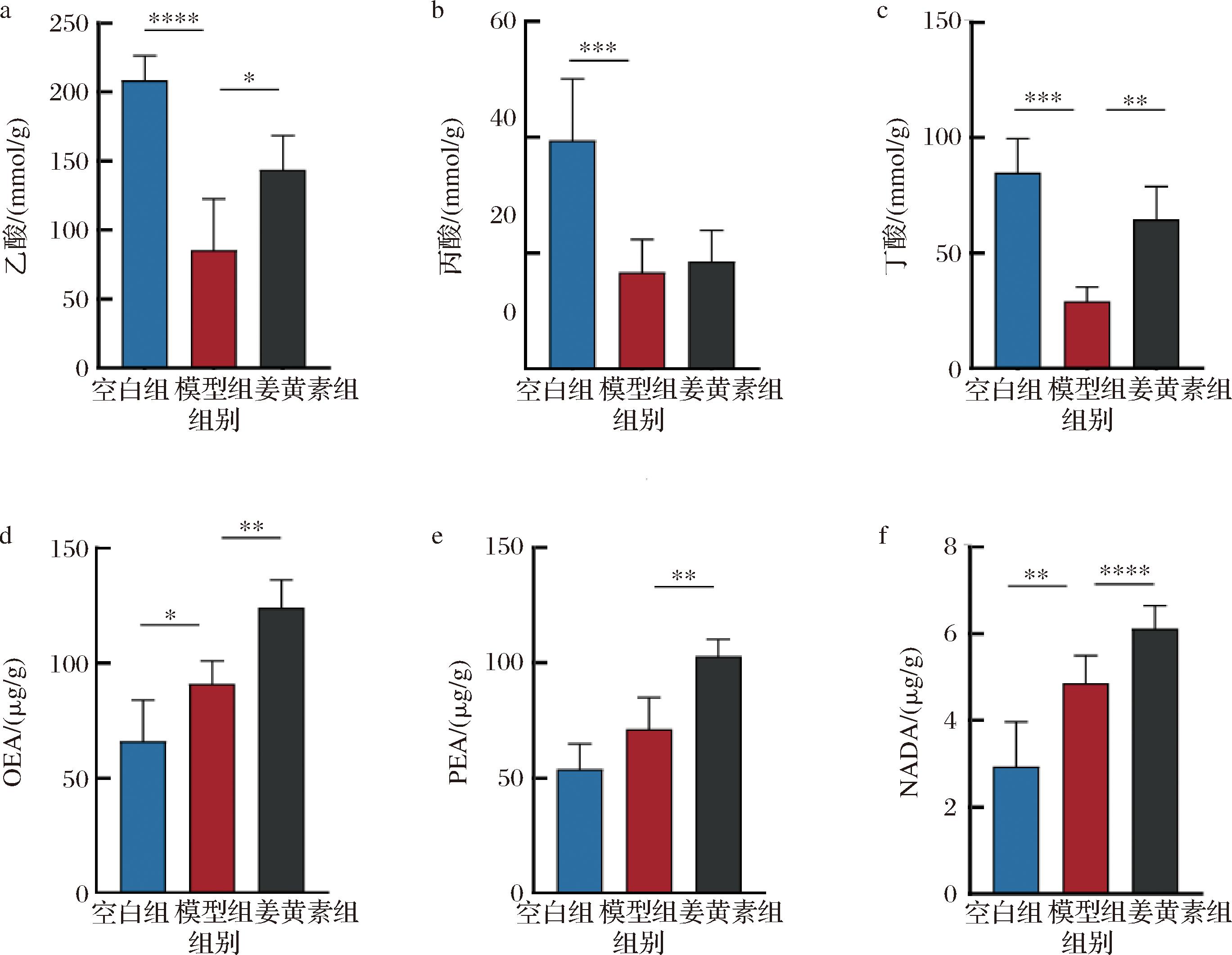
a-粪便乙酸含量;b-粪便丙酸含量;c-粪便丁酸含量;d-盲肠内容物中OEA含量;e-盲肠内容物中PEA含量;f-盲肠内容物中NADA含量
图5 姜黄素对小鼠肠道菌群代谢物含量的影响
Fig.5 Effect of curcumin on metabolite content of gut microbiota in mice
肠道菌群产生FAA代谢产物能增强运动表现与动机[9]。如图5-d~图5-f所示,与模型组相比姜黄素盲肠内容物中OEA(P<0.01)、PEA(P<0.01)、NADA(P<0.000 1)含量显著增加。DOHN LOV
LOV 等[9]发现肠道菌群有助于肠道FAA代谢产物的产生,触发CB1表达TRPV1+感觉神经元,并促进纹状体MAO水平下调,MAO的下调能帮助提高多巴胺水平并且增强运动能力。由此推测姜黄素可能通过促进肠道内FAA含量增加,进而提高运动动机与表现。
等[9]发现肠道菌群有助于肠道FAA代谢产物的产生,触发CB1表达TRPV1+感觉神经元,并促进纹状体MAO水平下调,MAO的下调能帮助提高多巴胺水平并且增强运动能力。由此推测姜黄素可能通过促进肠道内FAA含量增加,进而提高运动动机与表现。
2.5 肠道菌群及其代谢产物与运动表现指标相关性分析
如图6-a所示,对各组小鼠肠道菌群菌种与小鼠力竭游泳时间、疲劳转棒时间、抓力和血清疲劳相关指标进行相关性分析,Bacteroides xylanisolvens和Parabacteroides goldsteinii的相对丰度与疲劳转棒时间(P<0.01)和抓力(P<0.05)呈显著正相关。如图6-b所示,对各组小鼠肠道菌群代谢物浓度与小鼠力竭游泳时间、疲劳转棒时间、抓力和血清疲劳相关指标进行相关性分析,小鼠疲劳转棒时间与丁酸(P<0.01)、OEA(P<0.01)、PEA(P<0.05)和NADA(P<0.05)呈显著正相关。粪便中乙酸含量与BLA(P<0.05)和CK(P<0.05)含量显著负相关。并且丁酸含量与LDH(P<0.05)和BUN(P<0.01)含量显著负相关。此外,除OEA与BLA含量之间无显著负相关,其余3种FAA类物质含量与血清疲劳相关指标均显著负相关。这些结果表明姜黄素可能通过调节肠道菌群及其代谢产物进而提高运动表现。
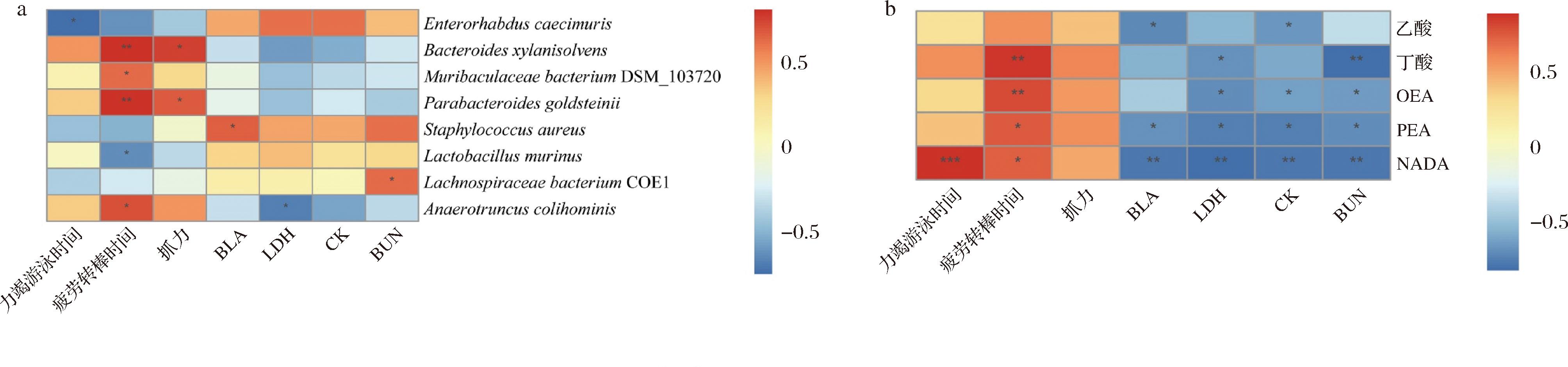
a-运动表现指标与不同菌种的相关性;b-运动表现指标与不同菌种的相关性
图6 肠道菌群及其代谢产物与运动表现指标相关性
Fig.6 Correlation between intestinal flora and its metabolites and exercise performance indicators
3 结论
本研究表明,姜黄素在提高小鼠运动表现方面发挥了积极的作用。首先,姜黄素能显著增加小鼠力竭游泳时间和疲劳转棒时间,表明其能提高运动耐力。其次,姜黄素能够改善小鼠血清和肌肉代谢,减少血清乳酸、尿素氮和肌酸激酶等疲劳相关指标的含量,同时增加肌糖原的储备,有利于维持运动时的能量供应和减轻肌肉损伤。此外,姜黄素还能改善肠道菌群,提高肠道有益菌群代谢物的浓度,进而影响运动表现。综合而言,姜黄素可能通过改善肌肉代谢、提高糖原储备、调节肠道菌群及其代谢物等途径,促进小鼠的运动表现。这些发现不仅有助于理解姜黄素在提高运动表现中的作用机制,还为运动营养食品的开发提供了新的理论依据。
[1] CONSTANTIN-TEODOSIU D, CONSTANTIN D.Molecular mechanisms of muscle fatigue[J].International Journal of Molecular Sciences, 2021, 22(21):11587.
[2] MATTHEWS J, PISAURO M A, JURGELIS M, et al.Computational mechanisms underlying the dynamics of physical and cognitive fatigue[J].Cognition, 2023, 240:105603.
[3] 康鹏, 李国薇, 马宏祥, 等.运动营养食品及其抗疲劳活性成分研究进展[J].食品安全质量检测学报, 2021, 12(23):9157-9164.KANG P, LI G W, MA H X, et al.Research progress of sports nutrition food and its anti-fatigue bioactive components[J].Journal of Food Safety and Quality, 2021, 12(23):9157-9164.
[4] 郑毅, 郑施施, 王增寿.姜黄素-PLGA纳米粒提高口服给药生物利用度的研究[J].中国现代应用药学, 2014, 31(6):717-721.ZHENG Y, ZHENG S S, WANG Z S.Enhancement of oral bioavailability of curcumin loaded PLGA nanoparticles[J].Chinese Journal of Modern Applied Pharmacy, 2014, 31(6):717-721.
[5] CHEN Y M, CHIU W C, CHIU Y S, et al.Supplementation of nano-bubble curcumin extract improves gut microbiota composition and exercise performance in mice[J].Food &Function, 2020, 11(4):3574-3584.
[6] DI MEO F, MARGARUCCI S, GALDERISI U, et al.Curcumin, gut microbiota, and neuroprotection[J].Nutrients, 2019, 11(10):2426.
[7] ESTAKI M, PITHER J, BAUMEISTER P, et al.Cardiorespiratory fitness as a predictor of intestinal microbial diversity and distinct metagenomic functions[J].The FASEB Journal,2016,30:1027.5.
[8] MOHR A E, J GER R, CARPENTER K C, et al.The athletic gut microbiota[J].Journal of the International Society of Sports Nutrition, 2020, 17(1):24.
GER R, CARPENTER K C, et al.The athletic gut microbiota[J].Journal of the International Society of Sports Nutrition, 2020, 17(1):24.
[9] DOHN LOV
LOV L, LUNDGREN P, CARTY J R E, et al.A microbiome-dependent gut-brain pathway regulates motivation for exercise[J].Nature, 2022, 612(7941):739-747.
L, LUNDGREN P, CARTY J R E, et al.A microbiome-dependent gut-brain pathway regulates motivation for exercise[J].Nature, 2022, 612(7941):739-747.
[10] WANG L L, HU L J, YAN S, et al.Effects of different oligosaccharides at various dosages on the composition of gut microbiota and short-chain fatty acids in mice with constipation[J].Food &Function, 2017, 8(5):1966-1978.
[11] BEGHINI F, MCIVER L J, BLANCO-M GUEZ A, et al.Integrating taxonomic, functional, and strain-level profiling of diverse microbial communities with bioBakery 3[J].ELife, 2021, 10:e65088.
GUEZ A, et al.Integrating taxonomic, functional, and strain-level profiling of diverse microbial communities with bioBakery 3[J].ELife, 2021, 10:e65088.
[12] DEVLIN J, PATON B, POOLE L, et al.Blood lactate clearance after maximal exercise depends on active recovery intensity[J].The Journal of Sports Medicine and Physical Fitness, 2014, 54(3):271-278.
[13] WANG Z W, LIU X D, GAO K, et al.Clinical effects and biological mechanisms of exercise on lumbar disc herniation[J].Frontiers in Physiology, 2024, 15:1309663.
[14] 陶雅浩, 金其贯, 徐昊然.牡蛎肽补充和运动训练对小鼠运动耐力的影响[J].食品科技, 2020, 45(3):57-63.TAO Y H, JIN Q G, XU H R.Effects of oyster peptide supplementation and exercise training on exercise endurance in mice[J].Food Science and Technology, 2020, 45(3):57-63.
[15] KNUIMAN P, HOPMAN M T E, MENSINK M.Glycogen availability and skeletal muscle adaptations with endurance and resistance exercise[J].Nutrition &Metabolism, 2015, 12:59.
[16] ZHU X P, YAO T, WANG R, et al.IRF4 in skeletal muscle regulates exercise capacity via PTG/Glycogen pathway[J].Advanced Science, 2020, 7(19):2001502.
[17] CLAUSS M, GÉRARD P, MOSCA A, et al.Interplay between exercise and gut microbiome in the context of human health and performance[J].Frontiers in Nutrition, 2021, 8:637010.
[18] KRYPOTOU E, TOWNSEND G E, GAO X H, et al.Bacteria require phase separation for fitness in the mammalian gut[J].Science, 2023, 379(6637):1149-1156.
[19] LAI H C, LIN T L, CHEN T W, et al.Gut microbiota modulates COPD pathogenesis:Role of anti-inflammatory Parabacteroides goldsteinii lipopolysaccharide[J].Gut, 2022, 71(2):309-321.
[20] YASUMA T, TODA M, ABDEL-HAMID A M, et al.Degradation products of complex arabinoxylans by Bacteroides intestinalis enhance the host immune response[J].Microorganisms, 2021, 9(6):1126.
[21] MONDA V, VILLANO I, MESSINA A, et al.Exercise modifies the gut microbiota with positive health effects[J].Oxidative Medicine and Cellular Longevity, 2017, 2017(1):3831972.
[22] SCHEIMAN J, LUBER J M, CHAVKIN T A, et al.Meta-omics analysis of elite athletes identifies a performance-enhancing microbe that functions via lactate metabolism[J].Nature Medicine, 2019, 25(7):1104-1109.
[23] YAN J L, PAN Y B, SHAO W M, et al.Beneficial effect of the short-chain fatty acid propionate on vascular calcification through intestinal microbiota remodelling[J].Microbiome, 2022, 10(1):195.
[24] CHEN S J, HUANG L J, LIU B D, et al.Dynamic changes in butyrate levels regulate satellite cell homeostasis by preventing spontaneous activation during aging[J].Science China Life Sciences, 2024, 67(4):745-764.
[25] GUO Q, HOU X Y, CUI Q, et al.Pectin mediates the mechanism of host blood glucose regulation through intestinal flora[J].Critical Reviews in Food Science and Nutrition, 2024,64(19):6714-6736.