融合魏斯氏菌(Weissella confusa)归属于厚壁菌门、杆菌纲、乳杆菌目、明串珠菌科、魏斯氏菌属,是食品混菌发酵体系中常见的乳酸菌[1],广泛存在于酱油、泡菜、豆豉、香肠等发酵食品中[2]。W.confusa具有耐受低pH、耐受高胆盐、抑菌和高产胞外多糖等特性,可作为附属发酵剂在发酵食品中改善食品质构,促进风味物质和营养成分产生,提升发酵产品感官品质[3]。在W.confusa参与发酵的食品中,常会加入适量的食盐,如泡菜的发酵盐质量浓度为20~40 g/L;腊肉的发酵盐质量浓度为100~130 g/L;高盐稀态发酵酱油的发酵盐质量浓度为160~200 g/L[4]。这些发酵体系中的高盐浓度会引起高渗透压,使得微生物细胞内的水分向外渗出,细胞胞质分离,最终致使细胞生长停滞,严重时甚至造成细胞死亡[5-6]。因此,微生物在高盐环境中的存活、生长和代谢能力对产品品质至关重要[6]。
微生物适应高盐环境有2种策略:盐溶(salt-in)机制和盐析(salt-out)机制[7]。盐溶机制是微生物通过在细胞中积累高浓度的无机盐离子(如K+)来实现渗透平衡,该策略主要存在于嗜盐微生物中,但也在少数耐盐微生物中发挥作用。盐析机制又称相容性溶质机制[8],是微生物通过胞内合成或胞外转运积累相容性溶质以维持细胞渗透平衡,该策略是中度嗜盐菌和耐盐菌最常见的耐盐机制[9]。相容性溶质是一类不带电荷或两性离子的低分子量有机化合物,可以在细胞内高浓度积累而不防碍重要细胞活动,主要包括氨基酸、糖、多元醇及其衍生物[10]。氨基酸是盐析机制中备受关注的一类相容性溶质,其中起到渗透保护作用的氨基酸主要有脯氨酸、谷氨酸、天冬氨酸和丙氨酸等[11]。潘子怡[12]发现外源添加谷氨酸、脯氨酸能提高两歧双歧杆菌和青春双歧杆菌盐诱导胁迫下的耐受能力。HE等[13]发现盐胁迫导致Tetragenococcus halophilus细胞内脯氨酸的积累,且在120 g/L NaCl高盐培养基中添加脯氨酸时,与未添加脯氨酸相比,菌体密度增加了34.6%。W.confusa为耐盐菌,可在0~100 g/L的NaCl环境下生长[14],但调控W.confusa抗高盐胁迫的氨基酸类相容性溶质尚未见报道,其适应高盐环境的耐盐机制仍未明确。
本课题组前期从广式酱油酿造过程中制曲阶段24 h时的酱曲样品中分离到一株W.confusa JQ3,该菌株能耐高盐和低pH,可降解亚硝酸盐[15-16]。为进一步研究该菌株的耐盐特性,本研究以具有自主知识产权的W.confusa JQ3为研究对象,对其耐盐性、盐胁迫氨基酸变化以及氨基酸调控盐胁迫下菌株的生长特性进行研究,以期明晰关键氨基酸调控W.confusa抗盐胁迫的机制,为高盐体系中W.confusa发酵剂作用的高效发挥提供科学依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
本研究所用W.confusa JQ3来源见前文,保存于中国普通微生物菌种保藏中心(CGMCCC),登记号为CGMCC No.21637。
1.1.2 试剂
MRS肉汤培养基、技术琼脂粉,广东环凯微生物科技有限公司;氯化钠,福晨(天津)化学试剂有限公司;脯氨酸、鸟氨酸、组氨酸、谷氨酸、丙氨酸、瓜氨酸、酪氨酸、叔丁醇,上海麦克林生化科技股份有限公司;50%戊二醛、无水乙醇,天津市大茂化学试剂厂;甲醇、乙腈、甲酸,美国Fisher Chemical公司;钠测定试剂盒、钾测定试剂盒,南京建成生物工程研究所。
1.2 仪器与设备
LRH-150隔水式恒温培养箱,上海一恒科技有限公司;SW-CJ-1FD超净工作台,苏州安泰空气技术有限公司;BioTek ELx800多功能酶标仪,美国伯腾仪器有限公司;UHPLC-Q Exactive HF-X超高效液相色谱串联傅里叶变换质谱、Thermo Fisher Quatro S扫描电子显微镜,美国赛默飞世尔科技有限公司;SCIENTZ-10 N/A冷冻干燥机,宁波新芝生物科技股份有限公司;ICON 100自动菌落计数仪,上海磐麦科技有限公司;GR60DA全自动灭菌锅,美国ZEALWAY仪器股份有限公司;ALLEGRA-64R冷冻高速离心机,美国贝克曼库尔特公司。
1.3 实验方法
1.3.1 菌株活化
将菌株JQ3以2%(体积分数)的接种量接种于MRS液体培养基中,37 ℃静置培养10 h活化一代,再以2%(体积分数)接种量转移至新鲜MRS液体培养基中,37 ℃静置培养5 h作为预培养物。
1.3.2 盐胁迫对W.confusa JQ3生长的影响
将预培养物以10%(体积分数)的接种量接种至100 mL含有不同NaCl质量浓度(0、30、60、90 g/L)的MRS培养基中,测量菌体在0~24 h内600 nm波长条件下的吸光度值,研究菌株JQ3在不同浓度NaCl胁迫条件下的生长情况。将菌株在不同浓度NaCl胁迫下的培养液梯度稀释,涂布于MRS琼脂平板上,37 ℃恒温培养箱中培养24 h,通过计算其活菌数(lg CFU/mL)评价菌株JQ3的耐盐能力。
1.3.3 盐胁迫下W.confusa JQ3胞内氨基酸的变化
将预培养物以10%(体积分数)的接种量接种至100 mL含有不同NaCl质量浓度(0、60 g/L)的MRS培养基中,37 ℃静置培养4和24 h。菌悬液于8 000×g、4 ℃离心10 min,弃去上清液,得到菌体。取50 mg菌体,加入400 μL甲醇-水(4∶1,体积比)提取液,且提取液中含0.02 mg/mL的内标(L-2-氯苯丙氨酸)。样本溶液于冷冻组织研磨仪研磨6 min(-10 ℃,50 Hz),低温超声提取30 min(5 ℃,40 kHz)。将样品在-20 ℃静置30 min,于13 000×g、4 ℃离心15 min,对得到的上清液进行液相色谱-质谱分析。
液相色谱条件:色谱柱为HSS T3色谱柱(100 mm×2.1 mm,1.8 μm),流动相A为含体积分数0.1%甲酸的乙腈-水(95∶5,体积比),流动相B为含体积分数0.1%(体积分数)甲酸的乙腈-异丙醇-水(47.5∶47.5∶5,体积比),进样量3 μL,流速为0.4 mL/min,柱温为40 ℃。质谱条件:采用正负离子扫描模式,质量扫描范围为70~1 050 m/z,正负离子电压为3 500 V,鞘气流速为50 psi,辅助气流速为13 psi,辅助气加热温度为425 ℃,归一化的碰撞能为20-40-60 V循环碰撞能。样品上机完成之后,液相色谱-质谱原始数据导入处理软件Progenesis QI进行基线过滤、峰识别、积分、保留时间校正、峰对齐,同时将质谱信息比对数据库后,得到氨基酸信息。
1.3.4 外源添加不同种类氨基酸对盐胁迫下W.confusa JQ3生长的影响
根据胞内氨基酸变化结果,将预培养物以10%(体积分数)的接种量分别接种至100 mL含有8 mmol/L不同氨基酸(鸟氨酸、脯氨酸、谷氨酸、丙氨酸、组氨酸、瓜氨酸和酪氨酸)的MRS-NaCl培养基中(含有60 g/L NaCl)。培养4和24 h后,测量600 nm波长下的吸光度值,评价不同氨基酸对盐胁迫下菌株JQ3的作用。
1.3.5 盐胁迫下脯氨酸的最佳添加量
将预培养物以10%(体积分数)的接种量接种至100 mL含有不同浓度脯氨酸(0、8、16、24、32、40 mmol/L)的MRS-NaCl培养基中(含有60 g/L NaCl),培养4和24 h后,测量菌体在600 nm波长条件下的吸光度值,结合稀释涂布活菌数(lg CFU/mL)确定脯氨酸的最佳添加量。
1.3.6 脯氨酸调控盐胁迫下W.confusa JQ3的生理响应
1.3.6.1 细胞膜完整性测定
细胞膜的完整性参考MERGHNI等[17]的方法,通过测定胞外OD260和OD280值的变化分析细胞中核酸和蛋白质的释放。将预培养物培养至对数生长期,离心、悬浮至含有0 g/L NaCl、60 g/L NaCl、60 g/L NaCl-脯氨酸的无菌水中,使其终浓度为1.0×108 CFU/mL,37 ℃下培养4和24 h,取1 mL菌液,8 000×g离心10 min,得到的上清液经0.22 μm滤膜过滤后,测量上清液在260 nm和280 nm波长条件下的吸光度值。
1.3.6.2 菌体形态变化
利用扫描电子显微镜观察不同培养条件下菌株JQ3的形态变化。样品的制备参考ZHANG等[18]的方法稍作修改。将预培养物以10%(体积分数)的接种量分别接种至MRS、MRS-NaCl以及MRS-NaCl-脯氨酸培养基中,37 ℃下培养4 h和24 h,于8 000× g、离心90 s收集细胞,并用PBS洗涤3次。使用2.5%(体积分数)戊二醛在4 ℃下固定过夜,洗涤后于8 000×g离心90 s,用不同体积分数的乙醇(30%、50%、70%、90%、95%、100%)对细胞进行梯度脱水15 min。将样品置于乙醇-叔丁醇(1∶1,体积比)的混合液中15 min,离心去上清液,然后用纯叔丁醇置换乙醇2次,每次15 min。将固定后的细胞置于冷冻干燥机中干燥4 h,将得到的菌粉固定在导电胶上,使用离子溅射镀膜设备,在样品表面镀上厚度为100~150 A的金膜。通过扫描电子显微镜以15 kV的电压,80 000×倍的放大倍数观察菌体形态。
1.3.6.3 离子浓度确定
将预培养物以10%(体积分数)的接种量分别接种至MRS-NaCl以及MRS-NaCl-脯氨酸培养基中,37 ℃下培养4 h和24 h,于4 ℃、8 000×g离心10 min,菌泥用去离子水洗涤3次后重悬于10 mL去离子水中。通过高压均质机(循环水温度4 ℃,均质压力为1 500 bar,循环7次)进行破碎,4 ℃、5 000×g离心10 min后收集上清液,通过测定试剂盒对Na+和K+浓度进行测定。
1.4 数据分析
所有实验均设定3个平行以上,数据采用SPSS 29软件进行显著性分析和方差分析,采用Origin 2021软件进行数据整理和作图。
2 结果与分析
2.1 不同浓度NaCl对W.confusa JQ3生长的影响
不同质量浓度NaCl对W.confusa JQ3生长的影响如图1所示。如图1-A所示,随着NaCl浓度升高,菌株JQ3的生长受到不同程度的抑制。在无盐培养条件下,菌株4 h后进入稳定期;在30、60 g/L NaCl培养条件下,菌体密度下降,表明菌株生长受到抑制;在90 g/L NaCl培养条件下,菌体密度维持在初始值,表明菌株几乎不生长。如图1-B所示,不同浓度NaCl在不同时间对菌株JQ3活菌数的影响不同。当盐胁迫4 h时,活菌数随着盐浓度的升高而下降,但60、90 g/L NaCl组活菌数无显著差异(P>0.05);当盐胁迫24 h后,30、60 g/L NaCl组活菌数无显著差异(P>0.05),且均高于无盐组和90 g/L NaCl组。相同盐浓度不同培养时间活菌数结果显示,0、30、90 g/L NaCl组的活菌数随着培养时间延长而下降,但60 g/L NaCl组活菌数不变。不同浓度NaCl对菌株JQ3生长结果表明,菌株能在0~90 g/L NaCl质量浓度下存活,与文献报道的融合魏斯氏菌耐受0~100 g/L NaCl质量浓度结果一致[14]。此外,本实验结果表明,不同盐浓度对融合魏斯氏菌生长的影响不同,0、30、90 g/L盐质量浓度活菌数变化趋势一致,但当盐质量浓度为60 g/L时,活菌数达到最大值后存活时间更长。
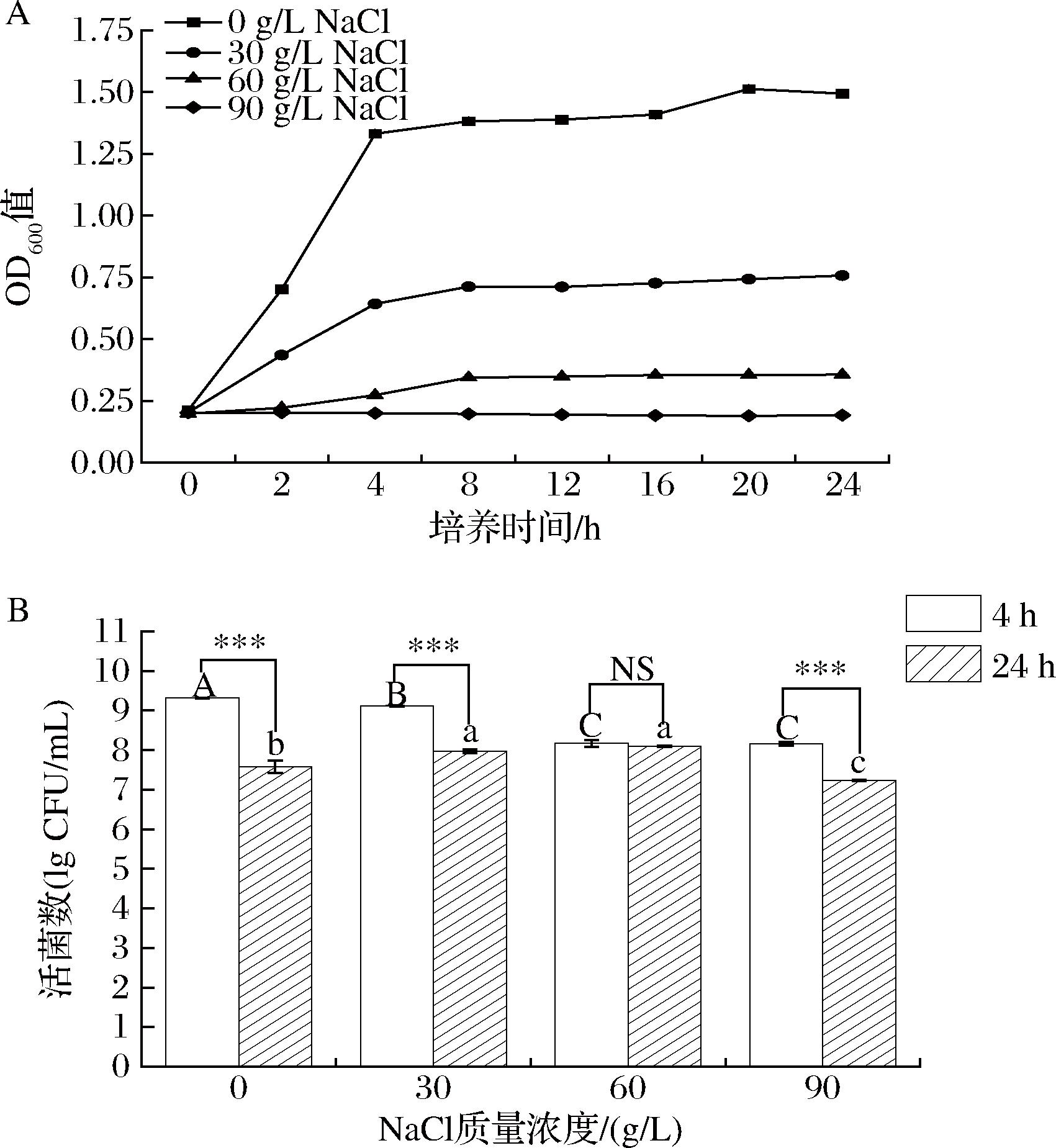
A-生长情况;B-存活情况
图1 不同浓度盐胁迫下W.confusa JQ3的生长情况和存活情况
Fig.1 Growth and survival of W.confusa JQ3 under different concentrations of salt stress
注:不同大写字母表示4 h时不同盐浓度活菌数差异显著(P<0.05);不同小写字母表示24 h时不同盐浓度活菌数差异显著(P<0.05);![]() 表示同一盐浓度不同时间之间的显著性差异情况(***:P<0.001,NS:P>0.05)。
表示同一盐浓度不同时间之间的显著性差异情况(***:P<0.001,NS:P>0.05)。
2.2 盐胁迫下W.confusa JQ3胞内氨基酸的变化
氨基酸是一类具有渗透保护作用的相容性溶质,高渗环境中大多数细菌可以通过从外界环境转运和胞内合成2种方式积累相容性溶质,提高细胞膨压以平衡渗透压[4]。为探究氨基酸对菌株JQ3在60 g/L盐胁迫下生长的影响,通过高效液相色谱-质谱技术对盐胁迫与非胁迫下菌株胞内氨基酸进行了分析,结果如表1所示。菌株JQ3胞内共检测出9种含量有变化的氨基酸。如表1所示,不同培养时间的盐胁迫下菌株胞内氨基酸变化不同。当菌株培养4 h后,与无盐组相比,60 g/L盐胁迫组中5种氨基酸相对含量显著增加,3种氨基酸含量显著下降,1种氨基酸变化不显著。当菌株培养24 h后,与无盐组相比,60 g/L盐胁迫组中7种氨基酸相对含量显著增加,2种氨基酸变化不显著。此外,盐胁迫下菌株胞内不同的氨基酸随时间变化趋势不同。菌株胞内5种氨基酸(脯氨酸、酪氨酸、丙氨酸、谷氨酸和瓜氨酸)在盐胁迫4 h和24 h后均显著高于无盐组。菌株胞内2种氨基酸(丝氨酸和天冬氨酸)在盐胁迫4 h后显著低于无盐组,但盐胁迫24 h后无显著性变化。菌株胞内组氨酸在盐胁迫4 h显著低于无盐组,但盐胁迫24 h后显著高于无盐组。菌株胞内鸟氨酸在盐胁迫4 h后无显著性变化,但盐胁迫24 h后显著高于无盐组。实验结果表明,除丝氨酸和天冬氨酸外,菌株JQ3在盐胁迫下胞内会积累其他7种氨基酸响应盐胁迫。
表1 盐胁迫下W.confusa JQ3胞内氨基酸的变化
Table 1 Changes of intracellular amino acids in W.confusa JQ3 under salt stress
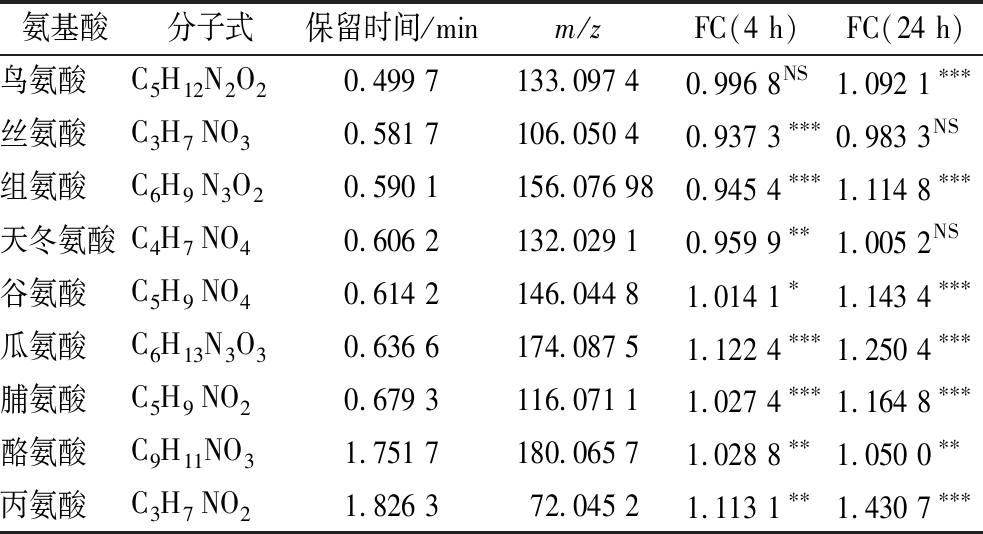
注:FC为差异倍数,即lg(盐胁迫峰面积)/lg(未胁迫峰面积);***表示P<0.001、**表示P<0.01、*表示P<0.05、NS表示P>0.05。
氨基酸分子式保留时间/minm/zFC(4 h)FC(24 h)鸟氨酸C5H12N2O20.499 7133.097 40.996 8NS1.092 1∗∗∗丝氨酸C3H7 NO30.581 7106.050 40.937 3∗∗∗0.983 3NS组氨酸C6H9 N3O20.590 1156.076 980.945 4∗∗∗1.114 8∗∗∗天冬氨酸C4H7 NO40.606 2132.029 10.959 9∗∗1.005 2NS谷氨酸C5H9 NO40.614 2146.044 81.014 1∗1.143 4∗∗∗瓜氨酸C6H13N3O30.636 6174.087 51.122 4∗∗∗1.250 4∗∗∗脯氨酸C5H9 NO20.679 3116.071 11.027 4∗∗∗1.164 8∗∗∗酪氨酸C9H11NO31.751 7180.065 71.028 8∗∗1.050 0∗∗丙氨酸C3H7 NO21.826 372.045 21.113 1∗∗1.430 7∗∗∗
顾頔[19]发现中度嗜盐菌细胞内常积累谷氨酸、丙氨酸、脯氨酸和精氨酸等相容性溶质,以在高渗条件下维持渗透平衡。王学良[20]发现,不耐盐菌株常转运甲硫氨酸、赖氨酸、组氨酸以及脯氨酸来缓解盐胁迫,且其转运顺序在不同时期存在差异。DEOP数据库中明确具有渗透保护作用的氨基酸有17种[21]。本实验检测的7种胞内积累氨基酸中,5种(脯氨酸、组氨酸、丙氨酸、谷氨酸和瓜氨酸)在DEOP数据库中明确具有渗透保护作用,但这些氨基酸是否对W.confusa具有渗透保护作用,迄今未见报道。下述实验将验证盐胁迫胞内积累的7种氨基酸对W.confusa JQ3在盐胁迫下的作用。
2.3 外源氨基酸对盐胁迫下W.confusa JQ3生长的影响
为探讨盐胁迫下胞内积累的氨基酸对菌株盐胁迫下生长的影响,通过外源添加以上氨基酸分析菌株在盐胁迫下菌体密度的变化,结果如图2所示。当盐胁迫4 h后,外源添加脯氨酸、谷氨酸和丙氨酸组的菌体密度显著高于未添加组。当盐胁迫24 h后,外源添加脯氨酸、谷氨酸、丙氨酸、鸟氨酸和组氨酸组的菌体密度显著高于未添加组。脯氨酸、谷氨酸和丙氨酸在2个时期均发挥作用;鸟氨酸和组氨酸仅在盐胁迫下24 h后发挥作用;瓜氨酸在2个时期均无作用。实验结果表明,外源添加脯氨酸、谷氨酸和丙氨酸均能促进菌株JQ3在盐胁迫下的生长,且脯氨酸的作用显著高于其他氨基酸。脯氨酸的渗透保护作用在其他微生物中也有报道,HE等[13]报道了T.halophilus在120 g/L NaCl胁迫下外源添加脯氨酸,菌体密度提高了34.6%。本实验中菌株JQ3在60 g/L NaCl胁迫下外源添加脯氨酸,菌体密度在盐胁迫4 h后提高了28.4%,在盐胁迫24 h后提高了29.3%,与文献报道的脯氨酸作用类似。下述实验将选择菌体密度提高最大的脯氨酸作为外源添加氨基酸,进一步研究脯氨酸对W.confusa的渗透保护作用。
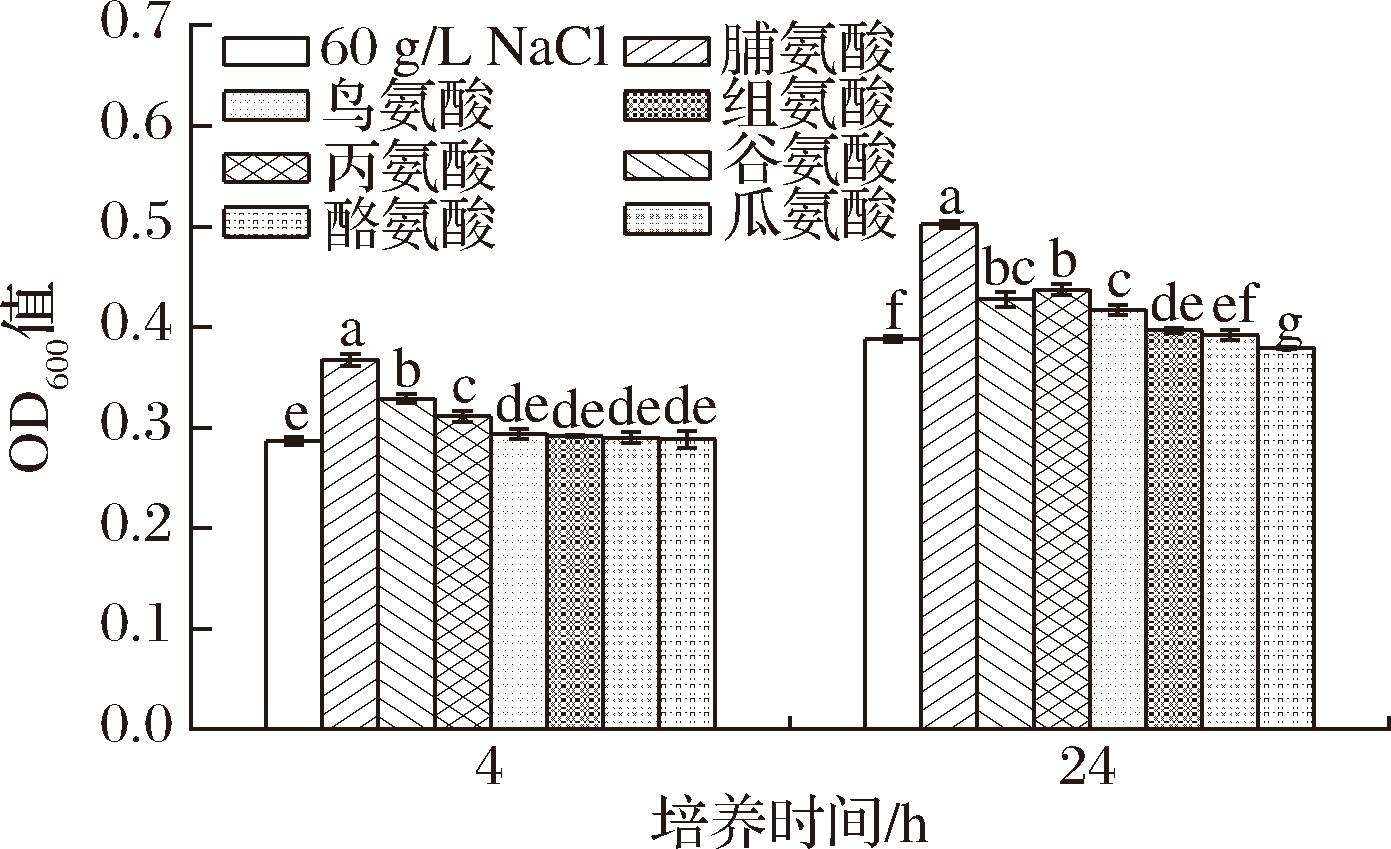
图2 不同外源氨基酸对盐胁迫下W.confusa JQ3生长的影响
Fig.2 Effect of different exogenous amino acids on the growth of W.confusa JQ3 under salt stress
注:相同时间下不同小写字母表示差异显著(P<0.05)(下同)。
根据上述实验结果,进一步研究了外源添加不同浓度的脯氨酸对菌株JQ3盐胁迫下生长的影响,结果如图3所示。如图3-A所示,外源添加8~40 mmol/L脯氨酸均能提高菌株盐胁迫下的菌体密度,但不同胁迫时间,脯氨酸的作用随浓度变化趋势不同。随着外源添加脯氨酸浓度的增加,菌体密度在盐胁迫4 h后先增加后降低;在盐胁迫24 h后先增加后保持不变。当脯氨酸添加浓度为16~32 mmol/L时,菌体密度在4和24 h均达到最大值。如图3-B所示,外源添加8~40 mmol/L脯氨酸均能提高菌株盐胁迫下的活菌数。当脯氨酸添加最小浓度为32 mmol/L时,活菌数在4和24 h均达到最大值。综合实验结果,确定外源添加脯氨酸浓度为32 mmol/L时,菌株JQ3在盐胁迫下菌体密度和活菌数提高最大。实验结果显示,当脯氨酸添加浓度为40 mmol/L时,相比于添加32 mmol/L,菌株培养4 h后菌体密度和活菌数均降低,但培养24 h后菌体密度和活菌数无差异。推测培养初期过多的外源氨基酸可能改变了培养基的渗透压等条件,对细胞产生氨基酸毒性,细胞活力反而下降[22]。随着培养时间的延长,微生物利用了部分脯氨酸,使得脯氨酸浓度降低,同时菌株可能会产生一些适应高浓度氨基酸的生存环境的蛋白等物质[23]。王阳等[24]发现,相比于不添加氨基酸的培养基,添加高浓度氨基酸的培养基中的菌体密度更低,说明高浓度氨基酸可能不利于细菌生长。钟凯等[25]认为植物在逆境胁迫下积累脯氨酸能够增强抗逆能力,但超过一定阈值后会表现出明显的毒害效应。与本研结果一致。
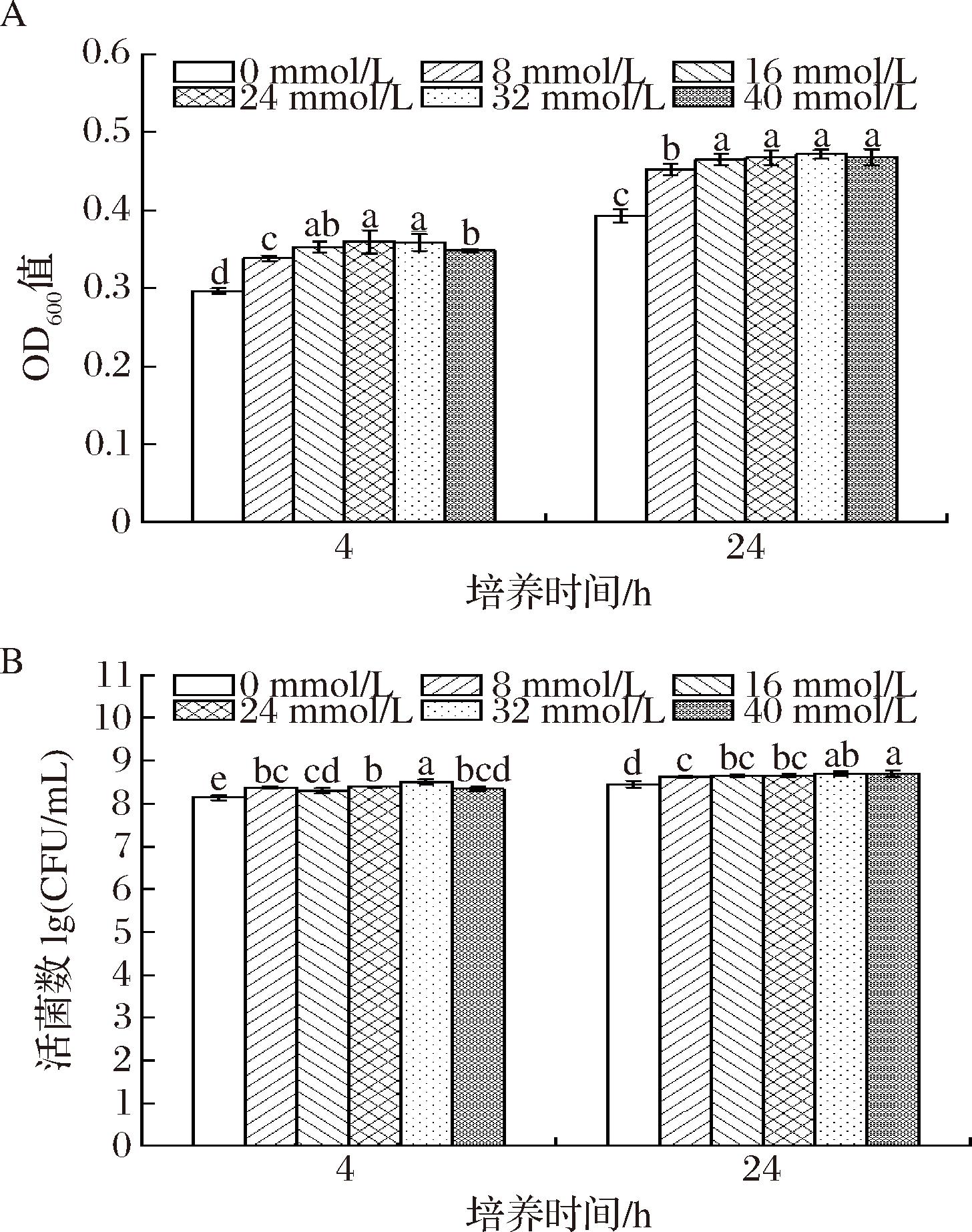
A-菌体密度;B-活菌数
图3 不同浓度脯氨酸对盐胁迫下W.confusa JQ3菌体密度和活菌数的影响
Fig.3 Effect of different concentrations of proline on OD600 nm and viable cell count of W.confusa JQ3 under salt stress
2.4 脯氨酸调控盐胁迫下W.confusa JQ3的生理响应
2.4.1 外源脯氨酸对盐胁迫下W.confusa JQ3细胞形态的影响
微生物的形态变化是响应环境胁迫的直观表现和重要适应策略[26],本实验通过扫描电子显微镜观察了盐胁迫下脯氨酸对菌株形态的影响,结果如图4所示。当菌株在正常条件下培养4 h和24 h后,细胞呈短杆状、端圆、形态饱满、表面光滑(图4-A),呈现出融合魏斯氏菌的典型形态特征[27]。当菌株在添加60 g/L NaCl条件下培养,盐胁迫4 h后的细胞表面平整度降低且少部分细胞出现破裂(图4-B),盐胁迫24 h后的细胞表面皱缩且变形严重(图4-B)。当菌株在添加60 g/L NaCl和脯氨酸条件下培养4 h后,细胞表面无破损且形态较饱满(图4-C),培养24 h后的细胞表面皱缩但变形程度较60 g/L NaCl组更轻(图4-C)。实验结果表明,盐胁迫会破坏W.confusa的细胞形态,外源添加脯氨酸能有效缓解盐胁迫对菌株细胞形态的影响。氨基酸类相容性溶质对盐胁迫细胞形态的影响在其他微生物中也有报道,SUN等[28]发现盐胁迫下德氏乳杆菌的生长迟缓且影响细胞的直径,但添加蛋氨酸、组氨酸和四氢嘧啶相容性溶质有助于盐胁迫下细菌细胞的直径和长度保持在正常值。

A-添加0 g/L NaCl条件下培养4 h和24 h;B-添加60 g/L NaCl条件下培养4 h和培养24 h;C-添加60 g/L NaCl和脯氨酸条件下培养4 h和24 h
图4 外源脯氨酸对盐胁迫下W.confusa JQ3细胞形态的影响
Fig.4 Effect of exogenous proline on the morphology of W.confusa JQ3 cells under salt stress
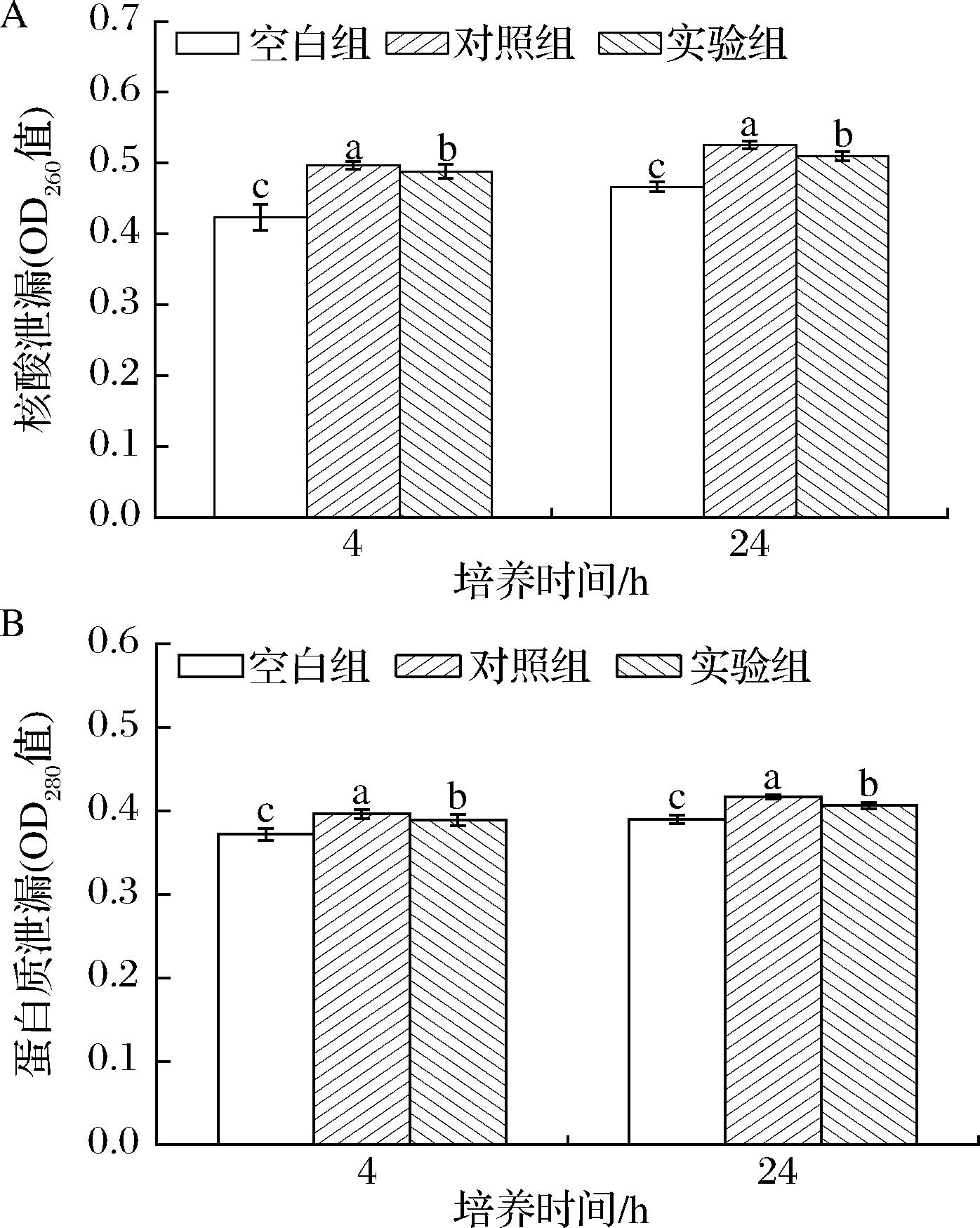
A-核酸泄漏量;B-蛋白泄漏量
图5 外源脯氨酸对盐胁迫下W.confusa JQ3细胞内核酸和蛋白质泄漏的影响
Fig.5 Effects of exogenous proline on nucleic acid leakage and protein leakage in W.confusa JQ3 under salt stress
注:空白组表示添加0 g/L NaCl组;对照组表示添加60 g/L NaCl组;实验组表示添加60 g/L NaCl和脯氨酸组
2.4.2 外源脯氨酸对盐胁迫下W.confusa JQ3细胞膜完整性的影响
细胞膜是将细胞与环境分开的第一道屏障,是环境压力造成损害的主要目标[29],细胞膜的完整性可通过监测细胞核酸和蛋白质的泄漏来评价[17]。如图5所示,菌株在添加60 g/L NaCl条件下培养,与0 g/L NaCl组相比,胁迫4和24 h后细胞外OD260和OD280值显著增加,表明盐胁迫下菌株的核酸和蛋白质泄漏量显著增加。当菌株在添加60 g/L NaCl和脯氨酸条件下培养,2个时期的细胞外OD260和OD280值均高于0 g/L NaCl组但低于60 g/L NaCl组,表明添加脯氨酸可降低盐胁迫下菌株核酸和蛋白质泄漏量。实验结果表明,盐胁迫对JQ3细胞膜完整性造成损伤,外源添加脯氨酸显著降低了JQ3在NaCl胁迫下细胞内容物的泄漏(P<0.05)。在盐胁迫下产生的细胞膜完整性损伤,以及外源添加相容性溶质减少细胞内容物泄露在其他微生物中也有报道。WANG等[30]发现Zygosaccharomyces rouxii在盐胁迫下,细胞完整性受到破坏,细胞壁破裂,导致细胞内物质溢出;WU等[31]发现外源添加抗氧化二肽显著减轻了酵母细胞内内容物的泄漏,其中添加苯丙氨酸-半胱氨酸后胞内核酸和蛋白质的泄漏量分别减少了2.86%和5.36%。
2.4.3 外源脯氨酸对盐胁迫下W.confusa JQ3胞内Na+/K+动态平衡的影响
NaCl对细胞的破坏作用主要是导致胞内的离子失衡,而微生物钠、钾等离子的转运调控有助于维持胞内外的渗透压平衡,对微生物在盐胁迫下的生存极为重要[32]。本研究对盐胁迫下添加或不添加脯氨酸胞内Na+、K+含量进行测定,结果如图6所示。盐胁迫下,Na+/K+值随着菌株培养时间的延长呈上升趋势。与对照组相比,培养4 h时添加脯氨酸组胞内Na+/K+值下降了43.78%,培养24 h时添加脯氨酸组胞内Na+/K+值下降了60.90%。实验结果表明,盐胁迫时间越长,细胞内离子失衡越严重,对细胞的破坏作用更大;而外源添加脯氨酸增强了细胞膜上离子通道的调节作用,有利于Na+的外排同时向胞内转入更多K+,维持细胞内外渗透压平衡,且脯氨酸的作用随着培养时间的延长而显著。鲁克嵩等[33]研究发现盐胁迫下油菜体内Na+/K+值升高,施用0.5 mmol/L外源脯氨酸能够有效降低Na+/K+值,减轻油菜受到盐胁迫引发的离子胁迫,与本研究结果一致。
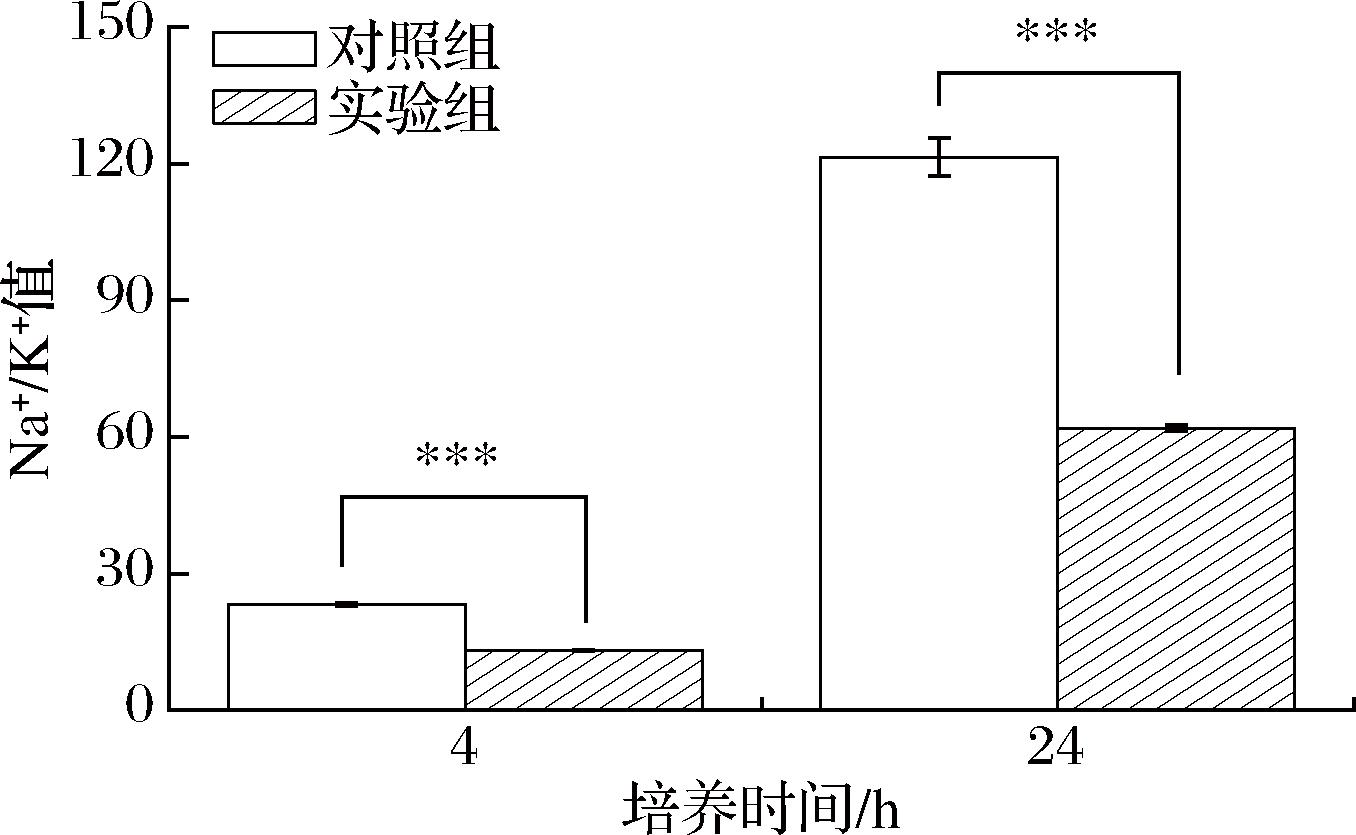
图6 外源脯氨酸对盐胁迫下W.confusa JQ3胞内Na+/K+动态平衡的影响
Fig.6 Effect of exogenous proline on intracellular Na+/K+ dynamic balance of W.confusa JQ3 under salt stress
注:对照组表示添加60 g/L NaCl组;实验组表示添加60 g/L NaCl和脯氨酸组;![]() 表示同一时间不同组别之间的显著性差异情况(***:P<0.001)。
表示同一时间不同组别之间的显著性差异情况(***:P<0.001)。
3 结论与展望
本论文以实验室前期筛选的W.confusa JQ3为研究对象,发现菌株能在0~90 g/L NaCl质量浓度下存活,且当盐质量浓度为60 g/L时,活菌数达到最大值后存活时间较未经盐胁迫的菌株更长。通过高效液相色谱-质谱分析盐胁迫与非胁迫下菌株胞内氨基酸发现,盐胁迫下JQ3会在胞内积累脯氨酸、酪氨酸、丙氨酸、谷氨酸、瓜氨酸、鸟氨酸和组氨酸7种氨基酸响应盐胁迫。当外源添加这些氨基酸时,脯氨酸提高盐胁迫下菌体密度的作用显著高于其他氨基酸;且外源添加脯氨酸的最佳浓度为32 mmol/L。当外源添加脯氨酸后,盐胁迫下的W.confusa JQ3产生了相关生理响应变化,包括:减轻了细胞表面皱缩和变形程度,缓解了细胞形态变化;减少了核酸和蛋白质的泄露,维持了细胞膜完整性;调控了Na+、K+的浓度,维持了细胞内外渗透压平衡。氨基酸可维持细胞结构的完整性、抵御各种环境胁迫对细胞造成的损害,是微生物在胁迫条件下自我调节的一个重要标志[34]。本文通过研究氨基酸对盐胁迫下W.confusa JQ3生长的影响,明确了脯氨酸调控菌株适应高盐胁迫的生理响应,后续也可以通过基因组学、转录组学以及多组学联用的方法研究相关功能基因及机制,阐明氨基酸介导的菌株抗高盐胁迫的分子机制,为深入解析W.confusa耐盐的调控机制提供科学依据,促进W.confusa在高盐发酵食品的有效应用。
[1] 严鑫, 艾连中, 夏永军, 等.融合魏斯氏菌安全性、益生潜力及功能特性研究进展[J].工业微生物, 2022, 52(6):37-48.YAN X, AI L Z, XIA Y J, et al.Research progress of safety probiotic potential and functional properties of Weissella confusa[J].Industrial Microbiology, 2022, 52(6):37-48.
[2] FUSCO V, QUERO G M, CHO G S, et al.The genus Weissella:Taxonomy, ecology and biotechnological potential[J].Frontiers in Microbiology, 2015, 6:155.
[3] 李巧玉, 方芳, 堵国成, 等.魏斯氏菌在发酵食品中的应用[J].食品与发酵工业, 2017, 43(10):241-247.LI Q Y, FANG F, DU G C, et al.The application of Weissella strains in fermented food[J].Food and Fermentation Industries, 2017, 43(10):241-247.
[4] 蒋雪薇, 高兴彪, 张旭旭, 等.盐胁迫下微生物在发酵食品中耐盐及促发酵机制研究进展[J].食品与机械, 2024, 40(6):1-10.JIANG X W, GAO X B, ZHANG X X, et al.Advances in salt tolerance and fermentation promotion mechanism of microorganisms in fermented foods under salt stress[J].Food &Machinery, 2024, 40(6):1-10.
[5] 林松洋, 郝利民, 刘鑫, 等.乳酸菌耐盐分子机制研究进展[J].食品科学, 2018, 39(3):295-301.LIN S Y, HAO L M, LIU X, et al.Progress in molecular mechanism of salt tolerance in lactic acid bacteria[J].Food Science, 2018, 39(3):295-301.
[6] 陈卫, 赵山山, 张秋香.乳酸菌的耐盐机制[J].中国食品学报, 2013, 13(10):1-7.CHEN W, ZHAO S S, ZHANG Q X.The mechanism of LAB to salt stress[J].Journal of Chinese Institute of Food Science and Technology, 2013, 13(10):1-7.
[7] KUMAR S, PAUL D, BHUSHAN B, et al.Traversing the “Omic” landscape of microbial halotolerance for key molecular processes and new insights[J].Critical Reviews in Microbiology, 2020, 46(6):631-653.
[8] 曲宜, 韩雪, 张兰威, 等.微生物积累及转运的相容性溶质种类的研究进展[J].食品科技, 2012, 37(11):27-30;34.QU Y, HAN X, ZHANG L W, et al.Progress on the variety of compatible solutes accumulated or transported in microorganisms[J].Food Science and Technology, 2012, 37(11):27-30;34.
[9] EDBEIB M F, WAHAB R A, HUYOP F.Halophiles:biology, adaptation, and their role in decontamination of hypersaline environments[J].World Journal of Microbiology &Biotechnology, 2016, 32(8):135.
[10] ZHANG Y, MAO B Y, TANG X, et al.Integrative genome and metabolome analysis reveal the potential mechanism of osmotic stress tolerance in Bifidobacterium bifidum[J].LWT, 2022, 159:113199.
[11] 王海娟, 韩雪, 马微, 等.高渗条件下相容性溶质对乳酸杆菌的作用[J].食品科技, 2015, 40(3):16-19.WANG H J, HAN X, MA W, et al.Effect of compatible solutes under hypertonic conditions on the Lactobacillus[J].Food Science and Technology, 2015, 40(3):16-19.
[12] 潘子怡. 耐高渗青春双歧杆菌和两歧双歧杆菌的筛选及生产工艺研究[D].无锡:江南大学, 2023.PAN Z Y. Screening and production technology of hypertonic resistant Bifidobacterium adolescentis and Bifidobacterium bifidum[D]. Wuxi: Jiangnan University, 2023.
[13] HE G Q, WU C D, HUNAG J, et al.Effect of exogenous proline on metabolic response of Tetragenococcus halophilus under salt stress[J].Journal of Microbiology and Biotechnology, 2017, 27(9):1681-1691.
[14] ZAMFIR M, GROSU-TUDOR S S.Stress response of some lactic acid bacteria isolated from Romanian artisan dairy products[J].World Journal of Microbiology &Biotechnology, 2014, 30(2):375-384.
[15] 钟先锋, 晏雅馨, 黄桂东, 等.一株能降解亚硝酸盐的耐高盐酱曲源融合魏斯氏菌JQ3及其应用:中国, CN202211359190.7[P]. 2023-03-24.ZHONG X F, YAN Y X, HUANG G D, et al.A strain of high salt-tolerant sauce koji source Weissella confusa JQ3 capable of degrading nitrite and its application:China, CN202211359190.7[P]. 2023-03-24.
[16] WANG A L, DU Q Q, LI X M, et al.Intracellular and extracellular metabolic response of the lactic acid bacterium Weissella confusa under salt stress[J].Metabolites, 2024, 14(12):695.
[17] MERGHNI A, BELMAMOUN A R, URCAN A C, et al.1,8-Cineol (Eucalyptol) disrupts membrane integrity and induces oxidative stress in methicillin-resistant Staphylococcus aureus[J].Antioxidants, 2023, 12(7):1388.
[18] ZHANG G J, LIU M, LIU R M, et al.Inhibition of streptococcus mutans biofilm formation and virulence by Lactobacillus plantarum K41 isolated from traditional Sichuan pickles[J].Frontiers in Microbiology, 2020, 11:774.
[19] 顾頔. 中度嗜盐菌Brachybacterium muris生物学特性、盐胁迫应答的相容性溶质分子鉴定及其作用机制研究[D].杭州:浙江大学, 2021.GU Y.Elucidation of the biological characteristics, molecular identification of compatible solutes and its mechanism in response to salt stress from moderately halophilic bacteria Brachybacterium muris[D].Hangzhou:Zhejiang University, 2021.
[20] 王学良. 相容性溶质对L.bulgaricus 3的渗透保护作用及其对细胞膜影响研究[D].哈尔滨:哈尔滨工业大学, 2015.WANG X L.Study on osmotic protection of compatible solute to L.bulgaricus 3 and the research of its effect on cell membrane[D].Harbin:Harbin Institute of Technology, 2015.
[21] SALIM B, ALEKSANDAR R, MAGBUBAH E, et al.DEOP:a database on osmoprotectants and associated pathways[J].Database:The Journal of Biological Databases and Curation, 2014, 2014(0):bau100.
[22] GANDHI A, SHAH N P.Effect of salt stress on morphology and membrane composition of Lactobacillus acidophilus, Lactobacillus casei, and Bifidobacterium bifidum, and their adhesion to human intestinal epithelial-like Caco-2 cells[J].Journal of Dairy Science, 2016, 99(4):2594-2605.
[23] 王立娜. 氨基酸与STAT5A基因互作对奶牛乳腺上皮细胞泌乳的调节作用及机理[D].哈尔滨:东北农业大学, 2014.WANG L N. Regulation of interaction between amino acids and STAT5A gene on lactation of mammary epithelial cells in dairy cows and its mechanism[D]. Harbin: Northeast Agricultural University, 2014.
[24] 王阳. 大肠杆菌5-氨基乙酰丙酸合成途径的改造及其对菌体代谢影响的初步研究[D]. 济南: 山东大学, 2012.WANG Y. Modification of the synthetic pathway of 5- aminolevulinic acid in Escherichia coli and its effect on bacterial metabolism[D]. Jinan: Shandong University, 2012.
[25] 钟凯, 何庆华, 吴永宁.乳酸菌ATCC367菌株在不同培养条件下的生长特性差异[J].中国食品卫生杂志, 2009, 21(3):225-228.ZHONG K, HE Q H, WU Y N.Characteristics of Lactobacillus brevis (ATCC367) in different media[J].Chinese Journal of Food Hygiene, 2009, 21(3):225-228.
[26] 张林, 陈翔, 吴宇, 等.脯氨酸在植物抗逆中的研究进展[J].江汉大学学报(自然科学版), 2023, 51(1):42-51.ZHANG L, CHEN X, WU Y, et al.Research progress of proline in plant stress resistance[J].Journal of Jianghan University (Natural Science Edition), 2023, 51(1):42-51.
[27] COLLINS M D, SAMELIS J, METAXOPOULOS J, et al.Taxonomic studies on some Leuconostoc-like organisms from fermented sausages:Description of a new genus Weissella for the Leuconostoc paramesenteroides group of species[J].The Journal of Applied Bacteriology, 1993, 75(6):595-603.
[28] SUN J.L, HAN X, WANG Y, et al.The effect of compatible solutes on the cell membrane of Lactobacillus delbrueckii subsp.bulgaricus 3[J].Microbiology, 2023, 92(3):379-388.
[29] 年洪娟, 陈丽梅.不饱和脂肪酸在逆境胁迫中的作用[J].中国微生态学杂志, 2012, 24(8):760-762.NIAN H J, CHEN L M.The role of unsaturated fatty acids in various environmental stresses[J].Chinese Journal of Microecology, 2012, 24(8):760-762.
[30] WANG D K, ZHANG M, HUANG J, et al.Zygosaccharomyces rouxii combats salt stress by maintaining cell membrane structure and functionality[J].Journal of Microbiology and Biotechnology, 2020, 30(1):62-70.
[31] WU C Y, ZHANG H X, YANG N N, et al.Antioxidant dipeptides enhance osmotic stress tolerance by regulating the yeast cell wall and membrane[J].Journal of Agricultural and Food Chemistry, 2024, 72(8):4339-4347.
[32] 马欣, 马想蓉, 朱德锐, 等.嗜盐耐盐微生物抗盐胁迫相关离子转运蛋白研究进展[J].微生物学报, 2024, 64(3):651-671.MA X, MA X R, ZHU D R, et al.Advances in ion transporters associated with tolerance of halophilic and halotolerant microorganisms to salt stress[J].Acta Microbiologica Sinica, 2024, 64(3):651-671.
[33] 鲁克嵩, 闫磊, 侯佳玉, 等.盐胁迫下外源脯氨酸对油菜Na+/K+平衡、生长及抗氧化系统的影响[J].华中农业大学学报, 2023, 42(5):141-148.LU K S, YAN L, HOU J Y, et al.Effects of exogenous proline on Na+/K+ balance, growth and antioxidant system of rapeseed under salt stress[J].Journal of Huazhong Agricultural University, 2023, 42(5):141-148.
[34] 郭欣然, 田缘, 孔保华, 等.发酵食品中微生物交叉保护策略及其作用机制研究进展[J].食品科学, 2024, 45(18):232-241.GUO X R, TIAN Y, KONG B H, et al.Research progress on microorganism cross-protection strategies and underlying mechanisms in fermented foods[J].Food Science, 2024, 45(18):232-241.