人体口腔内栖息着700多种微生物,是人体中仅次于胃肠道的第二复杂微生物群落栖息地。牙龈卟啉单胞菌(Porphyromonas gingivalis,Pg)是一种革兰氏阴性厌氧菌、是慢性牙周炎的关键致病菌[1]。除在口腔中发挥重要作用外,多项研究证明,Pg还通过唾液、血液等途径迁移到肠道等器官,促进炎症性肠病(inflammatory bowel diseases,IBD)、结直肠癌、动脉粥样硬化、非酒精性脂肪肝等全身性疾病相关[2-3]。相关研究报道了胃肠道疾病的发病机制存在“口肠轴”,尽管它在口腔中具有致病性,并且有可能通过唾液迁移到肠道,但目前关于Pg与肠道炎症间的研究仍然非常有限。肠道炎症的发病机制涉及多种因素的复杂相互作用,包括适应性免疫失调、肠道屏障破坏和肠道菌群失衡。CD4+T淋巴细胞被认为在IBD的发病机制中起着至关重要的作用。典型的口腔常驻细菌,如梭杆菌科和克雷伯氏菌属能够诱导反应性CD4+T细胞(Th1,Th17,Treg等)在肠黏膜中积累,进而在疾病的发病机制中参与作用[4]。其中,Th17和Treg细胞的平衡在全身性系统疾病中都发挥一定的作用[5-6]。此外,肠道菌群紊乱可能会引起肠道上皮黏液层的改变,从而损坏肠道屏障,而肠道屏障完整性的破坏和肠道菌群的失调可能会进一步加剧病原菌的异位定植,最终导致炎症和全身感染[7]。因此,Pg是否会通过“口肠轴”破坏宿主肠道菌群的平衡,并引起宿主的免疫反应和损害肠道屏障的完整性来加剧肠道炎症,其潜在作用机制及有效的干预策略需要进一步探索。果胶是天然存在的阴离子杂多糖聚合物,富含聚半乳糖醛酸[8]。果胶作为一种不可消化的碳水化合物,其在人类胃肠道中的降解是由人体肠道中小部分微生物群落介导的,且越来越被认可在肠道炎症、免疫调节和药物/营养素相互作用中发挥着重要作用[9]。
因此,本研究使用Pg灌胃葡聚糖硫酸钠(dextran sodium sulphate,DSS)诱导的结肠炎小鼠,并使用果胶进行干预治疗,检测小鼠结肠炎病理指标、脾脏免疫细胞和血清炎症因子水平的改变,分析肠道菌群的变化,为口腔细菌易位定植及相关疾病进展的预防提供参考。
1 材料与方法
1.1 材料与试剂
8周龄雌性C57BL/6 J小鼠,体重(18.0±0.2) g,SPF级,购于湖南斯莱克景达实验动物有限公司,资格证号为SCXK(XIANG)2019-0004。
果胶,CP Kelco(LM-102AS);牙龈卟啉单胞菌W83(Pg W83),广东省菌种保藏中心;DSS,MP biomedicals;4%多聚甲醛固定液,武汉塞维尔生物科技有限公司;白细胞介素-6(IL-6)、IL-17A试剂盒及流式细胞术抗体,赛默飞世尔科技;DNA提取试剂盒,天根生化科技(北京)有限公司。
1.2 仪器与设备
YXQ-100A立式压力蒸汽灭菌锅,上海博迅医疗生物仪器有限公司;Victor Nivo多功能酶标仪,PE Ensight;NL-CLC流式细胞仪,Cytek;NanoDrop ONE超微量核算蛋白测定仪,赛默飞世尔科技。
1.3 实验方法
1.3.1 果胶预处理
购买的果胶参照文献报道方法进行处理,采用透析袋进行透析,截留分子质量为8 000~14 000 Da,并在使用前冷冻干燥,以去除蔗糖等杂质[10]。
1.3.2 动物实验设计
小鼠饲养于单独通气笼系统(individually ventilated cage system,IVC)系统,给予正常饮食饮水,保持饲养环境稳定的温度[(22±2) ℃]和湿度[(50±5)%]环境,执行正常昼夜交替周期(12 h昼、12 h夜)。适应性喂养1周后,将小鼠随机分为3组,模型组、Pg处理组、果胶治疗组,每组5只小鼠。使用2% DSS构建小鼠结肠炎模型[11],灌胃1×108CFU Pg菌液[1]和200 mg/kg果胶[10],对照处理给予对应体积的PBS或纯净水,实验方案如表1所示。
表1 实验设计方案
Table 1 Experimental design scheme

分组1~7 d8~14 d模型组2% DSS;PBS;纯净水PBS纯净水Pg处理组2% DSS;Pg菌液,1×108CFU/只;纯净水Pg菌液,1×108CFU/只纯净水果胶治疗组2% DSS;Pg菌液,1×108CFU/只;200 mg/kg果胶Pg菌液,1×108CFU/只200 mg/kg果胶
实验期间每天记录小鼠体重、采食量和分辨情况。实验结束后采集小鼠脾脏、血清、粪便等样本进行检测。
1.3.3 小鼠基础指标的测定
每天上午记录小鼠体重,每隔3 d记录1次小鼠采食量。
解剖后,取出结肠和盲肠,小心拉直结肠,在自然状态下测量从盲肠到肛门的长度,然后收集肠道组织和肠内容物。
取出小鼠脾脏并称重,将脾脏质量(mg)除以小鼠体重(g),再乘以系数10,得到脾脏指数[12]。
根据文献报道及疾病活动指数(disease activity index,DAI)评分标准[13],如表2所示,对小鼠体重变化、粪便形态、粪便出血情况行评分,DAI指数为3项指标的平均分。
表2 IBD 疾病活动指数评分表
Table 2 The disease activity index

评分体重降低/%粪便形态便血0<1 正常 无便血 11~5 25~10 轻微便稀肉眼可见便上有血310~204>20 液态粪便大量出血
1.3.4 结肠组织结构分析
采用苏木精-伊红染色(hematoxylin and eosin staining,H&E)分析小鼠结肠组织结构。截取近端结肠0.5~1 cm,并将新鲜结肠组织放在4%多聚甲醛中固定,然后将结肠组织在不同浓度的酒精(75%、80%、90%、95%、100%)中进行梯度脱水,接着放入二甲苯中进行清洗。随后将处理的组织用石蜡浸润并包埋成块。根据标准程序切割4 μm厚的肠切片并通过H&E染色。最后,使用光学显微镜在适当的放大倍数下观察染色后的组织切片,评估组织的病理学特征。结肠组织病理损伤主要关注炎性细胞浸润情况、上皮变化和整体黏膜结构3个类别[14-15]。
1.3.5 小鼠血清细胞因子检测
使用酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)试剂盒根据制造商的说明测量小鼠血清IL-6和IL-17A水平。
小鼠血清前处理:将全血收集在带盖的试管中。收集全血后,将其置于室温下待血清析出,随后在冷冻离心机中以2 000×g离心10 min以去除凝块,所得上清液即为血清,立即使用移液器将血清转移到干净的聚丙烯管中。处理时将样品保持在2~8 ℃,根据说明测定血清中IL-6和IL-17A水平。
1.3.6 脾脏免疫细胞检测
1.3.6.1 小鼠脾细胞分离
取新鲜的小鼠脾脏,置于RPMI 1640培养基中,放在冰上暂存。用磨砂玻片研磨脾脏,并通过70 μm细胞过滤器过滤,收集滤液到15 mL离心管。1 500 r/min离心8 min,弃上清液,得到红色细胞沉淀。加2 mL 1×红细胞裂解液,轻柔吹打细胞使其重悬并混匀,室温下摇晃裂解2~3 min,再加5 mL RPMI 1640培养基,终止裂解反应;1 500 r/min离心8 min,弃上清液,得到白色细胞沉淀,用含有10%胎牛血清的RPMI 1640培养基重悬细胞,并做细胞计数,调整细胞浓度为1×107/mL。
1.3.6.2 细胞固定破膜与染色
细胞用刺激剂刺激16 h后,进行染色操作。每个样本即一个待检样本,此外每个样本取适量混匀,分成空白对照组、全染组及单染组。其中空白对照组不加任何抗体染色,全染组进行所有抗体染色,单染组进行相对应的抗体染色,其他处理与待检样本一致。
具体流程参考文献报道[16]并进行优化,操作如下:
a)细胞活死染色:取100 μL小鼠脾脏细胞(1×106个细胞),置于1.5 mL离心管内,加入活死抗体fixable viability stain,4 ℃孵育30 min;
b)胞外染色:孵育完毕后,加入PBS清洗,随后加入CD4抗体和CD25抗体混匀,4 ℃反应30 min;
c)固定破膜:清洗细胞后,加入1 mL稀释后的固定剂,涡旋混匀,4 ℃反应30 min;再加入1 mL破膜剂,涡旋混匀,弃上清液;
d)胞内染色:清洗细胞后,加入IL-17A抗体和Foxp3抗体,混匀后室温孵育30 min;清洗细胞,随后加入300 μL PBS,充分重悬细胞,即可上机检测。
1.3.7 小鼠肠道细菌检测
参考文献报道[17],采用磁珠法DNA提取试剂盒(DP712)从粪便样本中提取基因组DNA,具体实验步骤参照试剂盒说明书进行。用超微量核酸定量仪Nanodrop初步评估DNA浓度和质量,稀释后进行测序分析。选择细菌16S rDNA的V4区域使用Illumina MiSeq测序进行分析,测序由北京诺禾致源科技股份有限公司完成:使用Illumina公司的TruSeq® DNA PCR-Free Library Preparation Kit构建测序文库,并添加了索引代码,使用Qubit定量和评估文库质量。在Illumina NovaSeq平台进行测序。使用QIIME2工具对16S rDNA扩增子测序原始数据进行处理分析,经Deblur算法得到高质量的扩增子序列变体(amplicon sequence variants,ASVs)序列数据。计算样品的Alpha多样性和Beta多样性,以比较样品间和组间的多样性。
1.3.8 数据处理与统计分析
所有实验结果用“平均值±标准差”表示,每组各有5个样本(n=5)。采用GraphPad Prism 9.0.0(GraphPad Software,Inc,La Jolla,CA,USA)进行统计分析,样本间比较采用单因素方差分析(one-way ANOVA)和多重比较检验,P<0.05表示统计学上的差异显著。
2 结果与分析
2.1 小鼠结肠炎指标变化
结肠炎小鼠通常表现为明显的体重减轻、结肠长度缩短以及大便出血等基础结肠病理症状[18-19]。如图1所示,对DSS结肠炎小鼠进行Pg处理的第5天表现出体重减轻,并持续至造模结束后4 d,小鼠采食量在第6天后降低且持续下降,结肠长度缩短了18%。同时,小鼠从给予DSS的第4天开始出现软便和隐血,第7天时粪便呈液态,且大量便血,DAI指数显著上升。脾脏指数通常用于初步评估免疫情况,因为本研究计算了小鼠脾脏指数。与模型组相比,处理组小鼠的脾脏指数没有显著变化。果胶被报道具有调节肠道稳态调节功能,因此对Pg加剧的肠道炎症小鼠进行果胶治疗。如图1所示,果胶治疗缓解了小鼠体重损失,与处理组相比,结肠长度增加了19%,采食量维持基本稳定,DAI值极显著下降,脾脏指数无显著差异。综上,因此,Pg显著加剧DSS诱导的结肠炎,而果胶治疗可有效缓解相关病理症状。
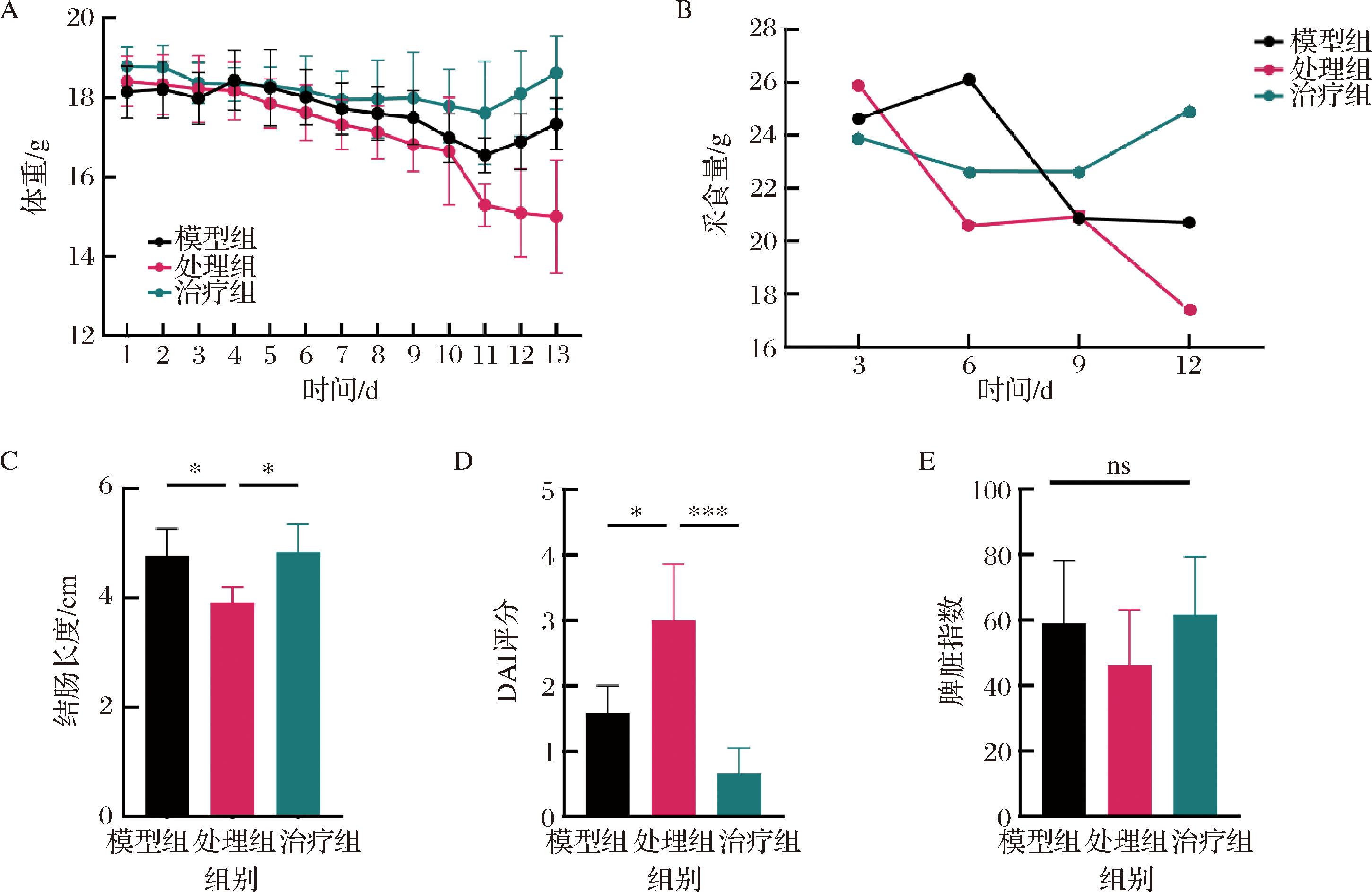
A-体重;B-采食量;C-结肠长度;D-DAI评分;E-脾脏指数
图1 小鼠结肠炎指标变化
Fig.1 Changes in colitis indicators in mice
注:*表示P<0.05,***表示P<0.001(下同)。
2.2 小鼠结肠组织病理学影响
为了进一步评估对结肠的影响,本研究使用H&E染色评估小鼠的结肠组织结构。图2展示了不同组别小鼠结肠组织的H&E染色结果。在模型组中,结肠组织固有层的绒毛状结构保持较完整,隐窝结构清晰可辨,杯状细胞数量丰富,仅有少量的炎性细胞浸润。在Pg处理组中,小鼠结肠组织表现出更严重的组织损伤,黏膜糜烂、隐窝破坏和炎症细胞浸润严重,杯状细胞大量丢失,甚至不具备完整的组织形态。而经果胶治疗后,组织病理学损伤显著减小,组织结构相对完整,且杯状细胞数量明显更多。这些发现表明,Pg能促使肠道屏障更严重的病变,果胶治疗可有效缓解被破坏的组织形态。
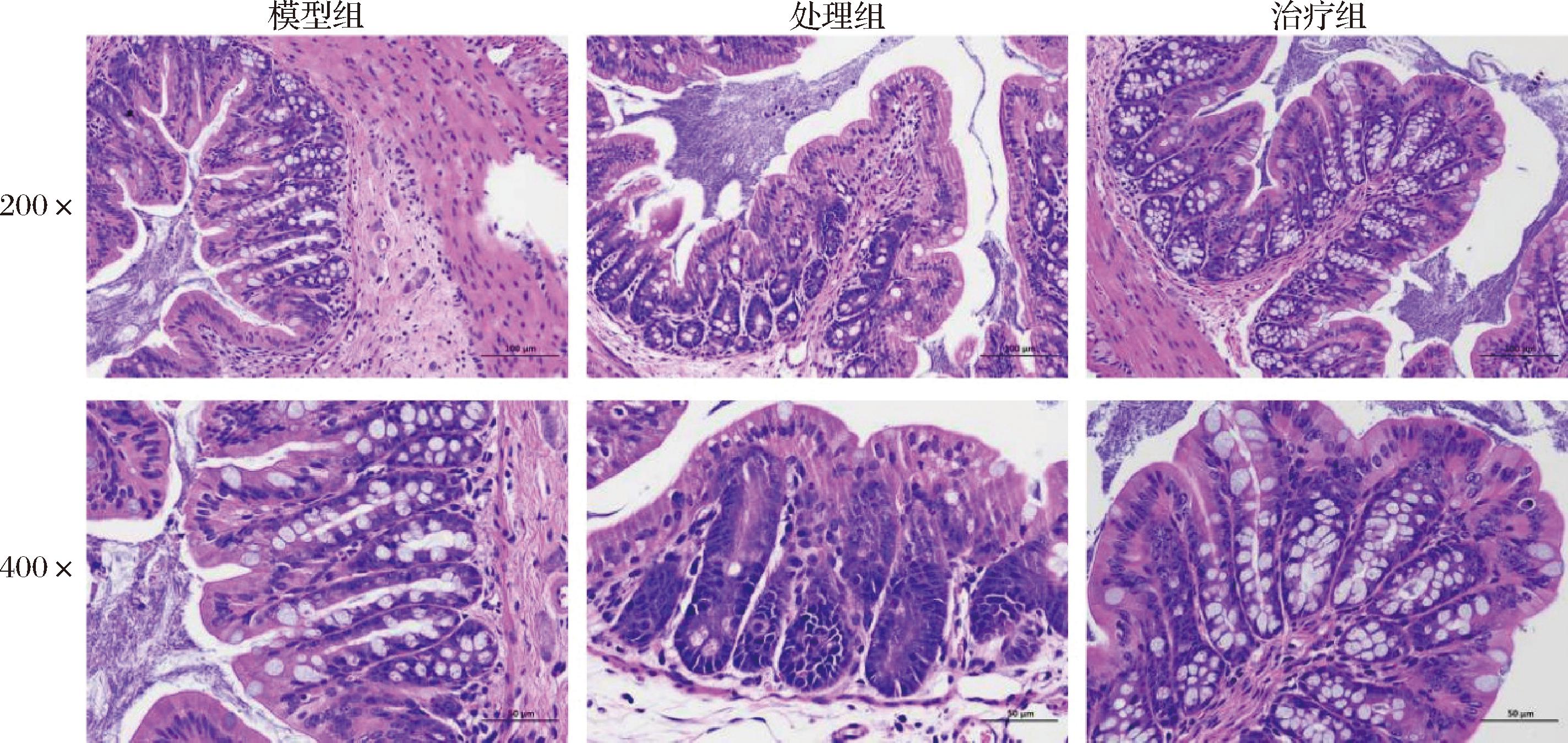
图2 小鼠结肠组织HE染色图
Fig.2 HE staining of mouse colon tissue
2.3 小鼠脾脏T免疫细胞的变化
越来越多的研究证实,Th17/Treg细胞介导的免疫应答与肠道炎症疾病发病机制密切相关。Th17细胞具有促炎作用,可通过分泌促炎相关细胞因子IL-17、IL-21、IL-22和TNF-α将单核细胞和中性粒细胞募集到炎症部位[20]。Treg细胞具有免疫抑制功能,其特征在于产生抗炎相关细胞因子IL-10和TGF-β[21]。在正常生理条件下,这些细胞处于稳态状态,以维持免疫系统的稳定性。在病理条件下,这种平衡被破坏,T细胞分化为Th17细胞的比例增加,从而引发一系列炎症反应。因此,本研究使用流式细胞术评估小鼠脾脏细胞的Th17和Treg细胞比例的变化。图3-A展示了Th17和Treg细胞亚群分群。与模型组相比,各组间Treg细胞比例没有显著差异(图3-B)。值得注意的是,Pg处理后Th17细胞比例显著增加;而果胶治疗后,Th17细胞数量较Pg组呈现减少的趋势,虽然该趋势在统计学上不具备显著意义(图3-C)。类似地,Th17/Treg细胞比率在3组间无显著性差异,但在其比值在Pg组升高,在果胶组降低(图3-D)。
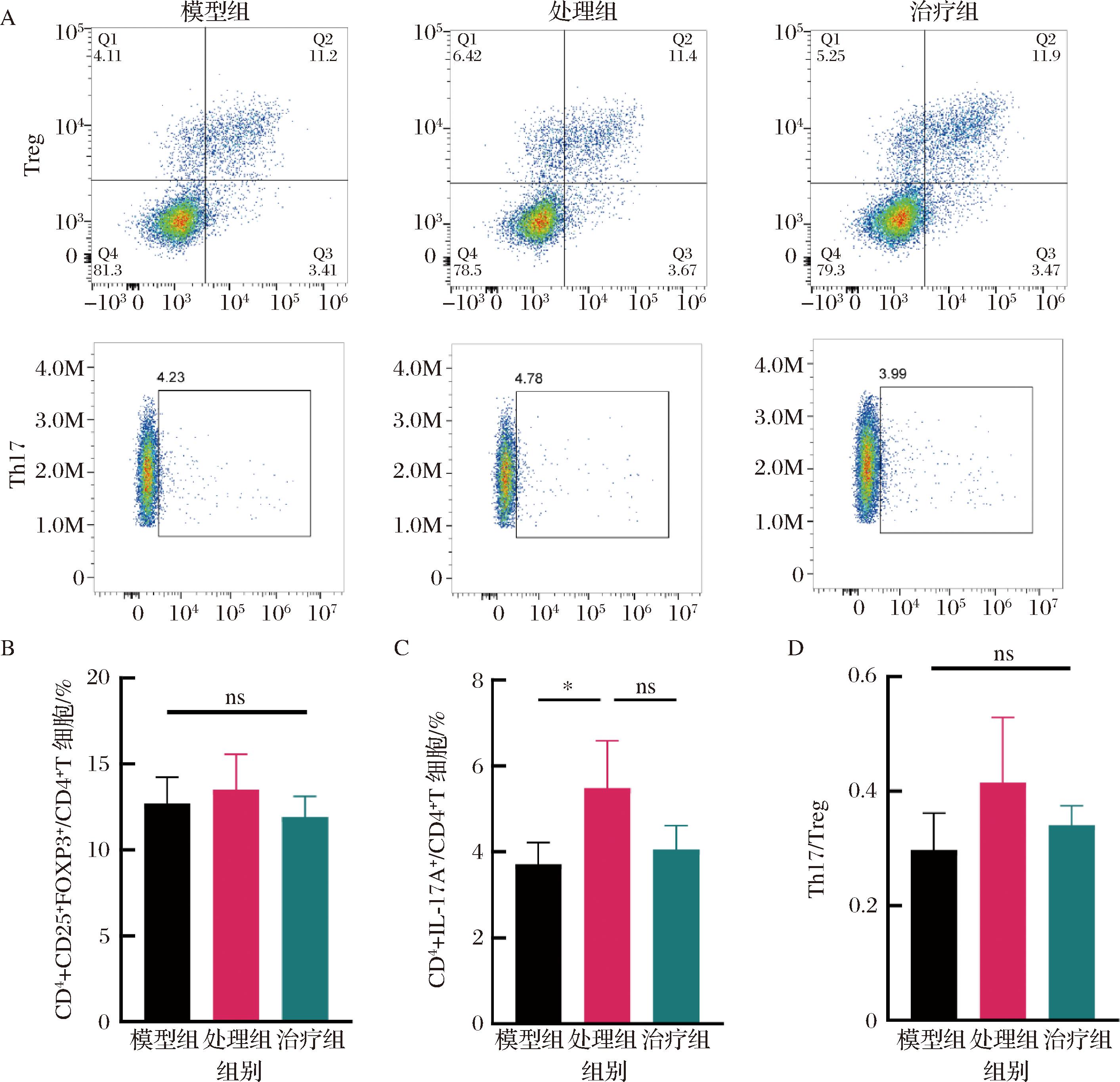
A-脾脏T细胞亚群分型图;B-Th17细胞比例;C-Treg细胞比例;D-Th17/Treg细胞比率
图3 小鼠脾脏T细胞变化
Fig.3 Changes of mouse spleen T cells
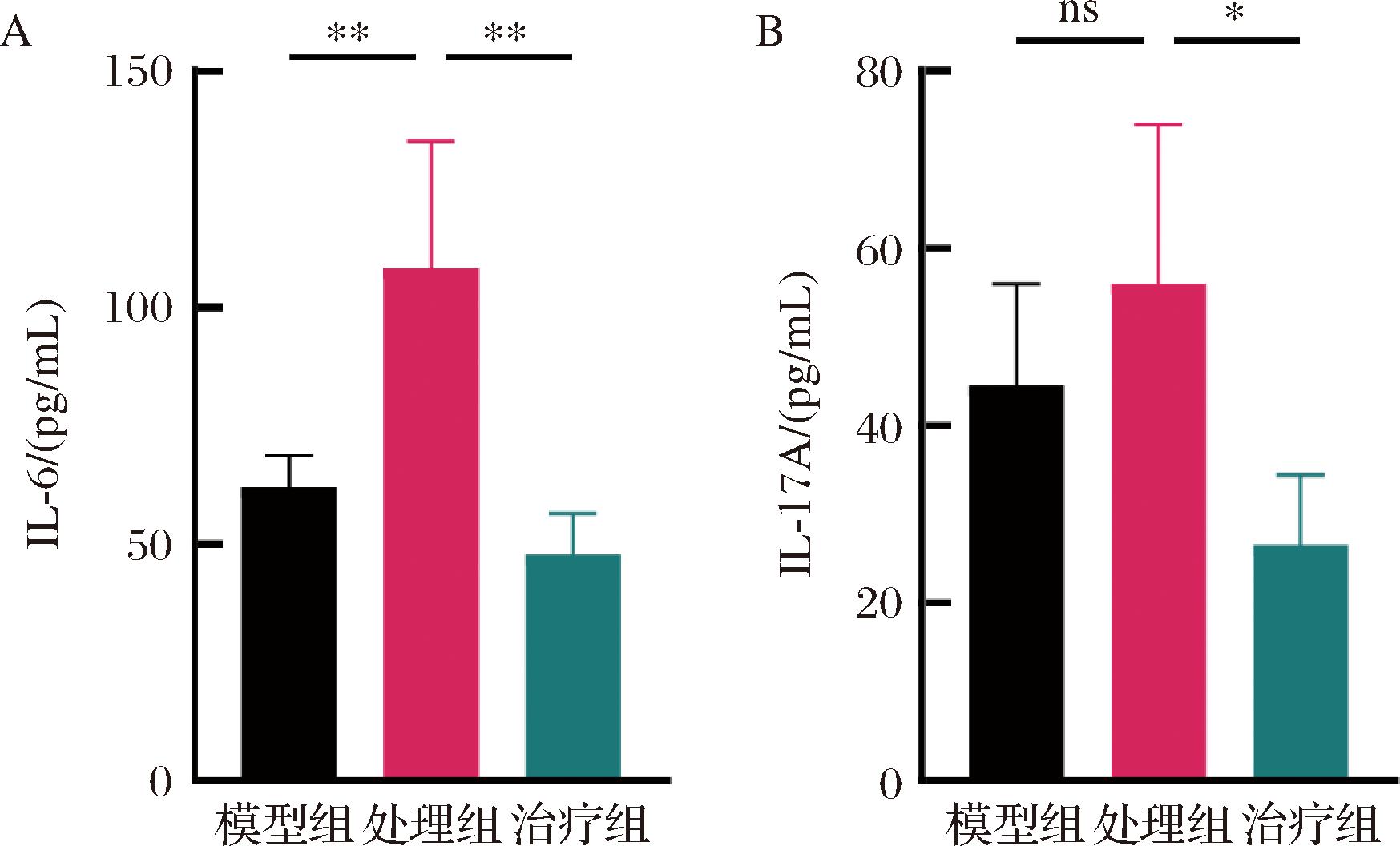
A-血清中IL-6水平;B-血清中IL-17A水平
图4 小鼠血清细胞因子水平
Fig.4 Cytokine levels in mouse serum
注:**表示P<0.01。
2.4 小鼠血清细胞因子水平变化
Th17和Treg细胞由CD4+T淋巴细胞分化,且受不同转录因子的调控。IL-6是一种多效细胞因子,具有促炎和抗炎特性,在调节免疫反应中通过激活转录因子的表达来实现对Th17和Treg平衡的调节[5]。在免疫反应中,CD4+T细胞分化为Th17细胞并增加IL-17A表达[6]。因此,本研究使用ELISA检测了小鼠血清中细胞因子IL-6和IL-17A水平。如图4所示,与模型组相比,Pg处理组小鼠血清中IL-6水平显著升高,IL-17A水平升高但不具备显著性。与处理组相比,小鼠进行果胶治疗后,小鼠血清中IL-6和IL-17A水平均显著降低,说明果胶对小鼠体内炎症细胞因子的良好调节作用。
2.5 小鼠肠道菌群变化
2.5.1 Alpha多样性分析
小鼠肠道菌群的Alpha多样性分析显示,不同处理组之间的Pielou均匀度(图5-A)和Shannon指数(图5-B)均无显著差异。
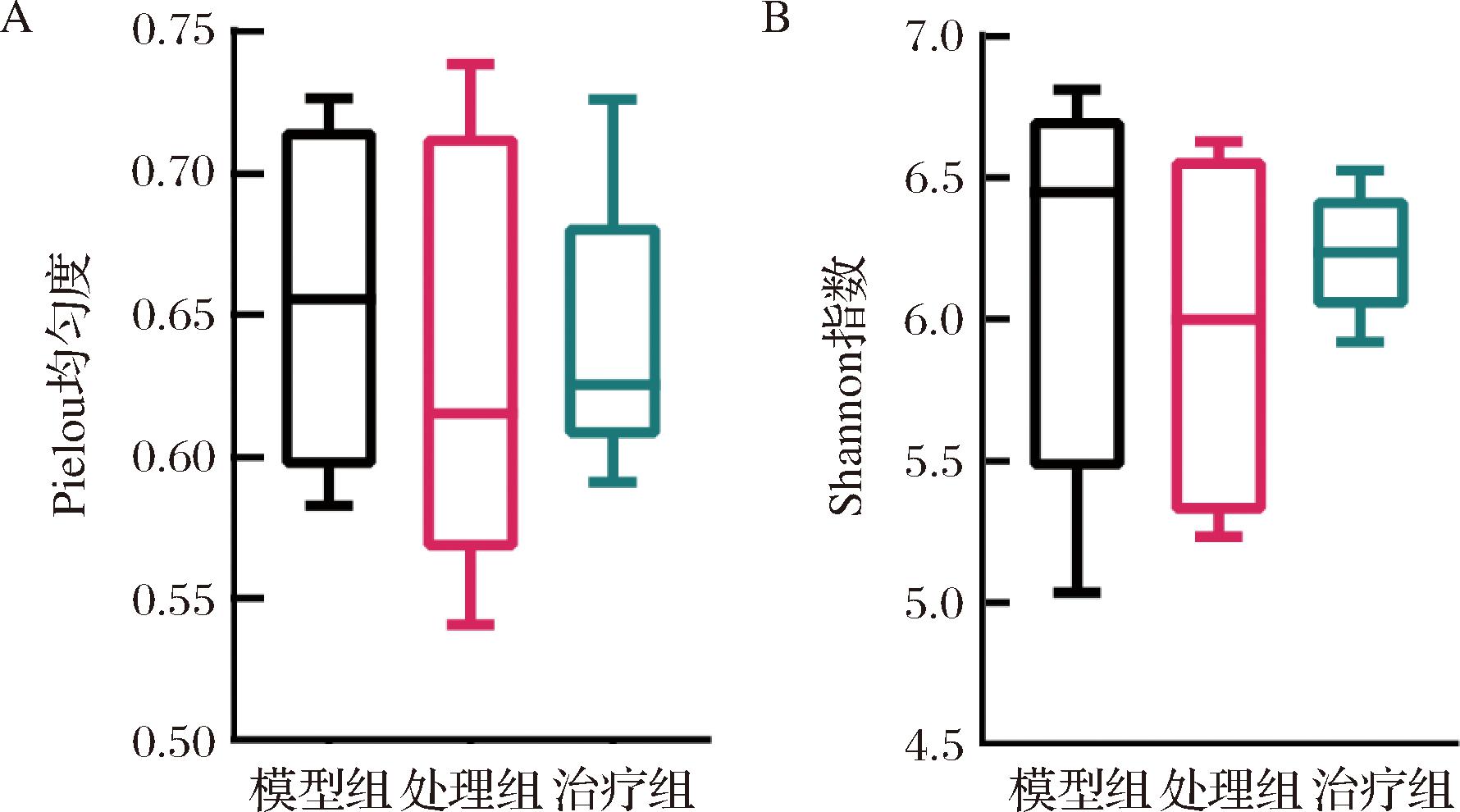
A-Pielou均匀度指数分析;B-Shannon指数分析
图5 菌群alpha多样性分析结果
Fig.5 Results of bacterial alpha diversity analysis
2.5.2 Beta多样性分析
在PCoA图上,模型组肠道微生物样本与处理组分别形成聚类(PERMANOVA,P<0.01,图6),说明Pg引起肠道菌群组成发生显著改变。果胶治疗组与处理组分别聚类,且果胶组小鼠的肠道菌群朝模型组方向恢复,表明果胶能调节Pg引起的菌群紊乱。
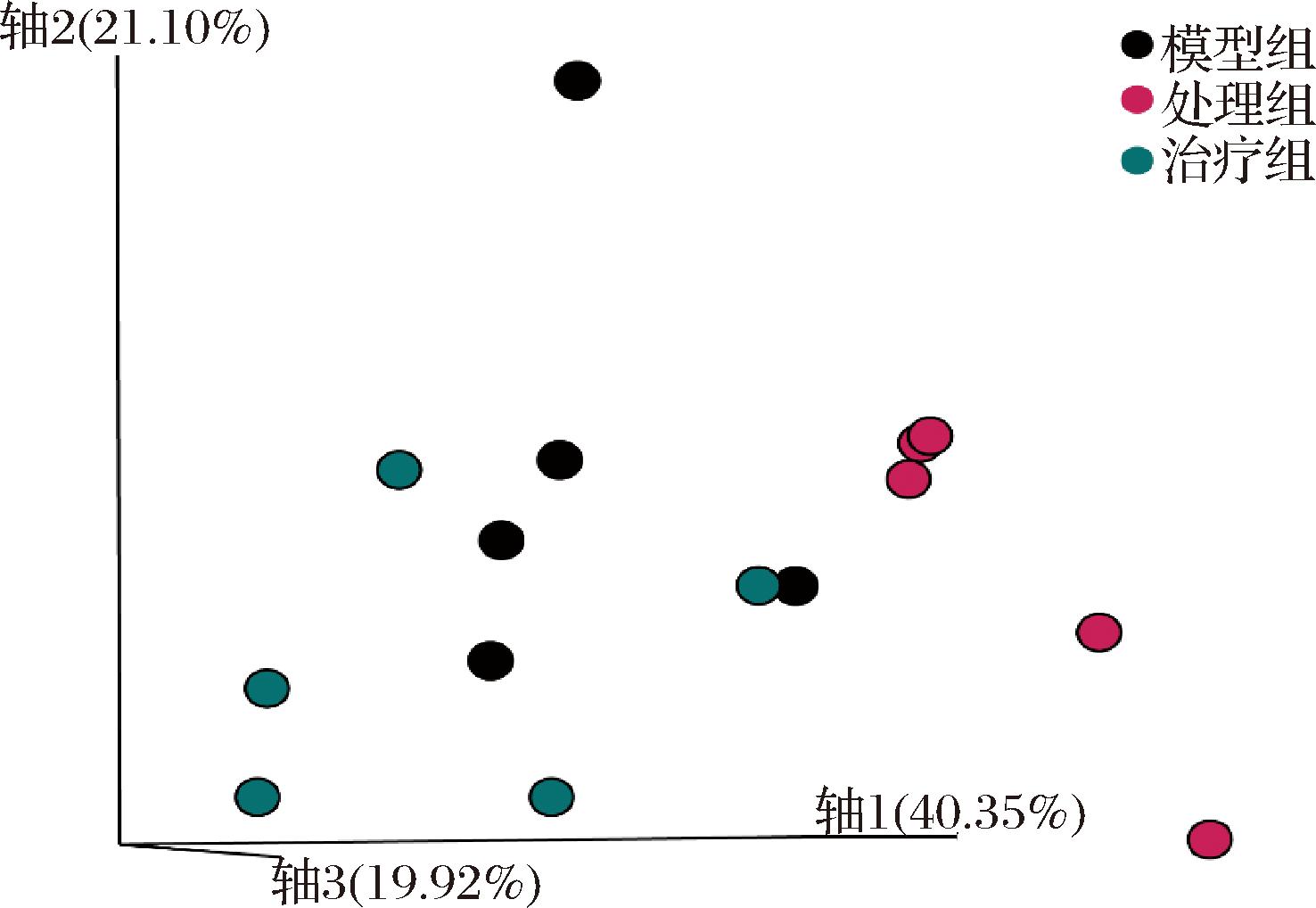
图6 基于weighted UniFrac距离的PCoA图
Fig.6 PCoA plot based on weighted UniFrac distance
2.5.3 小鼠肠道菌群门分类水平物种组成的影响
图7展示了门水平上的物种丰度,不同组别小鼠的主要物种均是Bacteroidetes、Verrucomicrobia、Firmicutes和Proteobacteria。Bacteroidetes在模型组的平均相对丰度是52.92%,Pg处理使其丰度降低至29.71%,果胶治疗后相对丰度为48.31%,接近模型组水平。Firmicutes在模型组的平均相对丰度是26.76%,Pg处理使其升高至45.16%,果胶治疗后相对丰度恢复至25.27%。Proteobacteria通常被认为是肠道菌群紊乱的标志[22],其平均相对丰度分别是12.06%、20.30%、12.14%,果胶治疗使其相对丰度恢复至Pg处理前的水平。Verrucomicrobia被认为有助于人体肠道中的葡萄糖稳态,并具有抗炎特性,且可能有助于肠道健康[23],其平均相对丰度在果胶治疗后为10.27%,高于模型组的5.56%。以上门水平微生物组成结果进一步说明,Pg能引起肠道菌群紊乱,果胶治疗能有效调节肠道菌群。
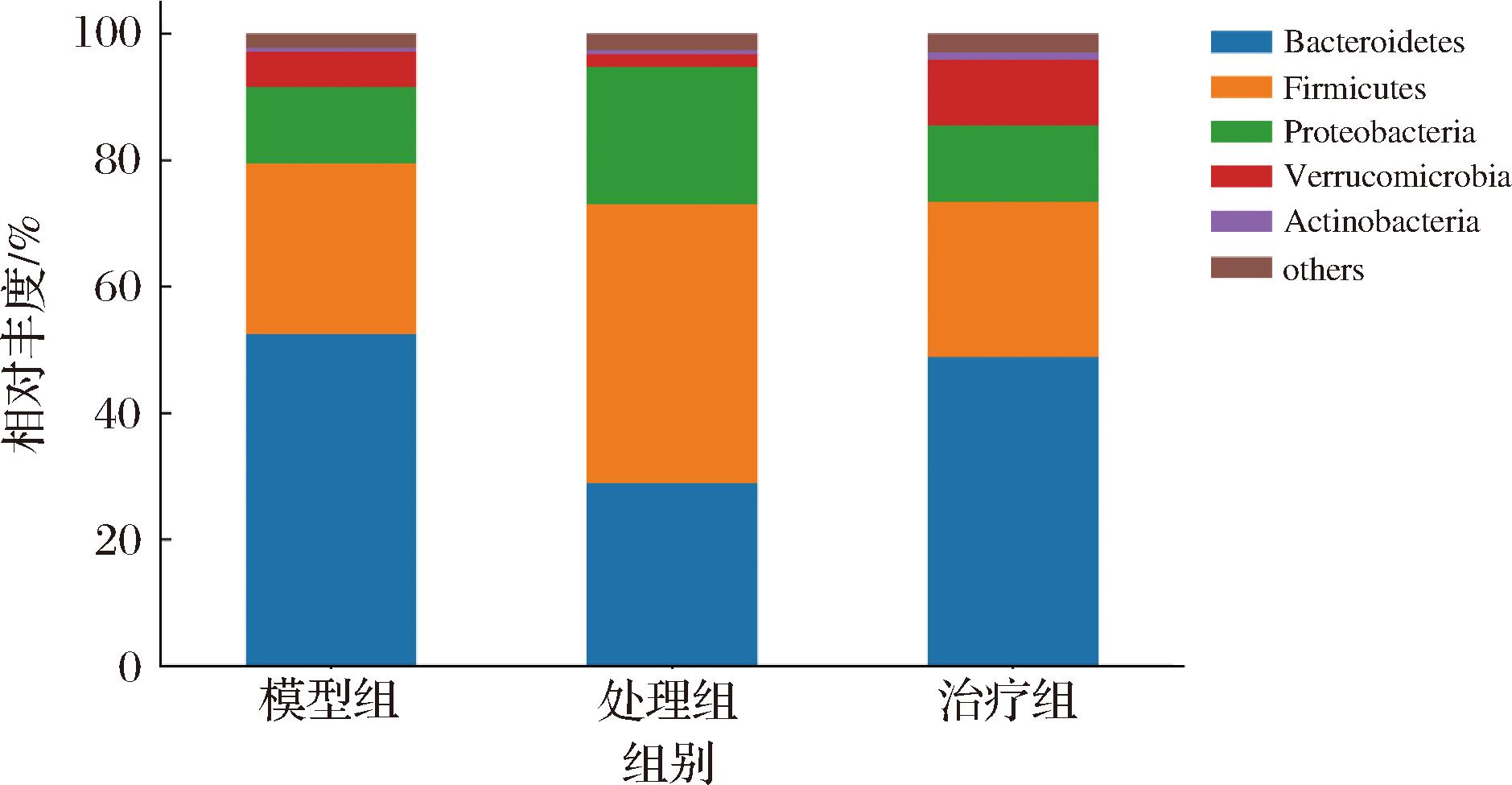
图7 各组样本门水平菌群组成
Fig.7 The phylum-level microbiome composition in each group
2.5.4 小鼠肠道菌群属分类水平物种组成的影响
图8展示了属水平上的菌群差异组成。通常被认为在健康小鼠肠道中占主导地位的S24-7 unknown genus在模型组相对丰度为18.63%,Pg处理后比例降低至7.67%,这种变化趋势前人的研究结果一致[24],而在果胶干预后相对丰度恢复至31.61%。Akkermansia被认为是下一代益生菌[25],在模型组的相对丰度为5.49%,Pg处理组中减少为1.92%,果胶处理后相对丰度恢复为10.07%。此外,观察到Pg升高了Lactobacillus、Clostridiales unknown genus、Helicobacter等细菌的相对丰度,果胶处理降低了它们的相对丰度。Lactobacillus被发现可以通过增加活性氧、诱导免疫耐受来促进胃癌的进展[26]。Clostridiales是肠道一大类兼性厌氧细菌,其中部分细菌被发现能引起组织和神经坏死产生外毒素并与感染性结肠炎相关[27]。Helicobacter通常在胃内存在,它可引起慢性胃炎、消化性溃疡和胃癌等疾病[28]。因此,以上结果提示Pg能引起肠道菌群紊乱,果胶治疗能通过增加有益菌丰度、减少有害菌丰度实现对肠道菌群的调节作用,进而缓解被Pg加剧的结肠炎。
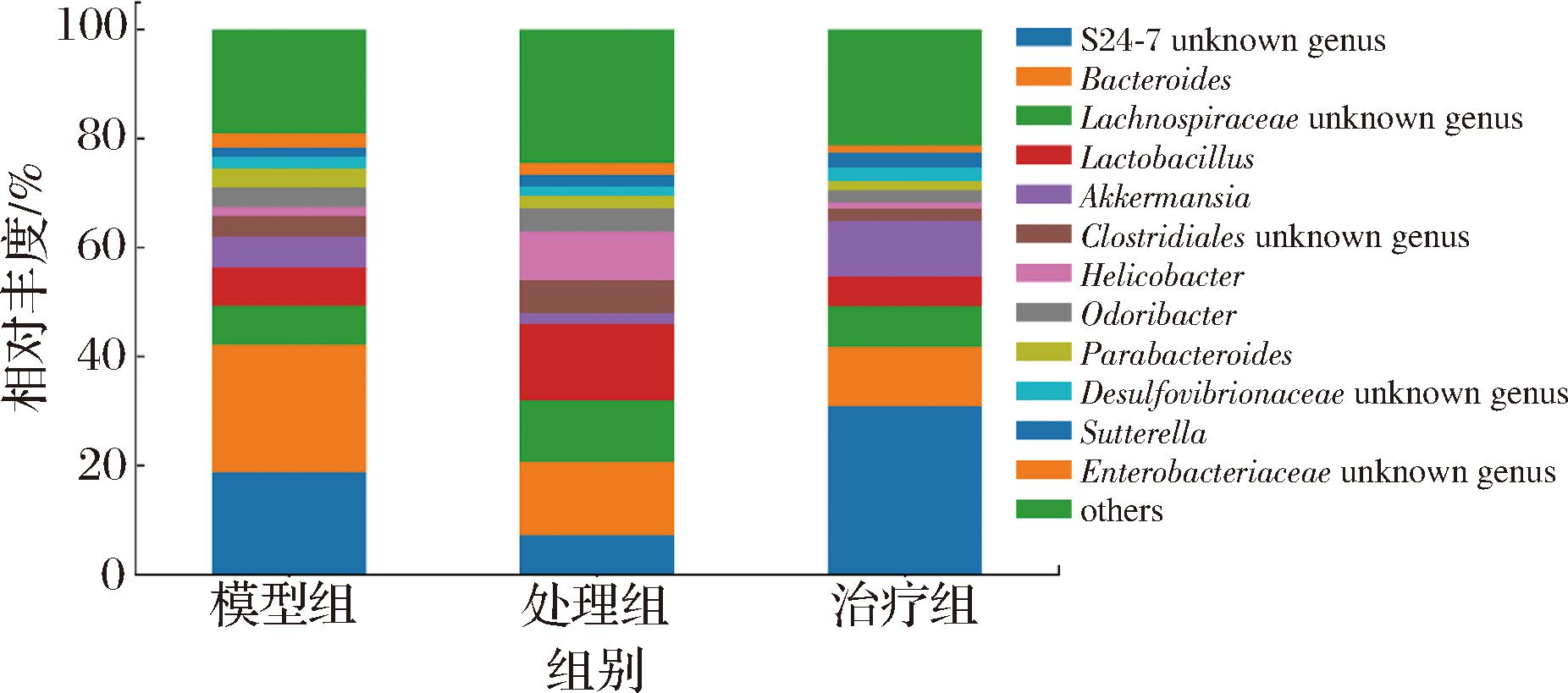
图8 各组样本属水平菌群组成
Fig.8 The genus-level microbiome composition in each group
3 结论
综上所述,Pg能加剧小鼠结肠炎症状,引起血清细胞因子水平升高和肠道菌群紊乱。果胶治疗可有效改善Pg加剧的结肠炎症状,具体表现在改善体重减轻和结肠长度现象,保护结肠组织结构完整性,降低血清中细胞因子IL-6和IL-17A水平,减少引起更严重的免疫失调。在肠道菌群调节上,果胶作用效果明显,门水平上增加了Bacteroidetes、Verrucomicrobia的平均相对丰度,减少了Firmicutes、Proteobacteria的平均相对丰度;在属水平上,通过增加有益菌丰度和降低有害菌丰度修复肠道菌群紊乱。因此,果胶可能作为一种潜在的免疫和菌群调节功能性物质,为预防或治疗口腔细菌易位引起的下消化道疾病相关产品的开发提供了参考。在未来研究中,还需进一步结合多组学技术对果胶缓解Pg加剧结肠炎的机制进行探索。
[1] ZHAO X D, LIU J B, ZHANG C, et al.Porphyromonas gingivalis exacerbates ulcerative colitis via Porphyromonas gingivalis peptidylarginine deiminase[J].International Journal of Oral Science, 2021, 13(1):31.
[2] LAMONT R J, FITZSIMONDS Z R, WANG H Z, et al.Role of Porphyromonas gingivalis in oral and orodigestive squamous cell carcinoma[J].Periodontology 2000, 2022, 89(1):154-165.
[3] TAN Q, MA X, YANG B, et al.Periodontitis pathogen Porphyromonas gingivalis promotes pancreatic tumorigenesis via neutrophil elastase from tumor-associated neutrophils[J].Gut Microbes, 2022, 14(1):2073785.
[4] KITAMOTO S, NAGAO-KITAMOTO H, JIAO Y Z, et al.The intermucosal connection between the mouth and gut in commensal pathobiont-driven colitis[J].Cell, 2020, 182(2):447-462.
[5] KAUR S, BANSAL Y, KUMAR R, et al.A panoramic review of IL-6:Structure, pathophysiological roles and inhibitors[J].Bioorganic &Medicinal Chemistry, 2020, 28(5):115327.
[6] CHANG D H, XING Q, SU Y, et al.The conserved non-coding sequences CNS6 and CNS9 control cytokine-induced rorc transcription during T helper 17 cell differentiation[J].Immunity, 2020, 53(3):614-626.
[7] DE VOS W M, TILG H, VAN HUL M, et al.Gut microbiome and health:Mechanistic insights[J].Gut, 2022, 71(5):1020-1032.
[8] LIU D, TANG W, HUANG X-J, et al.Structural characteristic of pectin-glucuronoxylan complex from Dolichos lablab L.hull[J].Carbohydrate Polymers, 2022, 298:120023.
[9] PEDROSA L F, RAZ A, FABI J P.The complex biological effects of pectin:Galectin-3 targeting as potential human health improvement?[J].Biomolecules, 2022, 12(2):289.
[10] FAN L L, ZUO S, TAN H Z, et al.Preventive effects of pectin with various degrees of esterification on ulcerative colitis in mice[J].Food &Function, 2020, 11(4):2886-2897.
[11] 田春雨. 乳酸杆菌对DSS诱导的小鼠溃疡性结肠炎的抑制作用[D].哈尔滨:哈尔滨工业大学, 2018.TIAN C Y.Lactobacilli inhibit DSS-induced ulcerative colitis in mice[D].Harbin:Harbin Institute of Technology, 2018.
[12] 陈非玥, 洪龙胜, 李婉雁, 等.白术多糖对小鼠胸腺与脾脏指数、组织结构及p38/MAPK信号通路的影响[J].动物医学进展, 2021, 42(12):43-49.CHEN F Y, HONG L S, LI W Y, et al, Effect of polysaccharide of Atractylodes macrocephala koidz on thymus and spleen indexes and tissue structure and p38/MAPK signaling pathway in mice[J] Progress in Veterinary Medicine, 2021, 42(12):43-49.
[13] 陈巍, 韩峥, 邹艳丽, 等.溃疡性结肠炎小鼠血清miR-23a-3p和miR-27a-3p的表达水平及其作用的研究[J].上海交通大学学报(医学版), 2020, 40(8):1069-1074.CHEN W, HAN Z, ZOU Y L, et al.Expressions and effects of serum miR-23a-3p and miR-27a-3p in mice with ulcerative colitis[J] Journal of Shanghai Jiaotong University(Medical Science), 2020, 40(8):1069-1074.
[14] ERBEN U, LODDENKEMPER C, DOERFEL K, et al.A guide to histomorphological evaluation of intestinal inflammation in mouse models[J].International Journal of Clinical and Experimental Pathology, 2014, 7(8):4557-4576.
[15] 张桢, 高擎燏, 崔雷鸿, 等.植物乳杆菌+菊粉合生元缓解DSS诱导小鼠溃疡性结肠炎的研究[J].中国畜牧杂志, 2021, 57(8):224-229.ZHANG Z, GAO Q Y, CUI L H, et al.Study on Lactobacillus Plantarum-inulin synbiotics to relieve DSS-induced ulcerative colitis in mice[J].Chinese Journal of Animal Science, 2021, 57(8):224-229.
[16] 余天. 天然抗氧化物对小麦麸质蛋白诱导C57BL/6小鼠肠道炎症的干预作用及其工业化生产设计[D].南昌:南昌大学, 2021.YU T.Intervention effect of natural antioxidants on intestinal inflammation induced by wheat gluten proteins in C57BL/6 mice and its process design in industrial scale[D].Nanchang:Nanchang University, 2021.
[17] LI P, LI M, WU T, et al.Systematic evaluation of antimicrobial food preservatives on glucose metabolism and gut microbiota in healthy mice[J].NPJ Science of Food, 2022, 6(1):42.
[18] BRITTO S L, KRISHNA M, KELLERMAYER R.Weight loss is a sufficient and economical single outcome measure of murine dextran sulfate sodium colitis[J].FASEB BioAdvances, 2019, 1(8):493-497.
[19] ZHANG B W, ZHAO C Y, ZHANG X J, et al.An elemental diet enriched in amino acids alters the gut microbial community and prevents colonic mucus degradation in mice with colitis[J].mSystems, 2022, 7(6):e0088322.
[20] 袁余懿, 刘与进, 范恒.Th17 细胞及其相关细胞因子在 IBD 中研究新进展[J].世界华人消化杂志, 2021, 7(24):1402-1409.YUAN Y Y, LIU Y J, FAN H.New progress in research of Th17 cells and related cytokines in inflammatory bowel disease[J].World Chinese Journal of Digestology, 2021, 7(24):1402-1409
[21] CHENG H, WANG L B, YANG B L, et al.Cutting edge:Inhibition of glycogen synthase kinase 3 activity induces the generation and enhanced suppressive function of human IL-10+ FOXP3+-induced regulatory T cells[J].Journal of Immunology, 2020, 205(6):1497-1502.
[22] BYNDLOSS M X, OLSAN E E, RIVERA-CH VEZ F, et al.Microbiota-activated PPAR-γ signaling inhibits dysbiotic Enterobacteriaceae expansion[J].Science, 2017, 357(6351):570-575.
VEZ F, et al.Microbiota-activated PPAR-γ signaling inhibits dysbiotic Enterobacteriaceae expansion[J].Science, 2017, 357(6351):570-575.
[23] CAI X S, DENG L, MA X G, et al.Altered diversity and composition of gut microbiota in Wilson's disease[J].Scientific reports, 2020, 10(1):21825.
[24] KATO T, YAMAZAKI K, NAKAJIMA M, et al.Oral administration of porphyromonas gingivalis alters the gut microbiome and serum metabolome[J].mSphere, 2018, 3(5):e00460-e00418.
[25] CANI P D, DEPOMMIER C, DERRIEN M, et al.Akkermansia muciniphila:Paradigm for next-generation beneficial microorganisms[J].Nature Reviews Gastroenterology &Hepatology, 2022, 19(10):625-637.
[26] VINASCO K, MITCHELL H M, KAAKOUSH N O, et al.Microbial carcinogenesis:Lactic acid bacteria in gastric cancer[J].Biochimica et Biophysica Acta (BBA)—Reviews on Cancer, 2019, 1872(2):188309.
[27] 刘又嘉, 贺璐, 郭艳芳, 等.肠道梭菌的研究进展[J].世界华人消化杂志, 2017, 25(22):2007-2014.LIU Y J, HE L, GUO Y F, et al.Research progress of intestinal Clostridium[J].World Chinese Journal of Digestology, 2017;25(22):2007-2014
[28] MALFERTHEINER P, CAMARGO M C, EL-OMAR E, et al.Helicobacter pylori infection[J].Nature Reviews Disease Primers, 2023, 9:19.