大麦是最重要的谷物作物之一,其最广泛的用途是酿造和制作麦芽[1]。麦芽汁是经麦芽糖化制备而来,麦芽中含有多种营养成分,现阶段的研究表明,其含有丰富的糖类、硫胺素、多酚类化合物、核黄素、黄酮类化合物、生育酚和各种矿物质元素等[2]。同时,这些物质在麦芽糖化过程中会转移到麦芽汁中,并最终保留在产品中,对人类健康有益[3]。麦芽汁原液在不经发酵处理的情况下带有生味和不清爽的口感,利用微生物发酵可以去除原麦汁的异味,并带来愉快的气味。而且,非乳发酵食品,特别是发酵谷物产品,因迎合如乳糖不耐症、素食主义、纯素食主义和需低脂肪食品等人群的食品消费需求,受到广泛关注。传统的麦芽发酵饮料啤酒是世界上消费量最大的饮料之一,含有多种营养成分,具有令人赞赏的感官特性[4]。但其酒精含量较高,并不适合孕妇、儿童和驾驶人员等饮用。因此,有必要开发一款营养价值高且具有良好感官特性的无醇麦芽发酵饮料。
水开菲尔粒作为一种天然微生物共生的聚合体[5],是一种菌相极其复杂的传统发酵剂。有研究报道称,其是由具有已知益生菌功能的微生物组成,例如醋杆菌属和乳杆菌属[6]。有研究表明,水开菲尔粒发酵饮料的乙醇含量较低,如其发酵的梨汁中乙醇含量低于0.5%(体积分数),在梨泥中未检测到乙醇[7]。虽然水开菲尔粒具有适应不同食物基质的能力[8],但其微生物组成和生物活性的波动会导致最终产品的质量无法标准化[9],并不适合工业化大规模生产。陈树俊等[10]使用开菲尔粒中分离到的乳杆菌对藜麦浓浆进行发酵,发酵后多酚、黄酮含量和抗氧化活性明显升高,营养价值显著提高。同时,水开菲尔粒具有可回收性,通过自然发酵已筛选出发酵性能优异、遗传性能稳定、抗逆性强的优势菌株[11]。因此,水开菲尔粒可作为筛选发酵麦芽汁菌株的良好分离源。
基于此,本研究以水开菲尔粒为菌株分离来源,以菌株在麦芽汁中的生长情况、产酸能力、酒精度和感官特性为评价指标,筛选出发酵性能优异、遗传性能稳定的菌株,并进行营养价值、抗氧化活性和挥发性风味物质等方面的考察,以期开发一款富营养、无醇的麦芽汁饮料,并为大规模生产质量稳定的麦芽汁产品、设计具有明确菌群组成的复合菌剂提供参考,有助于拓展麦芽汁的发酵加工菌种资源,丰富谷物发酵制品的种类。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
麦芽粉,晟发生物科技有限公司;水开菲尔粒,内蒙古家庭手工自制;红糖,佳一粒广东中轻糖业集团。
1.1.2 培养基
MRS肉汤(g/L):蛋白胨10.0,牛肉粉8.0,酵母粉4.0,葡萄糖20.0,磷酸氢二钾2.0,柠檬酸氢二钾2.0,乙酸钠5.0,硫酸镁0.2,硫酸锰0.04,吐温801.0,121 ℃高压蒸汽灭菌15 min。固体MRS培养基中添加琼脂粉20 g。
1.1.3 试剂
福林酚、没食子酸(gallic acid, GaE)、水溶性维生素E(6-hydroxy-2,5,7,8-tetramethylchroman-2-carboxylic acid, Trolox)、过硫酸钾、ABTS、DPPH,上海麦克林生化科技有限公司;芦丁(rutin, RuE),上海源叶生物科技有限公司;MRS肉汤培养基,青岛海博生物技术有限公司;2×Taq Master Mix预混酶,生工生物工程(上海)股份有限公司。
1.2 仪器与设备
FE28-Standard pH计,上海梅特勒-托利多仪器有限公司;SBA-90生物传感分析仪,山东省科学院生物研究所;UV-5200紫外分光光度计,上海元析仪器有限公司;TS-5000Z电子舌,日本Insent公司;PEN33电子鼻,德国Airsense公司;HSU-32手持糖度计,上海精密仪器仪表有限公司;FlavourSpec®风味分析仪,德国G.A.S公司;7890 A/5975 C气相色谱质谱联用仪,美国Agilent公司。
1.3 实验方法
1.3.1 菌株的分离纯化
将水开菲尔粒以5%(体积分数)的比例[12]接种于10%(质量分数)的无菌红糖水(巴氏灭菌,97 ℃,1 min)中,30 ℃静置培养24 h,连续活化2代,最后活化培养的溶液即为水开菲尔粒活化液。取100 μL稀释活化液,在MRS培养基上进行涂布,37 ℃培养48 h后,经过划线分离纯化得到纯种的单菌落,对形态符合细菌形态的菌株进行冻存。
1.3.2 菌株的分子生物学鉴定
水开菲尔粒菌株基因组DNA的提取采用玻璃珠破碎法[13]。利用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′)进行16S rDNA体外扩增。将获得的PCR产物送至生工生物工程(上海)股份有限公司进行测序。测序结果在美国国家生物信息中心数据库进行比对。
1.3.3 麦芽汁的制备与发酵
准确称量40 g麦芽粉,加160 mL水调浆,54 ℃恒温水浴1 h再升温至64 ℃保温1 h,碘液检测至糖化完全。糖化液用4层纱布过滤至澄清,加热煮沸10 min。检测糖度值为(20±2) °Brix,分装于洁净的容器中,巴氏灭菌(97 ℃,1 min),备用[14]。
使用含有150 mL灭菌麦芽汁的500 mL蓝盖瓶一式3份进行发酵,接种OD600值为0.8±0.03的不同菌株于一式3份的发酵瓶中,37 ℃培养48 h。取0、8、16、24、32、40、48 h的发酵样品进行分析。每个发酵时间取3个平行瓶中的样品进行指标测定。
1.3.4 菌株的筛选
1.3.4.1 初筛
从1.3.2节鉴定出的细菌菌株中,在不同种属中各选取一株接种于麦芽汁中进行发酵,以产酸能力、酒精度、电子鼻风味分析和感官特性为指标进行菌株的初步筛选。
总酸和pH值测定:总酸的测定参照GB/T 12456—2021《食品安全国家标准 食品中总酸的测定》中的滴定法。采用pH计分别测定3个平行发酵瓶中麦芽汁发酵样品的pH值。
酒精度的测定:通过SBA-90生物传感分析仪使用乙醇酶膜进行测定。
电子鼻的测定:参考CHEN等[15]的方法并稍作修改,对麦芽汁样品进行分析。电子鼻PEN3由10个传感器组成,分别对不同种类的香气成分灵敏,如表1所示。取2 mL样品放入20 mL顶空气质瓶中,60 ℃水浴20 min。电子鼻使用清洁空气作为载气,流速200 mL/min,数据采集间隔1 s,清洗时间30 s,测定时间100 s。使用软件Win Muster对电子鼻数据进行采集。
表1 电子鼻传感器性能
Table 1 Electronic nose sensor performance
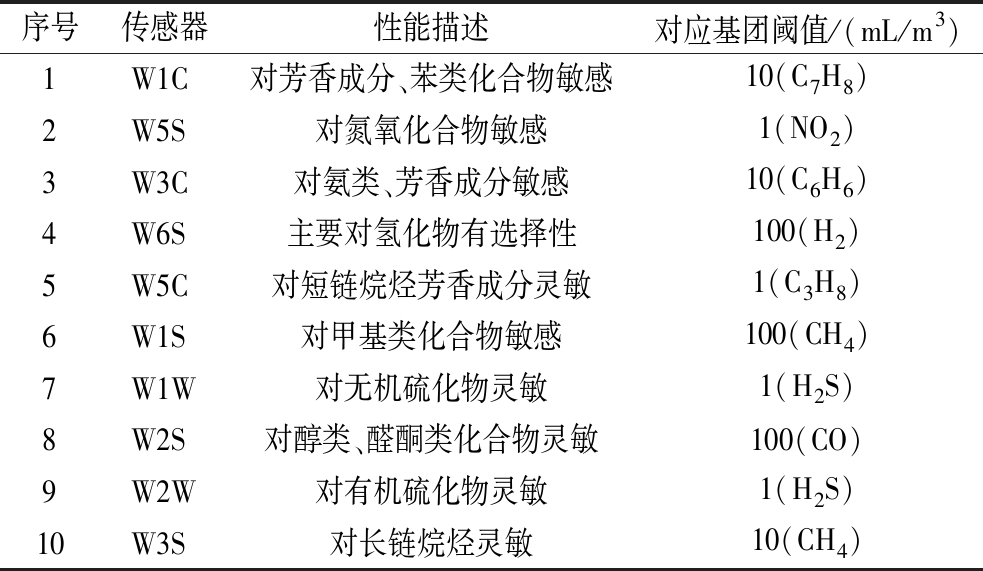
序号传感器性能描述对应基团阈值/(mL/m3)1W1C对芳香成分、苯类化合物敏感10(C7H8)2W5S对氮氧化合物敏感1(NO2)3W3C对氨类、芳香成分敏感10(C6H6)4W6S主要对氢化物有选择性100(H2)5W5C对短链烷烃芳香成分灵敏1(C3H8)6W1S对甲基类化合物敏感100(CH4)7W1W对无机硫化物灵敏1(H2S)8W2S对醇类、醛酮类化合物灵敏100(CO)9W2W对有机硫化物灵敏1(H2S)10W3S对长链烷烃灵敏10(CH4)
电子舌的测定:采用电子舌分别对未发酵的原麦汁和发酵后的麦芽汁的味觉进行测定,通过传感器电极测量评估样品的味觉信息,重复4次,以信号强度的方式呈现。通过Food-stuffer-sensor计算得出酸味、苦味、苦味回味、涩味、涩味回味、鲜味、丰富度和咸味[16]。
感官评价:参考刘仁禄[14]的方法,由大连工业大学的15名学生对未发酵的原麦汁和发酵后的麦芽汁样品进行感官评价。随机分配样品用于试验。对外观(色泽、组织状态)、口感(酸甜平衡、可接受性)和香味进行了评价。以5分制进行评分,其中,0分代表感官评价最差,5分代表感官评价最佳。
1.3.4.2 复筛
将1.3.4.1节初筛得到的细菌菌株重新接种于麦芽汁中进行发酵,以生长能力和营养价值为评价指标进行菌株的复筛。
活菌数的测定:取0、12、24、36、48 h的发酵样品进行菌落计数。样品稀释至10-3、10-4、10-5梯度。取100 μL稀释液均匀涂布MRS平板,每个稀释倍数做3个平行实验,37 ℃培养48 h,记录每个平板菌落总数。
总酚的测定:根据G![]() SIOR等[17]的方法稍作修改。将0.1 mL的麦芽汁样品与1 mL福林酚试剂反应3 min,加入3 mL 200 g/L的Na2CO3溶液暗反应30 min。使用分光光度计在765 nm处对制备的样品进行分析。结果以没食子酸当量表示(g GaE/L)。
SIOR等[17]的方法稍作修改。将0.1 mL的麦芽汁样品与1 mL福林酚试剂反应3 min,加入3 mL 200 g/L的Na2CO3溶液暗反应30 min。使用分光光度计在765 nm处对制备的样品进行分析。结果以没食子酸当量表示(g GaE/L)。
总黄酮的测定:根据NARDINI等[18]的方法稍作修改。将0.25 mL的麦芽汁样品与1.25 mL水混合,加入75 μL 50g/L的NaNO2溶液反应6 min,再加入150 μL 10%的AlCl3·6H2O溶液静置反应5 min,最后加入500 μL 1 mol/L的NaOH溶液,加水定容至2.5 mL。使用分光光度计在510 nm处对制备的样品进行分析。结果以芦丁当量表示(g RuE/L)。
1.3.5 理化指标的测定
1.3.5.1 色度的测定
用水作空白样品,使用分光光度计在430 nm处对制备的样品进行分析。
1.3.5.2 还原糖的测定
采用DNS法进行测定。
1.3.5.3 可溶性固形物含量的测定
采用糖度计测定[19],以白利糖度值(°Brix)表示可溶性固形物含量。
1.3.5.4 DPPH自由基清除能力的测定
参考VINGRYS等[20]的方法稍作修改。将1 mL麦芽汁样品与1 mL 0.2 mmol/L的DPPH溶液在室温避光条件下反应30 min。使用分光光度计在517 nm处对制备的样品进行分析。结果以没食子酸当量表示(g GaE/L)。
1.3.5.5 ABTS阳离子自由基清除能力的测定
参考SURIANO等[21]的方法稍作修改。将14 mmol/L的ABTS溶液与5 mmol/L的过硫酸钾溶液以1∶1的体积比混合,室温避光反应12~24 h,使用80%的乙醇溶液稀释至OD734值为0.8。将100 μL麦芽汁与900 μL ABTS溶液室温避光反应15 min。使用分光光度计在734 nm处对制备的样品进行分析。结果以Trolox当量表示(g Trolox/L)。
1.3.6 挥发性风味物质的测定
1.3.6.1 GC-MS测定
使用GC-MS进行风味物质测定。参考XIA等[22]的方法稍作修改。
色谱柱:WaxHP-5MS(30 m×0.25 mm×0.25 μm);载气:高纯氦气;进样口温度:250 ℃;流速:1 mL/min;GC条件:柱温箱温度在35 ℃保持5 min,以3 ℃/min升到50 ℃,保持3 min,以5 ℃/min升到150 ℃,最后以20 ℃/min升到250 ℃保持5 min。
MS条件:EI模式;电子能量:70 eV;质量扫描范围为15~300 m/z;离子源温度:250 ℃;四极杆温度:150 ℃,无溶剂延迟。
1.3.6.2 气相色谱-离子迁移谱(gas chromatography-ion mobility spectrometry, GC-IMS)的测定
采用FlavourSpec®风味分析仪进行风味物质测定,参考LIU等[23]的方法稍作修改。
GC-IMS检测条件:分析时间:30 min;色谱柱:MXT-WAX(30 mm×0.53 mm×1 μm);柱温:60 ℃;载气/漂移气:N2;IMS温度:45 ℃;采用自动顶空进样,进样体积:1 000 μL;进样针温度:85 ℃。
气相色谱条件:0~2 min:漂移气150 mL/min,载气2 mL/min;2~10 min:漂移气150 mL/min,载气由2 mL/min提升至10 mL/min;10~20 min:漂移气150 mL/min,载气由10 mL/min提升至100 mL/min;20~30 min:漂移气150 mL/min,载气100 mL/min。
1.4 数据处理与分析
利用SPSS 23.0统计软件进行数据的统计处理和显著性分析;利用Origin2021软件作图;GC-IMS数据利用VOCal软件进行指纹图谱绘制分析。本研究中每组试验包含3个平行实验,实验数据均以平均值±标准差的形式呈现。
2 结果与分析
2.1 水开菲尔中细菌的分离与鉴定
通过16S rDNA测序鉴定,利用NCBI数据库进行BLAST分析,从水开菲尔粒中共筛选得到29株细菌,分别为3株氧化葡萄糖醋杆菌(Gluconobacter oxydans)、1株醋酸杆菌(Acetobacter syzygii)、10株桃醋酸杆菌(Acetobacter persici)、1株干酪乳酪杆菌(Lacticaseibacillus casei)、13株甘草乳杆菌(Lactobacillus nagelii)和1株红条乳杆菌(Liquorilactobacillus satsumensis)(表2)。本研究所得结果与高芫超等[6]的筛选结果存在区别,说明水开菲尔粒中微生物组成和生物活性存在波动。各选择1株菌株进行麦芽汁发酵实验,并以不同菌株在麦芽汁中的生长情况、产酸能力、营养价值和感官特性等为评价指标,确定最优发酵菌株,进行后续实验。
表2 水开菲尔粒中29株分离菌株的鉴定结果
Table 2 Identification results of 29 strains isolated from water kefir grains
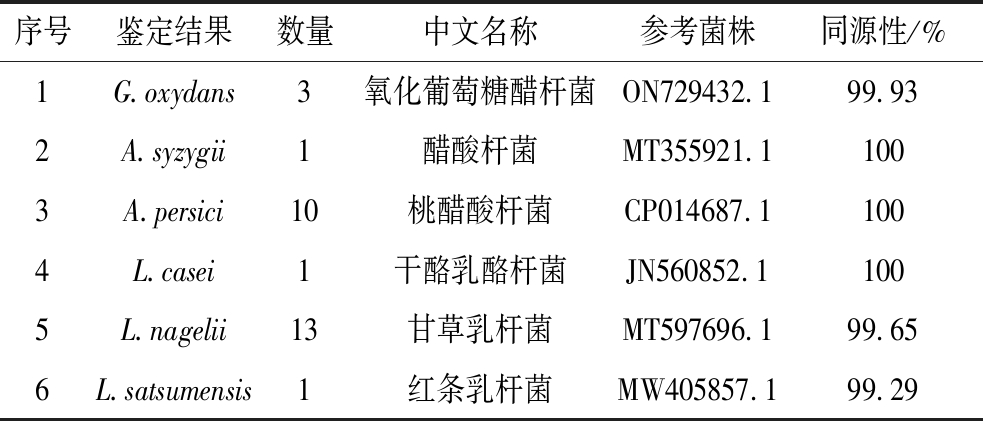
序号鉴定结果数量中文名称参考菌株同源性/%1G.oxydans3氧化葡萄糖醋杆菌ON729432.199.932A.syzygii1醋酸杆菌MT355921.11003A.persici10桃醋酸杆菌CP014687.11004L.casei1干酪乳酪杆菌JN560852.11005L.nagelii13甘草乳杆菌MT597696.199.656L.satsumensis1红条乳杆菌MW405857.199.29
2.2 筛菌结果
2.2.1 初筛结果
如图1所示,随着发酵的进行,不同菌株发酵的麦芽汁pH值呈下降趋势,总酸含量呈上升趋势。其中使用L.casei、L.nagelii和L.satsumensis这3株菌发酵的麦芽汁前期pH值和总酸含量变化幅度较大,后期趋于稳定。使用G.oxydans,A.syzygii和A.persici这3株菌发酵的麦芽汁与之相反。pH值和总酸含量的整体变化趋势与韩珍琼等[24]发酵麦芽汁的研究结果一致。pH值的降低和酸度的增加可能是由于发酵过程中产生了有机酸等酸性物质[25]。值得注意的是,经过这6株菌发酵后麦芽汁的乙醇含量均低于0.1%(体积分数),符合软饮料乙醇限量标准[小于0.5%(体积分数)],结果可为开发一款新型无醇麦芽汁饮料提供前提条件,拓展麦芽发酵饮品市场潜力(表3)。
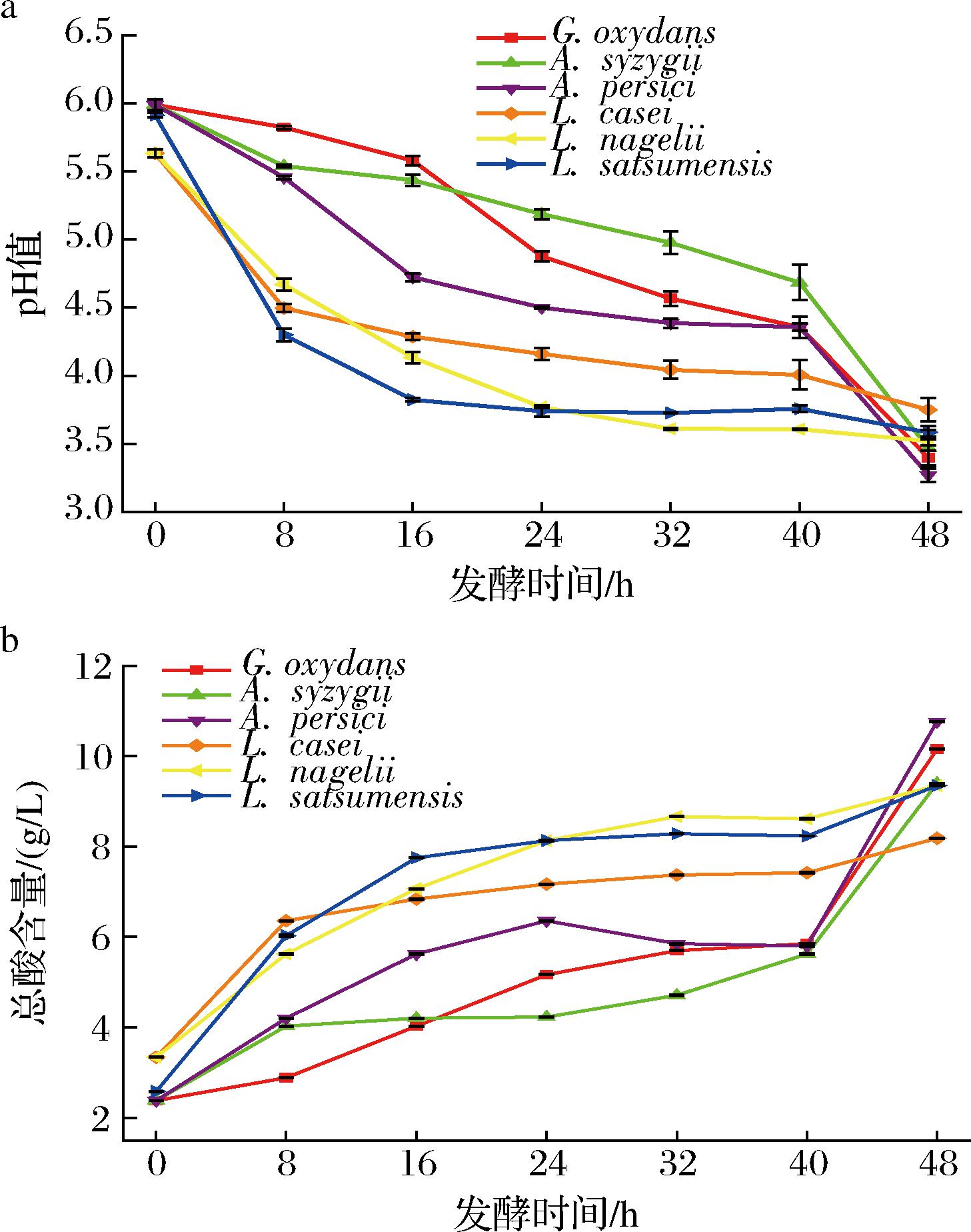
a-pH值;b-总酸
图1 不同菌株发酵过程中麦芽汁产酸能力的变化
Fig.1 Changes in wort acid production capacity during fermentation with different strains of bacteria
表3 不同菌株发酵麦芽汁的酒精度(体积分数) 单位:%
Table 3 Alcohol content of wort fermented by different strains of bacteria(volume ratio)
注:表中数值为平均值±标准偏差(n=3),不同小写字母表示同行差异显著(P<0.05)(下同)。
未发酵原麦汁G.oxydansA.syzygiiA.persiciL.caseiL.nageliiL.satsumensis0.02±0.00a0.06±0.00b0.06±0.00b0.07±0.00c0.02±0.00a0.09±0.00d0.03±0.00a
电子鼻主要是模拟人嗅觉系统,利用10个金属传感器对不同气味的敏感程度来识别挥发性气味[26]。6种样品的气味差异的电子鼻分析如图2所示。从图2中可以看出,各个样品之间存在一定差异,其中W1C、W5S和W2W 3个传感器对6种样品的信号值差异较大,尤其是W1C(对芳香成分、苯类化合物灵敏)和W5S(对氮氧化合物很灵敏)。其他7个传感器的信号值在不同样品之间基本相似,说明这几个传感器检测出的挥发性物质组成基本一致。
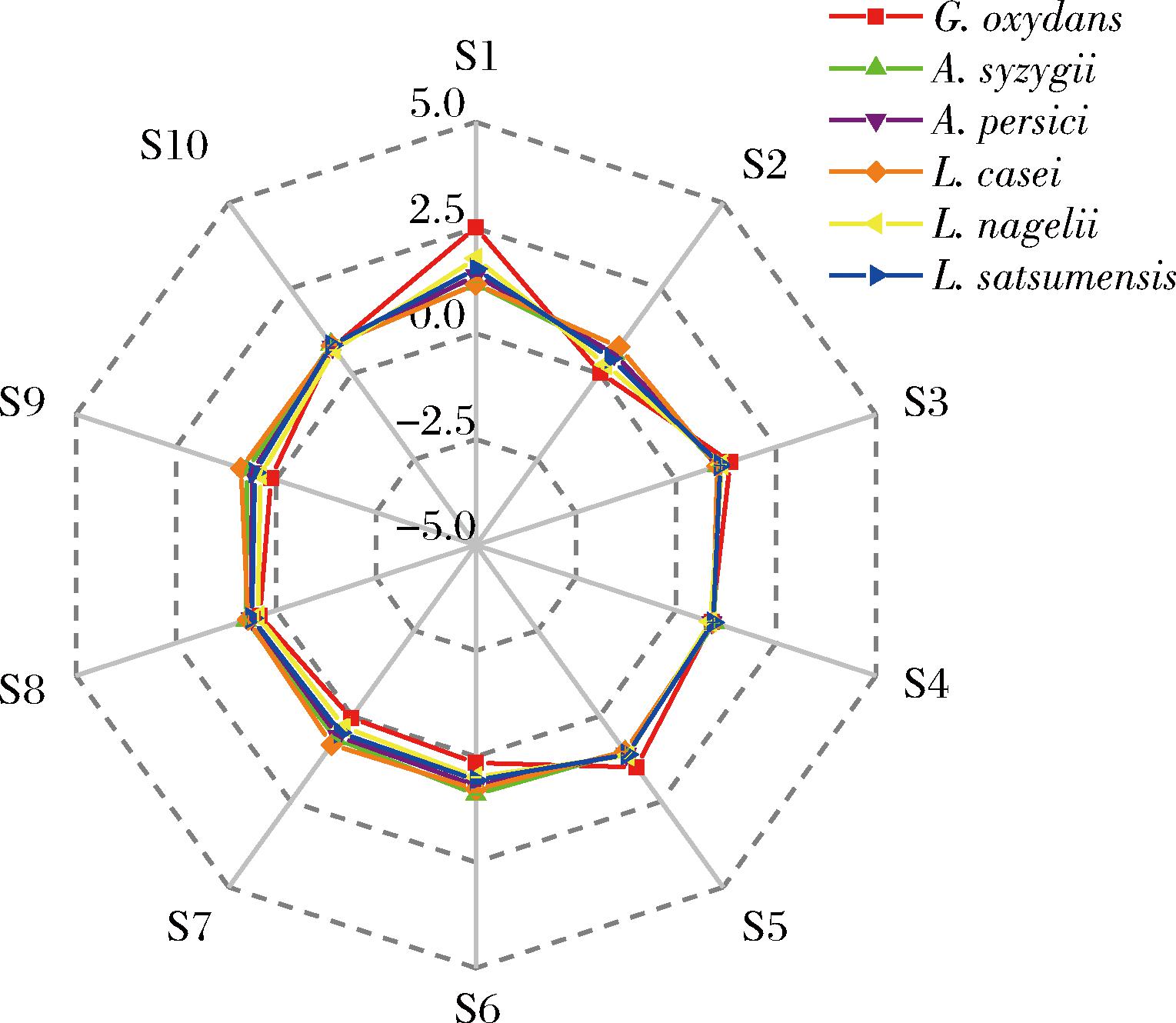
图2 不同菌株发酵对麦芽汁挥发性成分的影响
Fig.2 Effect of fermentation with different strains of bacteria on the volatile components of wort
本实验对G.oxydans、A.syzygii、A.persici、L.casei、L.nagelii和L.satsumensis发酵的麦芽汁样品进行了感官评价和电子舌的测定。如图3-a所示,G.oxydans和L.satsumensis发酵的麦芽汁总体感官评分最高,分数分别为(15.19±0.28)分和(14.82±0.44)分;经过发酵后的麦芽汁整体感官评分均高于未发酵的原麦汁,说明发酵可以改善麦芽汁的口感。由图3-b可知,L.satsumensis发酵的麦芽汁在苦味、苦味回味、涩味回味方面较其他菌株发酵麦芽汁和未发酵的原麦汁低,口感偏甜;而G.oxydans发酵的麦芽汁涩味较其他菌株发酵的麦芽汁和未发酵的原麦汁低,酸度和丰富度最高,口感偏酸。
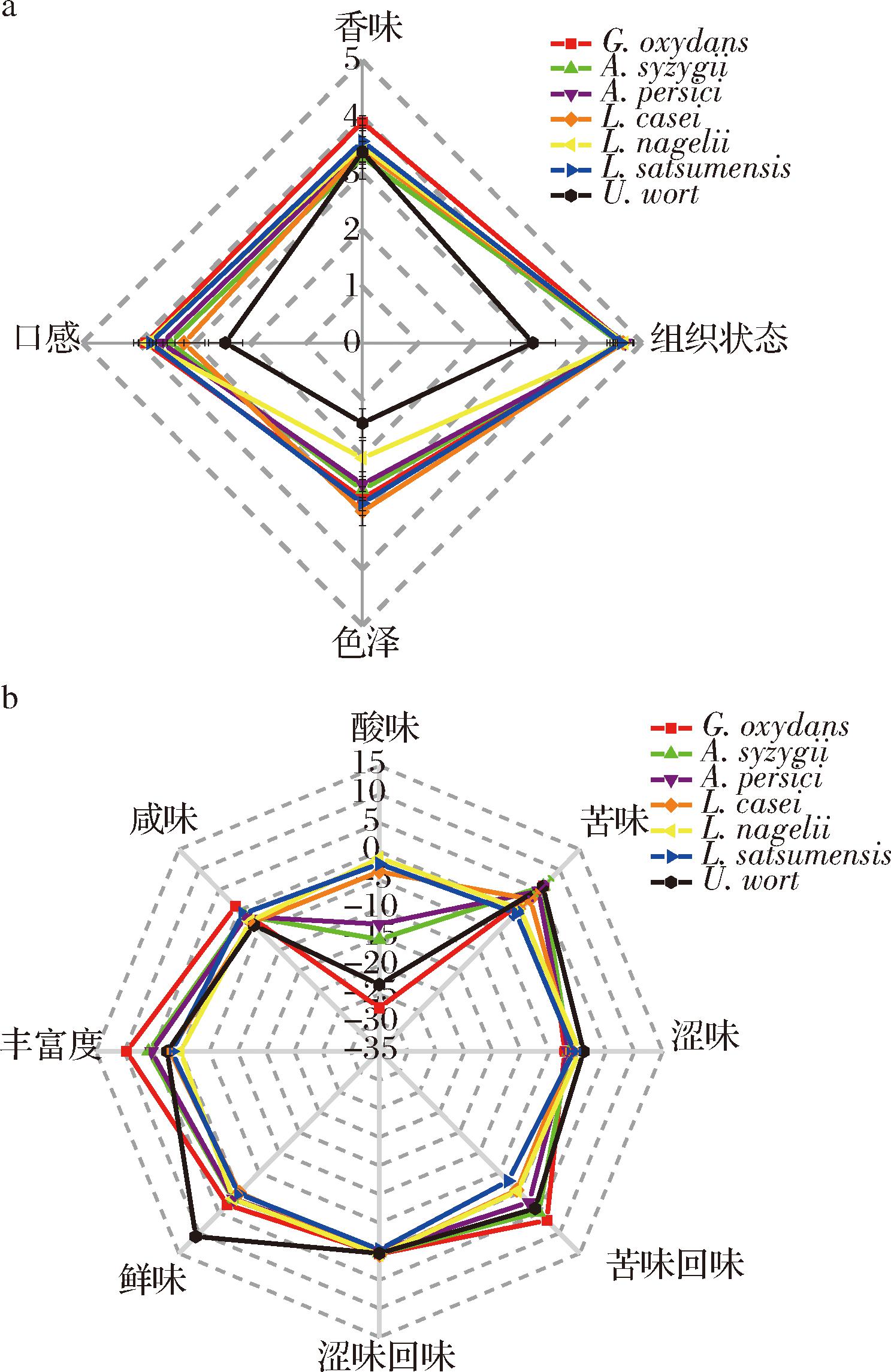
a-感官评价;b-电子舌
图3 不同菌株发酵对麦芽汁感官特性的影响
Fig.3 Effect of fermentation with different strains of bacteria on sensory characteristics of wort
综上所述,G.oxydans和L.satsumensis发酵的麦芽汁乙醇含量均低于0.1%(体积分数)且二者发酵的麦芽汁具有良好的感官特性和感官接受度。因此,将G.oxydans和L.satsumensis作为复筛候选菌株。
2.2.2 复筛结果
通过将初筛菌株重新接入麦芽汁中进行发酵,结果如图4所示,G.oxydans和L.satsumensis菌落总数在发酵过程中均表现出先上升后稳定的趋势,可以看出pH值的降低并未影响微生物的活力,其中L.satsumensis在麦芽汁中长势较好,更适合在麦芽汁基质中生长。
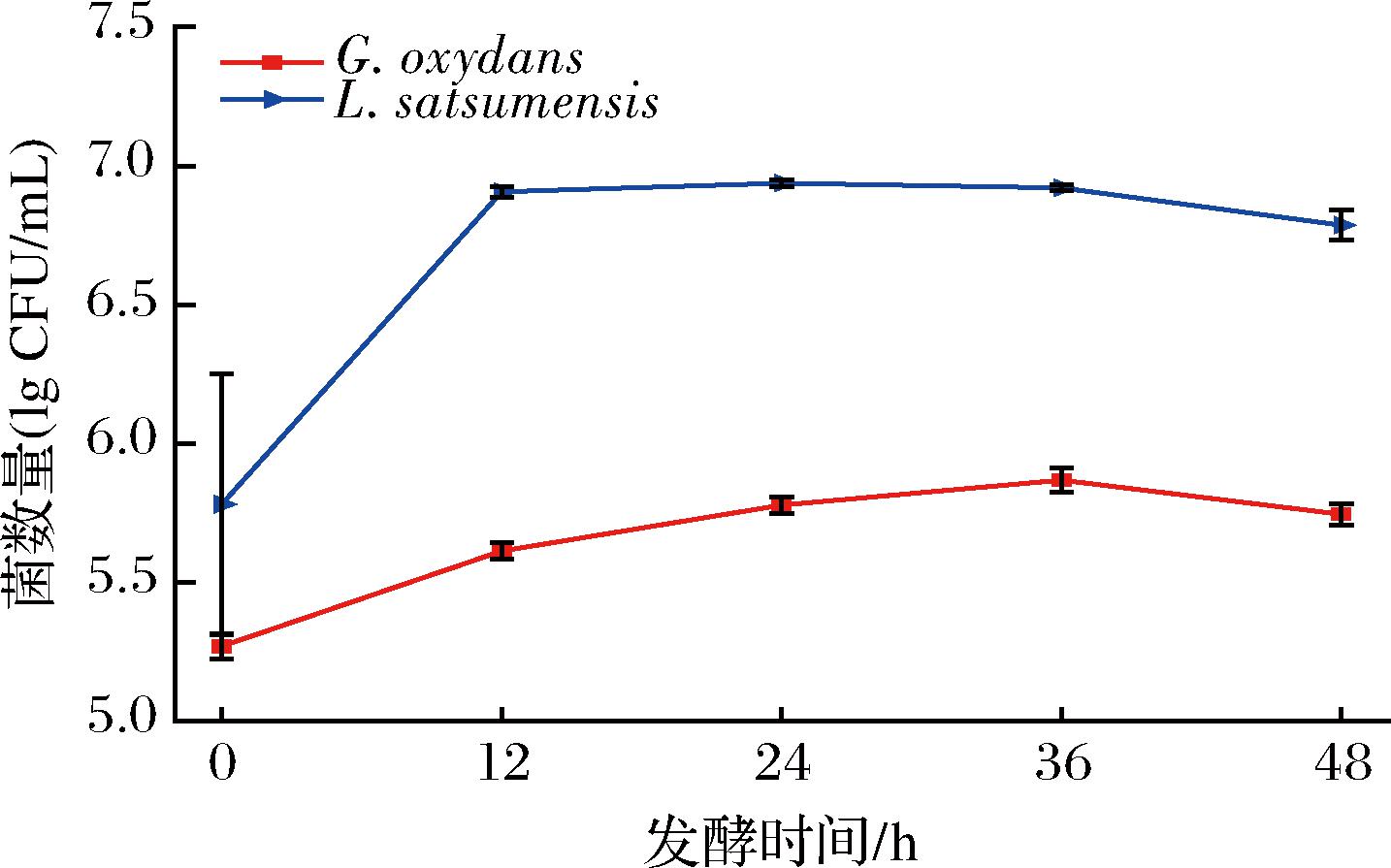
图4 不同菌株发酵过程中麦芽汁菌落总数的变化
Fig.4 Changes in total bacterial of wort during fermentation with different strains of bacteria
总酚含量、总黄酮含量对麦芽汁的色香味具有重要影响,总酚和总黄酮可以起到抗炎、抗氧化等作用,对人体有益。从表4可以看出,使用L.satsumensis发酵后总酚含量和总黄酮含量均高于未发酵的原麦汁,分别达到了(1.39±0.02) g GaE/L和(5.89±0.07) g RuE/L。总酚含量的增加可能是因为共轭形式的酚类化合物转化成了它们的游离形式[27]。总黄酮含量的增加可能是因为复杂的黄酮苷在麦芽汁发酵过程中转化为多种简单的黄酮类化合物。而使用G.oxydans发酵后总酚含量未发生显著变化,总黄酮含量降低。
表4 不同菌株发酵麦芽汁的生物活性物质
Table 4 Bioactive substances in fermented wort of different strains of bacteria

理化指标未发酵原麦汁发酵菌株G.oxydansL.satsumensis总酚/(g GaE/L)1.34±0.04a1.34±0.05a1.39±0.02a总黄酮/(g RuE/L)3.19±0.07b2.76±0.07c5.89±0.07a
综上所述,L.satsumensis更适合在麦芽汁基质中生长。同时,与未发酵的原麦汁相比,L.satsumensis发酵的麦芽汁总黄酮含量显著提升,总酚略有提升,提高了麦芽汁的营养价值。因此,选择L.satsumensis进行后续实验。
2.3 红条乳杆菌发酵麦芽汁的理化特性分析
如表5所示,经L.satsumensis发酵的麦芽汁可溶性固形物含量和色度都产生了轻微的下降,提高了麦芽汁的感官特性。糖类物质是L.satsumensis发酵麦芽汁过程的主要碳源,发酵后还原糖含量显著降低,由(135.90±0.16) g/L下降到(108.83±3.47) g/L,糖含量的降低对特殊人群的健康有益。发酵后抗氧化活性也有所提高,可能是由于乳杆菌发酵后产生了酸性物质,使得发酵体系呈现低酸性环境,有利于保护酚类物质不被氧化[28],提高其抗氧化活性。
表5 红条乳杆菌发酵麦芽汁的理化特性
Table 5 Physicochemical properties of wort fermented with L.satsumensis
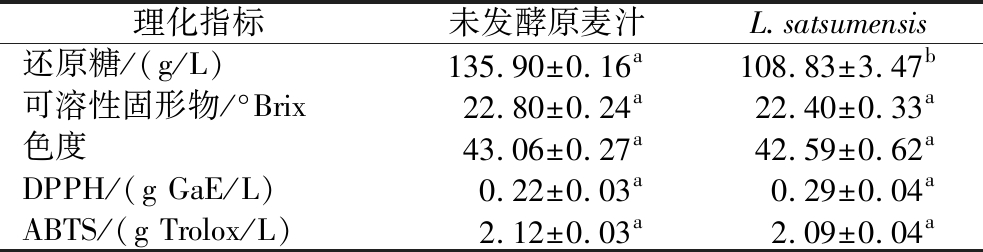
理化指标未发酵原麦汁L.satsumensis还原糖/(g/L)135.90±0.16a108.83±3.47b可溶性固形物/°Brix22.80±0.24a22.40±0.33a色度43.06±0.27a42.59±0.62aDPPH/(g GaE/L)0.22±0.03a0.29±0.04aABTS/(g Trolox/L)2.12±0.03a2.09±0.04a
2.3.1 通过GC-MS鉴别的挥发性化合物
发酵前后麦芽汁样品风味物质的GC-MS分析结果如表6所示。从表6可以看出,利用GC-MS在麦芽汁中共检测到19种挥发性化合物,包括2种醇类、3种醛类、6种酸类、2种酯类和6种其他化合物。在3种醛类中,麦芽汁经过L.satsumensis发酵后苯甲醛含量降低,苯乙醛含量升高,降低了麦芽汁中的苦杏仁味,增强了花香[29];在6种酸类物质中,发酵后麦芽汁中均未检测到异戊酸和癸酸,二者均呈现出难闻的气味,说明发酵对麦芽汁的风味具有改良作用;在6种其他化合物中,2-乙酰基呋喃主要存在于咖啡、啤酒和绿茶等挥发性香气成分中,呈杏仁、坚果、酵香、牛奶和甜的焦糖似香气。甲基麦芽酚天然存在于炒麦芽中,有似焦香奶油糖的特殊香气。在发酵后的麦芽汁中可以检测到这2种挥发性物质,由此可见,经L.satsumensis发酵后麦芽汁的香气更加饱满。
表6 红条乳杆菌发酵麦芽汁中挥发性风味物质含量
Table 6 Volatile flavour substances in L.satsumensis fermented wort
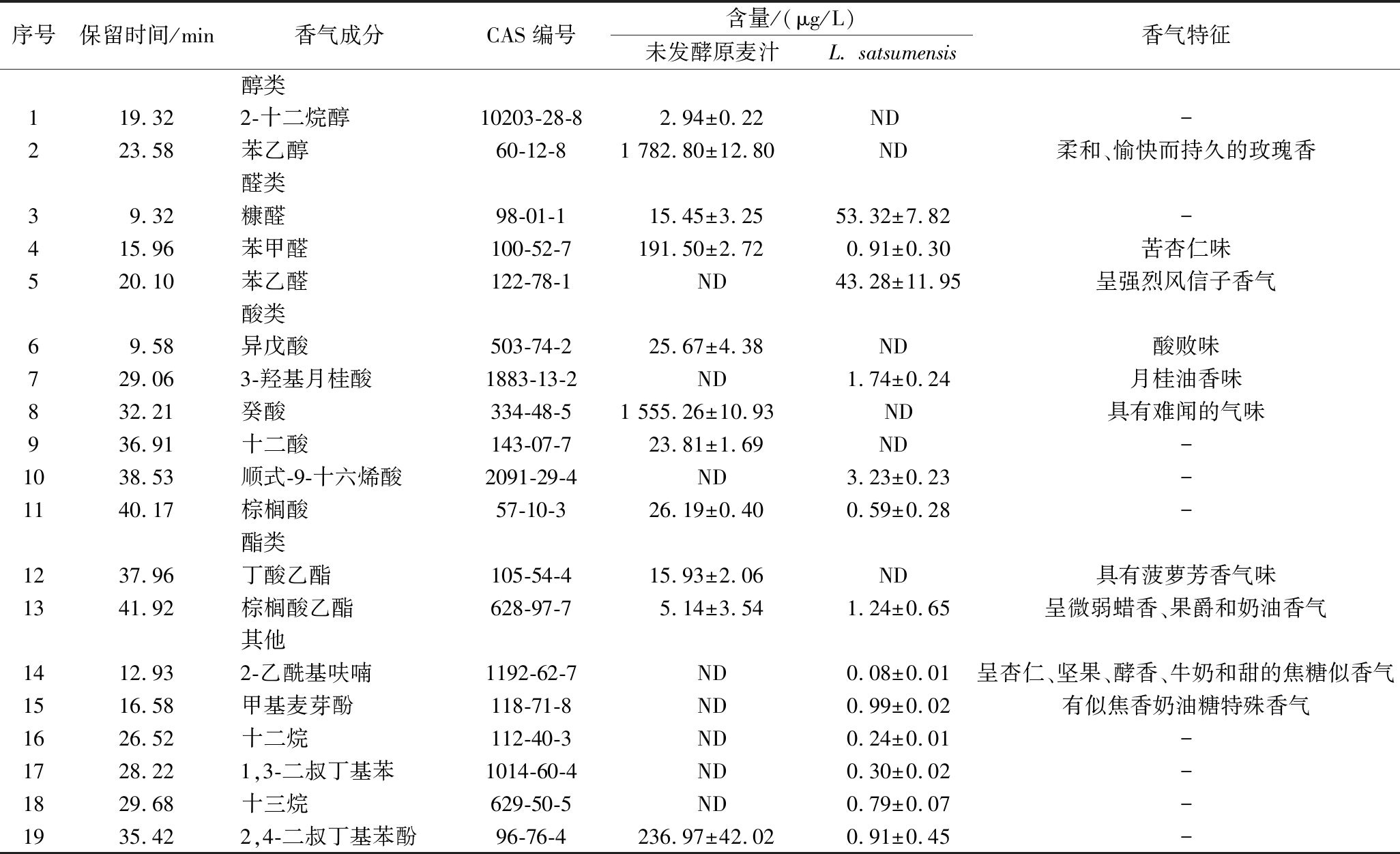
注:ND代表未检测到该物质;-表示无数据。
序号保留时间/min香气成分CAS编号含量/(μg/L)未发酵原麦汁L. satsumensis香气特征醇类119.322-十二烷醇10203-28-82.94±0.22ND -223.58苯乙醇60-12-81 782.80±12.80ND柔和、愉快而持久的玫瑰香醛类39.32糠醛98-01-115.45±3.2553.32±7.82-415.96苯甲醛100-52-7191.50±2.720.91±0.30苦杏仁味520.10苯乙醛122-78-1ND43.28±11.95呈强烈风信子香气酸类69.58异戊酸503-74-225.67±4.38ND酸败味729.063-羟基月桂酸1883-13-2ND1.74±0.24月桂油香味832.21癸酸334-48-51 555.26±10.93 ND具有难闻的气味936.91十二酸143-07-723.81±1.69ND-1038.53顺式-9-十六烯酸2091-29-4ND3.23±0.23-1140.17棕榈酸57-10-326.19±0.400.59±0.28-酯类1237.96丁酸乙酯105-54-415.93±2.06ND具有菠萝芳香气味1341.92棕榈酸乙酯628-97-75.14±3.541.24±0.65呈微弱蜡香、果爵和奶油香气其他1412.932-乙酰基呋喃1192-62-7ND0.08±0.01呈杏仁、坚果、酵香、牛奶和甜的焦糖似香气1516.58甲基麦芽酚118-71-8ND0.99±0.02有似焦香奶油糖特殊香气1626.52十二烷112-40-3ND0.24±0.01-1728.221,3-二叔丁基苯1014-60-4ND0.30±0.02-1829.68十三烷629-50-5ND0.79±0.07-1935.422,4-二叔丁基苯酚96-76-4236.97±42.020.91±0.45-
2.3.2 通过GC-IMS鉴别的挥发性化合物
风味是饮料最基本的特征,采用GC-IMS技术分析了发酵前后挥发性成分的差异。如图5所示,总共检测到26种有机挥发性化合物,包括5种酯类、3种醇类、2种醛类、2种酸类、2种酮类、3种其他化合物和9种未知化合物。在比较发酵前后麦芽汁样品的挥发性物质时,采用了差异比较模型(图5-b)。如果挥发性化合物一致,扣除背景后为白色;若浓度高于参考值,则扣除背景后为红色;若浓度低于参考值,则扣除背景后为蓝色。选取未发酵的原麦汁的地形图作为背景参考,每个点代表一个化合物。与未发酵的原麦汁相比,随着发酵的进行,挥发性化合物的数量有所增加。
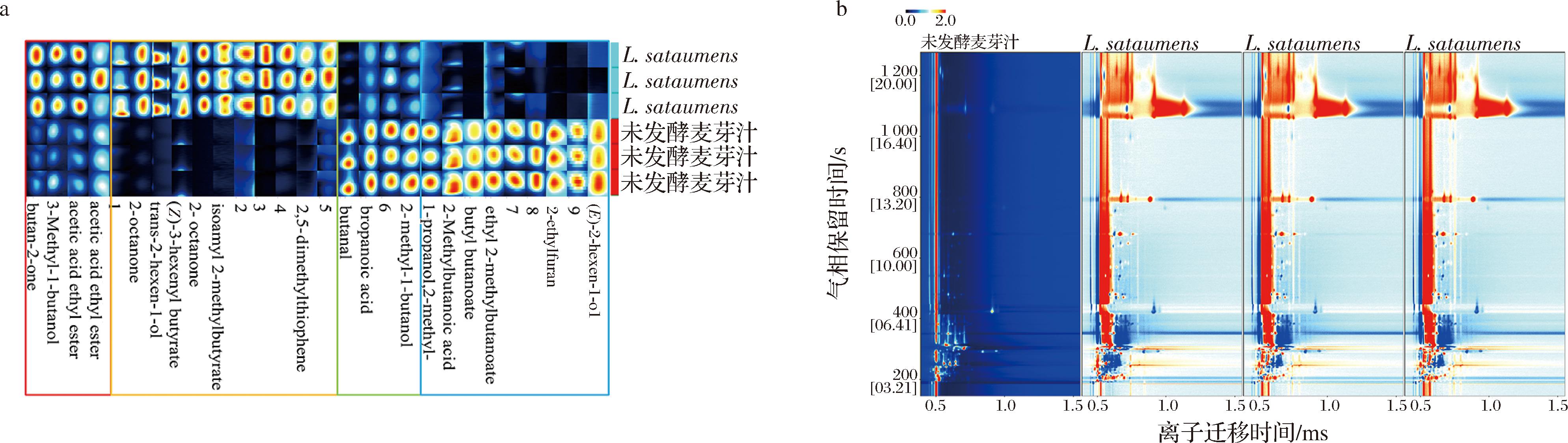
a-指纹图谱;b-微分图
图5 红条乳杆菌发酵麦芽汁样品的挥发性化合物的指纹图谱和微分图
Fig.5 Fingerprinting and differential mapping of volatile compounds in L.satsumensis fermented wort samples
注:a图中数据表示未知化合物。
为了显示发酵后麦芽汁中挥发性化合物的变化规律和相对含量,进行了指纹图谱分析。各样品中挥发性化合物的差异见图5-a。在GC-IMS中观察到的挥发性化合物的显著差异被标记为指纹,化合物的含量随信号强度而变化。如图5-a所示,红框中的物质在发酵后含量增加,如2-丁酮和乙酸乙酯,其中乙酸乙酯具有明显的花果香(苹果香和菠萝香),是各种水果与花香的主要来源[30];橘框中的物质是发酵后新产生的特殊风味物质,如2-辛酮、反式-2-己烯醇和丁酸叶醇酯,其中丁酸叶醇酯呈新鲜水果的青香香气,微带奶油似芳香;绿框中的物质在发酵后逐渐减少,如正丁醛、2-甲基丁醇和丙酸,其中正丁醛和丙酸均呈难闻的刺激性气味,发酵后浓度降低证明发酵有助于麦芽汁良好风味的形成;蓝框中的物质在发酵后未检测到,如异丁醇、2-乙基呋喃和2-甲基丁酸。
3 结论
本文从水开菲尔粒中分离得到29株细菌菌株(分别隶属于6种不同细菌菌种),经鉴定为G.oxydans、A.syzygii、A.persici、L.casei、L.nagelii和L.satsumensis。在此基础上,选择6株不同种属的菌株用于麦芽汁发酵特性的研究。结果表明,经过6株不同的菌株发酵后麦芽汁的乙醇含量均低于0.1%(体积分数);6株菌中L.satsumensis在麦芽汁中的长势最好,适合在麦芽汁基质中生长。且经L.satsumensis发酵后总黄酮含量显著高于未发酵的原麦汁,且总酚含量和抗氧化活性也有轻微提高,感官评价和电子舌的评分最好。同时,经L.satsumensis发酵后还保留了原麦芽汁中的香气成分,如苯乙醛和乙酸乙酯并新产生了2-乙酰基呋喃、甲基麦芽酚、和丁酸叶醇酯等具有良好风味的物质,使得发酵后麦芽汁中香气更加饱满。综上所述,L.satsumensis发酵的麦芽汁效果最好,提高了麦芽汁的营养价值,改善了麦芽汁的品质和风味,获得了更高的感官接受度,具有应用于发酵麦芽汁的潜力。本研究可拓展麦芽汁的发酵加工菌种资源,丰富谷物发酵制品的种类和产品风味。
[1] TOMKOV -DR
-DR BKOV
BKOV L, PSOTA V, SACHAMBULA L, et al.Changes in polyphenol compounds and barley laccase expression during the malting process[J].Journal of the Science of Food and Agriculture, 2016, 96(2):497-504.
L, PSOTA V, SACHAMBULA L, et al.Changes in polyphenol compounds and barley laccase expression during the malting process[J].Journal of the Science of Food and Agriculture, 2016, 96(2):497-504.
[2] 凌俊红, 王金辉, 王楠, 等.大麦芽的化学成分[J].沈阳药科大学学报, 2005, 22(4):267-270.LING J H, WANG J H, WANG N, et al.Studies on the chemical constituents of malt[J].Journal of Shenyang Pharmaceutical University, 2005, 22(4):267-270.
[3] WOOD P J.Cereal β-glucans in diet and health[J].Journal of Cereal Science, 2007, 46(3):230-238.
[4] MARTINEZ-GOMEZ A, CABALLERO I, BLANCO C A.Phenols and melanoidins as natural antioxidants in beer.Structure, reactivity and antioxidant activity[J].Biomolecules, 2020, 10(3):400.
[5] TU C H, AZI F, HUANG J, et al.Quality and metagenomic evaluation of a novel functional beverage produced from soy whey using water kefir grains[J].LWT, 2019, 113:108258.
[6] 高芫超,肖爱波,王成, 等.水开菲尔和水开菲尔粒细菌多样性分析及乳酸菌分离鉴定[J].粮油食品科技, 2022, 30(1):182-189.GAO Y C, XIAO A B, WANG C, et al.Bacterial diversity analysis of water kefir and water kefir granules and isolation and identificationof lactic acid bacteria[J].Science and Technology of Cereals, Oils and Foods, 2022, 30(1):182-189.
[7] HAMPTON J, TANG C, JAYASREE SUBHASH A, et al.Assessment of pear juice and puree as a fermentation matrix for water kefir[J].Journal of Food Processing and Preservation, 2021, 45(3):e15223.
[8] BUENO R S, RESSUTTE J B, HATA N N Y, et al.Quality and shelf life assessment of a new beverage produced from water kefir grains and red pitaya[J].LWT, 2021, 140:110770.
[9] ALRADDADI F A J, ROSS T, POWELL S M.Evaluation of the microbial communities in kefir grains and kefir over time[J].International Dairy Journal, 2023, 136:105490.
[10] 陈树俊, 王婉榕.响应面优化开菲尔藜麦发酵乳及其抗氧化分析[J].食品与发酵工业, 2021, 47(20):232-238.CHEN S J, WANG W R.Optimization of quinoa fermented drink with kefir by response surface methodology and its antioxidant properties[J].Food and Fermentation Industries, 2021, 47(20):232-238.
[11] 何明迎. 奶啤菌种的优选、冻干菌粉的制备及奶啤发酵工艺的研究[D].镇江:江苏大学, 2021.HE M Y.Study on the optimization of milk beer strains, the preparation of freeze-dried bacterial powder and the fermentation process of milk beer[D].Zhenjiang:Jiangsu University, 2021.
[12] SYROKOU M K, PAPADELLI M, NTAIKOU I, et al.Sugary kefir:Microbial identification and biotechnological properties[J].Beverages, 2019, 5(4):61.
[13] 周雪琴, 刘良忠.枯草芽孢杆菌筛选及其产纳豆激酶的液态发酵条件优化[J].食品工业科技, 2022, 43(7):163-169.ZHOU X Q, LIU L Z.Screening of Bacillus subtilis and optimization of liquid fermentation conditions for nattokinase production[J].Science and Technology of Food Industry, 2022, 43(7):163-169.
[14] 刘仁禄. 复合菌种发酵麦汁的工艺研究[D].武汉:武汉轻工大学, 2015.LIU R L.Study on technology of composite bacteria fermented wort[D].Wuhan:Wuhan Polytechnic University, 2015.
[15] CHEN J, LIN B, ZHENG F J, et al.Characterization of the pure black tea wine fermentation process by electronic nose and tongue-based techniques with nutritional characteristics[J].ACS Omega, 2023, 8(13):12538-12547.
[16] HE Z, CHEN H Y, WANG X Y, et al.Effects of different temperatures on bacterial diversity and volatile flavor compounds during the fermentation of Suancai, a traditional fermented vegetable food from northeastern China[J].LWT, 2020, 118:108773.
[17] G![]() SIOR J, KAWA-RYGIELSKA J, KUCHARSKA A Z.Carbohydrates profile, polyphenols content and antioxidative properties of beer worts produced with different dark malts varieties or roasted barley grains[J].Molecules, 2020, 25(17):3882.
SIOR J, KAWA-RYGIELSKA J, KUCHARSKA A Z.Carbohydrates profile, polyphenols content and antioxidative properties of beer worts produced with different dark malts varieties or roasted barley grains[J].Molecules, 2020, 25(17):3882.
[18] NARDINI M, GARAGUSO I.Characterization of bioactive compounds and antioxidant activity of fruit beers[J].Food Chemistry, 2020, 305:125437.
[19] 董江清, 林晓珊, 林旭广, 等.新型固定化酵母细胞发酵生产乙醇的研究[J].安徽农业科学, 2011, 39(24):15001-15002;15006.DONG J Q, LIN X S, LIN X G, et al.The research of newly immobilized yeast's fermentation of ethanol[J].Journal of Anhui Agricultural Sciences, 2011, 39(24):15001-15002;15006.
[20] VINGRYS K, MATHAI M, ASHTON J F, et al.The effect of malting on phenolic compounds and radical scavenging activity in grains and breakfast cereals[J].Journal of Food Science, 2022, 87(9):4188-4202.
[21] SURIANO S, IANNUCCI A, CODIANNI P, et al.Phenolic acids profile, nutritional and phytochemical compounds, antioxidant properties in colored barley grown in southern Italy[J].Food Research International, 2018, 113:221-233.
[22] XIA Y N, ZHA M S, FENG C C, et al.Effect of a co-fermentation system with high-GABA-yielding strains on soymilk properties:Microbiological, physicochemical, and aromatic characterisations[J].Food Chemistry, 2023, 423:136245.
[23] LIU Z, LIU L X, HAN Q D, et al.Quality assessment of rose tea with different drying methods based on physicochemical properties, HS-SPME-GC-MS, and GC-IMS[J].Journal of Food Science, 2023, 88(4):1378-1391.
[24] 韩珍琼, 彭凌.乳酸菌发酵麦芽汁果汁复合饮料的研制[J].食品工业科技, 2004, 25(1):87-89.HAN Z Q, PENG L.Development of complex beverage fermented by lactic acid bacteria with wort juice[J].Science and Technology of Food Industry, 2004, 25(1):87-89.
[25] MENEZES A G T, RAMOS C L, DIAS D R, et al.Combination of probiotic yeast and lactic acid bacteria as starter culture to produce maize-based beverages[J].Food Research International, 2018, 111:187-197.
[26] 胡雨晴, 牛秀梅, 王美美, 等.黑果腺肋花楸红树莓复合饮料配方优化及贮藏品质研究[J].食品工业科技, 2023, 44(4):234-242.HU Y Q, NIU X M, WANG M M, et al.Optimization of formula of Aronia melanocarpa and Rubusidaeus L.compound beverage and its storage quality[J].Science and Technology of Food Industry, 2023, 44(4):234-242.
[27] WANG S, ZHANG L M, QI L B, et al.Effect of synthetic microbial community on nutraceutical and sensory qualities of kombucha[J].International Journal of Food Science and Technology, 2020, 55(10):3327-3333.
[28] 费永涛, 黄一鹤, 屈春云, 等.覆盆子乳酸菌饮料发酵工艺优化及挥发性风味物质分析[J].中国酿造, 2023, 42(7):214-220.FEI Y T, HUANG Y H, QU C Y, et al.Optimization of fermentation process and volatile flavor substances of raspberry lactic acid bacteria beverage[J].China Brewing, 2023, 42(7):214-220.
[29] 廖鹏飞, 王松, 王哲, 等.同时蒸馏萃取结合GC-MS分析酿酒五粮原料蒸煮香气成分[J].食品科学, 2023, 44(6):235-243.LIAO P F, WANG S, WANG Z, et al.Analysis of aroma components of five steamed grains for production of Nongxiangxing Baijiu by simultaneous distillation and extraction combined with gas chromatography-mass spectrometry[J].Food Science, 2023, 44(6):235-243.
[30] 张卜升, 高杏, 闫昕, 等.基于GC-IMS技术分析石榴果酒酿制过程中挥发性风味成分的变化[J].食品与发酵工业, 2022, 48(7):252-257.ZHANG B S, GAO X, YAN X, et al.Changes of volatile flavor components during brewing of pomegranate wine based on GC-IMS[J].Food and Fermentation Industries, 2022, 48(7):252-257.