肠道渗透压环境的剧烈波动会显著影响肠道微生物群落的组成和丰度,不仅会干扰宿主与共生菌之间的平衡关系,还能削弱宿主对病原体的免疫防御能力[1-2]。大肠杆菌Nissle1917(Escherichia coli Nissle1917,EcN)是一种革兰氏阴性菌,具有抑制有害细菌生长和繁殖的能力[3-4],能够调节肠道菌群平衡,改善肠道环境[5]。因此,其被广泛应用于预防和治疗炎症性肠病(inflammatory bowel disease,IBD),是最广泛的益生菌之一[6]。EcN的K5荚膜多糖和H1血清型鞭毛能够促进该菌在肠道中有效定植和黏附[7-8]。然而,在高渗透压条件下,EcN的生长会受到抑制。EcN的ProU基因座编码具有高亲和力的甘氨酸甜菜碱转运系统,高渗透压诱导的ProU基因座的转录与表达被用于渗透调节[9]。该甘氨酸甜菜碱转运系统由ATP酶ProV、内膜蛋白ProW和细胞周质配体结合蛋白ProX组成[10]。
为了在高渗透压环境中生长,细菌通过摄取或生物合成相容性溶质来平衡细胞内外渗透压[11]。甘氨酸甜菜碱(glycine betaine,GB)作为最常见的生物相容性溶质之一,在渗透压胁迫下能够通过被动扩散进入细胞周质空间[12]。它与具有高亲和力和特异性的ProX结合形成底物转运复合物,并通过嵌入细胞内膜的蛋白ProW将其输送至细胞内部,而ATP酶ProV则为GB的输送过程提供能量[13-14]。高渗透环境中,细胞内高浓度的GB不仅可以平衡细胞内外渗透压,还能保护细胞内的酶活力[9, 15]。因此,GB对于维持细胞内稳态,以及确保细菌正常的生长和繁殖具有重要意义。
为了深入了解大肠杆菌的渗透调控机制,并寻找新的天然细菌渗透调节剂,本研究采用了高通量虚拟筛选(high-throughput virtual screening,HTVS)、标准精度(standard precision,SP)和额外精度(extra precision,XP)对接等计算方法,对大量的潜在配体进行了筛选。通过分子力学广义波恩表面积计算(molecular mechanics generalized born surface area,MM-GBSA)评分和分子动力学(molecular dynamics,MD)模拟进一步评估了配体的结合效果和稳定性,从中筛选出了具有潜力的候选配体。
1 材料与方法
1.1 硬件与软件
本研究采用12th Gen Intel® CoreTM i5-12500处理器、512 GB硬盘进行虚拟筛选和对接。系统运行在Windows 11操作系统上,并搭配NVIDIA GeForce RTX 3050 Laptop GPU 4GB显卡。研究使用Schrödinger软件(Schrödinger,LLC,NY,USA)的不同模块进行虚拟筛选、分子对接以及MM-GBSA分析研究,使用GROMACS进行分子动力学模拟研究。
1.2 配体准备
通过筛选自然产物库,使用Schrödinger套件里的Glide模块(Glide,Schrödinger,LLC,NY,USA)从MCE(https://www.medchemexpress.cn)获得ProX蛋白的天然产物配体。MCE化学品的天然产物库收录了1 367种商业化天然产物。在进行虚拟筛选和分子对接之前,所有天然产物(或配体)都在LigPrep(LigPrep,Schrödinger,LLC,NY,USA)中预处理。在Epik(Epik,Schrödinger,LLC,NY,USA)的处理下,配体的离子化状态在pH值7.0±2.0下生成,然后进行配体脱盐。对于任何给定的配体,最多产生32个立体异构体。使用经过优化的OPLS4力场进行液体模拟,对配体进行能量最小化处理,并保持其他参数为默认值。
1.3 蛋白质的准备和网格的生成
从PDB数据库(http://www.rcsb.org/pdb)中检索到ProX的X射线晶体结构(PDB Id:1R9L)[17]。使用Glide软件中的“Protein Preparation Workflow”添加缺失的氢原子、分配键序并删除其他杂原子。同时,去除与蛋白质或配体相互作用少于2个氢键的水分子。使用Prime(Prime,Schrödinger,LLC,NY,USA)软件添加缺失环和侧链。对蛋白质进行优化,利用Epik在pH值7.0±0.5下生成蛋白质的电离状态,建立氢键网络,使用OPLS4力场最小化能量。在Schrödinger套件中利用受体-网格生成模块,选择将配体作为网格盒生成文件压缩包,以待进行后续的分子对接。
1.4 HTVS、SP和XP对接
刚性对接HTVS近似将配体和受体视为刚性,不考虑构象的变化,排除任何类型的柔性[18]。柔性XP对接是同时考虑配体空间构象和蛋白质受体的变化,柔性对接比刚性对接更适用于精确观测靶点与配体之间的对接状况[18]。
使用Ligand Docking(Ligand Docking,Schrödinger)对天然化合物库中的配体进行刚性HTVS对接,参数设置默认。将docking score得分<-7的配体从HTVS中过滤出来,在保持默认设置不变的情况下继续进行半柔性SP对接。将docking score得分<-9的配体从SP对接结果中过滤出来,默认参数不变继续进行柔性XP对接。
1.5 MM-GBSA
MM-GBSA是一种用于计算蛋白质-配体复合物结合自由能的方法。该方法采用OPLS4力场、VSGB溶剂模型和旋转子搜索算法[19]进行计算。根据之前的研究[20],在本研究中使用Schrödinger套件的Prime模块计算MM-GBSA。默认情况下,所有蛋白质原子都被视为刚性,而所有配体原子则被松弛处理。根据结合自由能对蛋白质-配体复合物进行排序。
1.6 MD模拟
使用系统方法建立了蛋白质-配体复合物系统进行MD模拟。首先,通过进行50 000步的最陡下降算法能量最小化步骤来放松初始结构并消除空间冲突。为了中和蛋白质-溶剂系统的电荷,每个复合物都单独使用TIP3P水模型进行溶剂化,并添加适当的离子以保持系统中性。在溶剂化后,在生产MD运行之前对系统进行稳定性平衡处理。平衡过程包括100 ps的NVT加热阶段,在此阶段通过恒温器将系统从0 K逐渐升温至310 K。随后,在0.1 MPa压力和310 K温度下,利用压力稳定器控制压力,并经历100 ps的NPT平衡阶段。最后,在310 K下执行100 ns的生产MD运行,其中使用恒温器维持温度,并借助压力稳定器将压力控制在0.1 MPa范围内。为了分析MD模拟过程中复合物内部相互作用,对平衡构象采用分层聚类方法进行聚类,并从这些簇中选择最大的中心结构进行进一步分析。利用分子可视化软件生成立体图像来直观展示和研究所选结构内部相互作用。
2 结果与分析
2.1 ProX潜在配体的虚拟筛选
本实验使用的计算方法是一种广泛应用于新型酶抑制剂药物发现的技术[20]。本研究使用了MedChemExpress(MCE)中1 367种高度生物活性且商业化的天然化合物,用于筛选针对ProX结构域的潜在配体。在使用LigPrep处理配体之后,共有3 012个配体构象进行了HTVS。根据对接分数(≤-7.0 kcal/mol),从3 012个构象中筛选出了90种化合物。这90种化合物经过标准精度(SP)对接进一步筛选,选择SP对接后对接分数≤-9.0 kcal/mol的14种活性化合物。最终,通过额外精度(XP)对接确定具有最低结合能量的先导化合物,表1列举了XP对接分数≤-11 kcal/mol的7种活性化合物。其中,发现D-荞麦碱(对接得分为-12.266 kcal/mol)是具有最高生物活性的先导化合物。甘氨酸甜菜碱是ProX的天然配体,XP对接得分(-12.194 kcal/mol)稍次于D-荞麦碱。
表1 XP对接中对接分数≤-11.0 kcal/mol的化合物
Table 1 Compounds with docking scores ≤-11.0 kcal/mol in XP docking
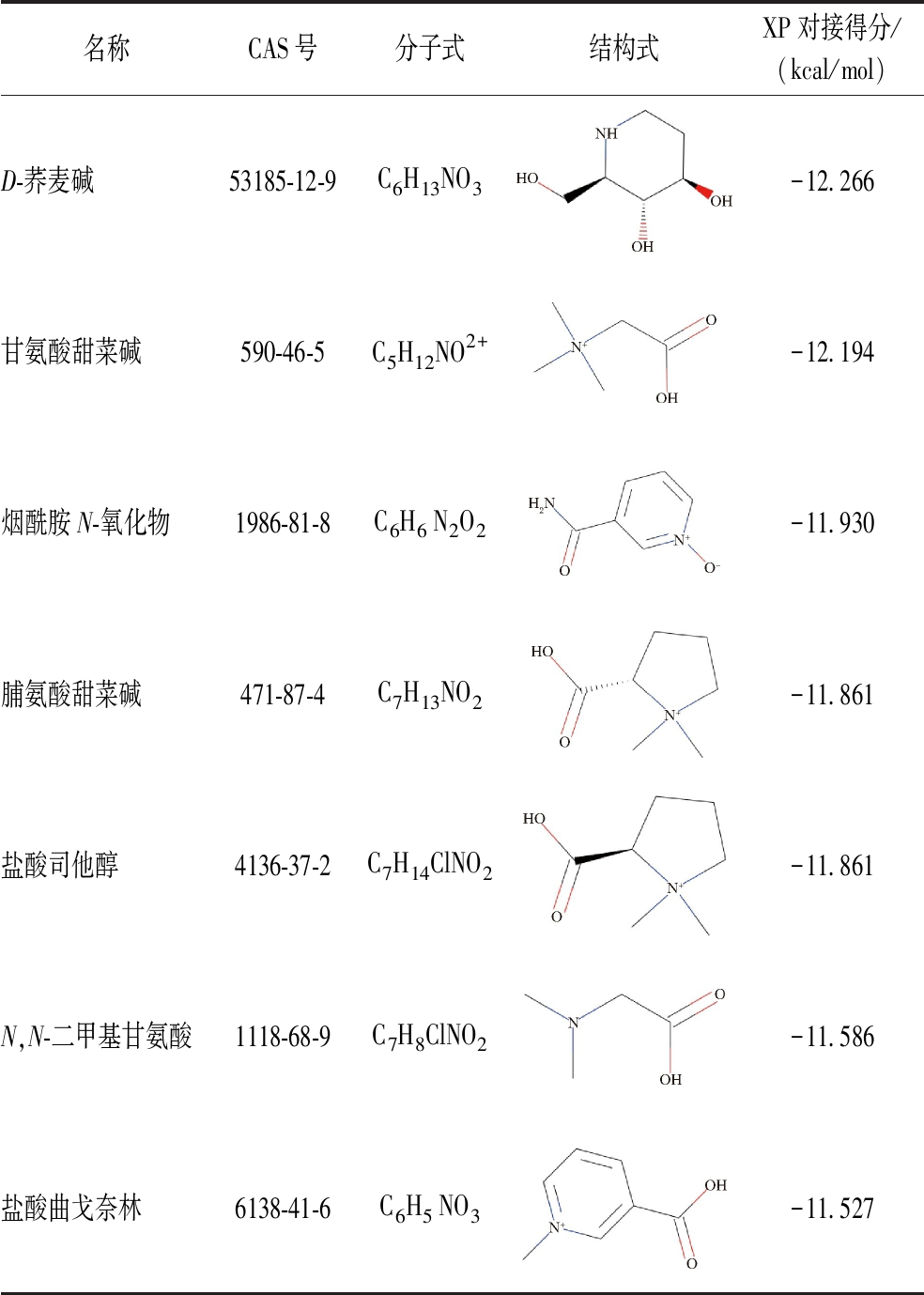
名称CAS号分子式结构式XP对接得分/(kcal/mol)D-荞麦碱53185-12-9C6H13NO3-12.266甘氨酸甜菜碱590-46-5C5H12NO2+-12.194烟酰胺N-氧化物1986-81-8C6H6 N2O2-11.930脯氨酸甜菜碱471-87-4C7H13NO2-11.861盐酸司他醇4136-37-2C7H14ClNO2-11.861N,N-二甲基甘氨酸1118-68-9C7H8ClNO2-11.586盐酸曲戈奈林6138-41-6C6H5 NO3-11.527
2.2 MM-GBSA计算
MM-GBSA是一种具有高度精确性和可靠性的受体-配体稳定性评估方法,因为它考虑了溶剂对复合物稳定性的影响,能够更准确地反映生物体系中的实际情况。实验计算了XP对接得分≤-12 kcal/mol的化合物的MM-GBSA能量。结果发现,D-荞麦碱具有最低的MM-GBSA结合能(-40.05 kcal/mol),其次是甘氨酸甜菜碱(-35.31 kcal/mol)。D-荞麦碱的MM-GBSA能量低于甘氨酸甜菜碱,表明ProX和D-荞麦碱可结合形成稳定的复合物。
2.3 D-荞麦碱与ProX结构域的相互作用
D-荞麦碱 (1,2-二脱氧野尻霉素)是一种六元环亚氨基糖,最初是从荞麦种子中分离得到[21];其羟基的空间构型与D-葡萄糖和D-甘露糖相同。D-荞麦碱作为一种温和的糖苷酶抑制剂[22],是功能性食品成分的合适候选者。研究发现,D-荞麦碱可以有效调节餐后血糖水平,避免血糖过高,且D-荞麦碱可调节肠道细菌的黏附[23],不仅可选择性地凝集潜在有害的肠杆菌科,阻止它们黏附在肠黏膜上,还可促进了乳酸杆菌属的黏附。
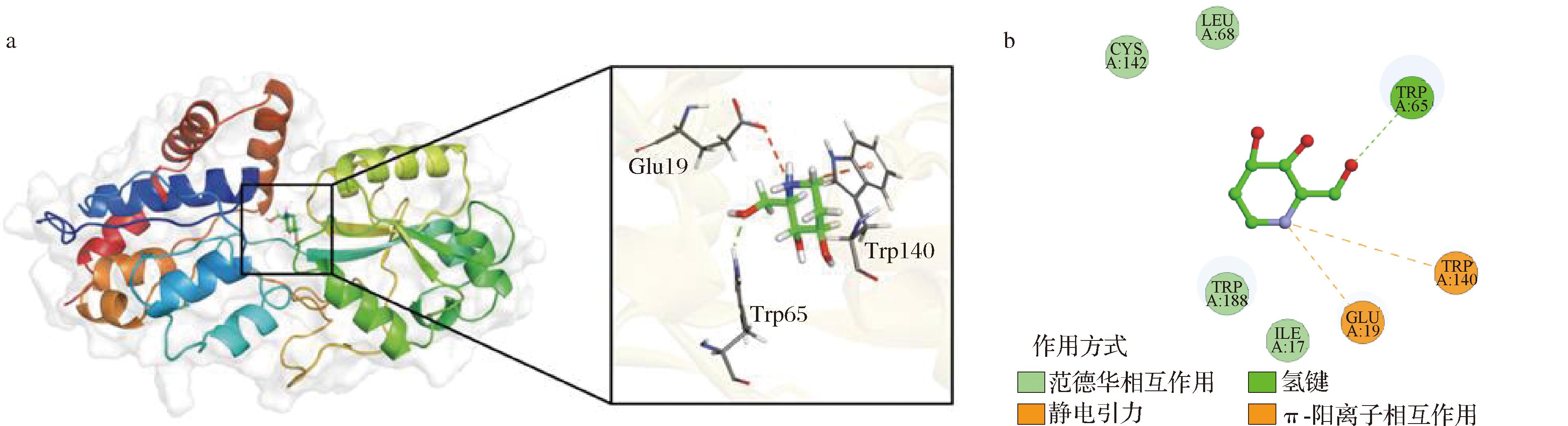
将D-荞麦碱与ProX进行分子对接发现,两者形成了一个稳定的复合物,ProX中参与稳定D-荞麦碱-ProX复合物的不同氨基酸残基见图1-a;D-荞麦碱与ProX的结合图见图1-b。D-荞麦碱可以与ProX蛋白的GLY141、GLU20残基形成氢键,与TRP140、TRP188残基形成了π-阳离子相互作用。同时ILE17、TRP140、TRP188、TYR186等关键残基也与配体形成疏水作用力,有助于配体与ProX蛋白的稳定结合。
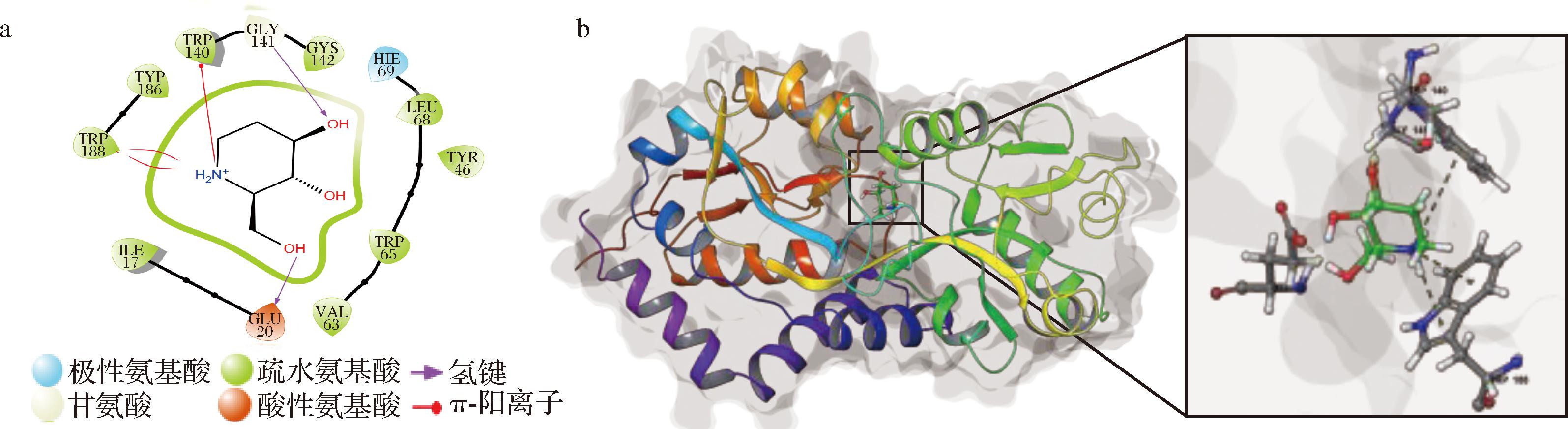
a-ProX中参与稳定D-荞麦碱-ProX复合物的不同氨基酸残基;b-D-荞麦碱与ProX结构域的结合
图1 D-荞麦碱在ProX活性位点的分子对接
Fig.1 Molecular docking of D-fagomine at the active site of ProX
以甘氨酸甜菜碱作为阳性对照,通过分子对接分析(图2),发现甜菜碱也与TRP140、TRP188残基形成π-阳离子相互作用,与GLY141残基形成氢键。这些结果揭示了D-荞麦碱与ProX蛋白的相互作用,为D-荞麦碱作为潜在渗透调节剂的生物活性提供了结构基础。
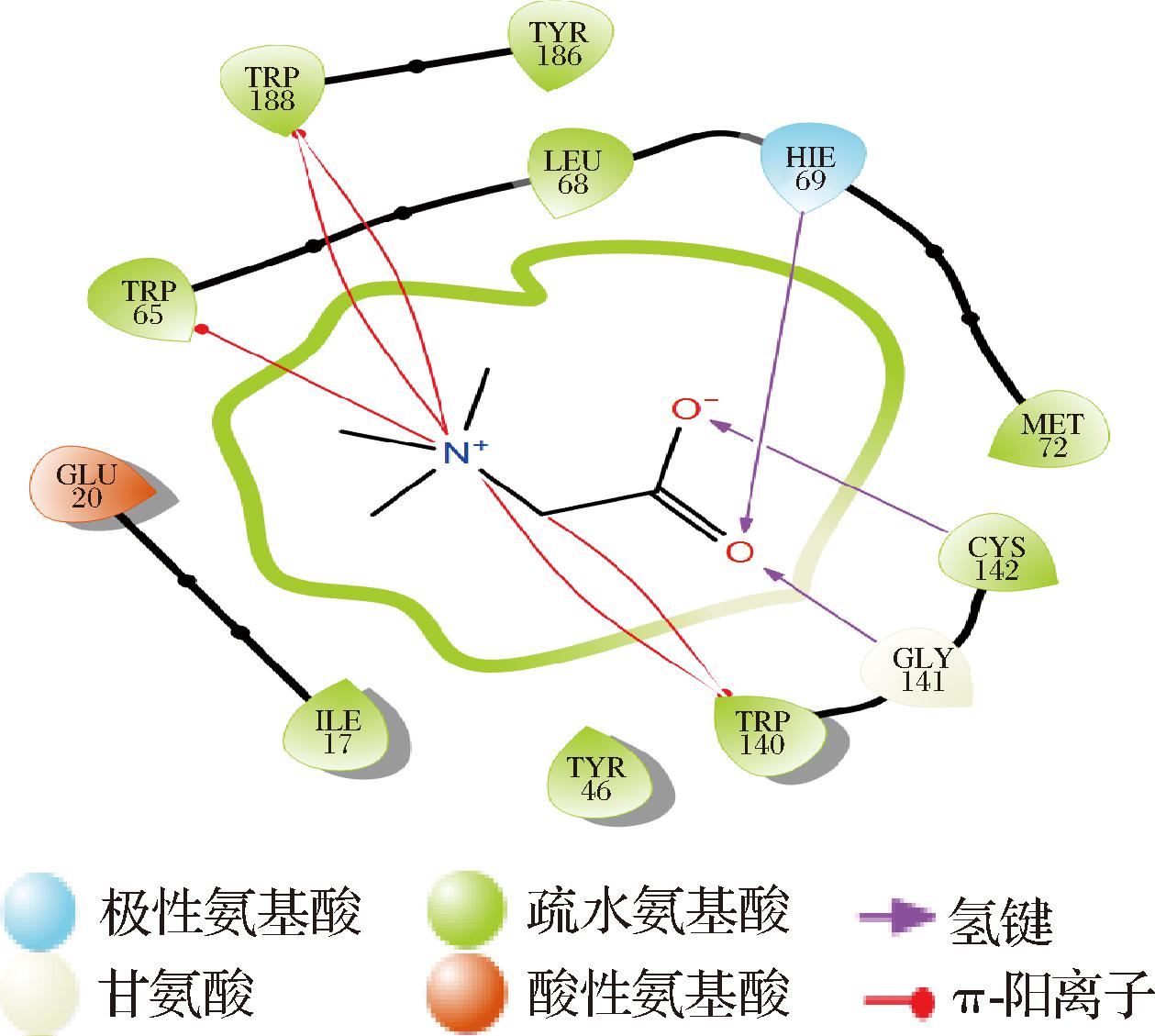
图2 GB在ProX活性位点的分子对接
Fig.2 Molecular docking of GB at the active site of ProX
2.4 MD模拟
为了进一步研究D-荞麦碱-ProX复合物的稳定性,对D-荞麦碱和蛋白-配体复合物进行MD模拟。将MD模拟扩展到了100 ns,结果见图3。通过蛋白质主链的均方根偏差(root mean square deviation,RM)分析发现,在大约5 000 ps后,配体的构象开始变得稳定,表明复合物达到了相对稳定的状态。此外,蛋白质骨架的RMSD没有显著偏移,说明整个模拟过程中蛋白质整体结构保持稳定。同时,实验还监测了蛋白质回转半径(radius of gyration,Rg),以评估其紧凑性和折叠稳定性。在整个100 ns模拟过程中,Rg值保持相对恒定,表明蛋白质没有发生重大结构变化,结果证实D-荞麦碱-ProX复合物在模拟过程中形成了一个稳定的结构。
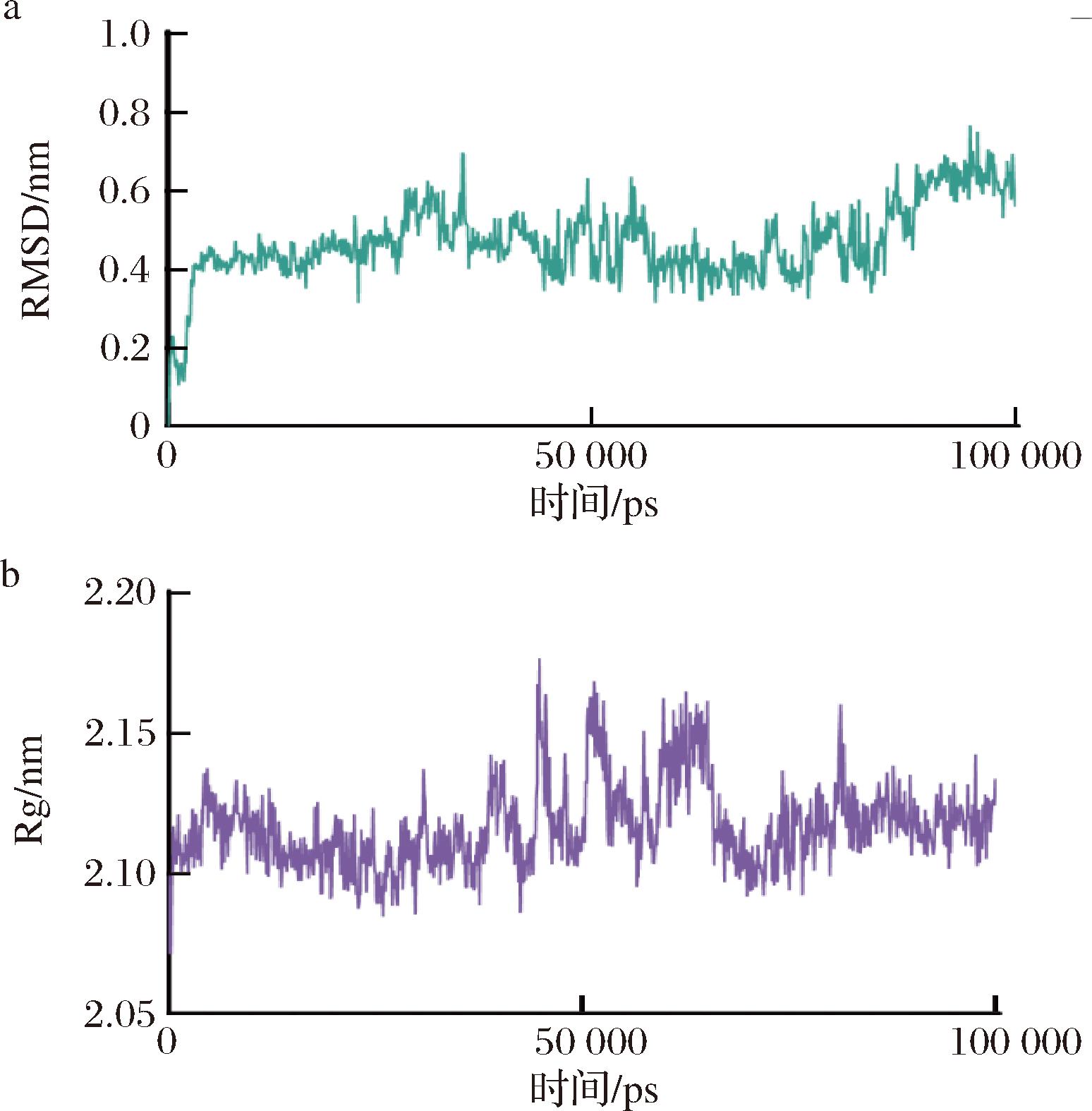
a-D-荞麦碱-ProX对接复合物的RMSD曲线;b-D-荞麦碱-ProX对接复合物的Rg曲线
图3 D-荞麦碱与ProX复合物在100 ns的MD模拟
Fig.3 100 ns MD simulation of the D-fagomine-ProX complex
通过MD模拟可以发现,D-荞麦碱与ProX结构域之间形成了特定的相互作用(图4),如与配体形成静电相互作用的GLU16和TRP140,以及形成氢键的TRP65,均有助于复合物的稳定性。这些相互作用在整个100 ns模拟期间保持不变,并进一步证实这些残基在维持ProX活性位点内结合和稳定D-荞麦碱上起着重要作用。综上所述,D-荞麦碱所呈现出来的稳定构象以及其与蛋白质持续发生相互作用,支持持久和功能相关的复合物的形成。
a-动力学模拟中D-荞麦碱与ProX结构域的结合;b-ProX中参与稳定D-荞麦碱ProX复合物的关键氨基酸残基
图4 100 ns MD模拟中与D-荞麦碱相互作用密切相关的氨基酸残基
Fig.4 Amino acid residues closely interacting with D-fagomine during the 100 ns MD simulation
3 结论
本研究采用分子对接和MD模拟筛选MCE的天然化合物库,以确定ProX结构域的潜在配体。经分子对接实验筛选出了一个潜在的ProX蛋白靶点配体D-荞麦碱。对接结果表明,D-荞麦碱与ProX的XP对接得分和甘氨酸甜菜碱相当,均≤-12 kcal/mol。经MM-GBSA分析计算结合自由能后发现,D-荞麦碱与ProX的结合自由能优于原本的天然配体甘氨酸甜菜碱。通过分析配体与靶点的相互作用发现,ProX中的氨基酸残基TRP140、TRP188、GLY141在与D-荞麦碱和甘氨酸甜菜碱的静态相互作用中均有贡献。为了进一步探索D-荞麦碱-ProX复合物的稳定性,将MD模拟扩展到了100 ns进行动态模拟分析,结果表明D-荞麦碱-ProX复合物具有长期稳定性,显示了D-荞麦碱作为一种天然产物,具备了作为潜在渗透调节剂的巨大潜力。这些研究结果为D-荞麦碱提供了在健康领域中的潜在运用价值,还为发现其他天然渗透调节剂的研究提供了有益参考。
[1] KARIN M, LAWRENCE T, and NIZET V.Innate immunity gone awry:Linking microbial infections to chronic inflammation and cancer[J].Cell, 2006, 124(4):823-835.
[2] FAVA F, DANESE S.Intestinal microbiota in inflammatory bowel disease:Friend of foe?[J].World Journal of Gastroenterology, 2011, 17(5):557-566.
[3] BEHROUZI A, MAZAHERI H, FALSAFI S, et al.Intestinal effect of the probiotic Escherichia coli strain Nissle 1917 and its OMV[J].Journal of Diabetes and Metabolic Disorders, 2020, 19(1):597-604.
[4] PARK J, KIM D H, KIM S, et al.Anti-inflammatory properties of Escherichia coli Nissle 1917 in a murine colitis model[J].Intestinal Research, 2021, 19(4):478-481.
[5] WANG Y R, SUN L, CHEN S W, et al.The administration of Escherichia coli Nissle 1917 ameliorates irinotecan-induced intestinal barrier dysfunction and gut microbial dysbiosis in mice[J].Life Sciences, 2019.231:116529.
[6] LASARO M A, SALINGER N, ZHANG J, et al.F1C fimbriae play an important role in biofilm formation and intestinal colonization by the Escherichia coli commensal strain nissle 1917[J].Applied and Environmental Microbiology, 2009, 75(1):246-251.
[7] HAFEZ M, HAYES K, GOLDRICK M, et al.The K5 capsule of Escherichia coli strain Nissle 1917 is important in stimulating expression of Toll-like receptor 5, CD14, MyD88, and TRIF together with the induction of interleukin-8 expression via the mitogen-activated protein kinase pathway in epithelial cells[J].Infection and Immunity, 2010, 78(5):2153-2162.
[8] KLETA S, NORDHOFF M, TEDIN K, et al.Role of F1C fimbriae, flagella, and secreted bacterial components in the inhibitory effect of probiotic Escherichia coli Nissle 1917 on atypical enteropathogenic E.coli infection[J].Infection and Immunity, 2014, 82(5):1801-1812.
[9] STIRLING D A, HULTON C S J, WADDELL L, et al.Molecular characterization of the proU loci of Salmonella typhimurium and Escherichia coli encoding osmoregulated glycine betaine transport systems[J].Molecular Microbiology, 1989, 3(8):1025-1038.
[10] GOWRISHANKAR J.Nucleotide sequence of the osmoregulatory proU operon of Escherichia coli[J].Journal of Bacteriology, 1989, 171(4):1923-1931.
[11] WOOD J M.Bacterial osmoregulation:A paradigm for the study of cellular homeostasis[J].Annual Review of Microbiology, 2011, 65:215-238.
[12] FAATZ, E, MIDDENDORF A, and BREMER E.Cloned structural genes for the osmotically regulated binding-protein-dependent glycine betaine transport system (ProU) of Escherichia coli K-12[J].Molecular Microbiology, 1988, 2(2):265-279.
[13] HIGGINS C F.ABC transporters:From microorganisms to man[J].Annual Review of Cell Biology, 1992, 8:67-113.
[14] FETSCH E E and A L DAVIDSON.Vanadate-catalyzed photocleavage of the signature motif of an ATP-binding cassette (ABC) transporter[C].Proceedings of the National Academy of Sciences of the United States of America, 2002, 99(15):9685-9690.
[15] CAIRNEY J, BOOTH I R, HIGGINS C F.Osmoregulation of gene expression in Salmonella typhimurium:ProU encodes an osmotically induced betaine transport system[J].Journal of Bacteriology, 1985, 164(3):1224-1232.
[16] SCHIEFNER A, BREED J, BÖSSER L, et al.Cation-pi interactions as determinants for binding of the compatible solutes glycine betaine and proline betaine by the periplasmic ligand-binding protein ProX from Escherichia coli[J].Journal of Biological Chemistry, 2004, 279(7):5588-5596.
[17] 刘玉甜, 赵诗雨, 吕邵娃.基于分子对接的计算机虚拟筛选技术在新药发现中的应用进展[J].化学工程师, 2020, 34(2):59-63.LIU Y T, ZHAO S Y, LV S W.Application of virtual screening technology based on molecular docking in drug discovery[J].Chemical Engineer, 2020, 34(2):59-63.
[18] 王哲. 基于分子对接的虚拟筛选方法的评测、优化和应用[D].杭州:浙江大学, 2019.WANG Z.Evaluation, optimization and application of virtual screening method based on molecular docking[D].Hangzhou:Zhejiang University, 2019.
[19] GENHEDEN S, RYDE U.The MM/PBSA and MM/GBSA methods to estimate ligand-binding affinities[J].Expert Opinion on Drug Discovery, 2015, 10(5):449-461.
[20] ALAJMI M F, REHMAN M T, HUSSAIN A, et al.Pharmacoinformatics approach for the identification of Polo-like kinase-1 inhibitors from natural sources as anti-cancer agents[J].International Journal of Biological Macromolecules, 2018, 116:173-181.
[21] KOYAMA M and SAKAMURA S.The structure of a new piperidine derivative from buckwheat seeds(Fagopyrum esculentum moench)[J].Agricultural and Biological Chemistry, 1974, 38(5):1111-1112.
[22] KATO A, ASANO N, KIZV H, et al.Fagomine isomers and glycosides from Xanthocercis zambesiaca[J].Journal of Natural Products, 1997, 60(3):312-314.
[23] G MEZ L, MOLINAR-TORIBIO E, CALVO-TORRAS M
MEZ L, MOLINAR-TORIBIO E, CALVO-TORRAS M  , et al.D-Fagomine lowers postprandial blood glucose and modulates bacterial adhesion[J].British Journal of Nutrition, 2012, 107(12):1739-1746.
, et al.D-Fagomine lowers postprandial blood glucose and modulates bacterial adhesion[J].British Journal of Nutrition, 2012, 107(12):1739-1746.