超高温处理是一种常用的食品热加工技术,已被广泛应用于乳制品的生产[1]。超高温瞬时灭菌(ultra-high temperature,UHT)技术在高温、短时间内对牛乳进行灭菌处理,不仅便于液态乳制品的保存和运输,而且延长了产品的保质期。在UHT处理过程中,牛乳中的蛋白质会发生部分变性和聚集,最终导致牛乳在贮藏期间形成沉淀或老化凝胶[2]。老化凝胶主要是乳清蛋白与酪蛋白相互作用的结果。在牛乳中,αs1、αs2、β-酪蛋白和κ-酪蛋白以及磷酸钙纳米团簇,可自组装形成酪蛋白胶束[3]。据报道,κ-酪蛋白在UHT处理过程中部分从酪蛋白胶束中解离到乳清相中[4]。因此,κ-酪蛋白与乳清蛋白之间的相互作用已被广泛报道[5]。然而,乳清蛋白是否与其他酪蛋白单体发生相互作用尚未被报道。由于目前酪蛋白单体的晶体结构尚不清楚,导致难以开展相关的研究。随着生物信息学技术的发展[6],蛋白质结构预测和分子动力学模拟为进一步揭示乳清蛋白与酪蛋白的互作提供了可能。
本研究旨在探究UHT处理下β-乳球蛋白(β-lactoglobulin,β-Lg)与酪蛋白之间的相互作用。首先分析了不同温度和时间制备的UHT乳老化凝胶的蛋白质组成,随后利用微量热涌动技术明确了β-Lg与α-酪蛋白、β-酪蛋白之间的亲和力及结合模式,最后通过蛋白质结构建模和分子动力学模拟,探究了酪蛋白单体与β-Lg的分子交互机制。本研究结果对优化超高温处理工艺,提高UHT乳制品品质具有重要指导意义。
1 材料与方法
1.1 材料与试剂
β-Lg(纯度≥ 90%),Sigma-Aldrich(上海,中国)。色谱级乙腈、三氟乙酸(trifluoroacetic acid,TFA),上海麦克林生化科技股份有限公司(上海,中国)。
1.2 仪器与设备
UHT pilot plant直接蒸汽注入系统,美国斯必克流体有限公司;Jeol JSM-5510扫描电子显微镜,日本电子株式会社;HT7800透射电子显微镜,日本日立公司;iBright FL1500凝胶成像系统,美国赛默飞世尔科技公司;Optima MAX-XP超速离心机,美国贝克曼库尔特有限公司;LC-2050液相色谱仪,日本岛津公司;Monolith NT.115 MST微量热泳动仪,德国NanoTemper 公司。
1.3 实验方法
1.3.1 UHT牛乳的制备
脱脂原料奶在蒙牛工厂(上海,蒙牛乳业有限公司)通过中试规模的热处理生产UHT牛乳。首先,将脱脂牛乳在75 ℃下预热30 s,然后通过直接蒸汽注入系统进行灭菌。采用10 种不同的温度和时间组合对牛乳进行超高温灭菌,包括 153 ℃ 0.25 s、147 ℃ 0.25 s、142 ℃ 0.25 s、157 ℃ 0.116 s、153 ℃ 0.116 s、147 ℃ 6 s、142 ℃ 6 s、147 ℃ 3 s、142 ℃ 3 s和 153 ℃ 3 s,均质后无菌分装,对应的样品编号分别为 1~10。UHT 牛乳样品在30 ℃的黑暗环境中贮藏,以模拟加速贮藏过程。
1.3.2 UHT乳老化凝胶的形貌观察
UHT牛乳老化凝胶沉淀冻干后,将其粘贴到黏性橡胶上,在样品表面喷涂金粉以增强导电性。使用工作在5 000 V的扫描电子显微镜以6 000×放大倍率拍摄粉末样品。
1.3.3 SDS-PAGE分析UHT乳老化凝胶乳的蛋白组成
将10份UHT牛乳样品按照1∶30(体积比)用去离子水稀释,与含有β-巯基乙醇的上样缓冲液混合后进行煮沸处理,持续10 min。5%丙烯酰胺浓缩凝胶和12%丙烯酰胺分离凝胶用于电泳实验,使用考马斯亮蓝染色后,并用凝胶成像系统对电泳结果进行分析。
1.3.4 酪蛋白胶束和β-Lg复合体系的制备
酪蛋白胶束参照THILL等[7]的方法制备。脱脂乳使用超速离心机在30 ℃、76 000×g条件下超速离心90 min。将获得的酪蛋白沉淀在37 ℃下搅拌2 h,然后向酪蛋白胶束悬浮液中添加β-Lg,终质量浓度达到3 mg/mL。根据超高温灭菌处理的常用参数[8],将复合物依次置于25 ℃(未处理)、75 ℃ 30 s(预热)和145 ℃ 3 s(超高温灭菌)条件下,以模拟UHT乳的加工过程。
1.3.5 酪蛋白胶束与β-Lg的结合测定
复合体系进行超高速离心分离酪蛋白胶束,使用HPLC检测上清液中β-Lg含量变化[9]。取20 μL样品注入反相 HPLC-UV系统。洗脱液 A 含有溶于水的0.1% (体积分数)TFA,洗脱液B含有 0.1% (体积分数) TFA的乙腈。分离温度设置为40 ℃,梯度为:30%~50% B,持续 35 min;50%~30% B,持续 5 min,流速为 1 mL/min。采用透射电子显微镜观察超高温灭菌处理后酪蛋白胶束和β-Lg 复合物的形态。
1.3.6 β-Lg与酪蛋白单体的亲和力测定
通过微量热法测定β-Lg与α-酪蛋白和β-酪蛋白单体的结合亲和力[10]。首先使用红色荧光染料 RED-NHS (磷酸盐缓冲盐溶液-吐温20)对β-Lg的赖氨酸残基进行共价标记,在PBST(红色荧光染料与NHS酯活性基团的结合体)缓冲液(含1.37 mol/L NaCl、26.8 mmol/L KCl、81 mmol/L Na2HPO4、17.6 mmol/L KH2PO4以及0.05% Tween20)进行稀释。未标记的α-酪蛋白和β-酪蛋白单体作为配体然后,分别取其10 μL与10 μL标记β-Lg混合,通过Monolith NT.115记录微量热泳动(microscale thermophoresis,MST)曲线,使用NanoTemper分析软件计算解离常数(Kd)。
1.3.7 β-Lg与酪蛋白单体的分子对接
利用C-I-TASSER构建αs1-酪蛋白, αs2-酪蛋白和β-酪蛋白单体结构模型,然后通过Ramachandran Plot分析了结构中每个氨基酸残基的二面角分布,评估蛋白质结构的合理性[11]。β-Lg 晶体结构来自于RCSB数据库(PDB:3 NPO),使用 Z-dock对β-Lg 和3种酪蛋白单体进行刚性对接,得到β-Lg 和酪蛋白的蛋白质复合体[12]。
1.3.8 β-Lg与酪蛋白单体的分子动力学模拟
基于GROMACS软件,采用amber 99 sb-ildn 力场进行蛋白质复合体分子动力学模拟[13]。利用 GROMACS 软件包进行了轨迹分析,包括均方根偏差(root-mean-square deviation,RMSD)、回转半径(radius of gyration, Rg)。分子力学泊松-玻尔兹曼表面积(molecular mechanics poisson-boltzmann surface area, MM-PBSA)量化β-Lg和酪蛋白之间的结合自由能。
2 结果与分析
2.1 UHT乳老化凝胶的形态观察
在30 ℃条件下,随着贮藏时间的延长,经过超高温灭菌后的脱脂奶出现了不稳定现象。如图1-a所示, UHT乳在贮藏180 d后,颜色从乳白色变为青色,并出现明显的胶状物质。DATTA等[14]发现超高温灭菌乳在30 ℃贮藏条件下,在 90~150 d会形成胶状沉淀,这与本研究观察结果一致。进一步使用扫描电子显微镜观察UHT乳老化凝胶的形貌,结果显示,凝胶表面粗糙多孔,质地紧实(图1-b),这与此前关于凝胶网络结构的研究报道有所不同[15],这种差异可能源于不同的老化凝胶形成机制。UHT乳老化凝胶的形成,可分为酶促和非酶作用2种情况。在酶促作用下,纤溶酶水解酪蛋白生成的蛋白片段会重排聚集形成复合体,促进老化凝胶形成三维网络结构。在非酶作用下,蛋白沉淀更容易形成紧实的凝胶。为了深入理解UHT乳老化凝胶的形成机制,进一步解析了老化凝胶中蛋白质成分及其相互作用。

a-UHT乳在贮藏过程中的老化凝胶;b-老化凝胶的形貌
图1 UHT乳的老化凝胶
Fig.1 Age gelation of UHT milk
2.2 UHT乳形成老化凝胶前后的蛋白质组成变化
在老化凝胶过程中,通过SDS-PAGE分析了10种不同UHT奶的蛋白质组成。如图2-a所示,未经热处理的鲜乳与UHT乳在蛋白质组成上没有显著差异,主要包括乳铁蛋白、牛血清蛋白、αs1-酪蛋白、αs2-酪蛋白、β-酪蛋白、κ-酪蛋白、β-Lg和α-乳白蛋白。这表明UHT处理很好地保留了牛乳营养成分[8]。然而,图2-b显示老化凝胶乳的SDS-PAGE条带与未发生老化凝胶的UHT乳显著不同,表明老化凝胶导致牛乳的蛋白质组成发生了变化。具体来说,老化凝胶奶中乳铁蛋白、酪蛋白和β-Lg的条带消失或变浅,α-酪蛋白、β-酪蛋白和κ-酪蛋白的含量减少。由于老化凝胶过程中形成了大量沉淀,酪蛋白可能从原来的牛乳体系转移到了凝胶。酪蛋白单体通常通过疏水或静电相互作用形成胶束形态[16],但图2-b显示大部分UHT牛乳中的α-酪蛋白消失,而β-酪蛋白和κ-酪蛋白在大多数老化凝胶乳样品中仍然存在。这表明在老化凝胶形成过程中,部分酪蛋白胶束可能解体,游离的酪蛋白单体进入到乳清相。在乳清蛋白中,β-Lg的条带颜色变淡,而α-乳白蛋白的条带颜色基本未变,表明β-Lg可能与酪蛋白胶束或酪蛋白单体结合形成凝胶,导致乳清中可溶性β-Lg含量降低。这一结果为抑制老化凝胶的形成提供了理论基础,即在UHT处理过程中应尽量避免或者降低β-Lg与酪蛋白之间的交互作用。
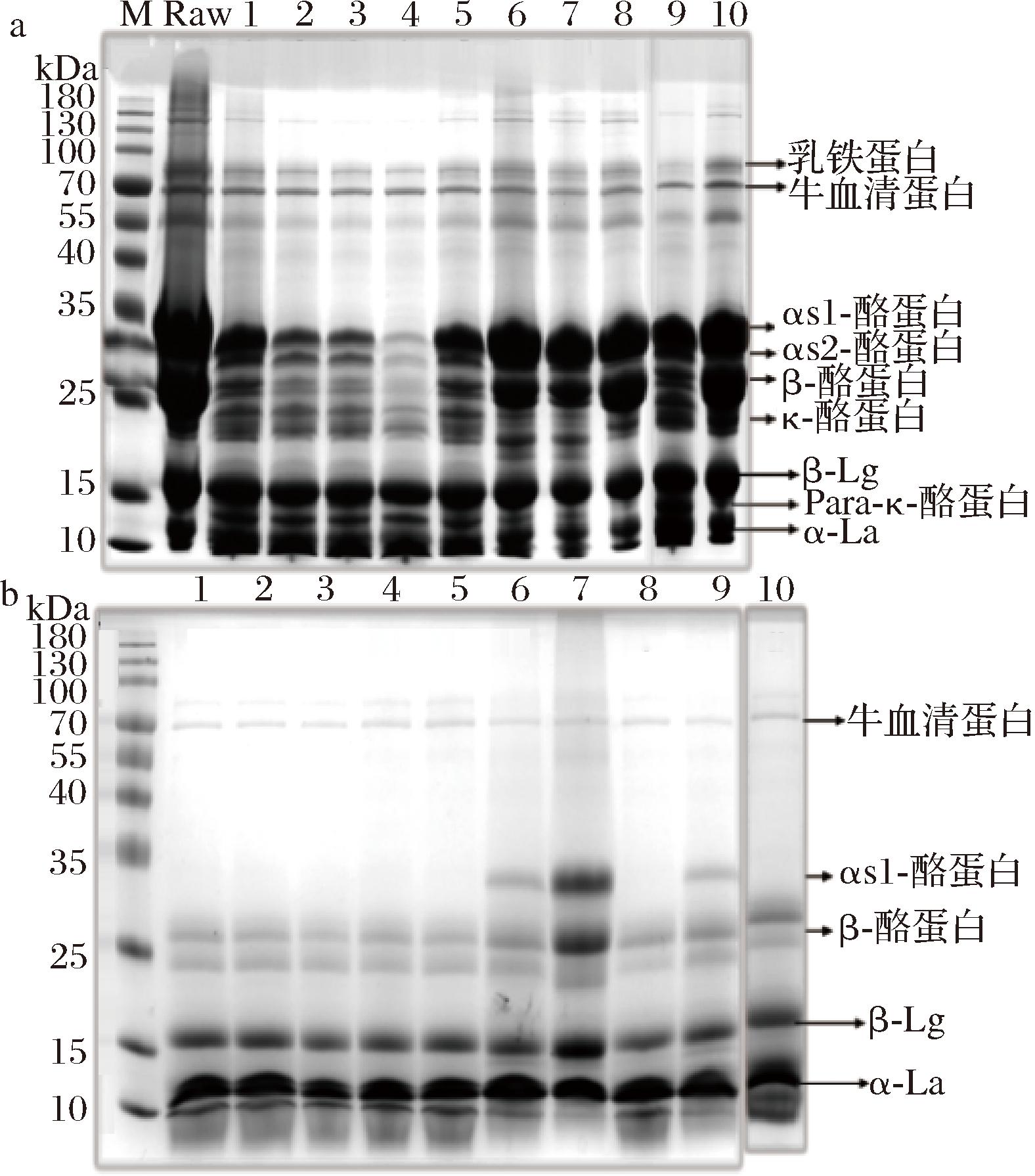
a-未经处理的原料奶和经10种不同UHT处理的牛乳(泳道1~10);b-10种老化凝胶的UHT牛乳
图2 不同牛乳样品凝胶前后的SDS-PAGE谱图
Fig.2 SDS-PAGE of different milk samples before and after age gelation

a-不同温度下β-Lg与酪蛋白复合体中β-Lg的液相色谱;b-UHT处理后β-Lg与酪蛋白复合体形貌
图3 β-Lg与酪蛋白的交互作用
Fig.3 Interaction between β-Lg and casein
2.3 β-Lg与酪蛋白的互作研究
为了探究β-Lg与酪蛋白胶束之间的相互作用,模拟了整个UHT乳加工过程,包括热处理前(25 ℃)、预热(75 ℃)和超高温处理(145 ℃)不同加工阶段,然后对酪蛋白胶束与β-Lg的混合物进行了研究。当β-Lg加入酪蛋白胶束后,随着温度的升高,β-Lg峰面积逐渐减小。这表明在高温处理过程中,β-Lg与酪蛋白胶束发生了结合,导致上清液中β-Lg含量逐渐减少[17]。这种现象可能是因为高温促使酪蛋白胶束和β-Lg的结构发生变化,使得两者更容易发生结合形成复合体。利用透射电镜进一步观察了超高温处理后的β-Lg/酪蛋白胶束复合体。如图2-b所示,除了典型的球状酪蛋白胶束[18],体系中还出现了网状聚合物,这些网状聚合物将酪蛋白胶束包裹其中,并相互连接形成更大的聚集体。根据之前的研究,β-Lg在热处理后会形成类似纤维桥状的聚集体[19]。TEM结果进一步证明了β-Lg在高温处理过程中能够与酪蛋白结合形成复杂的聚合结构。体系中出现的网状聚合物是组成老化凝胶的基础,因此这些网状聚合物可以作为优化UHT处理的依据,通过降低它们的含量来避免老化凝胶的形成。网状结构可能是热处理引起了蛋白质构象变化,暴露的氨基酸基团促进了β-Lg与酪蛋白之间的疏水作用和静电作用而形成结合。这些复合体的形成可能是导致UHT乳在贮藏过程中产生凝胶的重要因素之一。
2.4 β-Lg与酪蛋白单体的结合力分析
不同蛋白质之间的结合力是评价蛋白质相互作用强弱的重要指标。鉴于κ-酪蛋白与β-Lg之间的交互作用已被广泛研究,本研究采用MST技术分析了β-Lg与β-酪蛋白、α-酪蛋白的结合能力。荧光标记的β-Lg在局部加热区受到激发,随后迁移到外部冷区,直至达到稳定状态(图4-a)。当加入β-酪蛋白后,蛋白质的热泳迁移率显著降低,归一化荧光信号增加,表明β-酪蛋白与β-Lg之间发生了结合,影响了β-Lg的热泳行为。β-Lg与β-酪蛋白的Kd为(39.62±21.12) μmol/L。图4-b展示了β-Lg与α-酪蛋白的结合显示出类似模式,其Kd为(22.74±7.80) μmol/L,表明β-Lg与α-酪蛋白之间的结合力较强。通过Kd值进一步计算吉布斯自由能(ΔG),结果发现ΔG <0,表明β-Lg与β-酪蛋白和α-酪蛋白之间是自发结合。由于MST技术是基于Langmuir结合等温线和1∶1相互作用模型[20],因此β-酪蛋白和α-酪蛋白与β-Lg之间的结合不是共价结合,而是通过弱的分子间力来实现,如氢键、范德华力和静电相互作用等。酪蛋白单体与β-Lg的自发结合,意味着除了酪蛋白胶束外,从胶束中游离出的酪蛋白单体也参与了老化凝胶形成,因此UHT处理条件的优化应尽可能保证酪蛋白胶束的完整性,以避免老化凝胶的形成。
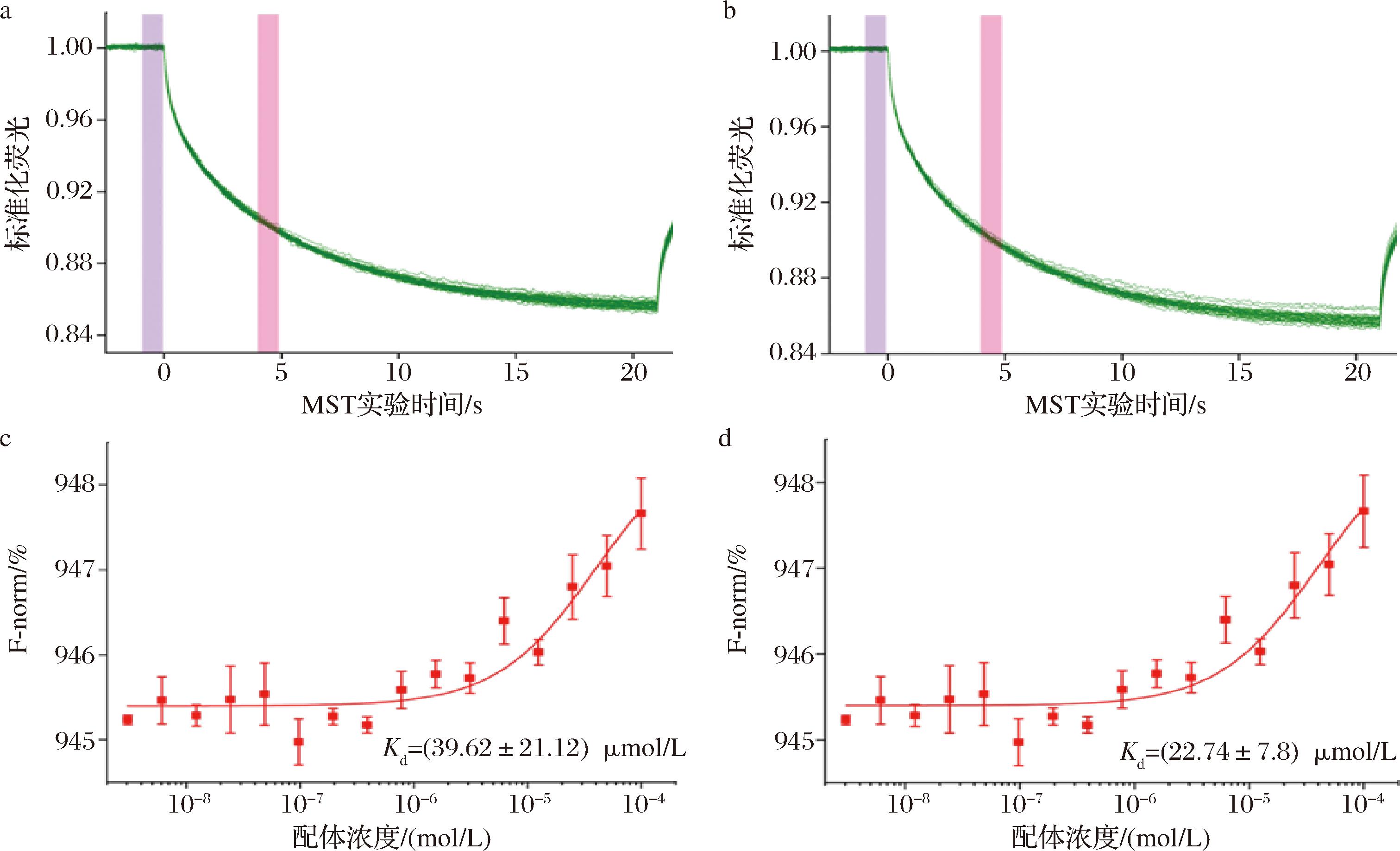
a-β-Lg 与β-酪蛋白的MST时间轨迹;b-β-Lg与α-酪蛋白的MST 时间轨迹;c-β-Lg 与β-酪蛋白的MST结合曲线;d-β-Lg与α-酪蛋白的MST结合曲线
图4 β-Lg与酪蛋白的MST 时间轨迹和MST 结合曲线
Fig.4 MST time traces and MST binding curves of β-Lg with casein
2.5 酪蛋白单体结构建模和分子对接
MST的结果证明β-Lg与酪蛋白之间通过非共价作用形成复合体。然而,目前尚未解析出酪蛋白单体的结构,这阻碍了β-Lg与酪蛋白的分子结合机制的研究。因此,本研究采用从头建模的方法,利用I-TASSER软件生成了αs1-酪蛋白、αs2-酪蛋白和β-酪蛋白的3D模型,并通过Ramachandran Plot对这些结构的合理性进行了评估。如图5-a~图5-c所示,3种酪蛋白结构均显示出明显的二级结构特征,拉氏图显示了每个氨基酸残基的二面角分布,证明了3种酪蛋白结构的合理性。Ramachandran Plot分析表明,αs1-酪蛋白的合理构象占95.90%,αs2-酪蛋白合理构象占97.40%,β-酪蛋白合理构象占96.60%,可用于后续的分子对接和分子动力学模拟[21]。采用刚性对接方法,将从头建模获得的αs1-酪蛋白、αs2-酪蛋白和β-酪蛋白的3D模型分别与β-Lg进行对接,生成3种蛋白质复合体:β-Lg/αs1-酪蛋白、β-Lg/αs2-酪蛋白和β-Lg/β-酪蛋白(图5-d)。这些复合体为深入理解乳蛋白质之间的分子互作提供了重要的理论基础。考虑到酪蛋白在牛奶中主要以胶束形式存在,3种酪蛋白单体与β-Lg形成的复合体,并不能阐述胶束状态下酪蛋白单体与β-Lg的结合形态,但由于加热同样会导致部分酪蛋白单体从胶束相游离到乳清相,这为有助于揭示游离的酪蛋白单体与β-Lg结合的分子机制。
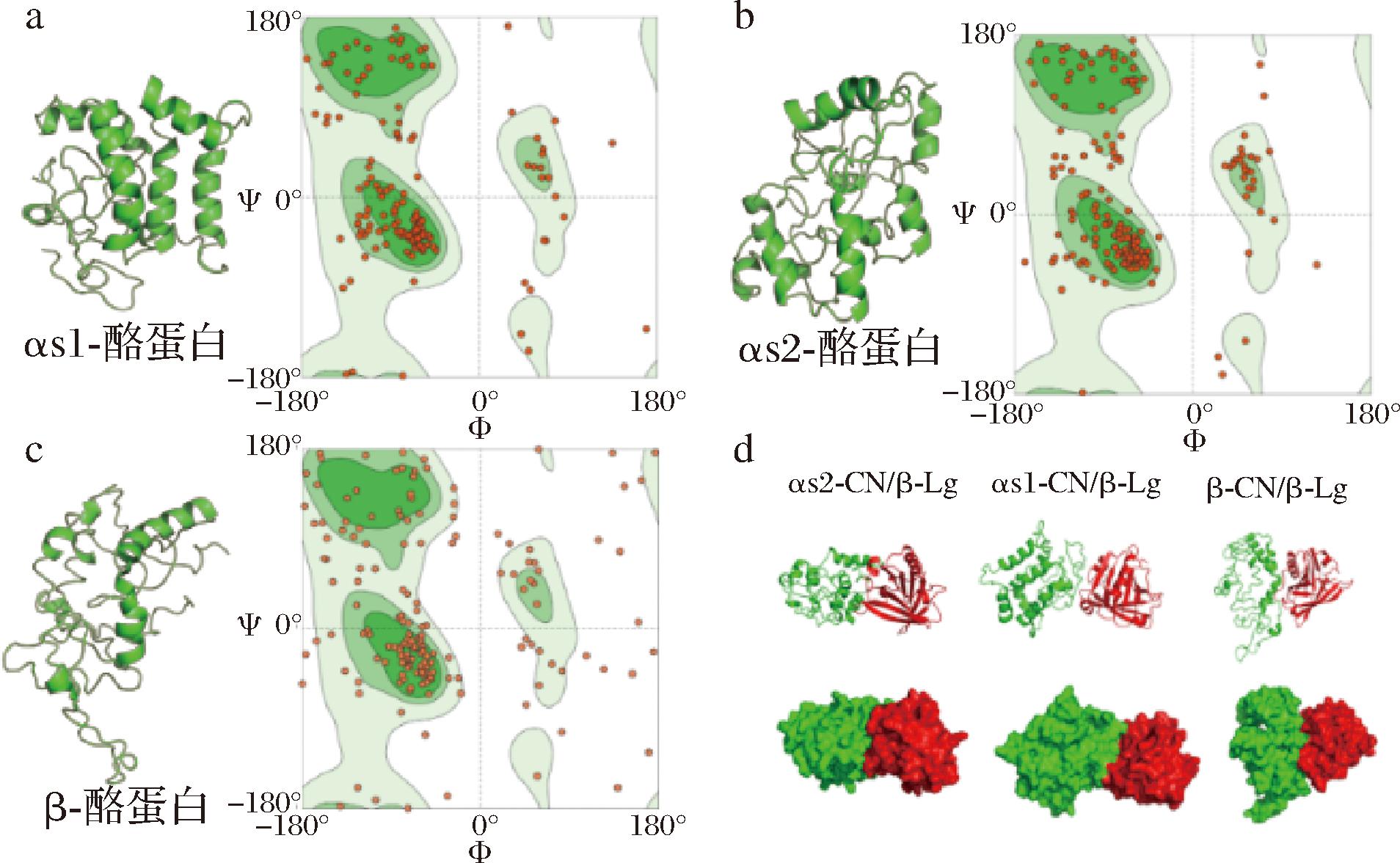
a-αs1-酪蛋白;b-αs2-酪蛋白;c-β-酪蛋白;d-3种蛋白质复合体结构图
图5 酪蛋白单体结构模型
Fig.5 Structural models of casein monomers
2.6 β-Lg与酪蛋白单体结合的分子动力学模拟
通过原子空间位置与初始结构各自位置的差异,分析了3种不同复合体中β-Lg、αs1-酪蛋白、αs2-酪蛋白及β-酪蛋白的RMSD,以评估它们的稳定性。图6-a显示了αs1-酪蛋白、αs2-酪蛋白和β-酪蛋白与β-Lg形成复合物的RMSD值。在模拟过程中,αs1-酪蛋白的RMSD值约为1.54 nm。尽管初始阶段有一定的波动,但在100 ns后趋于稳定,波动范围在0.2 nm以内,表明系统达到平衡[22]。αs2-酪蛋白的RMSD值约为1.31 nm,表现出与αs1-酪蛋白类似的稳定性。β-酪蛋白的RMSD值约为0.92 nm,显示出更高的稳定性。图6-b显示β-Lg的RMSD值约为0.39 nm,表明β-Lg在复合体中具有较高的稳定性。Rg反映了蛋白质整体结构的紧凑程度[23]。图6-c中αs1-酪蛋白和αs2-酪蛋白的Rg值相似,均约为1.88 nm。由图6-d可知,β-酪蛋白的Rg值约为1.76 nm,略低于αs1-酪蛋白和αs2-酪蛋白,表明β-酪蛋白在复合体中具有更紧凑的结构。在3个不同复合物中,β-Lg的Rg值几乎完全重叠,约为1.52 nm,表明β-Lg在不同复合体中均保持了高度一致的结构紧凑性。综合分析Rg与RMSD的结果,发现酪蛋白单体(αs1-酪蛋白、αs2-酪蛋白和β-酪蛋白)在酪蛋白/β-Lg复合体中的结构上具有较高的波动性,而β-Lg在复合体中显示出更高的稳定性和一致性。上述结果表明,β-Lg为复合体提供了一个稳定的核心结构,而酪蛋白则在其周围呈现一定的动态性。而当β-Lg与酪蛋白胶束结合时,由于β-Lg更容易与酪蛋白胶束表面的κ-酪蛋白结合,在此情形下酪蛋白胶束可能作为稳定复合体的核心结构。
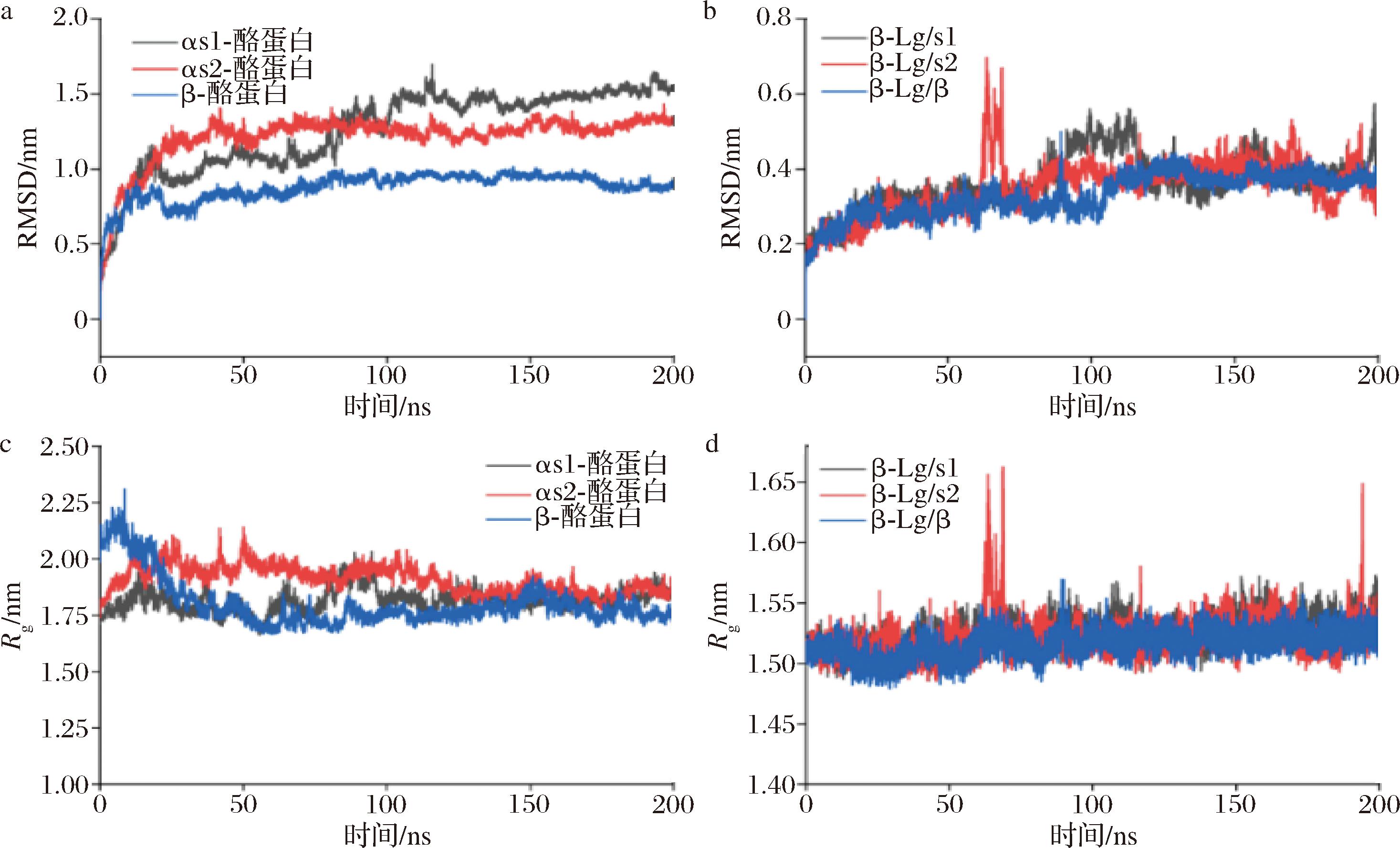
a-αs1-酪蛋白,αs2-酪蛋白和β-酪蛋白在复合物中的RMSD;b-β-乳球蛋白在复合物中的RMSD;c-αs1-酪蛋白,αs2-酪蛋白和β-酪蛋白在复合物中的Rg;d-β-乳球蛋白在复合物中的Rg
图6 三种酪蛋白/β-Lg复合物的分子动力学模拟
Fig.6 Molecular dynamics simulation trajectories of three casein/β-lactoglobulin complexes
2.7 酪蛋白与β-Lg的结合能分析
利用MM-PBSA方法分析了αs1-酪蛋白/β-Lg、αs2-酪蛋白/β-Lg和β-酪蛋白/β-Lg 3种复合体的非共价结合作用力。结果如图7所示,3种复合体的静电力分别为αs1-酪蛋白/β-Lg:(-1 355.61±137.01) kJ/mol,αs2-酪蛋白/β-Lg:(-1 626.73±163.34) kJ/mol和β-酪蛋白/β-Lg:(1 074.74±112.68) kJ/mol。静电作用被认为是引发最初聚集的主要因素。范德华力在所有复合体中均是相互作用的第二大驱动力。总结合能反映了复合体的稳定性和自发结合的容易程度。3种复合体的总结合能分别为αs1-酪蛋白/β-Lg:(-195.13±70.96) kJ/mol,αs2-酪蛋白/β-Lg:(-148.77±85.39) kJ/mol和β-酪蛋白/β-Lg:(-113.59±38.43) kJ/mol,表明αs1-酪蛋白和αs2-酪蛋白与β-Lg的结合相较于β-酪蛋白更容易[13];这与MST的研究结果一致,MST研究同样显示αs1-酪蛋白和αs2-酪蛋白与β-Lg的结合亲和力高于β-酪蛋白。上述研究结果为阐明乳蛋白质之间的分子互作机制提供了重要信息。然而,由于酪蛋白胶束结构尚未得到解析,复杂的结构导致难以分析β-Lg与胶束形态的相互作用,因此β-Lg与单体之间的结合能并不能用来反映β-Lg与酪蛋白胶束之间的交互作用力。
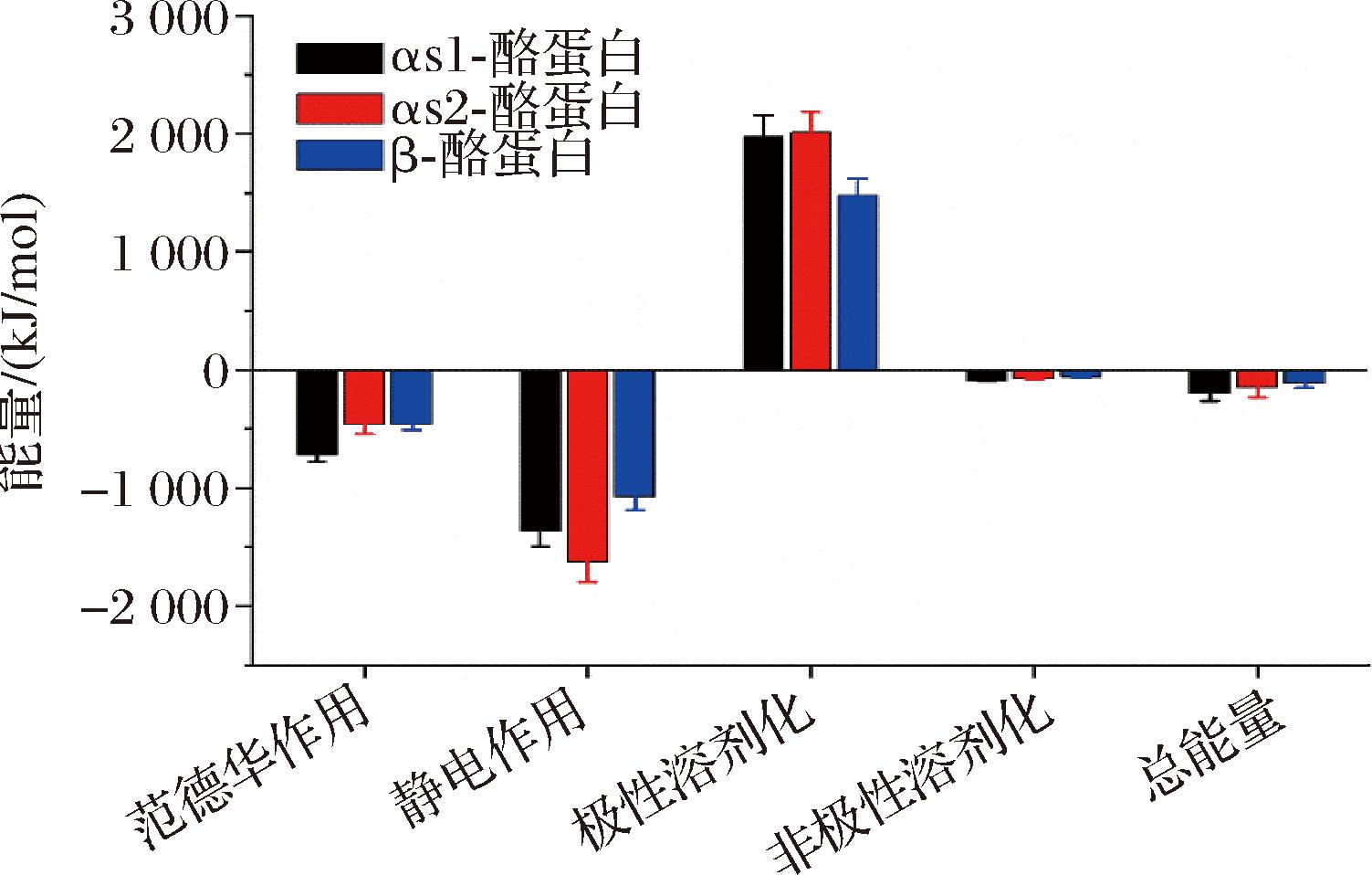
图7 β-Lg与酪蛋白之间的非共价相互作用结合能
Fig.7 Non-covalent interaction binding energy between β-Lg and casein
2.8 β-Lg与酪蛋白结合界面的氨基酸分析
分子动力学模拟得到了稳定的蛋白复合体,利用LigPlot+软件分析了这些复合体中αs1-酪蛋白、αs2-酪蛋白和β-酪蛋白与β-乳球蛋白的相互作用界面特征。结果显示,这些复合体主要通过疏水相互作用和氢键稳定结合。图8显示了这些复合体中通过疏水作用和氢键相互作用的氨基酸残基。在αs1-酪蛋白/β-Lg复合体中,形成了6条氢键,包括αs1-酪蛋白中的Asp181、Lys193、Thr195、Ser180和His8,以及β-Lg中的Arg40、Asp33、Asn152、Gln155和Ile162。这些氢键使得复合物保持结构稳定。在αs2-酪蛋白/β-Lg复合体中,形成了8条氢键,涉及到αs2-酪蛋白中的Gly55、Lys166、Arg160、Tyr179、Thr182和His186,以及β-Lg中的Gln155、Glu158、Gly64、Gln35、Glu62、Glu65、Asn63、Arg148和Ile147。在β-酪蛋白/β-Lg复合体中,形成了6条氢键,分别由β-酪蛋白中的Glu37、Gln40、Glu44和Thr41,以及β-Lg中的Lys141、Gln5和Lys8参与。此外,疏水相互作用也对这些复合体的稳定性起到了关键作用。以上结果揭示了在酪蛋白在游离状态下,酪蛋白单体与β-Lg之间发生交互作用的氨基酸残基,然而不同的酪蛋白单体聚集形成胶束时,彼此之间也会发生氨基酸残基互作,这可能会改变它们与β-Lg之间的交互作用网络。整体的分析表明,酪蛋白单体与β-Lg之间的结合稳定性主要与氢键和疏水相互作用有关,这与MST和MM-PBSA的分析结果一致,进一步证实了这些蛋白质通过非共价相互作用形成稳定的复合体。
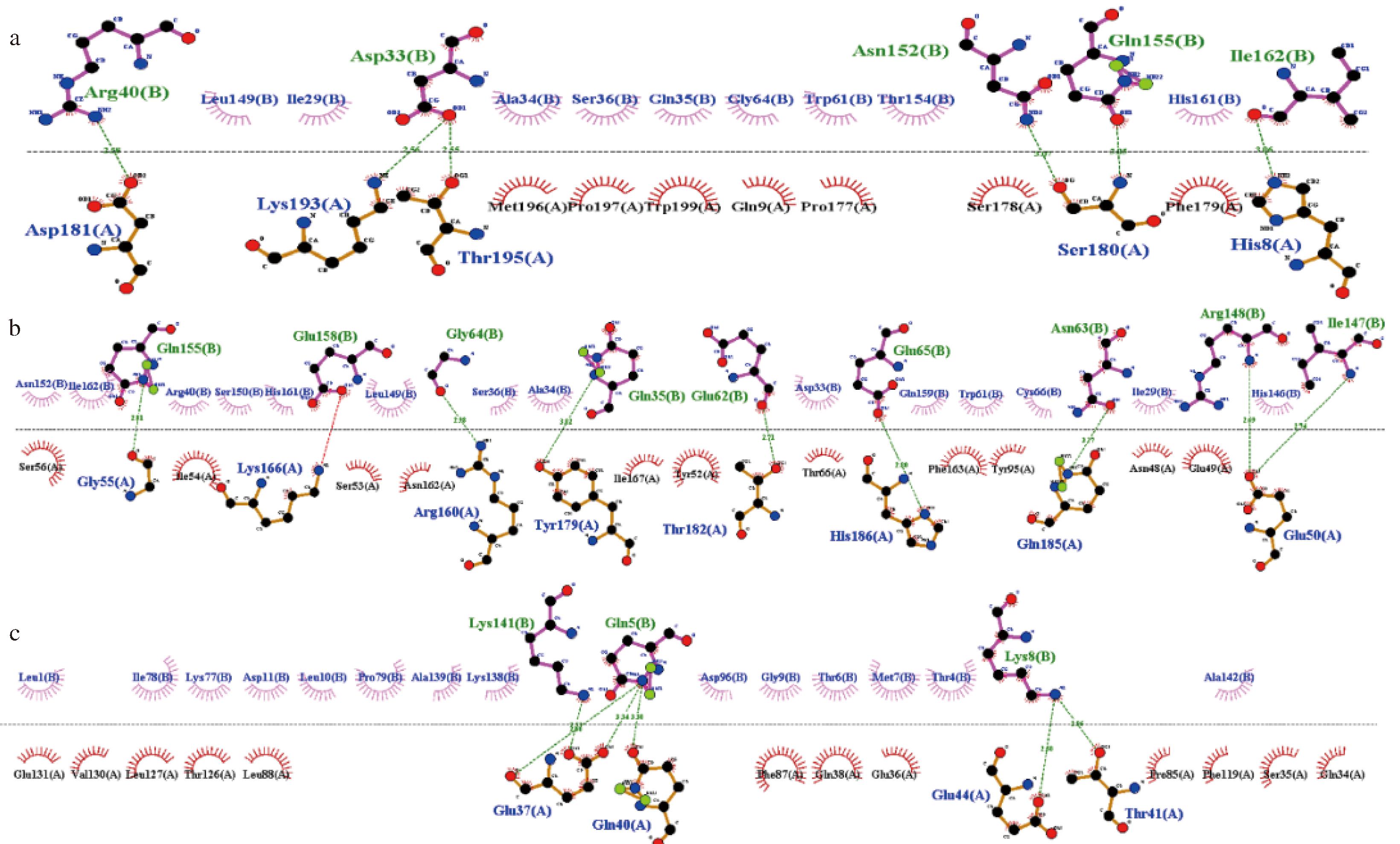
a-αs1-酪蛋白/β-Lg;b-αs2-酪蛋白/β-Lg;c-β-酪蛋白/β-Lg复合体
图8 不同酪蛋白与β-Lg的结合界面的氨基酸残基交互作用网络
Fig.8 Interaction network of amino acid residues at the binding interface between different caseins and β-Lg
3 结论
本文对UHT牛乳中酪蛋白与β-Lg形成老化凝胶的机制开展了探索研究。UHT乳贮藏过程中产生了表面多孔、质地密实的凝胶。超高温处理促进了β-Lg与酪蛋白单体结合形成稳定的复合体,且α-酪蛋白相较β-酪蛋白与β-Lg具有更高的结合力。分子对接和分子动力学模拟的结果表明,β-Lg对维持酪蛋白/β-Lg复合体的稳定性具有核心作用。酪蛋白与β-Lg通过氢键、静电力、范德华力等分子作用力实现非共价结合。由于UHT乳老化凝胶的形成是一个动态过程,未来应系统研究比较UHT乳体系中酪蛋白胶束和单体与乳清蛋白在不同贮藏时间的相互作用,以全面揭示UHT乳在贮藏过程中老化凝胶的形成机制,为建立有效的控制方法奠定理论基础。
[1] 孟繁宇, 韩兆盛, 张哲婷, 等.浸入式和喷射式超高温瞬时灭菌对牛乳中活性蛋白和风味化合物的影响[J].食品科学技术学报, 2023, 41(2):70-80.MENG F Y, HAN Z S, ZHANG Z T, et al.Effect of steam infusion and steam injection ultra-high temperature treatment on active proteins and flavor compounds in milk[J].Journal of Food Science and Technology, 2023, 41(2):70-80.
[2] 杨晋辉, 钱文涛, 李洪亮, 等.牛乳纤溶酶及其活性影响因素研究进展[J].食品科学, 2023, 44(13):235-243.YANG J H, QIAN W T, LI H L, et al.Recent advances in milk plasmin and factors affecting its activity[J].Food Science, 2023, 44(13):235-243.
[3] VELAZQUEZ-DOMINGUEZ A, HENNETIER M, ABDALLAH M, et al.Influence of enzymatic cross-linking on the apparent viscosity and molecular characteristics of casein micelles at neutral and acidic pH[J].Food Hydrocolloids, 2023, 139:108552.
[4] AKKERMAN M, JOHANSEN L B, RAUH V, et al.Relationship between casein micelle size, protein composition and stability of UHT milk[J].International Dairy Journal, 2021, 112:104856.
[5] YUN G, GILLIES G, RIPBERGER G, et al.Modelling the reaction kinetics of β-lactoglobulin and κ-casein heat-induced interactions in skim milk[J].Journal of Food Engineering, 2023, 344:111391.
[6] LI S W, WU S N, WANG L, et al.Recent advances in predicting protein-protein interactions with the aid of artificial intelligence algorithms[J].Current Opinion in Structural Biology, 2022, 73:102344.
[7] THILL S, SCHMIDT T, JANA S, et al.Fine structure and swelling properties of fibers from regenerated rennet-treated casein micelles[J].Macromolecular Materials and Engineering, 2022, 307(10):2200272.
[8] EISNER M D.Direct and indirect heating of milk- A technological perspective beyond time-temperature profiles[J].International Dairy Journal, 2021, 122:105145.
[9] LUND P, NIELSEN S B, NIELSEN C F, et al.Impact of UHT treatment and storage on liquid infant formula:Complex structural changes uncovered by centrifugal field-flow fractionation with multi-angle light scattering[J].Food Chemistry, 2021, 348:129145.
[10] HUANG J Y, HE Z Y, CHENG R Q, et al.Assessment of binding interaction dihydromyricetin and myricetin with bovine lactoferrin and effects on antioxidant activity[J].Spectrochimica Acta, Part A:Molecular and Biomolecular Spectroscopy, 2020, 243:118731.
[11] ZHENG W, ZHANG C X, LI Y, et al.Folding non-homologous proteins by coupling deep-learning contact maps with I-TASSER assembly simulations[J].Cell Reports Methods, 2021, 1(3):100014.
[12] PIERCE B G, WIEHE K, HWANG H, et al.ZDOCK server:Interactive docking prediction of protein-protein complexes and symmetric multimers[J].Bioinformatics, 2014, 30(12):1771-1773.
[13] ZHANG T, LIU Y S, WANG P J, et al.Exploration of interaction between α-lactalbumin and β-lactoglobulin under dUHT treatment and storage:Experimental and molecular dynamics study[J].Food Hydrocolloids, 2023, 138:108469.
[14] DATTA N, DEETH H C.Age gelation of UHT milk: A review[J].Food and Bioproducts Processing, 2001, 79(4):197-210.
[15] WU P P, GUO M Y, WANG P J, et al.Age Gelation in direct steam infusion ultra-high-temperature milk:Different heat treatments produce different gels[J].Foods, 2024, 13(8):1236.
[16] MCMAHON D J, OOMMEN B S.Supramolecular structure of the casein micelle[J].Journal of Dairy Science, 2008, 91(5):1709-1721.
[17] DUMPLER J, WOHLSCHL GER H, KULOZIK U.Dissociation and coagulation of caseins and whey proteins in concentrated skim milk heated by direct steam injection[J].Dairy Science &Technology, 2017, 96(6):807-826.
GER H, KULOZIK U.Dissociation and coagulation of caseins and whey proteins in concentrated skim milk heated by direct steam injection[J].Dairy Science &Technology, 2017, 96(6):807-826.
[18] ZHANG J L, LIU D S, TAO X M, et al.Effect of enzymatic dephosphorylation on caprine casein micelle structure[J].Food Hydrocolloids, 2024, 148:109466.
[19] KAVANAGH G M, CLARK A H, ROSS-MURPHY S B.Heat-induced gelation of globular proteins:Part 3.Molecular studies on low pH β-lactoglobulin gels[J].International Journal of Biological Macromolecules, 2000, 28(1):41-50.
[20] NASREDDINE R, NEHMÉ R.Microscale thermophoresis for studying protein-small molecule affinity:Application to hyaluronidase[J].Microchemical Journal, 2021, 170:106763.
[21] TAM B, SINHA S, WANG S M.Combining Ramachandran plot and molecular dynamics simulation for structural-based variant classification:Using TP53 variants as model[J].Computational And Structural Biotechnology Journal, 2020, 18:4033-4039.
[22] LIU J Y, SONG G S, ZHOU L K, et al.Comparison of non-covalent binding interactions of six caffeoylquinic acids with β-lactoglobulin:Spectroscopic analysis, molecular docking and embedding of curcumin[J].Food Hydrocolloids, 2023, 137:108391.
[23] GHASEMI M, HABIBIAN-DEHKORDI S, FARHADIAN S.Change in thermal stability and molecular structure characteristics of whey protein beta-lactoglobulin upon the interaction with levamisole hydrochloride[J].Food Chemistry, 2024, 431:137073.