益生菌一直是人们研究的热点,其在调节肠道菌群、缓解肥胖、防止便秘、降低血压、降低胆固醇、抗炎等方面发挥积极作用[1]。益生菌发挥益生功能的前提是其浓度必须保持在107~109 UFC/g以上,并且进入人体后依旧能够保持活性;另外,在生产、运输、贮存和使用等环节,益生菌生物活性往往会受到影响,对生存环境要求苛刻,以上问题在一定程度上限制了益生菌在食品中的广泛应用[2-3]。
近年来,越来越多的研究表明灭活的菌体或其代谢产物具有为宿主健康提供益生功能的能力,这种物质被称为“后生元”[4-5]。后生元与益生菌相比,具有保质期长、方便易用、环境耐受性强、活性不易丧失等优势[3],引起国内外学者的关注。KHODAII等[6]研究发现16株乳杆菌和双歧杆菌的菌株上清液均能够减少肠侵袭性大肠杆菌(Enterinvasive Escherichia coli, EIEC)对T84和Caco-2细胞的侵袭,分析可能与菌株产生的代谢产物有关。IZUDDIN等[7]研究报道了后生元对断奶羔羊的益生效果,结果表明添加植物乳植杆菌(Lactiplantibacillus plantarum)RG14后生元可以提高羔羊的体重、营养摄入量和消化率,增加纤维降解细菌的数量,以及改善断奶后羔羊的生长性能。另外,ANDRESEN等[8]研究发现双歧杆菌MIMBb75与其热灭活的培养物显著缓解了肠易激综合征。舒鑫等[9]通过体内实验发现植物乳植杆菌后生元可以有效缓解小鼠沙门氏菌感染,陈峰等[10]发现灭活的卷曲乳杆菌CCFM1118-IB具有抗幽门螺杆菌的显著效果。由此看来,与活菌相比,后生元能发挥更稳定的益生功效,因此开发新型后生元及其应用具有重要意义。
基于此,本课题组前期从青海牦牛奶中分离得到一株植物乳植杆菌Q7,并发现该菌株及其代谢产物具有广谱抑菌活性,对于食品中多种常见致病菌,如单增李斯特菌(Listeria monocytogenes)、大肠杆菌、志贺氏菌、沙门氏菌、荧光假单胞菌等均具有明显的抑制效果[11],通过分离纯化确定主要抑菌物质为细菌素[12],并证明其具有安全性[13-14]。此前研究主要集中在活菌及其代谢产物的抑菌机制,而本研究主要通过制备植物乳植杆菌Q7后生元,研究不同温度和干燥方式对其抑菌活性的影响,并将其应用到馒头和牛乳的防腐保鲜。本研究旨在为植物乳植杆菌Q7后生元的开发及其在食品防腐中的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
植物乳植杆菌Q7、单增李斯特菌保存于中国海洋大学食品科学与工程学院。
MRS肉汤培养基、BHI(brain heart infusion)脑心浸液肉汤培养基、BHI脑心浸液琼脂培养基,青岛海博生物技术有限公司;巴氏杀菌牛乳,内蒙古蒙牛乳业(集团)股份有限公司;蒸馏水。
1.2 仪器与设备
SW-CJ-1D超净工作台,苏州净化设备有限公司;GHP-9050隔水式恒温培养箱,上海慧泰仪器制造有限公司;LDZX-75L立式高压蒸汽灭菌器,上海申安医疗器械厂;TG20KR-D高速冷冻离心机,长沙东旺实验仪器有限公司;DK-98-IIA电热恒温水浴锅,天津市泰斯特仪器有限公司;CY-8000Y二流体高温喷雾器,杭州川一实验仪器有限公司;YTLG-10A真空空冷冻干燥机,上海叶拓科技有限公司。
1.3 实验方法
1.3.1 菌株活化
将冻存的植物乳植杆菌Q7和单增李斯特菌以2%的接种量分别转接至MRS肉汤培养基和BHI脑心浸液肉汤培养基中,于37 ℃培养箱内培养24 h进行活化,2株菌均传2代之后使用。
1.3.2 植物乳植杆菌Q7后生元的制备
植物乳植杆菌Q7在37 ℃下培养24 h后获得发酵液,将发酵液先进行热诱导(40~45 ℃,20 min),接着热灭活(121 ℃,20 min)后获得后生元,经过喷雾干燥和真空冷冻干燥得到后生元冻干粉备用。
1.3.3 植物乳植杆菌Q7发酵液和后生元抑菌效果的测定
选择单增李斯特菌作为指示菌,向体积为20 mL的BHI半固体培养基(琼脂质量分数0.6%)中接入7 μL已活化好的单增李斯特菌菌液,振荡混匀后倒入已摆放好牛津杯的培养皿中,待培养基冷却凝固后移除牛津杯完成打孔。分别向孔中加入160 μL在1.3.2节中制备的植物乳植杆菌发酵液和后生元(液态制剂),置于37 ℃下培养24 h后使用游标卡尺测量抑菌圈直径[10]。
1.3.4 温度对植物乳植杆菌Q7发酵液抑菌活性的影响
将活化好的植物乳植杆菌Q7以2%的接种量转接至新的MRS液体培养基中,在37 ℃条件下培养24 h后,分别将发酵液于40、60、80、100、121 ℃温度下加热20 min,以37 ℃下的发酵液为对照组,每组3个重复。采用1.3.3节所述方法测定不同温度处理对植物乳植杆菌Q7发酵液抑菌活性的影响。
1.3.5 温度对植物乳植杆菌Q7发酵上清液抑菌活性的影响
将植物乳植杆菌Q7发酵液以6 000 r/min的速度离心10 min,除去菌体沉淀,获取上清液,再分别于40、60、80、100、121 ℃温度下加热20 min。以37 ℃的植物乳植杆菌Q7发酵上清液为对照组,每组3个重复。采用1.3.3节所述方法测定不同温度处理对植物乳植杆菌Q7发酵上清液抑菌活性的影响。
1.3.6 喷雾干燥对植物乳植杆菌Q7后生元抑菌活性的影响
按照1.3.2节方法制备100 mL植物乳植杆菌Q7后生元液体制剂,以入口温度120 ℃、进料速率800 mL/h、出口温度60 ℃对植物乳植杆菌Q7后生元进行喷雾干燥[15]。喷雾干燥后得到菌粉,按照干物质含量10%复溶,采用1.3.3节所述方法测定喷雾干燥处理对植物乳植杆菌Q7后生元抑菌活性的影响。
1.3.7 真空冷冻干燥对植物乳植杆菌Q7后生元抑菌活性的影响
按照1.3.2节方法制备100 mL植物乳植杆菌Q7后生元液体制剂,设置预冻温度-45 ℃、预冻时间4 h、真空度0.2 mbar进行冷冻干燥。冷冻干燥后得到菌粉,按照干物质含量10%复溶[16],采用1.3.3节所述方法测定真空冷冻干燥处理对植物乳植杆菌Q7发酵液抑菌活性的影响。
1.3.8 植物乳植杆菌Q7发酵液和后生元在延缓馒头发霉中的应用
将活化好的植物乳植杆菌Q7以2%的比例接种到新的MRS液体培养基中,在37 ℃下培养24 h后,分别将发酵液于37、40、60、80、100、121 ℃温度下加热20 min,每组3个重复,其中,60~121 ℃加热后的植物乳植杆菌Q7发酵液为后生元。将发酵液和后生元均匀的涂抹在大小一致的馒头片上,以不做任何处理的馒头片为对照组。将馒头片放置在潮湿的环境中每天观察馒头片的发霉情况。
1.3.9 牛乳中单增李斯特菌落数测定
按照先前的方法[17-18],将巴氏杀菌乳进行分装并接入单增李斯特菌,使细菌细胞在牛乳中的终浓度为1×103 CFU/mL。实验组牛乳中加入植物乳植杆菌Q7后生元,按10%的比例复溶在牛乳中,对照组加入等量的无菌水。参照GB 4789.2—2022《食品安全国家标准 食品微生物学检验 菌落总数测定》,将处理好的牛乳密封保存于4 ℃,每隔1 d从中取样,梯度稀释后进行涂布,并在37 ℃下培养48 h后计数。
1.4 数据统计分析
实验设置3次重复,试验数据采用SPSS 26.0软件进行处理;方法采用单因素方差(one way ANOVA)进行统计。P<0.05为统计学上有显著差异。运用Graphpad Prism 8软件作图。
2 结果与分析
2.1 植物乳植杆菌Q7发酵液和后生元抑菌效果的测定
采用牛津杯法测定植物乳植杆菌Q7发酵液和植物乳植杆菌Q7后生元对单增李斯特菌的抑菌效果,结果如图1所示。结果表明,植物乳植杆菌发酵液抑菌圈直径平均值为(25.56±0.15) mm,植物乳植杆菌Q7后生元抑菌圈直径平均值为(24.71±0.32) mm,抑菌效果显著。
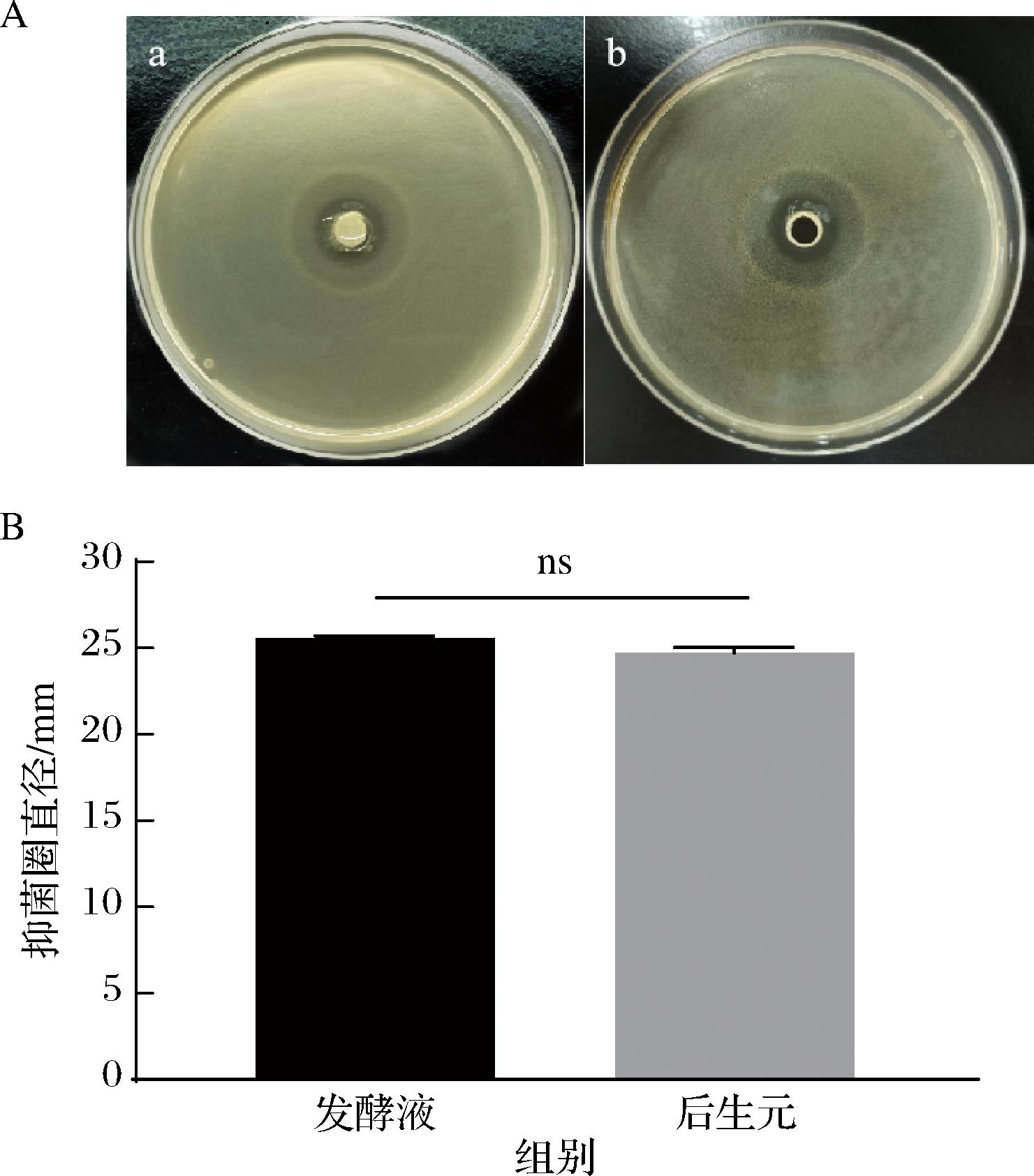
A-抑菌圈图(a-发酵液,b-后生元);B-抑菌圈直径柱状图
图1 植物乳植杆菌Q7发酵液及后生元对单增李斯特菌的抑菌作用
Fig.1 Inhibitory effect of L.plantarum Q7 fermentation broth and postbiotic on L.monocytogenes
注:ns表示无显著性差异。
发酵液抑菌圈直径略大于后生元抑菌圈直径,可能由于植物乳植杆菌发酵液的抑菌作用不止依靠植物乳植杆菌代谢产生的有机酸和细菌素等多种代谢产物,发酵液中活的菌体细胞也可以通过生长繁殖和菌体的竞争排斥等作用来促进抑菌效果的产生[19]。
2.2 温度对植物乳植杆菌Q7发酵液抑菌活性的影响
不同温度对植物乳植杆菌Q7发酵液抑菌活性的影响如图2所示。结果表明在经过40、60、80、100 ℃处理后,发酵液仍然保持较高的抑菌活性,在经过121 ℃处理20 min后,植物乳植杆菌Q7发酵液仍然保留96%左右的抑菌活性,说明植物乳植杆菌Q7发酵液热稳定性较好,高压蒸汽灭菌不会对其抑菌能力产生影响。本课题组前期研究发现,植物乳植杆菌Q7能够发酵合成耐热性较强的抑菌物质植物乳植杆菌细菌素Q7[11]。另外,苯乳酸[20]、过氧化氢[21]等物质的存在也会起到协同抑菌作用。
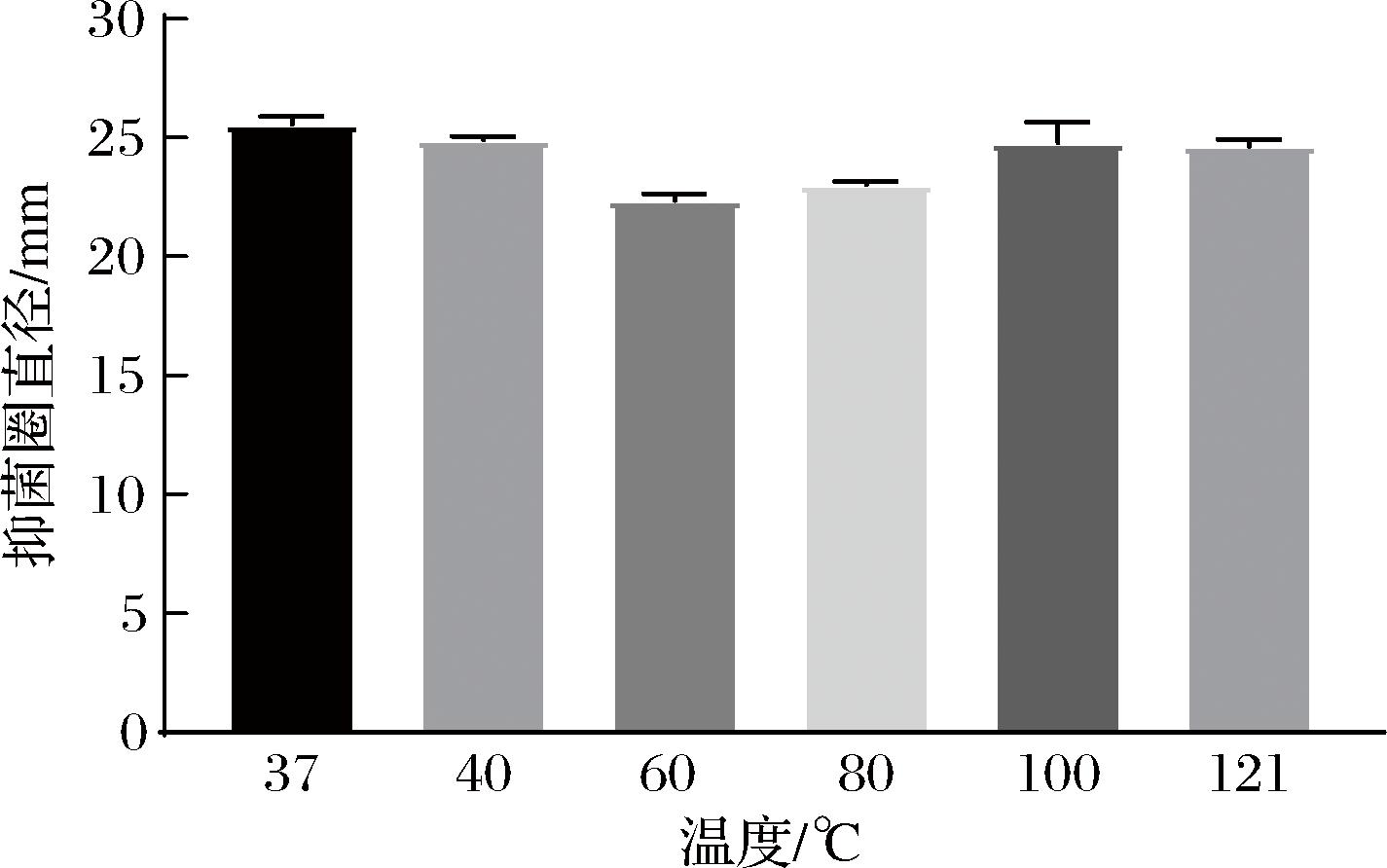
图2 温度对植物乳植杆菌Q7发酵液抑菌活性的影响
Fig.2 Effect of temperature on the antibacterial activity of L.plantarum Q7 fermentation broth
2.3 温度对植物乳植杆菌Q7发酵上清液抑菌活性的影响
温度对植物乳植杆菌Q7发酵上清液抑菌活性的影响如图3所示。与37 ℃对照组中的原发酵上清液相比,分别经过40、60、80、100、121 ℃处理20 min后的上清液,其抑菌活性均未出现明显降低(P<0.05),说明植物乳植杆菌Q7发酵上清液中的抑菌物质热稳定性强。这一结果与WANG等[22]的研究结果略有不同,其研究发现一株乳酸菌的发酵上清液经过不同温度处理后,抑菌活性有所下降,温度越高,活性越低。王虹军等[23]对植物乳植杆菌细菌素粗提液在121 ℃处理30 min后,发现其抑菌效果下降为原来的81%。这表明不同菌株后生元的耐热性具有菌株特异性,同时也表明植物乳植杆菌Q7后生元应用范围更广,在热加工食品的防腐保鲜领域具有良好的应用前景。此外,与2.2节中温度对发酵液抑菌活性的影响比较发现,发酵上清液的抑菌能力与发酵液的抑菌能力接近,推测植物乳植杆菌Q7发挥抑菌活性的能力可能主要来源于其发酵上清液。
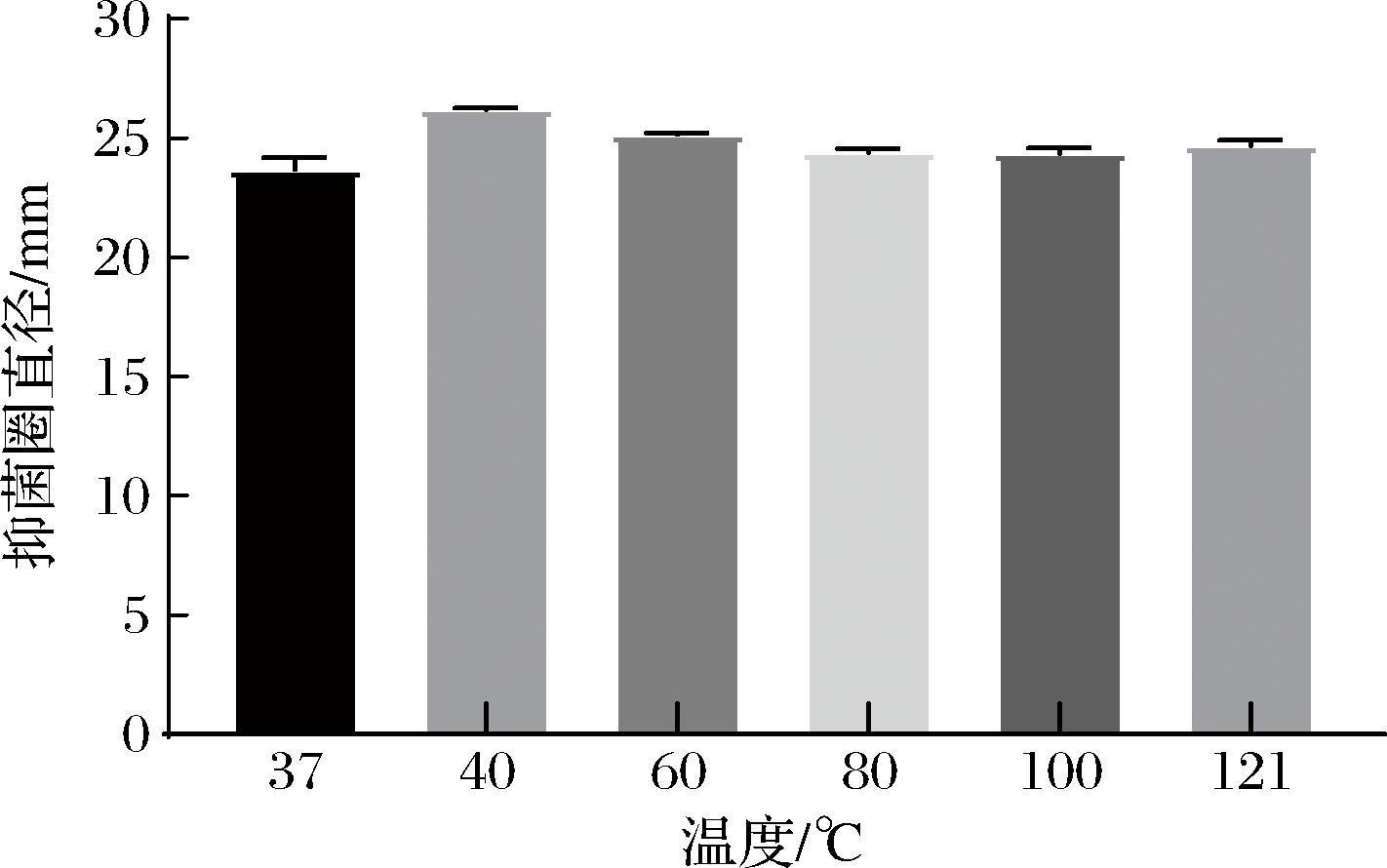
图3 温度对植物乳植杆菌Q7发酵上清液抑菌活性的影响
Fig.3 Effect of temperature on the antibacterial activity of L.plantarum Q7 fermentation supernatant
2.4 喷雾干燥和真空冷冻干燥对植物乳植杆菌Q7后生元抑菌活性的影响
分别利用喷雾干燥和真空冷冻干燥制备植物乳植杆菌Q7后生元,然后将制备得到的植物乳植杆菌Q7后生元粉进行复溶,测定其抑菌活性。抑菌效果如图4所示。植物乳植杆菌Q7后生元抑菌效果经过这2种干燥方式处理后,抑菌活性变化不大。总体上,这2种干燥方式均有利于植物乳植杆菌Q7后生元实现产品化,其中真空冷冻干燥效果更好。分析其原因可能是相较于喷雾干燥,真空冷冻干燥造成植物乳植杆菌Q7后生元中的抑菌成分活性的损失较少,可以更好地保留其抑菌活性[15]。若想要最大程度保留植物乳植杆菌Q7后生元的抑菌能力,需要对这2种干燥条件作进一步优化,如改变加工温度、时间、培养基成分和添加保护剂等[24]。
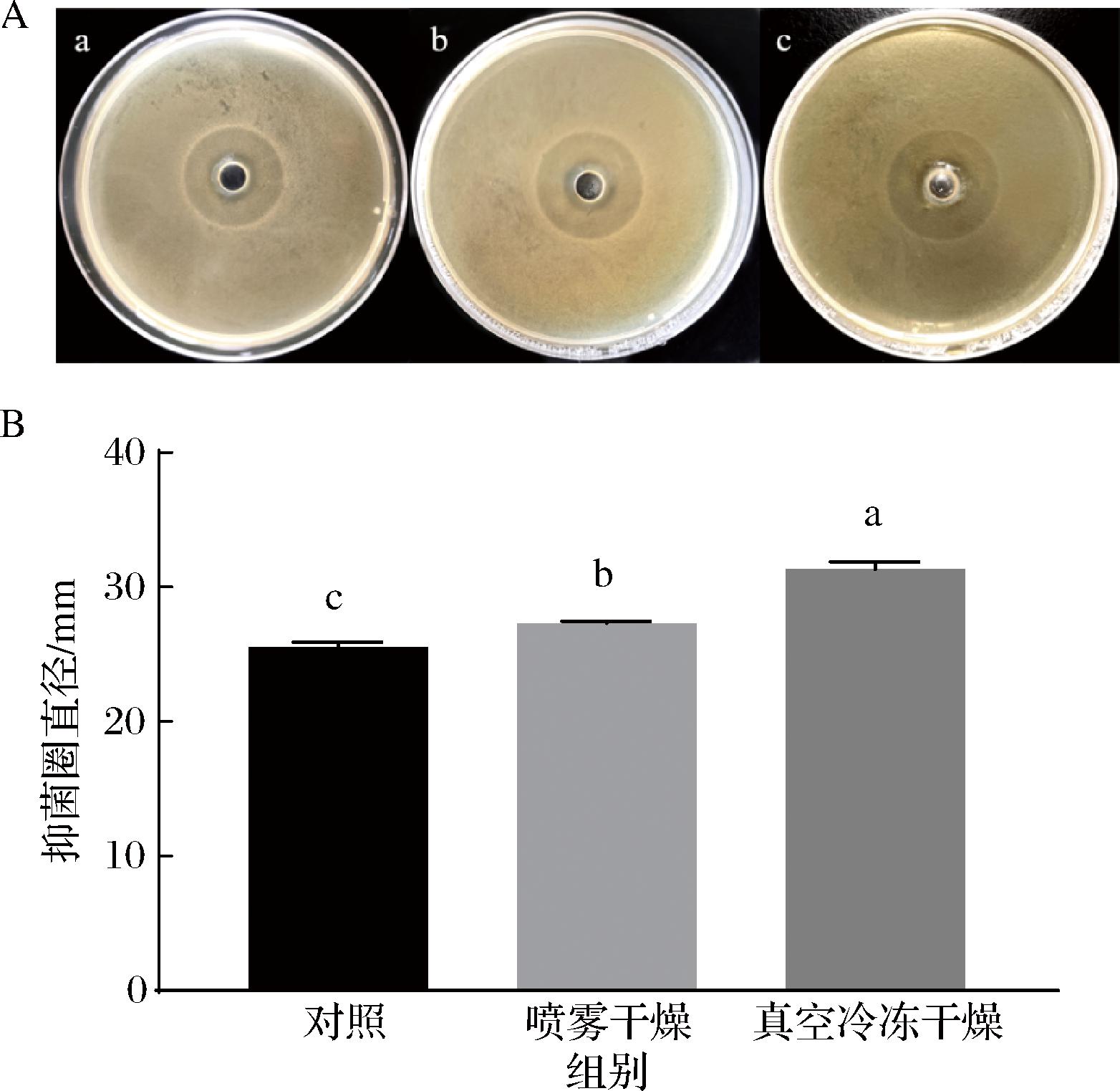
A-抑菌圈图(a-对照,b-喷雾干燥,c-真空冷冻干燥);B-为抑菌圈直径柱状图
图4 喷雾干燥和真空冷冻干燥对植物乳植杆菌Q7后生元抑菌活性的影响
Fig.4 Effects of spray drying and vacuum freeze drying on the antibacterial activity of L.plantarum Q7 postbiotic
注:柱形图中不同小写字母表示差异显著(P<0.05)。
2.5 植物乳植杆菌Q7后生元对馒头发霉的抑制效果
不同温度处理的植物乳植杆菌Q7后生元对馒头的贮藏保鲜效果如图5所示。未添加植物乳植杆菌Q7后生元的馒头在贮存第3天开始发生霉变,涂抹植物乳植杆菌Q7后生元的馒头片存放10 d后均没有出现霉菌生长。经过7 d的存放,未添加植物乳植杆菌Q7后生元的对照组出现明显可见霉斑,而涂抹不同温度处理后的后生元的各实验组没有发生霉变现象(图5-C)。在贮存第10天,由图5-D可以观察到对照组的霉菌生长面积增大,馒头片发霉严重,而各实验组的馒头片上仍未观察到霉菌。结合前面分析可知,植物乳植杆菌Q7后生元在37~121 ℃具有良好的热稳定性,抑菌效果保持良好,植物乳植杆菌Q7后生元表现出良好的生物防腐性能。刘怡君[25]发现乳酸菌发酵上清液能够高效抑制鲜食花生在贮藏期间的霉变产生,BARTKIENE等[26]发现乳酸杆菌发酵液与蔓越莓涂层相结合可以有效防止小麦面包发生霉变,提高面包品质,延长保质期。总体来看,植物乳植杆菌Q7后生元在防止食品腐败方面具有很好的应用前景。

A-第1天;B-第3天;C-第7天;D-第10天
图5 植物乳植杆菌Q7后生元对馒头发霉的抑制效果
Fig.5 Inhibition effect of L.plantarum Q7 postbiotic on mouldiness of steamed buns
2.6 植物乳植杆菌Q7后生元对牛乳中单增李斯特菌落数的影响
根据GB 19645—2010《食品安全国家标准 巴氏杀菌乳》规定,符合标准的巴氏杀菌乳中菌落总数应低于105 CFU/mL。研究了植物乳植杆菌Q7后生元对牛乳中单增李斯特菌抑制效果的影响,结果如图6所示。对照组牛乳在4 ℃贮存1 d后,牛乳中的单增李斯特菌菌落数>103 CFU/mL,在第5天时已经超过国家标准,>105 CFU/mL,在第13天已高达109 CFU/mL。与对照组相比,添加了植物乳植杆菌Q7后生元的牛乳在4 ℃贮存3 d后,菌落总数仍可以控制在103 CFU/mL以内。从第5天开始,菌落数逐渐超过103CFU/mL,第11天的菌落数开始略超过国标规定,贮存第13天的菌落数达到106。因此,将植物乳植杆菌Q7后生元添加到牛乳中可以有效减缓牛乳中单增李斯特菌的生长繁殖,延缓牛乳的腐败进程,对牛乳贮藏起到较好的保鲜效果。
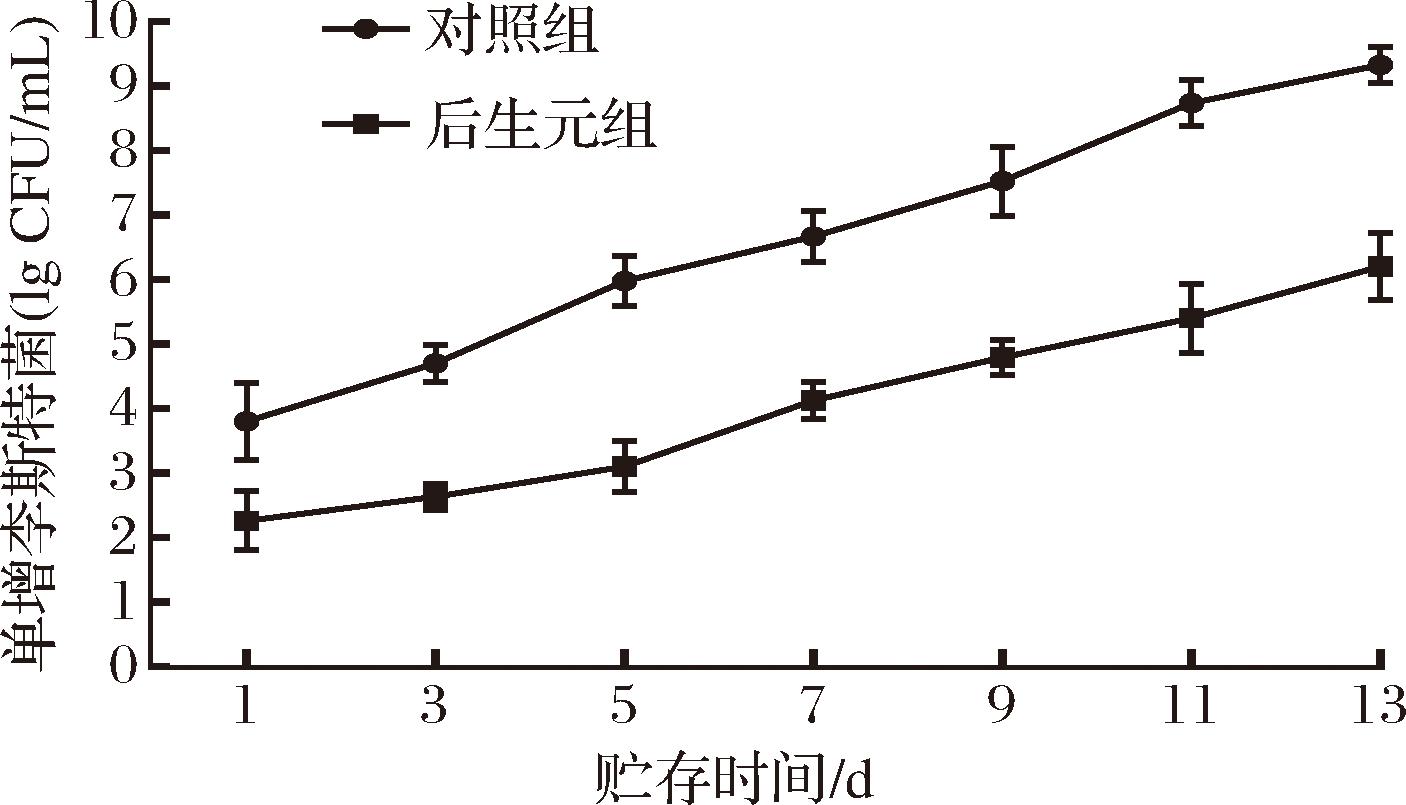
图6 植物乳植杆菌Q7后生元对牛乳中单增李斯特菌落数的影响
Fig.6 Effect of L.plantarum Q7 postbiotic on the colony count of L.monocytogenes in milk
3 结论
本研究通过研究植物乳植杆菌Q7后生元的热稳定性和抑菌性能,利用喷雾干燥和冷冻干燥分别制备了植物乳植杆菌Q7后生元,并将其应用到馒头和牛乳的防腐保鲜。发现植物乳植杆菌Q7后生元具有较好的稳定性,在喷雾干燥和真空冷冻干燥处理后,植物乳植杆菌后生元仍呈现出良好的抑菌能力,并且可以有效延缓馒头和牛乳腐败时间。综上,植物乳植杆菌Q7后生元具有抗菌活性强,稳定性好等特点,有望作为食品生物防腐剂用于食品的防腐保鲜。
[1] BHONSLE K, VYAS A, VYAS H.The role of probiotics in human health and prevention of disease:A review[J].IP Journal of Nutrition, Metabolism and Health Science, 2023, 6(2):66-69.
[2] 刘红霞, 李雪利, 吴秀英, 等.后生元研究进展及应用现状[J].食品科学, 2024, 45(1):326-333.LIU H X, LI X L, WU X Y, et al.Progress on research and application of postbiotics[J].Food Science, 2024, 45(1):326-333.
[3] 谢莹莹, 庞旭, 周海泳, 等.后生元的作用机制及其在食品领域的应用[J].食品科学, 2024, 45(8):354-363.XIE Y Y, PANG X, ZHOU H Y, et al.Action mechanisms of postbiotics and their applications in food field[J].Food Science, 2024, 45(8):354-363.
[4] SALMINEN S, COLLADO M C, ENDO A, et al.The International Scientific Association of Probiotics and Prebiotics (ISAPP) consensus statement on the definition and scope of postbiotics[J].Nature Reviews.Gastroenterology &Hepatology, 2021, 18(9):649-667.
[5] AGUILAR-TOAL J E, GARCIA-VARELA R, GARCIA H S, et al.Postbiotics:An evolving term within the functional foods field[J].Trends in Food Science &Technology, 2018, 75:105-114.
J E, GARCIA-VARELA R, GARCIA H S, et al.Postbiotics:An evolving term within the functional foods field[J].Trends in Food Science &Technology, 2018, 75:105-114.
[6] KHODAII Z, GHADERIAN S M H, NATANZI M M.Probiotic bacteria and their supernatants protect enterocyte cell lines from enteroinvasive Escherichia coli (EIEC) invasion[J].International Journal of Molecular and Cellular Medicine, 2017, 6(3):183-189.
[7] IZUDDIN W I, LOH T C, SAMSUDIN A A, et al.Effects of postbiotic supplementation on growth performance, ruminal fermentation and microbial profile, blood metabolite and GHR IGF-1 and MCT-1 gene expression in post-weaning lambs[J].BMC Veterinary Research, 2019, 15(1):315.
[8] ANDRESEN V, GSCHOSSMANN J, LAYER P.Heat-inactivated Bifidobacterium bifidum MIMBb75 (SYN-HI-001) in the treatment of irritable bowel syndrome:A multicentre, randomised, double-blind, placebo-controlled clinical trial[J].The Lancet.Gastroenterology &Hepatology, 2020, 5(7):658-666.
[9] 舒鑫, 黄雯霞, 马世越, 等.植物乳杆菌后生元缓解小鼠沙门氏菌感染的作用效果及机理[J].微生物学报, 2024, 64(4):1095-1109.SHU X, HUANG W X, MA S Y, et al.Effects and mechanism of Lactobacillus plantarum postbiotics on protecting against Salmonella enterica Typhimurium infection in mice[J].Acta Microbiologica Sinica, 2024, 64(4):1095-1109.
[10] 陈峰, 李敏玉, 刘玲, 等.灭活卷曲乳杆菌CCFM1118缓解幽门螺杆菌感染的作用评价[J].食品与发酵工业, 2024, 50(9):1-8.CHEN F, LI M Y, LIU L, et al.Evaluation of the effect of inactivated Lactobacillus crispatus CCFM1118 against Helicobacter pylori infection[J].Food and Fermentation Industries, 2024, 50(9):1-8.
[11] LIU Y X, BU Y S, LI J X, et al.Inhibition activity of plantaricin Q7 produced by Lactobacillus plantarum Q7 against Listeria monocytogenes and its biofilm[J].Fermentation, 2022, 8(2):75.
[12] 刘辉. 抑制耐冷菌的乳酸菌抗菌肽筛选及其结构和抗菌机理研究[D].哈尔滨:哈尔滨工业大学, 2016.LIU H.Screening, structure and mode of action of antimicrobial peptides inhibited psychrotrophs from lactic acid bacteria[D].Harbin:Harbin Institute of Technology, 2016.
[13] BU Y S, LIU Y S, LIU Y X, et al.Screening and probiotic potential evaluation of bacteriocin-producing Lactiplantibacillus plantarum in vitro[J].Foods, 2022, 11(11):1575.
[14] BU Y S, LIU Y S, LIU Y X, et al.Protective effects of bacteriocin-producing Lactiplantibacillus plantarum on intestinal barrier of mice[J].Nutrients, 2023, 15(16):3518.
[15] 向宬屹, 叶泽, 季彬, 等.一种植物乳杆菌菌剂喷雾干燥的制备工艺[J].中国食品添加剂, 2022, 33(7):105-111.XIANG C Y, YE Z, JI B, et al.Spray-drying conditions for Lactobacillus plantarum[J].China Food Additives, 2022, 33(7):105-111.
[16] 宫俊峰, 张国柱, 赵玉明, 等.植物乳杆菌真空冷冻干燥工艺的优化[J].食品工业, 2022, 43(9):71-74.GONG J F, ZHANG G Z, ZHAO Y M, et al.Optimization of vacuum freeze-drying process of Lactobacillus plantarum[J].The Food Industry, 2022, 43(9):71-74.
[17] 章燕玫. 细菌素RSQ01的抗菌特性及其在牛奶保鲜中的应用和机制[D].昆明:昆明理工大学, 2023.ZHANG Y M.Antibacterial properties of bacteriocin RSQ01 and its application and mechanism in milk preservation[D].Kunming:Kunming University of Science and Technology, 2023.
[18] CHEN X R, ZHAO X C, DENG Y H, et al.Antimicrobial potential of myristic acid against Listeria monocytogenes in milk[J].The Journal of Antibiotics, 2019, 72(5):298-305.
[19] SHENDEROV B A.Metabiotics:Novel idea or natural development of probiotic conception[J].Microbial Ecology in Health and Disease, 2013, 24:24.
[20] 李兴峰, 江波, 潘蓓蕾.新型生物防腐剂:苯乳酸在食品中的研究与应用[J].食品与发酵工业, 2007, 33(5):87-91.LI X F, JIANG B, PAN B L.Research and application in food of phenyllactic acid as a novel biopreservative:A review[J].Food and Fermentation Industries, 2007, 33(5):87-91.
[21] 王佳佳, 吴晓光, 刘学军.发酵肉制品中抗氧化活性乳酸菌的筛选及鉴定[J].粮食与油脂, 2023, 36(11):149-153.WANG J J, WU X G, LIU X J.Screening and identification of lactic acid bacteria with antioxidant activity in fermented meat products[J].Cereals &Oils, 2023, 36(11):149-153.
[22] WANG Y X, JING L J, ZHAO S H, et al.Inhibitory effect of lactic acid bacteria on Salmonella[J].Asian Agricultural Research, 2022, 14(5):27-30.
[23] 王虹军, 田星, 陈芝娟.具有抑菌活性植物乳杆菌细菌素生物稳定性研究[J].海南师范大学学报(自然科学版), 2022, 35(3):282-286, 296.WANG H J, TIAN X, CHEN Z J.Biostability of bacteriocin with antimicrobial activity produced by Lactobacillus plantarum[J].Journal of Hainan Normal University (Natural Science), 2022, 35(3):282-286, 296.
[24] BARAJAS- LVAREZ P, GONZ
LVAREZ P, GONZ LEZ-
LEZ- VILA M, ESPINOSA-ANDREWS H.Microencapsulation of Lactobacillus rhamnosus HN001 by spray drying and its evaluation under gastrointestinal and storage conditions[J].LWT, 2022, 153:112485.
VILA M, ESPINOSA-ANDREWS H.Microencapsulation of Lactobacillus rhamnosus HN001 by spray drying and its evaluation under gastrointestinal and storage conditions[J].LWT, 2022, 153:112485.
[25] 刘怡君. 乳酸菌的抑霉活性研究及其在鲜食花生储藏中的应用[D].郑州:河南工业大学, 2023.LIU Y J.Study on the antifungal activity of lactic acid bacteria and its application in the storage process of fresh edible peanuts[D].Zhengzhou:Henan University of Technology, 2023.
[26] BARTKIENE E, BARTKEVICS V, LELE V, et al.A concept of mould spoilage prevention and acrylamide reduction in wheat bread:Application of lactobacilli in combination with a cranberry coating[J].Food Control, 2018, 91:284-293.