乙酸苄酯是一种芳香酯,因其具有茉莉花、栀子花和铃兰等香味而备受关注。它通常用作香水、化妆品和肥皂香料中的基础香料成分,是香料行业中最大的品种之一[1]。乙酸苄酯天然存在于丁香、洋甘菊、茉莉花和风信子中,植物提取难以满足市场需求,因此乙酸苄酯主要是通过化学合成生产。化学反应一般在H2SO4存在下进行,这不仅会引起设备腐蚀,提高生产的成本,而且同时产生大量废液,后处理工艺复杂,环境污染严重。乙酸苄酯直接前体为苯甲醇,而苯甲醇的商业化生产主要以石油为原料,最常见的方式是氯化苄通过碱性水解发生[2],存在反应条件采用苛刻,原料不可再生等问题。以苯甲醇为起始,通过生物转化法合成乙酸苄酯也有相关报道。例如,通过在大肠杆菌中表达金黄色葡萄球菌的CATSa基因,外部添加2 g/L苯甲醇,通过高密度发酵培养,乙酸苄酯的质量浓度达到(152.44±29.5) mg/L[3];在含有来自酿酒酵母醇酰基转移酶(alcohol O-acetyltransferase,ATF1)的工程化大肠杆菌中,喂食2 g/L苯甲醇,通过高细胞密度发酵产生乙酸苄酯的质量浓度达到(1 177.98±45.72) mg/L[4]。
早在2015年PUGH等[5]实现了以葡萄糖为碳源从头生物合成苯甲醇(114±1) mg/L,主要通过在大肠杆菌中表达来自东方淀粉菌的扁桃酸合酶HmaS催化苯丙酮酸合成扁桃酸,来自恶臭假单胞菌的MdlB和MdlC催化扁桃酸转化为苯甲醛,苯甲醛在大肠杆菌内源性脱氢酶作用下生产苯甲醇。2019年LUKITO等[6]研究报道了通过6步酶级联反应包括脱氨-脱羧-环氧化-水解-氧化-氧化,实现L-苯丙氨酸生物转化合成(S)-扁桃酸。在此基础上,2020年ZHOU等[7]研究报道构建重组菌以甘油或葡萄糖为碳源发酵合成苯丙氨酸,然后构建另一重组菌表达9种酶,实现苯丙氨酸经扁桃酸、苯甲醛生物转化合成苯甲酸。2020年LUO等[8]创建了一种基于辅酶A依赖性β-氧化途径的苯甲酸生物合成途径,最终工程菌株进行分批补料发酵,利用葡萄糖产生(2.37±0.02) g/L苯甲酸。理论上苯甲醇可以通过羧酸还原酶催化苯甲酸而获得,然而羧酸还原酶多具有底物宽泛性,途径中间产物肉桂酸易还原为副产物肉桂醇,造成中间产物分流,难以合成苯甲醇。
本研究中,基于上述ZHOU等[7]构建苯甲酸的途径中苯丙氨酸到苯甲醛的合成反应,采用模块化方法,在大肠杆菌中创建了乙酸苄酯从头合成途径,包括苯乙烯合成模块、(S)-扁桃酸合成模块和乙酸苄酯合成模块。初步获得的工程化菌株BZ04在摇瓶中发酵,以甘油和葡萄糖为碳源合成(85.55±10.85) mg/L乙酸苄酯;优化筛选乙酸苄酯合成模块中的酰基转移酶,实现乙酸苄酯产量的提高。通过培养基中碳源优化筛选、增溶剂添加以及增加O2的供应等,进一步提高了乙酸苄酯产量。最优菌株BZ05在所筛选的发酵条件下,以甘油为碳源,在摇瓶中发酵培养产生(592.22±36.95) mg/L乙酸苄酯。本研究为开发高效的乙酸苄酯生物合成提供了可能,同时也为芳香族化合物微生物细胞工厂创建提供了参考。
1 材料与方法
1.1 实验材料
1.1.1 菌株和质粒
实验中所用菌株与质粒见表1,本实验所用的出发菌株为BL21(DE3),BL21(DE3)感受态细胞,购自北京擎科生物科技有限公司。质粒构建采用酶切酶连或无缝克隆,菌落PCR方法筛选阳性克隆并送金唯智测序验证,本研究所使用的引物见表2。
表1 本研究所中使用的菌株与质粒
Table 1 Strains and plasmids used in this study

菌株或质粒相关特征来源StrainsBL21(DE3)F-, ompT, hsdSB(rB-, mB-), gal, dcm (DE3)本实验室BZ01BL21 containing pACY-RgPAL-ScPAD本研究BZ02BL21 containing pACY-RgPAL-AnPAD本研究BZ03BL21 containing pACY-RgPAL-AnPAD, pCDF-StyAB-Speh and pET-AlkJ-FeaB本研究BZ04BL21 containing pACY-RgPAL-AnPAD, pCDF-StyAB-Speh, pET-AlkJ-FeaB and pRSF-MdlCB-ATF1本研究BZ05BL21 containing pACY-RgPAL-AnPAD, pCDF-StyAB-Speh, pET-AlkJ-FeaB and pRSF-MdlCB-CAT本研究BZ06BL21 containing pACY-RgPAL-AnPAD, pCDF-StyAB-Speh, pET-AlkJ-FeaB and pRSF-MdlCB-798本研究Plasmids本研究pETDuet-1ColE1 origin, AmpR本研究pRSFDuet-1RSF origin, KanR本研究pACYCDuet-1p15A origin, CmR本研究pCDFDuet-1CloDF13 origin, SmR本研究pACY-RgPAL-ScPADpACYCDuet-1 carrying RgPAL and ScPAD本研究pACY-RgPAL-AnPADpACYCDuet-1 carrying RgPAL and AnPAD本研究pCDF-StyAB-SpehpCDFDuet-1 carrying StyA, StyB and Speh本研究pET-AlkJ-FeaBpETDuet-1 carrying AlkJ and FeaB本研究pRSF-MdlCBpRSFDuet-1 carrying MdlC and MdlB本研究pRSF-MdlCB-ATF1pRSFDuet-1 carrying MdlC, MdlB and ATF1本研究pRSF-MdlCB-CATpRSFDuet-1 carrying MdlC, MdlB and CATec3-Y20F本研究pRSF-MdlCB-798pRSFDuet-1 carrying MdlC, MdlB and ANN09798本研究
表2 本研究中使用的引物
Table 2 Primers used in this study

引物名称引物序列(5′-3′)ScPAD1-FAAAACATATGCTCCTATTTCCAAGAAGAACScPAD1-RTGCTCCTTGGATCCGTTACTTGCTTTTTATTCCTTCCCScFdc1-FACGGATCCAAGGAGCAAATGAGGAAGCTAAATCCAGScFdc1-RAAAAGACGTCTTATTTATATCCGTACCTTTTCCalkJ-F2ATCATCACCACAGCCAGGATCCATGTATGATTATATTATTGTGGGalkJ-R2AACCGCATGGGCGATTTACATGCACACCGCfeaB-F2ATCGCCCATGCGGTTATGACAGAGCCGCATGfeaB-R2AAGCATTATGCGGCCGCTTAATACCGTACACACACCGmdlBC-5FATCATCACCACAGCCAGGATCCGATGTCACAGAATCTGTTTAATGTGGmdlB-R4TGGTATATCTCCTTATTCATGCATGGGTGCCTTTACCmdlC-F2ATAAGGAGATATACCATGGCCTCAGTTCATGGmdlBC-3RACCTGCAGGCGCGCCGAGCTCTTATTTAACCGGACTCACGG798-FAGTATAAGAAGGAGATATACATATGGACTCTAAACAGTCTTCTG798-R1TTACCAGACTCGAGTGCGGCCGCAAGCTTGTCGACGGAGCTCGAATTCGGATCCTTACAGAGCCGGACGGCATec3-FAAAACATATGATGAACTATACCAAATTTGCATec3-RAAAACTCGAGTTATTTCAGTTTGCTGTTGCATF1-FATATCGGCCGGCCACGCGATCGCGATGAATGAAATCGATGAGATF1-RAGCGGTTTCTTTACCAGACTCGAGCTAAGGGCCTAAAAGG
1.1.2 主要实验试剂
2×Taq PCR Master Mix、高保真DNA聚合酶、一步克隆试剂盒等,南京诺唯赞生物科技有限公司;限制性内切酶、DNA连接酶,Thermo Fisher公司;DNA纯化回收试剂盒、质粒小量提取试剂盒、凝胶回收试剂盒等,北京天根生化科技有限公司;基因、引物合成及测序,金唯智公司。
1.1.3 化学试剂
NaCl、葡萄糖、NH4Cl、Na2HPO4·12H2O,国药集团;蛋白胨、酵母粉、MgSO4、Na2SO4、CaCl2、甘油、琼脂粉、IPTG,北京索莱宝科技有限公司;KH2PO4,天津风船;琼脂糖,伯乐公司;氨苄青霉素、卡那霉素、链霉素、氯霉素、甲醇,西格玛奥德里奇生化科技有限公司;乙酸苄酯,上海源叶生物科技有限公司;(S)-扁桃酸、肉豆蔻酸异丙酯,麦克林生化科技有限公司;苯甲醇、苯乙烯,希恩思生化科技有限公司。
1.1.4 培养基
LB培养基(g/L):10.0 NaCl,5.0酵母粉,10.0蛋白胨;固体LB在液体LB培养基中加入15~20琼脂粉;发酵培养基G(g/L):10甘油,6.8 KH2PO4,17.9 12H2O·Na2HPO4,0.71 Na2SO4,2.67 NH4Cl,15蛋白胨,5酵母粉,2 mmol/L MgSO4,0.1 mmol/L CaCl2,高压蒸汽灭菌121 ℃,20 min。(其中MgSO4与CaCl2单独灭菌之后再加入培养基中)。抗生素质量浓度分别为:卡那霉素50 mg/L,氨苄青霉素100 mg/L,链霉素50 mg/L,氯霉素25 mg/L。600 g/L甘油和200 g/L葡萄糖,115 ℃、30 min灭菌。
1.1.5 主要仪器与设备
PCR仪,德国Eppendorf公司;核酸/垂直电泳仪,Bio-Rad公司;高效液相色谱仪、分光光度计,岛津仪器有限公司;液质色谱联用仪,安捷伦科技有限公司;电转化仪;德国艾本德公司。
1.2 实验方法
1.2.1 培养方法
摇瓶发酵:取出保存于-80 ℃冰箱的菌株在相应抗性的LB固体培养基平板上划线,于37 ℃培养箱中培养过夜,待长出单克隆菌落;挑取单克隆于相应抗性的5 mL液体LB培养基中,摇床培养(转速为220 r/min,温度37 ℃)。过夜培养后,作为种子液。取1 mL种子液接种于含有相应抗性的45 mL G培养基中,摇床培养(转速220 r/min,温度37 ℃),至OD600值为0.6~0.8时,加入诱导剂IPTG,IPTG终浓度为0.1 mmol/L,诱导培养温度为23 ℃,培养时间为16~18 h。诱导结束后,加入相应的200 g/L葡萄糖溶液或600 g/L甘油(葡萄糖溶液与甘油总体积为5 mL)。然后于30 ℃连续培养。其中乙酸苄酯发酵,再转30 ℃连续培养7 h时,加入肉豆蔻酸异丙酯。发酵48 h取样,用于测定菌体生长OD600及发酵产物。实验设定3个重复。
1.2.2 HPLC检测条件
HPLC检测系统是安捷伦液相色谱仪,C18柱(4.6 mm×250 mm)。乙酸苄酯、(S)-扁桃酸、苯乙烯的检测条件如下:流动相A为水(含0.1%甲酸),B为甲醇;流速1 mL/min;梯度洗脱条件,0.01~2 min,25%B保持不变;2~25 min,25%~100%B;25~35 min 100%B;35~36 min 100%~25%B;36~46 min 25%B,进样量20 μL,检测波长254 nm。
1.2.3 生物量的测定
紫外-可见分光光度法:吸取适量发酵液稀释一定倍数后,使用紫外-可见分光光度计测定波长600 nm处的吸光度值。
2 结果与分析
2.1 大肠杆菌从头合成乙酸苄酯的通路设计
本研究构建的乙酸苄酯合成途径如图1所示。葡萄糖或甘油可以通过莽草酸途径生成L-苯丙氨酸1,L-苯丙氨酸1通过苯丙氨酸裂解酶(phenylalanine ammonia lyase,PAL)和苯丙烯酸脱羧酶(phenylacrylic acid decarboxylase,PAD)高效脱氨脱羧获得苯乙烯3[9]。苯乙烯单加氧酶(styrene monooxygenase,SMO)环氧化苯乙烯3为氧化苯乙烯4。环氧化物水解酶(epoxide hydrolase,SpEH)水解氧化苯乙烯4为(S)-1-苯基-1,2-乙二醇5,然后经醇脱氢酶(alcohol dehydrogenase,AlkJ)生成(S)-扁桃醛6。(S)-扁桃醛6在大肠杆菌内源的苯乙醛脱氢酶(aldehyde dehydrogenase,EcALDH)作用下氧化为(S)-扁桃酸7。(S)-扁桃酸7经S-扁桃酸脱氢酶(S-mandelate dehydrogenase,SMDH)和苯甲酰甲酸酯脱羧酶(benzoylformate decarboxylase,BFD)转化为苯甲醛9。苯甲醛9在大肠杆菌内源醇脱氢酶、醛/酮还原酶作用下自发生成苯甲醇10。然后经酰基转移酶催化乙酰CoA的乙酰基至苯甲醇10,生成乙酸苄酯11。
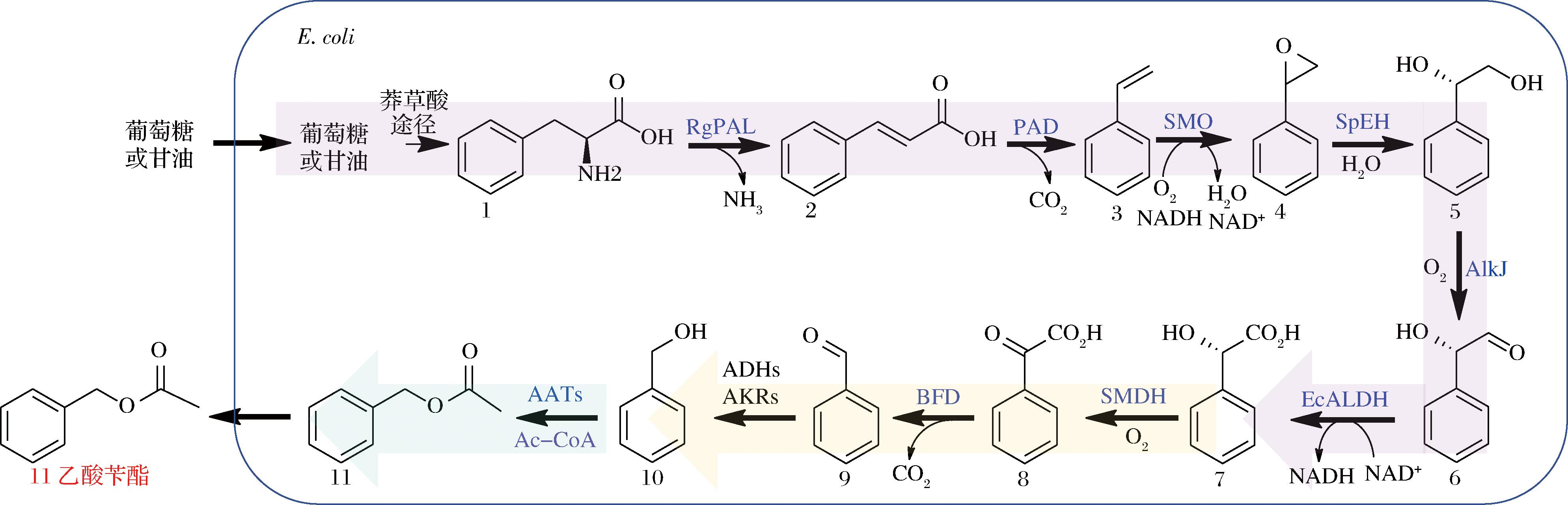
图1 大肠杆菌从头合成乙酸苄酯的通路设计
Fig.1 De novo synthetic pathway designed for benzyl acetate production in Escherichia coli
注:1-L-苯丙氨酸;2-反式肉桂酸;3-苯乙烯;4-氧化苯乙烯;5-(S)-1-苯基-1,2-乙二醇;6-(S)-扁桃醛;7-(S)-扁桃酸[(S)-MA];8-(S)-苯乙醛酸;9-苯甲醛;10-苯甲醇;11-乙酸苄酯。
在乙酸苄酯途径构建中,分为3个模块进行基因协同表达。包括苯乙烯合成模块I,扁桃酸合成模块Ⅱ,及乙酸苄酯合成模块Ⅲ,如图2所示。在模块I中,来源于黏红酵母的苯丙氨酸裂解酶PAL(RgPAL)[10],以及2种不同来源于的脱羧酶PAD,分别为来源于酿酒酵母的ScPAD(Scfdc与Scpad)[11]和来源于黑曲霉的AnPAD(Anfdc与Anpad)[9],构建到质粒pACYCDuet-1上,用于催化苯丙氨酸到苯乙烯的合成。分别将质粒pACY-RgPAL-ScPAD和pACY-RgPAL-AnPAD)质粒(图2)转化至大肠杆菌BL21(DE3),得到大肠杆菌BZ01与BZ02菌株。摇瓶发酵中添加碳源为12 g/L葡萄糖和24 g/L甘油(即甘油与葡萄糖的质量比为2∶1),检测苯乙烯3的合成。结果如图3-a所示,表达AnPAD的菌株BZ02可以检测到苯乙烯3合成,菌株BZ01(含有ScPAD)未检测到苯乙烯3。
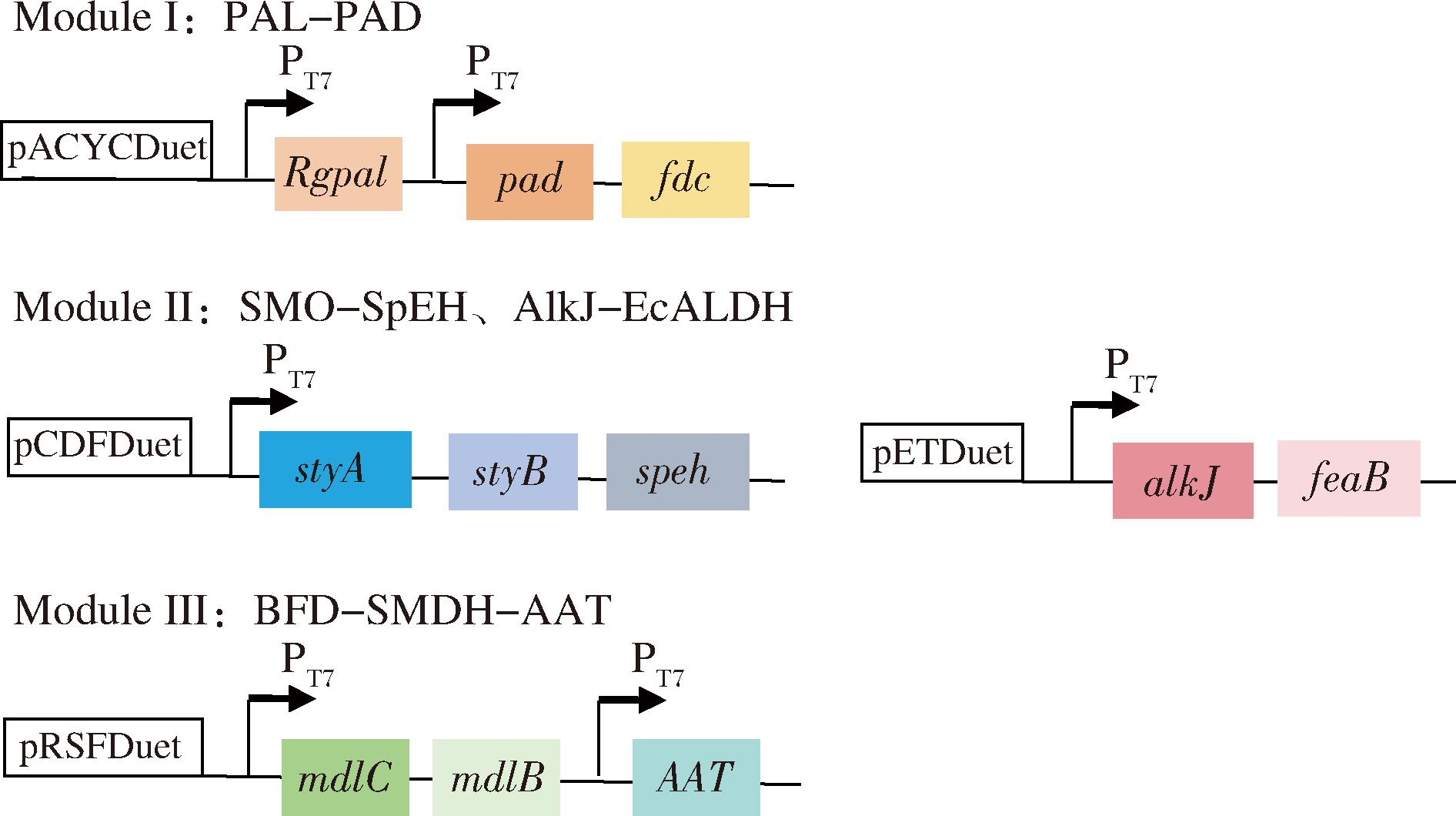
图2 模块Ⅰ~Ⅲ中所使用的质粒
Fig.2 Schematic illustration of the constructed plasmids in Modules Ⅰ-Ⅲ
注:模块I(苯乙烯3合成模块)包括两种异源酶:RgPAL(Rgpal),苯丙氨酸脱氨酶;PAD(pad与fdc),苯基丙烯酸脱羧酶。模块Ⅱ((S)-MA7合成模块)包括3种异源酶和1种内源酶:SMO(styA与styB),苯乙烯单加氧酶;SpEH(speh),环氧化物水解酶;AlkJ(alkJ),醇脱氢酶;EcALDH(feaB),醛脱氢酶。模块Ⅲ(乙酸苄酯11合成模块)包括3种异源酶:SMDH(mdlB),S-扁桃酸脱氢酶;BFD(mdlC),苯甲酰甲酸 酯脱羧酶,AAT,酰基转移酶(ATF1、ANN09798或CATec3-Y20F)。
扁桃酸合成模块Ⅱ如图2所示,选用来源于假单胞菌属VLB120的苯乙烯单加氧酶SMO(styA与styB)、来源于鞘氨醇单胞菌HXN-200的环氧化物水解酶SpEH(speh)、来源于恶臭假单胞菌GPo1的醇脱氢酶AlkJ(alkJ)以及来源于大肠杆菌的苯乙醛脱氢酶EcALDH(feaB)[12]。基因styAB和speh克隆到pCDFDuet-1质粒中,alkJ和feaB基因克隆到pETDuet-1的质粒中,基因在T7启动子的控制下表达。将模块Ⅱ两个质粒(pCDF-StyAB-Speh,pET-AlkJ-FeaB)共转化至大肠杆菌BZ02菌株,得到大肠杆菌BZ03(表1)。BZ03菌株在G培养基中发酵培养,碳源为12 g/L葡萄糖和24 g/L甘油,发酵液离心,上清液进行HPLC分析,结果如图3-b所示,在菌株BZ03中检测到了(S)-扁桃酸7的合成。乙酸苄酯合成模块Ⅲ构建中表达了来源于恶臭假单胞菌ATCC 12633的SMDH(mdlB)和BFD(mdlC)[13]。mdlB和mdlC克隆到质粒pRSFDuet-1上,产生质粒pRSF-MdlCB。再将来自酿酒酵母S288c的酰基转移酶基因ATF1[14-15]克隆到质粒pRSF-MdlCB上,即得质粒pRSF-MdlCB-ATF1如图2所示。将质粒pRSF-MdlCB-ATF1转化到构建的重组菌株BZ03,得到大肠杆菌BZ04(见表1)。菌株BZ04采用两相原位萃取的方法发酵,萃取剂选用肉豆蔻酸异丙酯[16-17],碳源为12 g/L葡萄糖和24 g/L甘油,肉豆蔻酸异丙酯发酵液体积的1/10,HPLC检测分析发酵产物水相和有机相中代谢产物。检测结果如图3-c所示。有机相中代谢物分析表明,在tR=17.2 min时有新化合物产生,与标品乙酸苄酯的出峰时间相同,并通过GC-MS进一步分析验证(图4)。根据乙酸苄酯的标准曲线计算,重组菌株BZ04产生了(85.55±10.85) mg/L乙酸苄酯(总量,包括有机相与水相),表明了在大肠杆菌重组菌株中实现了乙酸苄酯的从头生物合成。
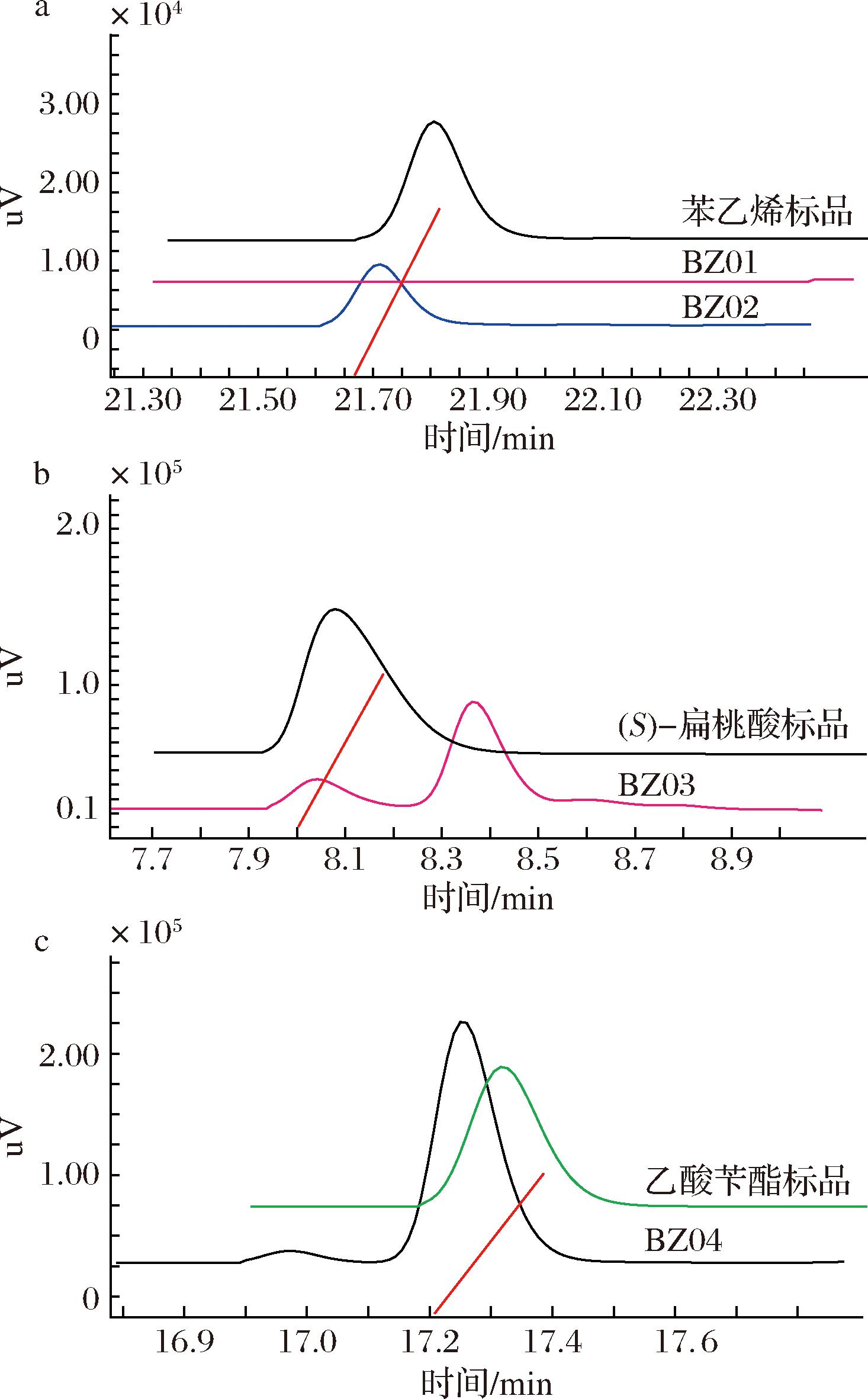
a-菌株BZ01与BZ02发酵代谢物的HPLC分析;b-菌株BZ03发酵代谢物的HPLC分析;c-菌株BZ04发酵代谢物有机相的HPLC分析图3 苯乙烯、(S)-扁桃酸及乙酸苄酯的HPLC分析
Fig.3 The HPLC analysis of styrene, (S)-MA, and benzyl acetate produced by engineered E.coli strains from mixed carbon sources
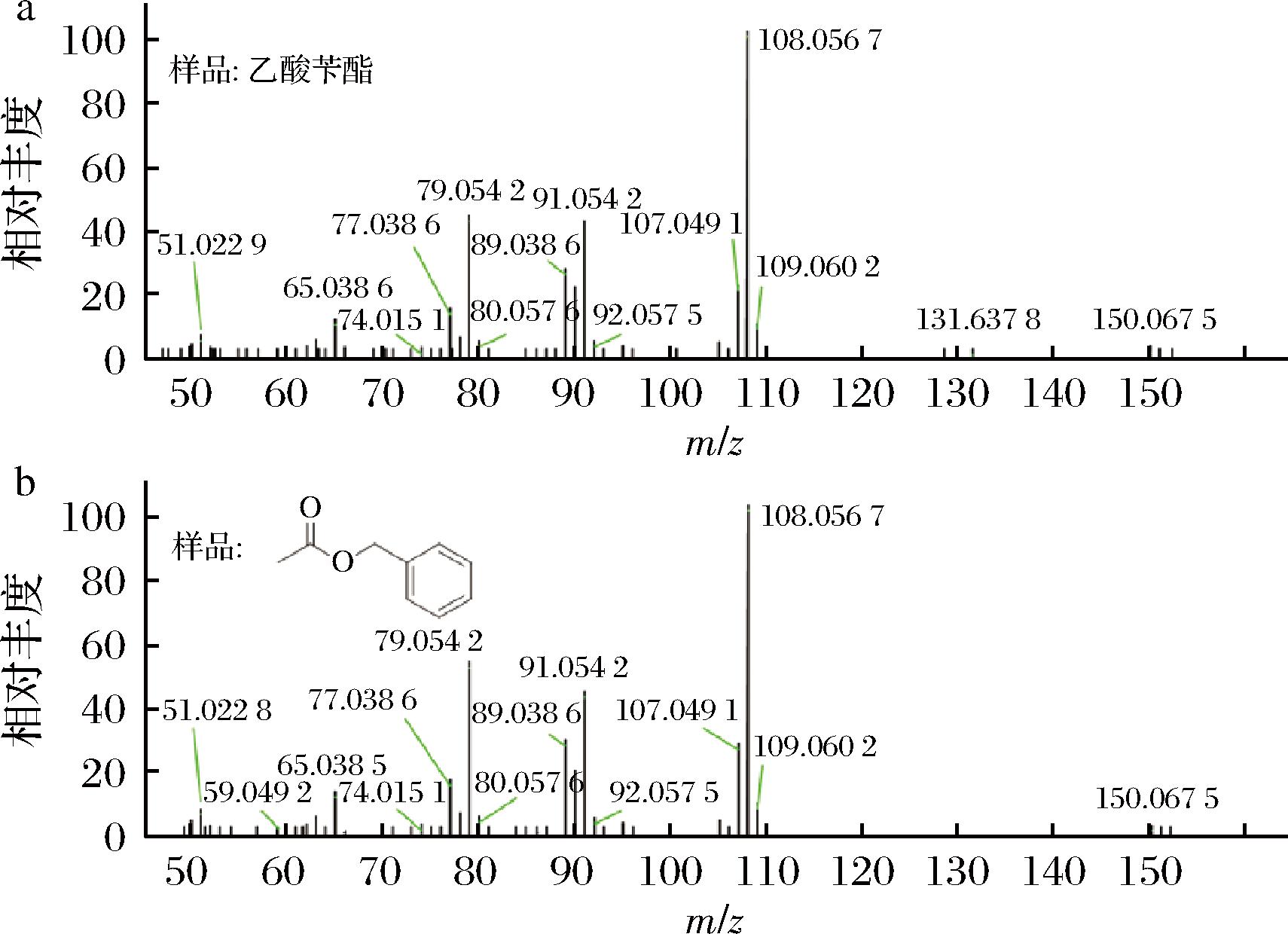
a-乙醇苄酯标准品;b-样品
图4 菌株BZ04生产的乙酸苄酯与乙酸苄酯标准品的GC-MS分析
Fig.4 The GC-MS analysis of benzyl acetate produced by BZ04 strain and benzyl acetate standard
2.2 筛选高活性酰基转移酶提高乙酸苄酯的产量
模块Ⅲ中酰基转移酶(AATs)催化苯甲醇合成乙酸苄酯,是生物合成途径关键酶。本研究中,为了进一步提高乙酸苄酯合成,同时表达了其他两种不同来源的AATs,分别为来自热纤梭菌的CATec3-Y20F(UniProtKB/Swiss-Prot:P00484.1)[18]和来自自烟草的ANN09798(GenBank:AF500202.1)[19-20]。克隆基因CATec3-Y20F或ANN09798到质粒pRSF-MdlCB上,分别得质粒pRSF-MdlCB-CAT或pRSF-MdlCB-798。将质粒pRSF-MdlCB-CAT和pRSF-MdlCB-798分别转化到重组菌BZ03,得到大肠杆菌BZ05和BZ06同样采用两相原位萃取发酵策略,发酵检测结果如图5-a所示。HPLC分析检测结果显示,重组菌株BZ05和BZ06的有机相中同样检测到乙酸苄酯的产生。BZ05菌株(含有CATec3-Y20F基因)与BZ06菌株(含有ANN09798基因)的乙酸苄酯总产量分别为(104.13±14.0) mg/L、(7.56±0.72) mg/L。与BZ04菌株的乙酸苄酯总产量[(85.55±10.85) mg/L]相比,BZ05菌株乙酸苄酯的产量增加了21%,且BZ05相对于是BZ04和BZ06生长最好的,OD600值达到15.01±0.31(图5-b)。CATec3-Y20F比ATF1、ANN09798更利于乙酸苄酯的合成。
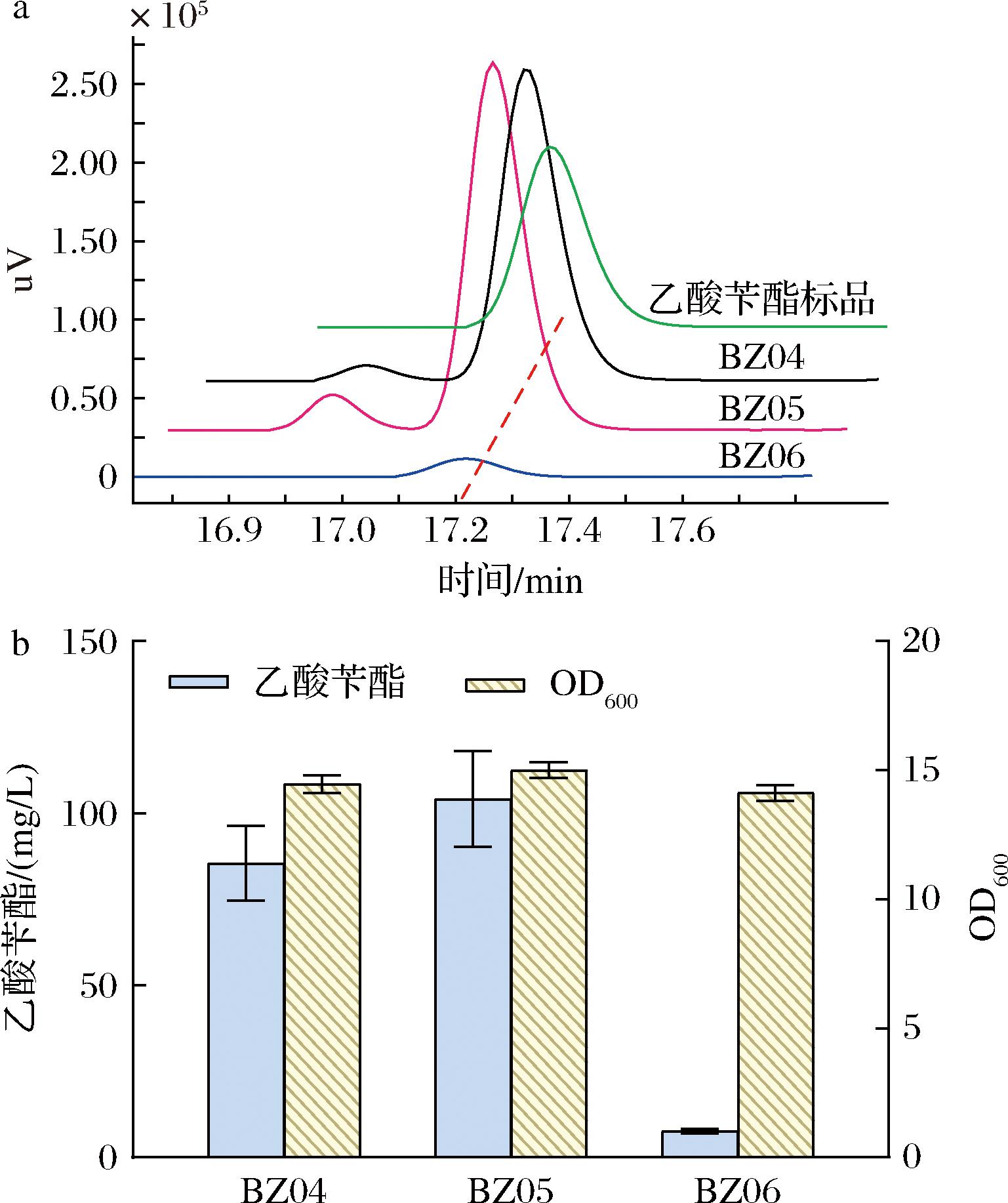
a-菌株EcYZ04(含有ATF1)、EcYZ05(含有CATec3-Y20F)和EcYZ06(含有ANN09798)有机相代谢物的HPLC分析;b-菌株EcYZ04、EcYZ05和EcYZ06生产乙酸苄酯的总量(包括有机相和水相)
图5 不同来源的酰基转移酶优化筛选
Fig.5 The optimal screening of acyltransferases from different sources
注:误差线代表平均数和标准差(下同)。
2.3 摇瓶发酵过程中甘油与葡萄糖比值的优化
实验发现,培养基中葡萄糖与甘油不同添加比例,对乙酸苄酯产量影响较大,本研究拟通过优化发酵过程中甘油/葡萄糖比例来提高乙酸苄酯的产量。以菌株BZ05进行两相原位萃取发酵,其中在23 ℃诱导完成之后,加入一系列不同质量比的甘油和葡萄糖,测定对乙酸苄酯产量的影响。所测定的甘油与葡萄糖质量比为1∶0、9∶2、3∶1、2∶1、3∶4及0∶1,若添加碳源为单一碳源时,葡萄糖为20 g/L,甘油为60 g/L。乙酸苄酯的总产量(包括水相和有机相)如图6所示,相对于其他比例的碳源,60 g/L甘油单独作为碳源时,产生的乙酸苄酯总产量最高,为(152.78±11.09) mg/L,是当甘油与葡萄糖比例为2∶1的1.47倍。对菌株生长检测结果显示,所测试的不同比例的甘油/葡萄糖对细胞生长影响较小,维持在13.5~15.1。研究结果表明,通过调整菌株的甘油/葡萄糖比值,可以适当调节细胞生长和乙酸苄酯的合成,而且补充60 g/L甘油在乙酸苄酯生产方面优于补充24 g/L甘油与12 g/L葡萄糖(即甘油与葡萄糖的质量比为2∶1)。推测当碳源为60 g/L甘油时,有利于碳通量流向乙酸苄酯的合成,可能进一步精细调控了细胞生长和乙酸苄酯产量的再平衡。基于此,在后续实验中,用60 g/L甘油作为碳源。
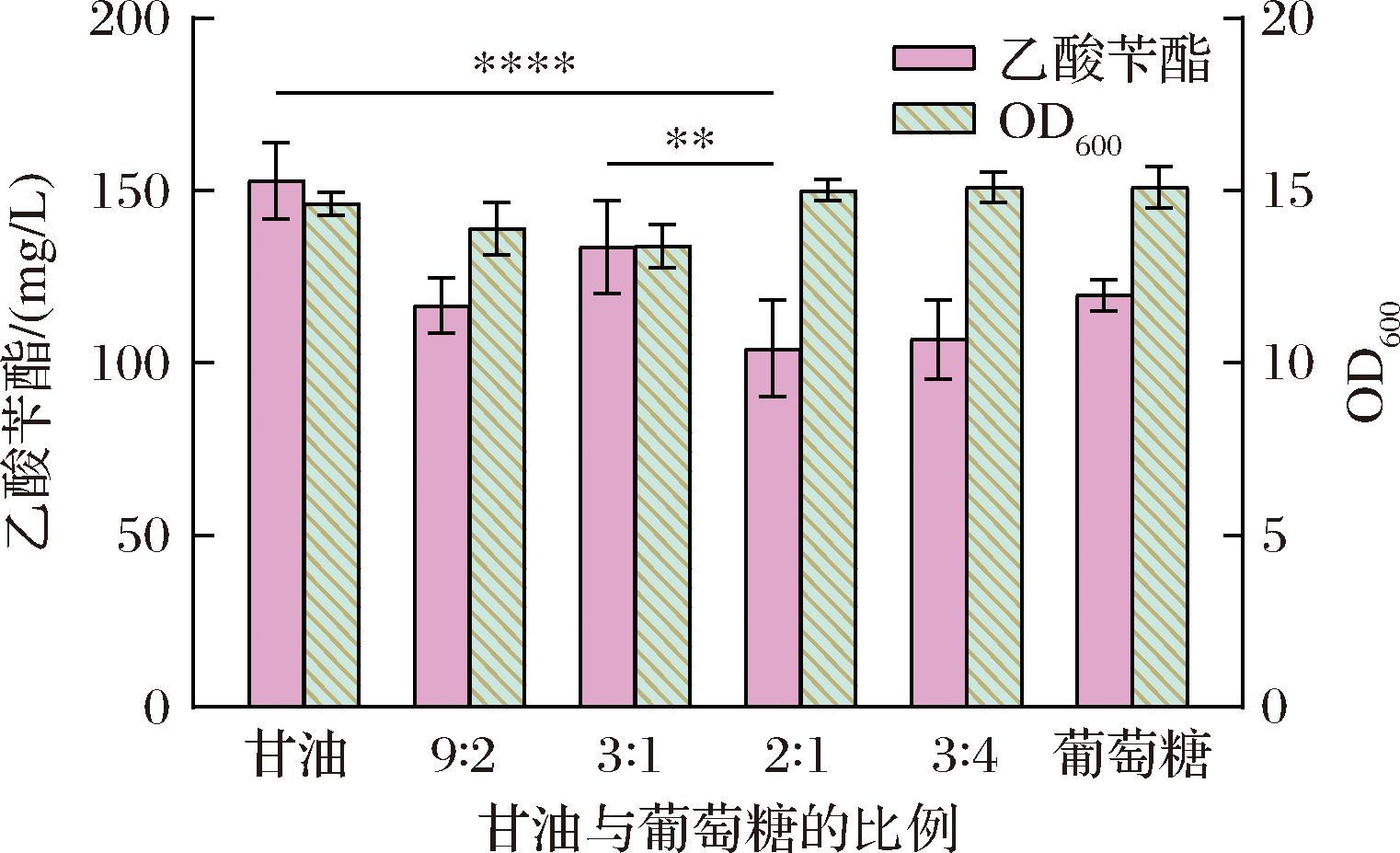
图6 混合碳源中甘油/葡萄糖比值对摇瓶发酵过程中细胞生长和乙酸苄酯总产量的影响
Fig.6 Effects of different ratios of glycerol/glucose in the mixed carbon sources on cell growth and total production of benzyl acetate in shake-flask fermentation
注:P值用双尾学生t检验(**表示P<0.01,****表示P<0.000 1)(下同)。
2.4 通过添加吐温-80以及使用挡板三角瓶来提高乙酸苄酯的量
非离子表面活性剂吐温-80,可以作为增溶剂和乳化剂,被广泛用于食品和化妆品[21]。其作为表面活性剂或营养物质,可以有效促进菌株对营养物质的吸收,防止菌体完整性的破坏,增强细胞膜的通透性[22]。本研究构建的合成途径中,终产物乙酸苄酯和途径关键中间体苯乙烯均是水溶性差易挥发性物质。实验中尝试在菌株BZ05发酵过程中添加增溶剂吐温-80,测试对摇瓶发酵过程中乙酸苄酯产量的影响。在酶的诱导表达结束后,加入甘油的同时,分别加入不同体积的吐温-80(1、2、3、4、5 mL),并以不添加吐温-80作为对照组。HPLC分析发酵液的水相和有机相的代谢产物。结果如图7所示,随着吐温-80加入量的增加,乙酸苄酯的总产量逐渐增加,其中更多的乙酸苄酯分散在水相中(表3)。当吐温-80加入量为5 mL时,乙酸苄酯的总产量最高,为(221.84±19.14) mg/L,是不添加吐温-80菌株的1.45倍。表明添加5 mL吐温-80,利于提高乙酸苄酯总产量及在水中的可溶性。
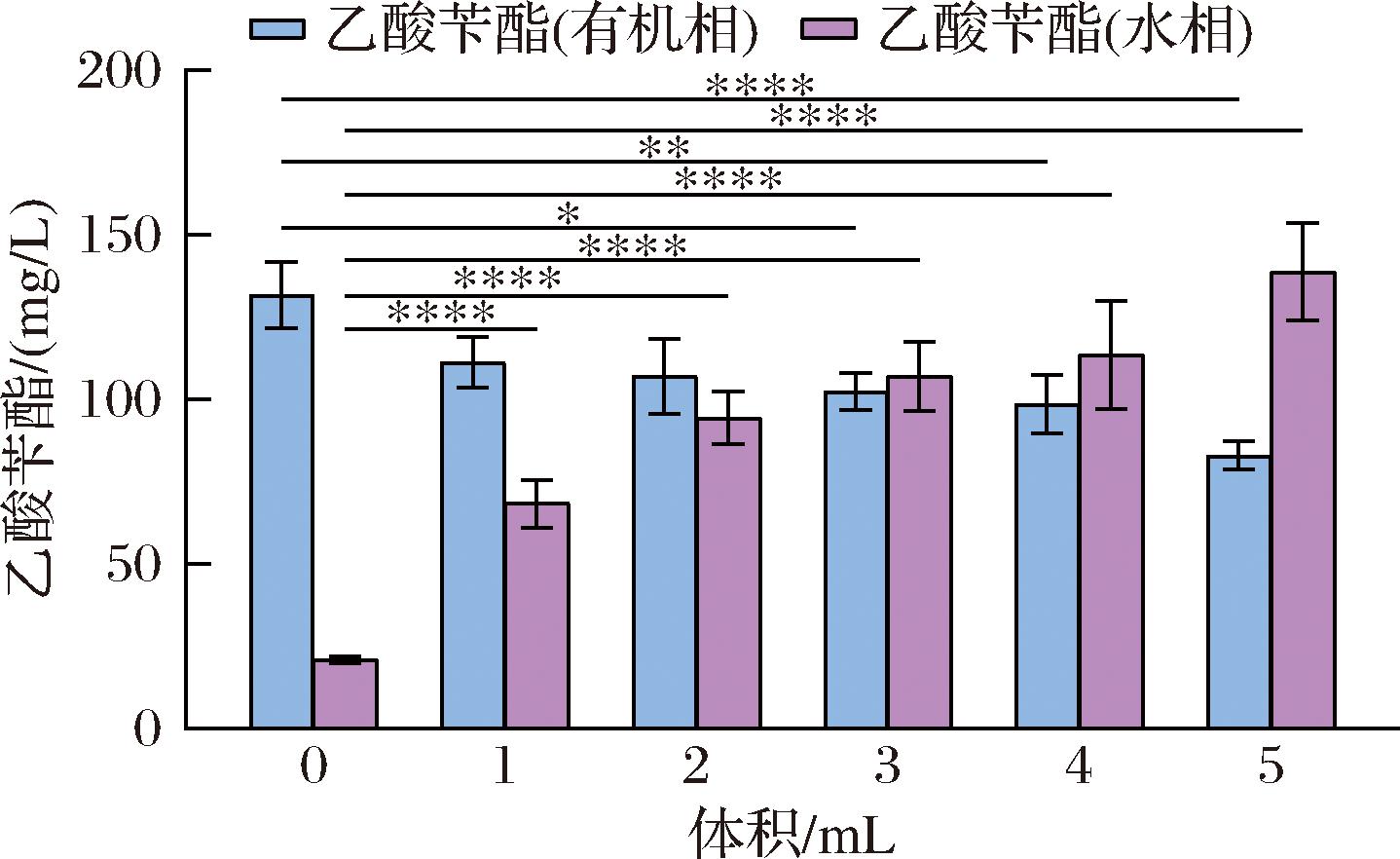
图7 吐温-80的加入量对摇瓶发酵过程中乙酸苄酯产量的影响
Fig.7 Effects of Tween-80 addition on benzyl acetate production in shake-flask fermentation
注:*表示P<0.05,***表示P<0.001。
表3 吐温-80不同添加量对乙酸苄酯产量的影响
Table 3 Effects of different addition volumes of Tween-80 on the production of benzyl acetate
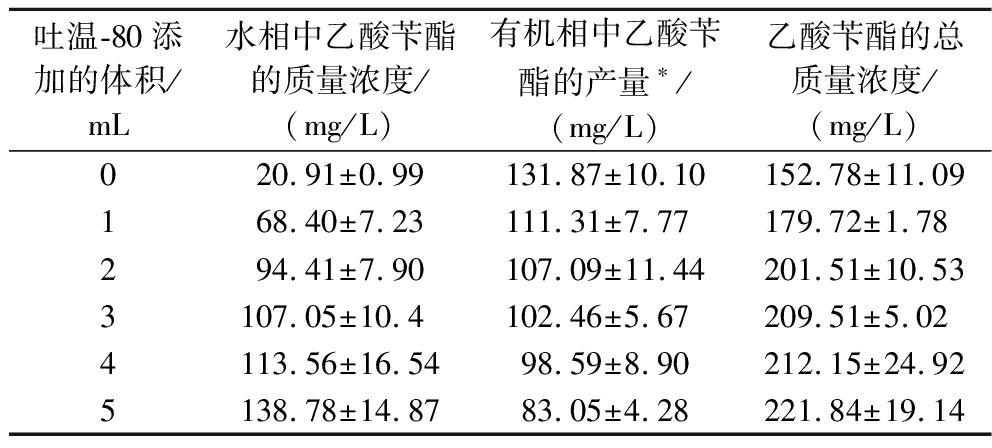
吐温-80添加的体积/mL水相中乙酸苄酯的质量浓度/(mg/L)有机相中乙酸苄酯的产量∗/(mg/L)乙酸苄酯的总质量浓度/(mg/L)020.91±0.99131.87±10.10152.78±11.09168.40±7.23111.31±7.77179.72±1.78294.41±7.90107.09±11.44201.51±10.533107.05±10.4102.46±5.67209.51±5.024113.56±16.5498.59±8.90212.15±24.925138.78±14.8783.05±4.28221.84±19.14
注:*有机相中乙酸苄酯的产量是被提取到有机相中样品的总质量(mg或g)除以50 mL(即水相的体积)计算得到。
在构建的乙酸苄酯从头合成的途径中,SMO催化苯乙烯环氧化的过程、AlkJ催化(S)-1-苯基-1,2-乙二醇脱氢的过程需要O2,在摇瓶发酵条件下,尝试使用挡板三角瓶来增加O2的量测试对乙酸苄酯产量的影响。菌株BZ05分别使用普通三角瓶、挡板三角瓶来进行摇瓶发酵,HPLC检测水相和有机相中乙酸苄酯。结果如图8所示,使用挡板三角瓶发酵之后,乙酸苄酯的总产量提高至(592.22±36.95)mg/L,是使用普通三角瓶发酵的2.7倍,推测挡板三角瓶有效增加了O2的供应,利于2个需氧反应的进行,进而增加乙酸苄酯的产量。至此,表达高活性酰基转移酶菌株BZ05在所优化筛选的发酵条件下,乙酸苄酯的总产量相对于起始乙酸苄酯总产量提高7倍。
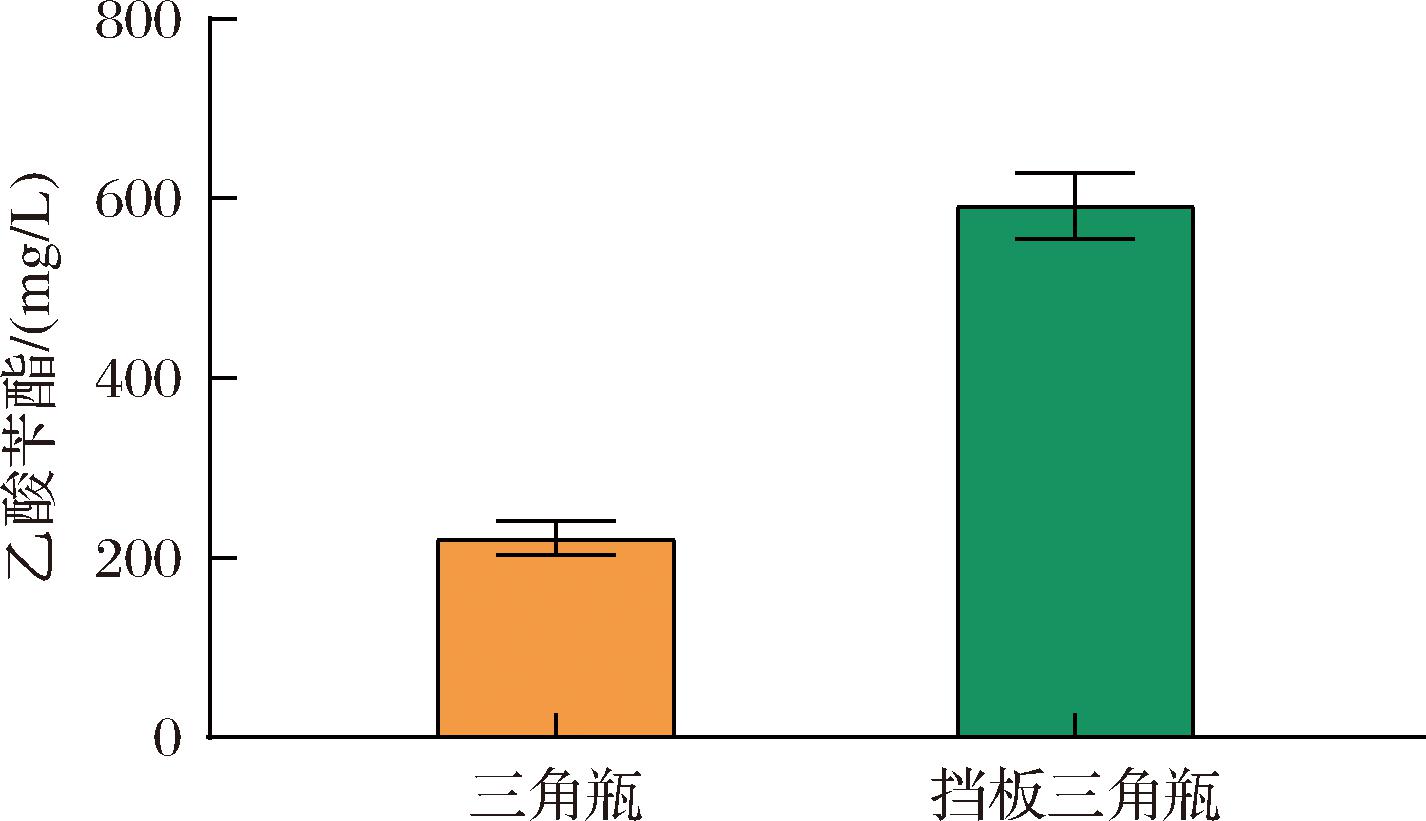
图8 挡板三角瓶的使用对摇瓶发酵过程中乙酸苄酯总产量的影响
Fig.8 Effects of the use of flapper triangle bottle on the total production of benzyl acetate
3 结论与讨论
本研究采用模块化方法,在大肠杆菌BL21(DE3)中,协同表达9种不同来源的酶,创建了基于苯乙烯为关键中间体的乙酸苄酯从头合成途径。通过微生物发酵,实现以甘油、葡萄糖为碳源从头合成乙酸苄酯。通过关键酶筛选,发酵培养条件优化,进一步提高了乙酸苄酯产量。获得的工程菌株BZ05在摇瓶发酵水平,合成(592.22±36.95) mg/L的乙酸苄酯。
在微生物中从头异源合成乙酸苄酯鲜有报道。在整理发表本研究结果期间,CHOI等[23]通过创建苯甲酸依赖的和不依赖的2条新颖的乙酸苄酯合成途径,在前体合成提高的大肠杆菌底盘中,实现了乙酸苄酯的从头合成,把合成途径上游模块和下游模块分别构建在不同的菌株中,采用延迟共培养策略,发酵罐分批发酵获得乙酸苄酯的高产,产量达2.2 g/L。本研究在没有进行苯丙氨酸前体合成提高的大肠杆菌菌株BL21(DE3)底盘中构建的乙酸苄酯合成途径,在进一步的研究中,可以尝试通过代谢工程提高底盘中苯丙氨酸的合成,进一步提高乙酸苄酯的产量。另外,可以进一步探索罐发酵工艺,提高工程菌株BZ05乙酸苄酯的产能。本研究为乙酸苄酯的合成提供了一种绿色、可持续的方法,也为进一步开发高效微生物发酵生产工艺提供了参考。
[1] SADEQ E Z, Al-OBAIDI N S, HAMMOODI O G, et al.Benzyl acetate:A review on synthetic methods.eurasian journal of physics[J].Chemistry and Mathematics, 2022,9:28-35.
[2] YADAV G D, MEHTA P H, HALDAVANEKAR B V. Capsule membrane phase transfer catalysis: Selective alkaline hydrolysis and oxidation of benzyl chloride to benzyl alcohol and benzaldehyde[J]. Studies in Surface Science and Catalysis, 1993, 78:503-512.
[3] SEO H, LEE J W, GARCIA S, et al.Single mutation at a highly conserved region of chloramphenicol acetyltransferase enables isobutyl acetate production directly from cellulose by Clostridium thermocellum at elevated temperatures[J].Biotechnology for Biofuels, 2019, 12:245.
[4] LEE J W, TRINH C T.Microbial biosynthesis of lactate esters[J].Biotechnology for Biofuels, 2019, 12:226.
[5] PUGH S, MCKENNA R, HALLOUM I, et al.Engineering Escherichia coli for renewable benzyl alcohol production[J].Metabolic Engineering Communications, 2015, 2:39-45.
[6] LUKITO B R, SEKAR B S, WU S K, et al.Whole cell-based cascade biotransformation for the production of (S)-mandelic acid from styrene, L-phenylalanine, glucose, or glycerol[J].Advanced Synthesis &Catalysis, 2019, 361(15):3560-3568.
[7] ZHOU Y, SEKAR B S, WU S K, et al.Benzoic acid production via cascade biotransformation and coupled fermentation-biotransformation[J].Biotechnology and Bioengineering, 2020, 117(8):2340-2350.
[8] LUO Z W, LEE S Y.Metabolic engineering of Escherichia coli for the production of benzoic acid from glucose[J].Metabolic Engineering, 2020, 62:298-311.
[9] ZHOU D Y, WU S K, LI Z.Cascade biocatalysis for sustainable asymmetric synthesis:From biobased L-phenylalanine to high-value chiral chemicals[J].Angewandte Chemie International Edition, 2016, 55(38):11647-11650.
[10] ZHU L B, CUI W J, FANG Y Q, et al.Cloning, expression and characterization of phenylalanine ammonia-lyase from Rhodotorula glutinis[J].Biotechnology Letters, 2013, 35(5):751-756.
[11] MCKENNA R, NIELSEN D R.Styrene biosynthesis from glucose by engineered E.coli[J].Metabolic Engineering, 2011,13(5):544-554.
[12] WU S K, ZHOU Y, WANG T W, et al.Highly regio- and enantioselective multiple oxy- and amino-functionalizations of alkenes by modular cascade biocatalysis[J].Nature Communications, 2016, 7:11917.
[13] MCLEISH M J, KNEEN M M, GOPALAKRISHNA K N, et al.Identification and characterization of a mandelamide hydrolase and an NAD(P)+-dependent benzaldehyde dehydrogenase from Pseudomonas putida ATCC 12633[J].Journal of Bacteriology, 2003, 185(8):2451-2456.
[14] NANCOLAS B, BULL I D, STENNER R, et al.Saccharomyces cerevisiae Atf1p is an alcohol acetyltransferase and a thioesterase in vitro[J].Yeast, 2017, 34(6):239-251.
[15] LIU G F, HUANG L, LIAN J Z.Alcohol acyltransferases for the biosynthesis of esters[J].Biotechnology for Biofuels and Bioproducts, 2023, 16(1):93.
[16] LI L, WANG X, LI X Y, et al.Combinatorial engineering of mevalonate pathway and diterpenoid synthases in Escherichia coli for cis-abienol production[J].Journal of Agricultural and Food Chemistry, 2019, 67(23):6523-6531.
[17] LIU C Q, MEN X, CHEN H L, et al.A systematic optimization of styrene biosynthesis in Escherichia coli BL21(DE3)[J].Biotechnology for Biofuels, 2018, 11:14.
[18] SEO H, LEE J W, GIANNONE R J, et al.Engineering promiscuity of chloramphenicol acetyltransferase for microbial designer ester biosynthesis[J].Metabolic Engineering, 2021, 66:179-190.
[19] 胡田东, 殷华, 毕慧萍, 等.3个植物源苯甲醇酰基转移酶合成乙酸肉桂酯的研究[J].微生物学通报, 2021, 48(7):2365-2373.
HU T D, YIN H, BI H P, et al.Biosynthesis of cinnamyl acetate by three plant-derived benzyl acyltransferases in engineered Escherichia coli[J].Microbiology China, 2021, 48(7):2365-2373.
[20] D’AURIA J C, CHEN F, PICHERSKY E.Characterization of an acyltransferase capable of synthesizing benzylbenzoate and other volatile esters in flowers and damaged leaves of Clarkia breweri[J].Plant Physiology, 2002, 130(1):466-476.
[21] AZMI N A N, ELGHARBAWY A A M, MOTLAGH S R, et al.Nanoemulsions:Factory for food, pharmaceutical and cosmetics[J].Processes, 2019, 7(9):617.
[22] HU Y H, GE M D, SUN D N, et al.Stimulating mechanism of corn oil on biomass and polysaccharide production of Pleurotus tuber-regium mycelium[J].International Journal of Biological Macromolecules, 2022, 201:93-103.
[23] CHOI K R, LUO Z W, KIM G B, et al.A microbial process for the production of benzyl acetate[J].Nature Chemical Engineering, 2024, 1:216-228.