红曲米是一种以大米为原料、通过红曲菌进行发酵的食品,红曲菌具有强大的次级代谢产物合成能力,可以产生结构复杂多样、具有多种生物活性的化合物。红曲黄色素是红曲菌重要的次级代谢产物,是开发功能性产品关注的焦点。红曲素(monascin,MS)和红曲黄素(ankaflavin,AK)具有明确的抗炎活性[1],主要影响包括白细胞介素-6(interleukin-6,IL-6),肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α),核因子κB(nuclear factor kappa-B,NF-κB),过氧化物酶体增殖物激活受体α(perixisome proliferator-activated receptor alpha,PPAR-α),过氧化物酶体增殖物激活受体 γ(perixisome proliferator-activated receptor γ,PPAR-γ),白细胞介素-1β(interleukin-1β,IL-1β)等炎症表达相关因子的转录和蛋白水平的表达。经动物实验证实具有减肥、降血脂、降血糖和改善动脉粥样硬化病变等功效。课题组前期研究发现[2]MC只影响甘油三酯(triglyceride,TG)代谢,不影响胆固醇代谢,MC存在于血脂康和其他市售功能红曲产品中,其具有抗氧化活性和抑制3-羟基-3-甲基戊二酸单酰辅酶A还原酶(3-hydroxy-3-methyl glutaryl coenzyme A reductase,HMG-CoA)活性[3],不仅能有效预防高脂饮食导致的体重增加,还能抑制外周脂肪堆积、血液和肝脏中血清总胆固醇(total cholesterol,TC)、TG的堆积,MC调控TG代谢的机制未见报道。
肥胖的特征在于脂肪细胞的肥大和增生,伴随着巨噬细胞募集和低度炎症[4]。巨噬细胞是重要的免疫细胞,通过体内特异性(细胞免疫)或非特异性防御(先天免疫)参与一系列炎症和自身免疫性疾病[5]。巨噬细胞可以分化成不同的表型,并在不同的微环境中执行专门的功能。根据活化和功能状态,巨噬细胞被划分为两类:一类是经典活化巨噬细胞(M1),另一类是交替活化巨噬细胞(M2)[6]。人源THP-1和小鼠源RAW264.7两种经典巨噬细胞系已被广泛用于研究炎症机制和细胞信号传导途径[7-8]。因此本研究以脂多糖(lipopolysaccharide,LPS)诱导THP-1细胞和RAW264.7细胞建立炎症模型,评估3种红曲黄色素的抗炎作用,为后续开发高品质功能性红曲产品提供新思路。
1 材料与方法
1.1 试验材料
1.1.1 红曲菌和细胞来源
红曲霉CP-1菌株,天津科技大学食品科学与工程学院发酵食品与微生物资源开发实验室分离纯化。
人单核THP-1细胞,上海中乔新舟生物科技有限公司。
小鼠单核巨噬细胞白血病RAW264.7细胞,北京协和细胞资源中心。
1.1.2 药品与试剂
红曲黄色素MS和AK(纯度≥98%),天津科技大学食品科学与工程学院发酵食品与微生物资源开发实验室提取;脂多糖,上海吉至生化科技有限公司;二甲基亚砜(dimethyl sulfoxide,DMSO)、真菌抗生素,北京索莱宝科技有限公司;1640培养基、胰蛋白酶,Gibco化学试剂公司;胎牛血清(fetal bovine serum,FBS),新西兰NEWZERUM公司;佛波酯(Phorbol 12-myristate 13-acetate,PMA),美国Sigma公司;β-巯基乙醇,上海中乔新舟生物科技有限公司;Trizol裂解液,美国Life Invitrogen公司;Prime ScriptTM RT试剂盒和TB Green® Premix Ex TaqTM Ⅱ试剂盒,日本TAKARA公司;人源IL-6、TNF-α ELISA试剂盒,欣博盛生物科技有限公司;鼠源TNF-α ELISA试剂盒,依科赛生物科技(太仓)有限公司;其他溶剂和化学品均从认证供应商处购买。
1.1.3 仪器与设备
Agilent1260高效液相色谱仪,安捷伦科技有限公司;KCL-2000W恒温恒湿培养箱,日本东京理化器械株式会社;SW-CJ-IFD超净工作台,苏州安泰空气技术有限公司;CX41生物显微镜,日本OLYMPUS公司;Infinite M200 PRO多功能酶标仪,瑞士TECAN公司;MX3000P荧光定量PCR仪,美国AGILENT公司。
1.2 实验方法
1.2.1 红曲菌CP-1固态发酵
按照文献中方法[9]配制麦芽汁斜面培养基、种子液培养基和大米固态发酵培养基。取红曲菌CP-1,在麦芽汁斜面培养基上进行菌种活化。在活化好的CP-1菌种斜面内倒入适量的无菌水,再转移至种子液培养基中,恒温摇床上培养36 h。用纱布过滤孢子悬浮液至锥形瓶中,用血球计数板计数,调整孢子的浓度为106 CFU/mL。移取种子液置于大米固态发酵培养基中,振荡混匀后,在30 ℃恒温培养箱中培养6 d,再25 ℃恒温培养至18 d。培养结束后,将红曲菌固态发酵产物烘干后粉碎,120目过筛。
1.2.2 红曲黄色素MC的提取
采用料液比1∶20提取粗色素,振荡混匀后1 200 r/min,3 min离心、60 ℃烘干。使用薄层层析硅胶G 1∶1拌样,硅胶柱层析分离,湿法装柱,分别用二氯甲烷、V(石油醚)∶V(乙酸乙酯)=10∶1、V(石油醚)∶V(乙酸乙酯)=5∶1的洗脱剂进行洗脱,旋蒸仪55 ℃蒸发大部分有机试剂后,置于60 ℃烘箱烘干。
1.3 薄层层析(thin-layer chromatography,TLC)法和HPLC法测定MC纯度
以V(二氯甲烷)∶V(甲醇)=50∶1 的比例作为展开剂放在展开缸内进行TLC测定;溶解MC后用0.22 μm有机滤膜过滤,置于液相小瓶中进行HPLC分析。使用COSMOSIL Packed Column,Cholester,4.6 ID×250 mm,5 μm的色谱柱;流动相及洗脱条件如文献[9]所示。
1.4 细胞培养
THP-1细胞用1640基础培养基(含体积分数为1%三抗、体积分数为10%胎牛血清和50 μmol/L β-巯基乙醇)置于37 ℃、5% CO2恒温细胞培养箱中培养,每1~2 d换1次液。待长至80%进行传代培养。RAW264.7细胞用1640培养基(含体积分数为1%三抗、体积分数为10%胎牛血清)培养,培养方式同上。
1.5 噻唑蓝(methylthiazolyldiphenyl-tetrazolium bromide,MTT)法检测细胞活性
将细胞按照104/mL的密度接种在96孔板上,用不同剂量的MC、MS或AK孵育THP-1细胞24 h后,在96孔板中加入20 μL MTT溶液/孔,在恒温细胞培养箱中培养4 h,用DMSO溶解甲瓒,振荡助溶后利用酶标仪在490 nm处测定OD值,计算细胞存活率。
1.6 THP-1细胞和RAW264.7细胞炎症模型的建立及毒性检测
使用100 ng/mL的PMA诱导THP-1细胞使其分化为M0型巨噬细胞并用2 μg/mL的LPS继续诱导THP-1细胞24 h,以建立THP-1细胞炎症模型;用2 μg/mL 的LPS诱导RAW264.7细胞24 h,以建立RAW264.7细胞炎症模型。毒性检测同1.5节。
1.7 促炎细胞因子IL-6和TNF-α水平的测定
将细胞按照106/mL的密度接种在6孔板上,使用6 μg/mL的MC、MS和AK孵育THP-1细胞或RAW264.7细胞24 h,按照TAKARA试剂盒所述进行反转录、聚合酶链反应(RT-qPCR),引物序列如表1所示;按照ELISA试剂盒手册所述,使用酶标仪在450 nm处测定OD值,测定细胞上清液中的IL-6和TNF-α蛋白。
表1 引物序列
Table 1 Primer sequences
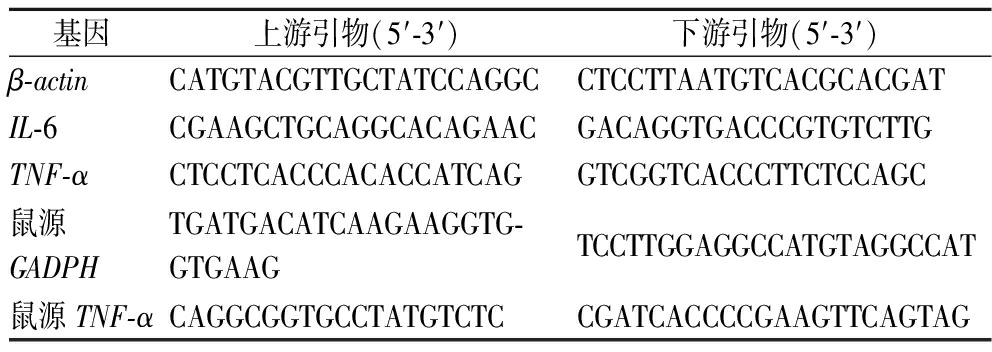
基因上游引物(5′-3′)下游引物(5′-3′)β-actinCATGTACGTTGCTATCCAGGCCTCCTTAATGTCACGCACGATIL-6CGAAGCTGCAGGCACAGAACGACAGGTGACCCGTGTCTTGTNF-αCTCCTCACCCACACCATCAGGTCGGTCACCCTTCTCCAGC鼠源GADPHTGATGACATCAAGAAGGTG-GTGAAGTCCTTGGAGGCCATGTAGGCCAT鼠源TNF-αCAGGCGGTGCCTATGTCTCCGATCACCCCGAAGTTCAGTAG
1.8 数据处理与统计学分析
所有试验重复3次。结果以平均值±标准差表示。对数值进行T检验,其中P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 红曲霉CP-1固态发酵结果
以红曲霉CP-1变温固态发酵大米,其红曲产品中可检测出以MC为主的4种次级代谢产物。HPLC检测结果如图1所示。根据其保留时间的先后顺序,依次为红曲红色素R1、红曲黄色素MC、红曲黄色素MS和红曲橙色素O1。将CP-1红曲产品用于MC提取纯化的原料。
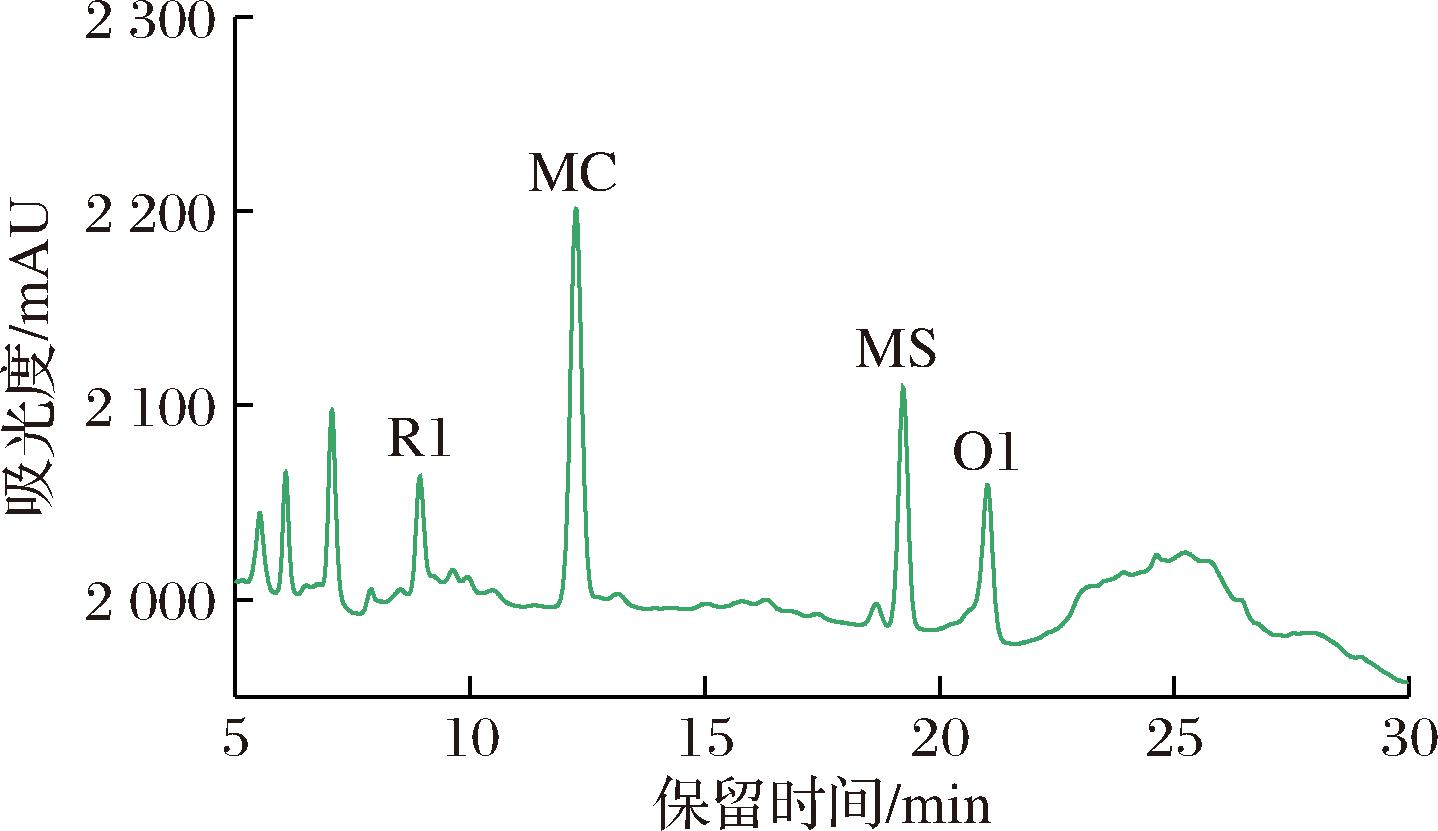
图1 红曲霉CP-1固态发酵HPLC
Fig.1 The HPLC of solid-state fermentation with Monascus CP-1
2.2 红曲黄色素MC的纯度分析
按照方法1,对提取出MC进行纯度分析。如图2-a所示,制备出的MC与已知的标品Rf值相同,确认红曲色素提取物中富含MC。如图2-b所示,MC经与标品的洗脱时间和光谱图的比对,被进一步确定。样品纯度>98%,可用于后续细胞实验。
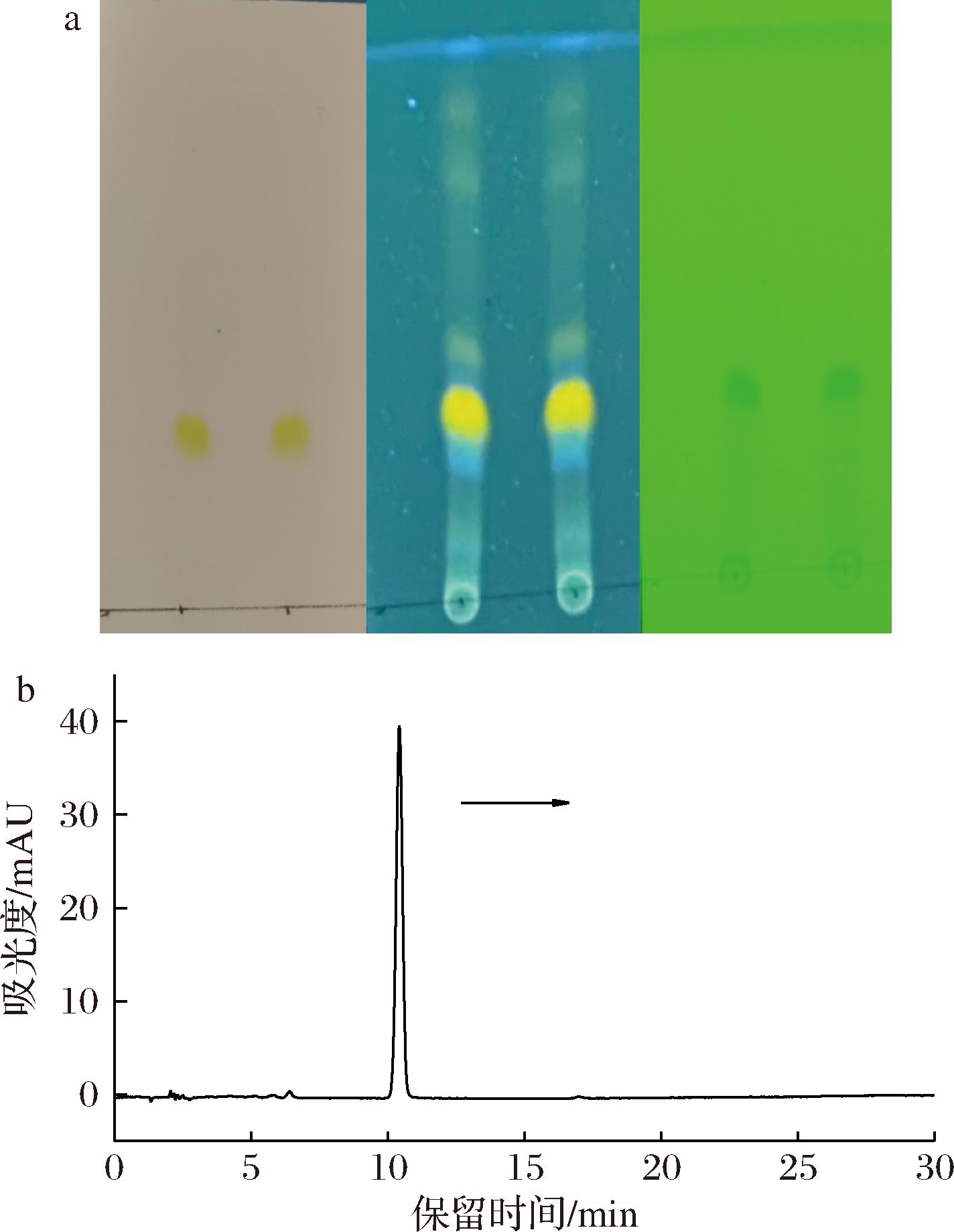
a-TLC;b-HPLC
图2 MC和标品的TLC和MC的HPLC
Fig.2 TLC of MC and standard products and HPLC of MC
2.3 红曲黄色素和脂多糖细胞毒性评价
实验设置5、10、15、20、25、30 μg/mL的MC、MS、AK和2、4、6、8、10 μg/mL的LPS进行毒性试验,以完全培养基培养THP-1细胞的存活率为对照,对添加不同质量浓度的MC、MS、AK和LPS的细胞存活率进行分析。结果如图3所示,当红曲黄色素的质量浓度在0~10 μg/mL时,细胞存活率在90%以上,即在此质量浓度范围内红曲黄色素对细胞的毒性较小。另外,当单独使用2 μg/mL的LPS时,也在安全范围之内。
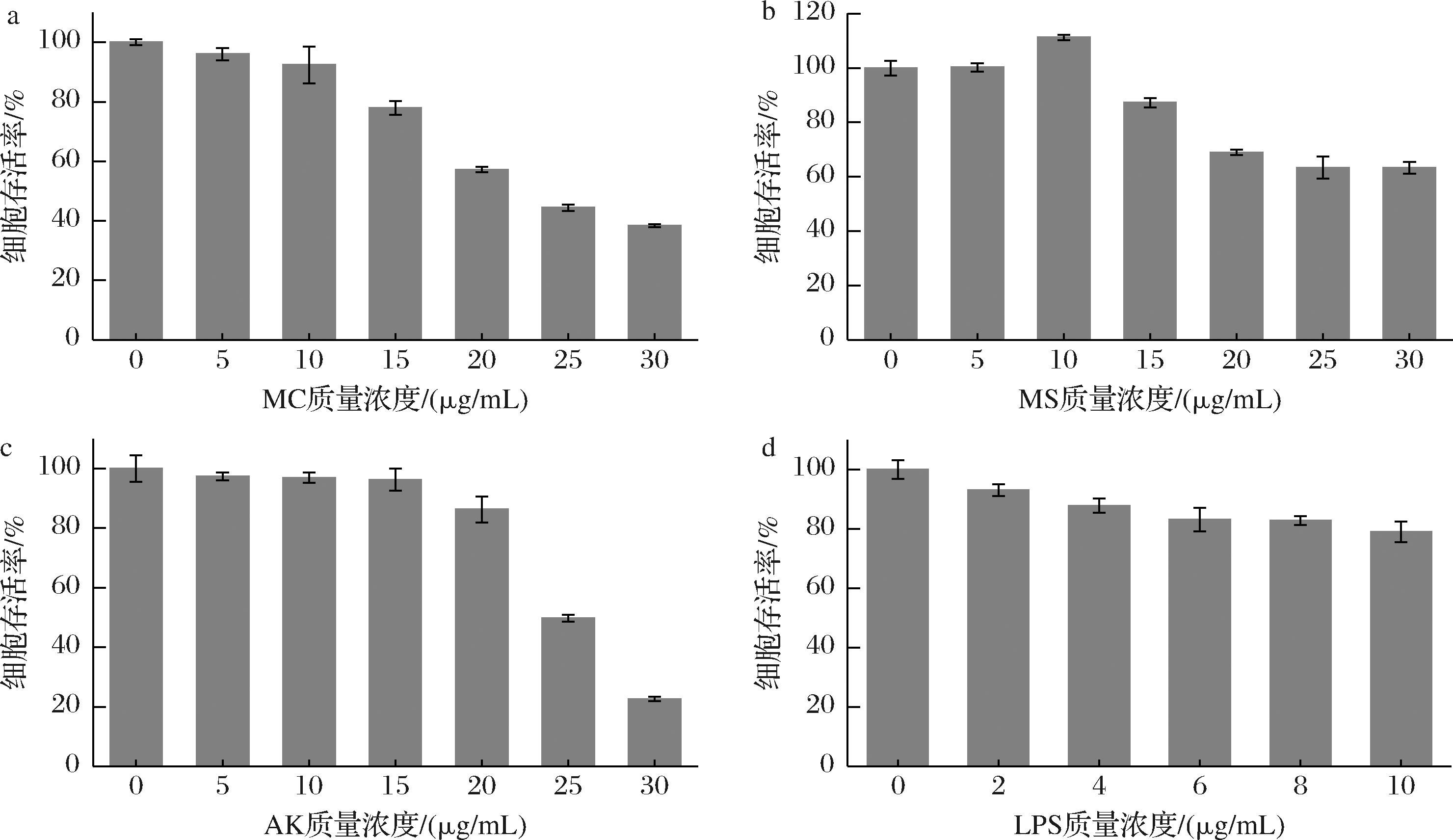
a-MC细胞毒性;b-MS细胞毒性;c-AK细胞毒性;d-LPS细胞毒性
图3 不同质量浓度MC、MS、AK和LPS对THP-1细胞存活率的影响
Fig.3 Effects of different concentrations of MC, MS, AK, and LPS on survival rate of THP-1 cells
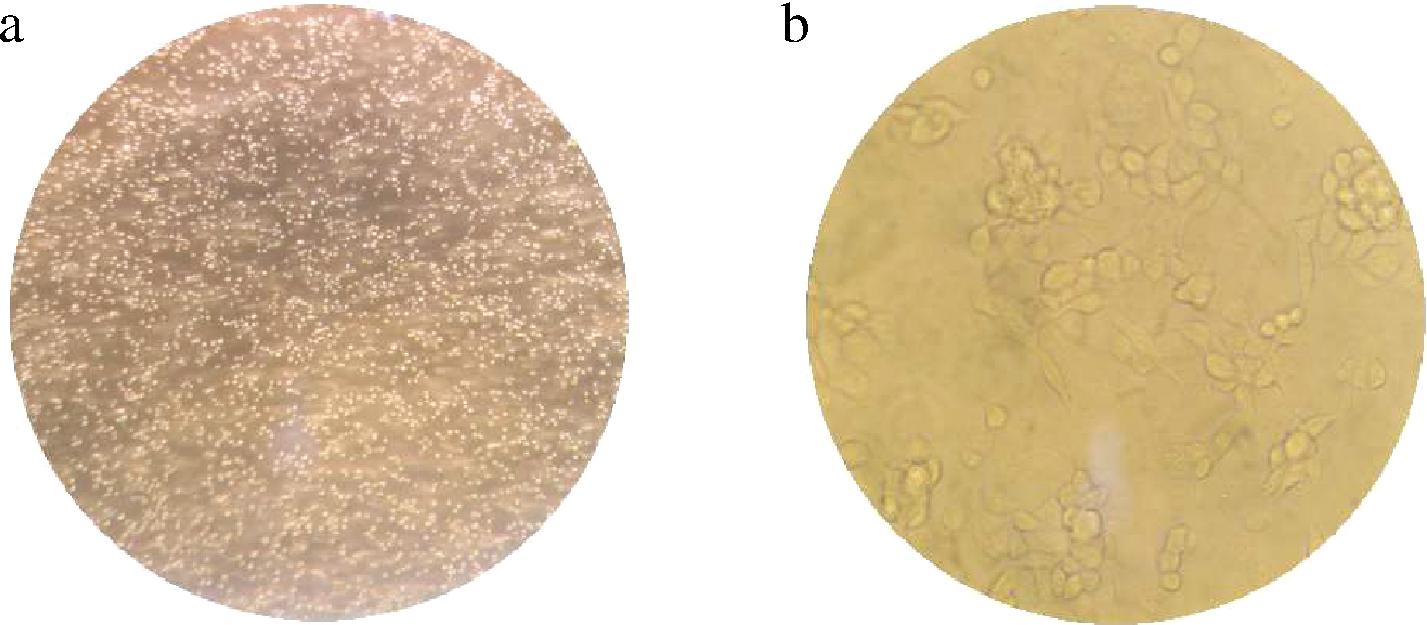
a-正常THP-1细胞(倒置显微镜×100);b-100 ng/mL PMA诱导的THP-1细胞(倒置显微镜×400)
图4 PMA诱导THP-1单核细胞分化巨噬细胞的形态学观察
Fig.4 Morphological observation of THP-1 monocyte differentiated macrophages induced by PMA
2.4 红曲黄色素对THP-1细胞炎症模型的毒性评价
按照1.6节方法,体外诱导THP-1细胞为M0型巨噬细胞。通过倒置显微镜分别对正常组、PMA诱导组进行观察。结果如图4-a所示,THP-1细胞未经诱导前为悬浮细胞,细胞呈圆型、透亮,经PMA诱导24 h细胞贴壁生长(图4-b),伸出伪足,呈椭圆形或梭型。这与文献报道一致[10],可以初步表明THP-1单核细胞已成功分化为M0型巨噬细胞。
实验设置0~10 μg/mL的MC、MS和AK处理2 μg/mL LPS诱导的THP-1巨噬细胞进行毒性试验,以完全培养基培养THP-1巨噬细胞的存活率为对照,对不同质量浓度的MC、MS和AK的细胞存活率进行分析,筛选红曲黄色素最适浓度进行后续试验,结果如图5所示,MC、MS和AK与LPS诱导的THP-1巨噬细胞存活率呈剂量依赖关系,0~10 μg/mL的MC、MS和AK处理的细胞存活率在85%~100%,综合分析选择6 μg/mL的实验浓度。有研究发现0~10 μg/mL 的MS和AK与β-淀粉样蛋白诱导的PC-12细胞存活率呈剂量依赖关系,但MS和AK对于PC-12细胞毒性不同[11]。本研究在THP-1细胞未发现同剂量MS和AK存在毒性差异。
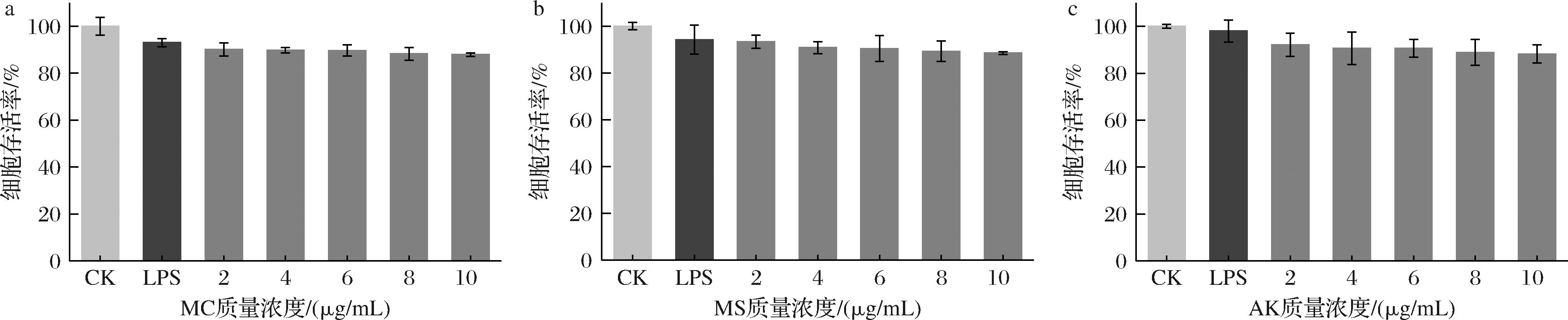
a-MC细胞毒性;b-MS细胞毒性;c-AK细胞毒性
图5 MC、MS、AK对LPS诱导的THP-1细胞存活率的影响
Fig.5 Effects of MC, MS, and AK on survival rate of LPS-stimulated THP-1 cells
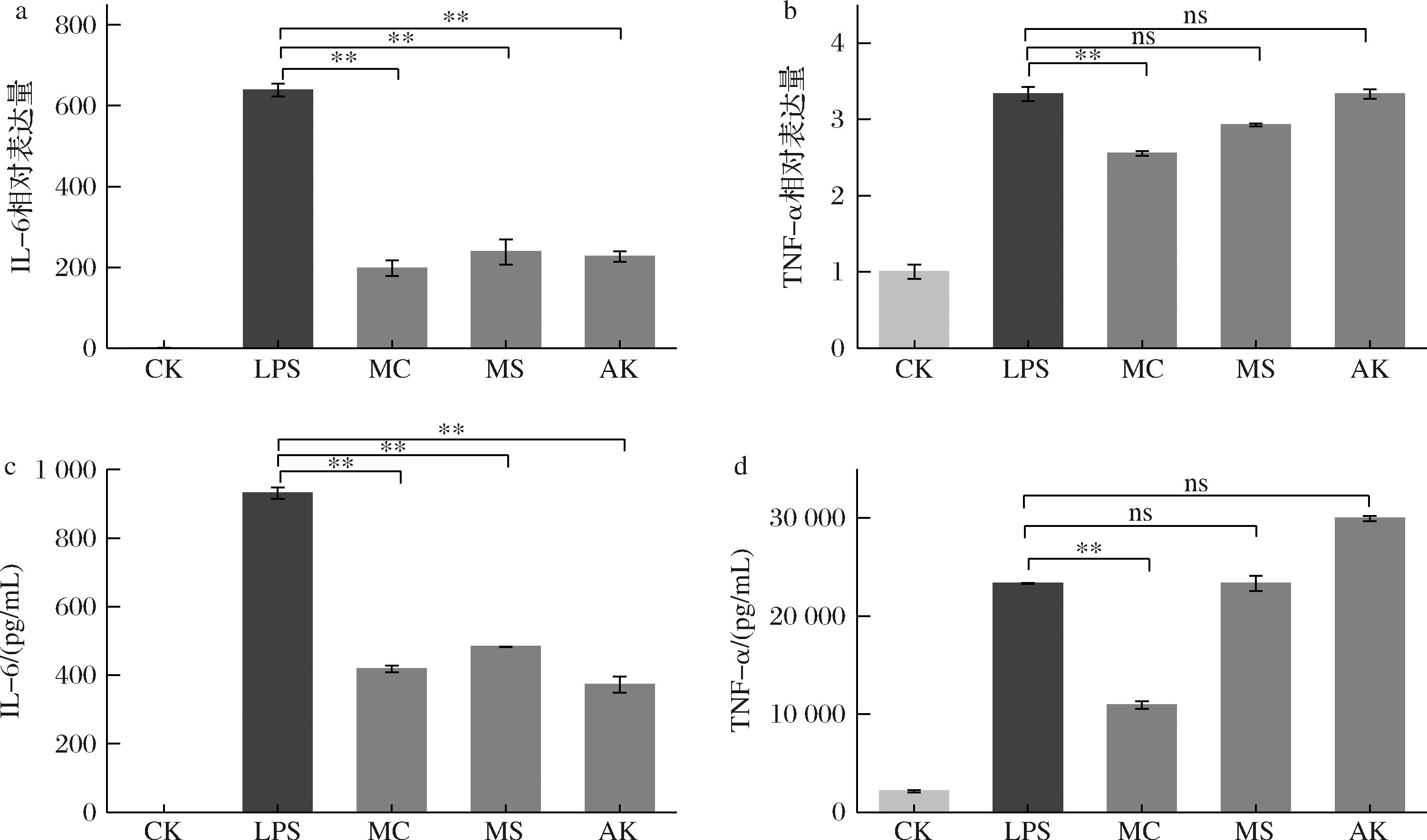
a-IL-6相对表达量;b-TNF-α相对表达量;c-IL-6蛋白分泌量;d-TNF-α蛋白分泌量
图6 MC、MS、AK对LPS诱导的THP-1细胞中IL-6、TNF-α表达量的影响
Fig.6 Effects of MC, MS, and AK on the expression levels of IL-6 and TNF-α in LPS-stimulated THP-1 cells
注:**表示与LPS诱导组相比差异性极显著(P<0.01);ns表示无显著性差异(下同)。
2.5 红曲黄色素对LPS诱导的THP-1细胞中细胞因子IL-6和TNF-α的影响
本课题组前期研究发现[12],6 μg/mL的MC、MS和AK均可以在转录水平和翻译水平上降低RAW264.7细胞中IL-6的表达。IL-6是炎症过程中产生的一种多功能细胞因子。它可以刺激炎症反应中大多数急性期蛋白的产生,在宿主防御侵袭性感染中起关键作用,从而直接反映炎症的存在和强度[13]。TNF-α可以激活炎症反应中的细胞因子级联,并刺激IL-1β、IL-6和单核细胞趋化蛋白-1(monocyte chemoattractant protein-1,MCP-1)的表达[14]。控制炎症的机制是抑制炎症细胞因子并调节其产生或功能,IL-6和TNF-α均为促进炎症反应的细胞因子,是反映炎症程度的重要指标[15]。为了验证MC、MS和AK的抗炎作用,我们使用RT - qPCR和ELASA检测炎症细胞因子的表达。结果如图6所示,2 μg/mL的LPS刺激THP-1细胞后,IL-6和TNF-α基因转录表达水平有所提高。与LPS诱导组相比,3种红曲黄色素均显著降低了IL-6的表达(P<0.01);MC还能显著抑制TNF-α的表达(P<0.01),但MS和AK对于TNF-α的表达无显著性差异,ELISA实验结果与RT-qPCR结果一致。LPS诱导RAW264.7细胞IL-6的分泌量[12]约为THP-1细胞的10倍,说明人源和鼠源巨噬细胞炎症模型存在较大的差异。LIN等[16]研究表明,MS和AK对高脂饮食诱导的大鼠代谢紊乱模型中脂肪细胞TNF-α、IL-6、IL-1β的表达具有显著的调节作用,但MS和AK在调节血糖方面的作用机制有所不同。他们推测,MS的作用机制可能与激活机体的抗氧化能力以及调节TG和TC的代谢有关,而AK的作用机制则更多地与其抗炎作用以及对TG和TC代谢的调节相关。这与本实验研究结论一致,结构相似的MC、MS、AK抗炎调控机制存在差异性。MC抗炎作用机制未见报道,通过本研究可知在THP-1细胞中MC能显著抑制IL-6和TNF-α的表达和分泌水平,具有有效的抗炎作用,且其抗炎效果优于MS和AK。
2.6 红曲黄色素对LPS诱导的RAW264.7细胞中细胞因子TNF-α的影响
LPS诱导的RAW 264.7细胞是评估天然产物潜在生物活性和抗炎特性最常用的模型[14,17]。TNF-α是一种关键的促炎细胞因子,可导致多种形式的肾损伤,主要由巨噬细胞分泌[18]。巨噬细胞受到脂多糖刺激后会开始分泌TNF-α,引起炎症反应。本研究通过RT-qPCR实验来分析MC对小鼠RAW264.7细胞内TNF-α基因转录水平的影响,以MS和AK作为对照组。结果如图7-a所示,2 μg/mL的LPS提高了RAW264.7细胞内TNF-α基因的表达量。与LPS组相比,MC显著抑制了TNF-α的表达(P<0.05),而MS和AK对TNF-α的表达无显著性差异(P>0.05)。有研究通过RT-qPCR检测脂质代谢、氧化应激和炎症相关基因的mRNA水平,从而阐明MS在预防肝损伤方面的机制[19],结果表明MS干预可调节肝脏脂质代谢、抗氧化状态和炎症反应相关基因的mRNA转录和蛋白表达。这与本研究结论有所不同,这反映出不同炎症模型间的差异。
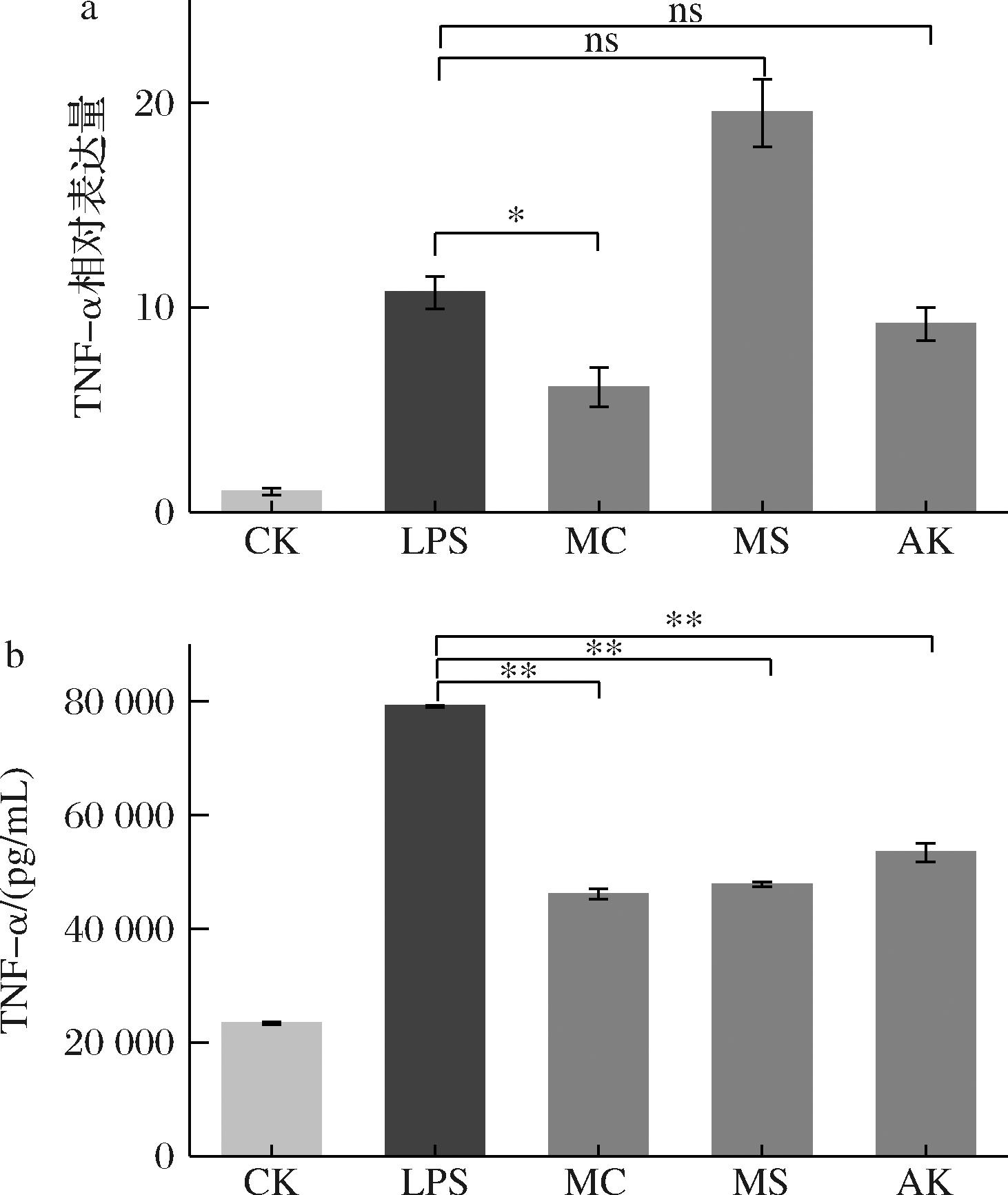
a-TNF-α相对表达量;b-TNF-α蛋白分泌量
图7 MC、MS、AK对LPS诱导的RAW264.7细胞中TNF-α表达量的影响
Fig.7 Effects of MC, MS, and AK on the expression levels of TNF-α in LPS-stimulated RAW264.7 cells
利用小鼠TNF-α的ELISA试剂盒进行高灵敏性的检测,测定RAW264.7细胞培养上清液中TNF-α的分泌量。结果如图7-b所示,2 μg/mL的LPS提高了RAW264.7细胞上清液中TNF-α的分泌量,并显著高于同剂量LPS诱导的THP-1细胞。3种黄色素处理后,均能显著降低TNF-α的分泌量(P<0.01)。这体现了3种红曲黄色素具有有效的抗炎作用,但此结果与转录结果不一致,这可能是因为转录后的过程中存在一系列的调控和修饰机制,这些机制可能影响蛋白的表达。这些结果表明,MC对LPS诱导的炎症因子具有稳定、有效的抑制能力。有研究发现,MS和AK作为抗炎和抗氧化作用的潜在药物能显著下调β-淀粉样蛋白诱导的大鼠海马组织中TNF-α、IL-6、IL-1β等炎性蛋白的表达[11],并能抑制PMA或LPS刺激的Balb/cByJNarl小鼠中IL-6、IL-1β和TNF-α等炎症因子的表达[20],与本实验研究结论一致。越来越多的科学证据表明[21-22],天然小分子如黄酮类化合物也具有抗炎特性,具有减轻组织损伤或纤维化的潜力。研究发现,黄酮类化合物可通过下调促炎基因的转录水平、减少促炎因子的分泌水平,从而抑制炎症性疾病的发生和发展。这表明小分子化合物在抗炎方面具有显著的潜力[23]。
3 结论
本研究以2 μg/mL的LPS分别刺激人源巨噬细胞THP-1和鼠源巨噬细胞RAW264.7,建立了炎症细胞模型,从转录和蛋白分泌水平考察了红曲中3种结构类似的黄色素(MC、MS和AK)对炎症标志物IL-6、TNF-α的抑制效果。结果表明:6 μg/mL的MC、MS、AK均能显著抑制IL-6和TNF-α的表达,具有明确的抗炎活性。以THP-1和RAW264.7两种炎症细胞模型分别评价3种黄色素,获得的抗炎活性结果具有一致性,但LPS诱导RAW264.7细胞产生的炎症标志物分泌水平极高,更适合急性炎症模型。LPS诱导THP-1产生的炎症标志物分泌水平明显低于RAW264.7的炎症细胞模型。因此,THP-1细胞可作为低度炎症模型,更适合研究红曲黄色素对抑制或缓解脂代谢异常等引发机体慢性低度炎症的研究。慢性炎症主要来源于组织驻留的巨噬细胞,它们释放不同的炎症细胞因子。世界上超过50%的死亡被归因于与慢性炎症相关的疾病[24],因此缓解慢性炎症有利于维护个人的健康。
脂代谢异常会导致肠道菌群失调,引发肠道革兰氏阴性菌异常增殖,其细胞壁的内毒素LPS通过结合免疫细胞的细胞膜Toll样受体蛋白(Toll-like receptor 4,TLR4),经细胞质内的NF-κB信号通路进一步激活细胞核内各种炎症因子转录表达的上调,引发巨噬细胞等免疫细胞的慢性炎症响应,分泌IL-6、TNF-α等炎症标志蛋白。本研究以LPS分别刺激THP-1和RAW264.7细胞,模拟机体脂代谢异常引发的炎症,3种黄色素均显著抑制了IL-6、TNF-α炎症标志物的转录表达和蛋白分泌,表明MC、MS、AK干扰了LPS-TLR4-NF-κB经典炎症信号通路的级联表达,从而抑制了IL-6、TNF-α炎症标志物分泌,达到了抗炎效果。
[1] SHI Y X, CHEN W S.Monascin ameliorate inflammation in the lipopolysaccharide-induced BV-2 microglial cells via suppressing the NF-κB/p65 pathway[J].Iranian Journal of Basic Medical Sciences, 2020, 23(4):461-468.
[2] 陈勉华, 高嘉欣, 张妍, 等.一种制备红曲黄素C用的红曲菌及利用其制备红曲黄素C的方法:中国, CN201911338798X[P].2019-12-21.
CHEN M H, GAO J X, ZHANG Y, et al.Method for preparing monascinol with Monascus and its application in the preparation of monascinol:China, CN201911338798X[P].2019-12-21.
[3] WU L, ZHOU K X, CHEN F, et al.Comparative study on the antioxidant activity of Monascus yellow pigments from two different types of Hongqu-functional Qu and coloring qu[J].Frontiers in Microbiology, 2021, 12:715295.
[4] HUANG P Y, HSIEH C C.Immunomodulatory effects of seed peptide lunasin in RAW264.7 macrophages in obese microenvironments[J].Journal of Functional Foods, 2023, 108:105719.
[5] NAVEGANTES K C, DE SOUZA GOMES R, PEREIRA P A T, et al.Immune modulation of some autoimmune diseases:The critical role of macrophages and neutrophils in the innate and adaptive immunity[J].Journal of Translational Medicine, 2017, 15(1):36.
[6] BOSCO M C.Macrophage polarization:Reaching across the aisle?[J].Journal of Allergy and Clinical Immunology, 2019, 143(4):1348-1350.
[7] SHIRATORI H, FEINWEBER C, LUCKHARDT S, et al.THP-1 and human peripheral blood mononuclear cell-derived macrophages differ in their capacity to polarize in vitro[J].Molecular Immunology, 2017, 88:58-68.
[8] CASTANEDA O A, LEE S C, HO C T, et al.Macrophages in oxidative stress and models to evaluate the antioxidant function of dietary natural compounds[J].Journal of Food and Drug Analysis, 2017, 25(1):111-118.
[9] 史成, 王笑, 高嘉欣, 等.两种辅料对固态发酵红曲米莫纳可林K与红曲色素产量的影响[J].食品科学技术学报, 2020, 38(4):119-126.
SHI C, WANG X, GAO J X, et al.Effects of two auxiliary substrates on yield of monacolin K and Monascus pigments in solid-state fermentation of red yeast rice[J].Journal of Food Science and Technology, 2020, 38(4):119-126.
[10] KONG F Q, YE B Z, CAO J T, et al.Curcumin represses NLRP3 inflammasome activation via TLR4/MyD88/NF-κB and P2X7R signaling in PMA-induced macrophages[J].Frontiers in Pharmacology, 2016, 7:369.
[11] LIN C W, LIN P Y, HSU Y W, et al.Monascus-fermented metabolites repressed amyloid β-peptide-induced neurotoxicity and inflammatory response in in vitro and in vivo studies[J].Journal of Functional Foods, 2023, 104:105509.
[12] 王晶. 具有抗炎活性红曲色素的筛选及应用研究[D].天津:天津科技大学, 2022.
WANG J.Screening and application of Monascus pigment with anti-inflammatory activity[D].Tianjin:Tianjin University of Science &Technology, 2022.
[13] SILVA B, BILUCA F C, MOHR E T B, et al.Effect of Mimosa scabrella Bentham honeydew honey on inflammatory mediators[J].Journal of Functional Foods, 2020, 72:104034.
[14] LIN Z W, GAN T T, HUANG Y Z, et al.Anti-inflammatory activity of mulberry leaf flavonoids in vitro and in vivo[J].International Journal of Molecular Sciences, 2022, 23(14):7694.
[15] OH H, PARK S H, KANG M K, et al.Asaronic acid attenuates macrophage activation toward M1 phenotype through inhibition of NF-κB pathway and JAK-STAT signaling in glucose-loaded murine macrophages[J].Journal of Agricultural and Food Chemistry, 2019, 67(36):10069-10078.
[16] LIN C W, LIN C H, HSU Y W, et al.Monascin and ankaflavin prevents metabolic disorder by blood glucose regulatory, hypolipidemic, and anti-inflammatory effects in high fructose and high fat diet-induced hyperglycemic rat[J].Journal of Functional Foods, 2023, 104:105537.
[17] CHEN S Y, WANG G Y, LIN J H, et al.Antioxidant and anti-inflammatory activities and bioactive compounds of the leaves of Trichodesma khasianum Clarke[J].Industrial Crops and Products, 2020, 151:112447.
[18] NEWMAN D J, CRAGG G M.Natural products as sources of new drugs over the nearly four decades from 01/1981 to 09/2019[J].Journal of Natural Products, 2020, 83(3):770-803.
[19] WU L, LI W L, CHEN G M, et al.Ameliorative effects of monascin from red mold rice on alcoholic liver injury and intestinal microbiota dysbiosis in mice[J].Food Bioscience, 2022, 50:102079.
[20] LEE B H, HSU W H, HUANG T, et al.Effects of monascin on anti-inflammation mediated by Nrf2 activation in advanced glycation end product-treated THP-1 monocytes and methylglyoxal-treated wistar rats[J].Journal of Agricultural and Food Chemistry, 2013, 61(6):1288-1298.
[21] MALEKI S J, CRESPO J F, CABANILLAS B.Anti-inflammatory effects of flavonoids[J].Food Chemistry, 2019, 299:125124.
[22] PARK M, RYU D, CHO J, et al.Anti-inflammatory flavonoids from Agrimonia pilosa ledeb:Focusing on activity-guided isolation[J].Molecules, 2024, 29(2):283.
[23] NONG K Y, QIN X Y, LIU Z N, et al.Potential effects and mechanism of flavonoids extract of Callicarpa nudiflora Hook on DSS-induced colitis in mice[J].Phytomedicine, 2024, 128:155523.
[24] NEELAND I J, ROSS R, DESPRÉS J P, et al.Visceral and ectopic fat, atherosclerosis, and cardiometabolic disease:A position statement[J].The Lancet.Diabetes &Endocrinology, 2019, 7(9):715-725.