由于环境污染、营养不均衡以及生活压力增大等因素,癌症已成为21世纪以来影响和威胁人类健康的第二大常见疾病。肺癌是最常见的肺原发性恶性肿瘤,其发病率增长快、死亡率高。由于其错综复杂的生物学特性,人们对其潜在的发病机制仍不完全了解。手术、化疗和放疗等临床治疗方法副作用大、耐受性低[1]。因此,寻找新的靶点和方法缓解肺癌的发展,仍然是一个亟待解决的科学难题。
肠道菌群是人体不可缺少的“微生物器官”,在营养代谢、免疫系统调节和能量稳态等多个生理过程中发挥着至关重要的作用。此外,肠道菌群衍生的代谢物短链脂肪酸(short chain fatty acids,SCFAs)是连接肠道微生物组和癌症进展的关键枢纽,可以通过重塑肿瘤微环境和调节癌细胞、免疫细胞中的关键信号通路,影响癌症进展[2]。近年来研究发现,肠道菌群与肺癌之间存在着密切联系,肺癌患者肠道菌群普遍存在失调现象,主要表现为肠道微生物多样性、组成特征改变以及代谢相关生物活性的降低[3],天然多糖可以通过重塑肠道菌群和调节微生物代谢产物干预疾病的发展。因此,利用天然多糖改善肠道微生态,增强机体免疫反应,可能是预防和延缓肺癌的有效策略。
牛膝多糖(Achyranthes bidentata polysaccharide,AP)水溶性好且毒副作用小,具有抗肿瘤、抗氧化和抗病毒等多种药理作用,是潜在的抗癌剂[4]。然而,牛膝多糖对肠道健康的影响仍不明确。体外模拟胃肠消化和发酵模型实验为研究食品在消化道中的变化提供了一种方便、快捷且经济的方法,能够监测一段或多段肠道内微生物群的组成与代谢功能,有助于深入理解食物的性质及其对肠道环境的影响[5]。因此,本研究旨在通过体外模拟胃肠消化系统和肺癌患者粪便酵解模型,研究牛膝多糖的体外消化酵解特性,以探索其对肺癌患者肠道健康的潜在影响,从而为预防或辅助治疗肺癌提供有益的支持,为牛膝多糖在保健食品和医药等领域的应用提供理论依据。
1 材料与方法
1.1 材料
1.1.1 实验材料
牛膝,上海实久科技发展有限公司。牛膝多糖的提取方法参考文献[6]。首先,采用蒸馏水浸泡提取、分离牛膝中的粗多糖,进一步过滤、浓缩和纯化,得到牛膝多糖。牛膝多糖主要有葡萄糖和果糖组成,其物质的量比约为1∶8。
1.1.2 主要试剂
唾液淀粉酶、胃脂肪酶、胃蛋白酶、胰蛋白酶、玉米淀粉、酵母提取物、黏蛋白、3号胆盐和维生素K,上海源叶生物科技有限公司;无水乙醇、NaOH、HCl、KCl、NACl、NaHCO3、(NH4)2CO3、K2HPO4、CaCl2·2H2O、MnCl2·4H2O、CuSO4·5H2O、MgCl2·6H2O、NiCl2·6H2O、FeSO4·7H2O、CoSO4·7H2O、ZnSO4·7H2O、MgSO4·7H2O和吐温-80,国药集团化学试剂有限公司;蛋白胨、血红素、L-半胱氨酸盐酸盐,上海麦克林生物科技有限公司。
1.1.3 仪器设备
五连发酵罐(合作设计),上海百伦生物科技有限公司;ZNCL-GS智能磁力搅拌器,上海越众仪器设备有限公司;HH-2数显恒温水浴锅,常州朗越仪器制造有限公司;SW-CJ-2FD超净工作台,苏州净化设备有限公司;KZ-Ⅱ高速组织研磨仪,武汉赛维尔生物科技有限公司;QP2010Ultra气相色谱质谱联用仪,日本岛津公司。
1.2 体外模拟胃肠消化
参考BRODKORB等[7]的方法,对牛膝多糖进行口腔、胃和小肠这3个阶段的体外消化模拟实验(图1-a)。
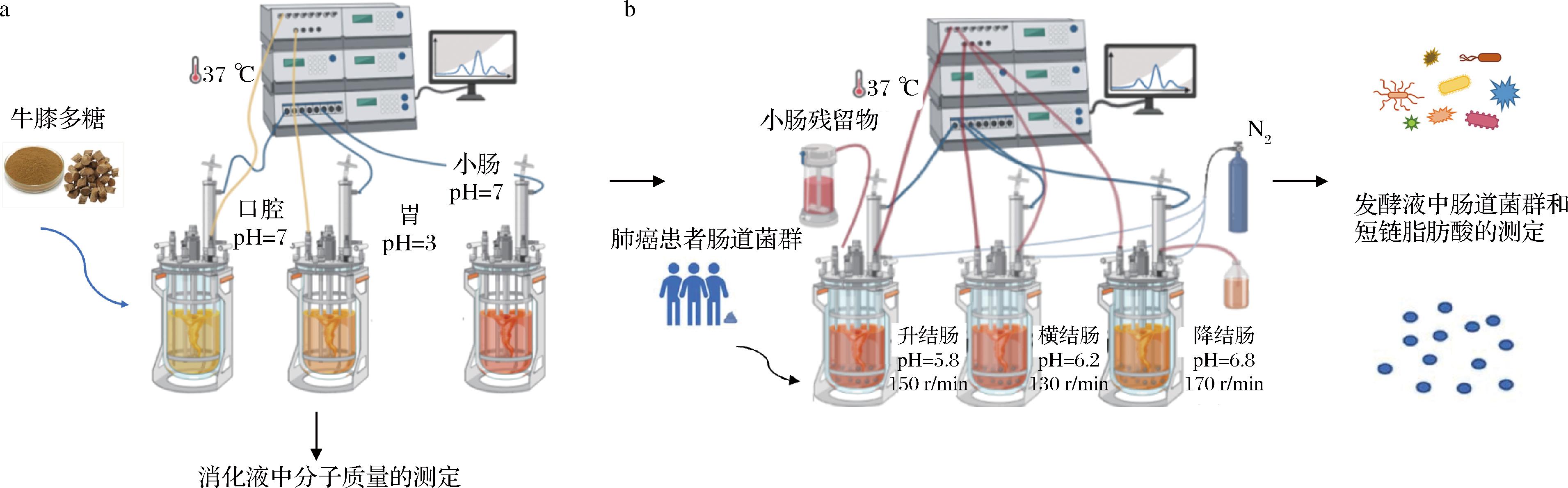
a-体外消化模拟实验;b-人体结肠系统模拟实验
图1 实验流程图
Fig.1 Flowchart of the experiment
注:发酵罐图片引自[8]。
体外模拟口腔消化:将50 mL样品与40 mL模拟口腔缓冲液混合,再加入0.25 mL 0.3 mol/L CaCl2溶液、160.9 mg 46.6 U/mg唾液淀粉酶,并用超纯水补足溶液至100 mL,37 ℃孵育2 min。在消化0和2 min分别取出5 mL样品,沸水浴灭酶10 min后保存在-20 ℃冰箱。同时设置空白对照组。
体外模拟胃消化:将口腔消化后的样品溶液与80 mL模拟胃缓冲液混合,再加入0.05 mL 0.3 mol/L CaCl2溶液、133.3 mg 2 000 U/mL胃蛋白酶、120 mg 60 U/mL胃脂酶,并用超纯水补足溶液至200 mL,在37 ℃的体外模拟系统中以150 r/min搅拌2 h,同时控制pH 3.0。在消化的0、1和2 h分别取出5 mL样品,沸水浴灭酶10 min后保存在-20 ℃冰箱。同时设置空白对照组。
体外模拟小肠消化:将胃消化后的样品溶液与80 mL模拟小肠缓冲液混合,再加入0.4 mL 0.3 mol/L CaCl2溶液、307.69 mg 130 U/mg胰蛋白酶、2 723.8 mg 10 mmol/L胆盐,并用超纯水补足溶液至400 mL,在37 ℃的体外模拟系统中以150 r/min搅拌5 h,同时控制pH 7.0。在消化0、1、3和5 h分别取出5 mL样品,沸水浴灭酶10 min后保存在-20 ℃冰箱。同时设置空白对照组。
1.3 体外模拟结肠酵解
根据SHIME模型和先前实验室研究,确定了“7 d稳定+7 d发酵”的试验方法[8],将牛膝多糖经口腔、胃和小肠消化后未被吸收的部分和10%的小肠可溶性部分进行体外发酵。
粪便收集:在进行体外发酵实验当天,使用一次性无菌采样器收集粪便样本。由3名(2名男性,1名女性,50~80岁)患有非小细胞肺癌,无炎症性肠炎等胃肠道疾病、未接受抗生素治疗且没有其他重大疾病的志愿者自愿提供粪便。所有患者均来自江南大学附属医院,并签署知情同意书。从每份粪便样本中称取5 g,加入120 mL无菌磷酸盐缓冲液(pH 6.8),充分混匀后用无菌纱布过滤,然后储存在厌氧环境中。
在无菌实验条件下,通过连接升、横和降结肠发酵罐模拟人体结肠系统(图1-b)。参数设置和肠道培养基配制方法均参考实验室先前的研究[8]。在每个发酵罐中接种10%(体积分数)肠道菌群,并通过pH自动控制系统添加1 mol/L NaOH溶液和1 mol/L HCl溶液以调节pH值。同时,每天3次向发酵罐中通入N2以维持严格的无氧环境。接种菌群24 h后,每天3次补充养料和排除废料各100 mL,以维持微生物的正常生长。
将小肠消化后的样品溶液在4 ℃的条件下,4 000×g离心10 min,以获得未消化的固体残渣。据研究,在小肠消化过程中大约有10%的潜在可吸收成分未能被吸收,但最终进入结肠[9]。因此,将体积分数为10%的小肠可溶性部分和未消化的固体残渣作为菌群发酵底物。肠道菌群接种7 d后,趋于稳定生长,然后在补料罐中额外加入样品,进行连续7 d结肠发酵。收集发酵前(发酵第0天)和发酵第2、4、6和7天各结肠部位的发酵液。
1.4 分子质量测定
不同时间点的样品离心后取上清液,用0.22 μm微孔滤膜处理后上机检测。采用高效凝胶渗透色谱技术进行分析,配置高性能液相色谱系统,该系统配备了2414型示差折射指数检测器以及Empower3软件平台进行数据处理。
色谱分析条件如下:使用UltrahydrogelTM Linear色谱柱(300 mm×7.8 mm×2 columns),采用0.1 mol/L NaNO3溶液作为流动相,流动速率设置为0.9 mL/min,色谱柱温度维持在45 ℃,样品进样量为10 μL。
1.5 16S rDNA测序分析
用CTAB法提取样本的基因组DNA,并用琼脂糖凝胶电泳评估DNA的纯度和浓度。在PCR条件下,使用特定引物扩增整个基因组的16S rDNA基因(V3~V4区域),并使用磁珠纯化合格的PCR产物。使用TruSeq® DNA PCR-Free样品制备试剂盒(Illumina,美国)生成测序文库。DNA测序在Illumina NovaSeq平台上进行。使用PICRUSt2软件和KEGG数据库对肠道微生物基因组进行功能分析。
1.6 短链脂肪酸含量的测定
准确称取100~150 mg样品,加入0.1 mL 0.1 mg/mL 2-羟基丁酸内标溶液、0.1 mL KHSO4饱和溶液,混合均匀后剧烈振荡15 min。然后,以4 000 r/min转速离心12 min,目的是从二甲基碳酸酯相中提取SCFAs。最后,采用GC-MS对SCFAs进行分析[10]。
1.7 数据统计与分析方法
本论文数据表示为平均值±标准差,采用GraphPad Prism 9.0进行统计学分析和图形绘制。本实验两组间的比较采用非配对t检验,3组间或3组间以上选用单因素方差分析。P<0.05被认为具有统计学意义。
2 结果与分析
2.1 牛膝多糖消化过程中分子质量的变化
食物在口腔胃肠消化过程会发生一系列化学和物理变化,而物质的成分和结构会影响其营养和功能,因此,了解消化过程中物质的变化对机体健康至关重要。表1和图2显示了牛膝多糖在体外模拟口腔、胃和小肠消化过程中分子质量的变化情况。
表1 体外模拟消化过程中牛膝多糖的分子质量变化
Table 1 Molecular weight changes of AP during simulated digestion in vitro

口腔消化分子质量/Da牛膝多糖空白胃消化分子质量/Da牛膝多糖空白小肠消化分子质量/Da牛膝多糖空白0 min1 7227740 h1 6457480 h1 6877372 min1 7167681 h1 5377471 h1 6867382 h1 6367493 h1 6907325 h1 688739
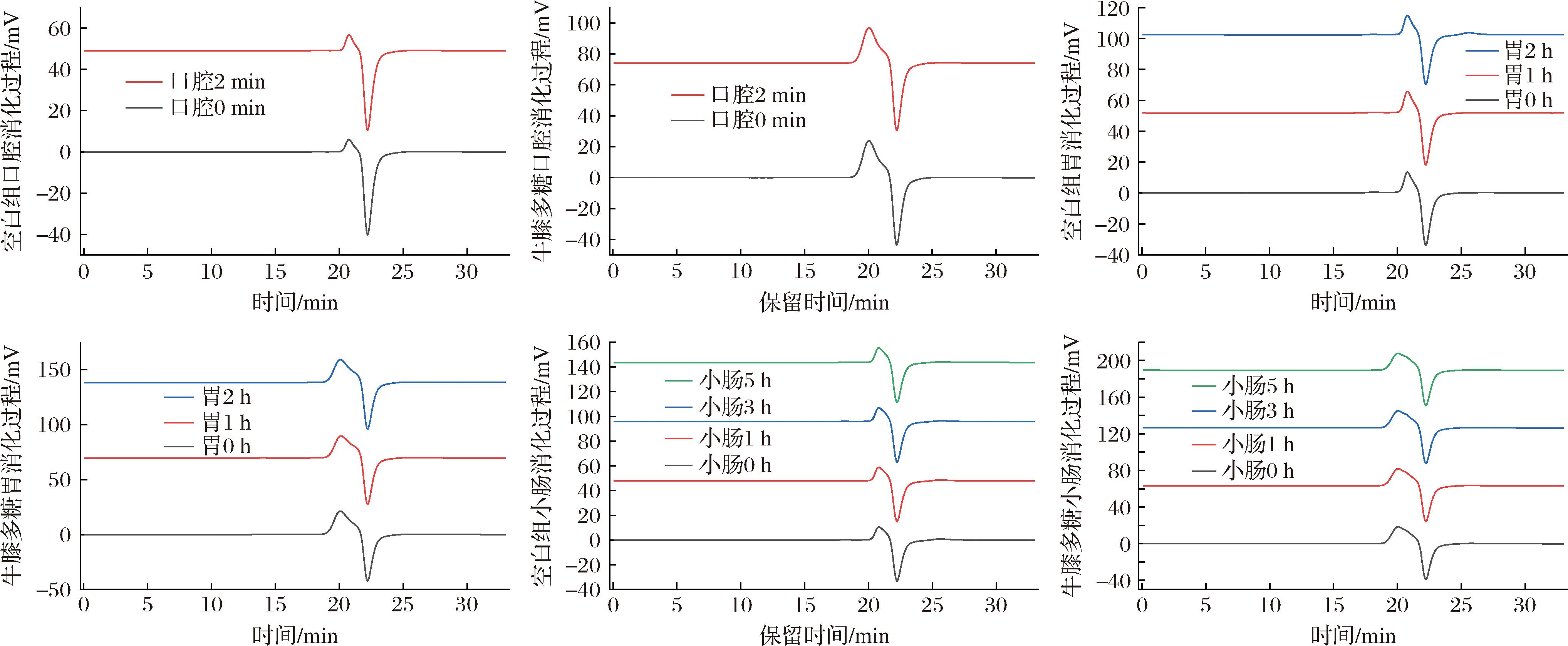
图2 牛膝多糖消化液中分子质量的变化
Fig.2 Changes in molecular weight in AP digest
在模拟口腔消化实验中,2 min内分子质量仅从1 722 Da变为1 716 Da,且在色谱图中所显示的出峰时间并未有明显变化,表明其不受唾液消化影响;在胃液消化过程中,2 h内分子质量从1 645 Da降至1 636 Da,且在色谱图中的出峰时间未有明显变化。在模拟小肠液消化实验中,5 h内分子质量基本持平,从1 687 Da至1 688 Da,多糖的出峰时间及峰形也未有明显变化,说明牛膝多糖在小肠液消化过程中也不易被降解。
综上所述,牛膝多糖在消化过程中基本保持稳定,不易被降解,可以较为“完整”地进入结肠,为后续研究牛膝多糖对肠道菌群的调节作用提供了理论依据。
2.2 牛膝多糖对肺癌患者肠道菌群的影响
2.2.1 牛膝多糖对肺癌患者肠道菌群多样性的影响
本研究利用16S rDNA测序研究牛膝多糖对肺癌患者肠道菌群的影响。首先,通过Chao1指数、Simpson指数和Shannon指数评估牛膝多糖对菌群Alpha多样性的影响。Chao1指数反映菌群的丰富度,指数越大,物种数量越多;Shannon指数评估微生物的多样性;Simpson指数描述物种分布的多样性和均匀度[11]。随着发酵时间的延长,第7天Chao1指数显著低于发酵前(D0组)(P<0.05)(图3-a),表明微生物物种数量显著降低。在发酵过程中,Shannon和Simpson指数显示菌群的多样性和均匀性具有先降低后上升再下降的趋势,并始终低于发酵前(图3-b和图3-c),说明牛膝多糖可以调节肺癌患者肠道菌群丰度和多样性。

a-Chao1指数;b-Shannon指数;c-Simpson指数;d-PCoA;e-PCA
图3 牛膝多糖对肺癌患者肠道菌群多样性的影响
Fig.3 Effect of AP on the diversity of gut microbiota diversity in lung cancer patients
注:*P<0.05 vs D0组,D0代表发酵的第0天(发酵前),D2、4、6和7代表发酵的第2、4、6和7天(下同)。
通过主成分分析(principal components analysis,PCA)和主坐标分析(principal co-ordinates analysis,PCoA)评估牛膝多糖对菌群Beta多样性的影响,样品间菌群组成结构越相似,它们在图中的距离越接近。从图3-d和图3-e中可以看出,D0组的样本点与其他组的距离较远,而D2、D4、D6和D7组的距离相对较近,表明发酵前后群落结构存在显著性差异,进一步说明牛膝多糖可以调节肺癌患者肠道菌群的结构。
2.2.2 牛膝多糖对肺癌患者肠道菌群组成的影响
2.2.2.1 门水平上的变化
为了进一步研究牛膝多糖对肠道菌群组成的影响,从门和属水平进行分析。图4-a所示为体外模拟人体的升结肠、横结肠和降结肠厌氧发酵7 d过程中,门水平上肠道菌群的相对丰度,主要有拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、互养菌门(Synergistetes)和放线菌门(Actinobacteria)组成。随着发酵时间延长,与发酵前相比,发酵后拟杆菌门(Bacteroidetes)、变形菌(Proteobacteria)的相对丰度增加,厚壁菌门(Firmicutes)的相对丰度减少。这些结果表明,牛膝多糖可以影响肺癌患者肠道菌群的组成。

a-门水平;b-属水平
图4 牛膝多糖对肺癌患者肠道菌群组成的影响
Fig.4 Effects of AP on the composition of gut microbiota in lung cancer patients
注:S-升结肠、H-横结肠、J-降结肠,0、2、4、6、7代表发酵时间(天)(下同)。
2.2.2.2 属水平上的变化
在属水平上进一步分析肠道菌群的组成,结果如图4-b所示,主要有普雷沃氏菌属(Prevotella)、柠檬酸杆菌属(Citrobacter)、巨球型菌属(Megasphaera)、芽殖菌属(Gemmiger)、拟杆菌属(Bacteroides)、肠杆菌属(Enterobacter)、萨特氏菌属(Sutterella)、考拉杆菌属(Phascolarctobacterium)等组成。
图5-a和图5-b结果表明,相比发酵前,发酵后普雷沃氏菌属(Prevotella)、巨球型菌属(Megasphaera)、梭菌属(Clostridium)(P<0.05)、巨单胞菌属(Megamonas)(P<0.001)、肠杆菌属(Enterobacter)、考拉杆菌属(Phascolarctobacterium)、阿克曼氏菌属(Akkermansia)(P<0.05)的相对丰度增加,瘤胃球菌属(Ruminococcus)、萨特氏菌属(Sutterella)的相对丰度显著降低(P<0.001)。
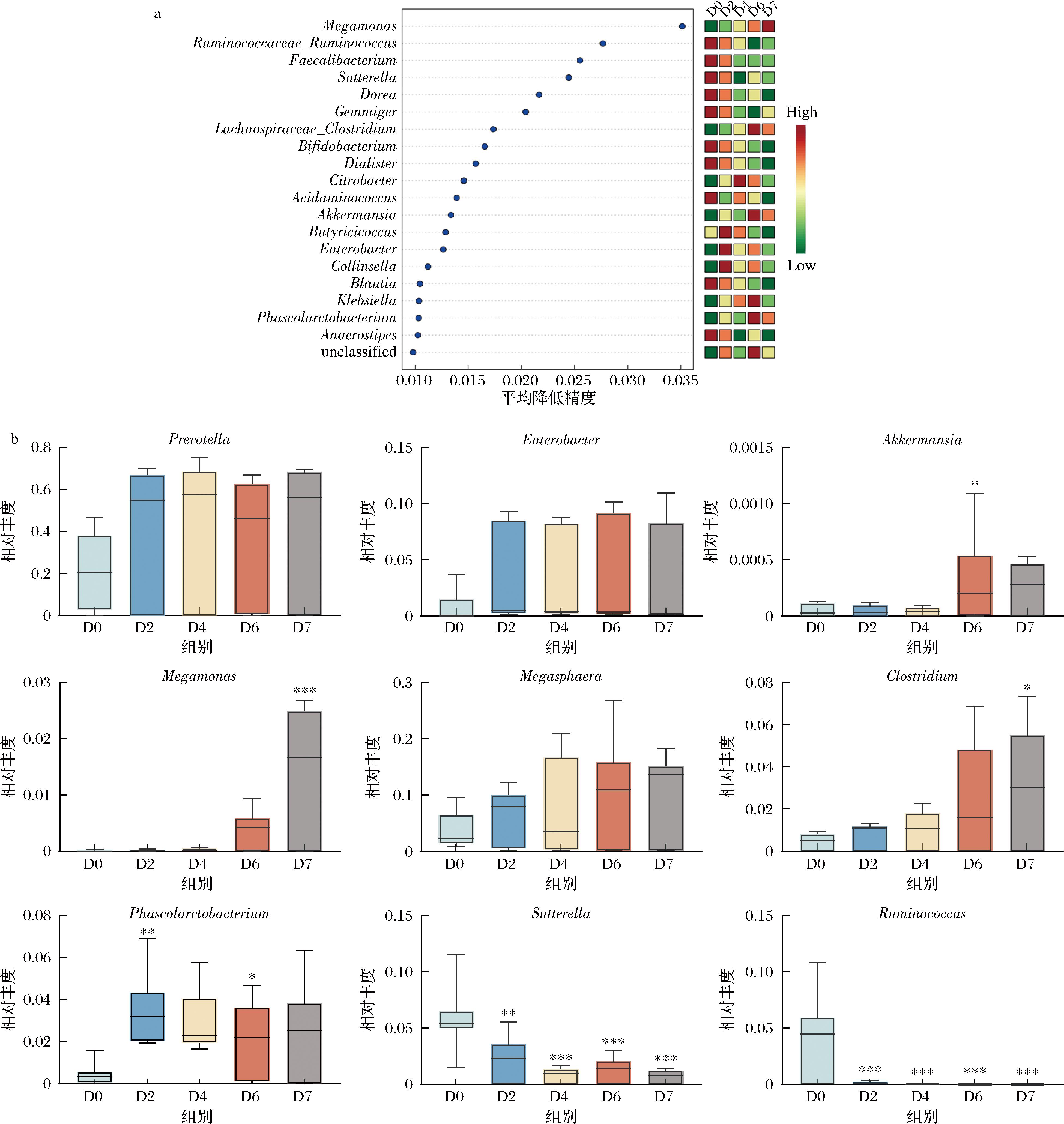
a-随机森林分析;b-属水平上肠道菌群的相对丰度
图5 属水平上肠道菌群的变化
Fig.5 Changes in gut microbiota at the genus level
注:*P<0.05,**P<0.01和***P<0.001 vs D0组。
进一步分析各类菌属微生物丰度变化及其功能:
1)普雷沃氏菌属(Prevotella)是与高纤维饮食相关的有益菌,可以利用多糖促进短链脂肪酸的产生。此外,研究发现普雷沃氏菌属在体内的富集程度与机体免疫水平密切相关,其相对丰度与肠黏膜中活化的CD4+和CD8+细胞数成正比[12]。
2)肠杆菌属(Enterobacter)通过作用于胆碱和其受体α7nAChR介导视黄酸和转化生长因子-β(transforming growth factor-β,TGF-β)上调,增强机体免疫耐受能力,从而保护小鼠免受硫酸葡聚糖钠盐诱导的结肠炎[13]。
3)阿克曼氏菌属(Akkermansia)通过影响代谢酶活性和代谢物水平,调控肿瘤代谢。它能够抑制肿瘤组织中的碳水化合物和谷氨酰胺代谢,形成不利于肿瘤生长的代谢微环境,从而抑制肺癌发展[14]。
4)牛膝多糖干预促进了巨单胞菌属(Megamonas)、巨球型菌属(Megasphaera)和梭菌属(Clostridium)、考拉杆菌属(Phascolarctobacterium)的增殖,这些菌可以促进SCFAs的产生,从而对宿主健康产生积极影响[15-16]。
5)瘤胃球菌属(Ruminococcus)与肠易激综合征呈正相关,并与代谢疾病密切相关。在非酒精性脂肪性肝炎和肝细胞癌患者中,瘤胃球菌的丰度显著增加[17]。
6)萨特氏菌属(Sutterella)可能损害肠道免疫功能,引发轻微的炎症反应。此外,有研究表明,岩藻多糖可以降低萨特氏菌属的相对丰度,减少宿主中的抗原负载和炎症反应[18]。
综上所述,牛膝多糖不仅可以促进产SCFAs、维护肠道健康及调节肿瘤免疫的有益菌属增殖,还可以抑制潜在有害菌增殖。说明其具有维护肠道健康及潜在的改善肺癌的作用。
2.2.2.3 相关性网络分析
为了进一步探究牛膝多糖对肺癌患者肠道菌群网络关联的影响,构建了属水平微生物的共线网络(图6)。结果表明,相关性较强的微生物包括拟杆菌属(Bacteroides)、颤螺菌属(Oscillospira)、副拟杆菌属(Parabacteroides)、肠杆菌属(Enterobacter)、瘤胃球菌属(Ruminococcus)和芽殖菌属(Gemmiger)。其中,拟杆菌属(Bacteroides)处于核心地位。拟杆菌属(Bacteroides)是优秀的多糖降解剂,含有较多的碳水化合物活性酶[19]。这些结果表明在牛膝多糖干预下,上述菌属在调节肠道微生态平衡方面发挥关键作用。
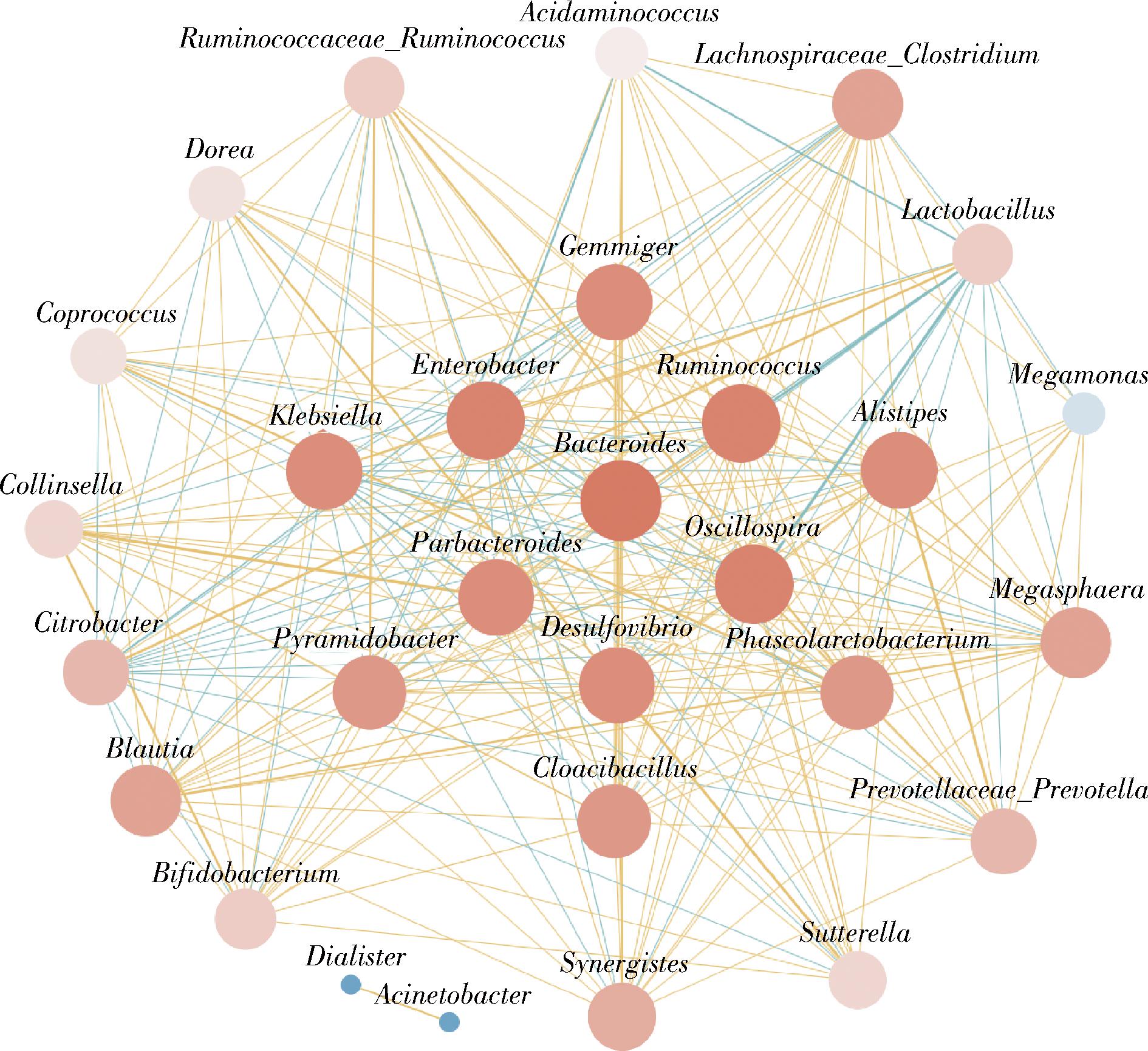
图6 微生物属水平网络分析
Fig.6 Genus-level network analysis of microbiota
2.2.3 牛膝多糖对肺癌患者微生物代谢功能的影响
肠道微生物群的相对丰度与宿主在健康和疾病中的代谢能力高度相关,为了深入研究牛膝多糖在调节肠道微生物和代谢过程中的作用,本研究采用了PICRUSt2算法和KEGG数据库分析肠道菌群的代谢功能。
如图7-a所示,PCA结果表明发酵前后微生物的代谢功能发生了明显变化,在Level 2上进行随机森林分析(图7-b),发现牛膝多糖干预促进了辅助因子和维生素代谢、氨基酸代谢、核苷酸代谢和能量代谢等途径,同时减弱了药物依赖性,这些结果表明牛膝多糖能够改善微生物代谢功能。图7-c呈现了Level 3中最突出的20条代谢途径,牛膝多糖干预显著上调了泛酸和辅酶A的生物合成,氨基酸的生物合成,缬氨酸、亮氨酸和异亮氨酸的生物合成,硫胺素新陈代谢等途径。氨基酸代谢、泛酸和辅酶A的生物合成与肿瘤免疫密切相关。氨基酸不仅供给免疫细胞所需的能量和生物基质,还通过其代谢产物参与信号传递和免疫调节,从而维持免疫系统平衡[20]。此外,研究表明,辅酶A可以通过激活缺氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)和芳香烃受体AhR的表达,增强T细胞的氧化磷酸化水平,从而增强抗肿瘤效果[21]。

a-PCA结果;b-Level 2上的微生物代谢水平;c-Level 3上的微生物代谢水平
图7 牛膝多糖对微生物代谢功能的影响
Fig.7 Effects of AP on microbial metabolic function
综上所述,预测结果表明牛膝多糖通过影响肠道菌群,提高机体营养物质的合成与代谢能力,促进氨基酸生物合成、泛酸和辅酶A代谢,从而抑制肺癌发展。
2.3 牛膝多糖对肺癌患者SCFAs的影响
微生物群衍生的代谢物是宿主-微生物相互作用的关键介质。SCFAs作为肠道微生物发酵未消化膳食纤维的最终产物,在维持肠道和全身稳态、影响葡萄糖代谢、炎症和免疫系统功能方面具有重要作用。此外,作为重要的细胞稳态调节因子,SCFAs通过调节组蛋白去乙酰化酶和G蛋白偶联受体的活性,影响细胞附着、免疫细胞迁移、细胞因子产生、趋化性和程序性细胞死亡,从而减少癌变,延缓癌症发展,进一步达到预防和治疗胃肠道癌和肺癌的目的[2]。为了研究牛膝多糖对肺癌患者SCFAs的影响,通过GC-MS测定了发酵液中SCFAs的浓度。
如图8-a所示,乙酸、丙酸和丁酸是牛膝多糖主要的发酵产物。与发酵前相比,经过7 d发酵,SCFAs的总浓度从(10.74±0.82) μg/g显著增加到(15.43±1.03) μg/g(P<0.001),进一步证实了牛膝多糖促进肠道菌群产生SCFAs的作用。其中,厌氧发酵7 d后,乙酸、丙酸和丁酸的浓度较发酵前显著增加(P<0.05),戊酸、异戊酸和异丁酸的浓度也有增加,但没有统计学差异。
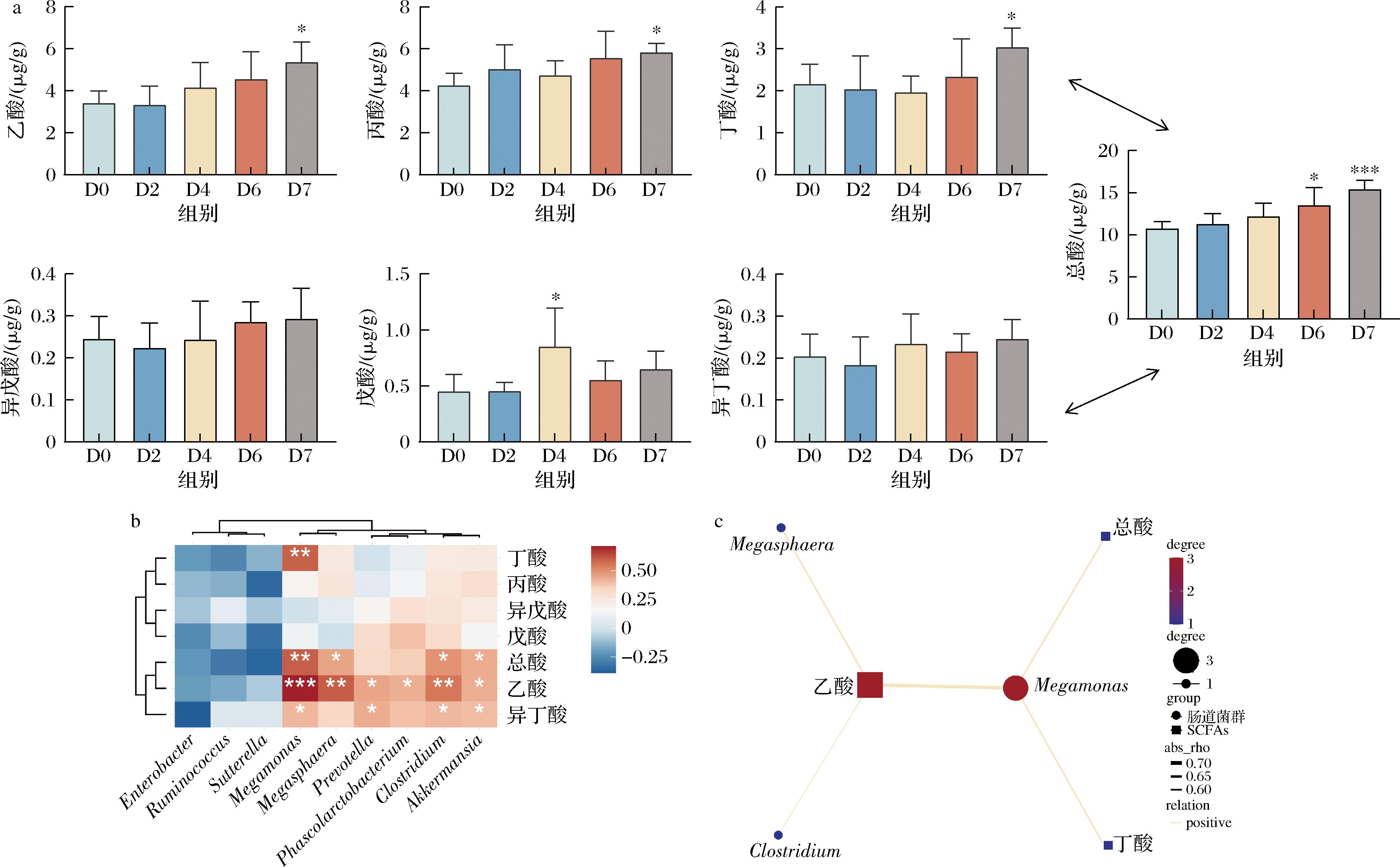
a-SCFAs浓度;b-差异菌与SCFAs的相关性分析;c-差异菌与SCFAs的相关性分析网络图
图8 体外模拟发酵过程中SCFAs的变化及相关性分析
Fig.8 Changes and correlation analysis of SCFAs during simulated fermentation in vitro
研究报道,乙酸盐可以通过影响机体的脂质代谢和葡萄糖稳态来维持能量平衡和代谢稳态,抵抗氧化和线粒体应激,从而影响免疫反应[22]。在厌氧发酵7 d的时间内,乙酸浓度随着发酵时间的延长呈上升趋势,由(3.42±0.57) μg/g逐步增加到(5.36±0.97) μg/g(P<0.05)。另外,从总体上研究,丙酸浓度也基本随着发酵时间延长逐步增加,研究表明丙酸可以通过下调存活素表达,激活细胞凋亡和细胞周期停滞,从而显示出抗肺癌特性[23];此外,丙酸和丁酸通过调节炎症因子的表达,促进免疫细胞的分化和迁移,提高肿瘤免疫反应[24]。7 d后,丁酸浓度显著增加到(3.04±0.46) μg/g(P<0.05),研究指出,丁酸有利于促进肠道健康,它可以通过刺激上皮细胞增殖、增加黏液层并改善紧密连接蛋白的表达,维持肠道屏障完整性[25]。
综上所述,牛膝多糖可以被肺癌患者肠道菌群所利用,促进乙酸、丙酸和丁酸等SCFAs的产生,从而有助于维持肠屏障功能,调节炎症因子水平,增强免疫应答,从而影响肺癌发展。
2.4 相关性分析
Spearman相关性分析旨在探索属水平的肠道菌群和SCFAs之间的潜在关系(图8-b和图8-c)。其中巨球型菌属(Megasphaera),巨单胞菌属(Megamonas),柠檬酸杆菌属(Citrobacter),阿克曼氏菌(Akkermansia),与总酸和乙酸呈显著正相关(P<0.05)。此外,普雷沃氏菌属(Prevotella)和考拉杆菌属(Phascolarctobacterium)与乙酸呈显著正相关(P<0.05),实验结果表明,牛膝多糖通过促进产SCFAs的有益菌增殖,调节SCFAs的浓度,改善肠道稳态。
综上所述,牛膝多糖通过调节肠道菌群的组成,增加SCFAs的浓度,从而有助于维护肠道健康,调节肿瘤免疫,缓解肺癌发展。
3 结论
本研究发现,牛膝多糖经体外模拟口腔、胃和小肠液消化后,分子质量无显著变化,可以较为“完整”地进入结肠;经肺癌患者粪便菌群酵解后,可以调节发酵液中菌群的结构和组成,促进普雷沃氏菌属、考拉杆菌属和阿克曼氏菌属等有益菌的增殖,抑制瘤胃球菌属和萨特氏菌属潜在有害菌的生长,同时,促进乙酸、丙酸和丁酸的产生,改善短链脂肪酸代谢。此外,功能预测表明,牛膝多糖通过影响肠道菌群,提高机体营养物质的合成与代谢能力,促进氨基酸生物合成、泛酸和辅酶A代谢,从而抑制肺癌发展。综上所述,牛膝多糖可能是干预肺癌的潜在益生元,为预防或辅助治疗肺癌提供有益的支持,并为开发有效的膳食和药物干预策略提供新的思路。然而,由于本研究中肺癌患者粪便的样本量较少,体外发酵的结果并不能完全反应牛膝多糖对肺癌患者肠道菌群的潜在调节作用,未来仍需要进一步探究。此外,在后续研究中,应结合动物实验和人体实验全面评估牛膝多糖的安全性和有效性,并深入探究其对肺癌患者肠道菌群长期效应的影响。
[1] THAI A A, SOLOMON B J, SEQUIST L V, et al.Lung cancer[J].The Lancet, 2021, 398(10299):535-554.
[2] CORR A-OLIVEIRA R, FACHI J L, VIEIRA A, et al.Regulation of immune cell function by short-chain fatty acids[J].Clinical &Translational Immunology, 2016, 5(4):e73.
A-OLIVEIRA R, FACHI J L, VIEIRA A, et al.Regulation of immune cell function by short-chain fatty acids[J].Clinical &Translational Immunology, 2016, 5(4):e73.
[3] ZHENG Y J, FANG Z Y, XUE Y, et al.Specific gut microbiome signature predicts the early-stage lung cancer[J].Gut Microbes, 2020, 11(4):1030-1042.
[4] CHAI J H, HE T T, JIANG S L, et al.Oligo/polysaccharides from Cyathula officinalis and Achyranthes bidentata:A review of structures and bioactivities[J].Journal of Pharmacy and Pharmacology, 2024, 76(4):307-326.
[5] GUO Y X, CHEN X F, GONG P, et al.Advances in the in vitro digestion and fermentation of polysaccharides[J].International Journal of Food Science &Technology, 2021, 56(10):4970-4982.
[6] FAN S R, WANG Y X, ZHANG Y, et al.Achyranthes bidentata polysaccharide activates nuclear factor-kappa B and promotes cytokine production in J774A.1 cells through TLR4/MyD88 signaling pathway[J].Frontiers in Pharmacology, 2021, 12:753599.
[7] BRODKORB A, EGGER L, ALMINGER M, et al.INFOGEST static in vitro simulation of gastrointestinal food digestion[J].Nature Protocols, 2019, 14(4):991-1014.
[8] LIU C, GUO Y H, CHENG Y L, et al.A colon-targeted delivery system of torularhodin encapsulated in electrospinning microspheres, and its co-metabolic regulation mechanism of gut microbiota[J].Food Hydrocolloids, 2023, 135:108189.
[9] PÉREZ-BURILLO S, MOLINO S, NAVAJAS-PORRAS B, et al.An in vitro batch fermentation protocol for studying the contribution of food to gut microbiota composition and functionality[J].Nature Protocols, 2021, 16(7):3186-3209.
[10] LIU C, DU P, CHENG Y L, et al.Study on fecal fermentation characteristics of aloe polysaccharides in vitro and their predictive modeling[J].Carbohydrate Polymers, 2021, 256:117571.
[11] LIU C, JIANG W H, YANG F W, et al.The combination of microbiome and metabolome to analyze the cross-cooperation mechanism of Echinacea purpurea polysaccharide with the gut microbiota in vitro and in vivo[J].Food &Function, 2022, 13(19):10069-10082.
[12] TETT A, PASOLLI E, MASETTI G, et al.Prevotella diversity, niches and interactions with the human host[J].Nature Reviews.Microbiology, 2021, 19(9):585-599.
[13] LI Q Q, SUN X, YU K Y, et al.Enterobacter ludwigii protects DSS-induced colitis through choline-mediated immune tolerance[J].Cell Reports, 2022, 40(9):111308.
[14] DEROSA L, ROUTY B, THOMAS A M, et al.Intestinal Akkermansia muciniphila predicts clinical response to PD-1 blockade in patients with advanced non-small-cell lung cancer [J].Nature Medicine, 20, 28(2):315-324.
[15] SHETTY S A, MARATHE N P, LANJEKAR V, et al.Comparative genome analysis of Megasphaera sp.reveals niche specialization and its potential role in the human gut[J].PLoS One, 2013, 8(11):e79353.
[16] ZHANG J C, GUO Z, XUE Z S, et al.A Phylo-functional core of gut microbiota in healthy young Chinese cohorts across lifestyles, geography and ethnicities[J].The ISME Journal, 2015, 9(9):1979-1990.
[17] HALL A B, YASSOUR M, SAUK J, et al.A novel Ruminococcus gnavus clade enriched in inflammatory bowel disease patients[J].Genome Medicine, 2017, 9(1):103.
[18] KAAKOUSH N O.Sutterella species, IgA-degrading bacteria in ulcerative colitis[J].Trends in Microbiology, 2020, 28(7):519-522.
[19] SCHWALM N D, GROISMAN E A.Navigating the gut buffet:Control of polysaccharide utilization in Bacteroides spp[J].Trends in Microbiology, 2017, 25(12):1005-1015.
[20] GROHMANN U, BRONTE V.Control of immune response by amino acid metabolism[J].Immunological Reviews, 2010, 236(1):243-264.
[21] ST PAUL M, SAIBIL S D, HAN S, et al.Coenzyme A fuels T cell anti-tumor immunity[J].Cell Metabolism, 2021, 33(12):2415-2427.
[22] BACH KNUDSEN K E, L☞RKE H N, HEDEMANN M S, et al.Impact of diet-modulated butyrate production on intestinal barrier function and inflammation[J].Nutrients, 2018, 10(10):1499.
[23] KIM K, KWON O, RYU T Y, et al.Propionate of a microbiota metabolite induces cell apoptosis and cell cycle arrest in lung cancer[J].Molecular Medicine Reports, 2019, 20(2):1569-1574.
[24] SAM Q H, LING H, YEW W S, et al.The divergent immunomodulatory effects of short chain fatty acids and medium chain fatty acids[J].International Journal of Molecular Sciences, 2021, 22(12):6453.
[25] HU J M, LIN S L, ZHENG B D, et al.Short-chain fatty acids in control of energy metabolism[J].Critical Reviews in Food Science and Nutrition, 2018, 58(8):1243-1249.