富硒食品近年来一直是消费者追逐的热点,其核心原因在于硒参与人体至少25种硒蛋白的合成,它们具有抗氧化防御、调节甲状腺激素和脂质代谢等多种生理作用[1-2]。硒蛋白的生物学功能高度依赖机体硒营养状态,硒缺乏将导致机体免疫力下降,并与至少10种以上疾病(如克山病、大骨节病、肿瘤等)的发生紧密相关。由于只有少数地区的土壤富含硒元素,这导致我国乃至全球大部分地区人群的硒摄取量低于WHO/FAO推荐水平(50~200 μg/d)。有研究认为当前全球至少10亿人面临硒缺乏[3],而我国约1/3人口的硒摄入量(<25 μg/d)也远低于中国营养学会推荐的成人膳食硒推荐量(60 μg/d)[4]。因此,寻找高效安全的硒营养强化剂和富硒食品具有十分重要的意义。
茶树具有很强的富硒能力,富硒地区种植的茶树能富集约0.17~2.35 mg/kg硒[2]。富硒茶80%以上的硒以有机硒形态存在,其中蛋白硒约占有机硒76%,且主要为硒代蛋氨酸(selenomethionine,SeMet)[3]和甲基硒代半胱氨酸(methyl-selenocysteine,MeSeCys),是高效安全的补硒食品之一[5]。与普通茶叶相比,富硒茶具有更强的抗氧化[6]及改糖脂代谢能力[7]。超微粉碎是一种将物料颗粒粉碎为粒径为1~100 μm的现代加工技术,可显著提升物料的生物利用度、持水性、溶解性、比表面积等理化特性。与传统茶叶相比,超微茶粉在开发高附加值的功能产品上具有优势,近年来成为茶叶提质增效加工的常用手段之一。研究表明,随着茶粉粒度减小,超微绿茶粉的亮度逐渐增加,茶多酚、游离氨基酸等物质含量呈先升高后降低的趋势[8]。褚飞洋等[9]发现随着茶粉粒度降低,超微红茶粉的水浸出物含量、氨基酸含量及可溶性糖的含量显著增加,但茶多酚、茶色素和粗纤维的含量呈降低趋势。此外,茶富含的活性成分可改善肠道菌群多样性和丰度,进而有效调控糖脂代谢[7,10]。然而,目前对茶活性成分的研究大多集中在茶多糖、茶多酚和茶蛋白的功能特性及其在胃肠消化和发酵过程中的变化,对茶中主要硒化合物在胃肠道消化过程中的变化研究较少。
本研究以富硒绿茶为原料,探究超微粉碎和普通粉碎对其基本组分、硒含量和形态及粉体性质的影响差异;进一步利用体外模拟胃肠消化及体外发酵手段,研究超微富硒绿茶硒代氨基酸的释放规律及其体外益生特性,以期为富硒茶产品超微化的研发及精深加工提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
新鲜富硒绿茶,重庆市旺发茶叶有限公司。SeMet、MeSeCys、硒代胱氨酸(selenocysteine,SeCys2)(纯度≥98%,分析纯),上海麦克林生化科技有限公司;α-淀粉酶(A0521,1 000~3 000 U/mg)、胃蛋白酶(P7125,≥400 U/mg),美国Sigma公司;胰酶(S10031,胰蛋白酶≥4 000 U/mg,胰α-淀粉酶≥7 000 U/mg,胰脂肪酶≥4 000 U/mg)、蛋白酶K(S10085,30 U/mg)、考马斯亮蓝试剂盒(G-250),上海源叶生物科技有限公司;猪胆盐(G8310,纯度>65%),北京索莱宝科技有限公司;超氧化物歧化酶(superoxide dismutase,SOD)活力试剂盒(A001-2-2)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活力试剂盒(A005-1-2),南京建成生物工程研究所;乙酸(纯度≥98%)、丙酸(纯度≥99%)、丁酸(纯度≥99%)、戊酸(纯度≥99%)、2-乙基丁酸(纯度≥99%),上海阿拉丁生化科技股份有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
CJM-SY-B高能纳米冲击磨,河北省秦皇岛市太极环纳米制品有限公司;AQ-180E多功能粉碎机,慈溪市耐欧电器有限公司;MS2000马尔文激光粒度仪,英国马尔文仪器有限公司;Scientz-10 ND真空冷冻干燥机,宁波新芝生物科技股份有限公司;UltraScan PRO测色仪,美国HunterLab公司;LC-20A高效液相色谱仪(SPD-20A可变波长紫外检测器)、GC-2010气相色谱仪,日本岛津仪器有限公司;WX-7000HP微波消解仪,上海屹尧仪器科技发展有限公司;L6分光光度计,上海仪点分析仪器有限公司;PF52原子荧光光度计,北京普析通用仪器有限责任公司;DHG-9140电热恒温鼓风干燥箱,上海齐欣科学仪器有限公司。
1.3 实验方法
1.3.1 不同粒径富硒绿茶粉的制备
采用振动球磨机对富硒绿茶进行干法超微粉碎6 h(冷却温度5 ℃,研磨腔体容积4 L,功率4 kW,转速400 r/min,研磨介质为氧化锆陶瓷球),制得超微富硒绿茶粉P1;采用粉碎机粉碎富硒绿茶1 min(额定功率220 W,电动机转速22 000 r/min),分别过80、100、200目筛并收集筛下物茶粉,依次命名为P2、P3、P4。所有样品密封于-20 ℃条件下储藏备用。
1.3.2 理化指标测定
采用马尔文激光粒度仪对样品进行测定[11],粒径分布由D10、D50、D90来表述。水分测定依据GB 5009.3—2016《食品安全国家标准 食品中水分的测定》;可溶性蛋白含量采用考马斯亮蓝试剂盒测定;游离氨基酸含量测定依据GB/T 8314—2013 《茶 游离氨基酸总量的测定》,标准曲线方程y=2.108 3x-0.053 2(R2=0.991 2);采用苯酚-硫酸法测定可溶性总糖[12],标准曲线方程y=6.816 4x+0.004 2(R2=0.999 6);总浸出物测定依据GB/T 8305—2013《茶 水浸出物测定》。
1.3.3 硒含量测定
总硒含量测定依据GB 5009.93—2017《食品安全国家标准 食品中硒的测定》;无机硒含量测定参考DBS 42/010—2018《食品安全地方标准 富硒食品中无机硒的测定方法》并略作修改。取0.2 g茶粉于离心管,加入50 mL纯水,沸水浴浸提45 min后室温冷却,4 000 r/min离心10 min,取上清液过膜。取5~8 mL滤液倒入玻璃消解管,加入3 mL 6 mol/L盐酸溶液,在恒温消解仪中继续加热至溶液清亮,待溶液冷却后,定容至10 mL,采用原子荧光光谱法测定。总硒和无机硒含量差值即为有机硒含量。
1.3.4 多酚及叶绿素测定
茶多酚总量测定依据GB/T 8313—2018《茶叶中茶多酚和儿茶素类含量的检测方法》,标准曲线方程y=5.624 3x+0.015(R2=0.996 4);叶绿素总量测定依据NY/T 3082—2017《水果、蔬菜及其制品中叶绿素含量的测定 分光光度法》,分别在645 nm和663 nm处测定吸光值。
1.3.5 粉体特性
1.3.5.1 休止角测定
将漏斗固定水平放置的白纸上方5 cm,取2 g茶粉倒入漏斗,下落形成圆锥体,稳定1 min后测定圆锥体底部直径(D)和高(H)[13]。休止角(θ)计算如公式(1)所示:
θ/°=arctan(2H/D)
(1)
1.3.5.2 堆积密度测定
将2 g茶粉(m)置于10 mL量筒,并记录样品体积(V)[13]。堆积密度(ρ)计算如公式(2)所示:
(2)
1.3.5.3 色泽测定
采用测色仪测定色差,L*表示亮度,a*表示红绿度,b*表示黄蓝度。
1.3.5.4 水合特性和持油力
参考张嘉妮等[14]方法进行持水力、膨胀力、溶解度及持油力测定,计算如公式(3)~公式(6)所示:
持水力![]()
(3)
式中:m1,茶粉的质量,g;m2,离心管的质量,g;m3,弃上清液后湿沉淀和离心管的质量,g。
膨胀力![]()
(4)
式中:m,茶粉的质量,g;V1、V2分别为膨胀前、后体积,mL。
溶解度![]()
(5)
式中:m1,茶粉的质量,g;m2,烧杯的质量,g;m3,干燥后溶解物质和烧杯的质量,g。
持油力![]()
(6)
式中:m1,茶粉的质量,g;m2,离心管的质量,g;m3,弃上层玉米油后湿沉淀和离心管的质量,g。
1.3.6 体外口腔-胃肠模拟消化
1.3.6.1 体外模拟口腔-胃消化
参考MINEKUS等[15]的方法,研究体外模拟口腔-胃消化过程中超微富硒绿茶硒代氨基酸的释放变化。称取2 g超微富硒绿茶粉,加入2 mL模拟唾液(含12.5 mg/mL α-淀粉酶),在37 ℃恒温水浴摇床(120 r/min)消化5 min后,用0.5 mol/L HCl溶液调pH至1.5,加入4 mL模拟胃液(含10 mg/mL胃蛋白酶),充入N2后在37 ℃恒温水浴摇床继续消化,分别在胃消化0、30、60、90、120 min取样,沸水浴灭活5 min,4 000 r/min离心10 min,取上清液,-20 ℃保存待测。
1.3.6.2 体外模拟口腔-胃肠消化
称取5 g超微富硒绿茶粉,按照1.3.6.1节中经体外模拟口腔-胃消化120 min后,用饱和NaHCO3溶液调pH至6.8,加入8 mL模拟肠液(含25 mg/mL胰酶和9 mg/mL猪胆盐),充入N2后在37 ℃恒温水浴摇床继续消化,分别在肠消化150、180、210、240 min取样,沸水浴灭活5 min,4 000 r/min离心10 min,分别取上清液和茶渣,-20 ℃保存待测。
1.3.6.3 硒代氨基酸测定
采用柱前衍生-反相高效液相色谱法进行测定[14],外标法定量。SeMeCys、SeMet、SeCys2检测线性范围(以Se计)为1~40 μg/L。硒代氨基酸的释放率计算如公式(7)所示:
释放率![]()
(7)
式中:m0,超微富硒绿茶硒代氨基酸质量,g;mt,体外消化t min后上清液中硒代氨基酸质量,g。
1.3.7 体外发酵
实验使用的粪便样本由3名健康志愿者(2女1男,年龄23~25岁,BMI 18~24 kg/m2)提供,粪便采集前要求志愿者至少3个月内未服用过抗生素药物,无消化道系统疾病。3名志愿者皆自愿参与研究,在实验前签署书面知情同意书,所有的实验内容均遵守相关法律法规及准则(伦理审核批准号HF20240408)。清晨统一收集各志愿者空腹新鲜粪便样本后,混合,立即与4 ℃灭菌磷酸盐缓冲液(0.1 mol/L)配制为100 g/L溶液,均质后用8层灭菌纱布过滤,收集滤液立即用于体外粪便发酵实验。
采用体外口腔-胃肠消化后的茶渣用于体外粪便发酵实验。基础培养基参考WU等[16]的方法配制。准确称取1.3.6.2节中获得的富硒超微绿茶渣100 mg(P1),灭菌50 mL离心管,加入1 mL 100 g/L的粪浆滤液和9 mL的基础培养基,混匀后充N2,密封置于37 ℃厌氧发酵。在发酵0、6、12、18、24 h取样,4 000 r/min离心10 min,收集上清液用于测定硒代氨基酸、pH值和总短链脂肪酸(total short-chain fatty acids,SCFAs);沉淀(含肠道菌群)则立即放入-80 ℃冰箱保存,用于肠道菌群酶活力测定和16S rDNA测序。未加入茶渣进行后续操作为对照组(C)。
1.3.8 SCFAs和抗氧化化活性的测定
采用GC对发酵上清液SCFAs进行测定[17],采用内标法(2-乙基丁酸)定量。SOD及GSH-Px活力的测定按照试剂盒说明书进行操作。
1.3.9 微生物多样性分析
使用E.Z.N.A.TMMag-Bind soil DNA试剂盒对1.3.7节中发酵24 h获得的肠道菌群沉淀进行DNA抽提,以338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGT-WTCTAAT-3′)为引物扩增16S rRNA基因V3~V4的高变异区域,由上海美吉生物医药科技有限公司分析,在其生物信息平台上进行IlluminaMiSeq PE300数据测序分析,定量分析肠道菌群的结构和相对丰度。使用QIIME(version1.9.1)软件将有效序列按照97%的相似性进行OTUs聚类。利用Mothur(version1.30.2)对样品的α多样性指数(Sobs、Shannon、Simpson、Ace和Chao指数)进行计算。β多样性基于Bray-Curtis距离进行主坐标分析,并用PERMANOVA对群落结构进行显著性检验。通过线性判别分析效应大小(LEfSe,LDA≥3.5),在2组的肠道菌群中筛选出17个差异菌种。
1.4 数据统计与分析
测定结果以“平均值±标准差”表示(n=3)。不同粒度茶粉理化指标及超微富硒绿茶硒代氨基酸在体外模拟胃肠道的变化使用SPSS 26.0版软件进行单因素方差分析(ANOVA),进一步Posthoc分析采用Duncan法进行多重比较。微生物多样性分析采用配对样本t检验方法对α多样性指数、SCFAs、抗氧化活性指标及门水平相对丰度进行显著性差异统计。采用Wilcoxon秩和检验生成群落热图。利用环境因子关联分析评估(Spearman相关性分析)17个关键菌种变化与SCFAs及抗氧化酶活的相关性。P<0.05认为差异有统计学意义。
2 结果与分析
2.1 粉碎方式对富硒绿茶粒径、基本组分和功效成分的影响
表1为粉碎方式对富硒绿茶的粒径、基本组分和功效成分的影响。D10、D50、D90分别表示茶粉粒径累计分布为10%、50%、90%时对应的粒径。D50(粒径中值)常用来表示茶粉平均粒径。超微富硒绿茶粉(P1)D50为17.34 μm,已达到超微粉碎效果(<100 μm)。与普通粉碎(P2、P3、P4)相比,超微粉碎富硒绿茶粉水分、游离氨基酸、可溶性总糖、叶绿素、总浸出物含量分别显著提高了0%~15%、2%~6%、12%~32%、48%~113%、1%~5%;但多酚含量减少了4%~9%。这是因为干法超微粉碎使茶粉粒径显著减小,促进其吸水和营养物质及活性物质溶出[18-19],但由于粉碎时间过长,茶多酚被氧化导致含量略下降[20]。超微粉碎对可溶性蛋白、总硒、无机硒及有机硒的含量无显著影响(P>0.05)。不同粒度超微富硒绿茶总硒含量为1.17~1.19 mg/kg,且有机硒占总硒约84%~86%,符合我国富硒茶标准(0.2~4 mg/kg)(GH/T 1090—2014 《富硒茶》)。
表1 粉碎方式对富硒绿茶的粒径、基本组分及功效成分的影响
Table 1 Effect of grinding on the particle sizes, proximate, and biological compositions of selenium-enriched green tea

指标P1P2P3P4D10/μm4.03±0.04d9.42±0.14c78.72±0.36b161.46±0.42aD50/μm17.34±0.28d46.90±0.36c160.01±0.48b259.34±1.65aD90/μm51.27±1.38d101.67±1.15c271.05±1.31b379.05±2.88a水分/(g/g)5.21±0.37a4.65±0.04b4.52±0.01b5.24±0.31a可溶性蛋白/%5.11±0.24a5.04±0.10a5.03±0.17a4.91±0.11a游离氨基酸/%2.53±0.01a2.49±0.07ab2.42±0.08bc2.39±0.02c可溶性总糖/%13.53±0.25a12.09±0.06b11.26±0.60b10.22±0.19c总叶绿素/(mg/g)3.09±0.13a2.09±0.03b1.88±0.04c1.45±0.01d总浸出物/%51.53±0.74a50.80±0.22ab49.92±0.19bc49.31±0.18c多酚/%21.65±0.20b22.44±0.85ab23.84±0.60a23.39±0.96a总硒/(μg/g)1.18±0.01a1.17±0.02a1.19±0.01a1.18±0.01a无机硒/(μg/g)0.19±0.01a0.18±0.02a0.16±0.02a0.16±0.03a有机硒/(μg/g)0.99±0.02a0.99±0.01a1.02±0.01a1.02±0.01a
注:表中同一行数据上标不同字母表示有显著差异(P<0.05)(下同)。
2.2 粉碎方式对富硒绿茶粉体性质、水和特性及持油力的影响
休止角代表粉体的流动性,休止角越小,说明颗粒间摩擦力越小,流动性越好。由表2可知,超微粉碎使茶粉休止角增大了3%~33%,说明超微粉碎使茶粉流动性变差。这是由于超微粉碎使茶粉内部的黏结基团暴露,颗粒间黏附力和静电相互作用力增大,易团聚在一起导致摩擦力变大[19]。由于超微粉末团聚的影响,堆积密度随粒径减小而显著降低[19]。随着粒径减小,茶粉亮度(L*)及黄度(b*)显著升高,这是因为粒径越小,表面积越大,光反射率增加导致亮度增加;同时,由于超微粉碎时间较长,促使茶多酚氧化加剧,导致茶粉偏黄[21],这与多酚测定的结果一致(表1)。此外,超微粉碎能显著降低茶粉的持水力,提升其膨胀力和溶解度。一方面超微粉碎强度大,破坏了茶粉的细胞结构,导致其对水分的束缚力减小;另一方面超微粉碎使茶粉比表面积增大,与水的接触面积增大,水分在颗粒中运输距离短,且总浸出物增加(表1),使得超微富硒绿茶粉溶胀速度加快,溶解度上升[22]。综上,超微粉碎在不影响富硒绿茶硒含量的基础上,可有效破坏茶粉的细胞壁,促进其活性物质及总浸出物的溶出。因此,本研究选用超微富硒绿茶研究其在体外胃肠道消化及发酵过程中的变化。
表2 粉碎方式对富硒绿茶的粉体性质、水和特性及持油力的影响
Table 2 Effect of grinding on the powder properties, hydration characteristics, and oil holding capacity of selenium-enriched green tea
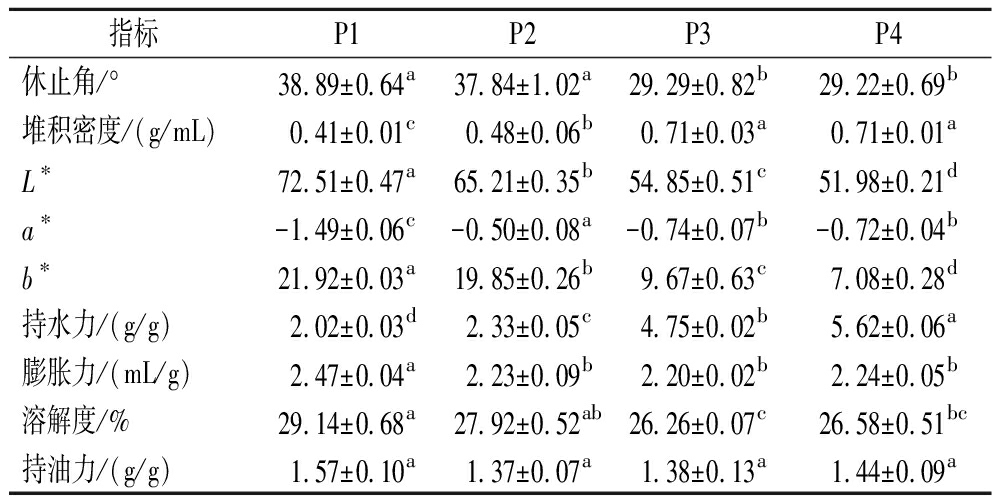
指标P1P2P3P4休止角/°38.89±0.64a37.84±1.02a29.29±0.82b29.22±0.69b堆积密度/(g/mL)0.41±0.01c0.48±0.06b0.71±0.03a0.71±0.01aL∗72.51±0.47a65.21±0.35b54.85±0.51c51.98±0.21da∗-1.49±0.06c-0.50±0.08a-0.74±0.07b-0.72±0.04bb∗21.92±0.03a19.85±0.26b9.67±0.63c7.08±0.28d持水力/(g/g)2.02±0.03d2.33±0.05c4.75±0.02b5.62±0.06a膨胀力/(mL/g)2.47±0.04a2.23±0.09b2.20±0.02b2.24±0.05b溶解度/%29.14±0.68a27.92±0.52ab26.26±0.07c26.58±0.51bc持油力/(g/g)1.57±0.10a1.37±0.07a1.38±0.13a1.44±0.09a
2.3 超微富硒绿茶在体外胃肠消化过程中硒代氨基酸的释放规律
超微富硒绿茶约80%以上为有机硒(表1),其中绝大多数以硒代氨基酸SeMet、MeSeCys和SeCys2形式存在[2,23]。由图1可知,超微富硒绿茶SeMet含量最高。由图1-b可知,随消化时间延长(0~240 min),茶粉SeMet和MeSeCys释放率持续上升;但在快进入肠消化阶段(90~240 min)时,SeCys2释放率骤然下降。这是因为SeCys2在消化过程中不稳定,被还原为SeCys[24]。模拟体外胃肠消化后,富硒超微绿茶中仍有约60%的硒代氨基酸,推测其在结肠能被肠道菌群进一步利用。
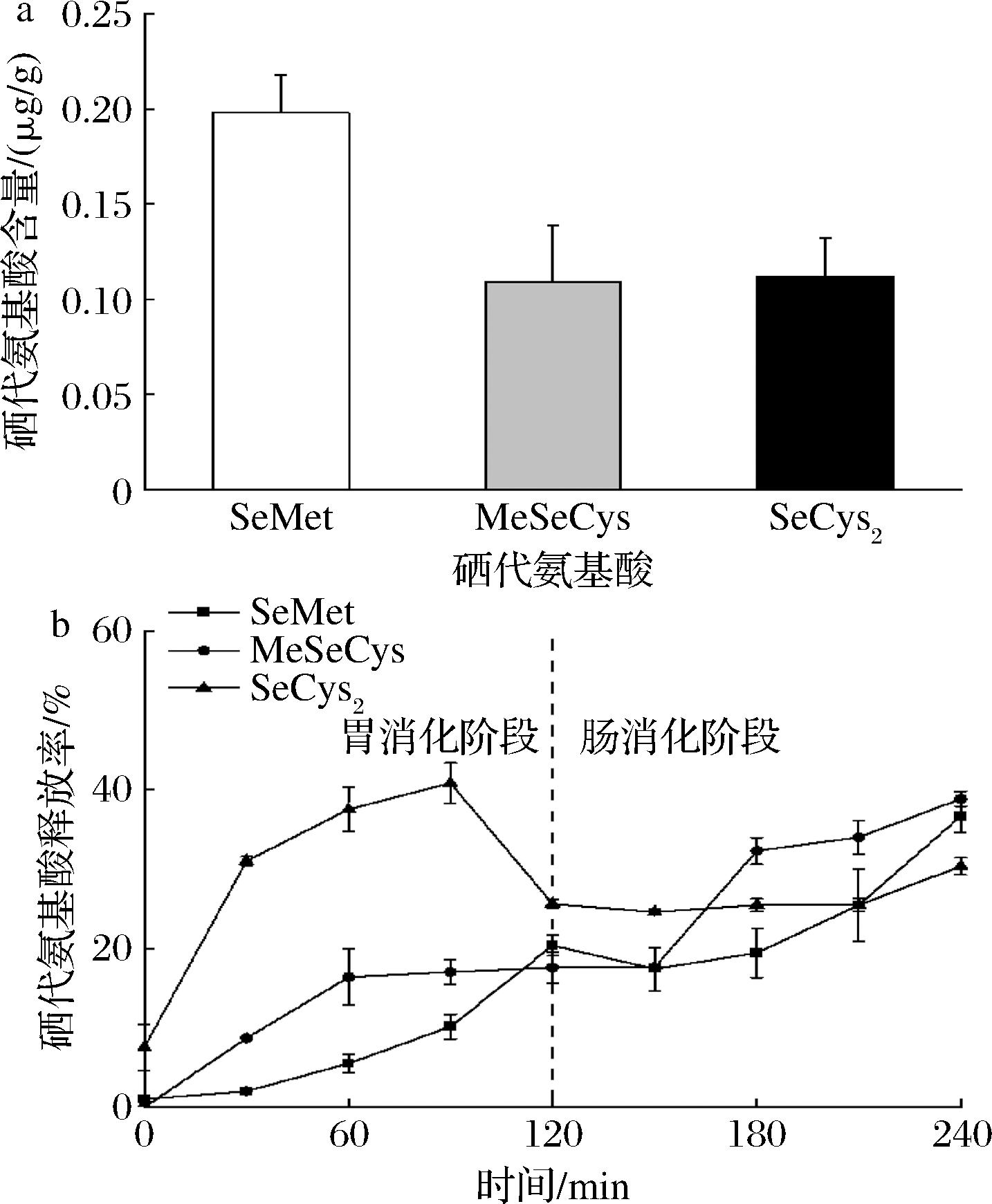
a-硒代氨基酸含量;b-硒代氨基酸释放规律
图1 超微富硒绿茶中硒代氨基酸在体外胃肠消化过程的释放规律
Fig.1 The release profiles of selenoamino acids in superfine grinding selenium-enriched green tea in vitro gastrointestinal digestion
2.4 体外发酵过程中超微富硒绿茶对抗氧化活性的影响
由图2-a~图2-c可知,与对照组(C)相比,超微富硒绿茶渣(P1)能显著提升上清液DPPH和ABTS阳离子自由基清除能力及铁离子还原能力,这是因为茶粉经体外胃肠消化后残留的多酚及硒提高了发酵液的抗氧化活性。发酵初期(0 h,图2-d和图2-e),C组和P1组肠道菌群SOD和GSH-Px活力无显著性差异;随着发酵时间延长(6~24 h),P1组SOD和GSH-Px活力显著提升,说明超微富硒茶对肠道菌群有益生特性。硒是GSH-Px的必需组分。研究表明,肠道菌群能吸收并利用硒合成GSH-Px,它通过消除脂质过氧化物和清除活性氧自由基,起到抗炎、抗癌、改善免疫力、心血管疾病及神经退行性疾病的作用[24]。
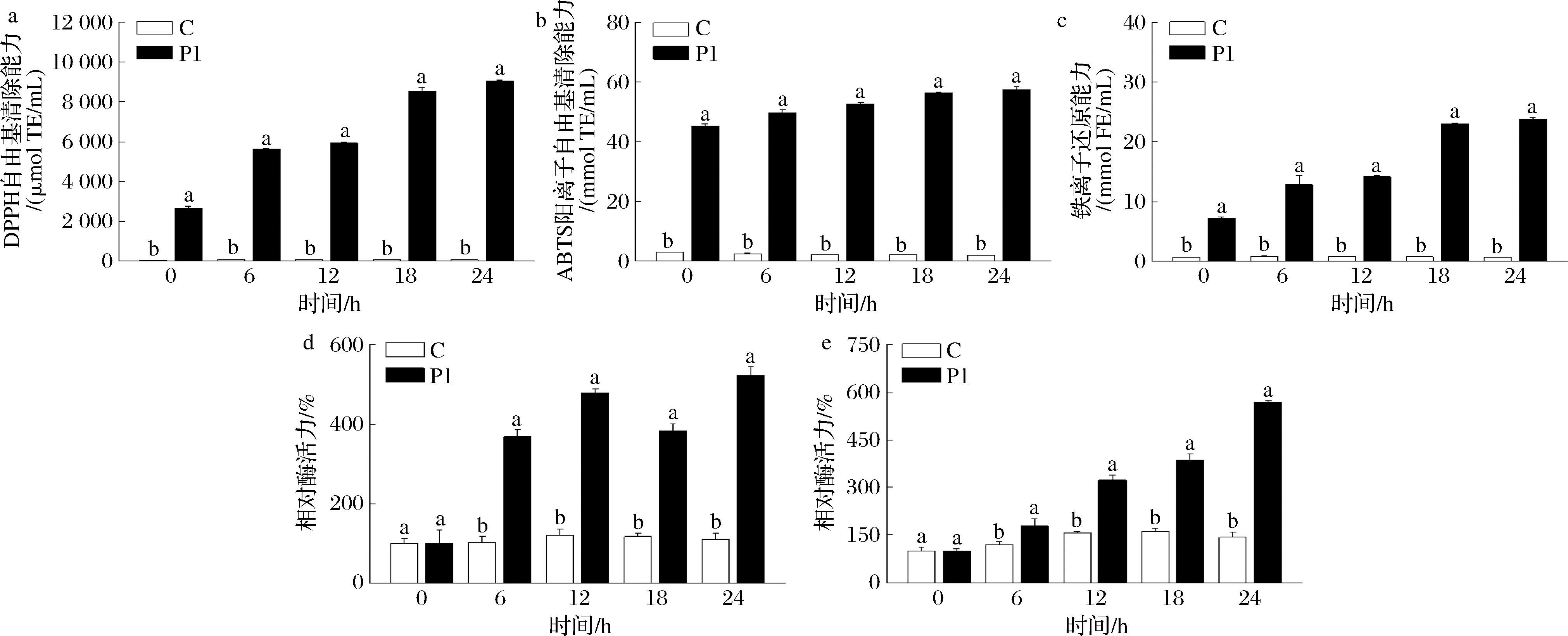
a-DPPH自由基清除能力;b-ABTS阳离子自由基清除能力;c-铁离子还原能力;d-SOD活力;e-GSH-Px活力
图2 超微富硒绿茶在体外发酵过程中上清液的抗氧化活性及肠道菌群SOD和GSH-Px活力的变化
Fig.2 Effect of superfine grinding selenium-enriched green tea residue on the enzyme activity of SOD and GSH-Px of fecal microbial pellets at different fermentation times
2.5 体外发酵过程中超微富硒绿茶对pH和SCFAs的影响
由图3-a可知,P1组上清液pH一直显著低于C组,表明超微富硒绿茶可促进肠道菌群体外发酵。结肠pH是肠道菌群生态系统的一个重要指标,pH降低有利于抑制病原菌的生长。由图3-b~图3-f可知,发酵初期(0 h),C组和P1组上清液总SCFAs、乙酸、丙酸、丁酸和戊酸含量相近;发酵24 h后,与C组相比,P1组上清液总SCFAs、乙酸、丙酸、丁酸质量浓度分别增加了105%、81%、145%、565%。SCFAs是肠上皮细胞主要能量来源,在免疫调节和能量稳态维持方面发挥重要作用[25]。但发酵12~24 h,添加超微富硒绿茶却显著抑制戊酸生成(图3-f)。这可能是因为茶粉残留的SeCys2在12 h后被肠道菌群还原为红色纳米硒,而肠道菌群还原SeCys2时会竞争产甲烷菌合成甲烷所需的氢,进而抑制中间产物戊酸生成[24,26]。
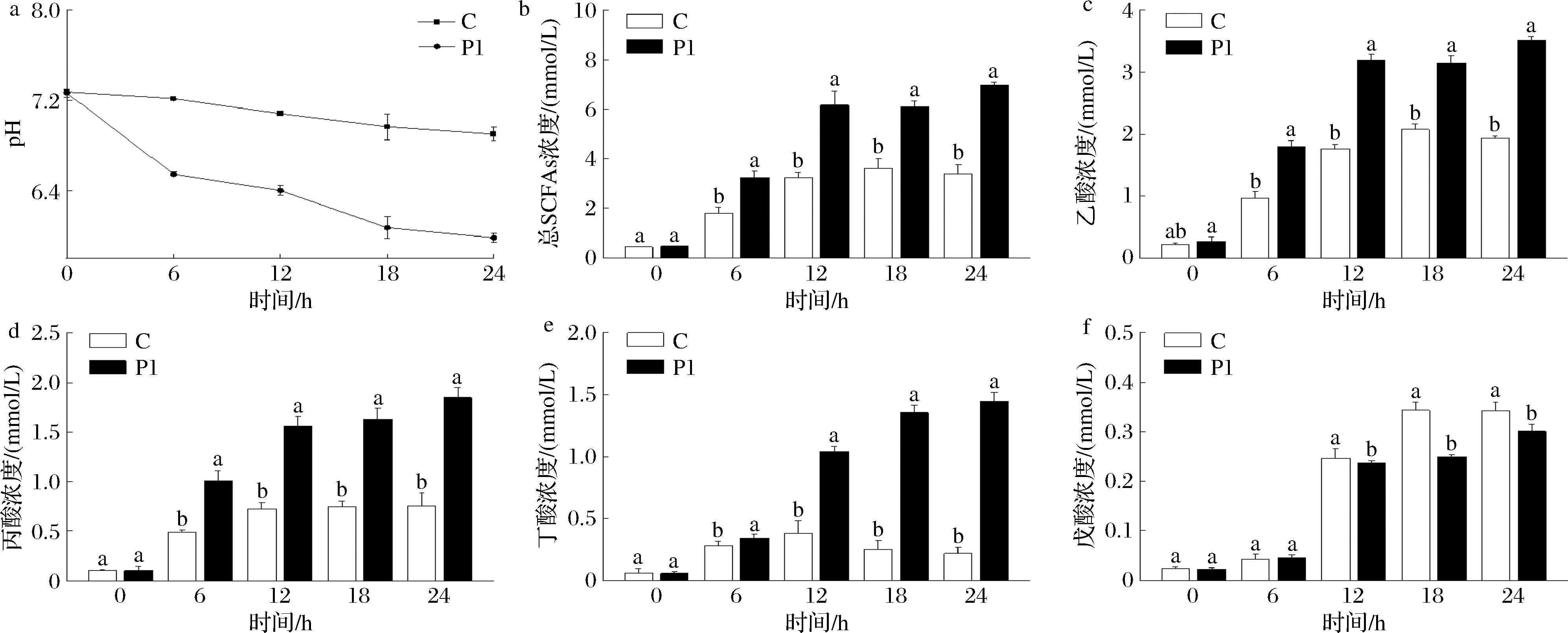
a-pH;b-总SCFAs;c-乙酸;d-丙酸;e-丁酸;f-戊酸
图3 超微富硒绿茶在体外发酵过程中上清液pH及SCFAs的变化
Fig.3 Effect of superfine grinding selenium-enriched green tea on pH and SCFAs changes in fecal supernatant at different fermentation times
2.6 超微富硒绿茶对肠道菌群的影响
2.6.1 肠道菌群多样性分析
肠道菌群高通量测序分析得到245 545条优化序列,经97%相似度归并后得到186个OTUs。本研究的α稀释曲线趋于平缓,证明样本的测序数量和测序深度比较好,基本覆盖了样品中所有的物种,确保了测序准确性。α多样性指数越大,代表样本中微生物多样性和丰度越高。与C组相比,超微富硒绿茶使肠道菌群Sobs指数降低(图4-a),但Ace和Chao指数增大(图4-d和图4-e),表明其多样性高于对照组,丰度增加。β多样性主坐标分析结果显示,C组和P1组的群落结构存在显著性差异(图4-f)。
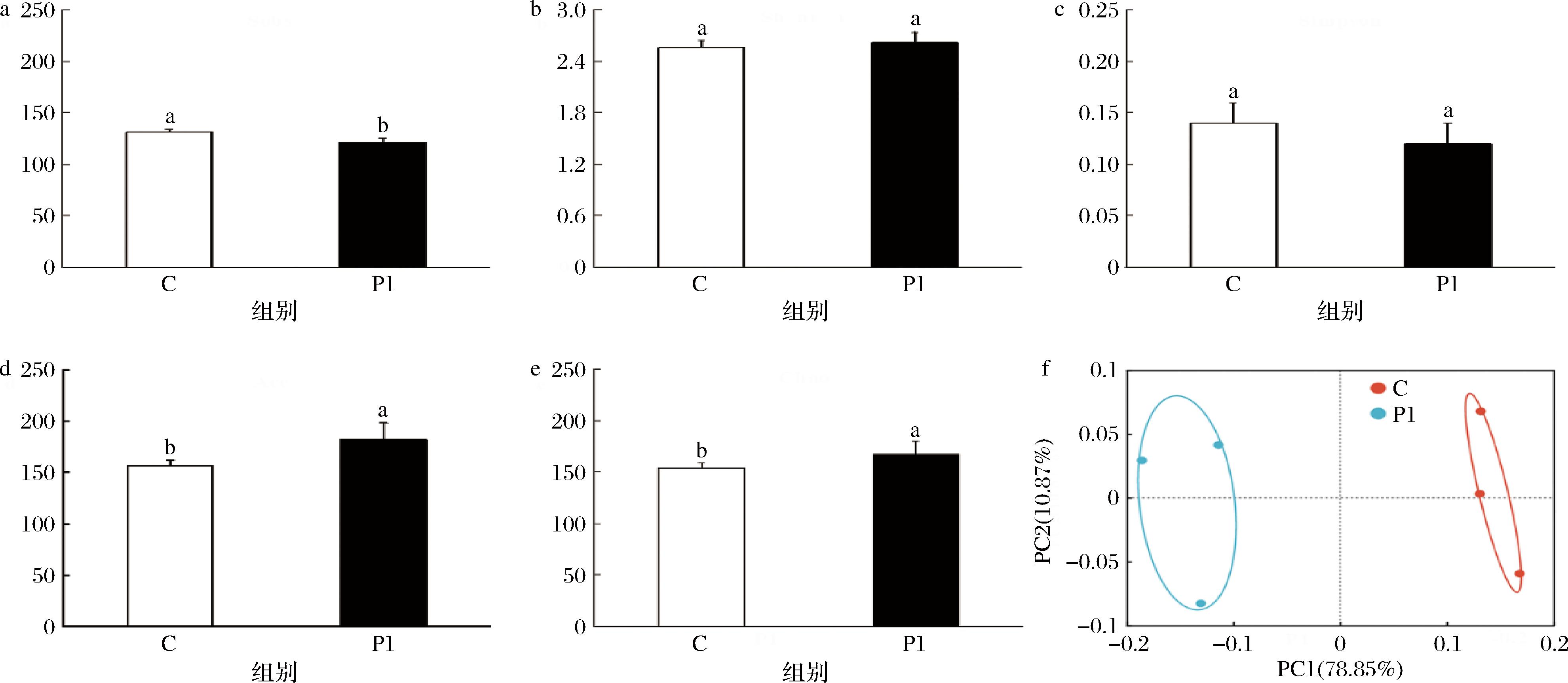
a-Sobs;b-Shannon;c-Simpson;d-Ace;e-Chao;f-主坐标分析
图4 体外发酵24 h肠道菌群α-多样性和β-多样性分析
Fig.4 Changes of alpha diversity and beta diversity of the gut microbiota after 24 h of in vitro fermentation at OUTs levels

a-群落组成及丰度分布(门);b-Fusobacteriota;c-Desulfobacterota;d-Bacteroidota;e-Bacteroidota
图5 体外发酵24 h肠道菌群的变化
Fig.5 Changes at the level of phylum for 24 h of in vitro fermentation
2.6.2 肠道菌群物种组成分析
由图5-a可知,肠道菌群在门水平上主要为拟杆菌门(Bacteroidota,34%~41%)、变形菌门(Proteobacteria,27%~30%)、梭杆菌门(Fusobacteriota,18%~26%)和厚壁菌门(Firmicutes,9%~12%)。与C组相比,添加超微富硒绿茶使梭杆菌门和脱硫菌门(Desulfobacterota)相对丰度分别下降32%(图5-b,P<0.05)和85%(图5-c,P<0.05);而拟杆菌门相对丰度增加22%(图5-d,P<0.05)。拟杆菌门能编码碳水化合物降解酶,可充分降解碳水化合物产生SCFAs,这与P1组发酵24 h后总SCFAs含量增加结果一致(图3-b)[27]。超微富硒绿茶富含茶多酚,可显著降低厚壁菌门/拟杆菌门比值(Firmicutes/Bacteroidota)(图5-e)[28]。研究表明,厚壁菌门/拟杆菌门比值降低,有助于缓解肥胖、糖尿病等疾病[29]。
2.6.3 肠道优势菌种组成及其与生化指标的相关性分析
由图6可知,与C组相比,P1组中隶属于肠球菌属(Enterococcus)的unclassified_g__Enterococcus,隶属于变形杆菌属(Proteus)的普通变形杆菌(Proteus_vulgaris_g_Proteus),隶属于拟杆菌属(Bacteroides)的纤维素类杆菌(Bacteroides_cellulosilyticus)、卵形拟杆菌(Bacteroides_ovatus)、单形拟杆菌(Bacteroides_uniformis)、多形拟杆菌(Bacteroides_thetaiotaomicron),隶属于考拉杆菌属(Phascolarctobacterium)的粪糠酸杆菌(Phascolarctobacterium_faecium),隶属于肠杆菌属(Enterobacter)的unclassified_g__Enterobacter相对丰度显著增加(P<0.05);而隶属于嗜胆菌属(Bilophila)的uncultured_bacterium_g_Bilophila,隶属于拟杆菌属的脆弱拟杆菌(Bacteroides_fragilis),隶属于消化链球菌属(Peptostreptocpccus)的uncultured_bacterium_g__Peptostreptococcus,隶属于副拟杆菌属(Parabacteroides)的粪副拟杆菌(Parabacteroides_merdae)、狄氏副拟杆菌(Parabacteroides_distasonis_ATCC_8503),隶属于梭杆菌属(Fusobacterium)的unclassified_g__Fusobacterium相对丰度显著降低(P<0.05)。嗜胆菌属和梭杆菌属相对丰度的增加对肥胖和肠道炎症的负面影响已得到证实[30-31]。

图6 体外发酵24 h后肠道优势菌种相对丰度热图
Fig.6 Heatmap of the relative abundance of key genera for 24 h of in vitro fermentation
注: 相比于C组,P1组中丰度显著增加;
相比于C组,P1组中丰度显著增加; 相比于C组,P1组中丰度显著降低。
相比于C组,P1组中丰度显著降低。
进一步探究肠道菌群在种水平上与SCFAs、SOD和GSH-Px活力的相关性。如图7所示,狄氏副拟杆菌与戊酸呈极显著正相关(P<0.01);而单形拟杆菌、粪糠酸杆菌与戊酸呈极显著负相关(P<0.01)。纤维素类杆菌、普通变形杆菌与乙酸、总SCFAs呈极显著正相关(P<0.01);而unclassified_g__Fusobacterium与乙酸、总SCFAs呈极显著负相关(P<0.01)。粪糠酸杆菌与SOD活力呈极显著正相关(P<0.01);而uncultured_bacterium_g_Peptostreptococcus与SOD活力呈极显著负相关(P<0.01)。unclassified_g__Enterobacter与丁酸、GSH-Px活力呈极显著正相关(P<0.01)。我们推测,超微富硒绿茶中的有机硒可能通过促进粪糠酸杆菌及unclassified_g__Enterobacter生长,上调和粪糠酸杆菌硒蛋白相关的基因表达提高SOD活力[32];而unclassified_g__Enterobacter产生的胞外多糖酶可提升GSH-Px活力[33]。结果表明,添加超微富硒绿茶可改变肠道菌群结构组成,提高SCFAs的含量;同时茶粉中多酚、硒等活性成分可被微生物利用,提高菌群抗氧化和酶活力。

图7 SCFAs、SOD及GSH-Px活力与肠道菌群相关性分析
Fig.7 Spearman’s correlation analysis between key genera and parameters related to SCFAs, SOD, and GSH-Px enzyme activity after 24 h of in vitro fermentation
注:*,P<0.05;**,P<0.01,***,P<0.001。
3 结论
与普通粉碎相比,超微粉碎可显著改善富硒绿茶的理化指标、营养特性及物化特性,但不影响硒含量及其形态,提示其潜在的食品加工适应性。进一步研究表明,在体外模拟胃肠道消化过程中,超微富硒茶硒代氨基酸的释放规律不同。体外发酵结果表明,添加超微富硒绿茶能显著提升肠道菌群SOD和GSH-Px活力,增加SCFAs含量。微生物多样性分析表明,超微富硒绿茶通过改善肠道菌群结构和组成影响抗氧化酶活及SCFAs生成。本研究为传统“饮茶”到“吃茶”的富硒茶产品研发提供了一定的理论基础。
[1] RAYMAN M P.Selenium and human health[J].The Lancet, 2012, 379(9822):1256-1268.
[2] ZHAO M, LUO T, ZHAO Z X, et al.Food chemistry of selenium and controversial roles of selenium in affecting blood cholesterol concentrations[J].Journal of Agricultural and Food Chemistry, 2021, 69(17):4935-4945.
[3] XIE M H, SUN X Y, LI P, et al.Selenium in cereals:Insight into species of the element from total amount[J].Comprehensive Reviews in Food Science and Food Safety, 2021, 20(3):2914-2940.
[4] CHEN J R, FENG T, WANG B, et al.Enhancing organic selenium content and antioxidant activities of soy sauce using nano-selenium during soybean soaking[J].Frontiers in Nutrition, 2022, 9:970206.
[5] 张浩, 刘本国, 王猷胜, 等.中国富硒茶的研究进展与展望[J].茶叶通讯, 2023, 50(1):13-23.
ZHANG H, LIU B G, WANG Y S, et al.Research progress and existing problems of selenium enriched tea[J].Journal of Tea Communication, 2023, 50(1):13-23.
[6] 梁蕾, 顾浩峰, 康永宁, 等.安康富硒茶中硒多糖的提取及抗氧化性研究[J].食品与发酵科技, 2023, 59(2):59-64.
LIANG L, GU H F, KANG Y N, et al.Extraction and antioxidant ability of Se-polysaccharides from Se-enriched tea[J].Food and Fermentation Science &Technology, 2023, 59(2):59-64.
[7] 尚露彤. 三种富硒茶与普通茶降血糖活性比较及机制初探[D].上海:上海师范大学, 2022.
SHANG L T.Comparison of hypoglycemic activity of three kinds of selenium-enriched tea and common tea and preliminary investigation of the mechanism[D].Shanghai:Shanghai Normal University, 2022.
[8] 张惠, 王会芳, 刘艳艳, 等.不同粒径抹茶粉体物化特性研究[J].茶叶科学, 2019, 39(4):464-473.
ZHANG H, WANG H F, LIU Y Y, et al.Study on physicochemical characteristics of matcha powder with different particle sizes[J].Journal of Tea Science, 2019, 39(4):464-473.
[9] 褚飞洋, 陈鹤立, 孙典, 等.超微粉碎对工夫红茶物化特性的影响[J].茶叶科学, 2017, 37(6):616-622.
CHU F Y, CHEN H L, SUN D, et al.Effects of superfine grinding on the physicochemical properties of congou black tea[J].Journal of Tea Science, 2017, 37(6):616-622.
[10] 叶江成, 赵进, 张一帆, 等.乌牛早红茶对高脂饮食小鼠降脂功能和肠道菌群的调控作用[J].中国食品学报, 2024, 24(2):83-98.
YE J C, ZHAO J, ZHANG Y F, et al.Modulation of lipid-lowering function and gut microbiota in mice on high-fat diet by Wuniu Zao black tea[J].Journal of Chinese Institute of Food Science and Technology, 2024, 24(2):83-98.
[11] 付佳宁, 李少博, 陈丽, 等.不同原料羊汤胶体纳米颗粒冻藏稳定性差异研究[J].食品与发酵工业, 2024, 50(17):268-274.
FU J N, LI S B, CHEN L, et al.Comparison of frozen stability of colloidal nanoparticles from different raw materials for sheep soup[J].Food and Fermentation Industries, 2024, 50(17):268-274.
[12] 韩宝银, 张倩, 叶迪, 等.铁皮石斛不同栽培方式不同海拔不同部位多糖含量对比研究[J].智慧农业导刊, 2022, 2(1):34-36.
HAN B Y, ZHANG Q, YE D, et al.A comparative study of polysaccharide content of Dendrobium candidum by different cultivation methods, at different altitude sand of different parts[J].Journal of Smart Agriculture, 2022, 2(1):34-36.
[13] HUANG X, LIANG K H, LIU Q, et al.Superfine grinding affects physicochemical, thermal and structural properties of Moringa oleifera leaf powders[J].Industrial Crops and Products, 2020, 151:112472.
[14] 张嘉妮, 张晓轩, 王大毛, 等.乳酸菌发酵改善脱脂富硒米糠的抗氧化活性[J].食品科学, 2023, 44(24):146-154.
ZHANG J N, ZHANG X X, WANG D M, et al.Improvement of antioxidant activity of defatted selenium-enriched rice bran by lactic acid bacteria fermentation[J].Food Science, 2023, 44(24):146-154.
[15] MINEKUS M, ALMINGER M, ALVITO P, et al.A standardised static in vitro digestion method suitable for food-An international consensus[J].Food &Function, 2014, 5(6):1113-1124.
[16] WU D T, NIE X R, GAN R Y, et al.In vitro digestion and fecal fermentation behaviors of a pectic polysaccharide from okra (Abelmoschus esculentus) and its impacts on human gut microbiota[J].Food Hydrocolloids, 2021, 114:106577.
[17] ZHAO G H, NYMAN M, JÖNSSON J Å.Rapid determination of short-chain fatty acids in colonic contents and faeces of humans and rats by acidified water-extraction and direct-injection gas chromatography[J].Biomedical Chromatography, 2006, 20(8):674-682.
[18] 夏晓霞, 寇福兵, 薛艾莲, 等.超微粉碎对枣粉理化性质、功能特性及结构特征的影响[J].食品与发酵工业, 2022, 48(12):37-45.
XIA X X, KOU F B, XUE A L, et al.Effect of superfine grinding on physicochemical properties, functional and structure characteristics of jujube powder[J].Food and Fermentation Industries, 2022, 48(12):37-45.
[19] 寇福兵, 夏晓霞, 薛艾莲, 等.超微粉碎对板栗粉理化特性及结构特征的影响[J].食品与发酵工业, 2022, 48(13):155-162.
KOU F B, XIA X X, XUE A L, et al.Effect of superfine grinding on physicochemical properties and structural characteristics of Chinese chestnut powder[J].Food and Fermentation Industries, 2022, 48(13):155-162.
[20] 冯晶晶, 郭建峰, 马心茹, 等.超微粉碎对沙棘茶粉颗粒结构及理化特性的影响[J].食品与发酵工业, 2023, 49(7):198-204.
FENG J J, GUO J F, MA X R, et al.Effects of ultrafine grinding on powder structure and physicochemical properties of sea buckthorn tea[J].Food and Fermentation Industries, 2023, 49(7):198-204.
[21] 廖珺, 王烨军, 苏有健, 等.超微绿茶粉对绿茶面包加工过程中色泽的影响[J].食品与发酵工业, 2019, 45(8):173-177.
LIAO J, WANG Y J, SU Y J, et al.Effect of ultra-micro green tea powder on the color of green tea bread during processing[J].Food and Fermentation Industries, 2019, 45(8):173-177.
[22] LI G H, GUO W Y, GAO X L, et al.Effect of superfine grinding on physicochemical and antioxidant properties of soybean residue powder[J].Food Science &Nutrition, 2020, 8(2):1208-1214.
[23] 陈瑶, 薛敏敏, 雷朋娜.茶叶中硒赋存形态的检测研究进展[J].食品安全导刊, 2023(9):167-169.
CHEN Y, XUE M M, LEI P N.Research progress on detection of selenium occurrence forms in tea[J].China Food Safety Magazine, 2023(9):167-169.
[24] LIANG S J, YU J L, ZHAO M, et al.In vitro digestion and fecal fermentation of selenocompounds:Impact on gut microbiota, antioxidant activity, and short-chain fatty acids[J].Food Research International, 2024, 180:114089.
[25] YAO Y, CAI X Y, FEI W D, et al.The role of short-chain fatty acids in immunity, inflammation and metabolism[J].Critical Reviews in Food Science and Nutrition, 2022, 62(1):1-12.
[26] KIM J, VAN SOEST P J, COMBS G F Jr.Studies on the effects of selenium on rumen microbial fermentation in vitro[J].Biological Trace Element Research, 1997, 56(2):203-213.
[27] MA Y Y, ZHU L Q, KE H W, et al.Oyster (Crassostrea gigas) polysaccharide ameliorates obesity in association with modulation of lipid metabolism and gut microbiota in high-fat diet fed mice[J].International Journal of Biological Macromolecules, 2022, 216:916-926.
[28] SEO D B, JEONG H W, KIM Y J, et al.Fermented green tea extract exhibits hypolipidaemic effects through the inhibition of pancreatic lipase and promotion of energy expenditure[J].British Journal of Nutrition, 2017, 117(2):177-186.
[29] DALBY M J, ROSS A W, WALKER A W, et al.Dietary uncoupling of gut microbiota and energy harvesting from obesity and glucose tolerance in mice[J].Cell Reports, 2017, 21(6):1521-1533.
[30] LIU J Y, HE D, XING Y F, et al.Effects of bioactive components of Pu-erh tea on gut microbiomes and health:A review[J].Food Chemistry, 2021, 353:129439.
[31] PARK C H, HAN D S, OH Y H, et al.Role of Fusobacteria in the serrated pathway of colorectal carcinogenesis[J].Scientific Reports, 2016, 6:25271.
[32] LI Z M, DONG Y P, CHEN S R, et al.Organic selenium increased gilts antioxidant capacity, immune function, and changed intestinal microbiota[J].Frontiers in Microbiology, 2021, 12:723190.
[33] JIN M L, WANG Y M, HUANG M, et al.Sulphation can enhance the antioxidant activity of polysaccharides produced by Enterobacter cloacae Z0206[J].Carbohydrate Polymers, 2014, 99:624-629.