糖尿病作为一种以高血糖为特征的代谢性疾病,主要包括1型糖尿病、2型糖尿病、妊娠期糖尿病,以及因基因或药物等导致的特定类型的糖尿病[1]。据报道,全球2型糖尿病的患病率持续上升,预计到2030年,全球糖尿病患病率可能增至7.079%,到2040年增至7.862%[2]。糖尿病如未及时控制,往往会引起严重的并发症,如心血管疾病、肾脏疾病、视网膜病变、截肢等[3],需要及时诊断和干预。目前常用的糖尿病治疗药物如磺酰脲类药物、α-葡萄糖苷酶抑制剂、噻唑烷二酮类药物、甲格利啶类药物和双胍类药物等[4],但都具有增加体重、导致低血糖等副作用,从食品原料或传统药材中提取天然成分已成为相对经济和安全的方法[5]。
黑木耳(Auricularia auricula-judae)属真菌类担子菌纲,是一种富含碳水化合物和蛋白质的可食用真菌[6]。研究表明,黑木耳多糖具有多种有益健康的作用,如调节肠道菌群、抗肿瘤、降血糖、降胆固醇、抗炎等[7],但因其较高的分子质量和优异的成胶能力[8],吸水后易形成凝胶,实际应用过程中存在一定的局限性,因此需要一种降低其分子质量并提高溶解度以实现稳定应用的方法。
微生物发酵作为生物转化法的一种,可以改变食品中的营养成分和比例,广泛应用在各个领域[9]。植物乳植杆菌、乳酸乳杆菌、副干酪乳酪杆菌等乳酸菌已被用于食品发酵,它们已被证明对健康有积极影响,如抗氧化和免疫调节活性[10]。植物乳植杆菌来源于传统植物发酵食品,已被应用于各类果蔬中,能有效改变产品的营养物质组成、增加产品功效。本研究选取黑木耳为原料,利用植物乳植杆菌N1发酵,探讨纯化后的黑木耳发酵多糖的理化结构,并建立胰岛素抵抗HepG2(insulin resistance HepG2, IR-HepG2)细胞与糖尿病斑马鱼模型,进一步探讨对糖尿病斑马鱼的降糖作用机制,为黑木耳发酵多糖作为功能性食品成分或营养保健品在降血糖中的应用奠定了基础。
1 材料与方法
1.1 材料与试剂
黑木耳,浙江方格有限公司提供,产地为浙江庆元;植物乳植杆菌N1(Lactiplantibacillus plantarun N1,CGMCC NO.15463),浙江工业大学功能食品研发中心提供;DEAE-Sepharose Fast Flow、Sephacryl S-300凝胶,美国GE有限公司;甘露糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖、木糖、岩藻糖、阿拉伯糖,分析纯,上海国药集团化学试剂有限公司;乙腈、三氯甲烷、甲醇、三氟乙酸、异丙醇,色谱纯,上海国药集团化学试剂有限公司;MRS液体培养基,青岛海博生物科技有限公司;胎牛血清、青霉素-链霉素溶液、胰酶,武汉普诺赛生命科技有限公司;DMEM(Dulbecco’s modified eagle medium)高糖培养基,上海启达生物科技有限公司;胰岛素,上海葵赛生物科技有限公司;Cell Counting Kit-8(CCK-8)试剂盒,爱迪生有限公司;RT-qPCR引物,生工生物工程(上海)股份有限公司;荧光定量试剂盒、反转录试剂盒,南京诺唯赞生物科技有限公司;刚果红,杭州吉工生物科技有限公司。
1.2 仪器与设备
NANODROP核酸蛋白分析仪,美国赛默飞世尔科技有限公司;AnalytikJena荧光定量PCR仪,德国耶拿分析仪器有限公司;PR-96E梯度PCR仪,杭州米欧仪器有限公司;罗氏卓越金采血糖仪及试纸,罗氏产品上海有限公司;Tiss-Basic组织破碎仪,上海净信实业发展有限公司;LC-2050高效液相色谱仪,日本岛津公司;P2050半制备液相色谱仪,北京澳诺科技有限公司。
1.3 实验方法
1.3.1 黑木耳发酵多糖的提取
将黑木耳粉碎后与去离子水按照料液比1∶100(g∶mL)混合,进行高温搅拌后高温高压灭菌,待液体降为室温后,接种植物乳植杆菌N1(5.5%,体积分数),37 ℃发酵70 h,进行二次灭菌,离心取上清液,得到黑木耳发酵液。向发酵液中加入4倍体积乙醇,醇沉过夜,12 000×g离心15 min,Sevag法脱蛋白后,冻干得到黑木耳发酵多糖(fermented Auricularia auricula-judae polysaccharide,FAAP)。
1.3.2 黑木耳发酵多糖的纯化
1.3.2.1 DEAE Sepharose Fast Flow分离纯化
利用DEAE Sepharose Fast Flow阴离子交换色谱柱分离,色谱柱规格60.4 mm×60 mm,上样量50 mL,上样质量浓度为10 mg/mL,配制0.02 mol/L的Tris-HCl(pH=8.0)为缓冲液,用缓冲液配制0.2、0.4、0.6 mol/L浓度的NaCl溶液进行洗脱,流速2 mL/min,每隔5 min收集1管,采用苯酚-硫酸法检测糖含量,在490 nm下测吸光值,以吸光度为纵坐标,洗脱管数为横坐标作洗脱曲线图。
1.3.2.2 Sephacryl S-300凝胶纯化
采用Sephacryl S-300对DEAE Sepharose Fast Flow阴离子交换色谱柱分离后的多糖进行分离纯化,色谱柱规格20 mm×1 000 mm,上样量5 mL,上样质量浓度为10 g/L,用蒸馏水洗脱,流速1.0 mL/min,每隔10 min收集1管,采用半制备液相洗脱,合并单一峰部分,冻干浓缩,溶于去离子水后进行纯度检测。
1.3.3 结构表征
1.3.3.1 分子质量测定
采用高效凝胶渗透色谱法测定各样品的分子质量分布,配备TSK-GEL保护柱、TSK-GEL5000K凝胶柱和示差检测器。
色谱条件:流动相为超纯水;流速0.6 mL/min;柱温35 ℃;进样量20 μL。采用不同分子质量的右旋糖苷(2 000 000、270 000、200 000、150 000、110 000、3 000、1 000、800、343 Da)作为标准品。
1.3.3.2 电镜分析
将干燥后的样品均匀地粘贴在样品级的导电黏合剂上,并在离子溅射器中涂上金。用扫描电镜观察形态[11]。
1.3.3.3 傅里叶变换红外光谱的测定
取1 mg左右真空冷冻干燥后的样品,与100 mg KBr混合后研磨压片,采用KBr压片法测定红外光谱,扫描波长为4 000~400 cm-1,扫描次数为32次。
1.3.3.4 单糖组成分析
参照PMP柱前衍生法,进行适当修饰[12]。取2 mg样品,加入二三氟乙酸(2 mol/L,4 mL),充入N2迅速密封在110 ℃反应4 h。通过减压浓缩将混合液蒸干,加入5 mL甲醇,再减压浓缩至蒸干,重复操作5次以除尽二三氟乙酸,加蒸馏水定容至2 mL备用。
色谱条件:色谱柱为C18 SHISEIDO;流动相:A为0.05 mol/L磷酸盐缓冲溶液(pH=6.8),B为乙腈,A∶B=82∶18(体积比);检测柱温度30 ℃;样品检测量20 μL;流速1 mL/min;紫外可见吸收检测器的波长245 nm。
1.3.3.5 刚果红试验
参考LI等[13]的方法并稍作修改,测定三螺旋结构。将2 mL多糖溶液(2 mg/mL)与2 mL刚果红溶液(0.2 mmol/L)混合均匀,然后逐滴加入2 mol/L的NaOH溶液,使溶液中最终NaOH浓度分别达到0、0.1、0.2、0.3、0.4、0.5 mol/L。在室温下静置10 min,用酶标仪测定400~600 nm范围内的最大吸收波长(λmax),用水代替空白对照。以NaOH浓度(c)为横坐标,溶液最大吸收波长(λmax)为纵坐标作图。
1.3.4 FAAP-2-1对IR-HepG2细胞模型的影响
1.3.4.1 不同浓度FAAP-2-1对HepG2细胞增殖及毒性的影响
将对数生长期的HepG2细胞接种到96孔板中,待细胞贴壁后移除上清液,用无血清的DMEM高糖培养基饥饿处理12 h。饥饿处理完成后,空白组不进行细胞培养,阴性组加入细胞和完全培养基,其余组加入含有不同浓度FAAP-2-1(100、300、500、1 000 μg/mL)的DMEM完全培养基,每组设置6个复孔。培养24 h后采用CCK8法检测对HepG2细胞增殖及毒性的影响。
1.3.4.2 IR-HepG2模型建立及葡萄糖消耗量影响
参考文献[14]的方法并稍作修改构建IR-HepG2。取对数生长期HepG2细胞,用胰酶消化,接种于96孔板。待细胞贴壁,用无血清的DMEM培养基培养12 h,进行饥饿处理。饥饿处理完成后,加入胰岛素浓度为10-6 mol/L的DMEM培养基100 μL诱导24 h,用葡萄糖氧化酶法测试盒检测各组细胞上清液的葡萄糖含量。
以IR-HepG2细胞为作用细胞,加入含5、50、500 μg/mL的低、中、高浓度的FAAP-2-1储备液的DMEM完全培养基100 μL作为试验组,阳性组为50 μg/mL的阿卡波糖处理,对照组为IR-HepG2细胞用DMEM完全培养基正常培养,正常HepG2细胞组为空白对照组,每组设置6个复孔,分别干预细胞24 h,检测细胞存活率以及上清液中葡萄糖消耗量。
1.3.5 FAAP-2-1对糖尿病斑马鱼的影响
成年斑马鱼的培养温度为28 ℃,光照时间为14 h,黑暗时间为10 h。产卵时,将雌鱼和雄鱼按 1∶1 的比例放入产卵槽中,第2天上午雌雄鱼开始追逐,2 h后采卵。每周产卵一次。受精后24 h清洗胚胎,根据发育阶段选择合适的胚胎。筛选后,将胚胎在E3水中培养。因为胚胎可以从卵黄囊中获取营养,所以在受精后9 d内不需要喂食[15]。
在显微镜下选取发育正常的4 dpf野生型AB系斑马鱼于六孔板中,每孔30尾,用0.5 mmol/L四氧嘧啶与40 g/L葡萄糖混合溶液10 mL联合处理,建立斑马鱼糖尿病模型,同时添加低剂量、中剂量、高剂量浓度(0.3、0.6、0.9 mg/mL)的FAAP-2-1和阿卡波糖处理。所有组在28 ℃的培养箱中培养24 h之后,丢弃旧培养基,将斑马鱼收集到1.5 mL离心管中,每管包含10条鱼。处死方法为:将斑马鱼浸泡在冰水浴中1 min,直到失去眼球运动。所有实验均按照浙江工业大学实验动物福利和伦理委员会的指导方针进行,符合动物实验的伦理原则(230508001F)。将试管中的水干燥后,加入100 μL无水乙醇,静置15 min,然后转移到60 ℃的烘箱中2 h。然后在每管中加入5 μL超纯水。再次将试管置于室温下15 min。最后,取2 μL溶液,用血糖仪测量葡萄糖含量后计算降糖率[16]。
1.3.6 FAAP-2-1对斑马鱼降血糖相关基因mRNA的影响
1.3.6.1 斑马鱼给药与样本收集
将30条4 dpf的斑马鱼用四氧嘧啶与葡萄糖的最佳联用浓度处理,同时给药24 h,将幼鱼收集到离心管中,每个样品30条鱼,及时提取样品。
1.3.6.2 RNA提取
分别将造模与给药完成的30条斑马鱼置于2 mL无菌研磨管中,加入1 mL Trizol裂解液,使用研磨机进行研磨,研磨完成后,将液体转移到1.5 mL的无菌离心管中,向裂解液中加入三氯甲烷,室温放置15 min左右,离心,吸取最上层水相,加入异丙醇,放置离心,用75%(体积分数)乙醇清洗后将离心管置于通风橱内挥发,加入10 μL无酶水溶解后测定浓度。
1.3.6.3 互补DNA(complementary DNA,cDNA)合成
测定完RNA浓度后,立即进行逆转录合成cDNA,所有操作在冰上完成,采用HiScript Ⅱ Q RT SuperMix for qPCR (+gDNA wiper)试剂盒,按照说明书进行操作。
1.3.6.4 PCR扩增
根据参考文献[17]进行引物设计,所用引物见表1,采用 ChamQ Universal SYBY qPCR Master Mix 试剂盒进行反应,反应体系为10 μL,循环40次。
表1 PCR引物序列表
Table 1 PCR primer sequence
基因F引物序列(5′-3′)R引物序列(5′-3′)IRSGTGTGTGACAGCACCGTTTCATGTGGCTGCTGTACTGTCCGLUT2ACTACTCATGGGCCTGGCTAATGCATCATGAGGGCCACAAPI3KCCCATTCCTCTCCCTCTGGACAGGGGTTTAGGGTCACGACAKTGGACCTGAAGCTGGAGAACCTCGCTGTCAAATGCCTCCATβ-ACTINCCGTGACATCAAGGAGAAGATACCGCAAGATTCCATACC
1.3.7 数据处理与分析
所有实验均为3次,数据以平均数±标准差表示,使用SPSS 27.0和Origin 2024进行统计分析和作图。多组数据采用单因素方差分析或双因素方差分析,以Tukey’s检验进行多重比较确定统计学意义,P<0.05表示有统计学意义。
2 结果与分析
2.1 黑木耳多糖纯化结果
如图1所示,经过DEAE Sepharose Fast Flow阴离子交换色谱柱分离纯化,FAAP被缓冲液和0.2、0.4、0.6 mol/L的NaCl梯度洗脱分离出2个组分。将FAAP被缓冲液和0.2 mol/L的NaCl冲洗下来的部分分别命名为FAAP-1和FAAP-2。
图1 DEAE-Sepharose Fast Flow阴离子交换色谱柱纯化图
Fig.1 DEAE-Sepharose Fast Flow column anion exchange chromatography purification chart
采用Sephacryl S-300对FAAP-2进行进一步分离纯化,利用半制备液相收集单一峰部分,合并浓缩冻干后再利用高效凝胶渗透色谱检测,结果如图2所示,色谱图为单一峰,表明得到的为单一纯品,命名为FAAP-2-1。同时,在280 nm下无明显吸收峰,表明不含有蛋白质。
图2 FAAP-2-1分子质量分布图
Fig.2 Molecular weight of FAAP-2-1
2.2 分子质量分析
采用高效凝胶渗透色谱法测定样品的分子质量分布,如图2所示,出峰时间为10.469 min,计算得到分子质量为1.48×106 Da。
2.3 单糖组成
如图3所示,在单糖实验中,FAAP-2-1主要由半乳糖、甘露糖、木糖、岩藻糖、葡萄糖、阿拉伯糖、半乳糖醛酸、葡萄糖醛酸8种单糖组成,其比例为4.27∶55.27∶0.36∶1.90∶16.34∶1.54∶2.51∶17.81,相关研究表明黑木耳多糖主要由甘露糖与葡萄糖组成,与实验结果相一致[18]。
a-单糖标准品;b-FAAP-2-1
图3 FAAP-2-1的单糖组成
Fig.3 Monosaccharide composition of FAAP-2-1
注:1-半乳糖;2-甘露糖;3-木糖;4-岩藻糖;5-葡萄糖;6-阿拉伯糖;7-半乳糖醛酸;8-葡萄糖醛酸。
2.4 微观结构分析
如图4所示,扫描电镜可以观察到FAAP-2-1由丝状结构与片状结构组成,丝状纤维互相连接,聚集成网络结构,末端紧密交错连接,表明具有较强的分子间相互作用力。放大后观察到其表面较为粗糙,可能是因为发酵修饰增加了多糖表面积,影响多糖的水溶性与生物活性。
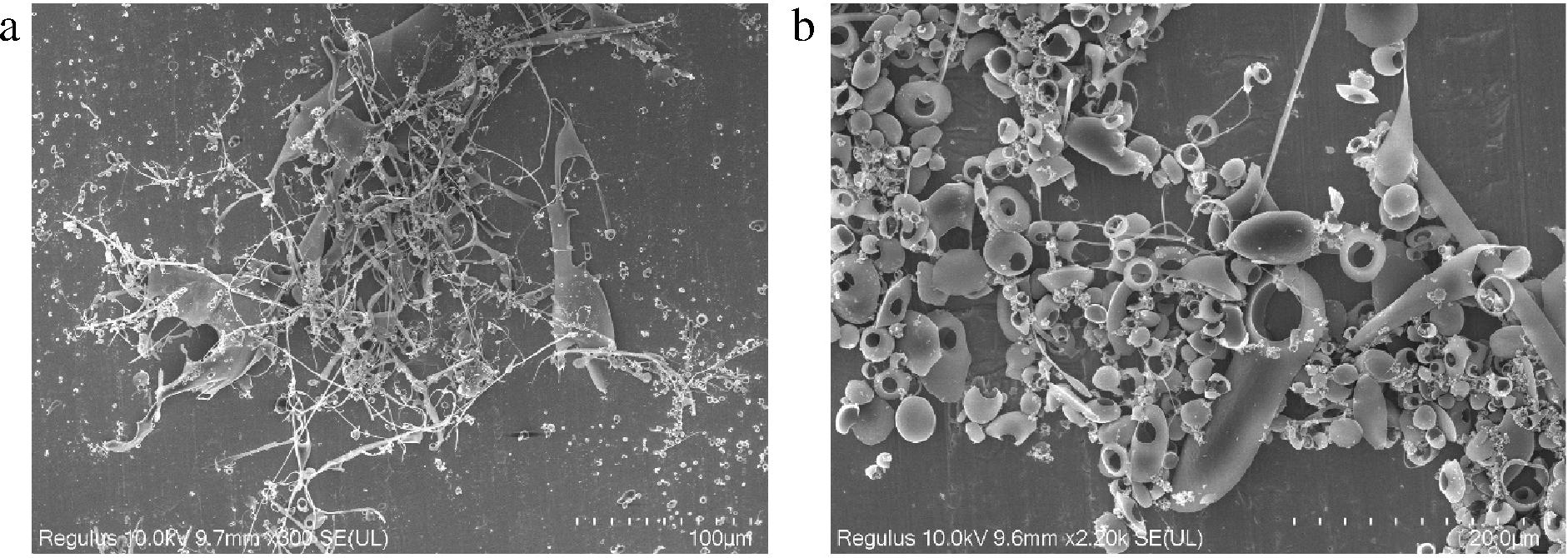
a-放大300倍;b-放大2 200倍
图4 FAAP-2-1的扫描电镜图
Fig.4 Scanning electron microscope of FAAP-2-1
2.5 红外光谱分析
傅里叶变换红外光谱是检测多糖结构的有效工具。如图5-a所示,3 400 cm-1左右的吸收峰是由多糖的O—H键的拉伸振动引起的,而接近2 910 cm-1的吸收峰是由糖环上的C—H键的拉伸振动引起的,这两者都是多糖吸收峰的典型。在1 630~1 730 cm-1处的吸收峰是由COOH的C![]() O的拉伸振动引起的,表明糖醛酸的存在[19],如半乳糖醛酸和葡萄糖醛酸,可能会影响多糖的溶解度和总体生物活性。在1 400~1 250 cm-1范围内的吸收峰被认为是不对称的和对称的C—H拉伸振动,在1 065 cm-1处的吸收峰归因于糖苷键C—O—C中的C—O键的存在,表明多糖含有一个吡喃环。609 cm-1处的弱吸收,可能为羧基的伸缩振动引起的,推测是葡萄糖和阿拉伯糖等糖的典型特征吸收[20]。
O的拉伸振动引起的,表明糖醛酸的存在[19],如半乳糖醛酸和葡萄糖醛酸,可能会影响多糖的溶解度和总体生物活性。在1 400~1 250 cm-1范围内的吸收峰被认为是不对称的和对称的C—H拉伸振动,在1 065 cm-1处的吸收峰归因于糖苷键C—O—C中的C—O键的存在,表明多糖含有一个吡喃环。609 cm-1处的弱吸收,可能为羧基的伸缩振动引起的,推测是葡萄糖和阿拉伯糖等糖的典型特征吸收[20]。
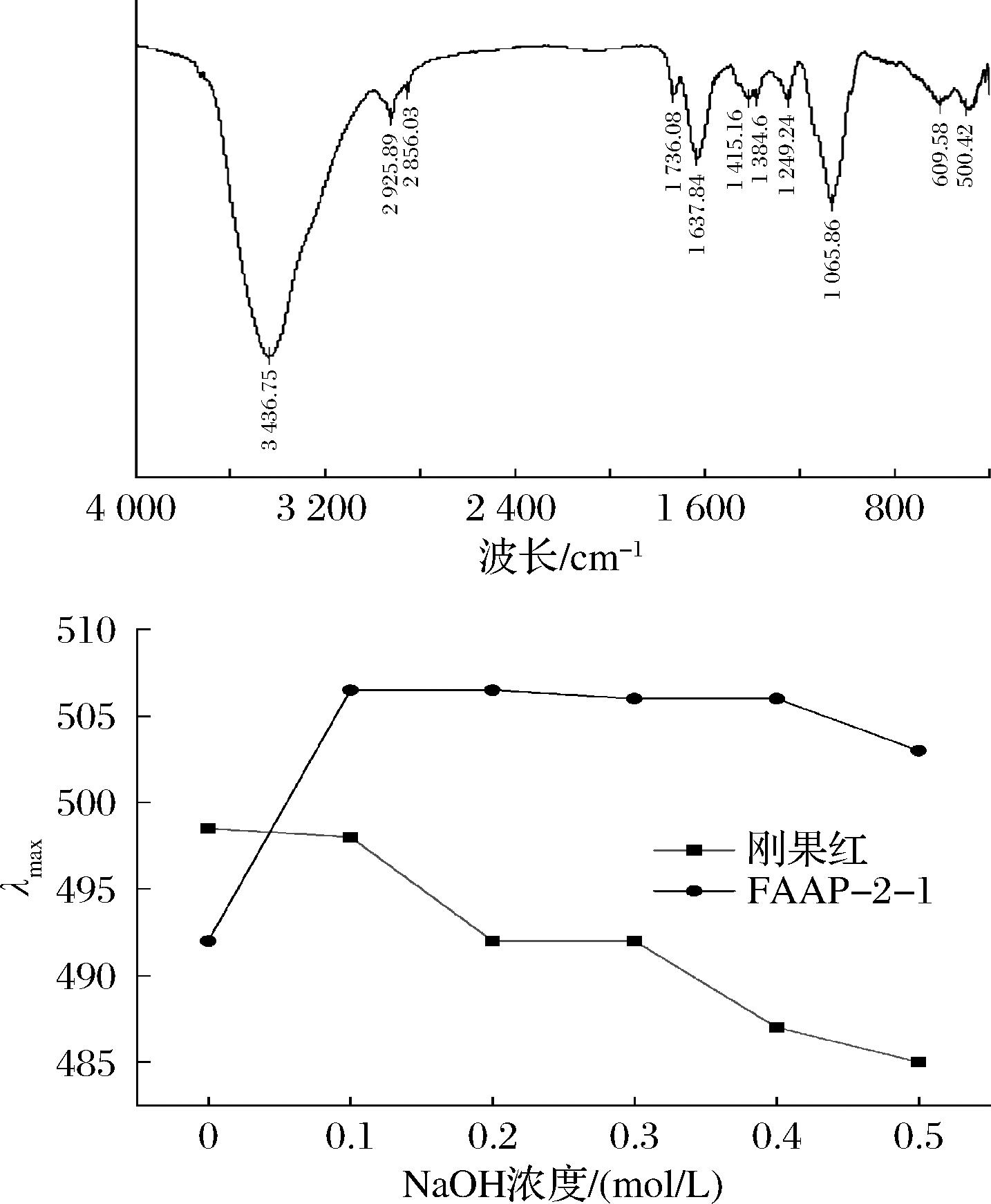
a-红外光谱图;b-刚果红结果图
图5 FAAP-2-1AAP-2-1红外光谱与三螺旋结构分析
Fig.5 FTIR spectra and triple-helix structure of FAAP-2-1
2.6 三螺旋结构分析
刚果红是一种特殊的染料,可与具有三螺旋结构的多糖结合形成络合物,这种络合物会导致相比于原始刚果红表现出明显红移,当三螺旋结构被破坏后,又发生蓝移现象,最大吸收波长下降。相关研究表明,多糖的构象以螺旋形式存在时,将发挥较为关键的功能活性[21]。由图5-b可见,在0~0.1 mol/L浓度范围内刚果红与FAAP-2-1的最大吸收波长有升高趋势,而在0.1~0.5 mol/L的浓度范围内,与刚果红的最大吸收波长开始下降,说明随着NaOH浓度增加,FAAP-2-1发生了解旋,由此分析可知,FAAP-2-1具有三螺旋结构,有利于发挥更好的生物活性功能。
2.7 HepG2细胞实验结果
2.7.1 FAAP-2-1对HepG2细胞存活率的影响
实验采用CCK8法测定不同浓度的FAAP-2-1(0、100、300、500、1 000 μg/mL)对HepG2细胞生存率的影响,以确定合适的给药浓度。如图6所示,对照组和FAAP-2-1处理组细胞存活率无明显差异(P>0.05)。说明在0~1 000 μg/mL范围内,FAAP-2-1对HepG2细胞无细胞毒性作用。因此,在接下来的实验中FAAP-2-1的使用浓度在0~1 000 μg/mL之间。
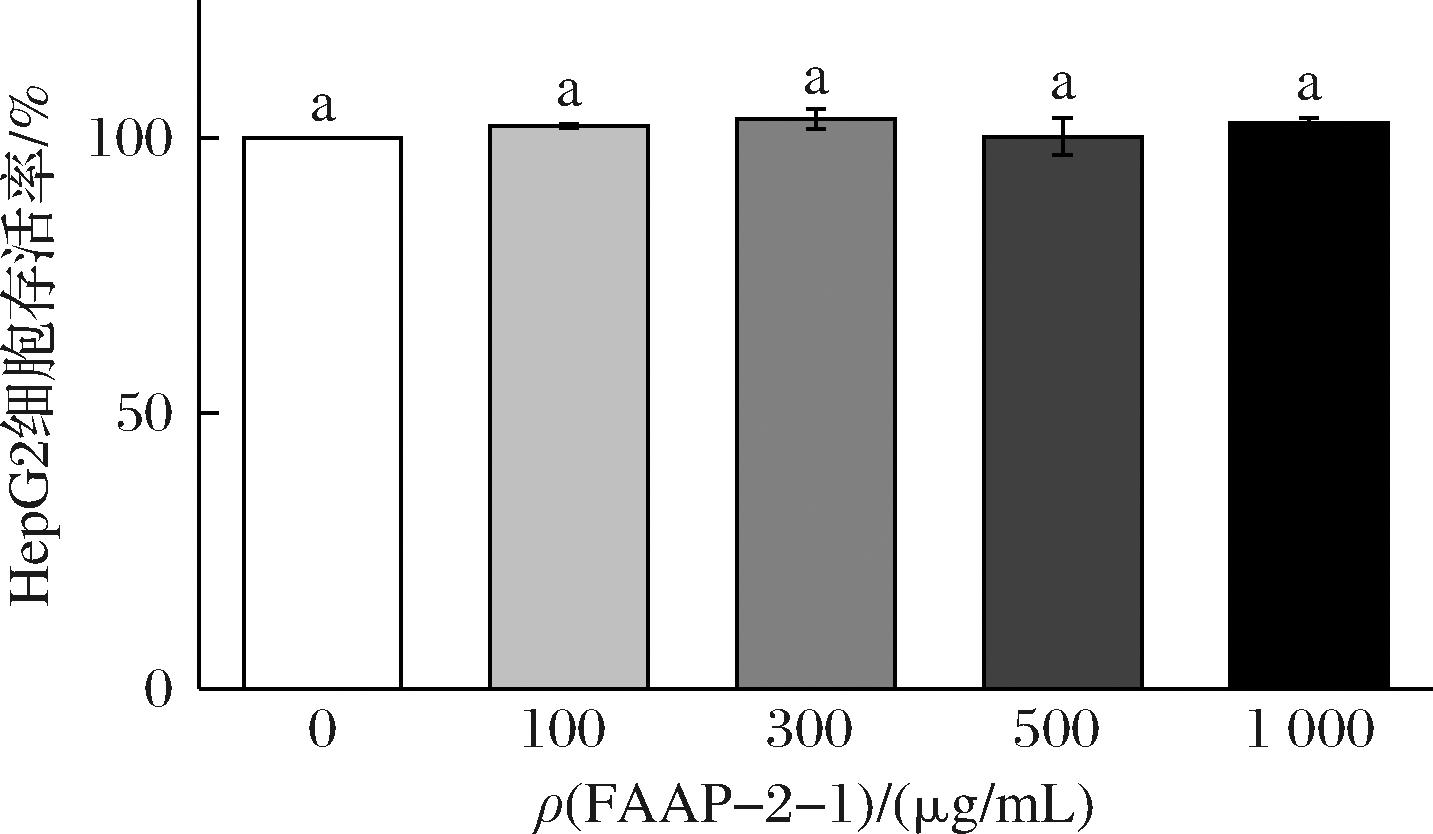
图6 不同浓度FAAP-2-1对HepG2存活率的影响
Fig.6 Effect of different concentrations of FAAP-2-1 on the survival of HepG2
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.7.2 FAAP-2-1对IR-HepG2细胞葡萄糖消耗量的影响
为了确定FAAP-2-1是否可以改善HepG2细胞的胰岛素抵抗,对给药前后的IR-HepG2细胞中进行了葡萄糖消耗量测定。如图7所示,胰岛素明显降低了HepG2细胞的葡萄糖消耗量,用FAAP-2-1(5、50、500 μg/mL)和阿卡波糖(50 μg/mL)处理后,细胞对葡萄糖的消耗量明显增加,且随着浓度的升高而增加,在用药浓度500 μg/mL时,细胞的葡萄糖消耗能力可以提高12.08%。该结果表明FAAP-2-1可以改善IR-HepG2细胞的胰岛素敏感性,对胰岛素抵抗和糖尿病有潜在的益处。
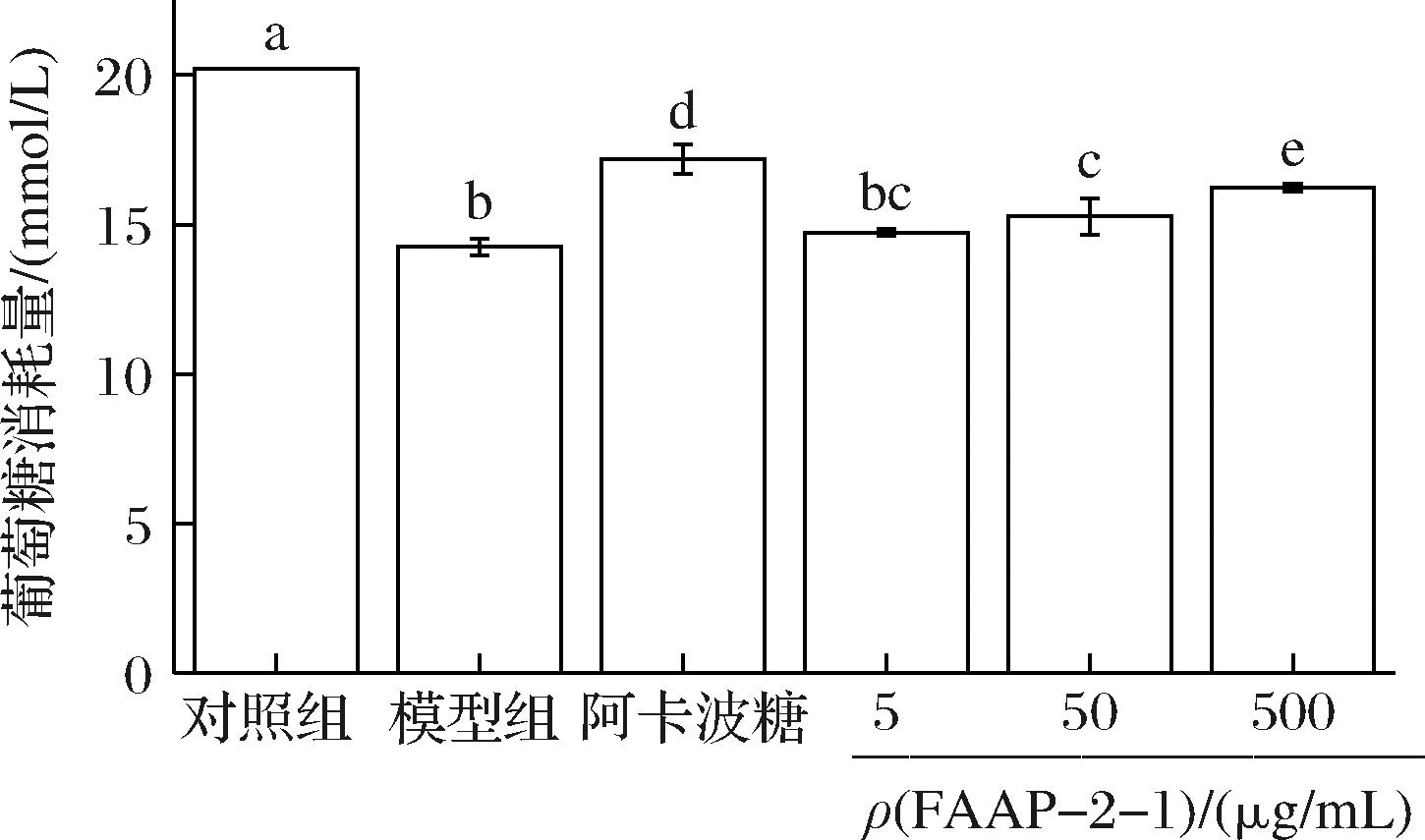
图7 不同浓度FAAP-2-1对IR-HepG2细胞葡萄糖消耗量的影响
Fig.7 Effect of different concentrations of FAAP-2-1 on glucose consumption of IR-HepG2 cells
2.8 糖尿病斑马鱼实验结果
2.8.1 FAAP-2-1对糖尿病斑马鱼的降血糖功效
斑马鱼胰腺的细胞结构与人类相似,斑马鱼胰腺对胰岛素敏感,参与血糖调节的其他组织器官(肝脏、肌肉、脂肪组织等)以及与糖代谢调节相关的一些分子机制在进化上与哺乳动物一致[22],因此采用斑马鱼建模进行降血糖探究。由图8可得,斑马鱼高血糖模型组的血糖升高236.84%,是对照组的近3倍,表明糖尿病模型造模成功。
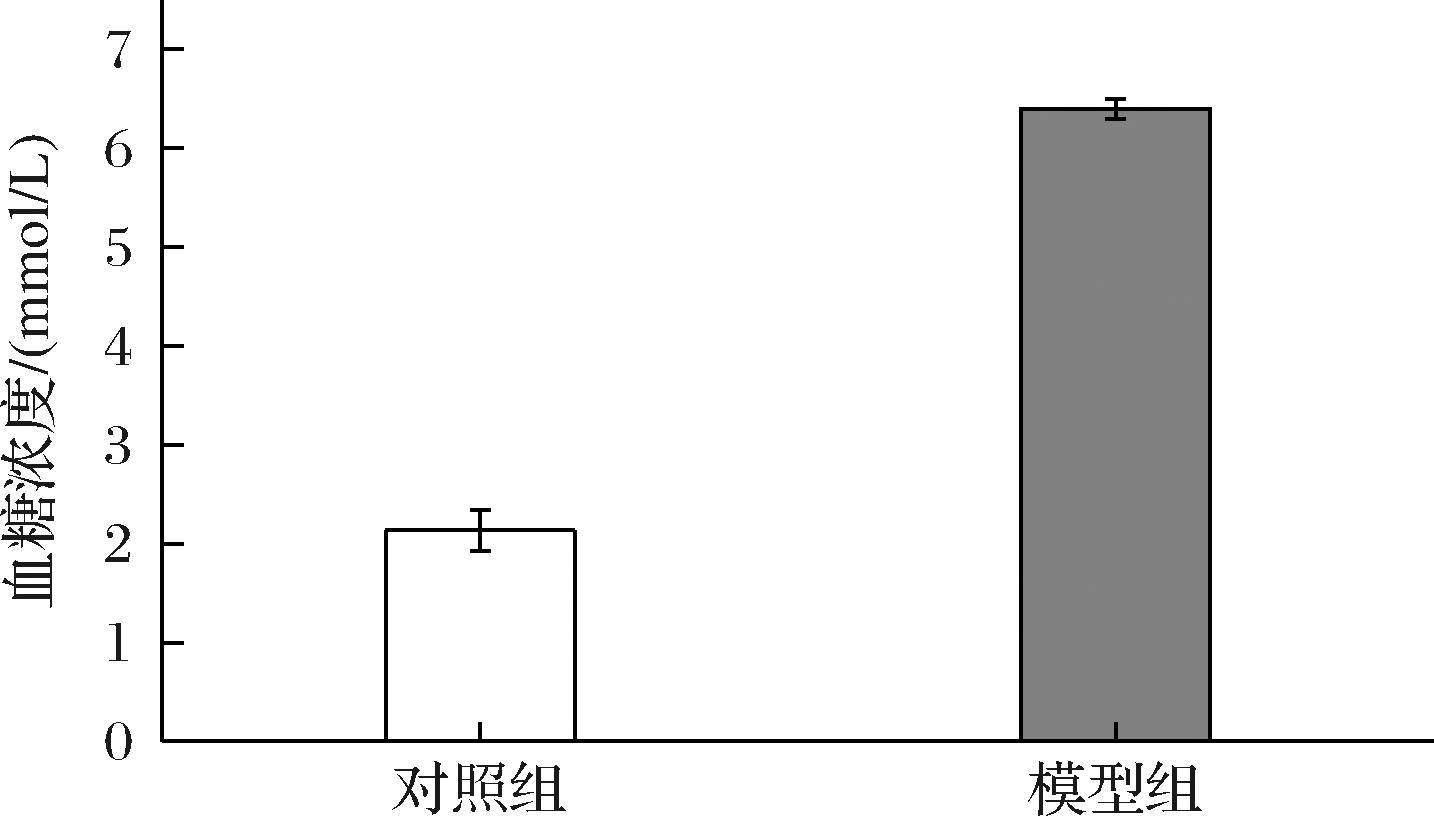
图8 葡萄糖四氧嘧啶联用对斑马鱼血糖影响
Fig.8 Effect of glucose- alloxan combination on blood glucose in zebrafish
由图9可知,随着用药浓度的升高,阿卡波糖和FAAP-2-1对斑马鱼的降血糖效果都有所提升,在高剂量用药浓度(0.9 mg/mL)时,阿卡波糖治疗组血糖水平下降94.05%,说明阿卡波糖具有明显的降糖作用,FAAP-2-1使血糖下降73.52%,说明经过发酵后的多糖具有一定的降血糖作用,原因可能是发酵使得黑木耳多糖分子质量变小,更有助于活性物质的释放。
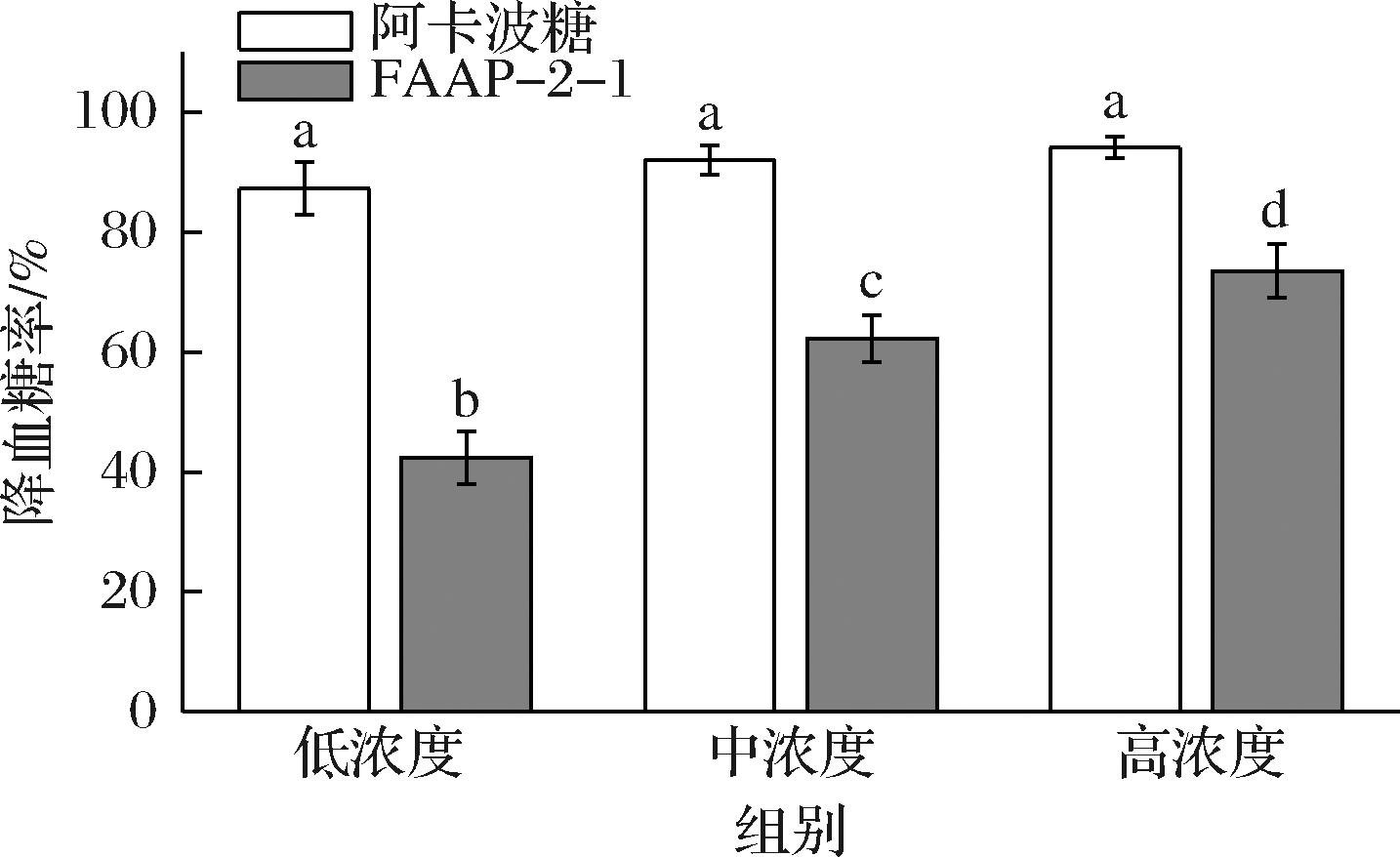
图9 阿卡波糖和FAAP-2-1对糖尿病斑马鱼血糖影响
Fig.9 Effect of acarbose and FAAP-2-1 on blood glucose in diabetic zebrafish
2.8.2 FAAP-2-1对糖尿病斑马鱼降血糖相关基因mRNA的影响
如图10-a所示,与空白组相比,模型组AKT的mRNA相对表达量明显下降56.92%,与模型组相比,高剂量处理的AKT表达量显著上升,是模型组的1.42倍。如图10-b所示,与模型组相比,高剂量组PI3K的表达显著上升了2.33倍。如图10-c所示,与空白组相比,模型组IRS的mRNA相对表达量明显下降65.18%,与模型组相比,高剂量处理的AKT表达量显著上升,是模型组的1.73倍。如图10-d所示,与模型组相比,高剂量组GLUT2的表达显著上升了1.98倍。综上所述,FAAP-2-1可以明显上调AKT、PI3K、IRS、GLUT2的mRNA表达水平,可基于PI3K/AKT信号转导通路及上下游反应,恢复和改善糖尿病斑马鱼葡萄糖代谢异常的症状,改善胰岛素抵抗。实验结果表明,FAAP-2-1对斑马鱼中与胰岛素信号通路相关的基因表达具有显著的影响。
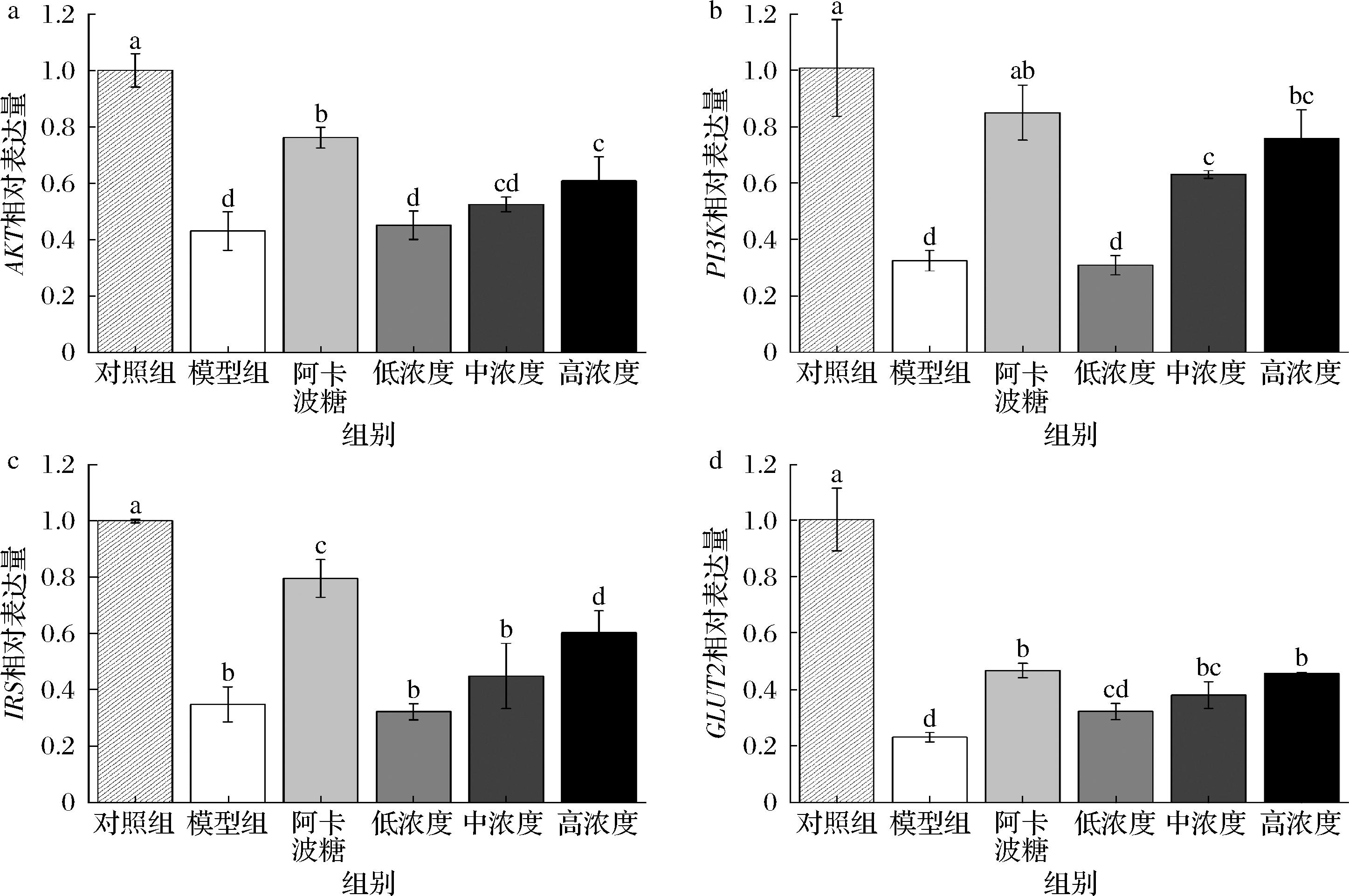
a-AKT mRNA表达量;b-PI3K mRNA表达量;c-IRS mRNA表达量;d-GLUT2 mRNA表达量
图10 FAAP-2-1对糖尿病斑马鱼转录因子的影响
Fig.10 Effect of FAAP-2-1 on transcription factors in diabetic zebrafish
3 结论与讨论
本实验利用植物乳植杆菌N1对黑木耳溶液进行发酵处理,纯化得到黑木耳发酵多糖FAAP-2-1,分子质量为1.48×106 Da,主要由半乳糖、甘露糖、木糖、岩藻糖、葡萄糖、阿拉伯糖、半乳糖醛酸、葡萄糖醛酸8种单糖组成,其比例为4.27∶55.27∶0.36∶1.90∶16.34∶1.54∶2.51∶17.81,且具有三螺旋结构。扫描电镜下呈现丝状与孔状结构,在自然条件下,多糖可能以水合状态存在,并不表现出孔状结构,所以在实际应用中,如药物递送和组织工程中,孔状结构可能会提供一定的优势,如提高载药能力和表面附着能力。通过HepG2细胞及斑马鱼降血糖试验,发现FAAP-2-1具有明显的降血糖效果,可以将IR-HepG2细胞的葡萄糖消耗能力提高12.08%,使高血糖斑马鱼的血糖下降73.52%。
PI3K/AKT信号通路在胰岛素抵抗中发挥着重要作用,能够通过调节细胞摄取葡萄糖的能力来调节脂质代谢[23]。AKT信号的激活在葡萄糖代谢和胰岛素信号传导中起着至关重要的作用,FAAP-2-1可以促进AKT表达,从而促进葡萄糖转运蛋白易位至细胞膜,增加细胞对葡萄糖的摄取,降低血糖水平。同样,PI3K mRNA表达在高剂量的FAAP-2-1调控下显着增强,由于PI3K是AKT的上游调节因子,PI3K的表达减少可能会导致糖脂代谢紊乱[24],其表达增加表明AKT通路被激活,说明FAAP-2-1具有影响胰岛素信号通路的潜力。FAAP-2-1增加了胰岛素受体底物(insulin receptor substrate,IRS)mRNA表达水平,说明可以影响胰岛素信号传导通路的关键蛋白,激活PI3K/AKT信号传导的下游通路。同时,高剂量的FAAP-2-1可以上调GLUT2的mRNA表达水平,说明可以通过影响种葡萄糖转运蛋白,从而维持葡萄糖稳态,在糖异生和糖原储存中发挥重要作用[25]。综上所述,FAAP-2-1可以通过调节斑马鱼中AKT、PI3K、IRS和GLUT2的基因表达来激活PI3K/AKT信号转导通路,从而改善胰岛素敏感性和促进葡萄糖利用,降低血糖。这些结论突出了微生物发酵对多糖的转化作用,说明发酵后的黑木耳多糖具有较好的降血糖活性。因此,发酵作为一种有效的生物技术工具,可以提高多糖的应用潜力,使发酵产品具有更广阔前景,为利用发酵技术提高多糖衍生物的生物活性奠定了基础,有利于其在生物医药和功能食品领域的应用。
[1] LIU X F, LUO D H, GUAN J J, et al.Mushroom polysaccharides with potential in anti-diabetes:Biological mechanisms, extraction, and future perspectives:A review[J].Frontiers in Nutrition, 2022, 9:1087826.
[2] KHAN M A B, HASHIM M J, KING J K, et al.Epidemiology of type 2 diabetes-global burden of disease and forecasted trends[J].Journal of Epidemiology and Global Health, 2020, 10(1):107-111.
[3] GIACCO F, BROWNLEE M.Oxidative stress and diabetic complications[J].Circulation Research, 2010, 107(9):1058-1070.
[4] JIANG X, MENG W Q, LI L Z, et al.Adjuvant therapy with mushroom polysaccharides for diabetic complications[J].Frontiers in Pharmacology, 2020, 11:168.
[5] WU L, GAO Y, SU Y, et al.Probiotics with anti-type 2 diabetes mellitus properties:Targets of polysaccharides from traditional Chinese medicine [J].Chinese Journal of Natural Medicines, 2022, 20(9):641-655.
[6] LU L X, YAO F J, WANG P, et al.Construction of a genetic linkage map and QTL mapping of agronomic traits in Auricularia auricula-judae[J].Journal of Microbiology, 2017, 55(10):792-799.
[7] DAMTE D, REZA M A, LEE S J, et al.Anti-inflammatory activity of dichloromethane extract of Auricularia auricula-judae in RAW264.7 cells[J].Toxicological Research, 2011, 27(1):11-14.
[8] ZHOU R, WANG Y J, WANG Z X, et al.Effects of Auricularia auricula-judae polysaccharide on pasting, gelatinization, rheology, structural properties and in vitro digestibility of kidney bean starch[J].International Journal of Biological Macromolecules, 2021, 191:1105-1113.
[9] XIA T, ZHANG B, LI S P, et al.Vinegar extract ameliorates alcohol-induced liver damage associated with the modulation of gut microbiota in mice[J].Food &Function, 2020, 11(4):2898-2909.
[10] ZHANG S T, WANG C F, SUN Y, et al.Xylanase and fermented polysaccharide of Hericium caputmedusae reduce pathogenic infection of broilers by improving antioxidant and anti-inflammatory properties[J].Oxidative Medicine and Cellular Longevity, 2018, 2018(1):4296985.
[11] LIAO Y T, GAO M, WANG Y T, et al.Structural characterization and immunomodulatory activity of exopolysaccharide from Aureobasidium pullulans CGMCC 23063[J].Carbohydrate Polymers, 2022, 288:119366.
[12] WANG Y P, GUO M R.Purification and structural characterization of polysaccharides isolated from [12] WANG Y P, GUO M R.Purification and structural characterization of polysaccharides isolated from Auricularia cornea var.Li[J].Carbohydrate Polymers, 2020, 230:115680.
[13] LI X-G, ZHANG F-Y, JIANG C-X, et al.Structural analysis, in vitro antioxidant and lipid-lowering activities of purified Tremella fuciformis polysaccharide fractions[J].Process Biochemistry, 2023, 133:99-108.
[14] ALAAELDIN R, ABDEL-RAHMAN I A M, HASSAN H A, et al.Carpachromene ameliorates insulin resistance in HepG2 cells via modulating IR/IRS1/PI3k/Akt/GSK3/FoxO1 pathway[J].Molecules, 2021, 26(24):7629.
[15] NASCIMENTO G O, MARQUES S P D, MAIA C E G, et al.Hypoglycemic effect of Coffea arabica leaf extracts and major bioactive constituents[J].Journal of Biomolecular Structure and Dynamics, 2023, 41(24):14871-14886.
[16] ZHOU H, WU Y Y, KIM E, et al.Simultaneous tests of theaflavin-3, 3′-digallate as an anti-diabetic drug in human hepatoma G2 cells and zebrafish (Danio rerio)[J].Nutrients, 2021, 13(12):4379.
[17] WANG X, YANG X L, LIU K C, et al.Effects of streptozotocin on pancreatic islet β-cell apoptosis and glucose metabolism in zebrafish larvae[J].Fish Physiology and Biochemistry, 2020, 46(3):1025-1038.
[18] CHEN N N, ZHANG H, ZONG X, et al.Polysaccharides from Auricularia auricula:Preparation, structural features and biological activities[J].Carbohydrate Polymers, 2020, 247:116750.
[19] HUANG F, HONG R Y, ZHANG R F, et al.Physicochemical and biological properties of Longan pulp polysaccharides modified by Lactobacillus fermentum fermentation[J].International Journal of Biological Macromolecules, 2019, 125:232-237.
[20] LIN Y Y, PI J J, JIN P Y, et al.Enzyme and microwave co-assisted extraction, structural characterization and antioxidant activity of polysaccharides from Purple-heart Radish[J].Food Chemistry, 2022, 372:131274.
[21] MUELLER A, RAPTIS J, RICE P J, et al.The influence of glucan polymer structure and solution conformation on binding to (1→3)-beta-D-glucan receptors in a human monocyte-like cell line[J].Glycobiology, 2000, 10(4):339-346.
[22] CAO Y, CHEN Q, LIU Y, et al.Research progress on the construction and application of a diabetic zebrafish model[J].International Journal of Molecular Sciences, 2023, 24(6):5195.
[23] SCHWANKE R C, MARCON R, MEOTTI F C, et al.Oral administration of the flavonoid myricitrin prevents dextran sulfate sodium-induced experimental colitis in mice through modulation of PI3K/Akt signaling pathway[J].Molecular Nutrition &Food Research, 2013, 57(11):1938-1949.
[24] NELSON V L B, JIANG Y P, DICKMAN K G, et al.Adipose tissue insulin resistance due to loss of PI3K p110α leads to decreased energy expenditure and obesity[J].American Journal of Physiology.Endocrinology and Metabolism, 2014, 306(10):E1205-E1216.
[25] LIU N N, CHEN M Y, SONG J N, et al.Effects of Auricularia auricula polysaccharides on gut microbiota composition in type 2 diabetic mice[J].Molecules, 2022, 27(18):6061.