枸杞为茄科属植物果实,主要分布在我国的西北、西南、华中、华南以及华东各个省份[1],是我国传统的药食同源食物,富含多种生物活性成分,如枸杞多糖、黄酮、甜菜碱、类胡萝卜素和维生素等,具有增强免疫力、降血压、降血糖、抗氧化、抗衰老等功效[2]。同时已有研究证实益生菌具有多种促进健康的作用,如调节肠道菌群、降低血清胆固醇水平、增强免疫系统和改善口腔疾病等[3],研究者常利用益生菌发酵各种植物以研究发酵对其产生的影响,对发酵枸杞汁的相关研究如黄宁馨等[4]通过植物乳植杆菌和发酵乳杆菌的复合发酵发现其提高了枸杞果汁中膳食多酚等活性成分含量;刘予煊等[5]分析了不同菌株发酵对枸杞汁品质与挥发性成分的影响;李旭阳等[6]利用从泡菜源中分离得到的瑞士乳杆菌研究了瑞士乳杆菌NXU—19022发酵枸杞汁的最优工艺并分析了发酵后的物质含量变化;乔博鑫等[7]研究了保加利亚乳杆菌与嗜热链球菌联合发酵枸杞的最佳发酵工艺并分析了发酵过程中理化指标及风味物质成分的变化。
糖尿病是一种受遗传和环境因素影响的慢性疾病[8],Ⅱ型糖尿病是最常见的类型,主要特征是胰岛素抵抗,胰岛β细胞功能障碍和肝葡萄糖输出量升高[9]。相关研究发现可以通过提高α-淀粉酶和α-葡萄糖苷酶的抑制率来有效控制血糖[10]。孙永进[11]表明西番莲果皮纯化多糖对胰脂肪酶、α-淀粉酶和α-葡萄糖苷酶均具有较好的抑制作用。冯诗华[12]表明绿球藻多糖对α-淀粉酶和α-葡萄糖苷酶具有较好抑制作用,可延缓餐后血糖上升,具有一定的体外降脂和降血糖活性。
微生物的降血糖作用已成为目前糖尿病防治研究的热点,但将益生菌与枸杞结合研究其功能特性相对较少,为进一步探讨发酵对枸杞汁体外降血糖及抗氧化活性的影响,本研究根据菌株的发酵特性、发酵枸杞汁对α-淀粉酶、α-葡萄糖苷酶活性的抑制能力从鼠李糖乳酪杆菌、副干酪乳酪杆菌、植物乳植杆菌、嗜酸乳杆菌这4株具有一定体外降血糖能力的菌株中优选出发酵枸杞汁的最适菌株,并以乳酸含量和α-葡萄糖苷酶的抑制率作为响应面指标,优化枸杞汁发酵工艺,分析发酵对枸杞汁品质的影响,这为益生菌发酵枸杞食品降血糖的功能性开发提供了一定的理论依据。
1 材料与方法
1.1 材料与试剂
试验所用枸杞为宁杞10号;所用菌株保存在宁夏大学食品微生物重点实验室;异抗坏血酸钠、果胶酶、牛胆盐、阿卡波糖、α-淀粉酶(≥5 U/mg)、α-葡萄糖苷酶(27.3 U/mg),上海源叶生物科技有限公司;MRS肉汤培养基、MRS培养基,青岛高科技工业园海博生物技术有限公司;柠檬酸、K2HPO4、KH2PO4、无水碳酸钠,天津市大茂化学试剂厂,DNS试剂,北京索莱宝科技有限公司;对硝基苯基-α-D-吡喃葡萄糖苷(p-nitrophenyl-α-D-glucopyranoside,PNPG),上海麦克林生化科技有限公司,以上试剂均为分析纯。
1.2 仪器与设备
BSP-100生化培养箱,上海博讯实业有限公司医疗设备厂;Alpha-1506紫外分光光度计,上海谱元仪器有限公司;PHS-3C pH酸度计,上海仪电科学仪器股份有限公司;TD-45糖度计,浙江托普云农科技股份有限公司。
1.3 实验方法
1.3.1 菌株的优选
1.3.1.1 菌株生长曲线的测定
将活化2~3代的菌种按2%接种量分别接种于MRS液体培养基中,置于37 ℃恒温培养箱中培养48 h。以液体培养基为对照,每隔2 h于600 nm 处测量吸光值,设置3组平行。以时间为横坐标,OD值为纵坐标,绘制生长曲线。
1.3.1.2 菌株耐酸耐胆盐能力的测定
根据文献[13]中的方法加以改动。将活化两代的菌株,用含有0.3%(质量分数)胆盐、pH=3的MRS液体培养基培养,于0、3、6 h分别测定OD600 nm值,以未接种的MRS液体培养基作为空白调零。
1.3.1.3 菌株发酵枸杞汁发酵性能的测定
pH值采用pH计进行检测;活菌数目的测定参照GB 4789.35—2023《食品安全国家标准 食品微生物学检验 乳酸菌检验》,采用稀释涂布平板法检测活菌数目。
1.3.1.4 发酵枸杞汁α-淀粉酶抑制率测定
根据文献[14]的方法加以改动。配制pH=6.8的磷酸盐缓冲溶液,以1 mg/mL 阿卡波糖为阳性对照。样品组为0.25 mL样品、0.25 mL α-淀粉酶溶液(1.68 U/mL)混合后于40 ℃水浴10 min,再加入0.25 mL 10 g/L可溶性淀粉溶液,40 ℃水浴5 min,加入1 mL DNS溶液沸水浴5 min后于591 nm测吸光值。背景组以磷酸盐缓冲溶液代替α-淀粉酶溶液。α-淀粉酶抑制率按公式(1)计算。
α-淀粉酶抑制率![]()
(1)
式中:A,实验样品的吸光度(样品和酶);B,样品背景组吸光度(不含酶的样品);C,空白组的吸光度(PBS和酶);D,空白背景组的吸光度(PBS)。
1.3.1.5 发酵枸杞汁α-葡萄糖苷酶抑制率测定
根据文献[15]的方法加以改动。配制pH=6.8的磷酸盐缓冲溶液,以1 mg/mL 阿卡波糖为阳性对照。样品组为0.7 mL样品、0.1 mL α-葡萄糖苷酶溶液(0.4 U/mL)混合后于40 ℃水浴10 min,再加入0.2 mL PNPG溶液40 ℃水浴8 min,加入1 mL Na2CO3溶液于405 nm处测吸光值。背景组以磷酸盐缓冲溶液代替α-葡萄糖苷酶溶液。α-葡萄糖苷酶抑制率按公式(2)计算。
α-葡萄糖苷酶抑制率![]()
(2)
式中:A,实验样品的吸光度(样品和酶);B,样品背景组吸光度(不含酶的样品);C,空白组的吸光度(PBS和酶);D,空白背景组的吸光度(PBS)。
1.3.2 枸杞汁及发酵枸杞汁的制备
根据文献[6]的方法加以改动。挑选无腐烂的宁夏枸杞干果,流动水冲去灰尘,把枸杞干果与纯水按照1∶5 (g∶mL)的比例,加入0.5 g/L的异抗坏血酸钠溶液浸泡10 h,再加入1.5 g/L的果胶酶打浆,用4层无菌纱布过滤,同时分别调至菌株的最适pH后分装,采用巴氏杀菌法(65 ℃,30 min)进行灭菌,待冷却后按接种量5%接入菌株,置于37 ℃恒温培养箱中发酵。
1.3.3 发酵枸杞汁单因素试验
用1.3.2节的方法制备枸杞汁,为保证单因素试验的可靠性,需保证接入菌株每一次活化后的生长状态一致,并且菌株生长越多,口感越酸,在保证枸杞汁的口感情况下,将菌体浓度调至1×109 CFU/mL。以乳酸含量及α-葡萄糖苷酶抑制率作为指标优化工艺。固定接种量5%,发酵温度37 ℃,发酵时间为6、8、10、12、14 h,确定最优发酵时间;固定发酵温度37 ℃,发酵时间8 h,接种量为3%、4%、5%、6%、7%,确定最优接种量;固定发酵时间8 h,接种量5%,发酵温度为33 ℃、35 ℃、37 ℃、39 ℃、41 ℃,确定最优发酵温度。
1.3.4 响应面试验设计
选取单因素试验确定的各因素的较优值,以发酵时间(A)、接种量(B)、发酵温度(C)3个因素为响应因素,以乳酸含量及其对α-葡萄糖苷酶抑制率为响应值,采用Design-Expert 13响应面设计软件进行三因素三水平Box-Behnken响应面优化试验。
1.3.5 发酵枸杞汁理化指标及营养成分的测定
1.3.5.1 pH、乳酸含量、可溶性固形物、活菌数的测定
pH采用pH酸度计进行检测;乳酸含量参GB 12456—2021《食品安全国家标准 食品中总酸的测定(含第1号修改单)》进行检测;可溶性固形物采用糖度计进行检测;活菌数参照1.3.1.3节的方法进行测定。
1.3.5.2 总酚含量的测定
采用福林酚比色法[16]测定。0.2 mL的样品溶液加入0.5 mL福林酚,0.5 mL Na2CO3溶液,0.8 mL去离子水混匀后静置1 h,760 nm处测定吸光值。以不同质量浓度的没食子酸标准液为标准品测定标准曲线,未发酵的枸杞汁作对照,得到标准曲线为y=13.459x+0.129 4,R2=0.998。
1.3.5.3 总黄酮含量的测定
采用比色法[17]测定总黄酮含量。用无水乙醇配置0、0.4、0.8、1.2、1.6、2 mg/mL芦丁,加入0.3 mL 50 g/L亚硝酸钠溶液,摇匀放置5 min后加10%硝酸铝溶液0.3 mL,6 min后加入2 mL 1 mol/L NaOH溶液,摇匀,放置15 min,510 nm处测定吸光度。以芦丁为标品,得到标准曲线y=0.352 7x+0.015 3,R2=0.998 8。
1.3.5.4 多糖含量的测定
采用苯酚硫酸法[18]测定多糖含量。样品稀释到合适倍数后在490 nm测定吸光值,根据标准曲线计算葡萄糖浓度,乘稀释倍数得到多糖含量。以葡萄糖为标品,得到标准曲线y=16.938x+0.011,R2=0.998 5。
1.3.5.5 可溶性蛋白的测定
采用考马斯亮蓝法[19]测定。将9 g/L NaCl溶液配置的25 mg/mL蛋白标准溶液稀释0.5 mg/mL,按0、5、10、20、40、60、100 μL加入试管,用9 g/L NaCl补至100 μL,加入1 mL考马斯亮蓝G 250溶液,充分混匀,室温放置3~5 min后595 nm下比色测定。以蛋白含量(μg)为横坐标,吸光度为纵坐标,得出标准曲线y=2.297 2x+1.043 6,R2= 0.995 1。
1.3.6 发酵枸杞汁体外抗氧化活性的测定
1.3.6.1 DPPH自由基清除能力测定
根据参考文献[20]的方法加以改动,将未发酵枸杞汁和发酵枸杞汁稀释不同倍数,吸取2 mL样品加2 mL 0.2 mmol/L DPPH试剂,置于室温下避光反应30 min 于517 nm处检测吸光值,按公式(3)计算DPPH自由基清除能力。
DPPH清除率![]()
(3)
式中:A1,DPPH溶液加无水乙醇的吸光值;A2,DPPH溶液中加样品反应后的吸光值;A3,无水乙醇中加入样品溶液的吸光值。
1.3.6.2 ABTS阳离子自由基清除能力的测定
根据参考文献[18]的方法加以改动,将相同量的ABTS(7.4 mmol/L)与K2S2O8(2.6 mmol/L)混合制备ABTS溶液,并在室温黑暗中保持12 h产生自由基,然后用95%(体积分数)乙醇稀释至734 nm处的吸光度为0.70±0.02,配制7 mmol/L ABTS溶液。将枸杞汁和发酵枸杞汁稀释不同倍数,混合均匀后于室温下避光孵育10 min,734 nm处测定。按公式(4)计算ABTS阳离子自由基的清除能力。
ABTS阳离子自由基清除率![]()
(4)
式中:A1,ABTS混合溶液加超纯水的吸光值;A2,ABTS混合溶液中加样品后的吸光值;A3,超纯水中加入样品溶液的吸光值。
1.3.6.3 羟自由基清除率测定
根据参考文献[21]的方法加以改动,配制9 mmol/L FeSO4溶液,9 mmol/L乙醇—水杨酸溶液,8.8 mmol/L 双氧水溶液,1 mL乙醇—水杨酸溶液加入1 mL FeSO4溶液,再加入1 mL双氧水溶液,1 mL样品溶液,混匀后于 37 ℃静置30 min,510 nm测定吸光值。按公式(5)计算羟自由基的清除能力。
羟自由基清除率![]()
(5)
式中:A1,羟基混合溶液加超纯水的吸光值;A2,羟基混合溶液中加样品后的吸光值;A3,超纯水中加入样品溶液的吸光值。
1.4 数据处理
应用Origin 2019软件对数据进行作图处理,应用SPSS 23对数据进行单因素方差分析,应用Excel 2010、Design expert 13对数据进行统计分析,数据均平行3次取平均值±标准差作为实验结果。
2 结果与分析
2.1 益生菌的发酵性能分析
2.1.1 益生菌的生长曲线
生长曲线能从某种程度上反映微生物的生长特征,是衡量其生长状况的重要指标。从图1中可看出随着培养时间的增加,4株菌的生长趋势相似,在0~8 h内鼠李糖乳酪杆菌、副干酪乳酪杆菌、植物乳植杆菌生长最快,嗜酸乳杆菌相对较慢,且在12 h左右均进入稳定期,在此期间其代谢产物在发酵体系中大量累积,结构和生理发生变化,菌体抗性增加[22],工业生产中通常将该阶段设为产物的最佳收获时期,所以后续选择12 h作为发酵时间。
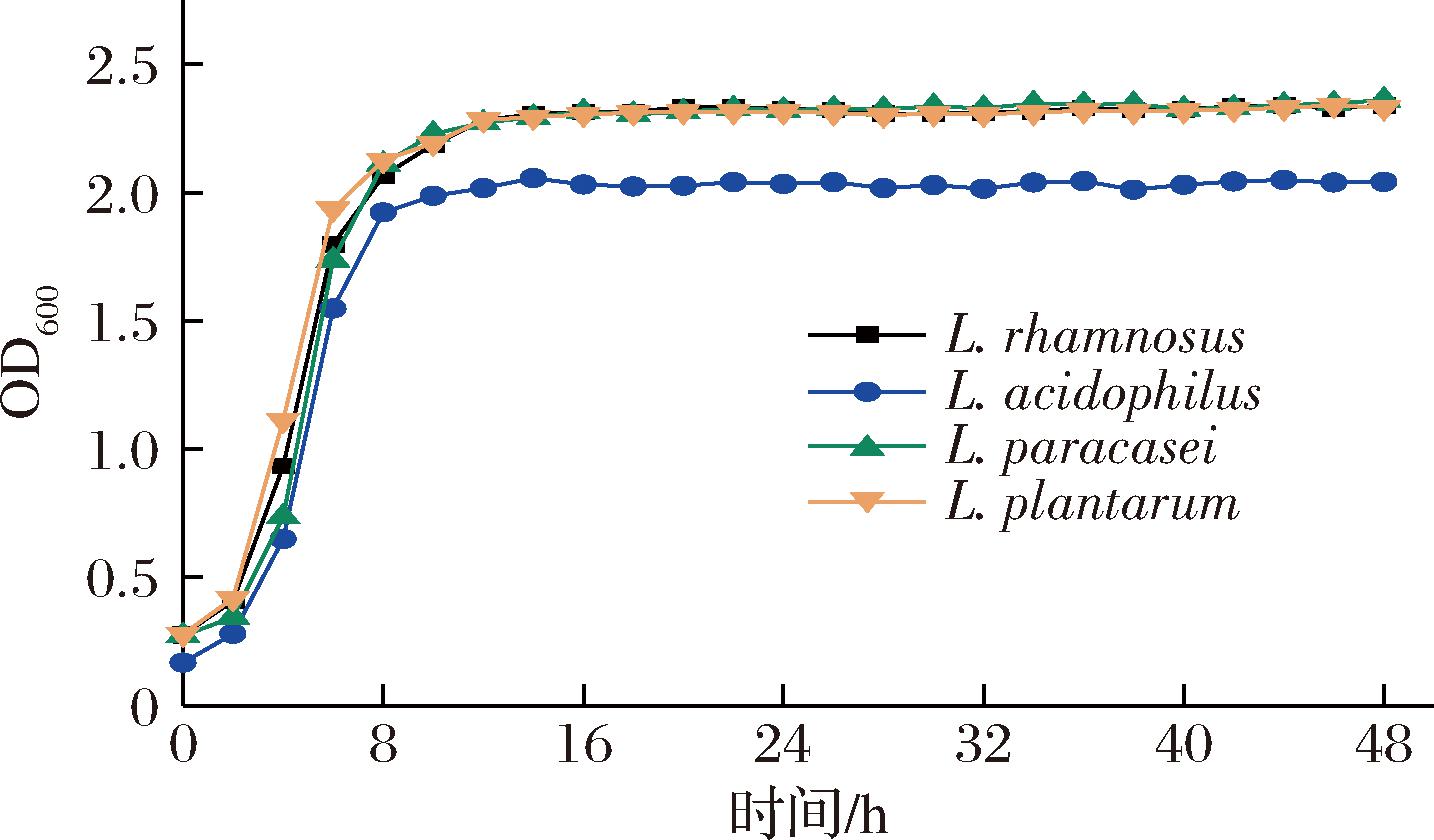
图1 乳酸菌生长曲线
Fig.1 Growth curve of lactic acid bacteria
2.1.2 益生菌耐酸耐胆盐能力的比较
益生菌必须能够忍受人体胃液中的强酸和肠道中的高浓度胆盐环境,才能在体内大量生存,起到益生作用[23]。胃液的极低pH值(2.5~3.5)和胃蛋白酶的抗菌作用可有效防止细菌进入肠道,是阻止细菌进入人体肠道的天然屏障,而食物一般需要在胃中停留2~4 h进行消化[24],图2为pH 3环境下的菌悬液浓度,0 h时由高至低依次为植物乳植杆菌、鼠李糖乳酪杆菌、副干酪乳酪杆菌、嗜酸乳杆菌,在3 h后,4种菌分别提升3.1%、3.11%、25.68%、1.29%,副干酪乳酪杆菌提高最多,说明副干酪乳酪杆菌对胃酸的耐受力较强;在6 h时植物乳植杆菌和嗜酸乳杆菌分别提升5.54%、6.09%;而副干酪乳酪杆菌和鼠李糖乳酪杆菌降低1.05%、4.99%。
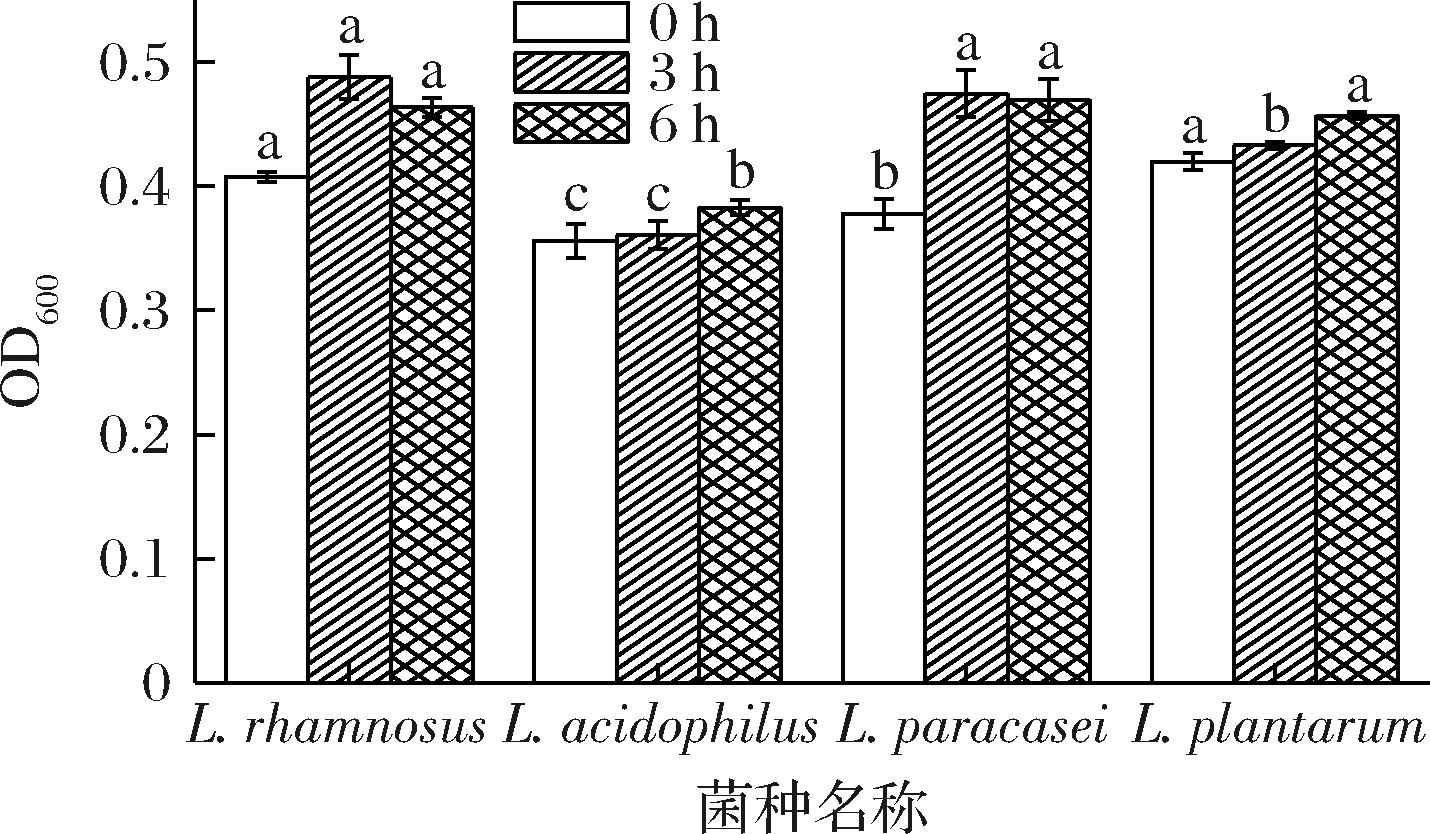
图2 菌株耐酸能力
Fig.2 Acid tolerance of strains
注:不同小写字母表示同一时间内不同菌株的OD值的差异性显著(下同)。
益生菌必须生存的另一个屏障是小肠,小肠的不良条件包括胆盐和胰酶,食物通过小肠的运输时间一般在1~4 h,并且0.15%~0.3%的胆盐质量分数是作为选择人类使用的益生菌的合适浓度范围,图3为乳酸菌在0.3%胆盐质量分数下的菌悬液浓度,3 h时植物乳植杆菌、鼠李糖乳酪杆菌、副干酪乳酪杆菌的浓度分别增加2.3%、1.66%和7.26%;嗜酸乳杆菌降低10%;6 h时分别降低4.5%、3.38%、2.78%和71.7%,结果表明,副干酪乳酪杆菌表现出较高的耐酸耐胆盐能力。
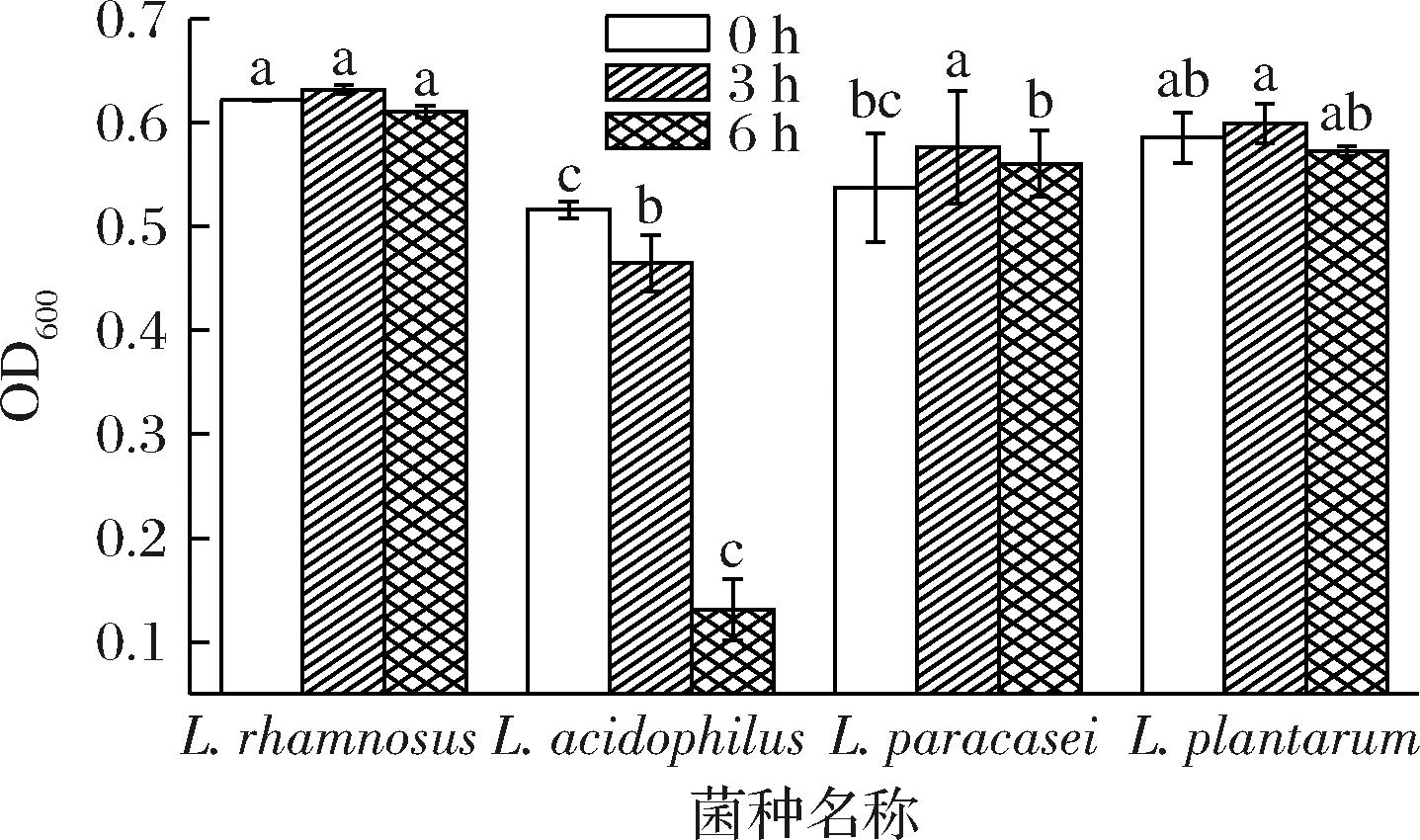
图3 菌株耐胆盐能力
Fig.3 Bile salt tolerance of the strain
2.1.3 益生菌对枸杞汁发酵能力的测定
菌株的发酵性能是一种评价发酵效果的指标。因此,评估了4种菌株在发酵过程中的pH值和活菌数的变化;图4显示了每种菌在最适pH下发酵枸杞汁pH值的变化,可看出pH值随着时间的增加均有降低的趋势,这是由于随着发酵时间的增加,乳酸菌会利用枸杞汁中的糖类等物质作为碳源使乳酸菌生长产生乳酸,使得pH下降,说明pH值的变化也可以表示菌株的生长状况;在发酵12 h后鼠李糖乳酪杆菌发酵枸杞汁pH下降19.53%;嗜酸乳杆菌发酵枸杞汁下降1.33%;植物乳植杆菌发酵枸杞汁pH下降13.12%,副干酪乳酪杆菌下降11.77%,结果表明嗜酸乳杆菌生长力最弱,这与生长曲线表现出的结果一致,同时也说明菌株的产酸性能与pH值有一定的正相关关系[25]。
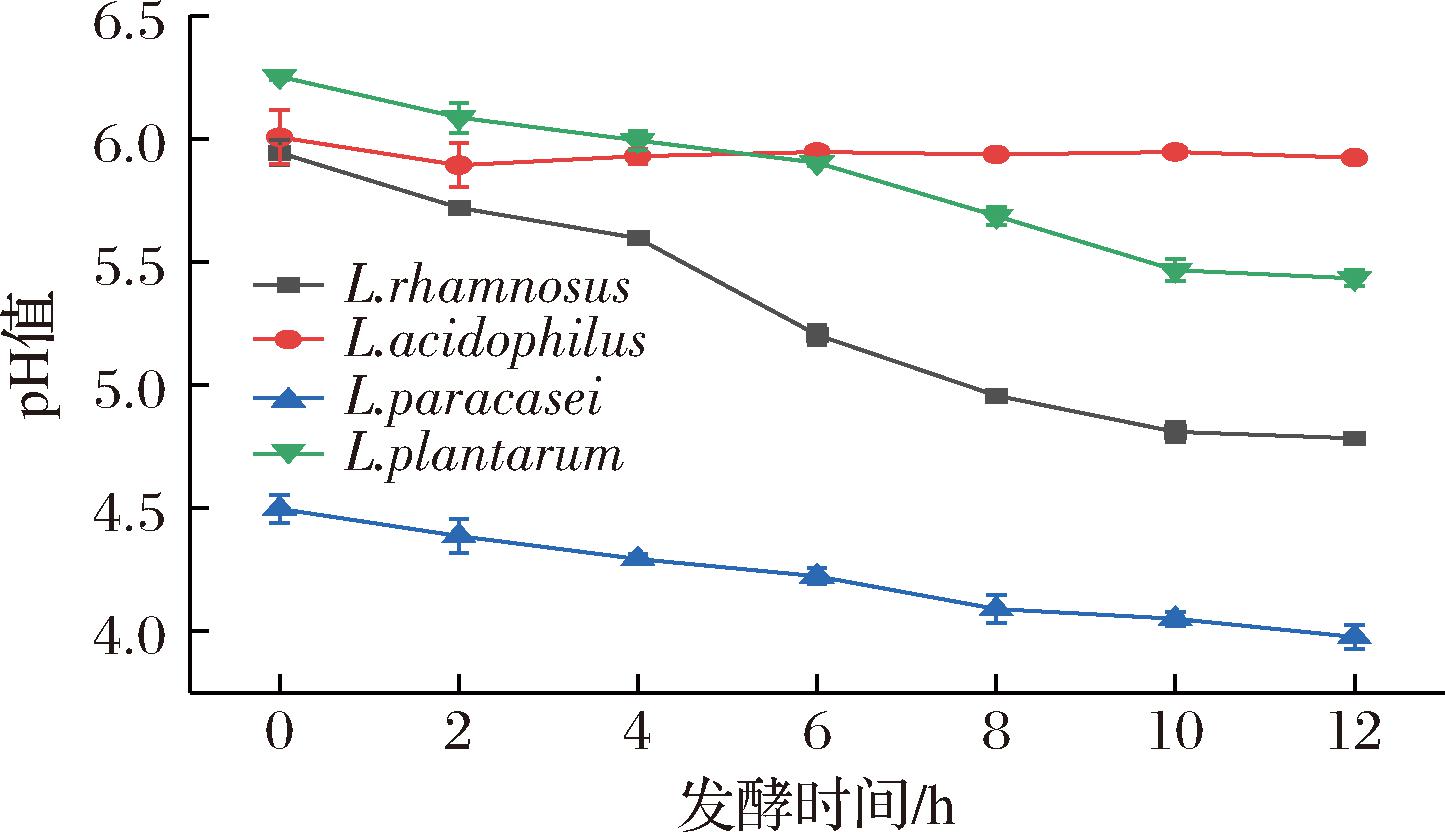
图4 菌株发酵枸杞汁pH的变化
Fig.4 Changes in pH of fermented goji berry juice of strains
图5可知发酵过程中活菌数的变化,4种菌的活菌数的变化趋势相似,植物乳植杆菌、鼠李糖乳酪杆菌、副干酪乳酪杆菌在发酵12 h后活菌数均可达到109 CFU/mL,且副干酪乳酪杆菌活菌数增长最多,增长了37.83%,综合发酵性能考虑,副干酪乳酪杆菌发酵性能较好。
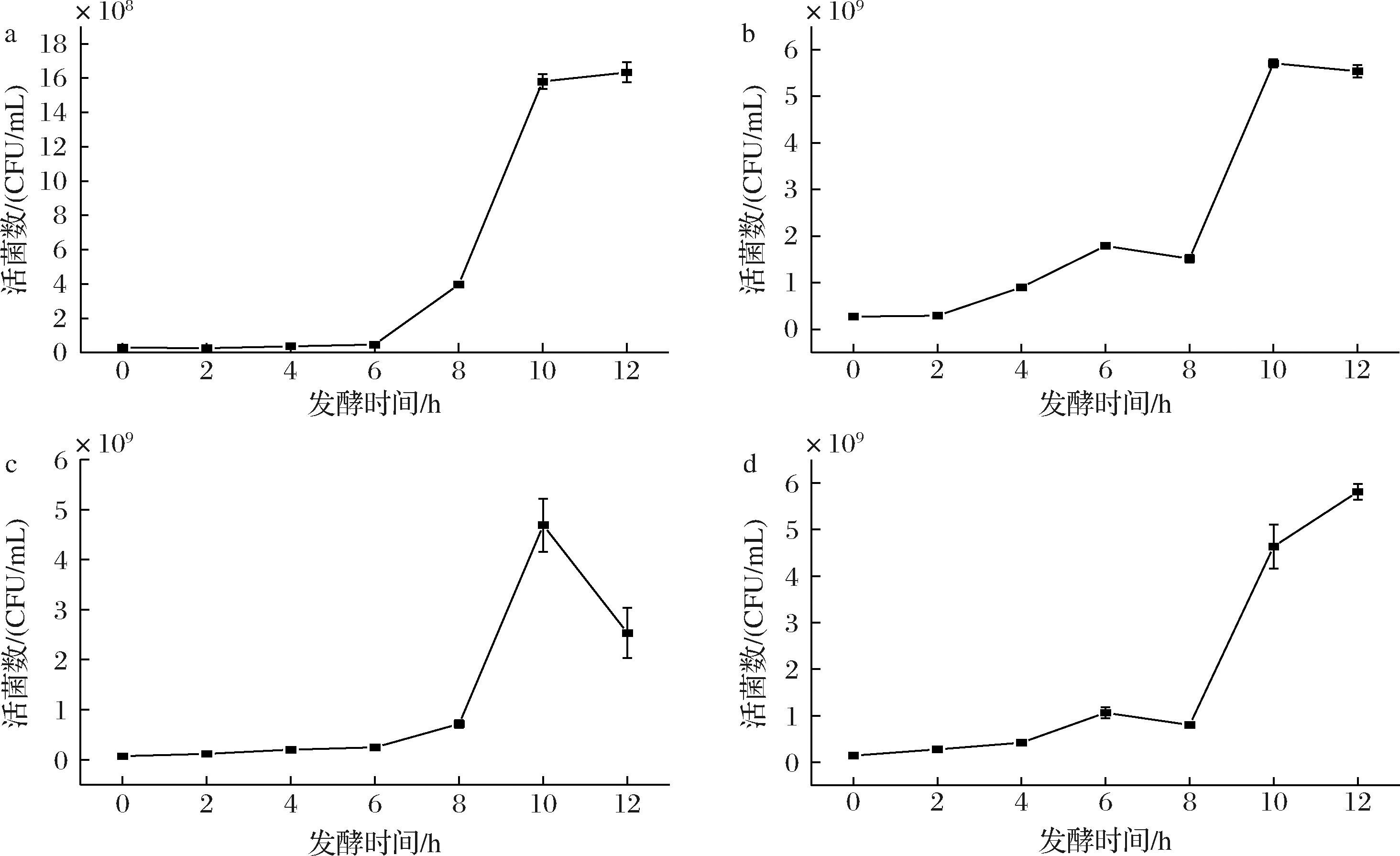
a-嗜酸乳杆菌;b-鼠李糖乳酪杆菌;c-植物乳植杆菌;d-副干酪乳酪杆菌
图5 菌株发酵枸杞汁活菌数的变化
Fig.5 Changes in the number of viable bacteria of strains fermented goji berry juice
2.1.4 发酵枸杞汁对α-淀粉酶的体外抑制率
图6为以1 mg/mL 阿卡波糖为阳性对照的4种菌株发酵枸杞汁的α-淀粉酶抑制率。4种菌株发酵枸杞汁对α-淀粉酶抑制率与阳性对照阿卡波糖相比差异性显著(P<0.05),鼠李糖乳酪杆菌发酵枸杞汁的α-淀粉酶抑制活性最高达到45%,其次是副干酪乳酪杆菌,嗜酸乳杆菌,植物乳植杆菌,分别可达到40%、37%、31%。
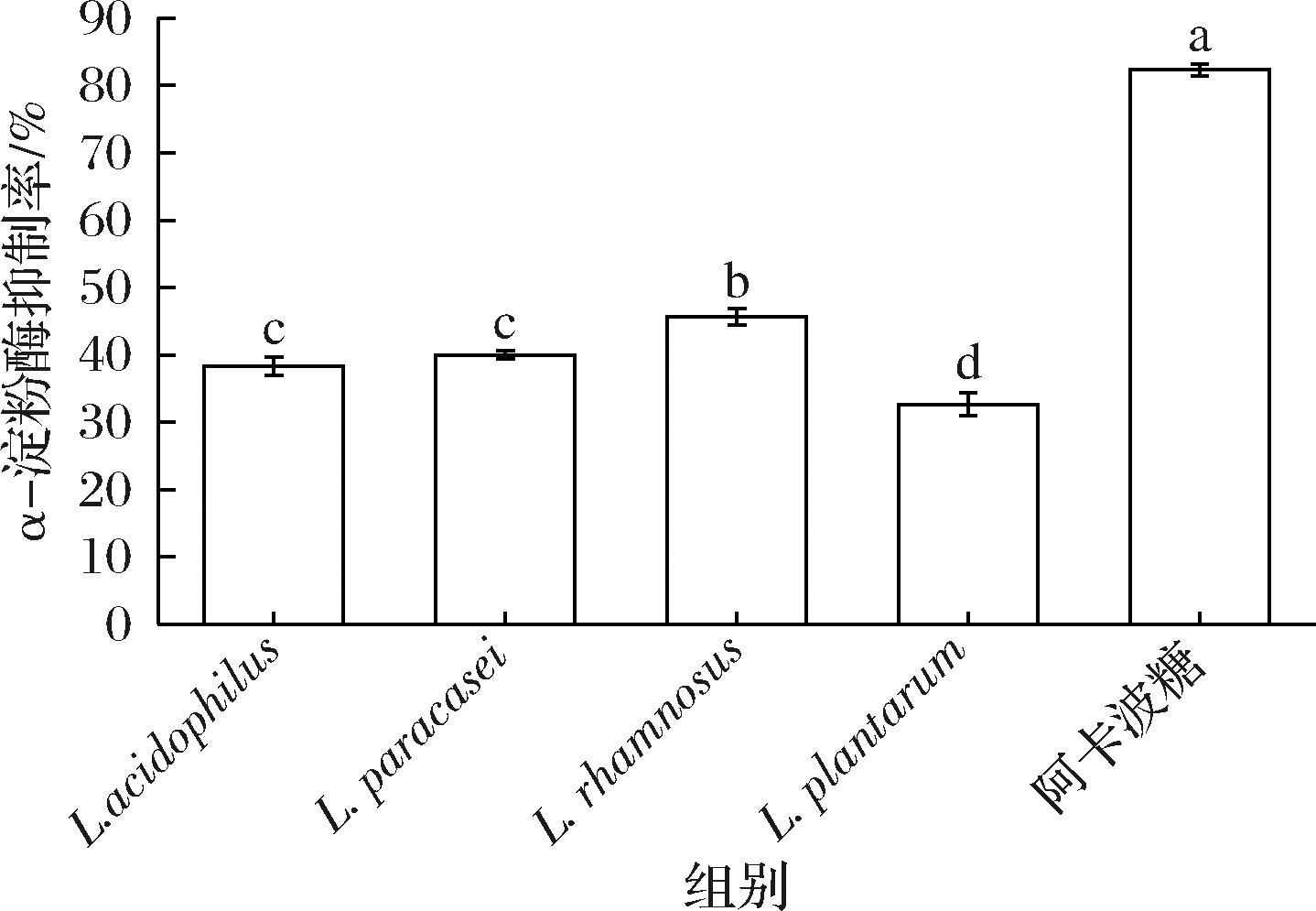
图6 各样品α-淀粉酶抑制率
Fig.6 α-Amylase inhibition rate of each sample
注:不同字母表示组间具有显著性差异(P<0.05)(下同)。
2.1.5 发酵枸杞汁对α-葡萄糖苷酶的体外抑制率
图7为以1 mg/mL 阿卡波糖为阳性对照的4种菌株发酵枸杞汁的α-葡萄糖苷酶抑制活性。从图中可以看出,4种菌株发酵枸杞汁的α-葡萄糖苷酶抑制活性与阳性对照组相比差异性显著(P<0.05),4种菌株发酵枸杞汁的α-葡萄糖苷酶抑制率两两相比差异性显著(P<0.05),副干酪乳酪杆菌发酵枸杞汁的α-葡萄糖苷酶抑制率最高达到70%,其次是植物乳植杆菌、鼠李糖乳酪杆菌、嗜酸乳杆菌,发酵枸杞汁α-葡萄糖苷酶抑制活性分别可达到47%、35%、24%。结果表明,副干酪乳酪杆菌具体更好的体外降血糖活性,选择其作为发酵枸杞汁的最终菌株。
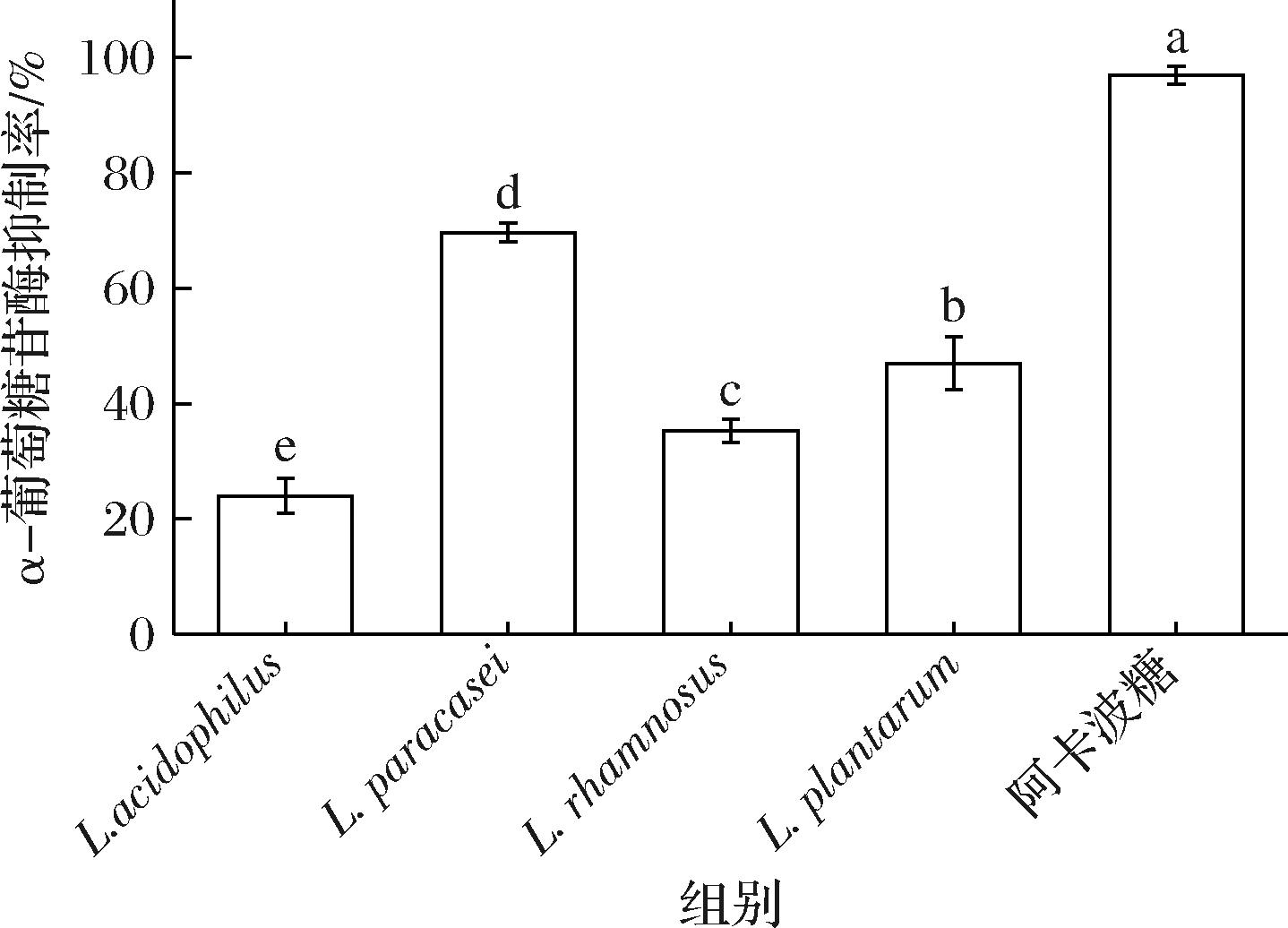
图7 各样品α-葡萄糖苷酶抑制率
Fig.7 α-Glucosidase inhibition rate of each sample
2.2 副干酪乳酪杆菌发酵枸杞汁的单因素试验分析
2.2.1 发酵时间对α-葡萄糖苷酶抑制活性及乳酸含量的影响
由图8可知,乳酸含量一直呈现升高的趋势,在6~12 h内激增,12 h后趋于平稳,乳酸含量在14 h可达到9.3 g/L;α-葡萄糖苷酶抑制率呈现先增加后降低的趋势,并在8 h达到最高52.30%,与其他发酵时间相比差异性显著(P<0.05),可能是由于乳酸菌在发酵过程中会产生大量的酸性物质,使其所处环境pH值降低,从而使某些功能性活性物质的稳定性变差,导致抑制率有减弱的倾向[26]。因此,选择6、8、10 h进行后续试验。
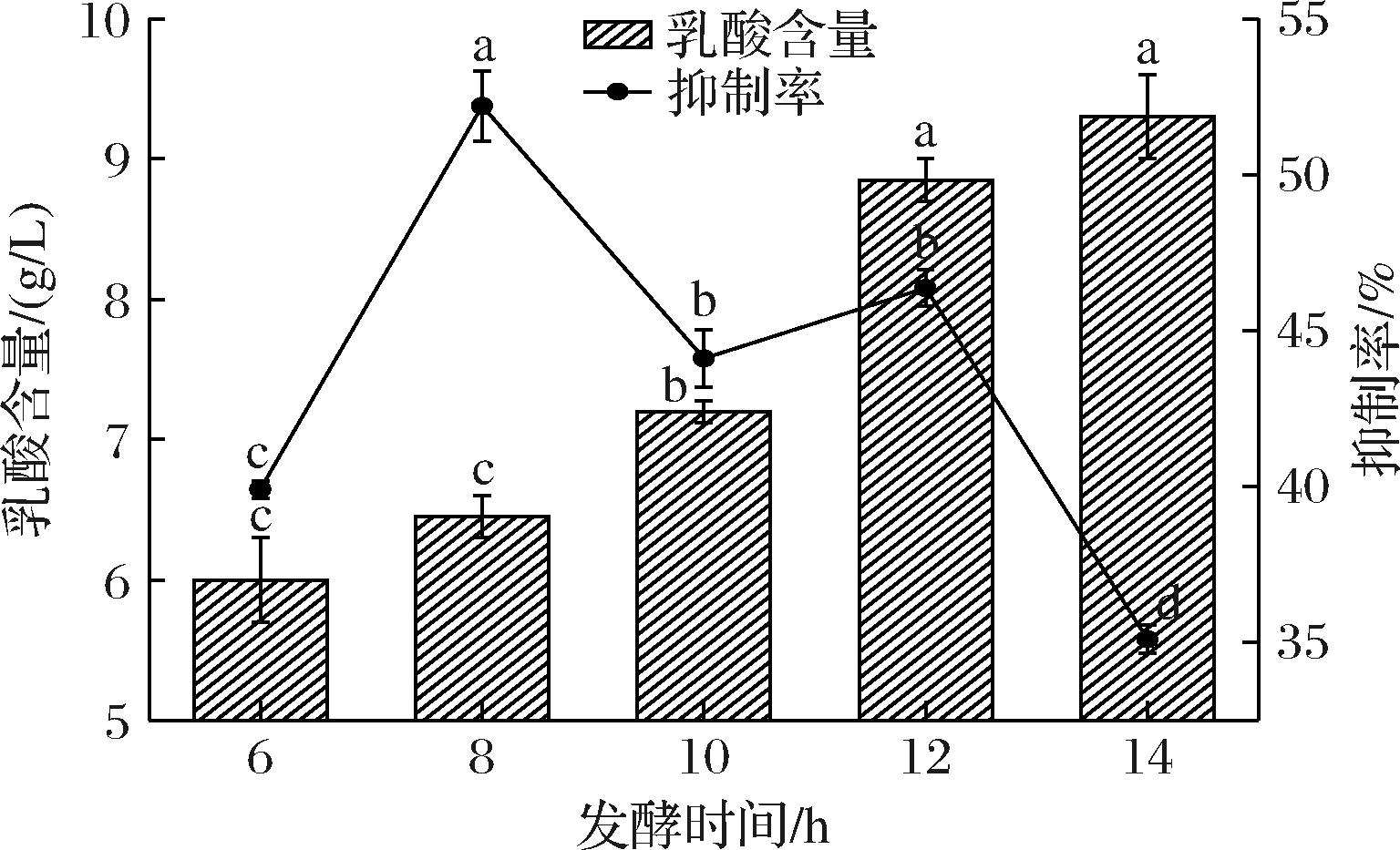
图8 发酵时间对α-葡萄糖苷酶抑制活性及乳酸含量的影响
Fig.8 Effect of fermentation time on α-glucosidase inhibitory activity and lactic acid content
2.2.2 接种量对α-葡萄糖苷酶抑制活性及乳酸含量的影响
由图9可知,乳酸含量与接种量成正比关系,在接种量7%时,乳酸含量最高达到8.96 g/L,与其他接种量条件相比差异性显著(P<0.05),α-葡萄糖苷酶抑制活性先增高后下降,并在接种量5%时达到最高51.75%,与其他接种量相比差异性显著(P<0.05),因此,选择4%、5%、6%进行后续试验。
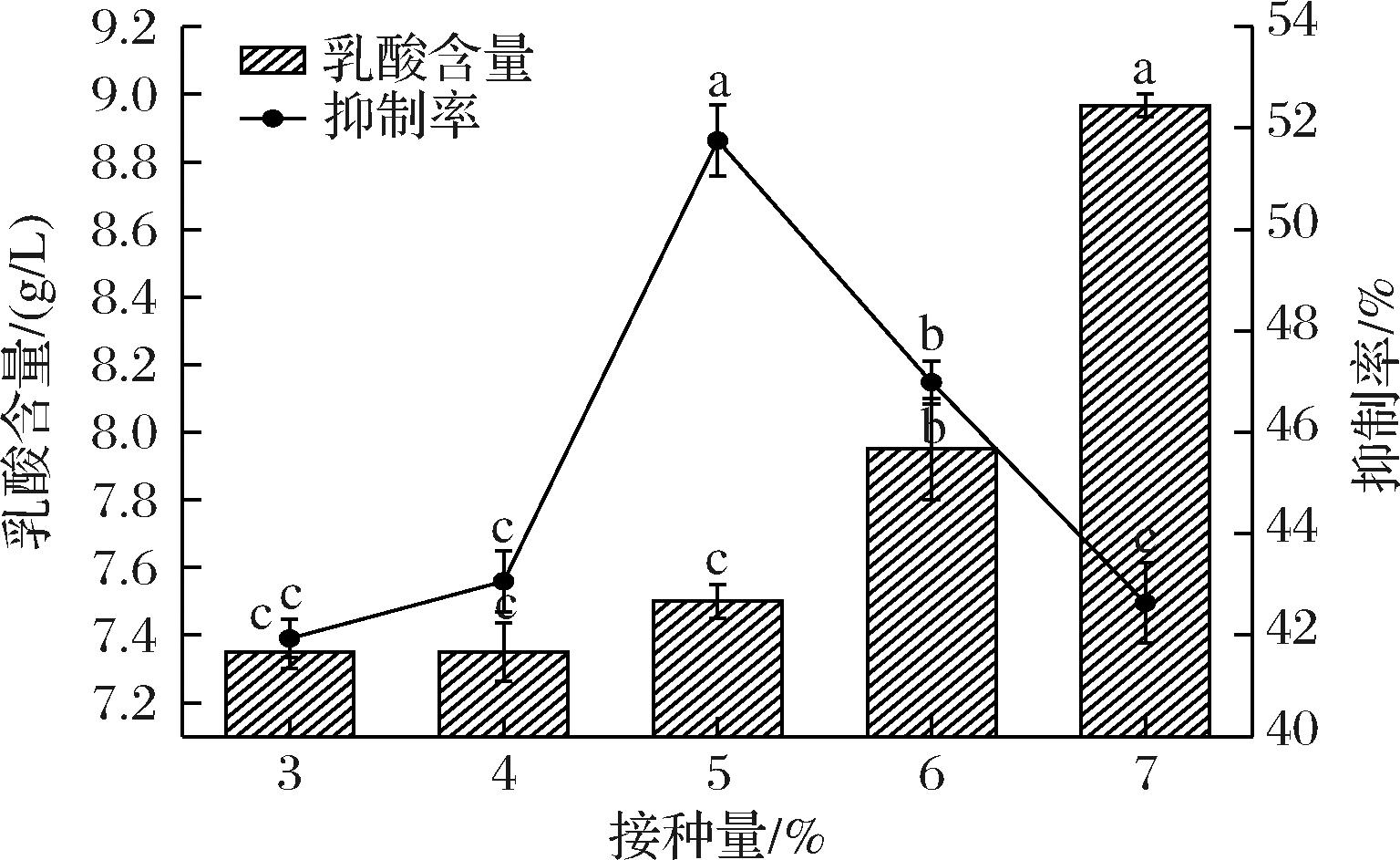
图9 接种量对α-葡萄糖苷酶抑制活性及乳酸含量的影响
Fig.9 Effect of inoculum amount on α-glucosidase inhibitory activity and lactate content
2.2.3 发酵温度对α-葡萄糖苷酶抑制活性及乳酸含量的影响
由图10可知,乳酸的含量随发酵温度的升高而先增大后减小,37 ℃时达到7.2 g/L,α-葡萄糖苷酶抑制率在发酵温度37 ℃时达到最高49.54%,与其他发酵温度相比差异显著(P<0.05),结果表明,发酵温度偏高会导致细胞生长代谢速率下降,影响发酵速度和产酸能力,当温度高于37 ℃时,不利于副干酪乳酪杆菌的生长,使乳酸含量和α-葡萄糖苷酶抑制率下降。因此,选择35、37、39 ℃进行后续试验。
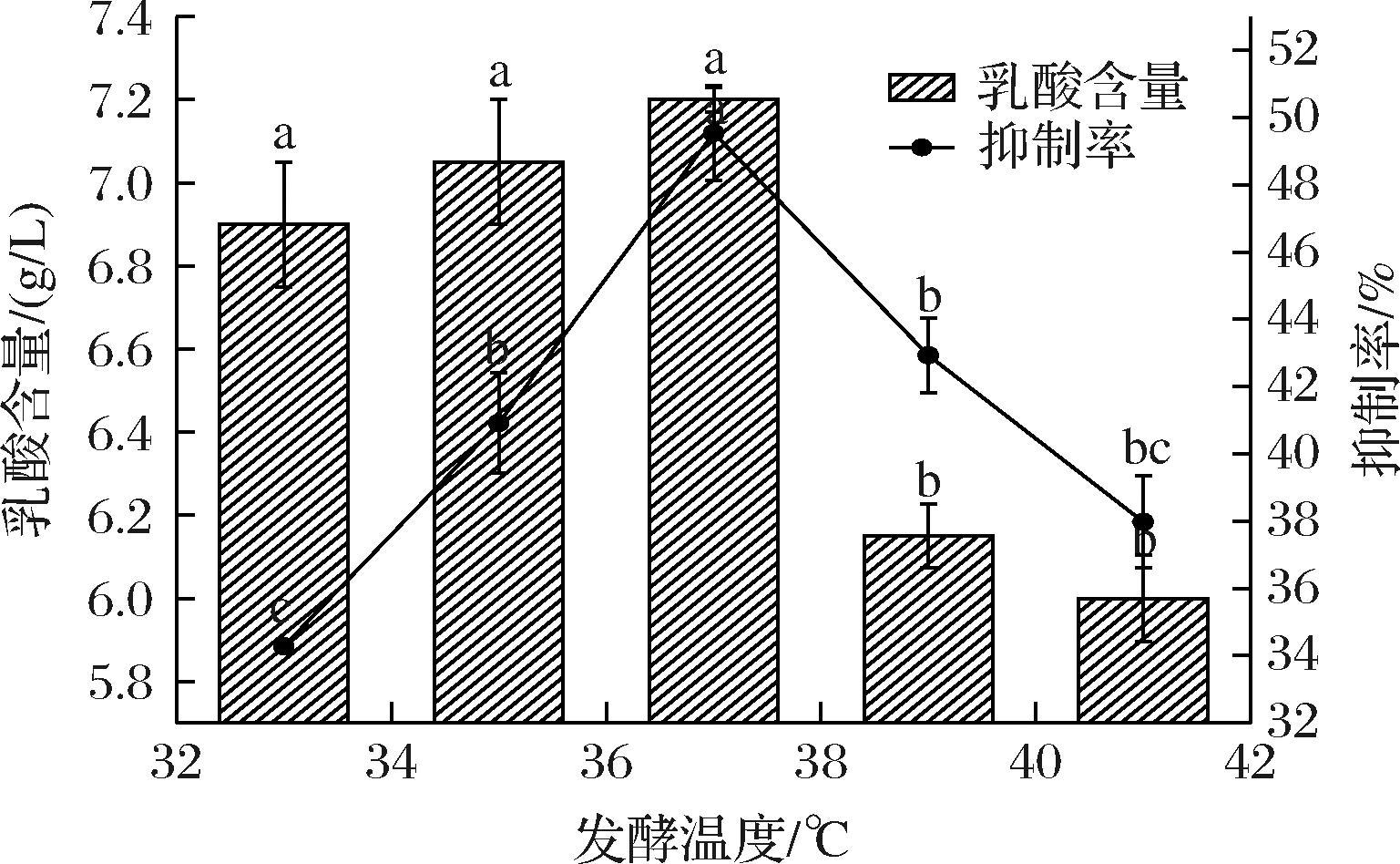
图10 发酵温度对α-葡萄糖苷酶抑制活性及乳酸含量的影响
Fig.10 Effect of fermentation temperature on α-glucosidase inhibitory activity and lactic acid content
2.3 响应面法优化发酵工艺结果分析
在单因素试验基础上,以发酵时间、菌种接种量、发酵温度为条件,乳酸含量及其对α-葡萄糖苷酶抑制活性为指标,采用三因素三水平的正交试验,试验设计见表1。
表1 Box-Behnken设计因素水平表
Table 1 Box-Behnkcn design factor level table
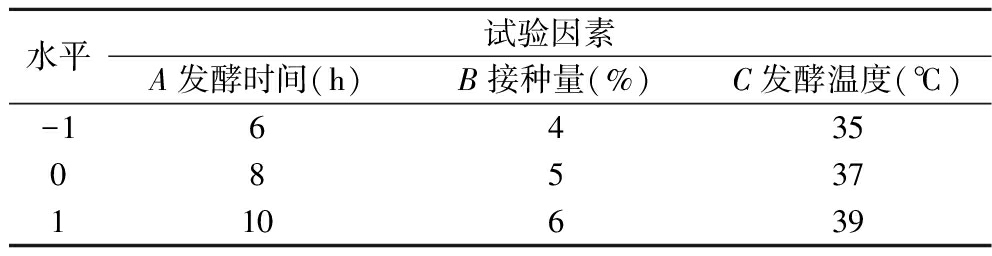
水平试验因素A发酵时间(h)B接种量(%)C发酵温度(℃)-1643508537110639
乳酸含量方差分析及显著性检验结果如表2所示。
表2 乳酸含量回归模型方差分析
Table 2 ANOVA of regression model for lactic acid content
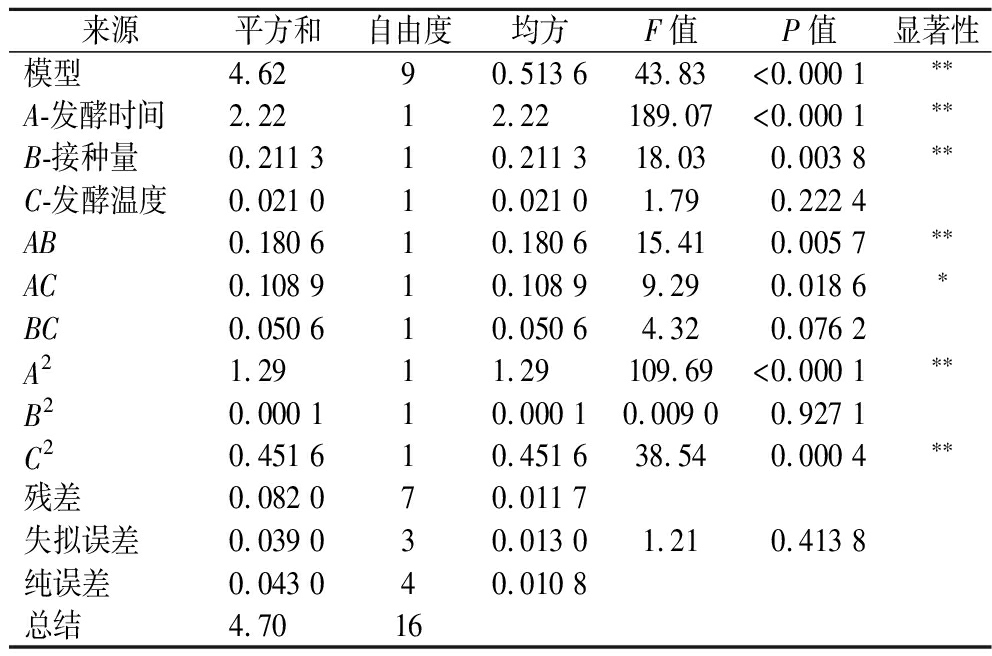
来源平方和自由度均方F值P值显著性模型4.62 90.513 643.83<0.000 1∗∗A-发酵时间2.2212.22189.07<0.000 1∗∗B-接种量0.211 310.211 318.030.003 8∗∗C-发酵温度0.021 010.021 01.790.222 4AB0.180 610.180 615.410.005 7∗∗AC0.108 910.108 99.290.018 6∗BC0.050 610.050 64.320.076 2A21.2911.29109.69<0.000 1∗∗B20.000 110.000 10.009 00.927 1C20.451 610.451 638.540.000 4∗∗残差0.082 070.011 7失拟误差0.039 030.013 01.210.413 8纯误差0.043 040.010 8总结4.7016
注:**表示差异极显著(P<0.01);*表示差异显著(P<0.05),下同。
响应面回归模型具有极显著性(P<0.01),而失拟项无显著性(P>0.05),可用来分析乳酸菌发酵的乳酸含量变化。用二次回归方程拟合上述结果,得到乳酸含量对自变量发酵时间(A)、接种量(B)和发酵温度(C)的回归方程为:Y=7.12+0.526 3A+0.162 5B-0.051 3C-0.212 5AB-0.165 0AC+0.112 5BC-0.552 5A2-0.005B2-0.327 5C2,以乳酸含量为响应值的回归方程的系数表明,一次项系数A、B显著,而C不显著,交互项系数AB、AC显著,BC不显著,二次项系数A2、C2显著,B2不显著,乳酸含量的影响为A(发酵时间)>B(接种量)>C(发酵温度)。
α-葡萄糖苷酶抑制活性方差分析及显著性检验结果如表3所示。响应面回归模型具有极显著性(P<0.01),而失拟项无显著性(P>0.05),可用来分析乳酸菌发酵枸杞汁的α-葡萄糖苷酶抑制活性变化。用二次回归方程拟合上述结果,得到α-葡萄糖苷酶抑制活性对自变量发酵时间(A)、接种量(B)和发酵温度(C)的回归方程为:Y=53.20+0.625 0A-0.875 0B+2.25C-10AB-4.75AC+6.25BC-13.1A2-10.6B2-7.35C2,以α-葡萄糖苷酶抑制活性为响应值的回归方程的系数表明,一次项系数C显著,而A、B不显著,交互项系数AB、AC、BC均显著,二次项系数A2、B2、C2均显著,α-葡萄糖苷酶抑制活性的影响为C(发酵温度)>B(接种量)>A(发酵时间)。
表3 α-葡萄糖苷酶抑制活性回归模型方差分析
Table 3 Analysis of variance for regression modelling of α-glucosidase inhibitory activity
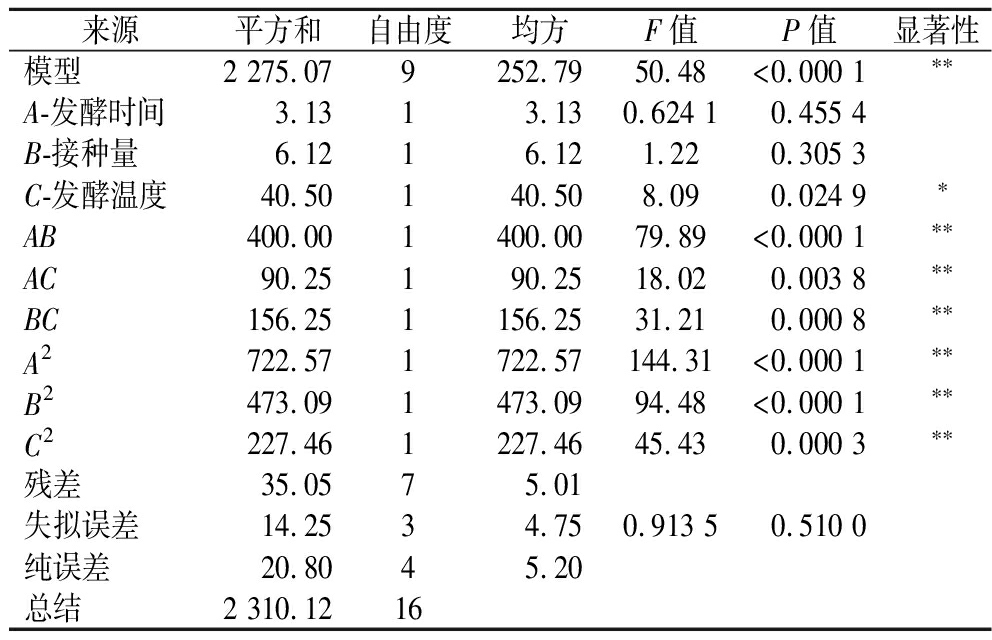
来源平方和自由度均方F值P值显著性模型2 275.079252.7950.48<0.000 1∗∗A-发酵时间3.1313.130.624 10.455 4B-接种量6.1216.121.220.305 3C-发酵温度40.50140.508.090.024 9∗AB400.001400.0079.89<0.000 1∗∗AC90.25190.2518.020.003 8∗∗BC156.251156.2531.210.000 8∗∗A2722.571722.57144.31<0.000 1∗∗B2473.091473.0994.48<0.000 1∗∗C2227.461227.4645.430.000 3∗∗残差35.0575.01失拟误差14.2534.750.913 50.510 0纯误差20.8045.20总结2 310.1216
各因素两两的交互作用对发酵枸杞汁α-葡萄糖苷酶抑制率的影响如图11所示。随着各因素水平的不断增加,发酵枸杞汁α-葡萄糖苷酶抑制活性均呈现先增加后降低的趋势,说明两两交互的效果显著。
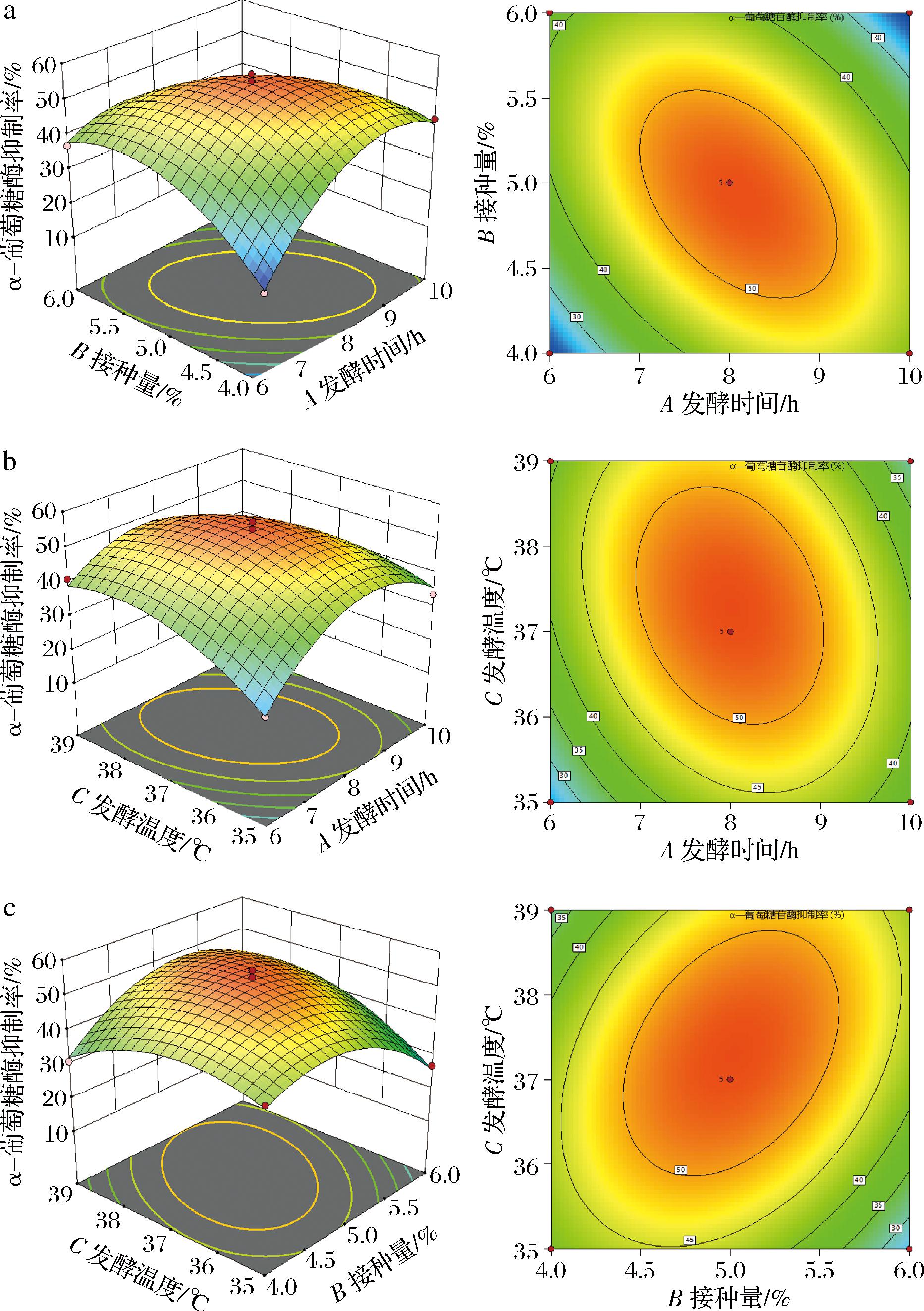
a-发酵时间与接种量;b-发酵时间与温度;c-接种量与发酵温度
图11 发酵时间、接种量、发酵温度三者对α-葡萄糖苷酶抑制率影响的响应面及等高线图
Fig.11 Response surface and contour plots of the effect of fermentation time, inoculum amount, and fermentation temperature on the inhibition rate of α-glucosidase
通过响应面结果分析得到副干酪乳酪杆菌发酵枸杞汁的最佳工艺条件为:发酵时间8.54 h,接种量4.91%,发酵温度36.87 ℃,在此条件下得到的乳酸含量预测值为7.22 g/L,α-葡萄糖苷酶抑制率达52.60%。为检验理论计算结果的准确性,便于实践,固将最佳发酵工艺的条件调整为发酵时间9 h,接种量5%,发酵温度37 ℃。在此优化条件下进行平行试验,结果得到乳酸含量为7.61 g/L,α-葡萄糖苷酶抑制率为56.00%。实验结果表明,采用响应面法确定的发酵工艺是可行的。
2.4 副干酪乳酪杆菌发酵枸杞汁理化指标及营养成分的测定
以未发酵枸杞汁作为对照,对比发酵前后各物质含量的差别,结果见表4。
表4 副干酪乳酪杆菌发酵枸杞汁理化性质及营养成分
Table 4 Physicochemical properties and nutritional composition of L.paracasei fermented goji berry juice

理化性质及营养成分未发酵枸杞汁已发酵枸杞汁pH4.634.33活菌数/(CFU/mL)02×108乳酸含量/(g/L)7.05±0.267.61±0.06∗可溶性固形物/%13.20±0.1412.80±0.18∗多酚含量/(mg/mL)1.59±0.011.68±0.04总黄酮含量/(mg/mL)0.22±0.020.29±0.01∗多糖含量/(mg/mL)38.34±0.3440.41±0.23∗可溶性蛋白含量/(mg/mL)0.35±0.040.325±0.01
注:*代表与未发酵枸杞汁差异显著(P<0.05)。
与未发酵枸杞汁作对比可知其乳酸含量显著升高(P<0.05),pH值下降,说明乳酸菌能够充分利用糖类物质发酵产酸,具有较好的发酵能力[27];可溶性固形物显著降低(P<0.01),多糖含量显著升高(P<0.05),这可能是由于发酵9 h,此时还处在乳酸菌的发酵前期,乳酸菌会将蔗糖分解为果糖和葡萄糖,且分解速度高于消耗糖的速度所导致[28]。可溶性蛋白含量始终低于1 mg/mL,这可能是由于在微生物的生长代谢过程中,可溶性蛋白会与纤维素、脂肪等发生结合,生成不溶于水的物质,从而在离心时发生流失,此外,因为环境酸度的增加,还会使可溶性蛋白水解为多肽和氨基酸[29]。多酚含量增加,但无显著差异,总黄酮含量显著升高(P<0.05),这与姜瑞[30]研究结果一致。
2.5 副干酪乳酪杆菌发酵枸杞汁体外抗氧化及体外降血糖能力分析
2.5.1 副干酪乳酪杆菌发酵枸杞汁体外抗氧化能力分析
由图12-a可知,稀释倍数与DPPH自由基的清除率呈反比关系,稀释不同倍数的发酵枸杞汁对DPPH自由基的清除率较发酵前均显著提高(P<0.05),稀释10倍可达到92.3%,稀释15倍达到91.22%,与未发酵枸杞汁相比显著增加4.35%(P<0.01)。由图12-b可知,稀释倍数与ABTS阳离子自由基的清除率呈反比关系,稀释不同倍数的发酵枸杞汁在发酵后对ABTS阳离子自由基的清除率均显著提高(P<0.05),且稀释20倍达到85.05%,与未发酵枸杞汁相比显著增加42.74%(P<0.05)。由图12-c可知,稀释不同倍数的发酵枸杞汁在发酵后对羟自由基的清除率均显著提高(P<0.05),稀释10倍最高可达到95.84%。

a-DPPH自由基清除率;b-ABTS阳离子自由基清除率;c-羟自由基清除率
图12 副干酪乳酪杆菌发酵枸杞汁体外抗氧化能力
Fig.12 In vitro antioxidant capacity of L.paracasei fermented goji berry juice
注:*表示与未发酵枸杞汁相比差异显著(P<0.05),**表示与未发酵枸杞汁相比差异极显著(P<0.01)。
结果表明发酵后提高了枸杞汁的体外抗氧化能力,这可能是由于乳酸菌发酵后产生的一些糖苷酶去除基化酚类化合物,使得抗氧化性增强,还可能是由于产品本身含有的多酚、黄酮等物质起到了一定的协同作用,从而使产品在发酵后抗氧化性显著增强[31]。
2.5.2 α-葡萄糖苷酶抑制活性分析
如图13所示,以未发酵枸杞汁、副干酪乳酪杆菌菌液作对比,测定发酵枸杞汁对α-葡萄糖苷酶的抑制活性,结果表明,副干酪乳酪杆菌菌液对α-葡萄糖苷酶抑制活性达到6.33%,未发酵枸杞汁对α-葡萄糖苷酶抑制活性达到43%,发酵枸杞汁对α-葡萄糖苷酶抑制活性可达到56%,与未发酵枸杞汁相比显著提高了30.23%(P<0.05)。这可能是在枸杞汁发酵过程中产生了能降低血糖的物质,如有机酸、酶系等,从而提高了发酵枸杞汁对α-葡萄糖苷酶的抑制能力,但具体是代谢的哪些物质起到关键作用,还需要后续进一步的研究。
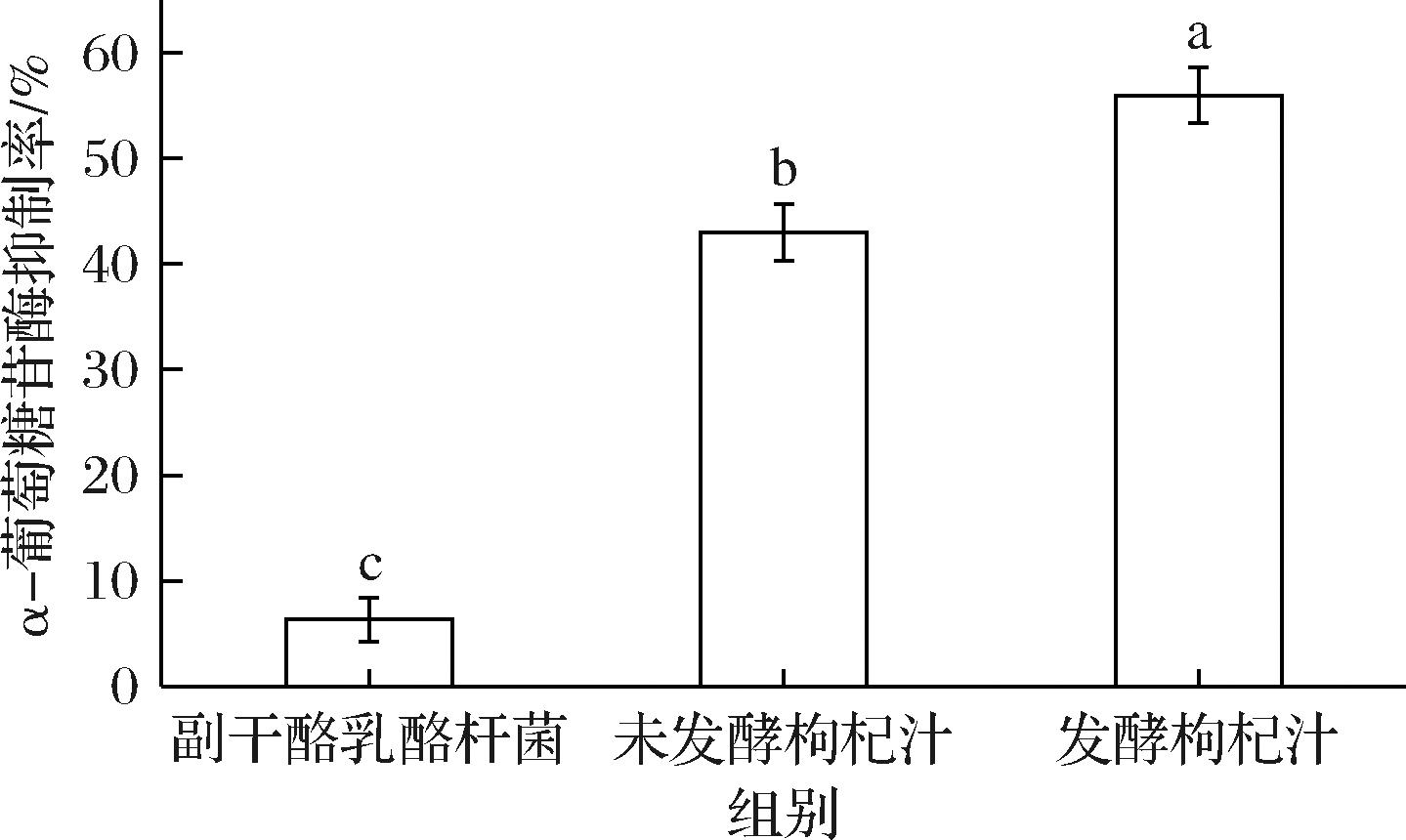
图13 α-葡萄糖苷酶抑制活性测定
Fig.13 Measurement of α-glucosidase inhibitory activity
3 结论
本研究以宁夏枸杞为实验原料,通过益生菌的发酵特性及体外降血糖能力优选出副干酪乳酪杆菌作为发酵枸杞汁的最适菌株,以乳酸含量及对α-葡萄糖苷酶的抑制率为指标优化发酵工艺,确定了发酵枸杞汁的最佳发酵工艺为发酵时间9 h、接种量5%、发酵温度37 ℃,并对副干酪乳酪杆菌发酵枸杞汁的体外降血糖及抗氧化活性进行了研究。在最优条件下发酵的枸杞汁与发酵前相比,多酚含量增加5.66%,总黄酮含量显著提高31.81%,同时,体外抗氧化及体外降血糖能力也有较大程度的提高,DPPH自由基的清除率显著提高,稀释10倍可达到92.3%,ABTS阳离子自由基的清除率稀释20倍时可达到85.05%,显著提高42.74%,羟自由基的清除率显著提高,稀释10倍可达到95.84%;同时对α-葡萄糖苷酶抑制率显著提高了30.23%,达到56.00%。综上所述,经过益生菌发酵后可以提高枸杞汁的体外抗氧化及降血糖能力,从而在一定程度上改善枸杞汁的营养价值及功能,对于起到提高体外抗氧化及降血糖作用的具体代谢物质还需要进一步研究。
[1] 张雪燕,戴瑜婷,王艺璇,等.枸杞化学成分和药理作用研究进展及质量标志物的预测分析[J].中华中医药学刊,2024,42(1):174-183;260.
ZHANG X Y, DAI Y T, WANG Y X, et al.Progress of chemical composition and pharmacological effects of Lycium barbarum and prediction analysis of quality markers[J].Chinese Journal of Traditional Chinese Medicine,2024,42(1):174-183;260.
[2] 杨永利, 明磊国, 林浩, 等.枸杞养肝明目功效研究进展[J].中国食物与营养, 2015, 21(7):75-78.
YANG Y L, MING L G, LIN H, et al.Research progress of liver and eyesight function of wolfberry[J].Food and Nutrition in China, 2015, 21(7):75-78.
[3] HASHEMI S M B, MOUSAVI KHANEGHAH A, BARBA F J, et al.Fermented sweet lemon juice (Citrus limetta) using Lactobacillus plantarum LS5:Chemical composition, antioxidant and antibacterial activities[J].Journal of Functional Foods, 2017, 38:409-414.
[4] 黄宁馨, 鲁群, 丁士勇, 等.复合乳酸菌发酵过程中枸杞果汁品质及抗氧化活性变化[J].华中农业大学学报, 2021, 40(6):186-194.
HUANG N X, LU Q, DING S Y, et al.Changes in quality and antioxidant activity of Goji juice during fermentation of compound lactic acid bacteria[J].Journal of Huazhong Agricultural University, 2021, 40(6):186-194.
[5] 刘予煊, 程焕, 叶兴乾, 等.不同菌株发酵枸杞汁中生物活性物质与香气组成物质含量变化[J].浙江农业学报, 2020, 32(3):499-509.
LIU Y X, CHENG H, YE X Q, et al.Changes of bioactive compounds and volatile compounds contents in goji juice fermented by different probiotics[J].Acta Agriculturae Zhejiangensis, 2020, 32(3):499-509.
[6] 李旭阳, 潘琳, 刘慧燕, 等.基于响应面法的瑞士乳杆菌NXU_19022发酵枸杞汁工艺优化[J].农业科学研究, 2022, 43(2):1-6.
LI X Y, PAN L, LIU H Y, et al.Optimization of fermentation process of goji berry juice by Lactobacillus helveticus NXU_19022 based on RSM[J].Journal of Agricultural Sciences, 2022, 43(2):1-6.
[7] 乔博鑫, 邢紫娟, 郭红莲.乳酸菌发酵枸杞过程中理化指标及风味物质的变化[J].食品工业科技, 2019, 40(9):6-12.
QIAO B X, XING Z J, GUO H L.Changes of physicochemical indexes and flavor components in the fermentation process of Lycium barbarum by lactic acid bacteria[J].Science and Technology of Food Industry, 2019, 40(9):6-12.
[8] SAEEDI P, PETERSOHN I, SALPEA P, et al.Global and regional diabetes prevalence estimates for 2019 and projections for 2030 and 2045:Results from the International Diabetes Federation Diabetes Atlas, 9th edition[J].Diabetes Research and Clinical Practice, 2019, 157:107843.
[9] ZHOU T T, XU X, DU M F, et al.A preclinical overview of metformin for the treatment of type 2 diabetes[J].Biomedicine &Pharmacotherapy, 2018, 106:1227-1235.
[10] WANG H, DU Y J, SONG H C.α-Glucosidase and α-amylase inhibitory activities of guava leaves[J].Food Chemistry, 2010, 123(1):6-13.
[11] 孙永进. 西番莲果皮多糖的纯化、结构表征及体外降脂活性研究[D].桂林:桂林理工大学, 2023.
SUN Y J.Purification, structural characterization and in vitro hypolipidemic activity of passion flower pericarp polysaccharides[D].Guilin:Guilin University of Technology, 2023.
[12] 冯诗华. 绿球藻多糖的抗氧化、抗炎及体外降糖降脂活性探究[D].太原:山西大学, 2023.
FENG S H.Study on antioxidant, anti-inflammatory and hypoglycemic and lipid-lowering activities of green algae polysaccharide in vitro[D].Taiyuan:Shanxi University, 2023.
[13] 曹英, 侯敏, 易光平, 等.驼乳制品中抑制α-淀粉酶和α-葡萄糖苷酶活性乳酸菌的筛选及益生特性研究[J].食品工业科技, 20, 43(19):191-201.
CAO Y, HOU M, YI G P, et al.Screening of lactic acid bacteria with α-amylase and α-glucosidase inhibiting activities in camel milk products and study of their probiotic properties[J].Food Industry Science and Technology, 20, 43(19):191-201.
[14] YE M, LIU C, CHEN S, et al.Screening of strains with potential hypoglycemic effect and its application in fermented garlic production[J].Systems Microbiology and Biomanufacturing, 2023(3):602-614.
[15] 王玉洁. 金银花绿原酸和总黄酮同步提取工艺及其体外降糖活性研究[D].哈尔滨:黑龙江东方学院, 2022.
WANG Y J.Study on the simultaneous extraction process of chlorogenic acid and total flavonoids from Honeysuckle and its in vitro hypoglycemic activity[D].Harbin:Heilongjiang Dongfang College, 2022.
[16] 张小龙, 吴斌霞, 朱钊宇, 等.山栀子不同部位活性成分含量及抗氧化活性[J].食品工业科技,2024,45(12):10-17.
ZHANG X L, WU B X, ZHU Z Y, et al.Content of active ingredients and antioxidant activity of different parts of Gardenia jasminoides[J].Food Industry Science and Technology,2024,45(12):10-17.
[17] 李汶轩. 高O2处理调控采后冬枣果实贮藏品质及生理特性的研究[D].杭州:浙江大学, 2022.
LI W X.Research on the storage quality and physiological characteristics of post-harvest winter jujube fruit regulated by high O2treatment[D].Hangzhou:Zhejiang University, 2022.
[18] 贺莹, 刘苗苗, 庞晓婷, 等.酿酒酵母发酵降解银杏叶多糖组分分析及活性研究[J].中国饲料,2024(1):135-140.
HE Y, LIU M M, PANG X T, et al.Analysis and activity of polysaccharides from Ginkgo biloba degraded by Saccharomyces cerevisiae[J].China Feed,2024(1):135-140.
[19] 黄宁馨. 复合乳酸菌发酵枸杞汁的工艺优化及其营养品质变化研究[D].武汉:华中农业大学, 2021.
HUANG N X.Optimization of fermentation process of Lycium barbarum juice by lactic acid bacteria and its nutritional quality changes[D].Wuhan:Huazhong Agricultural University, 2021.
[20] 郭畅, 李超, 侯明明, 等.荔枝草多糖的提取工艺优化及其体外抗氧化、降血糖活性分析[J].食品工业科技, 2022, 43(20):211-219.
GUO C, LI C, HOU M M, et al.Optimization of extraction process and in vitro analysis of antioxidant and hypoglycemic activities of Litchi chinensis[J].Food Industry Science and Technology, 2022, 43(20):211-219.
[21] 田欢, 申雪, 阿卜杜热合曼布海丽且姆, 等.不同干燥方式对黑木耳质构及多糖抗氧化活性的影响[J].发酵科技通讯, 2023, 52(3):151-157.
TIAN H, SHEN X, ABDU Zheheman Buhaili Zem, et al.Effects of different drying methods on the texture and antioxidant activity of polysaccharides in black fungus[J].Fermentation Science and Technology Newsletter, 2023, 52(3):151-157.
[22] 郑亚平, 王均豪, 王晨晨, 等.植物乳植杆菌J26高密度发酵工艺优化及其发酵豆乳的应用[J].现代食品科技,2024,40(10):154-164.
ZHENG Y P, WANG J H, WANG C C, et al.Optimization of high-density fermentation process of Lactobacillus plantarum J26 and its application to fermentation of soybean milk[J].Modern Food Science and Technology,2024,40(10):154-164.
[23] 赵小茜, 魏旭丹, 陈戴玲, 等.乳酸菌耐酸耐胆盐机制研究进展[J].乳业科学与技术, 2017, 40(3):33-36.
ZHAO X X, WEI X D, CHEN D L, et al.A review on the mechanism of acid and bile salt resistance of lactic acid bacteria[J].Journal of Dairy Science and Technology, 2017, 40(3):33-36.
[24] HUANG Y, ADAMS M C.In vitro assessment of the upper gastrointestinal tolerance of potential probiotic dairy propionibacteria[J].International Journal of Food Microbiology, 2004, 91(3):253-260.
[25] WANG X W, HAN M Z, ZHANG M N, et al.In vitro evaluation of the hypoglycemic properties of lactic acid bacteria and its fermentation adaptability in apple juice[J].LWT, 2021, 136:110363.
[26] 曾珠, 陈艳玲, 陈尚武.具有α-葡萄糖苦酶抑制活性的益生乳酸菌筛选[J].农业机械学报, 2020, 51(11):349-356.
ZENG Z, CHEN Y L, CHEN S W.Screening for potential probiotic lactic acid bacteria strains based on α-glucosidase inhibitory activity[J].Transactions of the Chinese Society for Agricultural Machinery, 2020, 51(11):349-356.
[27] 胡明珍. 副干酪乳杆菌NXU-19004发酵枸杞汁的条件优化及其对小鼠便秘的改善作用研究[D].银川:宁夏大学, 2021.
HU M Z.Optimization of conditions for fermentation of Lycium barbarum juice by Lactobacillus paracasei NXU-19004 and its ameliorative effect on constipation in mice[D].Yinchuan:Ningxia University, 2021.
[28] YANG X X, ZHOU J C, FAN L Q, et al.Antioxidant properties of a vegetable-fruit beverage fermented with two Lactobacillus plantarum strains[J].Food Science and Biotechnology, 2018, 27(6):1719-1726.
[29] 伍娟, 曾晓娇, 程宇, 等.乳酸菌发酵提高麦胚可溶性蛋白和总酚含量及抑制脂质体氧化能力的研究[J].食品工业科技, 2016, 37(6):233-238.
WU J, ZENG X J, CHENG Y, et al.Study on using lactic acid bacteria improve the content of soluble protein and total phenol of wheat germ and its ability to inhibit oxidation of liposome[J].Science and Technology of Food Industry, 2016, 37(6):233-238.
[30] 姜瑞. 蓝莓枸杞发酵果汁的研制及其功能性评价[D].哈尔滨:东北农业大学, 2021.
JIANG R.Development of blueberry wolfberry fermented juice and its functional evaluation[D].Harbin:Northeast Agricultural University, 2021.
[31] 王辉, 钟海旦, 白卫东, 等.番茄木瓜复合益生菌饮料发酵工艺优化及其抗氧化性[J].农产品加工, 2021(3):33-37;44.
WANG H, ZHONG H D, BAI W D, et al.Optimization of fermentation technology and antioxidation of tomato and Papaya compound probiotic beverage[J].Farm Products Processing, 2021(3):33-37;44.