酵母β-葡聚糖是一种天然生物聚合物,具有很好的免疫调节活性[1],由β-(1,3)-D-葡聚糖主链和β-(1,6)-D-葡聚糖侧链组成,由于其无毒性和生物降解性,在食品和生物医学领域受到了极大的关注[2]。研究表明酵母β-葡聚糖具有许多有用的生物活性,如能激活宿主的免疫系统,通过巨噬细胞、自然杀伤细胞和杀伤性T细胞发挥抗肿瘤作用[3],以及通过免疫调节参与先天免疫反应的细胞,发挥抗炎作用[4],并作为膳食纤维抑制胆固醇吸收[5]。然而,分子内多羟基相互作用形成致密的三螺旋结构,分子间氢键作用形成聚集体,导致其在水和部分有机溶剂(如乙醇)中不溶,从而严重限制了其生物医学应用[6]。因此提高酵母β-葡聚糖的水溶性显得尤为重要。
国内外学者通过物理降解及酶解等方法降低多糖分子质量或通过磺化、羧甲基化等化学改性法提高其溶解性,但以上方法往往存在产率低、反应条件剧烈或提纯步骤复杂等缺点。此前,本课题组在开展相关实验时发现,酵母β-葡聚糖经二甲基亚砜(dimethyl sulfoxide,DMSO)加热溶解后,用乙醇沉淀,沉淀物可溶于水。本文以市售酿酒酵母细胞壁为原料,通过高温浸提、碱法除杂提取碱不溶性酵母β-葡聚糖,通过DMSO加热溶解乙醇沉淀制备了水溶性酵母β-D-葡聚糖(water-soluble yeast β-D-glucan,WSYG),并用响应面法优化其制备工艺条件,利用色谱、红外光谱及原子力显微镜对其结构进行表征,并进一步评价了其体外活性。
1 实验部分
1.1 试剂与仪器
酿酒酵母细胞壁粉,大湾云商;DMSO,上海麦克林生化公司;无水乙醇,天津基准化学试剂有限公司;刚果红,合肥博美生物科技公司;邻苯三酚,生工生物工程(上海)股份有限公司;DPPH试剂,TCI(上海)化成工业发展有限公司;α-淀粉酶,北京索莱宝科技有限公司;α-葡萄糖苷酶、4-硝基苯基-β-D-吡喃葡萄糖苷(4-nitrophenyl-β-D-glucopyranoside,pNPG),北京酷尔化学有限公司。
GI54DS高压灭菌锅,厦门致微仪器有限公司;EPOCH 2酶标仪,美国伯腾仪器有限公司;Spectrum Two型傅里叶红外光谱仪,珀金埃尔默仪器有限公司;MultiMode 8原子力显微镜,美国布鲁克。
1.2 碱不溶酵母β-葡聚糖粗品的制备
参考刘琛仪等[7]的方法处理酵母细胞壁粉,离心后收集沉淀,加入40 g/L NaOH溶液混合均匀(料液比1∶20,g∶mL),60 ℃水浴加热4 h;随后室温下离心3次,过筛(100目),离心,收集沉淀,冻干,得碱不溶酵母β-葡聚糖粗品。
1.3 WSYG的制备
1.3.1 WSYG的制备工艺
参考曹桦强等[8]的方法取一定量粗多糖溶于10 g/L 的DMSO溶液,90 ℃水浴加热一定时间;12 000 r/min离心30 min,收集上清液;往上清液中加入一定体积的乙醇,醇沉过夜;4 ℃、8 000 r/min离心30 min,弃去上清液,所得醇沉物复溶后振荡混合均匀;离心,收集上清液,得酵母β-葡聚糖水溶液,将得到的酵母β-葡聚糖水溶液放入透析袋(3 500 Da),蒸馏水透析2 d,抽滤,收集液体冷冻干燥,得WSYG,WSYG得率与产率计算公式(1)、公式(2)如下:
WSYG得率![]()
(1)
WSYG产率![]()
(2)
配制适当浓度的WSYG溶液,测其总糖含量(苯酚-硫酸法[9])和还原糖含量(DNS法[10])。多糖含量按公式(3)计算:
多糖含量![]()
(3)
1.3.2 单因素实验
准确称取100.0 mg粗多糖溶于10 mL DMSO溶液,在固定DMSO体积分数为90%、乙醇体积分数为90%、乙醇溶液与DMSO溶液的体积比为4∶1、加热时间为150 min的基础上进行单因素试验,研究DMSO体积分数(50%、60%、70%、80%、90%、100%)、乙醇体积分数(50%、60%、70%、80%、90%、100%)、乙醇与DMSO的体积比(1∶1、2∶1、3∶1、4∶1、5∶1、6∶1)和加热时间(30、60、90、120、150、180 min)对WSYG多糖得率的影响。
1.3.3 响应面法优化WSYG制备工艺
根据单因素实验的结果,对DMSO体积分数(A)、乙醇体积分数(B)和乙醇与DMSO的体积比(C)进行三因素三水平的响应面实验,具体考察因素及水平见表1。
表1 响应面试验因素与水平设计
Table 1 Factors and levels of response surface experiment
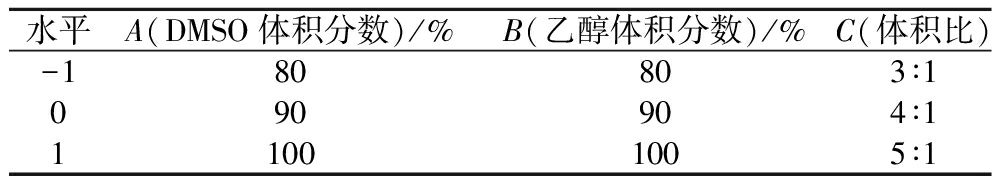
水平A(DMSO体积分数)/%B(乙醇体积分数)/%C(体积比)-180803∶1090904∶111001005∶1
1.3.4 分子质量测定
采用高效凝胶渗透色谱法测定WSYG的分子质量,以不同分子质量的葡聚糖标准品保留时间绘制标准曲线,色谱条件:凝胶柱为Shodex OHpak SB-805 HQ排阻色谱柱,流动相为0.01 mol/L NaNO3溶液,流速0.6 mL/min,进样量20 μL,柱温30 ℃,示差折光检测器。
1.3.5 单糖组成
参考杜镇等[11]的方法采用气相色谱法测定。
1.3.6 红外光谱
取适量WSYG样品,在4 000~500 cm-1波数范围内进行红外光谱扫描。
1.3.7 原子力显微镜观察
取适量碱不溶性酵母β-葡聚糖粗品溶于体积分数80% DMSO溶液,80 ℃加热30 min,冷却后抽滤,再将溶液稀释到0.02 mg/mL(YG溶液)。将WSYG溶于蒸馏水中,配成0.2 mg/mL的溶液,充分混匀后将样品稀释到0.02 mg/mL备用。分别取10 μL YG溶液和WSYG溶液滴在新制的云母片上,待自然干燥后在原子力显微镜下观察。
1.3.8 刚果红实验
配制1.0 mg/mL的WSYG溶液与80 μmol/L的刚果红溶液,各取1 mL振荡混合均匀,再加入NaOH溶液(1 mol/L),使得整个体系中的NaOH浓度梯度为0~0.5 mol/L,混合均匀后,检测混合液在400~600 nm范围内的最大吸收波长。
1.3.9 体外抗氧化、降血糖活性研究
参考王丽霞等[12]的方法测定超氧阴离子自由基(·O2-)清除能力:配制不同质量浓度WSYG和维生素C溶液。取5.7 mL 6 mmol/L Tris-HCl缓冲液(pH 6.8)加入试管,依次加入不同样液各2 mL,37 ℃水浴20 min后,再加入0.1 mL 6 mmol/L邻苯三酚溶液,混匀,37 ℃水浴,6 min后加入1 mL 0.1 mol/L HCl溶液终止反应,测定其在320 nm处吸光值。每个样品试验3次,取平均值,按公式(4)计算:
·O2-清除率![]()
(4)
式中:A样品,样品与邻苯三酚混合溶液的OD值;A0,蒸馏水同邻苯三酚混合溶液的OD值;A对照,样品同蒸馏水混合溶液OD值。
参考刘春阳等[13]的方法测定DPPH自由基清除能力:配制浓度为0.1 mmol/L的DPPH醇溶液和不同质量浓度的WSYG溶液和维生素C溶液。取试管依次加入2 mL DPPH溶液后再加入2 mL不同浓度的WSYG溶液摇匀,避光反应30 min,测定其在517 nm处的吸光度值。每个样品试验3次,取平均值,按公式(5)计算:
DPPH自由基清除率![]()
(5)
式中:A样品,样品与DPPH混合溶液OD值;A0,蒸馏水同DPPH混合溶液OD值;A对照,样品同蒸馏水混合溶液OD值。
参考CAO等[14]的方法测定α-淀粉酶抑制活性:用PBS溶液配制不同质量浓度的WSYG溶液、α-淀粉酶溶液(150 U/L)和10 g/L的可溶性淀粉溶液。向300 μL WSYG溶液里加入同体积的α-淀粉酶溶液,混匀后37 ℃水浴,10 min后加入300 μL淀粉溶液,沸水浴15 min,迅速冷却后加入DNS溶液500 μL,混合均匀后再次沸水浴5 min,冷却至室温,加入500 μL蒸馏水,测其在540 nm处的吸光值,阿卡波糖为阳性对照,按公式(6)计算:
α-淀粉酶抑制率![]()
(6)
式中:A样品,样品与α-淀粉酶混合溶液OD值;A对照,样品与PBS混合溶液OD值;A0,PBS与α-淀粉酶混合溶液OD值。
参考XU等[15]的方法测定α-葡萄糖苷酶抑制活性:用PBS配制不同质量浓度的WSYG溶液,α-葡萄糖苷酶溶液(1 U/mL)以及5 mmol/L pNPG溶液。取40 μL多糖溶液加入40 μL α-葡萄糖苷酶溶液,混合均匀后37 ℃水浴,10 min后加入40 μL pNPG溶液,37 ℃水浴,5 min后加入100 μL 1 mol/L Na2CO3溶液终止反应,测其在405 nm处的吸光值,阿卡波糖为阳性对照,按公式(7)计算:
α-葡萄糖苷酶抑制率![]()
(7)
式中:A样品,样品与α-葡萄糖苷酶混合溶液OD值;A对照,样品与PBS混合溶液OD值;A0,PBS与α-葡萄糖苷酶混合溶液OD值。
1.4 数据处理
各项指标进行3次独立重复试验,实验结果以平均值±标准差表示。采用GraphPad Prism 8处理数据、绘制图形并对数据进行ANOVA方差分析,显著水平设为P<0.05,不同的字母表示各组间存在显著差异。
2 结果与分析
2.1 单因素实验结果
加热时间:由图1-a可知,随着加热时间的增加,WSYG的得率逐渐增加,但超过150 min得率并无显著性增加(P>0.05),考虑到效率和生产成本,在后续实验中加热时间确定为150 min。
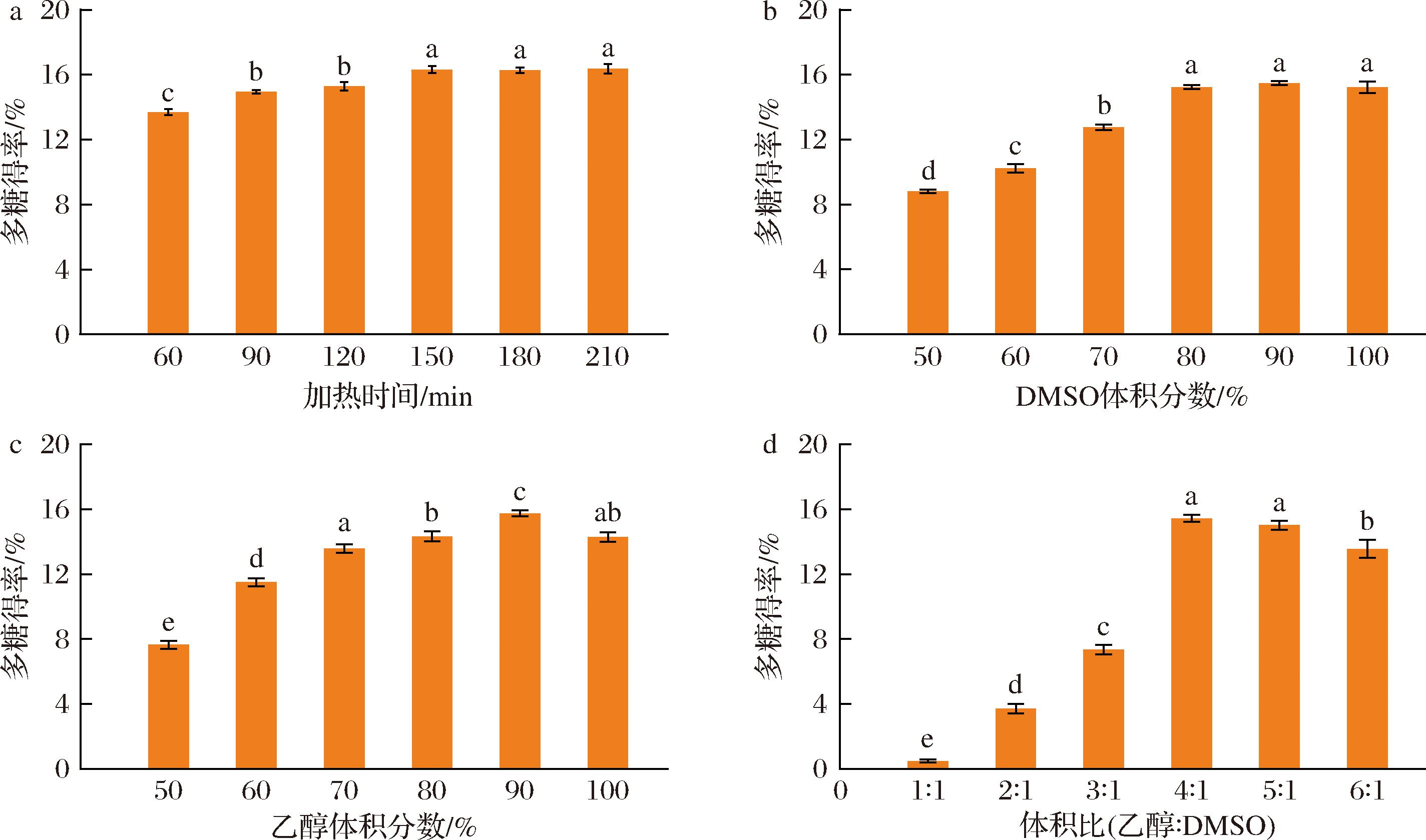
a-加热时间;b-DMSO体积分数;c-乙醇体积分数;d-体积比(乙醇∶DMSO)
图1 不同单因素条件下的WSYG得率
Fig.1 WSYG yield under different single factor conditions
注:图中不同字母表示差异显著(P<0.05)。
DMSO体积分数:由图1-b可知,当DMSO体积分数从50%增加到90%,多糖得率一直上升,在体积分数100%时多糖得率稍有下降,可能因为高浓度的强极性有机溶剂破坏了β-葡聚糖的三螺旋结构中的氢键,使其转变为无规螺旋或柔性单链,利于WSYG的醇沉[6]。因此响应面优化实验的DMSO体积分数选择80%、90%、100%。
乙醇体积分数:由图1-c可知,随着乙醇体积分数的增加,WSYG得率整体呈现先上升再下降的趋势,在90%时多糖得率最大。原因可能是一定范围内的醇沉浓度可以降低多糖的溶解度,利于WSYG的醇沉;当醇浓度过高时,会使某些杂质一起沉淀,降低多糖纯度,从而影响得率[16]。因此响应面优化实验的乙醇体积分数选择80%、90%、100%。
体积比(乙醇∶DMSO):由图1-d可知,随着乙醇与DMSO体积比的增加,WSYG得率先显著上升再下降,说明体积比过小或过大都不利于WSYG醇沉,体积比为4∶1(mL∶mL)时,多糖得率最大,因此响应面优化实验的体积比选择3∶1、4∶1、5∶1(mL∶mL)。
2.2 响应面法实验设计及结果
在单因素实验的基础上,利用BBD模型对工艺参数进行了优化。表2显示了17个3因素3水平试验结果。对实验数据进行多元回归分析,得到多糖得率与各因素关系为:
Y=16.84-0.325A+0.04B+0.717 5C-0.155AB+0.445AC+0.35BC-2.13A2-0.658 5B2-0.893 5C2
表2 响应面试验设计及结果
Table 2 Response surface test design and results
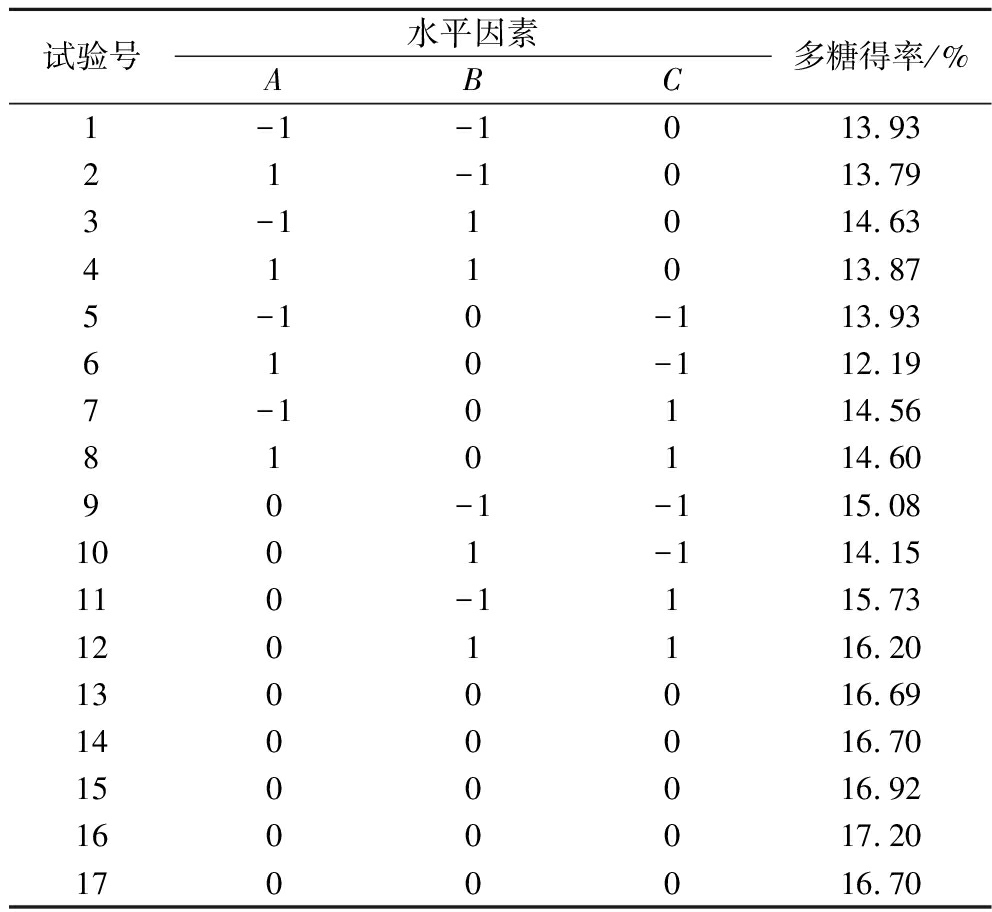
试验号水平因素ABC多糖得率/%1-1-1013.9321-1013.793-11014.63411013.875-10-113.93610-112.197-10114.56810114.6090-1-115.081001-114.15110-1115.731201116.201300016.691400016.701500016.921600017.201700016.70
由表3的方差结果可知,回归模型P<0.000 1,表示该模型极为显著;失拟项不显著(P>0.05),即此模型有效。说明该回归方程能够较好反映实际试验情况,可以利用该模型对WSYG制备的最佳条件进行预测分析。同时,在一次项中,DMSO体积分数(A)与体积比(C)达到显著水平(P<0.05),F(C)>F(A)>F(B),说明影响多糖得率的因素由大到小为:体积比>DMSO体积分数>乙醇体积分数。在平方项中,A2、B2及C2的回归系数均极显著(P<0.01),说明DMSO体积分数、乙醇体积分数及体积比与WSYG多糖得率之间存在着明显的二次关系。在交互项中,AC和BC的回归系数达到显著水平(P<0.05),表明DMSO体积分数与体积比的交互作用与乙醇体积分数与体积比的交互作用对WSYG多糖得率有显著影响。
表3 回归模型方差分析
Table 3 Analysis of variance of the model
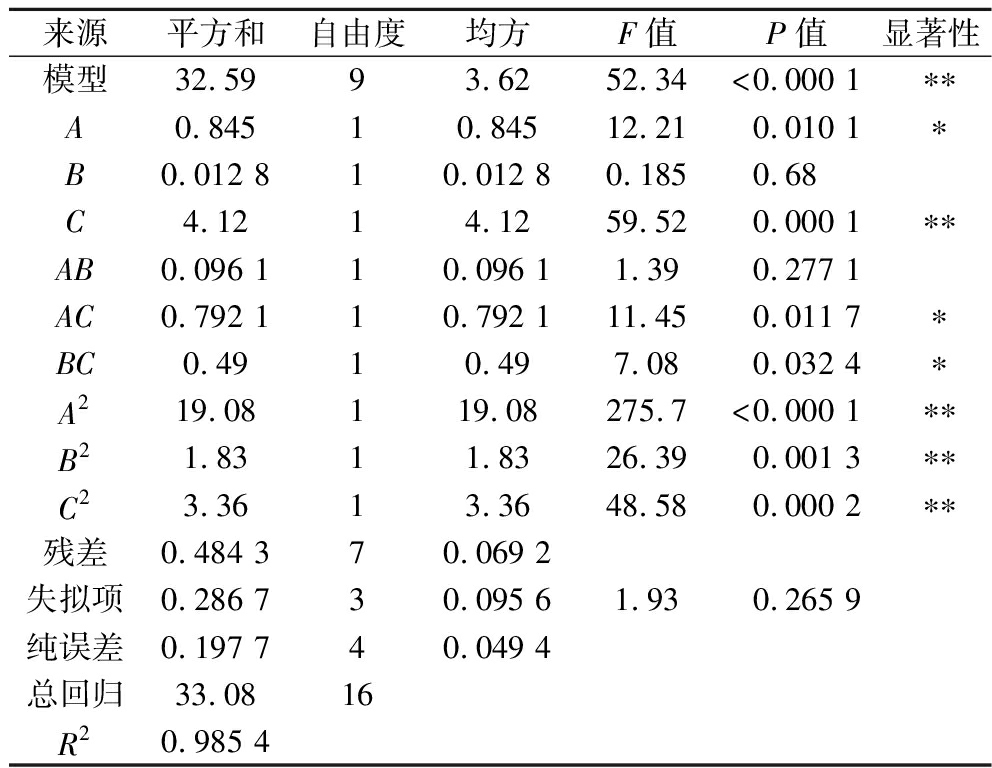
来源平方和自由度均方F值P值显著性模型32.5993.6252.34<0.000 1∗∗A0.84510.84512.210.010 1∗B0.012 810.012 80.1850.68C4.1214.1259.520.000 1∗∗AB0.096 110.096 11.390.277 1AC0.792 110.792 111.450.011 7∗BC0.4910.497.080.032 4∗A219.08119.08275.7<0.000 1∗∗B21.8311.8326.390.001 3∗∗C23.3613.3648.580.000 2∗∗残差0.484 370.069 2失拟项0.286 730.095 61.930.265 9纯误差0.197 740.049 4总回归33.0816R20.985 4
注:*表示P<0.05,差异显著;**表示P<0.01,差异极显著。
在响应面图中,响应值受曲线走势的影响,即曲线走势越陡峭,对多糖得率影响越大,曲线走势越平缓,对多糖得率影响越小[17]。由图2可知,DMSO体积分数与体积比和乙醇体积分数与体积比的交互曲线陡峭,说明这两种交互作用对WSYG得率有较大影响,而DMSO体积分数与乙醇体积分数的交互曲线相对平缓,说明其对WSYG得率影响较弱,与表3方差分析保持一致。
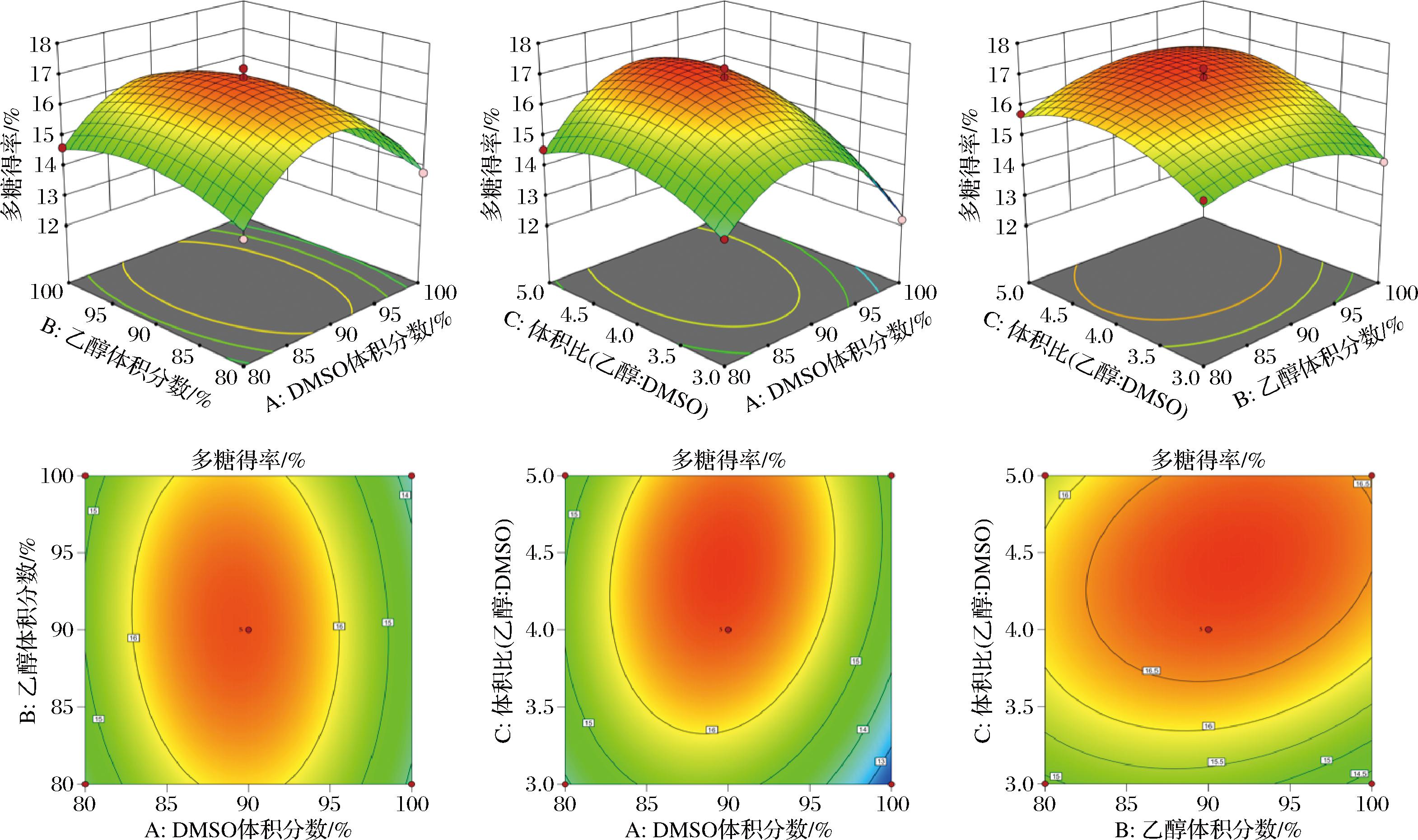
图2 各因素交互作用对WSYG得率影响的响应面和等高线面
Fig.2 Response surfaces and contour surfaces for the effects of factor interactions on WSYG yields
3D响应面图的拟合曲面为凸形说明多糖存在最大得率,进一步对方程求解,得到的最优提取条件为:DMSO体积分数89.63%,乙醇体积分数91.46%,体积比4.42∶1(mL∶mL),预测得率17.00%。为便于实际操作,将得到的最优条件调整为:DMSO体积分数90%,乙醇体积分数91%,体积比4.4∶1(mL∶mL)。采用调整后的条件进行重复验证实验,WSYG得率为(16.38±0.17)%,多糖含量为(96.02±1.37)%,实际得率与理论值接近,说明模型具有良好的拟合性和重复性。
经计算,本法制备WSYG的产率为11.42%,而高洁[18]采用离子液体结合高压微射流法和王寒梅等[19]采用高温高压法制备WSYG的产率分别为11.67%、11.78%,与本法相接近;而ZHENG等[20]采用碱法从粗β-葡聚糖中制备WSYG的得率为12.41%,低于本法得率16.38%,说明DMSO溶解-乙醇沉淀法是制备WSYG简单有效的方法。
2.3 分子质量测定结果
根据葡聚糖标准品的出峰时间与其相应的分子质量绘制标准曲线,得到线性回归方程y=-0.572 7x+12.96,R2=0.992 3。经计算WSYG的相对分子质量为602.56 kDa。
2.4 单糖组成分析
根据6种单糖标准品(D-葡萄糖、D-甘露糖、D-半乳糖、D-核糖、D-果糖、L-阿拉伯糖)的出峰时间,对混合标准样品色谱图的各个样品峰定性,结果如图3所示。将WSYG的出峰时间与标准单糖的出峰时间比对,分析可知WSYG由D-葡萄糖组成。
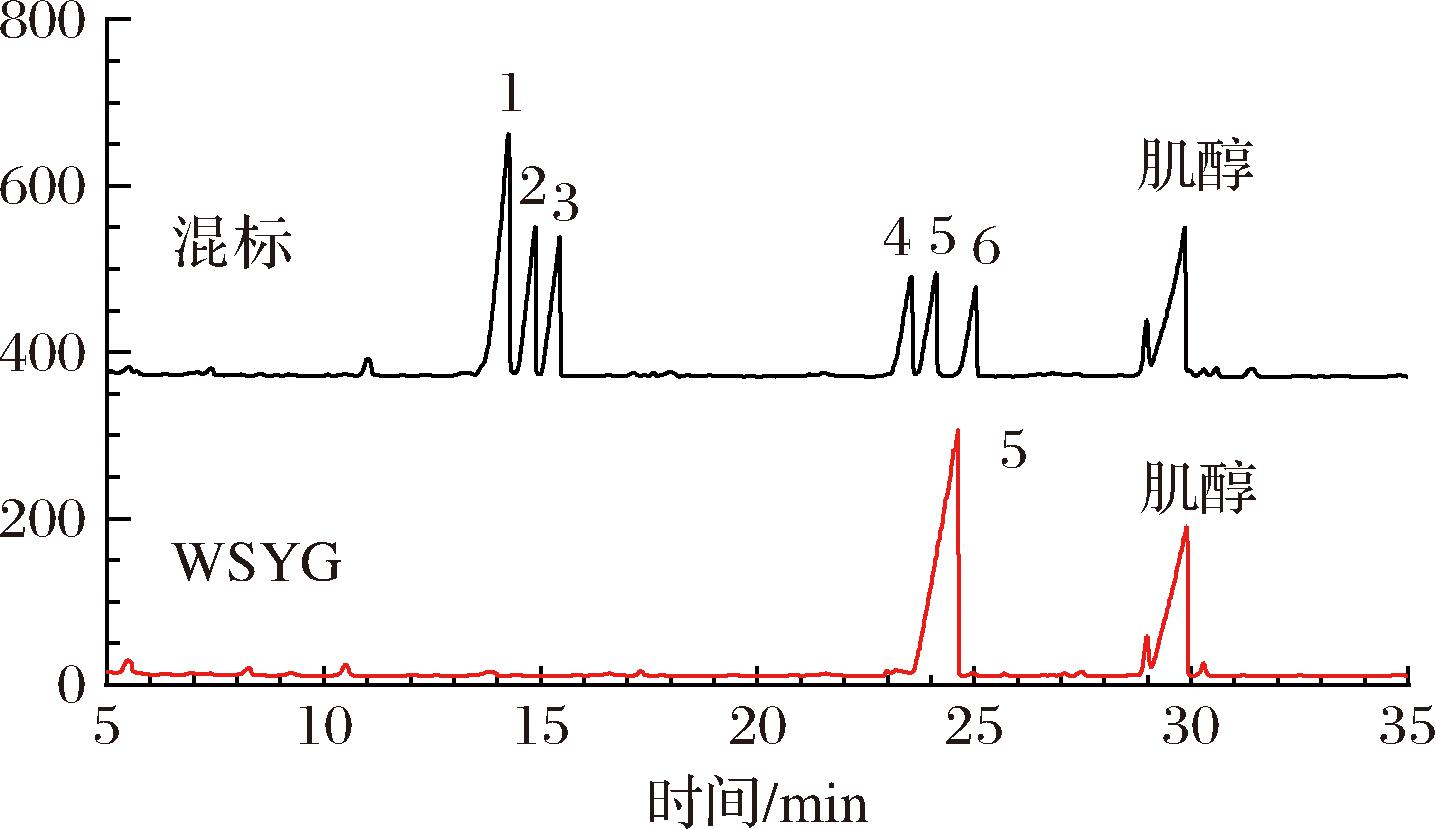
图3 6种标准单糖和WSYG的气相色谱图
Fig.3 Gas chromatogram of six standard monosaccharides and WSYG
注:1-核糖;2-阿拉伯糖;3-果糖;4-甘露糖;5-葡萄糖;6-半乳糖。
2.5 红外光谱分析
如图4所示,3 325 cm-1附近出现的强吸收峰归因于O—H的伸缩振动,而2 927 cm-1附近的吸收峰归因于亚甲基C—H的伸缩振动[21]。1 645 cm-1处的吸收峰是酯羰基的弯曲振动引起的,1 417 cm-1处吸收峰是C—H的变角振动引起的。1 200~1 000 cm-1之间的3个吸收峰表明存在吡喃糖环[22],而893 cm-1处的吸收峰表明WSYG含有β-糖苷键,说明WSYG由β-D-葡萄糖组成。
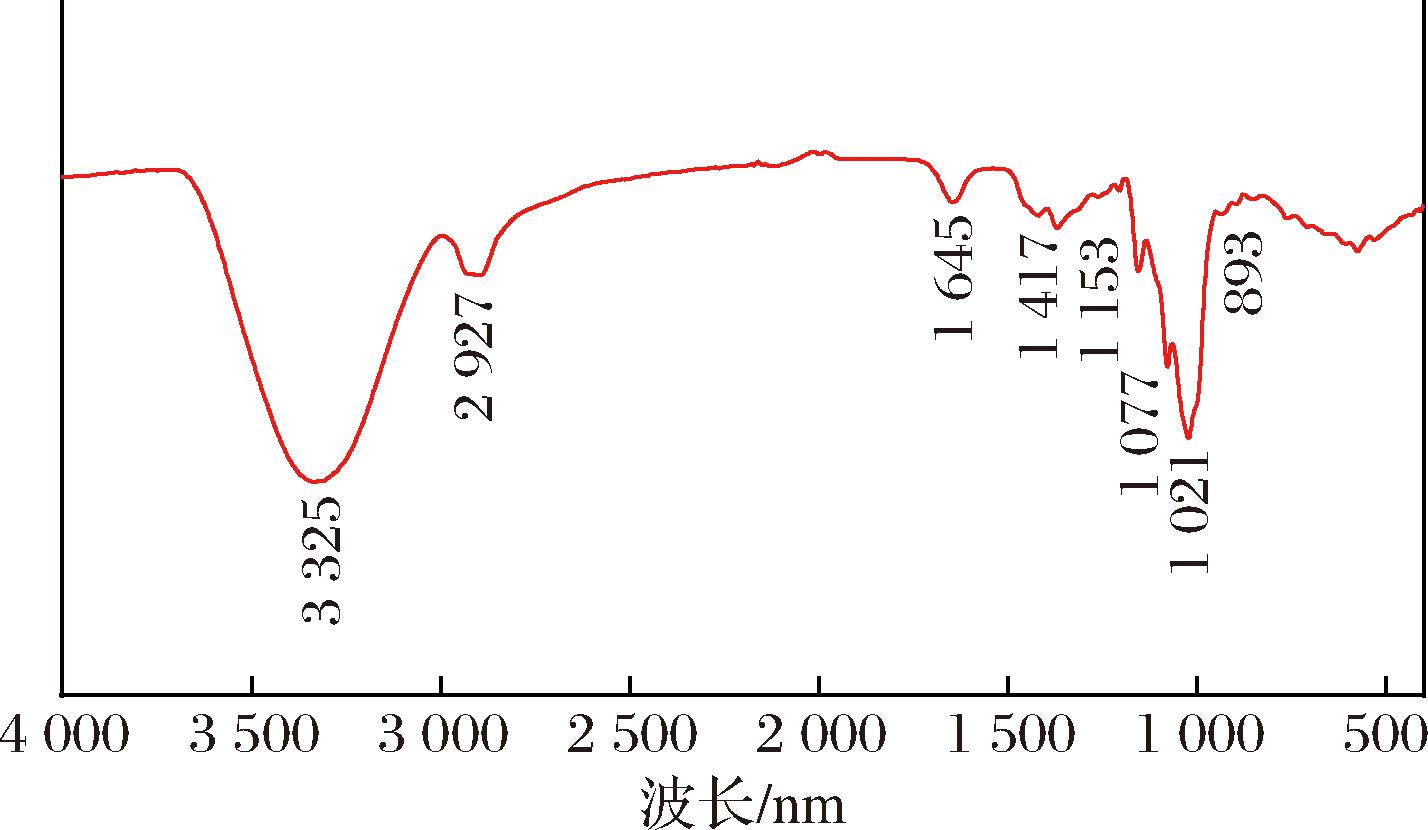
图4 WSYG的红外光谱图
Fig.4 Infrared spectroscopy of WSYG
2.6 原子力显微镜观察结果
原子力显微镜是研究多糖形貌及构象的有力工具,它可以在超纳米级分辨率下观察多糖链的形状、尺寸大小和聚集形态,进而确定多糖构象[23]。如图5所示,视野中YG(图5-a)呈链状,部分有弯曲,WSYG(图5-b)也呈链状结构,但链结构长于YG。此外,两样品中均有少量多糖聚集体存在,呈球状。软件分析显示,YG样品平均高度约为1.5~3.4 nm,WSYG样品平均高度约为0.5~1.0 nm,YG样品平均高度是WSYG样品高度的3倍左右。

a-YG;b-WSYG
图5 酵母葡聚糖表面微观形态
Fig.5 Microstructure of the surface of yeast glucan
由于高度约在0.5~1.0 nm范围内表示样品中没有重叠的单链[24],因此,高度3∶1提示YG结构可能为三螺旋结构,WSYG是由YG解螺旋而来,重叠的三螺旋转变为单链形式。
酵母β-葡聚糖的溶解性改变是DMSO与乙醇的双重作用结果,在高浓度DMSO溶液之中,酵母β-葡聚糖的三螺旋结构解旋[6],形成部分单链,乙醇加入使单链多糖沉淀,单链多糖遇水后由于氢键作用溶解于水,从而表现出酵母β-葡聚糖水溶性的增加。而图5-a仍显示出三螺旋结构,其原因可能是制样过程中DMSO挥发使部分多糖复性,重新恢复三螺旋结构[6,23]。这也解释了为什么曹桦强等[8]将DMSO加热处理过的酵母β-葡聚糖直接冻干所得的酵母β-葡聚糖是不溶于水的。
2.7 刚果红实验分析
刚果红染料能与三螺旋多糖形成络合物,络合物的最大吸收波长会在一定浓度范围内的NaOH溶液中发生红移,随着NaOH浓度增大,络合物结构被破坏,溶液最大吸收波长会下降[25]。图6表明,在浓度为0~0.5 mol/L的NaOH溶液中,刚果红和WSYG混合液的最大吸收波长并未展现出先红移后下降的变化趋势,表明WSYG不含三螺旋结构。
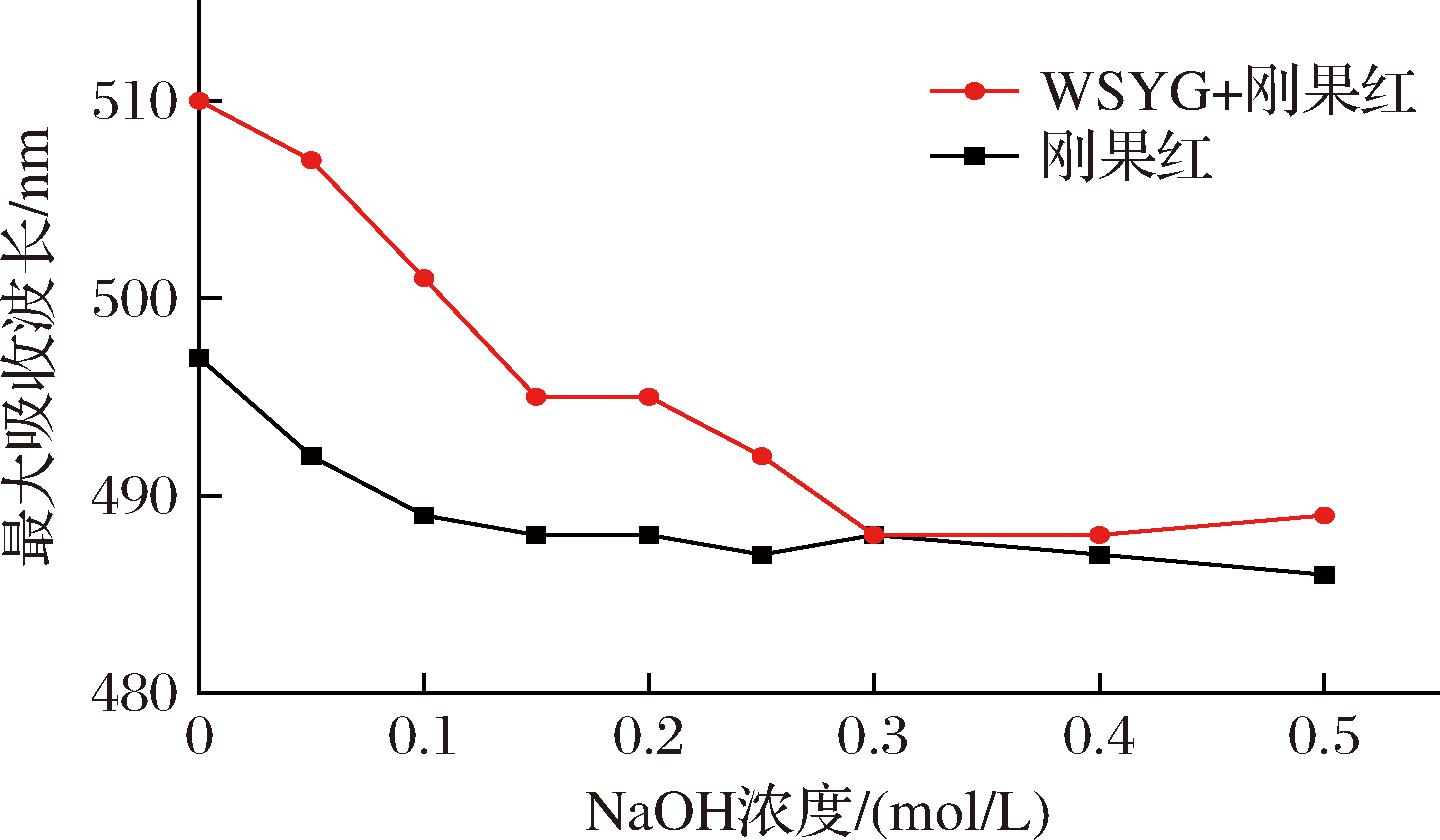
图6 刚果红和刚果红+WSYG溶液的最大吸收波长
Fig.6 Maximum absorption wavelength of Congo red and mixed liquids
2.8 体外抗氧化、降血糖活性
2.8.1 ·O2-清除能力
由图7可知,随着WSYG质量浓度的增大,·O2-清除率逐渐升高,呈现出正向的量效关系;WSYG质量浓度为0.004 mg/mL时,清除率为62.12%,WSYG和维生素C清除自由基的IC50值分别为0.031 5、0.032 7 μg/mL。可以看出WSYG在所选范围内清除·O2-的能力与维生素C接近,这表明WSYG是一种良好的·O2-清除剂。
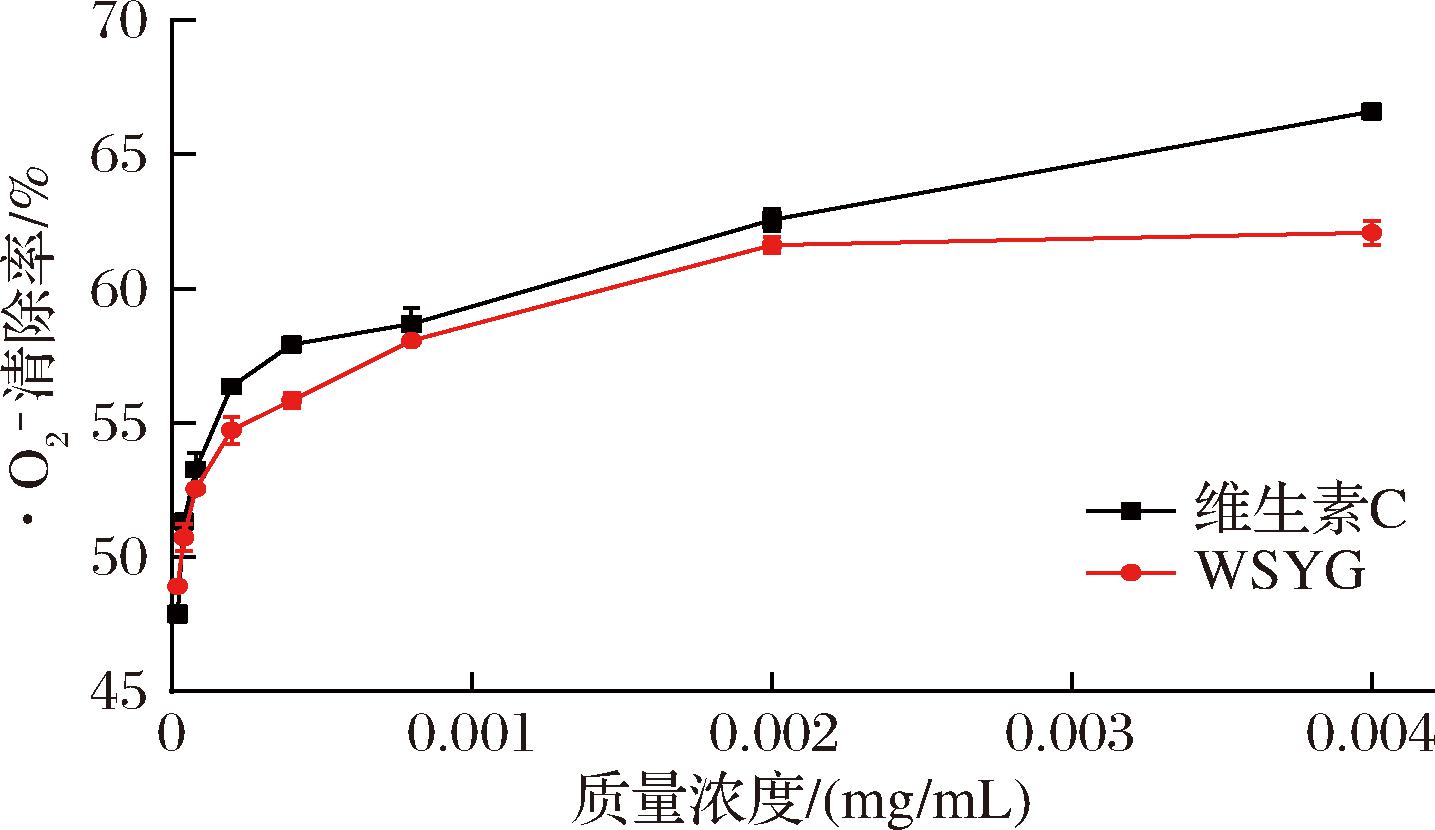
图7 WSYG的·O2-清除能力
Fig.7 Superoxide anion scavenging ability of WSYG
2.8.2 DPPH自由基清除能力
由图8可知,随着WSYG质量浓度的增大,DPPH自由基清除率缓慢上升,两者成正相关;WSYG质量浓度为4.0 mg/mL时,清除率为52.22%。可以看出,WSYG对DPPH自由基具有较强的清除能力,但比同质量浓度下的维生素C弱。
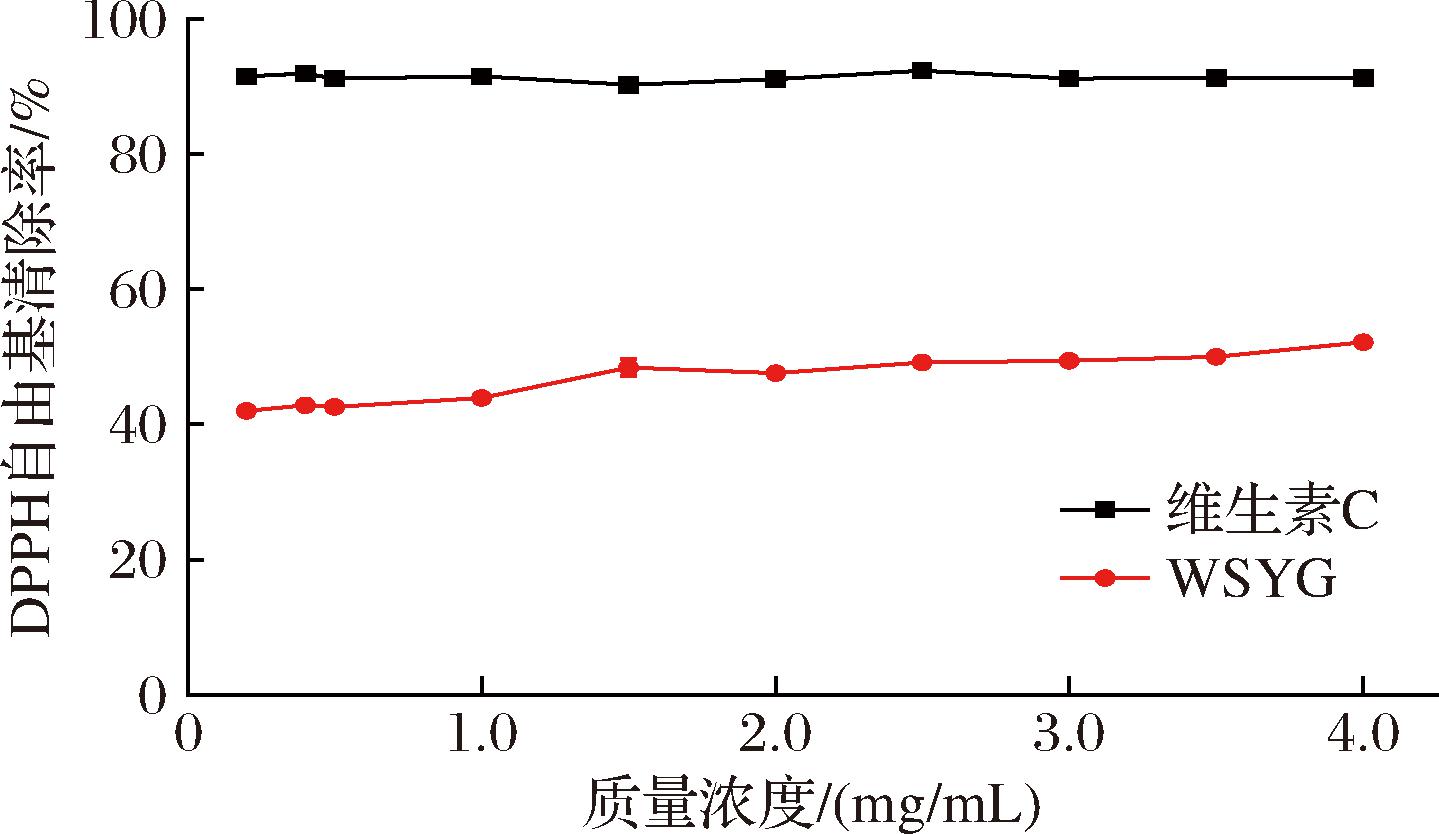
图8 WSYG的DPPH自由基清除能力
Fig.8 DPPH radical scavenging capacity of WSYG
2.8.3 α-淀粉酶抑制活性
餐后高血糖是2型糖尿病发病的主要因素之一[26],抑制α-淀粉酶可以延迟葡萄糖在肠道中的吸收,从而降低餐后血糖水平[27]。由图9可知,在所选浓度范围内,WSYG对α-淀粉酶的抑制率与浓度呈正向量效关系。在多糖最大质量浓度为1.0 mg/mL时,α-淀粉酶抑制率为65.45%,WSYG对α-淀粉酶具有较强的抑制作用,但比同质量浓度下的阿卡波糖弱。
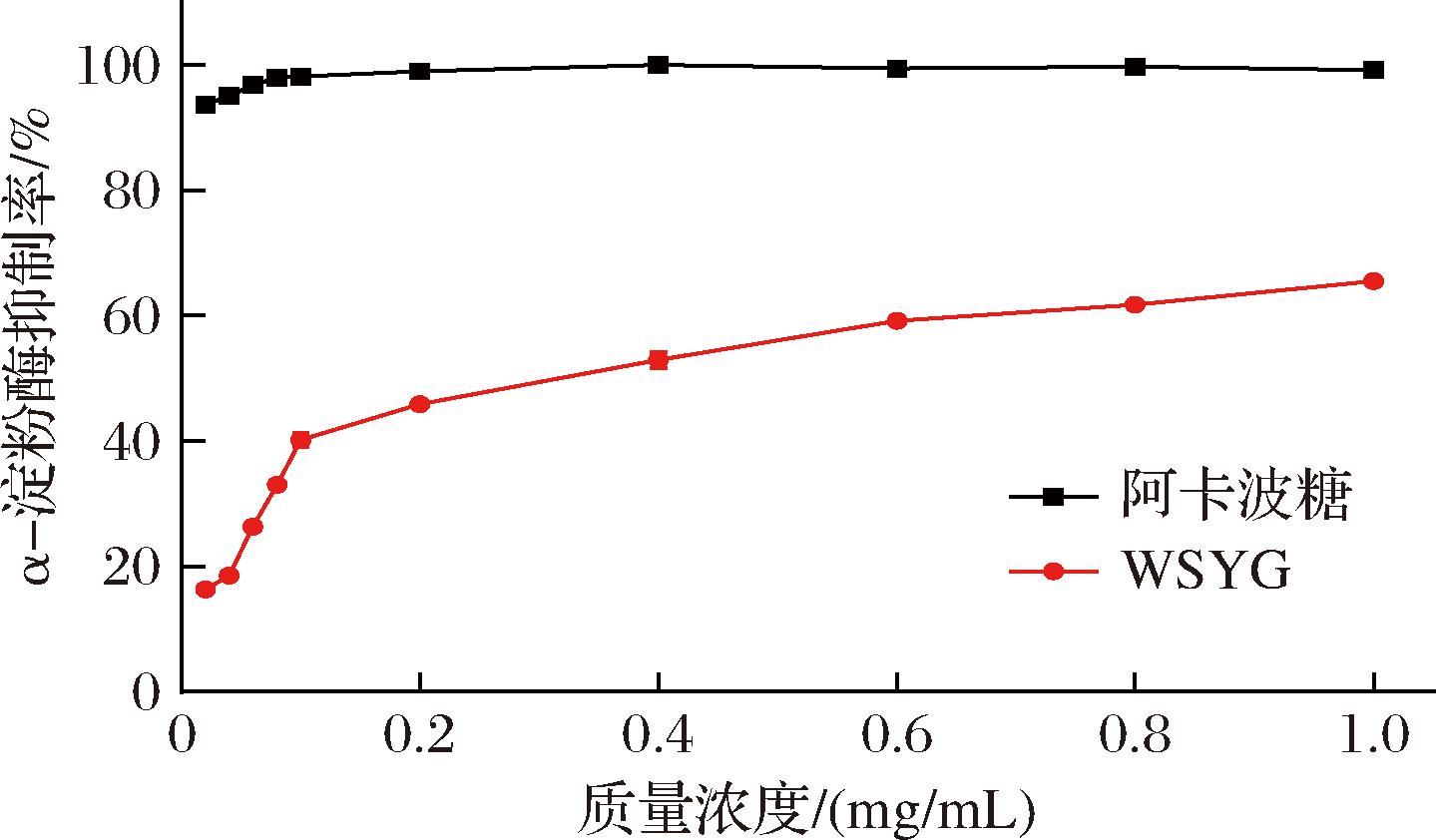
图9 WSYG的α-淀粉酶抑制曲线
Fig.9 α-Amylase inhibition curve of WSYG
2.8.4 α-葡萄糖苷酶抑制活性
α-葡萄糖苷酶在人体糖代谢过程中扮演着重要角色,抑制其活性可以有效降低肠道对碳水化合物的吸收速度,进而实现降低血糖的效果[27]。由图10可知,随着WSYG质量浓度的增大,α-葡萄糖苷酶抑制率缓慢上升,呈现出正向的量效关系;在多糖最大质量浓度为5.0 mg/mL时,α-葡萄糖苷酶抑制率为45.83%。可以看出,WSYG对α-葡萄糖苷酶具有一定的抑制作用,但比同质量浓度下的阿卡波糖弱。
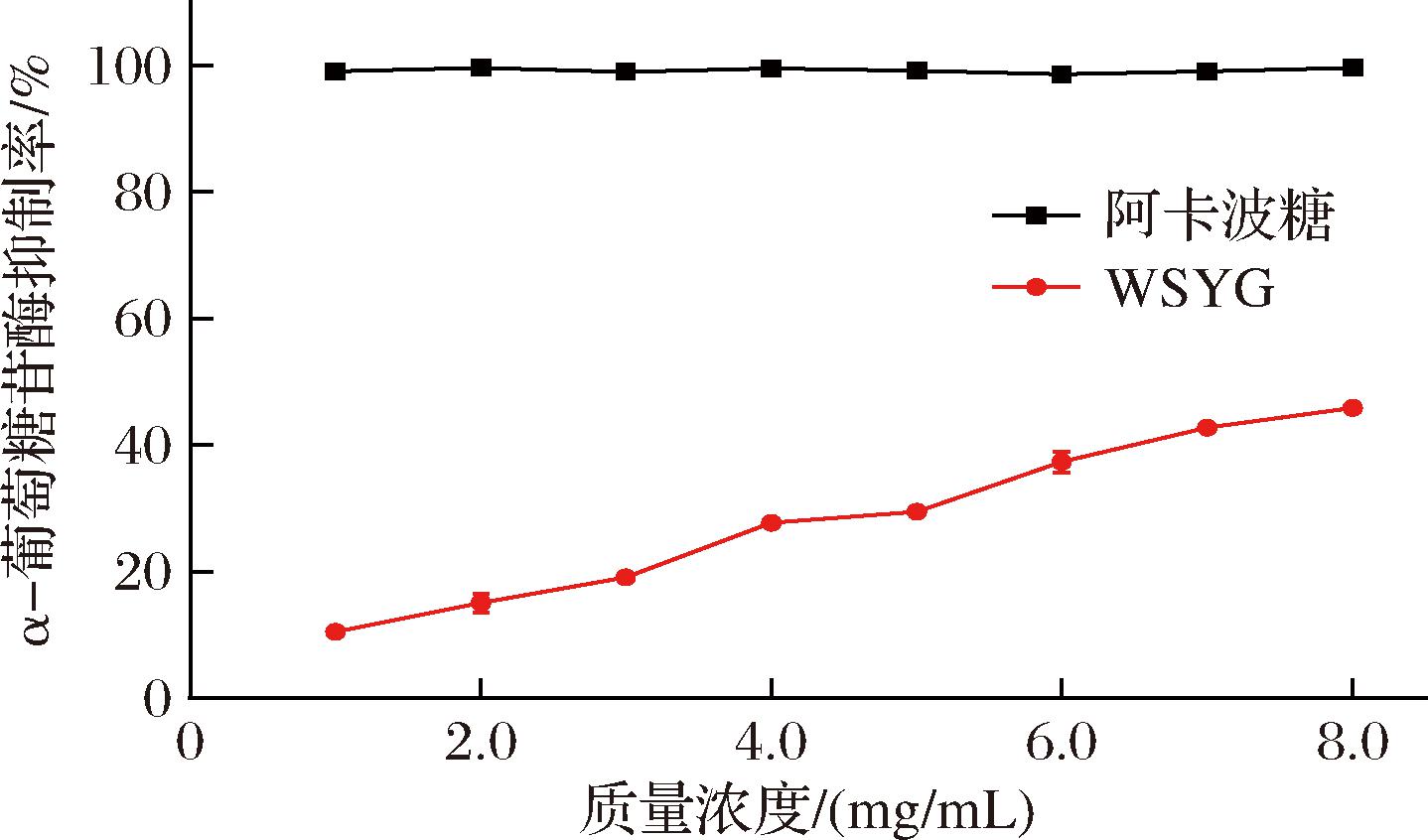
图10 WSYG的α-葡萄糖苷酶抑制曲线
Fig.10 α-Glucosidase inhibition curve of WSYG
3 结论
采用DMSO溶解-乙醇沉淀法制备WSYG。以多糖得率为指标,在单因素试验的基础上,通过响应面试验优化提取条件,并研究其体外抗氧化活性及降血糖活性。结果表明:最佳提取条件为DMSO体积分数90%,乙醇体积分数91%,体积比4.4∶1(mL∶mL),在此条件下WSYG得率为(16.38±0.17)%,多糖含量为(96.02±1.37)%。刚果红试验及原子力显微镜结果表明WSYG在水中呈链状且不具有三螺旋结构,这可能是DMSO与乙醇的双重作用导致酵母葡聚糖的三螺旋结构被破坏,使其水溶性增加。体外活性测试表明WSYG具有一定的抗氧化活性和降血糖活性。本研究为WSYG的制备提供了新的方法,该法操作简便易行,所得的水溶性多糖纯度高,利于后续活性实验的开展,进一步促进酵母β-葡聚糖生物功能的开发和利用。
[1] YUAN H J, HE Y, ZHANG H, et al.Ultrasound-assisted enzymatic hydrolysis of yeast β-glucan catalyzed by β-glucanase:Chemical and microstructural analysis[J].Ultrasonics Sonochemistry, 2022, 86:106012.
[2] CHEN H H, LIU N Y, HE F Z, et al.Specific β-glucans in chain conformations and their biological functions[J].Polymer Journal, 20, 54(4):427-445.
[3] ISHIMOTO Y, ISHIBASHI K I, YAMANAKA D, et al.Production of low-molecular weight soluble yeast β-glucan by an acid degradation method[J].International Journal of Biological Macromolecules, 2018, 107:2269-2278.
[4] DALONSO N, GOLDMAN G H, GERN R M M.β-(1→3), (1→6)-glucans:Medicinal activities, characterization, biosynthesis and new horizons[J].Applied Microbiology and Biotechnology, 2015, 99(19):7893-7906.
[5] FRANCELINO ANDRADE E, VIEIRA LOBATO R, VASQUES ARA JO T, et al.Effect of beta-glucans in the control of blood glucose levels of diabetic patients:A systematic review[J].Nutricion Hospitalaria, 2014, 31(1):170-177.
JO T, et al.Effect of beta-glucans in the control of blood glucose levels of diabetic patients:A systematic review[J].Nutricion Hospitalaria, 2014, 31(1):170-177.
[6] MENG Y, LYU F Z, XU X J, et al.Recent advances in chain conformation and bioactivities of triple-helix polysaccharides[J].Biomacromolecules, 2020, 21(5):1653-1677.
[7] 刘琛仪, 李涵, 曹桦强, 等.酵母来源甘露聚糖提取纯化新方法及体外活性的初步探究[J].食品科技, 2022, 47(7):167-174.
LIU C Y, LI H, CAO H Q, et al.Extraction, purification and in vitro activity of mannan from beer yeast[J].Food Science and Technology, 2022, 47(7):167-174.
[8] 曹桦强, 赵晨晨, 杨笑天, 等.二甲基亚砜辅助分离酵母细胞壁中β-葡聚糖的工艺探索[J].食品与生物技术学报, 2024(6):155-163.
CAO H Q, ZHAO C C, YANG X T, et al.Process exploration for separating β-glucan from yeast cell wall assisted by dimethyl sulfoxide[J].Journal of Food Science and Biotechnology,2024(6):155-163.
[9] 王宏亮, 惠哲哲, 梁犇, 等.皂荚叶多糖提取工艺及其抗氧化活性的研究[J].中国粮油学报, 2023, 38(12):176-18.
WANG H L, XI Z Z, LIANG B, et al.Primary study on extraction technology and antioxidant activity of polysaccharides from Gleditsia sinensis leaves[J].Journal of the Chinese Cereals and Oils Association, 2023, 38(12):176-18.
[10] 李珊, 梁俭, 冯群, 等.红心与白心火龙果总糖、还原糖含量及其抗氧化活性的对比分析[J].粮食与油脂, 2020, 33(5):20-24.
LI S, LIANG J, FENG Q, et al.Comparative analysis of total sugar, reducing sugar content and antioxidant activity in red pitaya and white pitaya[J].Cereals &Oils, 2020, 33(5):20-24.
[11] 杜镇, 张玲, 曹桂云, 等.薏苡仁多糖的分离纯化、单糖组成分析及对脾气虚证调节作用[J].中草药, 2023, 54(6):1736-1742.
DU Z, ZHANG L, CAO G Y, et al.Isolation, purification and monosaccharide composition analysis of Coicis Semen polysaccharide and its regulatory effect on spleen qi deficiency syndrome[J].Chinese Traditional and Herbal Drugs, 2023, 54(6):1736-1742.
[12] 王丽霞, 刘孟宗, 王芳, 等.铁皮石斛多糖提取及抗氧化活性研究[J].中国食品添加剂, 2019, 30(2):85-90.
WANG L X, LIU M Z, WANG F, et al.Study on extraction and antioxidant activity of polysaccharides from Dendrobium candidum[J].China Food Additives, 2019, 30(2):85-90.
[13] 刘春阳, 白金波, 杨尚青, 等.枳椇子多糖的酸提取工艺优化及其理化性质与抗氧化活性研究[J].食品与发酵工业, 2024, 50(9):148-156.
LIU C Y, BAI J B, YANG S Q, et al.Optimization of acid extraction process for polysaccharide from Hovenia dulcis seed and analysis of its antioxidant activity[J].Food and Fermentation Industries, 2024, 50(9):148-156.
[14] CAO C L, HUANG Q, ZHANG B, et al.Physicochemical characterization and in vitro hypoglycemic activities of polysaccharides from Sargassum pallidum by microwave-assisted aqueous two-phase extraction[J].International Journal of Biological Macromolecules, 2018, 109:357-368.
[15] XU Y Q, NIU X J, LIU N Y, et al.Characterization, antioxidant and hypoglycemic activities of degraded polysaccharides from blackcurrant (Ribes nigrum L.) fruits[J].Food Chemistry, 2018, 243:26-35.
[16] 张扬, 张艳, 杨秀东, 等.响应面法优化玉米苞叶多糖的提取工艺[J].食品工业科技, 2016, 37(14):267-271.
ZHANG Y, ZHANG Y, YANG X D, et al.Optimization of extraction process of polysaccharides from corn bract by response surface methodology[J].Science and Technology of Food Industry, 2016, 37(14):267-271.
[17] 程雷, 崔明晓, 刘可玉, 等.水芹多糖的提取及其对巨噬细胞RAW264.7免疫活性的初步研究[J].食品与发酵工业, 2023, 49(6):79-85.
CHENG L, CUI M X, LIU K Y, et al.Extraction of Oenanthe javanica polysaccharide and its immune activity of macrophage RAW264.7[J].Food and Fermentation Industries, 2023, 49(6):79-85.
[18] 高洁. 酵母β-葡聚糖制备、改性增溶和溶液构象研究[D].北京:中国农业科学院, 2013.
GAO J.Study on the preparation, modification and solution conformation of β-glucans in Saccharomyces cerevisiae[D].Beijing:Chinese Academy of Agricultural Sciences, 2013.
[19] 王寒梅, 刘垚, 何启煜, 等.高温高压降解制备低分子量水溶性酵母葡聚糖[J].食品研究与开发, 2024, 45(4):96-102.
WANG H M, LIU Y, HE Q Y, et al.Preparation of water-soluble yeast glucan with low molecular weight by high-temperature and high-pressure degradation[J].Food Research and Development, 2024, 45(4):96-102.
[20] ZHENG Z M, HUANG Q L, LING C Q.Water-soluble yeast β-glucan fractions with different molecular weights:Extraction and separation by acidolysis assisted-size exclusion chromatography and their association with proliferative activity[J].International Journal of Biological Macromolecules, 2019, 123:269-279.
[21] 李超, 郭畅, 王喆, 等.三相分离技术制备荔枝草多糖及其体外抗氧化活性研究[J].粮食与油脂, 2023, 36(9):84-89.
LI C, GUO C, WANG Z, et al.Study on the preparation of Salvia plebeia R.Br.polysaccharide by three-phase separation technology and its in vitro antioxidant activity[J].Cereals &Oils, 2023, 36(9):84-89.
[22] 张慧慧, 李灿, 刘会平, 等.肉桂多糖的提取纯化及体外抗氧化和降血糖活性分析[J].食品工业科技, 2024, 45(7):15-24.
ZHANG H H, LI C, LIU H P, et al.Extraction and purification of Cinnamomum cassia polysaccharides and its antioxidant and hypoglycemic activities in vitro[J].Science and Technology of Food Industry, 2024, 45(7):15-24.
[23] GUO X Y, KANG J, XU Z Y, et al.Triple-helix polysaccharides:Formation mechanisms and analytical methods[J].Carbohydrate Polymers, 2021, 262:117962.
[24] WEI C Y, LI W Q, SHAO S S, et al.Structure and chain conformation of a neutral intracellular heteropolysaccharide from Mycelium of Paecilomyces cicadae[J].Carbohydrate Polymers, 2016, 136:728-737.
[25] WANG Z B, PEI J J, MA H L, et al.Effect of extraction media on preliminary characterizations and antioxidant activities of Phellinus linteus polysaccharides[J].Carbohydrate Polymers, 2014, 109:49-55.
[26] LIU Y L, ZHAN L H, XU C, et al.α-Glucosidase inhibitors from Chinese bayberry (Morella rubra Sieb.et Zucc.) fruit:Molecular docking and interaction mechanism of flavonols with different B-ring hydroxylations[J].RSC Advances, 2020, 10(49):29347-29361.
[27] JAGADEESAN G, MUNIYANDI K, MANOHARAN A L, et al.Understanding the bioaccessibility, α-amylase and α-glucosidase enzyme inhibition kinetics of Allmania nodiflora (L.) R.Br.ex Wight polyphenols during in vitro simulated digestion[J].Food Chemistry, 2022, 372:131294.