不同的发酵曲和发酵工艺赋予了中国白酒多样的风味类型和复杂的风味特征[1]。特别是酱香型白酒,其酿造工艺在中国各类香型白酒中最为复杂。酱香型白酒的独特风味源自其特有的酿造工艺和方法,即高温制曲、高温堆积、高温发酵、高温馏酒;生产周期长、基酒贮存时间长;用曲量大、多轮次发酵[2-3]等。“四高二长、一大一多”的生产工艺,造就了酱香型白酒“酱香浓郁、优雅细腻、酒体醇厚、回味悠长”的特征风味[4],深受广大消费者青睐。
高温大曲作为酱香型白酒发酵必不可少的发酵剂,它富含发酵所需的菌系、酶系和物系,直接影响酒醅发酵的启动和顺利进行[5]。酱香型白酒风格的基础源于高温大曲,因此酱香型白酒高温大曲的品控是酱香型白酒风格特征及质量把控的关键之所在。高温大曲在发酵结束后往往会形成3种颜色,根据颜色将其划分为白色大曲、黄色大曲和黑色大曲[6-7]。3种大曲发酵结束形成的比例大约为:黄曲占80%,白曲占10%,黑曲占10%[8]。在大曲制造过程中,由于曲块的堆放位置的差异,以及曲房内温度、湿度等环境因素的影响,不同部分的曲的成熟度往往存在差异,曲发酵过程中更高的温度和湿度更利于美拉德反应,进而更利于黑曲的形成[9]。
目前,对不同颜色大曲的研究主要集中在其理化特性[10]、微生物组成变化[6,11]和挥发性物质[12]等方面。3种曲的理化性质方面存在着较大的差异,白曲在糖化酶、液化酶和蛋白酶活性上表现出明显优势,而黑曲在3种颜色大曲中各种酶活水平均偏低[10,13]。在微生物群落结构方面,白曲的群落丰富度最高,黑曲最低,黄曲位于两者之间,白曲的优势细菌属包括乳杆菌属(Lactobacillus)和放线菌属(Actinomycetes),黄曲的优势细菌属是芽孢杆菌属(Bacillus)和大洋杆菌属(Oceanobacillus),而白曲和黑曲共有的优势真菌属为热子囊菌属(Thermoascus)[14];在挥发性物质和代谢产物方面,白曲的挥发性成分最为丰富,其中白曲的乙偶姻和吡嗪浓度均高于黄曲和黑曲[15],而黑曲中类黑素和黑色素含量更高[9]。
在酱香型白酒实际生产过程中,3种颜色大曲的使用没有固定的比例,缺乏理论指导。生产中的成品曲主要根据工人的工作经验,将不同曲种磨碎混合形成。为了进一步明确不同颜色大曲对酱香型白酒各轮次酒醅和酒体的影响,本研究使用不同颜色高温大曲分别在酱香型白酒发酵车间进行原位发酵实验,并结合数理分析方法探究不同颜色大曲对酱香型白酒整个生产周期中酒醅和酒体的影响,为不同轮次中不同颜色高温大曲的合理利用提供理论性支持。
1 材料与方法
1.1 材料、试剂
酒醅和4种高温大曲:成品曲(由3种颜色大曲按照一定比例混合)、白曲、黄曲和黑曲,贵州钓鱼台国宾酒业有限公司。
邻苯二甲酸氢钾、茚三酮、Na2CO3、三氯乙酸、无水乙醇、磷酸、盐酸、硫酸、亚铁氰化钾、CuSO4、酒石酸钾钠、无水葡萄糖、NaOH等(均为分析纯),天津市科密欧化学试剂有限公司;乳酸、乙酸、乙酸乙酯、乳酸乙酯、异戊醇、正丁醇、正丙醇、异丁醇等标准品(均为色谱纯),上海阿拉丁生化科技股份有限公司。
1.2 仪器和设备
UV-1780紫外分光光度计,岛津企业管理有限公司;XMTB型电热恒温水浴锅,天津市中环实验电炉有限公司;FB-1A电热炉,上海析牛莱伯仪器有限公司;TXT-CXSB-20L超纯水系统,石家庄泰斯特仪器设备有限公司;DL102型电热鼓风干燥箱,天津市试验器械厂;Agilent Infinity 1260高效液相色谱仪、Agilent 7890B气相色谱仪,美国安捷伦科技有限公司。
1.3 实验方法
1.3.1 大曲取样方法
在曲房中采集不同季节时期样品,根据大曲外观颜色以及曲香的不同,随机抽取黄曲、白曲和黑曲各3块,全年共取样8次,将采集的不同颜色大曲分别进行粉碎制样。成品曲从车间磨曲点取样。取样后送至实验室保藏(4 ℃和-20 ℃)至检测。
1.3.2 大曲理化指标和主要酶活力的测定
大曲的总酸、还原糖、水分、淀粉、氨基酸态氮的测定方法参照QB/T 4257—2011《酿酒大曲通用分析方法》进行测定。
糖化酶活力的测定:称取相当于绝干曲10 g(精确至0.001 g)试样量置于250 mL烧杯中,加入20 mL乙酸-乙酸钠缓冲溶液(pH 4.6),再加水定容至200 mL,35 ℃水浴1 h,每15 min搅拌1次,过滤后作为待测酶液。使用菲林试剂法进行测定,具体操作参考QB/T 4257—2011《酿酒大曲通用分析方法》。
液化酶活力的测定:称取相当于绝干曲10 g(精确至0.01 g)试样量置于250 mL烧杯中,加入20 mL乙酸-乙酸钠缓冲溶液(pH 4.6),再加水定容至200 mL,35 ℃水浴1 h,每5 min搅拌1次,过滤后作为待测酶液。使用比色法进行测定,具体操作参考QB/T 4257—2011《酿酒大曲通用分析方法》。
酯化酶活力的测定:吸取1.5 mL己酸于250 mL锥形瓶中,加入25 mL无水乙醇、75 mL蒸馏水,再加入相当于绝干曲25 g(精确至0.01 g)试样量,充分摇匀,用塞子塞上,置于35 ℃恒温箱内酯化7 d,具体操作计算参考QB/T 4257—2011《酿酒大曲通用分析方法》。
酸性蛋白酶活力:称取5 g大曲试样量置于250 mL烧杯中,加入100 mL乳酸-乳酸钠缓冲溶液(pH 3.0),40 ℃水浴1 h,每15 min搅拌1次,过滤后作为待测酶液。使用福林酚法测定,测定结果按酸性蛋白酶标准曲线方程为y=0.010 2x+0.036 4(R2=0.995 8)计算,具体操作参考行业标准SB/T 10317—1999《蛋白酶活力测定法》。
1.3.3 酒醅的采集方法
原位发酵实验:按照酱酒工艺,在每个轮次蒸粮过后,将进行摊晾拌曲操作。本实验分为对照组(即成品曲和6 kg酒醅均匀混合后装入纱布袋内)和实验组,实验组分为黑曲组(黑曲和6 kg酒醅均匀混合后装入纱布袋内)、黄曲组(黄曲和6 kg酒醅均匀混合后装入纱布袋内)、白曲组(白曲和6 kg酒醅均匀混合后装入纱布袋内),拌曲后将纱布袋置于堆积发酵中层,堆积阶段样品摆放位置如图1-a所示,期间随车间操作进行移堆。堆积结束后,样品洒尾酒拌匀后继续下窖池发酵,窖池阶段样品摆放位置如图1-b所示,各样品彼此间隔40 cm。a点为对照组摆放位置,b、c、d点分别是黄曲组、白曲组、黑曲组的摆放位置。轮次结束后将样品全部取出,对取到的样品进行混匀后作为相应时间及相应组的样品,并将样品分装成两份,一份300 g用于理化指标的测定;另一份4 kg用于实验蒸酒。
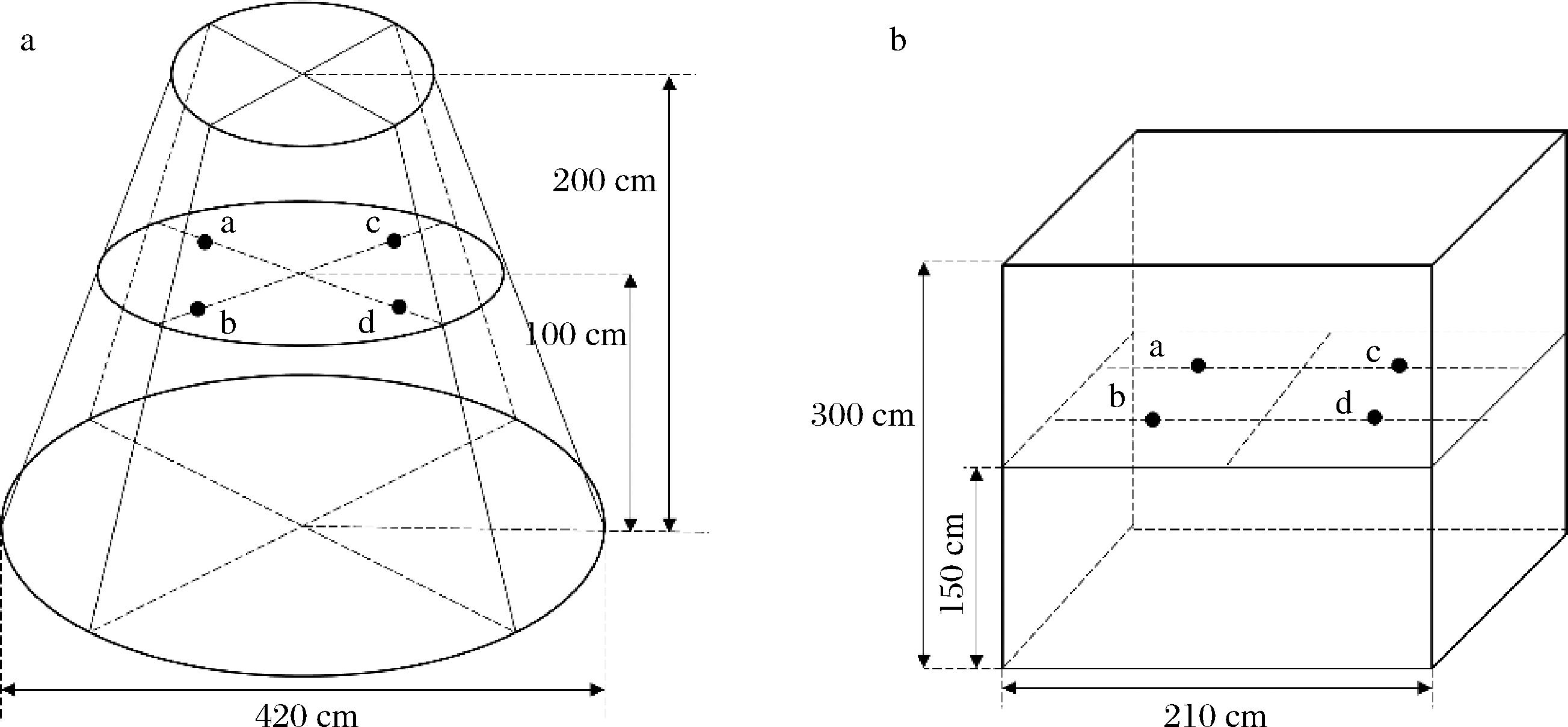
a-堆积发酵;b-窖池发酵
图1 原位堆积发酵和窖池发酵样品示意图
Fig.1 Location diagram of samples during the in-situ stacking fermentation and pit fermentation
1.3.4 酒醅理化指标的测定
酒醅的总酸、还原糖、水分、淀粉的测定方法参照中国酒业协会团体标准T/CBJ 004—2018《固态发酵酒醅通用分析方法》进行测定。
α-氨基氮含量测定:根据茚三酮显色法[16]对酒醅中游离的α-氨基氮进行测定。
1.3.5 酒样理化指标的测定
参考GB/T 10345—2022《白酒分析方法》,采用酸碱中和滴定法对总酸进行检测;采用皂化返滴定法对总酯进行检测。
1.3.6 有机酸和酒样主要风味物质的测定
酒醅待测液制备:称取15 g酒醅置于研钵中捣碎,取10 g放入250 mL锥形瓶中,加入50 mL蒸馏水混匀,浸泡20 min,期间每隔5 min搅拌1次,静置10 min后过滤,并用蒸馏水充分洗涤残渣,洗液并入100 mL容量瓶中,定容至100 mL,7 500 r/min离心10 min,取上清液即为样品待测液,并用0.22 μm膜过滤。
酒样待测液制备:使用12 L不锈钢蒸酒器模拟“见气上甑”,称取4 kg酒醅与稻壳拌匀备用。加热装有2 L蒸馏水不锈钢桶,待有蒸汽出现时,用不锈钢铲“轻、松、薄、准、匀、平”的将酒醅加入篦子上,保持酒醅的径高比与车间实际酒醅径高比一致,将不锈钢桶盖组装严,用烧杯接蒸馏出的酒样,用便携式数字密度计测酒样的瞬时酒度,直至瞬时酒度为6%(体积分数)时停止蒸酒,将所接的所有酒样混匀后,作为酒样待测液,并用0.22 μm膜过滤。
1)高效液相色谱法
采用Agilent 1260高效液相色谱仪(外标法)对酒醅酒样有机酸含量进行测定。
色谱条件:Agilent GH0830078H色谱柱(300 mm×7.8 mm,8 μm),紫外检测器,柱温50 ℃,流动相为5 mmol/L稀磷酸缓冲液,流速0.6 mL/min,波长210 nm,进样量20 μL。
2)气相色谱法
采用Agilent 7890B气相色谱仪对酒样乙醇含量和主要风味物质进行测定,具体参数参考宿萌[17]的方法。
1.3.7 数据处理
所得实验数据采用SPSS 25.0进行显著性分析,采用Graphpad 9、Origin 2021和SIMECA13.0对所得数据进行绘图处理及统计学分析。
2 结果与分析
2.1 不同颜色高温大曲理化指标和主要酶活力分析
高温大曲的理化指标是考察大曲品质的重要依据,与酱香白酒品质、产量、香味密切相关。本研究以成品高温大曲作为对照,3种不同颜色高温大曲作为实验组,首先测定了4种大曲的水分、氨基酸态氮、酸度等理化指标。结果显示,4种高温大曲在水分含量、氨基酸态氮和淀粉含量上并无显著性差异,4种高温大曲的水分含量在9.01%~9.75%(图2-b),4种大曲的氨基酸态氮含量和淀粉含量分别在3.25~3.65 mg/g和58.5%~60.0%(图2-c和2-d)。4种高温大曲在还原糖含量和酸度含量上出现了变化,其中黑曲酸度和还原糖含量相对较高(图2-e和2-f)。尤其在酸度方面,黑曲的酸度显著高于其他3种曲,其酸度达到2.09 mmol/10 g,比成品曲、黄曲分别高出74.2%和49.3%,黑曲的酸度达到白曲酸度的2.2倍(图2-f),制曲过程中黑曲升温过快,微生物大规模繁殖,加速了淀粉的分解过程,促进了有机酸的产生,从而导致还原糖和酸度含量的积累[18]。
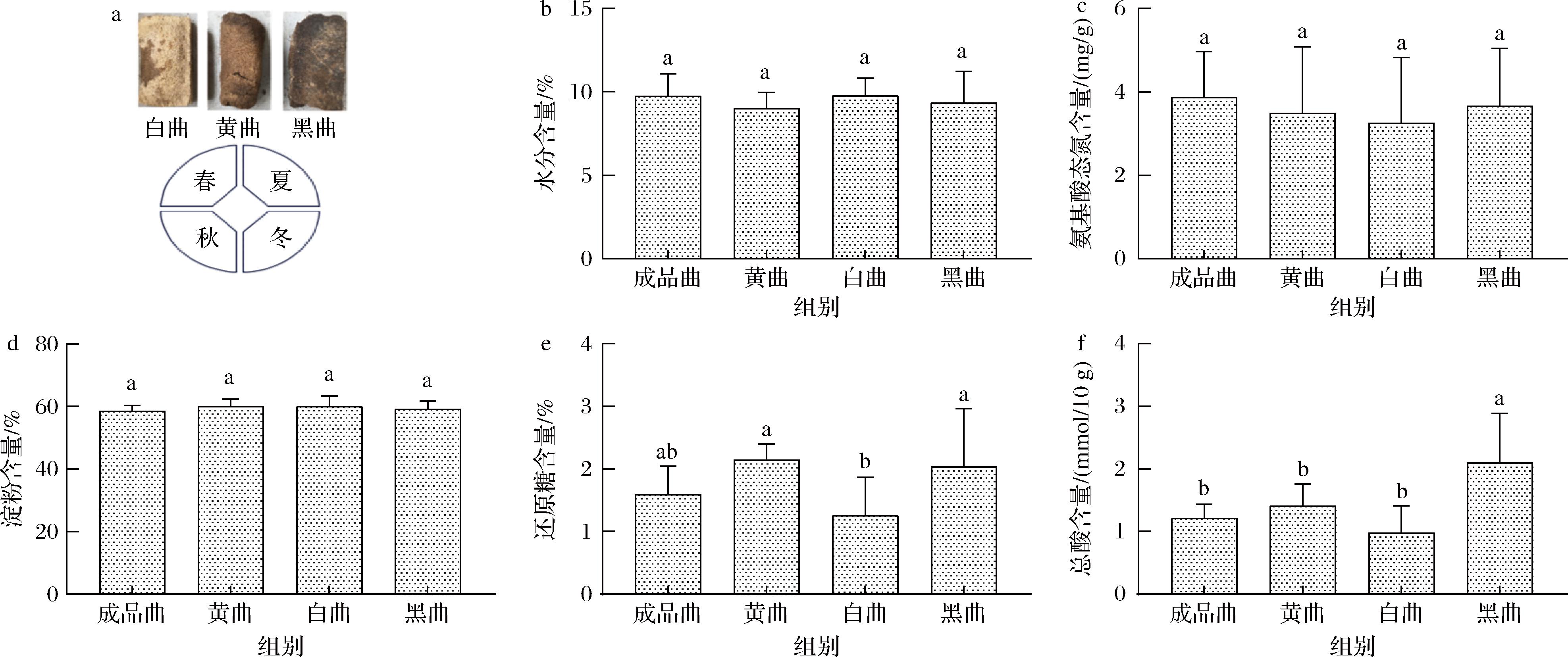
a-黄、白、黑曲样品;b-水分含量;c-氨基酸态氮含量;d-淀粉含量;e-还原糖含量;f-总酸含量
图2 不同高温大曲理化指标变化
Fig.2 Changes in physicochemical indicators of different high-temperature Daqu
注:图中不同字母表示在P<0.05水平上显著(下同)。
大曲在酿造过程中不仅为后续的发酵过程提供物系和菌系,更为重要的是为后续发酵过程提供了酶系。酱香型大曲中的水解酶系主要包括蛋白酶、液化酶、酯化酶和糖化酶等。水解酶通过促进蛋白质、淀粉和脂肪等物质的水解和转化,可以将复杂的大分子物质分解为更小的可溶性或可发酵的物质,为酿造过程提供了必要的底物。为了进一步探究4种大曲在酶系上的异同,对4种大曲的酶活力进行了测定。成品曲、黄曲、白曲和黑曲的的糖化力分别为319.25、99.75、597.25和44.5 U。其中白曲糖化力最高,显著高于其他大曲,白曲糖化力是黑曲糖化力的13.4倍,是成品曲的1.9倍(图3-a)。4种大曲在液化力上也表现出了显著的差异,并且与糖化力相似,液化力大小顺序依然为白曲>成品曲>黄曲>黑曲。白曲的液化力最高,达到了1.24 U,黑曲的液化力最低,仅为0.16 U,两者相差6.7倍(图3-b)。在酸性蛋白酶活力指标上,黄曲表现出更高的酸性蛋白酶活力,达到了30.2 U/g,黑曲在酸性蛋白酶活力方面依然是4种曲中最低,仅为11.6 U/g(图3-c)。在酯化力方面,成品曲、黄曲、白曲和黑曲的酯化力分别为84.49、42.48、102.95、20.83 U,白曲在酯化力方面显著高于黑曲(图3-d)。
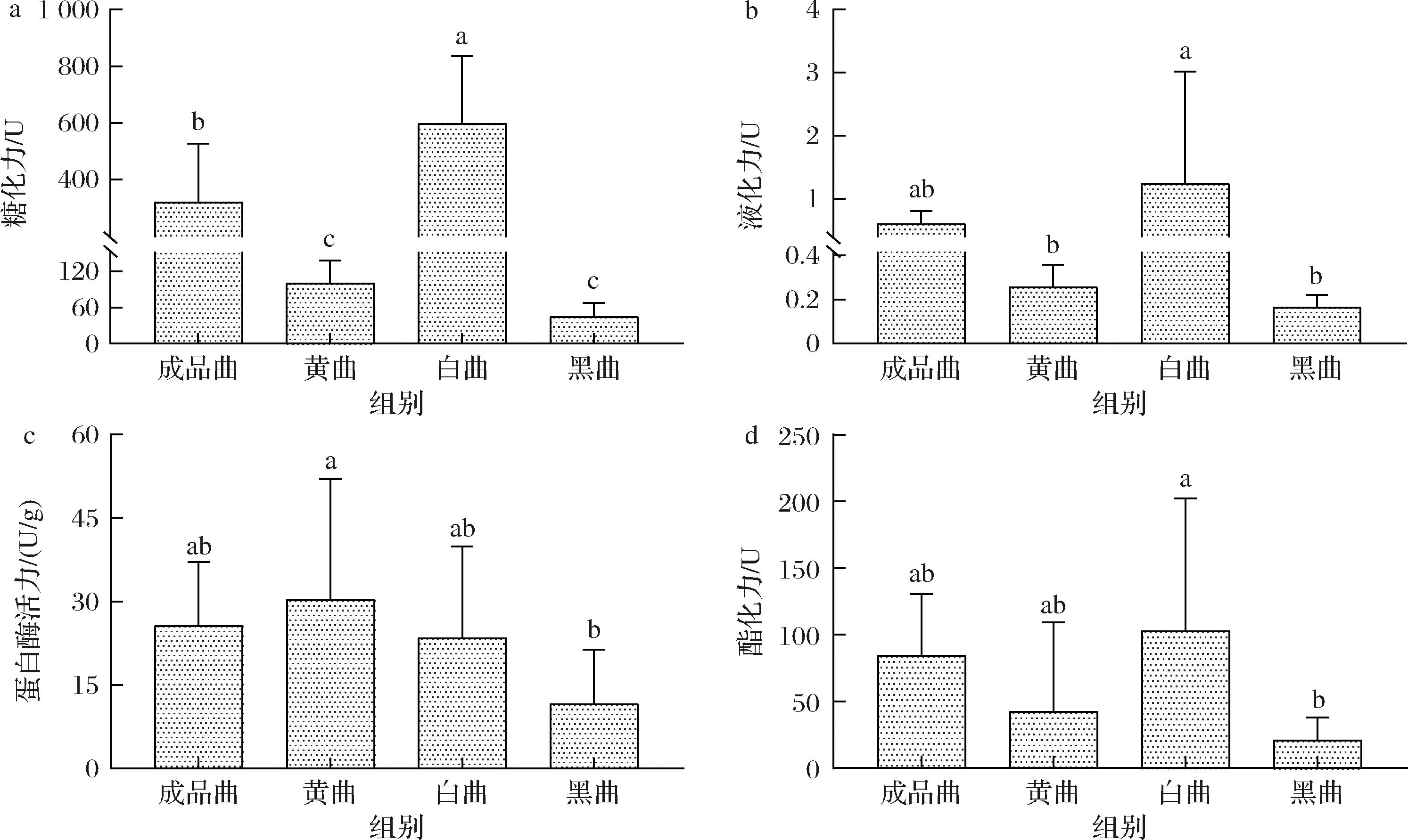
a-糖化力;b-液化力;c-酸性蛋白酶活力;d-酯化力
图3 不同高温大曲酶活力变化
Fig.3 Changes in enzymatic activity of different high-temperature Daqu
为了进一步分析4种大曲在理化指标和酶活力上的异同,将不同高温大曲的理化指标和酶活力性质进行主成分分析(principal component analysis,PCA)。结果如图4所示,在理化指标方面,4种大曲的总酸与还原糖和氨基酸态氮表现出较高的相关性,较丰富的营养物质(还原糖和蛋白质)会促进产酸微生物的生长和代谢,进而造成曲中酸度的增加[19]。在酶活力指标方面,糖化力、液化力和酯化力呈现出较高的相关性,并且3种酶活力与大曲的水分存在较高的相关性,水分的差异会导致制曲过程中微生物的生长和代谢出现差异,进而影响酶的生成和曲的酶活力[15]。另外,PCA显示不同高温大曲分布在不同的象限,说明4种大曲在理化指标和酶活力上存在显著性差异。其中,黑曲与总酸和氨基酸态氮表现出较强的相关性,但与4种酶活力均呈现出较弱的相关性;白曲与糖化力、液化力、酯化力和蛋白酶活力展现出较强的相关性,而黄曲仅与还原糖具有相关性。
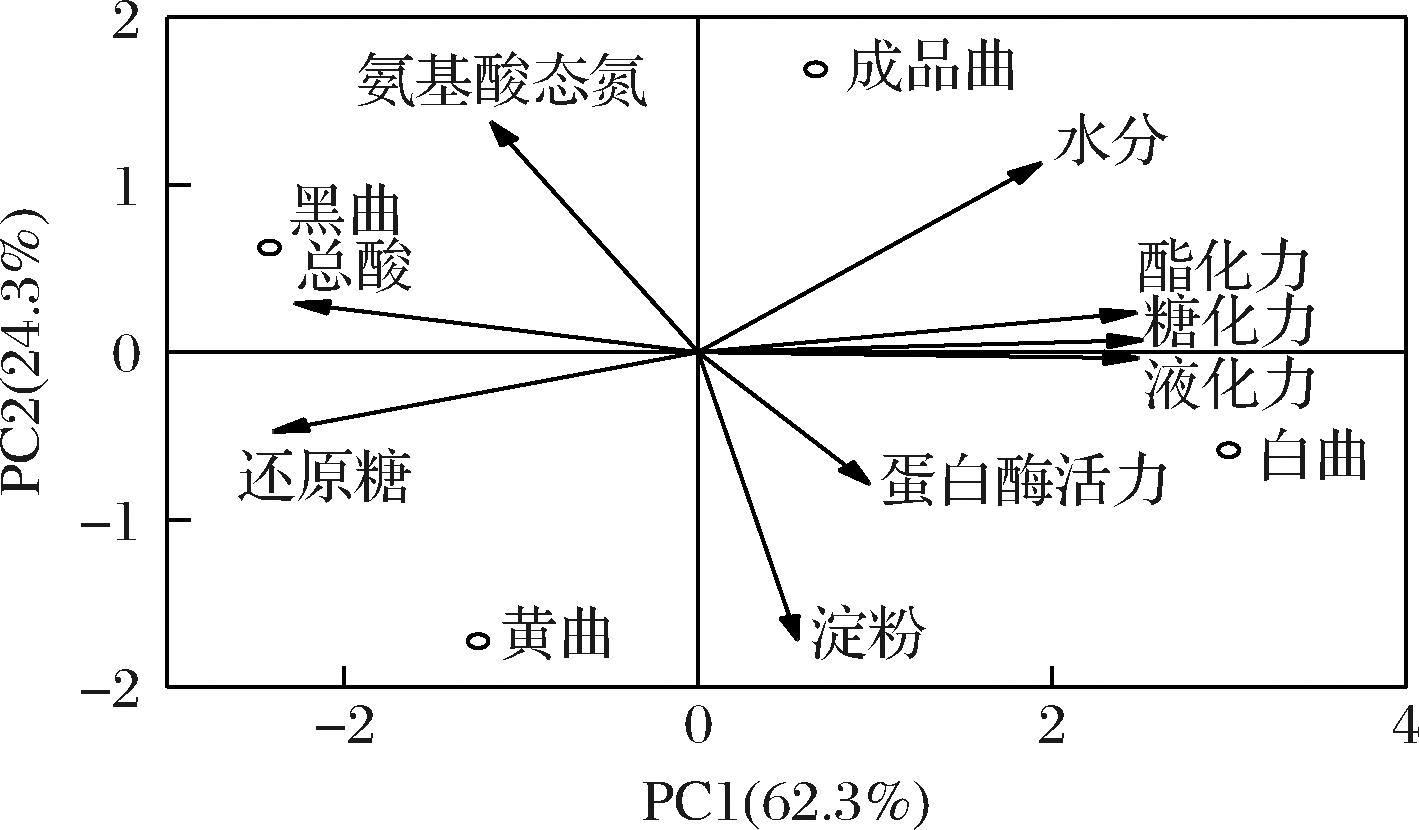
图4 不同高温大曲理化指标和酶活力主成分分析
Fig.4 Principal component analysis of physicochemical indicators and enzymatic activity in different high-temperature Daqu
2.2 不同轮次出窖酒醅理化指标的变化趋势
在酱香型白酒生产过程中,酒醅的水分含量被确定为一个至关重要的控制点。4种曲出窖酒醅含水量的变化趋势较为一致(图5-a)。随着轮次的增加,酒醅的水分含量呈整体上升的趋势,在1~5轮次中水分呈现不断上升的趋势,6轮次和7轮次出窖酒醅水分含量上升较为平缓。其中在4轮次中,黄曲组酒醅水分含量显著高于其他曲组。
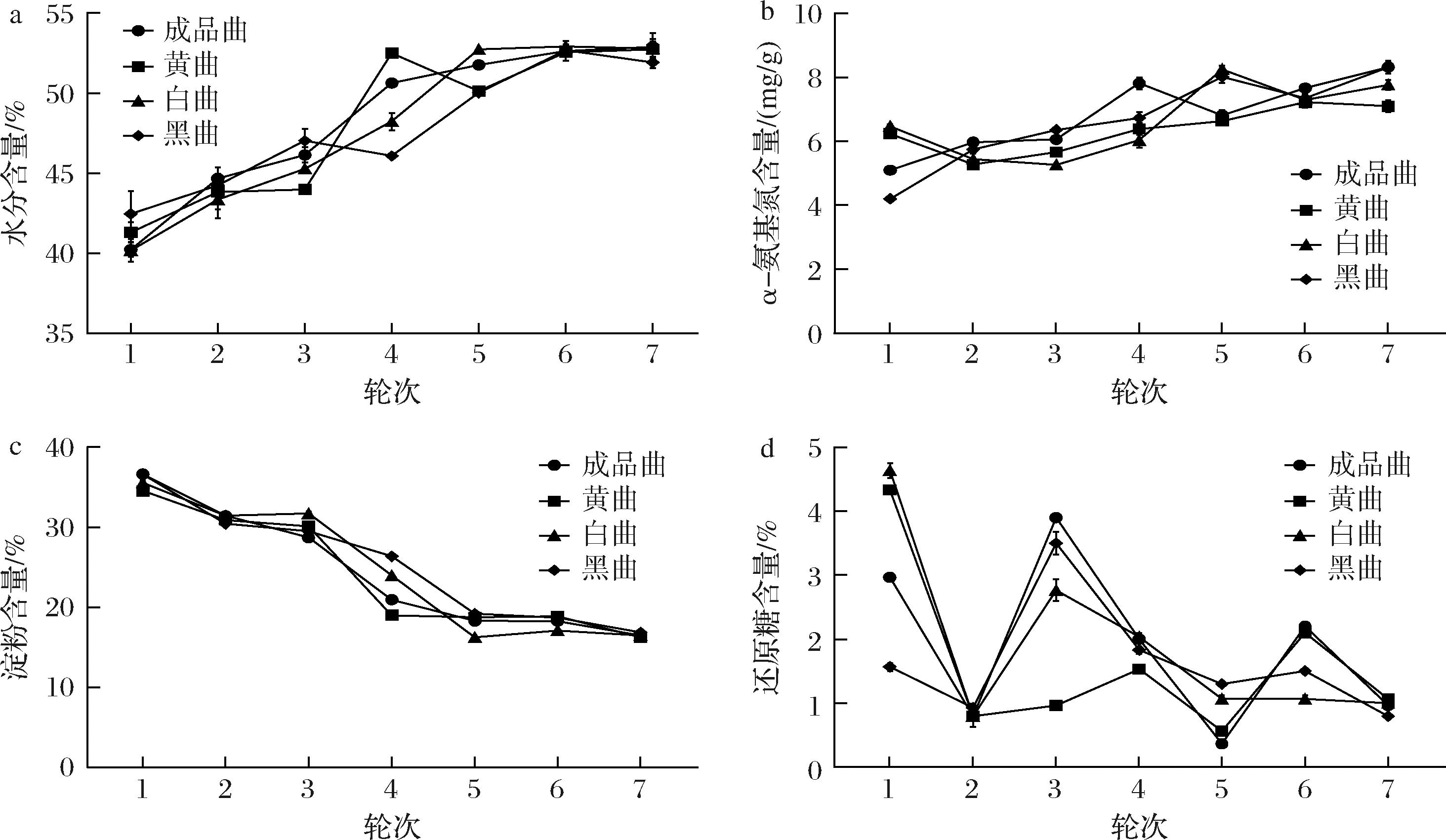
a-水分含量;b-α-氨基氮含量;c-淀粉含量;d-还原糖含量
图5 不同轮次出窖酒醅理化指标变化
Fig.5 Changes in physicochemical indicators of fermented grains released from the cellar in different rounds
α-氨基氮是微生物生长繁殖中能直接利用的氮源,含量的高低关系着微生物能否正常生长繁殖,是反映发酵程度的重要指标[20]。随着轮次增加,酒醅的α-氨基氮呈整体上升的趋势。在4轮次和7轮次中,成品曲组酒醅的α-氨基氮含量相对高于其他曲组(图5-b),可能是由于成品曲的酸性蛋白酶活力相对高于其他曲,使得蛋白酶将蛋白质降解为小分子多肽和氨基酸,进而造成成品曲酒醅中α-氨基氮含量升高[21]。
在酒醅发酵过程中,淀粉作为微生物产生酒精和其他碳水化合物的底物,其含量对发酵速度以及出酒率具有显著影响。随着轮次的增加,酒醅的淀粉含量整体呈下降的趋势(图5-c),在第3~5轮次期间,淀粉含量大幅度下降,其中白曲组淀粉消耗量高达15.4%,与成品组酒醅中淀粉消耗量(10.4%)相比,提升了5%。
酒醅中还原糖含量的变化,主要是受淀粉水解和微生物消耗两个方面的影响,在一定程度上反映了酒醅发酵速度和发酵情况。随着轮次的增加,酒醅的还原糖含量在0.3%~4.6%波动,总体呈“W”型,其中成品曲组最为明显,并在3轮次时还原糖含量显著高于其他曲组(图5-d)。
有机酸是白酒中重要的呈香物质,绝大部分的有机酸来自于酒醅,其种类和含量与微生物息息相关。随着轮次的增加,酒醅总酸H+含量变化整体先增加后下降再到酸度平稳(图6-a),其中在第2轮次时,成品曲组总酸H+含量达到最大,为5.3 mmol/10 g,显著高于其他曲组。在第5、6轮次时,白曲组酒醅总酸H+含量均高于其他曲组,可能是白曲较高的酶活力性质促进了酒醅中淀粉的快速分解,相比其他曲组,增加了微生物可利用的物质,从而加速了酒醅中酸类物质的积累[22]。酒醅中的总酸主要由乳酸构成,乳酸H+含量占到总酸的55.3%~90.6%。在整个周期中,乳酸H+含量的变化趋势与总酸H+含量的变化趋势相似(图6-b)。酒醅中乙酸H+含量在第2轮次达到最大值,其中依然是成品曲乙酸H+含量最大,之后随着轮次的增加,乙酸H+含量逐渐降低,不同曲组酒醅乙酸含量无显著差异(图6-c)。
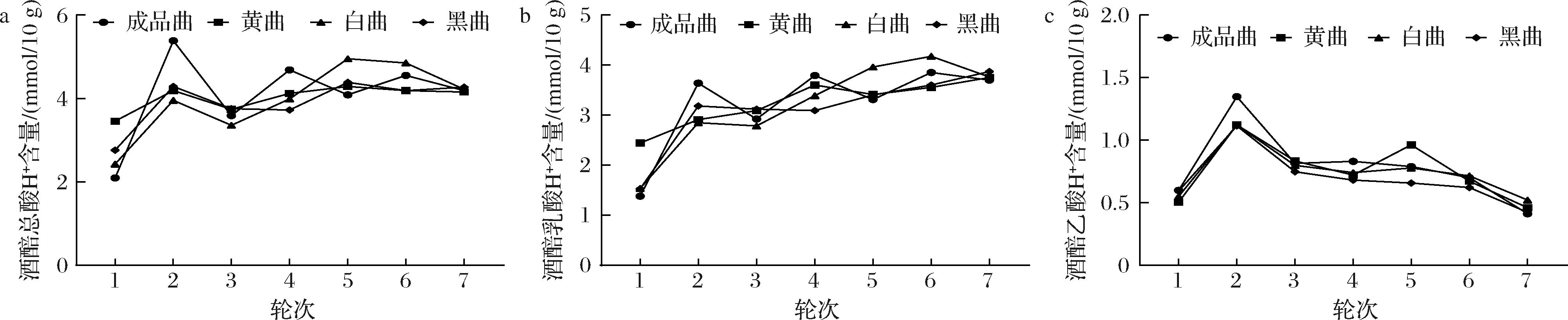
a-总酸;b-乳酸;c-乙酸
图6 不同轮次出窖酒醅有机酸H+含量变化
Fig.6 Changes in organic acid H+ content in fermented grains released from the cellar in different rounds
2.3 不同轮次酒样风味物质变化及相关性分析
根据不同颜色大曲在各个轮次发酵后酒样中的主要风味物质含量,利用偏最小二乘法判别分析(partial least squares discriminant analysis,PLS-DA)建立聚类模型分析。如图7所示,酒样的聚类主要是依据轮次进行的聚集,而并非根据不同颜色高温大曲进行聚类,因此认为酱香白酒发酵过程中,轮次对酒样风味的影响要远远大于不同颜色大曲对酒样风味的影响。
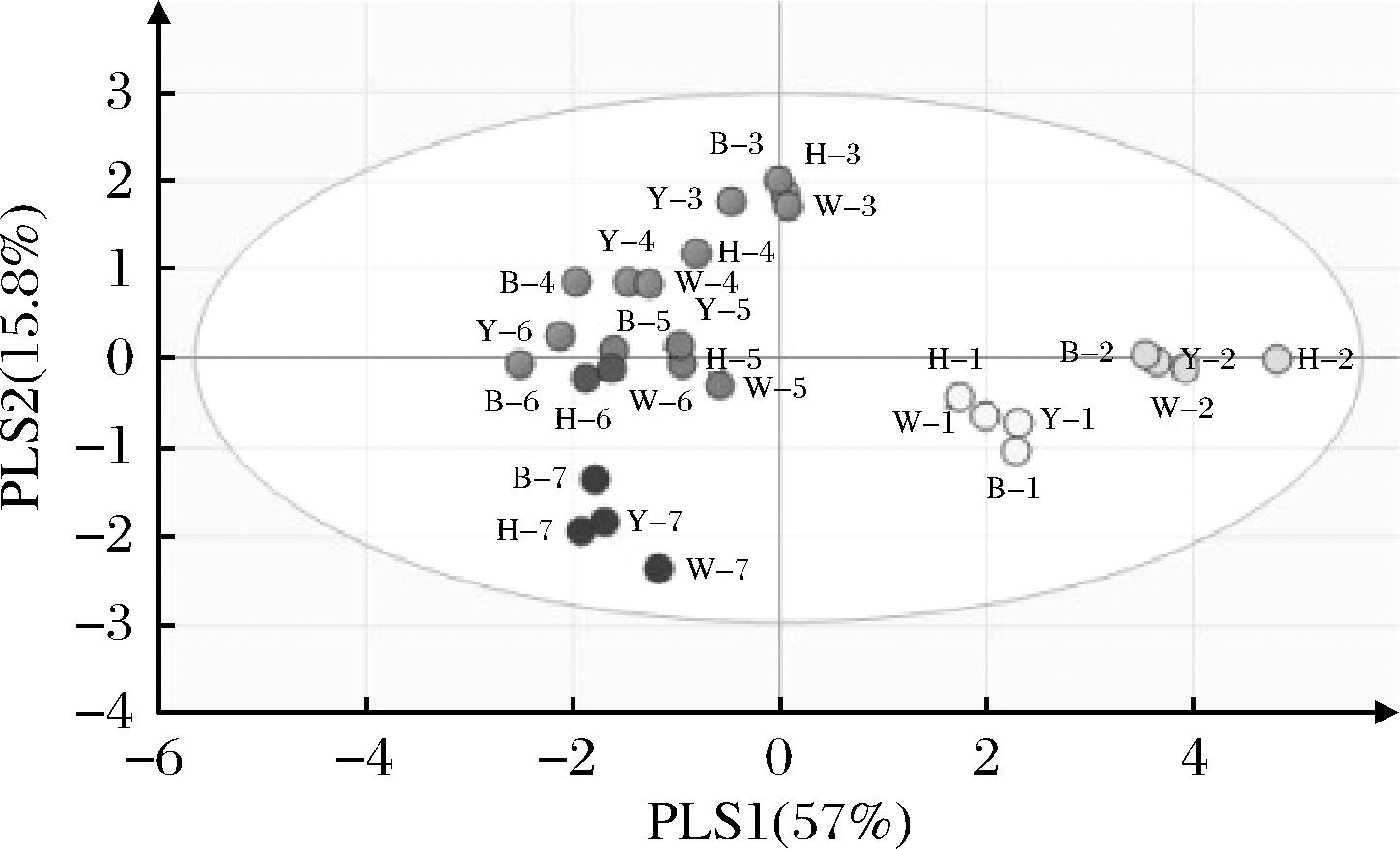
图7 不同轮次酒样主要风味物质PLS-DA结果
Fig.7 PLS-DA results for main flavor compounds in liquor from different rounds
注:图中数字1~7代表1~7轮次酒,H、Y、W、B分别代表成品曲组、黄曲组、白曲组、黑曲组。
通过聚类热图分析不同轮次中不同颜色大曲对酒样中风味物质的影响。图8-a结果表明,在第1轮次中使用黑曲发酵的酒样中高级醇的含量显著高于使用其他类型大曲发酵的酒样,其中正丙醇的增加最为显著。通过对大曲酶活性特征与酒样主要风味物质的相关性分析。结果显示,酒样中异戊醇含量与大曲的液化力呈极显著负相关(r=-0.993),其次是糖化力(r=-0.972)和酯化力(r=-0.953)。同时,蛋白酶活性与高级醇含量呈显著负相关(r=-0.974),与正丙醇含量也呈显著负相关(r=-0.982)(图8-b)。在第1轮次阶段,黑曲的蛋白酶活性较低,导致其分解蛋白质的能力较弱,从而无法及时提供微生物所需的氮源。在这种低氮环境下,微生物可能更倾向于进行糖代谢,以促进高级醇的合成[23],从而导致正丙醇含量显著增加。酱香白酒第1轮次酒中正丙醇含量较高是许多企业面临的问题,因此在第1轮次中减少成品曲中黑曲的比例,有望缓解这一问题。

a-1轮次酒样热图;b-1轮次酒样相关性分析;c-5轮次酒样热图;d-5轮次酒样相关性分析;e-7轮次酒样热图;f-7轮次酒样相关性分析
图8 不同轮次酒样主要风味物质热图,大曲酶活力性质与酒样风味物质相关性分析结果
Fig.8 Heatmap of main flavor substances of liquor from different rounds, correlation analysis results between Daqu enzyme activity properties and flavor substances of liquor
注:图中*表示在P<0.05水平上显著,**表示在P<0.01水平上极显著。
在白酒的诸多微量成分中,酯类化合物扮演了关键角色,通常赋予酒以愉悦的果香味。在第5轮次使用白曲进行发酵时,酒样中酯类物质(总酯、乳酸乙酯和乙酸乙酯)的含量显著高于使用其他曲发酵的5轮次酒样(图8-c)。酶活力和酒样风味物质相关性分析显示,在第5轮次时,大曲的糖化力、液化力和酯化力均与酒样中的酯类物质含量呈正相关,其中液化力与乙酸乙酯的相关性最为显著(r=0.967)(图8-d),因此在5轮次酒“大回酒”阶段,在成品曲的构成中增加酶活力更高的白曲比例,进而期望提高酒样中酯类风味物质的含量,是一种值得企业借鉴的方法。
第7轮次使用白曲进行发酵的酒样中各种风味物质含量普遍高于其他酒样(图8-e),主要表现在醇类和酯类物质。酶活力和酒样风味物质相关性分析结果显示,在第7轮次时,大曲的酯化力与总酯以及乳酸乙酯呈显著正相关,大曲的蛋白酶活性与高级醇、正丙醇、总酸和乙醇也呈显著正相关(图8-f)。添加具有较高蛋白酶活性和酯化力的白曲后,水解酶促进了蛋白质、淀粉和脂肪等物质的水解和转化,为微生物提供了充足的碳源和氮源,进而为更丰富的风味物质形成提供了基础[24]。因此,在第7轮次阶段,增加成品曲中白曲的比例有助于提高酒的风味物质含量。
3 结论
4种不同高温大曲的理化指标和酶活性质存在一定的差异性。白曲在酶活性方面具有明显优势,而黑曲的酸度和还原糖含量相对于其他大曲较高。使用不同颜色大曲贯穿整个生产周期的原位发酵实验结果显示,在第1轮次阶段,使用黑曲发酵后酒样中正丙醇含量显著高于其他酒样,因此在第1轮次阶段,通过减少成品曲中黑曲的比例,有望降低1轮次酒中正丙醇的含量。在第5轮次阶段,使用白曲发酵的酒样中酯类物质含量显著高于其他酒样,因此在大回酒阶段,适当增加白曲在成品曲中的占比,进而提高曲中酶活力,期望提高大回酒中的酯类物质含量,从而提升酒的品质和风味。在最后1个轮次阶段,使用白曲发酵的酒样中各种风味物质含量高于其他酒样,因此认为在第7轮次阶段增加成品曲中白曲的比例可有效提高酒样中风味物质含量以及出酒率。本研究结果为酱香型白酒企业的配曲工艺提供了理论支持。
[1] CAI W C, WANG Y R, WANG W P, et al.Insights into the aroma profile of sauce-flavor Baijiu by GC-IMS combined with multivariate statistical analysis[J].Journal of Analytical Methods in Chemistry, 2022, 2022(1):4614330.
[2] 崔东琦. 基于微生物组合的强化曲制备及其应用初探[D].贵阳:贵州大学, 2023.
Cui D Q.A preliminary study on the preparation and application of enhanced Daqu based on microbial combination[D].Guiyang:Guizhou University, 2023.
[3] 戴奕杰. 酱香型白酒酿造过程中微生物群落组成及其与酒品质的关系[D].长沙:湖南农业大学, 2021.
DAI Y J.The composition of microbial community and its relationship with liquor quality in the brewing process of Maotai-flavor liquor[D].Changsha:Hunan Agricultural University, 2021.
[4] 刘婧玮, 蒋英丽, 沈毅, 等.酱香型白酒中风味物质的成因研究现状[J].酿酒科技, 2013(5):85-89.
LIU J W, JIANG Y L, SHEN Y, et al.Research on the formation of flavoring substances in Jiang-flavor liquor[J].Liquor-Making Science &Technology, 2013(5):85-89.
[5] WANG B W, WU Q, XU Y, et al.Specific volumetric weight-driven shift in microbiota compositions with saccharifying activity change in starter for Chinese Baijiu fermentation[J].Frontiers in Microbiology, 2018, 9:2349.
[6] WANG Y R, CAI W C, WANG W P, et al.Analysis of microbial diversity and functional differences in different types of high-temperature Daqu[J].Food Science &Nutrition, 2021, 9(2):1003-1016.
[7] GAN S H, YANG F, SAHU S K, et al.Deciphering the composition and functional profile of the microbial communities in Chinese Moutai liquor starters[J].Frontiers in Microbiology, 2019, 10:1540.
[8] PANG Z M, LI W W, HAO J, et al.Correlational analysis of the physicochemical indexes, volatile flavor components, and microbial communities of high-temperature Daqu in the northern region of China[J].Foods, 2023, 12(2):326.
[9] 罗帅, 张巧玲, 杨帆, 等.基于非靶向代谢组学分析酱香型大曲中抑菌黑曲的功能成分[J].食品与发酵工业, 2022, 48(14):16-23.
LUO S, ZHANG Q L, YANG F, et al.Analysis of functional components of antibacterial black Daqu in sauce-flavored Daqu based on non-targeted metabolomics[J].Food and Fermentation Industries, 2022, 48(14):16-23.
[10] DENG L, MAO X, LIU D, et al.Comparative analysis of physicochemical properties and microbial composition in high-temperature Daqu with different colors[J].Frontiers in Microbiology, 2020, 11:588117.
[11] GUO Z, XIANG F S, HOU Q C, et al.Analysis of bacterial community structure and taste quality of different colored high-temperature Daqu in the Xiangyang region, China[J].LWT, 2023, 188:115411.
[12] 沈世明, 张娇娇, 张高瑜, 等.酱香型大曲贮存过程曲香风味物质变化的分析[J].中国酿造, 2022, 41(7):58-63.
SHEN S M, ZHANG J J, ZHANG G Y, et al.Change of the flavor substances of sauce-flavor Daqu during the storage[J].China Brewing, 2022, 41(7):58-63.
[13] 班世栋, 王晓丹, 胡宝东, 等.酱香型大曲中水解酶系研究[J].酿酒科技, 2015(4):13-19.
BAN S D, WANG X D, HU B D, et al.Hydrolyzing enzymes in Jiangxiang Daqu[J].Liquor-Making Science &Technology, 2015(4):13-19.
[14] 何猛超, 任义平, 熊林, 等.茅台地区不同高温大曲微生物群落结构解析[J].中国酿造, 2022, 41(6):51-57.
HE M C, REN Y P, XIONG L, et al.Microbial community structure of different high-temperature Daqu in Maotai area[J].China Brewing, 2022, 41(6):51-57.
[15] 王颖, 邱勇, 王隆, 等.不同产区酱香型高温大曲黑、白、黄曲的理化、挥发性成分差异性分析[J].中国调味品, 2022, 47(6):155-159.
WANG Y, QIU Y, WANG L, et al.Analysis on the differences of physicochemical indexes and volatile components of black, white and yellow koji at high temperature with Maotai flavor in different production areas[J].China Condiment, 2022, 47(6):155-159.
[16] ABERNATHY D G, SPEDDING G, STARCHER B.Analysis of protein and total usable nitrogen in beer and wine using a microwell ninhydrin assay[J].Journal of the Institute of Brewing, 2009, 115(2):122-127.
[17] 宿萌. 酱香型白酒发酵体系中优良酵母的筛选[D].天津:天津科技大学, 2024.
SU M.Screening of excellent yeast in fermentation system of Maotai-flavor liquor[D].Tianjin:Tianjin University of Science and Technology, 2024.
[18] 肖蓓. 酱香大曲中细菌类群关系研究与功能细菌筛选[D].贵阳:贵州大学, 2017.
XIAO B.Study on the relationship between bacterial groups and screening of functional bacteria in Maotai-flavor Daqu[D].Guiyang:Guizhou University, 2017.
[19] 赵金松, 张良, 孙啸涛, 等.酱香型大曲微生物群落特征与理化指标的相关性研究[J].基因组学与应用生物学, 2019, 38(1):199-204.
ZHAO J S, ZHANG L, SUN X T, et al.Study on the correlations between microbial community characteristics and physicochemical indicators of Maotai-flavor daqu[J].Genomics and Applied Biology, 2019, 38(1):199-204.
[20] 杨志波. 酱香型白酒糟资源化综合利用的研究[D].贵阳:贵州大学, 2021.
YANG Z B.Research on the comprehensive utilization of Maotai-flavor liquor dregs resources[D].Guiyang:Guizhou University, 2021.
[21] 刘晶晶. 大曲酶系和代谢物组分析及其中产复合酶菌株的应用研究[D].北京:中国农业大学, 2018.
LIU J J.Analysis of enzymes and metabolomies in Daqu, and application of compound enzyme-producing Bacillus from Daqu[D].Beijing:China Agricultural University, 2018.
[22] LUND M N, RAY C A.Control of Maillard reactions in foods:strategies and chemical mechanisms[J].Journal of Agricultural and Food Chemistry, 2017, 65(23):4537-4552.
[23] 董书甲. 氮源对酿酒酵母代谢产物的影响[D].济南:齐鲁工业大学, 2020.
DONG S J.Effects of nitrogen sources on the metabolites of Saccharomyces cerevisiae[D].Jinan:Qilu University of Technology,2020
[24] 唐胜球, 董小英, 许梓荣.酒用酸性蛋白酶的研究进展[J].酿酒科技, 2005(1):41-44.
TANG S Q, DONG X Y, XU Z R.Study on acid protease for liquor production[J].Liquor-making Science &Technology, 2005(1):41-44.