大曲作为一种含酶和微生物的发酵剂,广泛应用于白酒生产中[1]。以大曲为糖化发酵剂生产的酒类是区别于欧美国家酿酒重要特征[2]。大曲通常以小麦、大麦和豌豆等为原料,经破碎,加水拌料,压成砖块状的曲坯后,在人工控制温、湿度下富集环境中的微生物而制成[3]。大曲中的微生物和酶的种类和数量因制曲原料、制曲温度和环境等因素而不同[4]。
大曲中的微生物组成对白酒的质量具有重要的影响,有“曲乃酒之骨”一说[5]。因此,研究大曲微生物组成以及不同大曲间在微生物组成上的差异是研究不同白酒风味差异形成原因的基础。大曲的开放式生产方式使得不同生产环境所得大曲中微生物组成存在差异[6],这也是不同地区白酒具有很强的地域风格的一个重要原因[7]。我国南方地区气候湿润多雨,昼夜温差小且一年四季温度变化相差小。相比于南方,北方地区气候干燥且昼夜温差大,四季分明。研究表明,南北方清香型白酒大曲中的优势菌属是一致的,而且南方清香型白酒大曲乳酸菌属较北方清香型大曲丰富[8]。从风味上来看,不同地区的同一香型白酒也存在较大差异,如淮河流域生产的浓香型白酒相比四川盆地的浓香型白酒具有浓郁的烘烤味和酱油味[9-10]。
内蒙古自治区地处北疆,是我国白酒产量较大的省份[11]。内蒙古从西到东横跨2 000多公里,各种生态环境汇聚,拥有独特的酿酒资源。因此受自然环境及生产工艺的影响,内蒙古地区生产的白酒具有其自身的特点及独特的风味[12]。而大曲对白酒的风味有重大影响,大曲的理化指标是衡量大曲质量的重要参数对大曲的质量起决定性的作用。此外,大曲是重要的微生物来源,大曲发酵过程中,在开放的条件下网罗环境中的微生物。因此对大曲理化性质和微生物多样性的研究显得尤为重要。本研究以内蒙古地区7个规模以上白酒企业使用的中温大曲为研究对象,利用理化分析及高通量测序技术,初步揭示内蒙古中温大曲理化指标和微生物多样性组成差异,为进一步推动差异化发展,打造地区特色白酒奠定基础。
1 材料与方法
1.1 材料与试剂
原料:中温大曲样品于2021年11~12月采集自内蒙古7个规模以上白酒生产企业,分别来自LT、HT、MGW、ST、EEDS、YHD和HB。7种大曲原料以大麦和豌豆为主,顶温为55~60 ℃,培曲时间约为1个月,不同企业略有差别。样品采集地点如表1所示,每个酒企中各采集3块常用大曲,每块大曲采用五点式取样后混为一个样品。
表1 样本采集地点
Table 1 Sample collection location

样品名称采样地点LT内蒙古自治区包头市东河区HT内蒙古自治区巴彦淖尔市杭锦后旗MGW内蒙古自治区通辽市科尔沁区ST内蒙古自治区巴彦淖尔市乌拉特前旗EEDS内蒙古自治区鄂尔多斯市东胜区YHD内蒙古自治区鄂尔多斯市伊金霍洛旗HB内蒙古自治区呼和浩特市土默特左旗
1.2 仪器与设备
FA2104N电子天平,上海箐海有限公司;XMTD-8222恒温水浴锅,上海精宏实验设备有限公司;T6紫外可见分光光度计,北京普析通用仪器有限责任公司;DHG-9053A电热鼓风干燥箱、GHP-9080恒温培养箱,上海一恒科学仪器有限公司。
1.3 实验方法
1.3.1 理化测定方法
大曲的水分、酸度、液化力、糖化力和发酵力参照QB/T 4257—2011《酿酒大曲通用分析方法》测定。
1.3.2 微生物分析方法
1.3.2.1 基因组DNA提取与PCR扩增
使用Fast DNA® SPIN kit for Soil试剂盒进行基因组DNA抽提后,利用Thermo NanoDrop One 检测DNA的纯度和浓度。以基因组DNA为模板,根据测序区域的选择,使用带barcode的特异引物及TaKaRa Premix Taq® Version 2.0进行PCR扩增。使用Illumina Nova 6000平台对构建的扩增子文库进行PE250测序。
1.3.2.2 数据处理
测序所得数据利用fastp(an ultra-fast all-in-one FASTQ preprocessor,version 0.14.1,https://github.com/OpenGene/fastp)拼接后以97%相似度进行操作分类单元(operational taxonomic units,OTU)划分,将每个OTU的代表序列与SILVA(16S)、Unite(ITS)数据库进行比对获得物种注释信息。得到的数据由美格基因公司提供的在线平台(magigene.com)和R 4.3.0进行处理。使用SPSS 26.0和Origin 2021绘制大曲的理化性质柱状图以及微生物的Alpha多样性箱线图。菌群群落组成和主坐标分析使用https://www.majorbio.com在线平台。使用联川生物云平台(omicstudio.cn)分析并绘制大曲理化性质与微生物相关性热图。采用线性判别分析(linear discriminant analysis effect size,LEfSe)确定样品间的显著差异物种。
2 结果与分析
2.1 大曲的理化性质
经过测定后得出,7份大曲样品在含水量、酸度、糖化力、液化力和发酵力上存在差异,结果如图1所示。7份大曲的含水量为5%~7%,EEDS、LT和MGW的水分含量较高,分别为(6.87±0.06)%、(6.86±0.11)%和(6.84±0.12)%,显著高于其他样品(P<0.05)。HB的含水量显著低于其他样品(P<0.05),为(5.76±0.11) g/100 g。在酸度上7份大曲存在显著差异,MGW最高[(1.25±0.03) mmol/10 g],与除HT[(1.04±0.23) mmol/10 g]外的其他样品相比差异显著(P<0.05)。EEDS、HB、LT、ST和YHD样品的酸度间无显著性差异(P>0.05),MGW的显著高于除HT以外的其他样品(P<0.05)。在糖化力上,EEDS的显著高于其他样品[(979.18±168.80) U,P<0.05],HB的糖化力为(182.65±39.41) U,显著低于EEDS、HT和LT(P<0.05)。在液化力上,EEDS显著高于其他样品[(3.09±0.59) U,P<0.05],HB、HT、MGW和ST样品的液化力显著低于其他样品[(0.55±0.08)、(0.69±0.16)、(0.48±0.03) 和(0.66±0.18) U,P<0.05)]。在发酵力上,EEDS[(1.25±0.17 U)]样品显著高于HB、ST和YHD样品(P<0.05)。
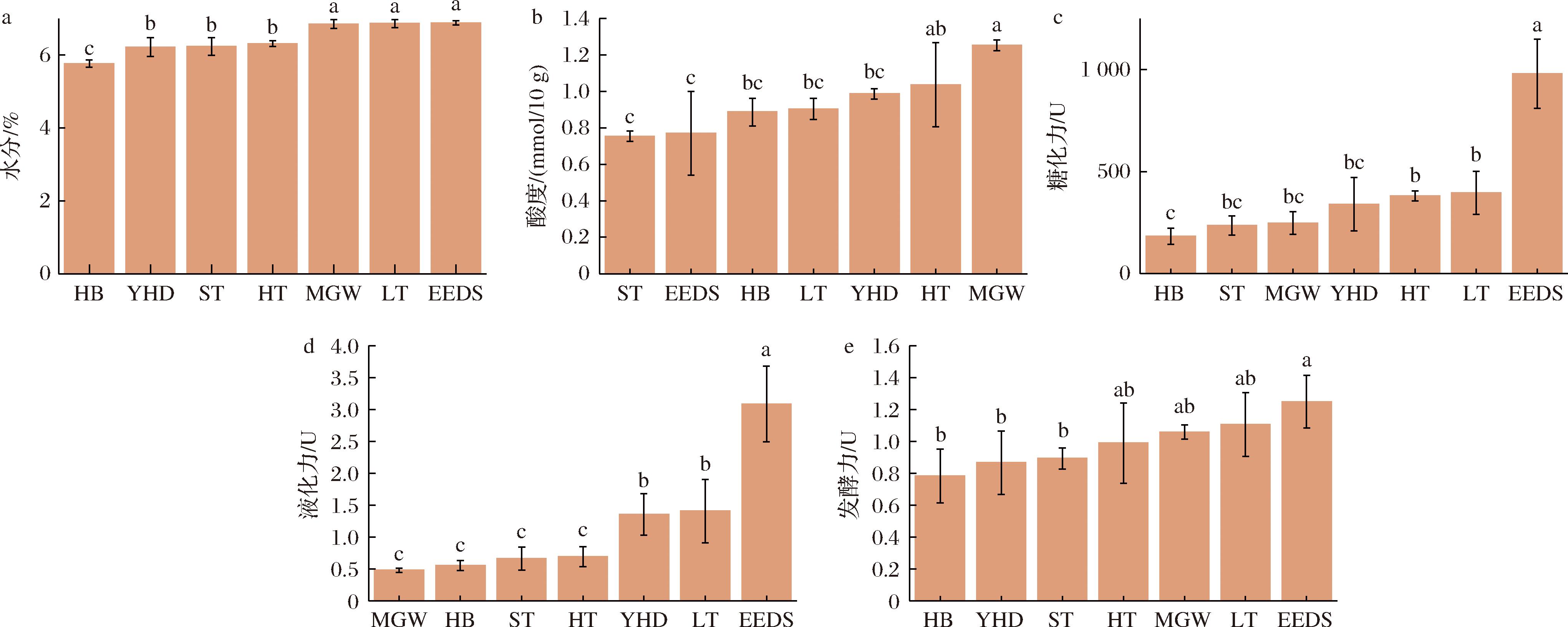
a-水分;b-酸度;c-糖化力;d-液化力;e-发酵力
图1 大曲的理化性质
Fig.1 Physicochemical properties of Daqu samples
注:不同字母表示3个样品之间的理化指标的显著差异(P<0.05)。
大曲的理化指标是衡量大曲质量的重要参数[13]。一般来说,大曲中的含水量不应超过13.0%[14]。本研究中7份大曲的水分含量虽然具有显著性差异(图1),但均满足该标准。EEDS大曲的糖化力和液化力都显著高于其他6种大曲,需进一步通过微生物组成来分析造成差异的原因。
2.2 大曲微生物多样性
2.2.1 大曲微生物α多样性分析
经测序、分析后,从7份大曲样品中共获得174 111个细菌和237 135个真菌扩增片段。进一步基于97%相似划分OTU后发现LT、MGW、HT、ST、EEDS、YHD和HB中细菌OTU的平均数量分别为283、227、336、265、199、238和232,真菌OTU的平均数量为144、198、128、162、187、164和137,可见所有样品中细菌OTU的数量显著高于真菌OTU的数量。
计算7个样品的Shannon指数和Chao1指数后得出,各样品间多样性指数存在显著差异(图2)。细菌Shannon指数显示,EEDS与HT最低且之间存在显著差异(P<0.05),MGW最高,其余样品间无显著差异(P>0.05)。细菌Chao1指数显示EEDS与HT最低但之间无显著差异(P>0.05),MGW最高,显著高于其余样品(P<0.05),其余样品间无显著差异(P>0.05)。真菌Shannon指数显示,HT、HB、LT和ST最低且之间无显著差异(P>0.05),YHD最高,与其余样品无显著差异(P>0.05)。真菌Chao1指数显示HT、HB与LT最低且之间无显著差异(P>0.05),MGW与EEDS最高且与其余样品无显著差异(P>0.05)。由此可知EEDS细菌群落多样性(Shannon指数)显著低于其他样品,其余样品在细菌群落的丰富度上(Chao1指数)无显著差异,真菌的多样性(Shannon指数)和群落丰富度上(Chao1指数)无显著差异。
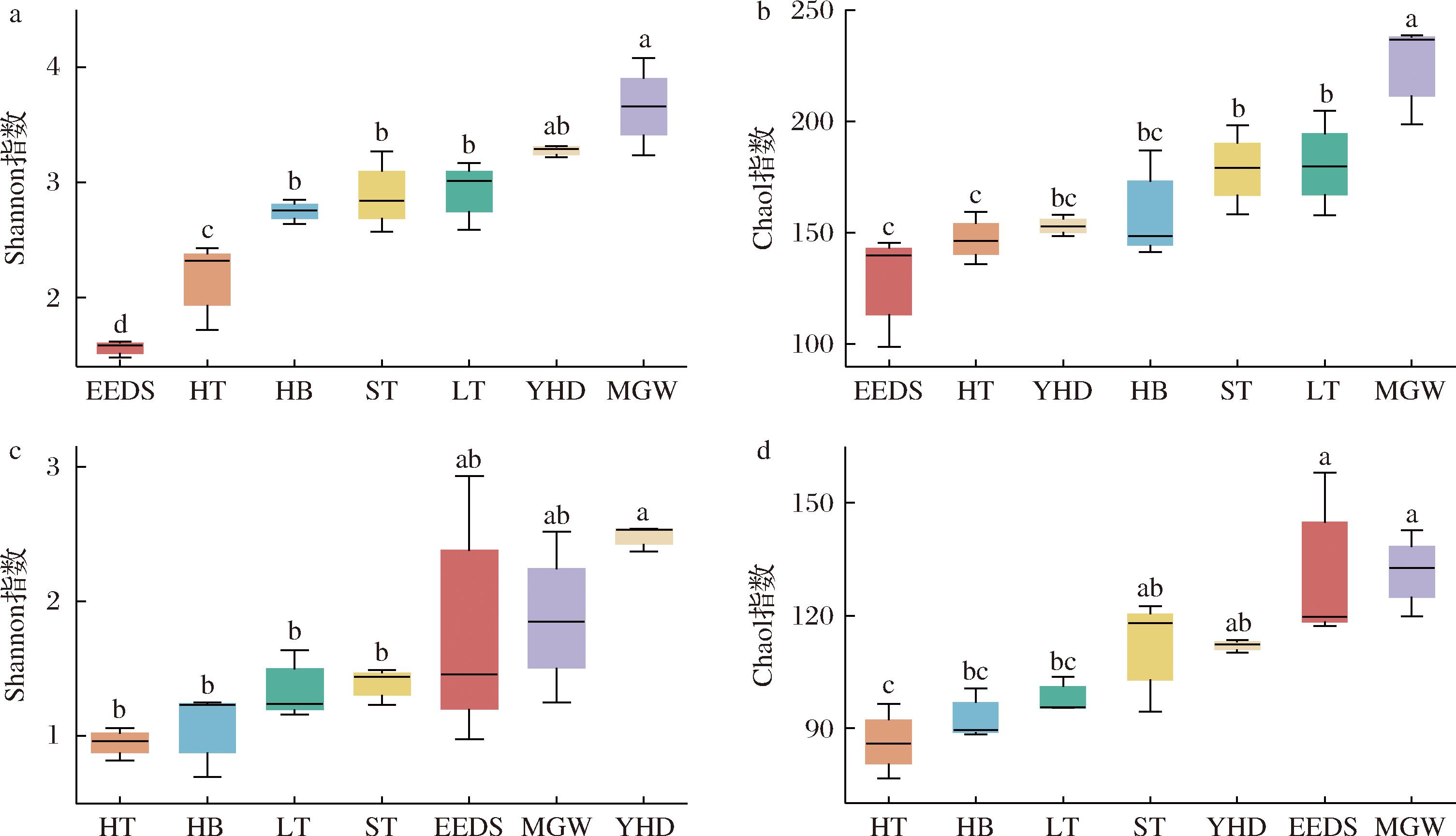
a-细菌Shannon指数;b-细菌Chao1指数;c-真菌Shannon指数;d-真菌Chao1指数
图2 大曲样品中微生物多样性指数
Fig.2 Microbial diversity indexes of Daqu samples

a-细菌门水平;b-真菌门水平;c-细菌属水平;d-真菌属水平
图3 大曲微生物群落组成
Fig.3 Microbiotic community composition of Daqu
注:others:相对丰度<0.01%的其他菌门或菌属;Firmicutes:厚壁菌门;Proteobacteria:变形菌门;Actinobacteria:放线菌门;Ascomycota:子囊菌门;Mucoromnycota:毛霉菌属;Basidiomycota:担子菌门;Sireptomyces:链霉菌属;Staphyiococeus:葡萄球菌属;Weissella:魏斯氏菌属;Baciltus:芽孢杆菌属;Lactobacillus:乳杆菌属;Kroppenstedtia:克罗彭斯特菌属;Pseudomonas:假单胞菌属;Acinetobacter:不动杆菌属;Pediococcus:片球菌属;Saccharopolyspora:糖多孢菌属;Leuconostoc:明串珠菌属;Oceanobacillus:海洋杆菌属;Cupriavidus:贪铜菌属;Acetobacter:醋酸杆菌属:Aspergillus:曲霉菌属; Theromyces:嗜热真菌属;Rhizopus:根霉菌属;Monascus:红曲霉属;Lichtheimia:横梗霉属;Issatchenkia:伊萨酵母属。
由此可知7份大曲的真菌微生物群落多样性明显低于细菌微生物群落。这是由于真菌较细菌对温度更敏感,在大曲生产过程中发酵温度升高使不耐热的酵母菌和霉菌被消除,少数耐热和嗜热微生物存活[15]。报道显示,在大曲自然发酵过程中,真菌的相对丰度会受到不利条件的影响而降低[16]。
2.2.2 大曲微生物群落组成
7份大曲中微生物组成各有特点,也有相似之处。总体来看,在各大曲样本中Firmicutes、Actinobacteria和Proteobacteria是主要的细菌菌门(图3-a),这个结果与之前报道的结果一致[14]。Ascomycota和Mucoromycot是主要的真菌菌门(图3-b)。由图3-c可知,在细菌属水平上,每份大曲均存在Unassigned(未识别)的菌属;同样,由图3-d可知,在真菌属水平上,unidentified(未识别)的菌属占比整体较高,原因可能因为有由于数据库中的信息不完整或者不准确,导致序列没有办法准确匹配到已知的菌属。有时候样本可能包含一些未知的物种,可能是未经充分研究的,新的或者罕见的物种,因此无法在现有的数据库中找到匹配项[17]。在细菌属水平上MGW的优势菌属是Staphylococcus,在真菌属水平上MGW的优势菌属是Aspergillus。HT在细菌属水平上的优势菌属是Staphylococcus,而真菌属水平上的优势菌属是Thermomyces。EEDS在细菌属水平上Pseudomonas的相对丰度较高,在真菌属水平上优势菌属为Aspergillus。 HB在属水平上的优势细菌为Streptomyces,优势真菌为Monascus。LT在细菌属水平上Streptomyces的相对丰度最高,在真菌属水平上优势菌属为Rhizopus。ST在细菌属水平上的优势菌属为Streptomyces,在真菌属水平上优势菌属为Aspergillu。YHD在细菌属水平上的优势菌属为Weissella,在真菌属水平上的优势菌属为Aspergillus。
由以上结果可知,7份大曲在细菌门水平上的组成基本一致,除EEDS和HB外,其余的5种大曲优势菌门都是Firmicutes。7份大曲在真菌门水平上的组成也一致,优势菌门都是Ascomycota。这可能是导致这7份大曲在真菌的多样性和群落丰富度上无显著差异的一个原因。细菌和真菌在门水平上组成一致是北方大曲的共有的特点[14]。
2.2.3 大曲微生物β多样性分析
利用主坐标分析了7份大曲样品间微生物群落差异,结果如图4-a所示。从细菌的角度来看,HT和MGW样品相互靠近,且与其他5个样品相距较远,说明HT和MGW间的细菌群落相似性较高。从真菌的角度来看(图4-b),与细菌类似,HT与其余6种大曲在真菌群落上存在差异。基于以上,可将7份大曲样品分别在细菌和真菌的群落上分别分为2组,即细菌:a组(EEDS、HB、LT、ST和YHD)和b组(HT和MGW),在真菌群落上c组(EEDS、ST、LT、HB、MG和YHD)和d组(HT)。分组结果可以更直观地反应(图4-c和图4-d)细菌与真菌在群落组成上的差异。
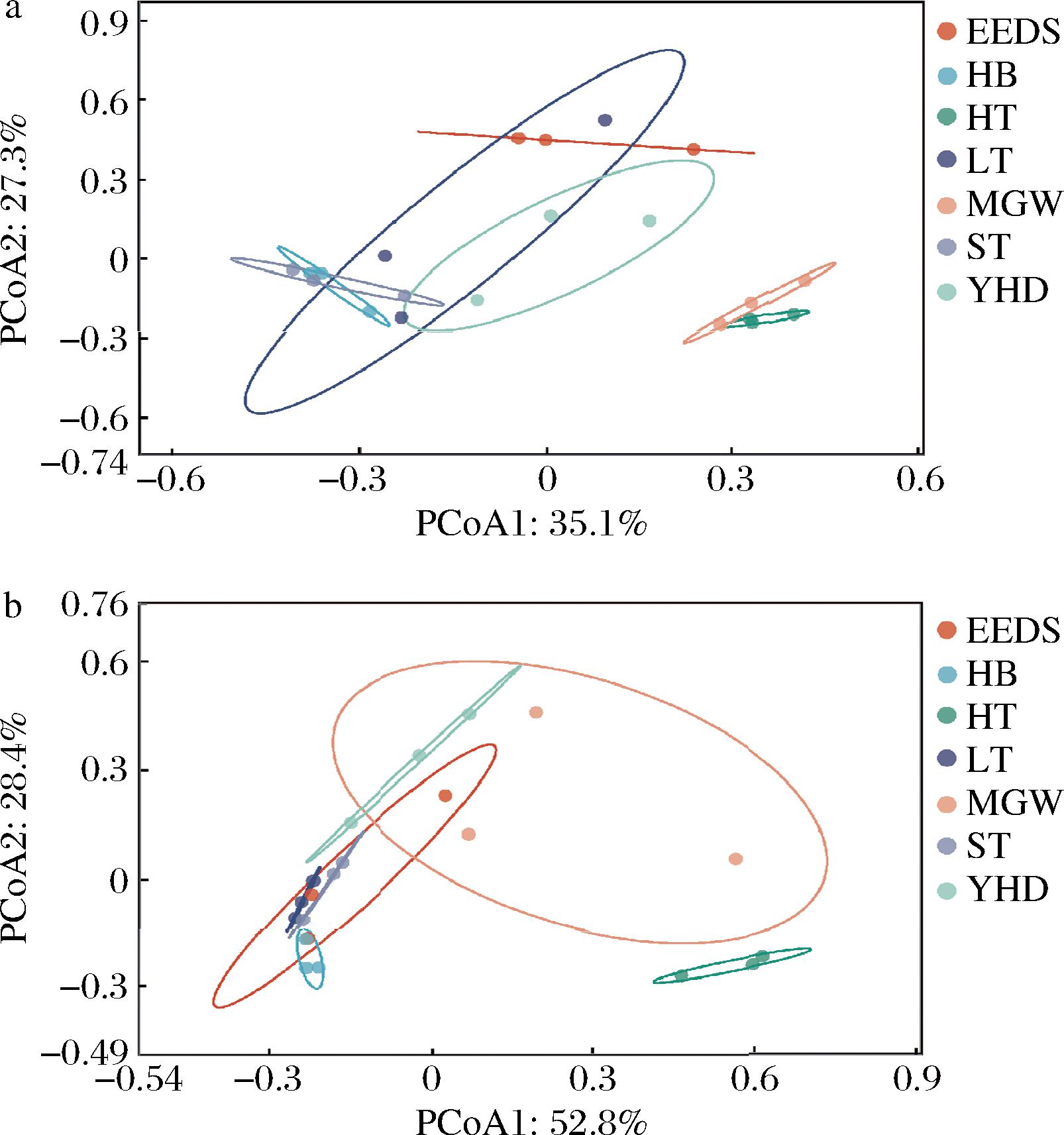
a-细菌群落;b-真菌群落
图4 大曲微生物群落β多样性的主坐标分析
Fig.4 Principal coordinates analysis of the β-diversity of the Daqu microbial community
2.2.4 大曲间差异物种分析
为进一步分析不同大曲样品中细菌和真菌群落结构的差异,基于上一部分分析结果,将7份大曲在细菌和真菌群落上分别分成2组后,以3.0的LDA阈值得分进行LEfSe分析。结果显示,在细菌中有2个差异菌属,在真菌群落中有9个差异菌属(P<0.05,结果如图5所示)。在细菌群落中,b组差异显著的菌属是Staphylococcus,在真菌群落中,c组差异显著的菌属为Aspergillus,d组差异显著的菌属为Thermomyces。
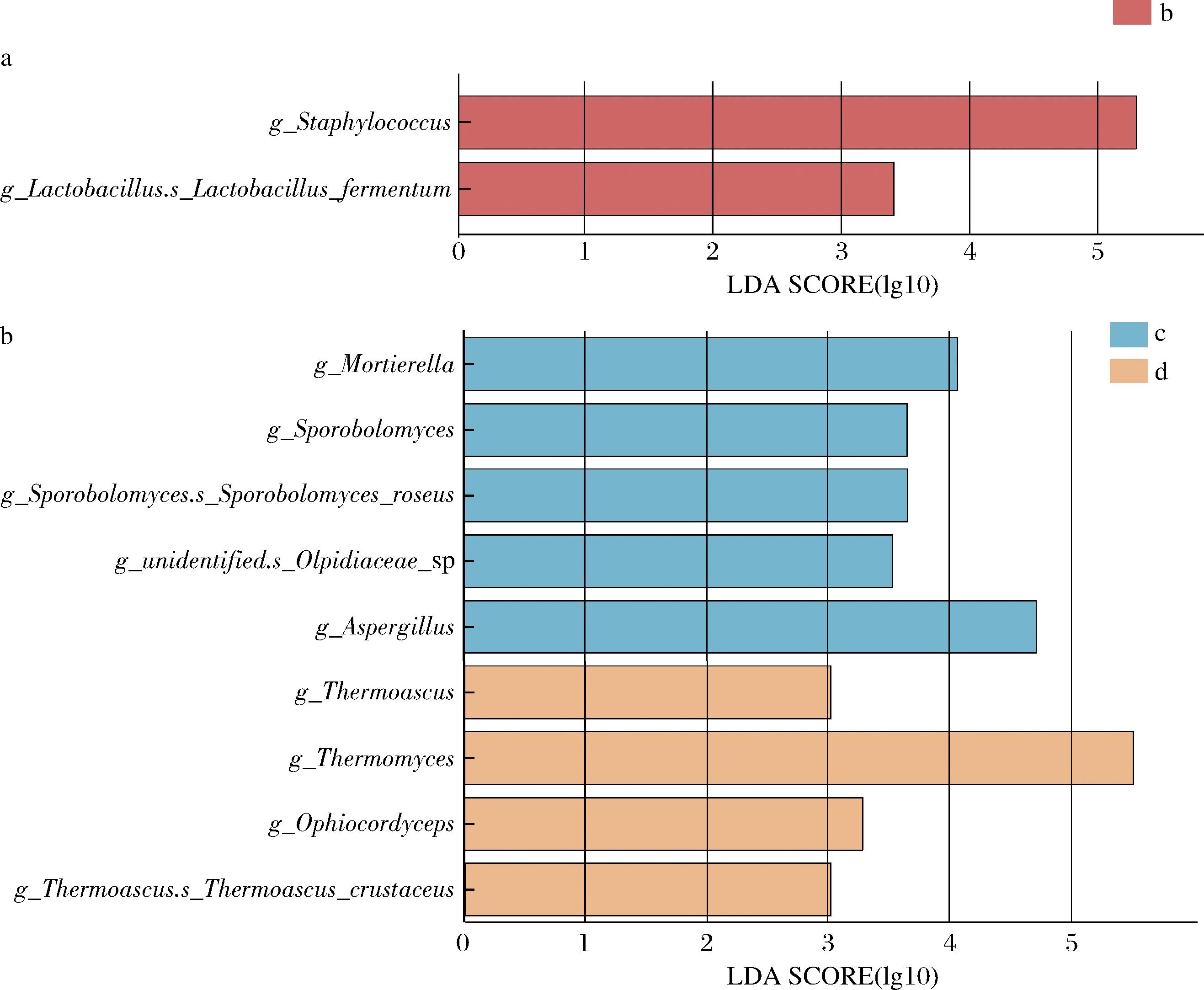
a-细菌群落;b-真菌群落
图5 大曲微生物群的LEfSe分析
Fig.5 LEfSe analysis results of microbial community in Daqu
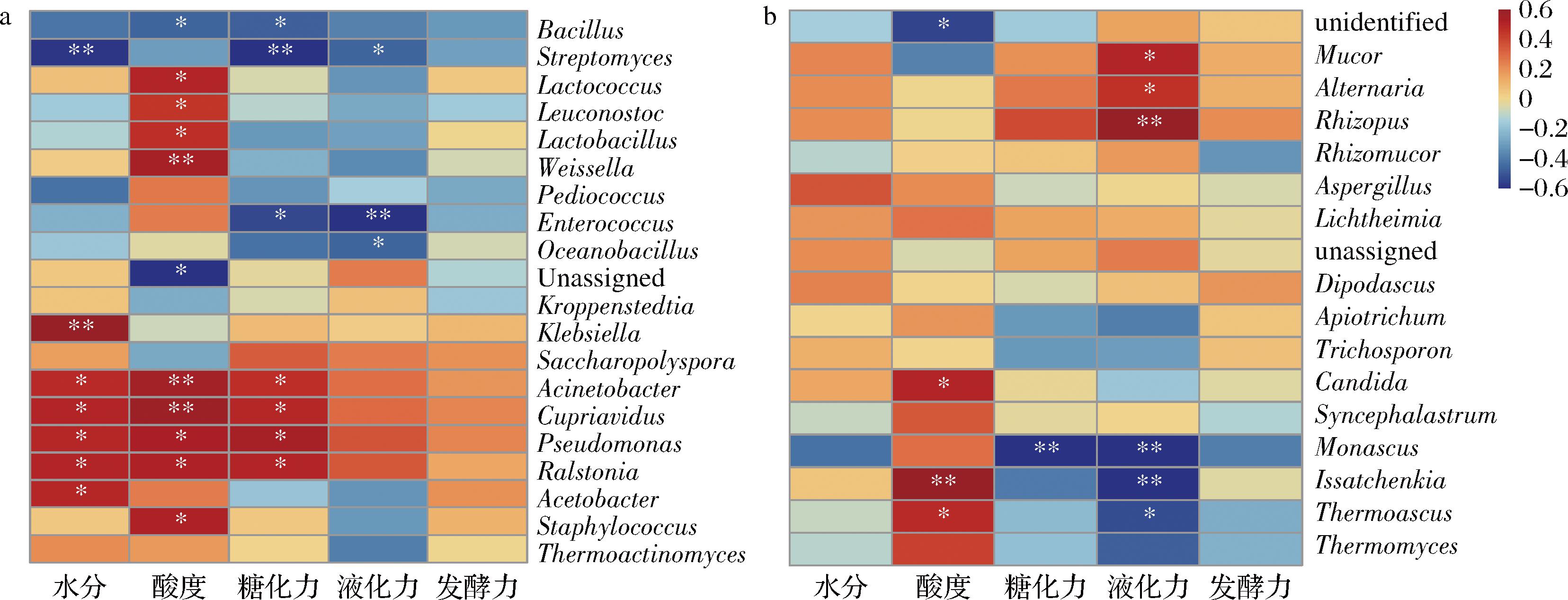
a-细菌群落;b-真菌群落
图6 大曲微生物群落与理化性质之间的斯皮尔曼相关性系数热图
Fig.6 Heatmap of Spearman correlation coefficient between microbial community and physicochemical properties in Daqu
注:相对丰度>0.01%的群落(**:P<0.01,*:P<0.05)。
2.2.5 大曲样品中优势菌属与理化性质相关性分析
挑选相对丰度大于0.01%的前20个细菌属,相对丰度大于0.01%的前17个真菌属(相对丰度大于0.01%的真菌属不足20个)。利用Spearman相关系数建立了7份大曲样品中优势细菌和真菌属水平与理化指标的相关性,结果如图6所示。分别有16个优势细菌属和9个优势真菌属与理化指标呈显著相关性(P<0.05)。其中,MGW与HT的优势细菌属Staphylococcus与酸度呈显著正相关(P<0.05),EEDS的优势细菌属Pseudomonas与水分、酸度、糖化力都成显著正相关(P<0.05),HB、LT和ST的优势细菌属Streptomyces与水分、糖化力和液化力呈显著负相关(P<0.05),YHD的优势细菌属Weissella与酸度呈显著正相关(P<0.01)。HB的优势真菌属Monascus与糖化力和液化力呈显著负相关(P<0.05),LT的优势真菌属Rhizopus与液化力呈显著正相关(P<0.01)。优势细菌和真菌中均没有与发酵力显著相关的属。b组的差异性细菌属Staphylococcus与酸度呈显著正相关(P<0.05)。
3 讨论与结论
在本研究中,由7份中温大曲的α多样性分析结果可知,MGW的细菌群落丰富度和多样性以及真菌群落丰富度都显著高于其他样品,这可能是由于MGW特殊地理位置有关。内蒙古东部的降水量及其气候的湿度相对内蒙古中西部较高,气候潮湿有利于微生物的生长[18]。研究表明,在大曲的生产和存储过程中微生物主要来自于原料和环境[19],7份样品分别来自内蒙古的不同地区,各地气候存在差异,且不同原料和生产方式,这些都是造成各地大曲微生物差异的原因。差异分析结果显示,b组的差异细菌属Staphylococcus对乳酸的形成可能有一定贡献[20],Staphylococcus存在于制曲环境、大曲以及酒醅中[21],是HT和MGW(b组)的优势菌属,这可能是b组的酸度高于a组大曲的一个原因。c组的差异真菌属Aspergillus主要位于大曲的中心部分,可以产生蛋白水解酶和其他裂解酶,对风味化合物的形成做出积极贡献[22]。Aspergillus是EEDS、MGW、ST和YHD的优势真菌属,由于Aspergillus与液化力呈负相关(图7),MGW、ST和YHD的液化力在7份样品中不是最高的,而EEDS的液化力却是最高。由此可知,Aspergillus虽然是EEDS的优势真菌属,但是并没有对其液化力造成影响。EEDS的优势细菌属Pseudomonas与液化力和糖化力呈正相关(P<0.05),因此EEDS的液化力与糖化力显著高于其余6份大曲的原因可能与上述菌属有关。d组的差异真菌属Thermomyces可以在高达60 ℃的温度下很好地成长,它是参与白酒酿造工艺和己酸己酯合成的已知核心微生物[23]。Thermomyces是HT的优势真菌属,这可能是HT在酿造白酒中风味区别曲其他酒厂的关键原因。
Streptomyces是一类广泛存在于各类生态系统中重要的微生物,具有分泌碱性磷酸酶、酯酶和磷酸水解酶的能力,增加白酒的风味[24]。其也是HB与ST中的优势菌属,并与糖化力呈显著负相关(P<0.01),结合图1的理化性质可知,HB与ST的糖化力的低可能与Streptomyces是它们的优势菌属有关。MGW的酸度最高,可能是因为 Weissella在MGW中相对丰度较高,其与酸度呈正相关(P<0.01),Weissella能产生细菌素、过氧化氢和有机酸[25],这也是可能导致MGW酸度较高的其中一个原因。LT的优势真菌属Rhizopus是一种嗜热菌,也存在于酿酒谷物原料和大曲中。它通过快速利用碳源产生甘油、乳酸、酶和挥发性化合物来影响酒的风味[16]。由与Rhizopus是LT的优势真菌属,且与液化力呈显著正相关(P<0.01)。LT的液化力的值是这7种大曲中除EEDS外较高的原因可能与此菌属有关,Rhizopus的存在可能使得LT有更加丰富的风味。
综上所述,本研究系统地比较分析了内蒙古地区7份中温大曲的理化指标和微生物群落组成,这7份大曲微生物群落组成在门水平上极为相似,但是在属水平上有较大差异。在菌落组成多样性上,MGW的细菌群落丰富度和多样性以及真菌群落丰富度都显著高于其他样品,且MGW的地理位置与其他6份大曲距离较远,因此大曲的空间分布差异会影响其菌落多样性。将7份大曲按群落组成差异在细菌和真菌群落上分别分成2组,各组的差异性菌属与一些大曲的优势菌属一致,b组的差异性菌属Staphylococcus是HT和MGW的优势细菌属,c组的差异性菌属Aspergillus是EEDS、MGW、ST和YHD的优势真菌属,d组的差异性真菌属Thermomyces是HT的优势真菌属,相对丰度大于0.01%的细菌与真菌菌属中,分别有16种细菌属和9种真菌属与理化指标具有显著相关性(P<0.05)。本研究为内蒙古中温大曲中的微生物在空间上的差异提供了重要的信息。
[1] 敖宗华, 陕小虎, 沈才洪, 等.国内主要大曲相关标准及研究进展[J].酿酒科技, 2010(2):104-108.
AO Z H, SHAN X H, SHEN C H, et al.Domestic related quality standards of Daqu &its research progress[J].Liquor-Making Science &Technology, 2010(2):104-108.
[2] 庄名扬. 中国白酒香味物质形成机理及酿酒工艺的调控[J].四川食品与发酵, 2007, 43(2):1-6.
ZHUANG M Y.The production mechanism of the fragrance in the Chinese spirit &the operation of the spirit brewing[J].Food and Fermentation Sciences &Technology, 2007, 43(2):1-6.
[3] 傅金泉. 我国酒曲的分类及其应用[J].中国酿造, 1983, 2(2):7-10.
FU J Q.Classification and application of koji in China[J].China Brewing, 1983, 2(2):7-10.
[4] 程伟, 吴丽华, 徐亚磊, 等.浓香型白酒酿造微生物研究进展[J].中国酿造, 2014, 33(3):1-4.
CHENG W, WU L H, XU Y L, et al.Research progress on brewing microbes in the production process of Luzhou-flavor liquor[J].China Brewing, 2014, 33(3):1-4.
[5] 刘敏芳, 王昊乾, 唐艺婧, 等.后火曲制作过程中理化、生化指标和微生物菌群变化及其相关性分析[J].中国酿造, 2023, 42(5):70-77.
LIU M F, WANG H Q, TANG Y J, et al.Changes of physicochemical and biochemical indexes and microbial community and analysis during the preparation of Houhuoqu[J].China Brewing, 2023, 42(5):70-77.
[6] 吕云怀, 王莉, 汪地强, 等.不同香型白酒大曲风味物质与其产品风格特征关系的分析[J].酿酒科技, 2012(7):72-75.
LYU Y H, WANG L, WANG D Q, et al.Analysis of the relations between flavoring substances of Daqu of different flavor type and its styles and characteristics[J].Liquor-Making Science &Technology, 2012(7):72-75.
[7] 吴树坤, 谢军, 卫春会, 等.四川不同地区浓香型大曲微生物群落结构比较[J].食品科学, 2019, 40(14):144-152.
WU S K, XIE J, WEI C H, et al.Comparison of microbial community structure of starter cultures (Daqu) for Luzhou-flavor liquor in different regions of Sichuan[J].Food Science, 2019, 40(14):144-152.
[8] 凌荔, 方尚玲, 牟飞燕, 等.基于高通量测序技术分析南方清香型白酒大曲的微生物多样性[J].酿酒科技, 2023(1):51-60.
LING L, FANG S L, MOU F Y, et al.Analysis of microbial diversity of Qingxiang Daqu based on high-throughput sequencing[J].Liquor-Making Science &Technology, 2023(1):51-60.
[9] SONG X B, JING S, ZHU L, et al.Untargeted and targeted metabolomics strategy for the classification of strong aroma-type Baijiu (liquor) according to geographical origin using comprehensive two-dimensional gas chromatography-time-of-flight mass spectrometry[J].Food Chemistry, 2020, 314:126098.
[10] HE Y X, LIU Z P, QIAN M, et al.Unraveling the chemosensory characteristics of strong-aroma type Baijiu from different regions using comprehensive two-dimensional gas chromatography-time-of-flight mass spectrometry and descriptive sensory analysis[J].Food Chemistry, 2020, 331:127335.
[11] 叶天宏. 中国白酒产业现状与发展对策研究[J].产业与科技论坛, 2017, 16(10):12-14.
YE T H.Study on the present situation and development countermeasures of China liquor industry[J].Industrial &Science Tribune, 2017, 16(10):12-14.
[12] 江月, 千里.发挥内蒙古区域优势!推动内蒙古酒业高质量发展[J].中国酒, 2023(3):58-71.
JIANG Y, QIAN L.Give full play to the regional advantages of Inner Mongolia! Promote the high-quality development of Inner Mongolia liquor industry[J].China Wine, 2023(3):58-71.
[13] ZHAO L N, WU Y, ZHAO Y L, et al.Deciphering the intra- and inter-Kingdom networks of microbiota in the pit mud of Chinese strong-flavor liquor[J].LWT, 2022, 165:113703.
[14] LUO H B, WANG D D, WANG Y, et al.The change rules of physiochemical indexes of Luzhou-flavor Daqu based on continuous flow chemical analyzer[J].Advanced Materials Research, 2014, 881-883:761-765.
[15] CHEN Y R, LI K M, LIU T, et al.Analysis of difference in microbial community and physicochemical indices between surface and central parts of Chinese special-flavor Baijiu Daqu[J].Frontiers in Microbiology, 2021, 11:592421.
[16] ZHUANSUN W W, XU J, LI Z Q, et al.Dynamic changes in the microbial community, flavour components in Jiupei of a novel Maotai-Luzhou-flavoured liquor under various Daqu blending modes and their correlation analysis[J].LWT, 2022, 172:114167.
[17] 胡梓晴, 刘晓艳, 白卫东, 等.高通量测序技术在白酒微生物多样性中的研究进展[J].中国酿造, 2023, 42(5):15-21.
HU Z Q, LIU X Y, BAI W D, et al.Research progress of high-throughput sequencing technology in microbial diversity of Baijiu production[J].China Brewing, 2023, 42(5):15-21.
[18] 闫金良. 内蒙古地区气候变化研究进展[J].内蒙古水利, 2017(9):73-75.
YAN J L.Research progress on climate change in Inner Mongolia[J].Inner Mongolia Water Resources, 2017(9):73-75.
[19] DU H, WANG X S, ZHANG Y H, et al.Exploring the impacts of raw materials and environments on the microbiota in Chinese Daqu starter[J].International Journal of Food Microbiology, 2019, 297:32-40.
[20] 陈青柳. 绍兴机械化黄酒风味形成途径和功能微生物的研究[D].无锡:江南大学, 2018.
CHEN Q L.Study on flavor formation pathways and functional microorganisms of Shaoxing mechanized rice wine[D].Wuxi:Jiangnan University, 2018.
[21] 任宇婷, 乔美灵, 乌力吉德布兴, 等.不同北方浓香型白酒大曲中微生物组成及理化差异分析[J].中国酿造, 2022, 41(11):49-55.
REN Y T, QIAO M L,WU L J D M X, et al.Analysis of microbial composition and physicochemical differences in different northern strong-flavor Baijiu Daqu[J].China Brewing, 2022, 41(11):49-55.
[22] WU X Y, JING R X, CHEN W H, et al.High-throughput sequencing of the microbial diversity of roasted-sesame-like flavored Daqu with different characteristics[J].3 Biotech, 2020, 10(11):502.
[23] HE G Q, HUANG J, ZHOU R Q, et al.Effect of fortified Daqu on the microbial community and flavor in Chinese strong-flavor liquor brewing process[J].Frontiers in Microbiology, 2019, 10:56.
[24] ZHENG X W, YAN Z, ROBERT NOUT M J, et al.Characterization of the microbial community in different types of Daqu samples as revealed by 16S rRNA and 26S rRNA gene clone libraries[J].World Journal of Microbiology &Biotechnology, 2015, 31(1):199-208.
[25] TEIXEIRA C G, FUSIEGER A, MILI O G L, et al.Weissella:An emerging bacterium with promising health benefits[J].Probiotics and Antimicrobial Proteins, 2021, 13(4):915-925.
O G L, et al.Weissella:An emerging bacterium with promising health benefits[J].Probiotics and Antimicrobial Proteins, 2021, 13(4):915-925.