低聚半乳糖(galactooligosaccharides,GOS)作为一种功能性低聚糖,主要由乳糖酶转化乳糖制得,因其出色的理化性质和生理功效,广泛应用于奶粉、糖果、烘焙和宠物食品等领域[1]。乳糖酶是一类重要的糖苷水解酶类,兼具水解活性及转糖基活性,在食品领域应用广泛[2]。虽然GOS商业化生产已取得许多进展,但乳糖酶性能欠佳导致了GOS产率的较低,因此,寻找酶学性质优良且转糖苷活性高的乳糖酶至关重要。产马乳酒乳杆菌(Lactobacillus kefiranofaciens)ZW3是本实验室从开菲尔粒中筛选分离得到的一株优良菌株,经前期研究发现该菌的乳糖酶具有较高转糖苷活性。因此,以ZW3来源的乳糖酶为研究对象,探究其酶学性质及其在合成GOS中的应用,对于工业化制备GOS中具有十分重要意义[3]。
随着生物产业的迅速发展,重组蛋白的分离纯化成为一种必不可少的技术。类弹性蛋白多肽(Elastin-like polypeptides,ELP)是一种温敏性蛋白,在高于相变温度的溶液中呈凝聚态,低于相变温度时又恢复溶液态[4]。因此,利用ELP标签的可逆相变特性,通过可逆相变循环(inverse transition cycling,ITC)的方法可以直接从细胞裂解液中特异性分离含有ELP标签的融合蛋白。与常用的色谱纯化蛋白相比,该方法仅需常规的离心机或者过滤装置就能分离纯化纯度极高的目标蛋白,成本低、操作简单、容易大规模生产[5]。虽然ELP标签方便经济,但尺寸通常很大,融合肽链越长,蛋白表达水平会越低[6]。有研究发现减小ELP标签大小可以显著提高融合重组蛋白的表达量,较短的标签更不易干扰目标蛋白的表达和功能[7]。ZHOU[8]构建了一种β-葡萄糖苷酶-ELP融合蛋白,与没有ELP标签的天然β-葡萄糖苷酶相比,该蛋白的表达水平要低得多。另外,ELP有助于稳定融合蛋白的α螺旋结构数量和堆积密度[9-10]。将ELP标签与蛋白质融合表达不仅可以方便高效地纯化融合蛋白,还可以提高其稳定性。例如,ELP与葡聚糖内切酶的融合提高了酶的热稳定性并延长了其半衰期[11]。ELP与IFN-γ的融合提高了其热稳定性[12]。
本研究中引入了Spytag/Spycatcher这种异肽键分子黏合剂[13-14]。利用SpyTag和SpyCatcher在温和条件下快速自发发生反应形成的稳定异肽键,将来源于产马乳酒乳杆菌ZW3的乳糖酶与ELP标签相结合,并通过ELP标签的ITC技术进行重组乳糖酶的分离纯化。并且,通过研究该重组乳糖酶的酶学性质和GOS制备效率,对基于ELP的乳糖酶分离纯化方法及其在GOS合成中的应用提供了一定的参考价值。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种、质粒及引物
本实验所用产马乳酒乳杆菌(Lactobacillus kefiranofaciens)ZW3分离自开菲尔粒中,保藏于中国普通微生物菌种保藏管理中心,保藏编号CGMCC2809;基因组序列公开于NCBI(https://www.ncbi.nlm.nih.gov/),Genbank登录号为CP002704,编码乳糖酶lac的基因由WANG_0293,WANG_0292两部分组成,分别编码乳糖酶的大小2个亚基,位于ZW3基因组序列第303 208~306 040位置;基因全长2 833 bp(大亚基基因长1 887 bp,小亚基基因973 bp,其中大小亚基之间有17 bp的重叠序列)。大肠杆菌(Escherichia coli)DH5α由北京博迈德生物技术公司获得;ELP-(VPGVG)50编码基因elp委托苏州金唯智生物科技有限公司合成,并克隆至质粒pLY01上;Spytag的编码基因来源于本实验室保存质粒pWG001(含阿拉伯糖操纵子,氨苄抗性);Spycatcher的编码基因来源于本实验室保存质粒pWG002(含阿拉伯糖操纵子,氨苄抗性)。本实验采用的引物序列如表1所示。
表1 实验用到的引物
Table 1 The primers used in this experiment

引物名称引物序列(5′-3′)P-ZW3-F1GGCTCCGGTGGCAGCGGCCAAGCAAATATTAAATGGCTTGATP-ZW3-R1CTTCATCTTAAACCAGTTTTAAGGATCCAAACTCGAGTAAGGATCTP-G001GJ-F1GGATCCAAACTCGAGTAAGGATCTCCP-G001GJ-R1CACAAAAGGCTCCGGTGGCAGCGGCP-LY02-YZ-F3GGCGTCACACTTTGCTATCCATP-LY02-YZ-R3GCTTGATGTAAGAGCCGACCP-002GJ-F1GACCTCGAGAGTAAGGATCTCCAGGCATCP-002GJ-R2CCTACGCGTTCACCTTTGCTGCCGCTGP-LY03-YZ-F3GCAGGTGCAACGATGGAACTTCP-LY03-YZ-R3GTGTTCCGGGCGTAGGTGT
1.1.2 试剂
限制性内切酶Xho I、Mlu I和T4 DNA连接酶,TaKaRa公司;2×Rapid Taq Master Mix,南京诺唯赞生物科技有限公司;基础版同源重组无缝克隆试剂盒,北京全式金生物技术有限公司;BCA蛋白浓度测定试剂盒,上海碧云天生物技术有限公司;PBS粉末,上海源叶生物科技有限公司;葡萄糖、半乳糖、乳糖、邻硝基苯-β-D-半乳糖苷(2-nitrophenyl β-D-galactopyranoside,ONPG)和邻硝基苯酚(2-nitrophenol,ONP),天津市江天技术股份有限公司。其他试剂如无特殊说明均为分析纯。
1.1.3 主要仪器与设备
22331-Hamburg PCR仪,德国Eppendorf公司;Power pv 3000电泳仪,美国BIO-RAD公司;CIENTA-ⅡD超声细胞破碎仪,宁波新芝生物科技股份有限公司;μLite超微量分光光度计,英国BioDrop公司;Thermo全波长酶标仪,美国Thermo Fisher公司;LC-20高效液相色谱仪,日本岛津公司。
1.2 实验方法
1.2.1 原核表达载体的构建与验证
利用特异性引物(P-ZW3-F1,P-ZW3-R1)从产马乳酒乳杆菌ZW3基因组中克隆得到乳糖酶基因lac,将基因通过同源重组无缝克隆方法连接到通过引物P-G001GJ-F1,P-G001GJ-R1得到的pWG001线性化载体中“Spytag”标签下游,获得了含有“Spytag-linker-Lac”基因片段的重组质粒pLY02。随后,利用Xho I和Mlu I双酶切从pLY01上获得elp片段,并利用T4 DNA连接酶将获得elp片段连接到同样利用Xho I和Mlu I双酶切处理的经引物P-002GJ-F1,P-002GJ-R2扩增得到的pWG002线性化载体,构建了含有“Spycatcher-linker-ELP”编码基因片段的重组质粒pLY03,质粒构建示意图如图1所示。将重组质粒pLY02、pLY03转入DH5α感受态细胞中,利用菌落PCR进行验证,分别使用特异性引物P-LY02-YZ-F3,P-LY02-YZ-R3和P-LY03-YZ-F3,P-LY03-YZ-R3扩增载体骨架与目的基因连接处的部分基因片段,验证条带大小是否正确,并将验证片段送到苏州金唯智生物科技有限公司进行测序分析。
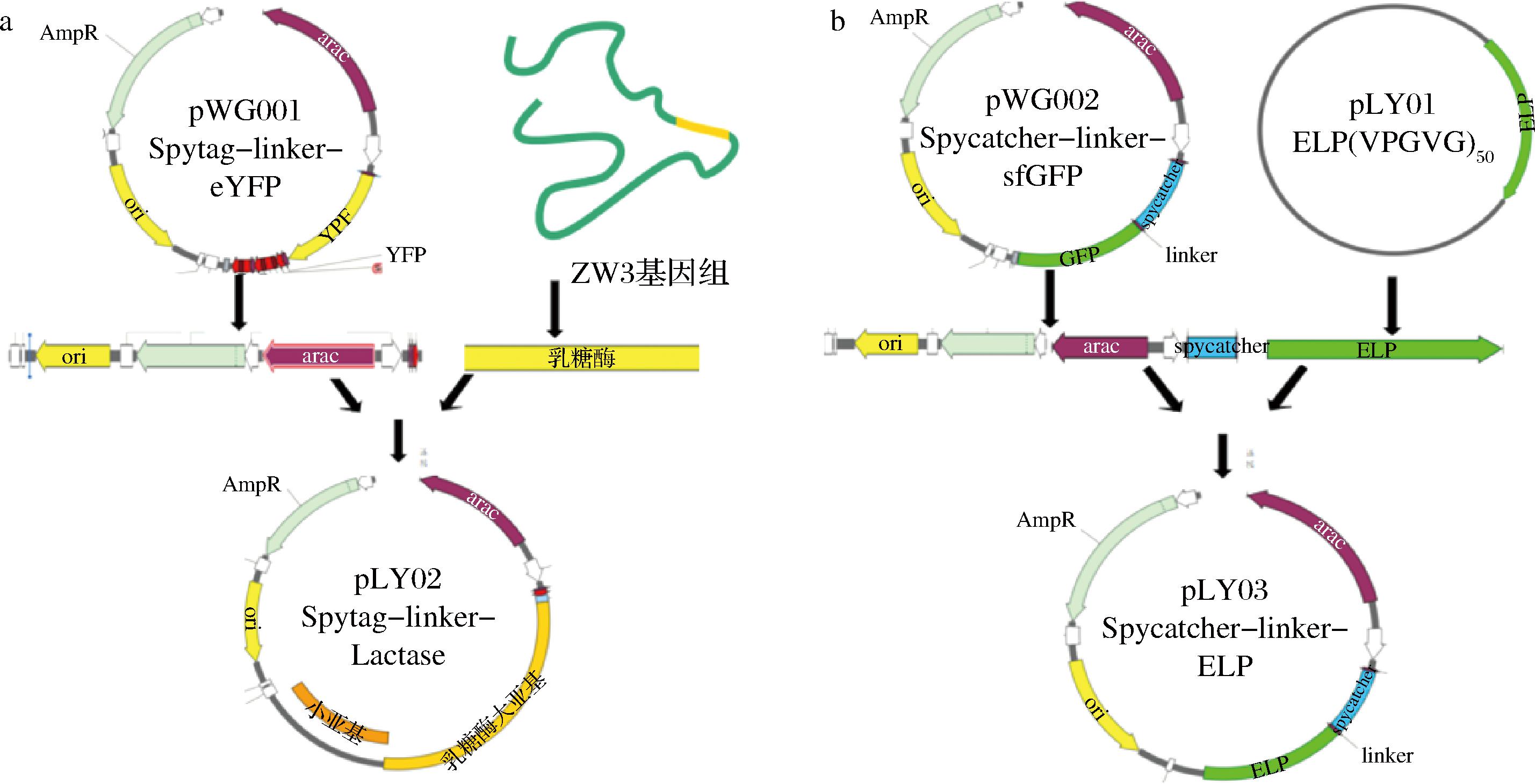
a-pLY02质粒构建示意图;b-pLY03质粒构建示意图
图1 质粒构建
Fig.1 Plasmid construction
1.2.2 乳糖酶和ELP标签的表达
将大肠杆菌重组菌株(E.coli-pLY002和E.coli-pLY003)分别以5%的接种量转接至100 mL的LB液体培养基(含氨苄青霉素100 μg/mL)中37 ℃培养直至OD600达到0.6左右时,加入2 g/L阿拉伯糖诱导蛋白表达。随后30 ℃,160 r/min培养10 h后,4 ℃,5 000 r/min离心20 min收集菌体。用4 mL PBS(含苯甲基磺酰氟1 mmol/L)重悬菌体,在冰浴中超声破碎,离心收集上清液和沉淀,通过SDS-PAGE分析蛋白的表达情况。
1.2.3 乳糖酶的ITC纯化方法
分别取0.5 mL在1.2.2节获得的重组菌株(E.coli-pLY002和E.coli-pLY003)的菌体破碎上清液,在25 ℃混合2 h。随后,利用ITC法快速纯化融合蛋白[8],将一定量的(NH4)2SO4分别加入1 mL上清混合液(0.5 mL E.coli-pLY002和0.5 mL E.coli-pLY003)和1 mL E.coli-pLY003上清液中,25 ℃孵育20 min后,在室温下10 000×g离心10 min,收集目标蛋白的沉淀。向沉淀中加入预冷的PBS,4 ℃孵育1 h后重新溶解蛋白。4 ℃下10 000×g离心10 min后,收集上清液,E.coli-pLY002和E.coli-pLY003细胞破碎上清混合液中获得的即为纯化的重组乳糖酶(Lac-ELP),E.coli-pLY003上清液中获得的即为纯化的SpyCatcher-ELP。蛋白的纯化情况通过SDS-PAGE进行分析。
1.2.4 Lac-ELP纯化条件的选择及酶活力测定
为进一步确定(NH4)2SO4溶液的使用浓度,分别用0.2~0.6 mol/L的(NH4)2SO4溶液进行乳糖酶的纯化。酶活力测定以PBS为溶剂,制备1 mg/mL的ONPG溶液,取1 mL ONPG溶液,加入0.5 mL稀释后的乳糖酶酶液,35 ℃反应10 min,加入1.5 mL浓度为0.15 mol/L的Na2CO3溶液停止反应,测定OD420值。酶活力单位定义:把1 mL酶液催化ONPG反应1 min生成1 μmol ONP定义为一个标准酶活力单位(U)。蛋白浓度采用BCA蛋白浓度测定试剂盒测定。依据Lac-ELP的纯化倍数和回收率确定最佳(NH4)2SO4浓度[15]。
1.2.5 酶学性质的测定
将经过ELP标签纯化得到的乳糖酶Lac-ELP和经30%饱和硫酸铵盐析得到的乳糖酶Lac在不同温度(20~70 ℃)、不同pH(4.0~9.0)下测定Lac-ELP和Lac的酶活力,以最高酶活力(100%)计算各温度和pH值下相对酶活力,确定乳糖酶催化的最适温度和pH值。另外,将酶液分别置于不同温度(20~70 ℃)和不同pH(4.0~9.0)下水浴保温30 min后,在最适温度和pH值下测定残余酶活力,确定乳糖酶催化的温度和pH稳定性。
1.2.6 GOS的测定
通过薄层层析(thin layer chromatography,TLC)定性分析GOS的合成情况。取适量的乳糖酶催化的产物(配制300 mg/mL的乳糖溶液,Lac-ELP添加量10 U/g乳糖,在30 ℃条件下反应24 h后,取样稀释20倍)与5%葡萄糖、5%半乳糖、5%乳糖标品及葡萄糖、半乳糖和乳糖各5%的混合标准样品于硅胶层析板上样,硅胶板于层析缸中展层显色后,置于80 ℃烘箱中显色10 min。其中展开剂为正丁醇∶乙醇∶水=5∶3∶2,显色剂由1 g二苯胺、1 mL苯胺、5 mL磷酸共溶于50 mL丙酮组成[16]。
利用HPLC,分析以乳糖为底物时候,乳糖酶催化合成GOS的合成量。色谱条件:岛津HPLC,示差折光检测器,色谱柱为氨基柱(5 μm,4.6×250 mm),流动相:乙腈∶水=70∶30(体积比);流速1 mL/min;柱温40 ℃;进样量20 μL。GOS生成量XGOS(mg/mL)和GOS产率YGOS计算按公式(1)[17]:
XGOS=L1-L2-G1-G2
(1)
(2)
式中:L1,反应产物中的初始乳糖质量,mg/mL;L2,反应产物中的残余乳糖质量,mg/mL;G1,反应产物中的葡萄糖质量,mg/mL;G2,反应产物中的半乳糖质量,mg/mL。
1.2.7 乳糖酶合成GOS条件优化
以乳糖为底物,测定不同反应温度、底物浓度、加酶量和时间对Lac-ELP合成GOS的影响。用PBS配制300 mg/mL的乳糖溶液,分别取1 mL置于2 mL离心管中,各管中分别加入10 U/g乳糖的乳糖酶酶液,并在不同的温度(25、30、35、40、45 ℃)下,200 r/min反应24 h,反应结束后沸水浴5 min灭酶,HPLC分析反应产物中GOS的含量,并计算产率,以确定反应最适温度。确定最适温度后,其他条件不变,优化Lac-ELP合成GOS的底物质量浓度100~500 mg/mL,加酶量(5、7.5、10、12.5、15 U/g乳糖)。确定最优乳糖浓度和加酶量后,确定最优反应时间。
2 结果与讨论
2.1 重组质粒验证
将重组质粒pLY02和pLY03转化入大肠杆菌DH5α中,对长出的转化子进行验证,分别使用特异性引物P-LY02-YZ-F3(位于质粒pLY02载体骨架上),P-LY02-YZ-R3(位于乳糖酶基因lac上)和P-LY03-YZ-F3(位于质粒pLY03载体骨架上),P-LY03-YZ-R3(位于ELP基因上)扩增载体骨架与目的基因连接部分的基因片段,结果见图2。
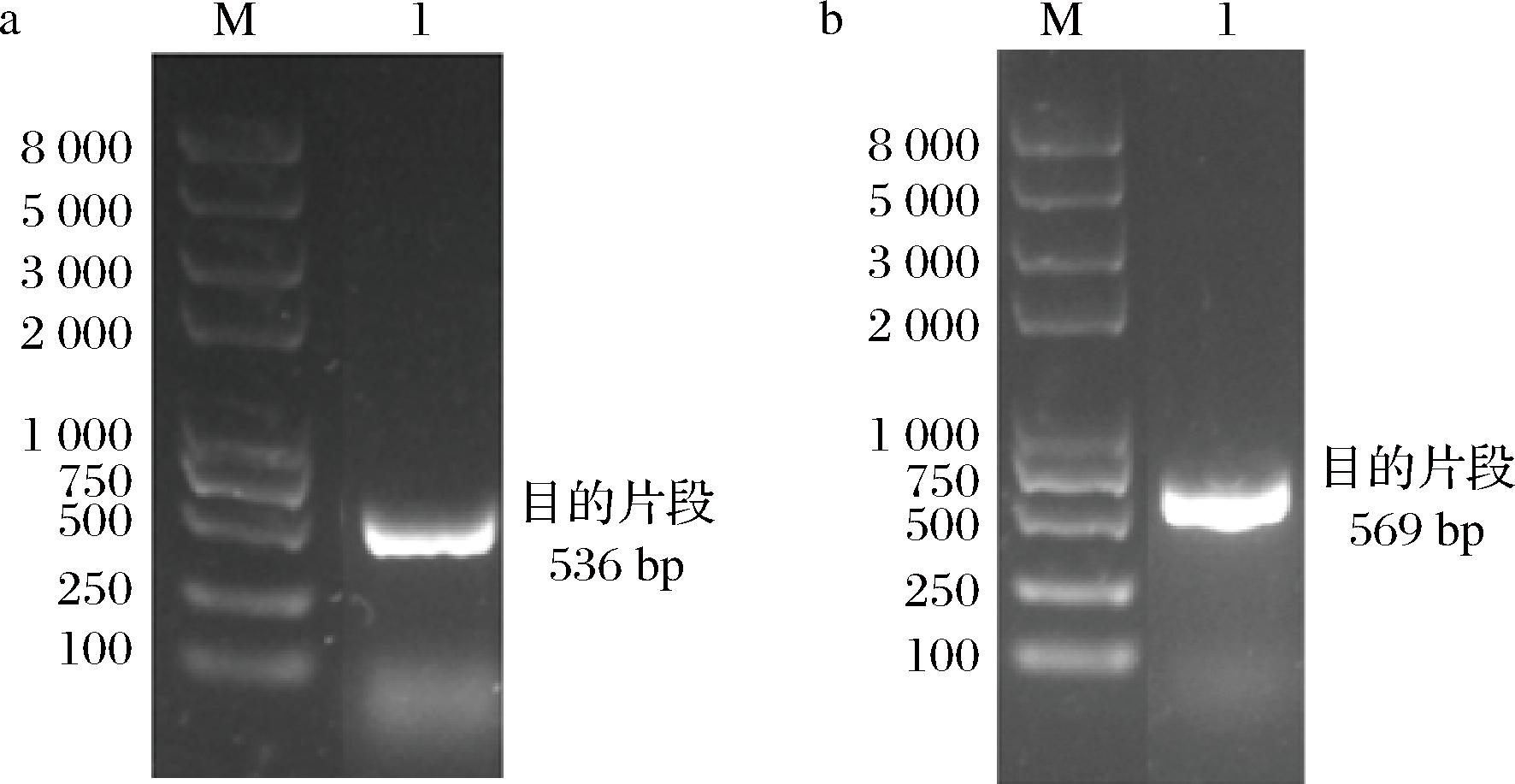
a-pLY02验证结果(M:DNA Marker;1:pLY02验证片段);b-pLY03验证结果(M:DNA Marker:1:pLY03 验证片段)
图2 重组质粒验证结果
Fig.2 Recombinant plasmid validation
PCR扩增的片段与预期大小一致(pLY02验证片段大小536 bp,pLY03验证片段大小569 bp),表明重组质粒构建成功。对重组质粒进行DNA测序,结果显示目的基因片段被成功插入表达载体中,未发生碱基突变和移位,表明pLY02和pLY03重组质粒构建成功。
2.2 表达和纯化分析
对大肠杆菌重组菌株(E.coli-pLY002和E.coli-pLY003)分别进行重组蛋白的表达,使用ELP标签ITC技术进行重组蛋白的分离纯化。表达产物与纯化产物分别进行SDS-PAGE,检测结果如图3所示。
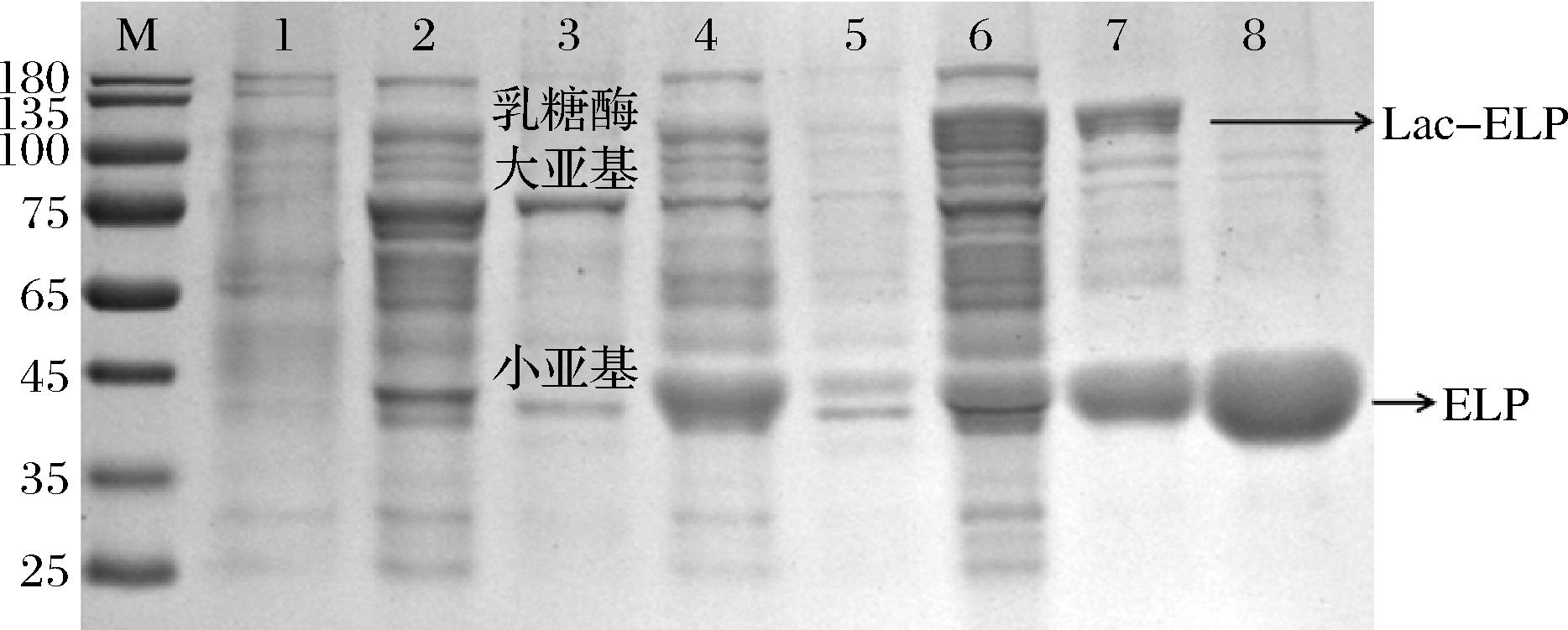
图3 SDS-PAGE分析
Fig.3 SDS-PAGE analysis
注:M-标准蛋白分子质量 marker;1-野生型DH5α细胞裂解液;2-E.coli-pLY002细胞裂解物上清液;3-E.coli-pLY002细胞裂解物沉淀;4-E.coli-pLY003细胞裂解物上清液;5-E.coli-pLY003细胞裂解物沉淀;6-E.coli-pLY002和E.coli-pLY003细胞裂解物上清混合液;7-纯化的重组乳糖酶Lac-ELP;8-纯化的ELP。
结果显示,E.coli-pLY002的上清液和沉淀在相对分子质量73 kDa和37 kDa附近均出现了明显的条带(泳道2、3),同乳糖酶大亚基与SpyTag融合蛋白、小亚基的预测的分子质量相符;E.coli-pLY003上清液和沉淀在分子质量为40 kDa附近出现了一条明显的条带(泳道4,5),同SpyCatcher-ELP的预测的分子质量相符;含乳糖酶的E.coli-pLY002上清液和含ELP的E.coli-pLY003上清混合一小时后,在分子质量为115 kDa附近出现了一条新的条带(泳道6)。这表明质粒pLY02、pLY03所编码的蛋白在E.coli DH5α中成功表达,并通过SpyTag/SpyCatcher的自发反应实现了ELP和Lac的融合。含ELP的E.coli-pLY003的上清液经过ITC纯化后,获得的SpyCatcher-ELP蛋白仅在40 kDa附近有单一明显条带(泳道8),说明ELP可以成功利用ITC的方法进行纯化。同样,通过SpyTag/SpyCatcher的自发反应而获得的融合蛋白Lac-ELP同样可以利用ITC的方法纯化获得。如图3所示,在泳道7中出线了明显的115 kDa的条带,大小和Lac-ELP的分子质量相符。同时,在40 kDa处的条带为乳糖酶小亚基和未结合的SpyCatcher-ELP的混合条带。
2.3 Lac-ELP纯化条件的选择
重组菌株E.coli-pLY002经超声破碎后得到的每毫升粗酶液的总酶活力为17.95 U,总蛋白为13.80 mg,比酶活力为1.30 U/mg。通过添加不同浓度(NH4)2SO4溶液,利用ELP标签的ITC技术纯化乳糖酶,测定乳糖酶的纯化倍数和回收率,结果如图4所示。当(NH4)2SO4浓度为0.4 mol/L时,纯化的重组乳糖酶Lac-ELP的总酶活力为13.24 U,总蛋白为1.20 mg,比酶活力为11.06 U/mg,乳糖酶的纯化倍数和回收率达到最大值,分别为8.51和73.8%,因此,0.4 mol/L为(NH4)2SO4纯化的最佳浓度。
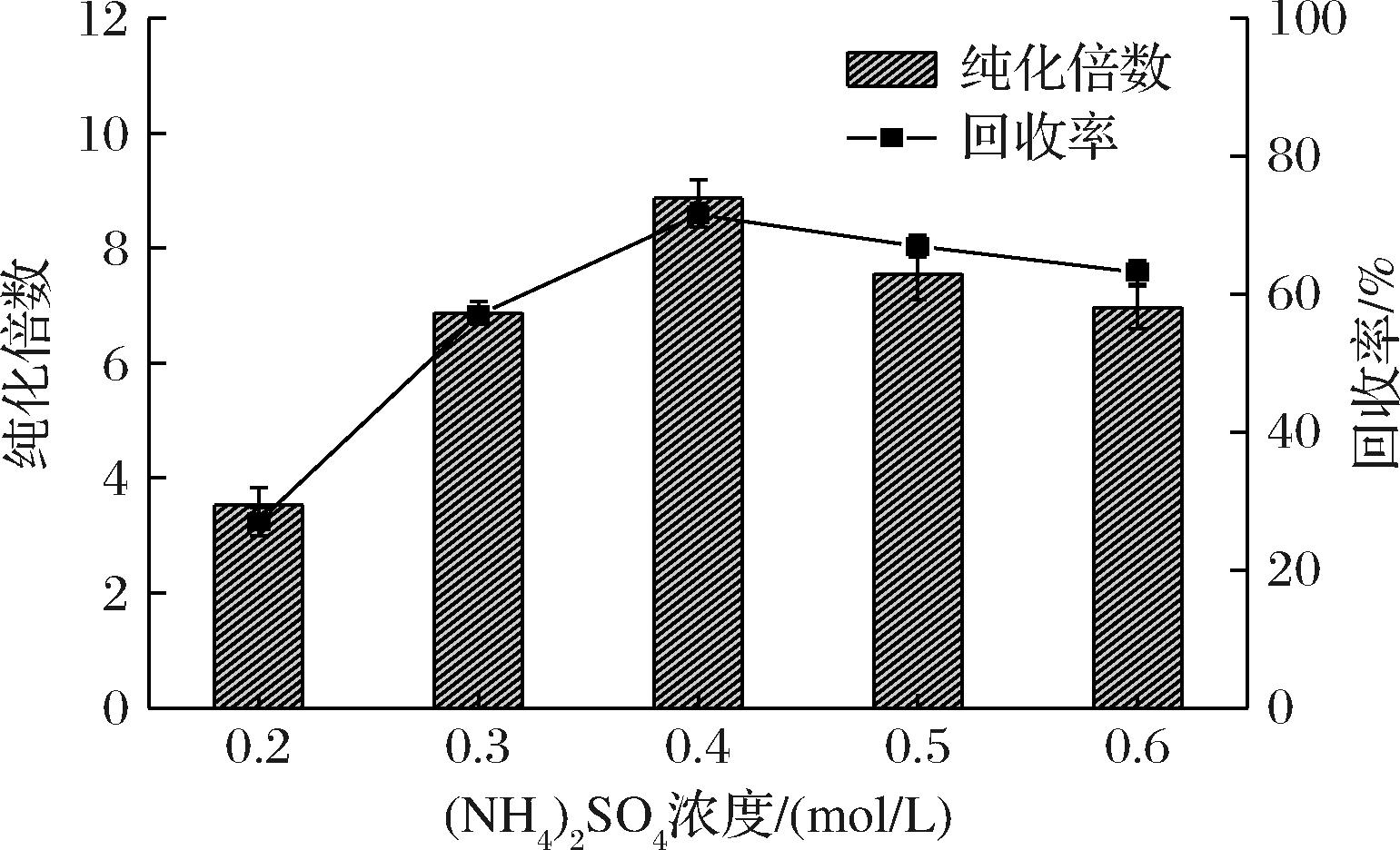
图4 不同浓度(NH4)2SO4纯化后的乳糖酶回收率与纯化倍数
Fig.4 Recovery and purification factor of lactase after purification under different purification conditions
2.4 酶学性质的测定
将经过ELP标签纯化得到的乳糖酶Lac-ELP和经饱和硫酸铵盐析得到的乳糖酶Lac的酶学性质进行比较,结果如图5所示。Lac-ELP和Lac的最适温度均为50 ℃(图5-a),该条件下每毫升酶液的酶活力分别为51.87 U和37.14 U。最适pH值均为7(图5-b),该条件下每毫升酶液的酶活力分别为47.75U和33.23 U。且在40~60 ℃和pH 5~8的范围内Lac-ELP和Lac均能保持50%以上活性,说明添加ELP标签,并不会影响乳糖酶的最适温度和pH值。
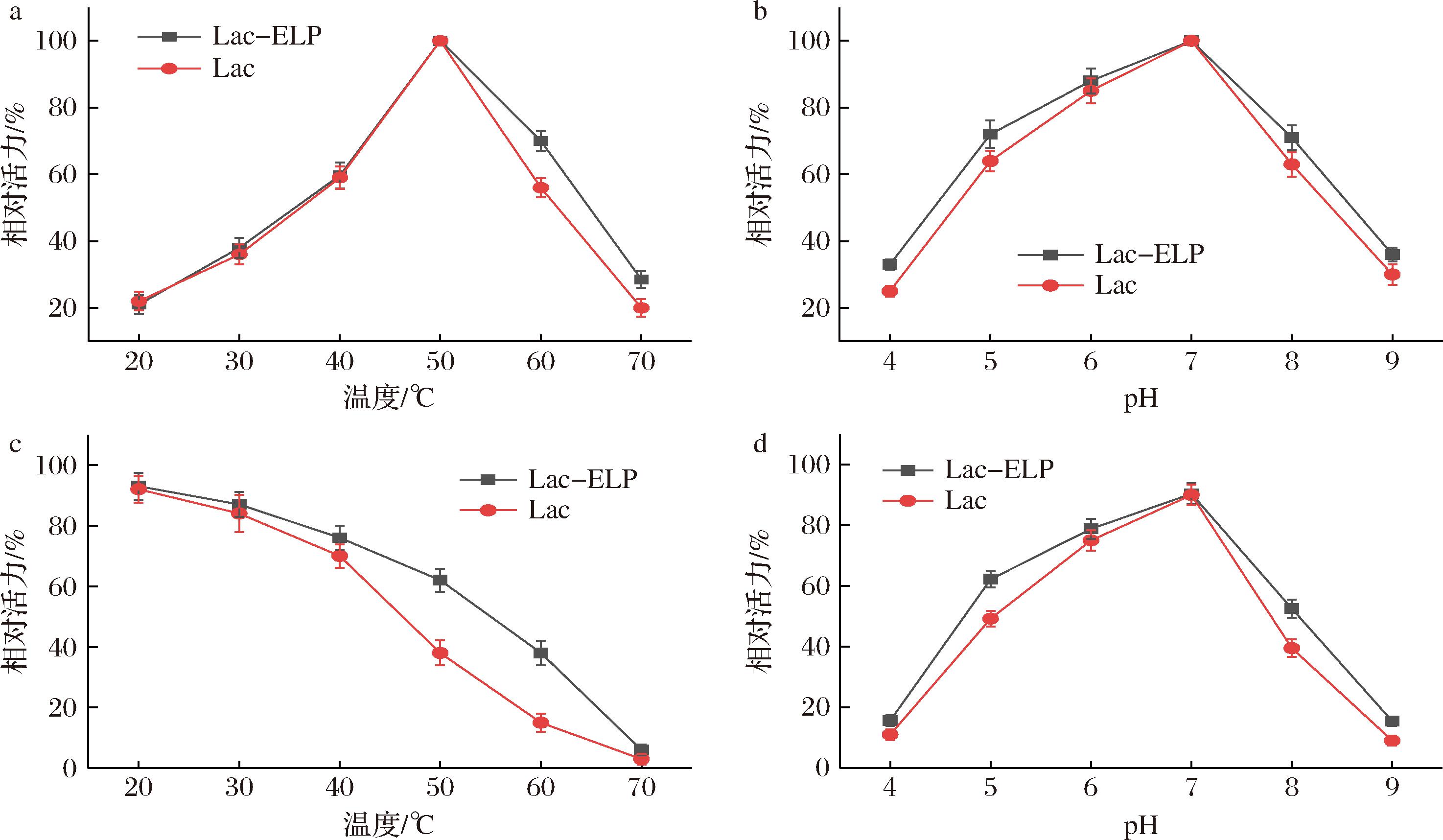
a-最适温度;b-最适pH值;c-热稳定性;d-酸碱稳定性
图5 Lac-ELP和Lac的酶学性质
Fig.5 Enzymatic properties of Lac-ELP and Lac
图5-c和图5-d为Lac-ELP和Lac的热稳定性和pH稳定性测试结果,当温度达到50 ℃时,Lac-ELP和Lac分别失去了33%和62%的初始活性,达到60 ℃时,Lac仅存有12%初始活性,而Lac-ELP保留了38%的初始活性(图5-c)。在pH值为7的条件下Lac-ELP和Lac最为稳定,在pH值为8时Lac-ELP和Lac分别持有61.5%和43.3%的酶活力,在pH值为5时Lac-ELP和Lac分别持有64.2%和45.2%的酶活力(图5-d)。表明添加ELP标签,可以使乳糖酶具有更高的热稳定性和pH稳定性,保证酶能发挥更高效的催化功能。
2.5 GOS的测定
以乳糖为底物,探究了Lac-ELP利用转糖基化活性生成GOS的能力。TLC的结果(图6)表明,在以乳糖为底物的情况下,Lac-ELP催化乳糖不仅生成了葡萄糖和半乳糖,还生成了迁移率较低的GOS。

图6 产物薄层层析图
Fig.6 Thin layer chromatography of the product
注:1为葡萄糖;2为半乳糖;3为乳糖;4为混合标品;5为本研究的GOS产品。
HPLC结果见图7,在较高浓度的乳糖溶液中添加乳糖酶进行反应,乳糖不仅水解生成了葡萄糖和半乳糖(峰1),同时乳糖酶的糖基转移作用还合成了GOS(峰3~6),证实了乳糖水解反应的发生和不同聚合度的GOS的合成。
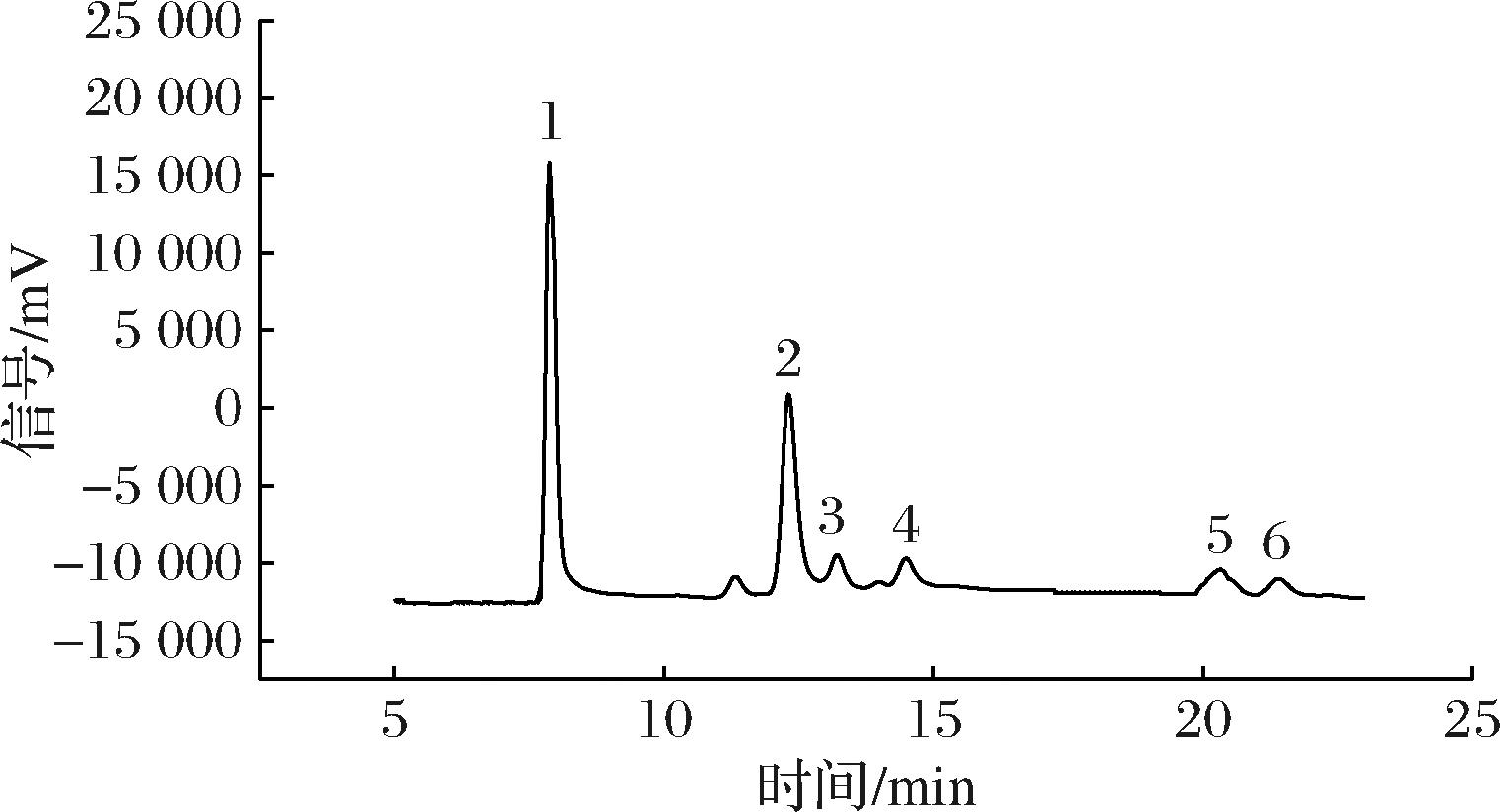
图7 乳糖酶水解产物高效液相色谱图
Fig.7 High-performance liquid chromatogram of lactase hydrolysate
注:1为葡萄糖+半乳糖;2为乳糖;3~6为本研究中获得的GOS产品。
2.6 乳糖酶合成GOS条件优化
随后,探究了反应温度、底物浓度、酶添加量、以及反应时间对Lac-ELP合成GOS产率的影响。如图8-a所示,反应温度从25 ℃增加到35 ℃时,GOS产率逐渐升高,在35 ℃时GOS产率达到最高值22.61%,而随着温度的进一步增加GOS产率开始下降。如图8-b,随着底物(乳糖)浓度的增加,GOS产率稳步上升,当乳糖质量浓度达到400 mg/mL时,GOS产率达到了32.36%。另外,如图8-c所示,GOS产率随酶添加量的增加先快速增加而后下降,当Lac-ELP添加量达到10 U/g乳糖时GOS的产率达到了32.41%,而当Lac-ELP添加量达12.5 U/g乳糖时GOS的产率达到了峰值32.80%。考虑经济效益,选择10 U/g乳糖作为最佳的酶添加量。反应时间对GOS产率的影响如图8-d所示,在24 h内GOS产率逐渐增加并达到最大值33.23%,当时间进一步增加时,GOS产率降低,因此选择24 h作为最佳的反应时间。
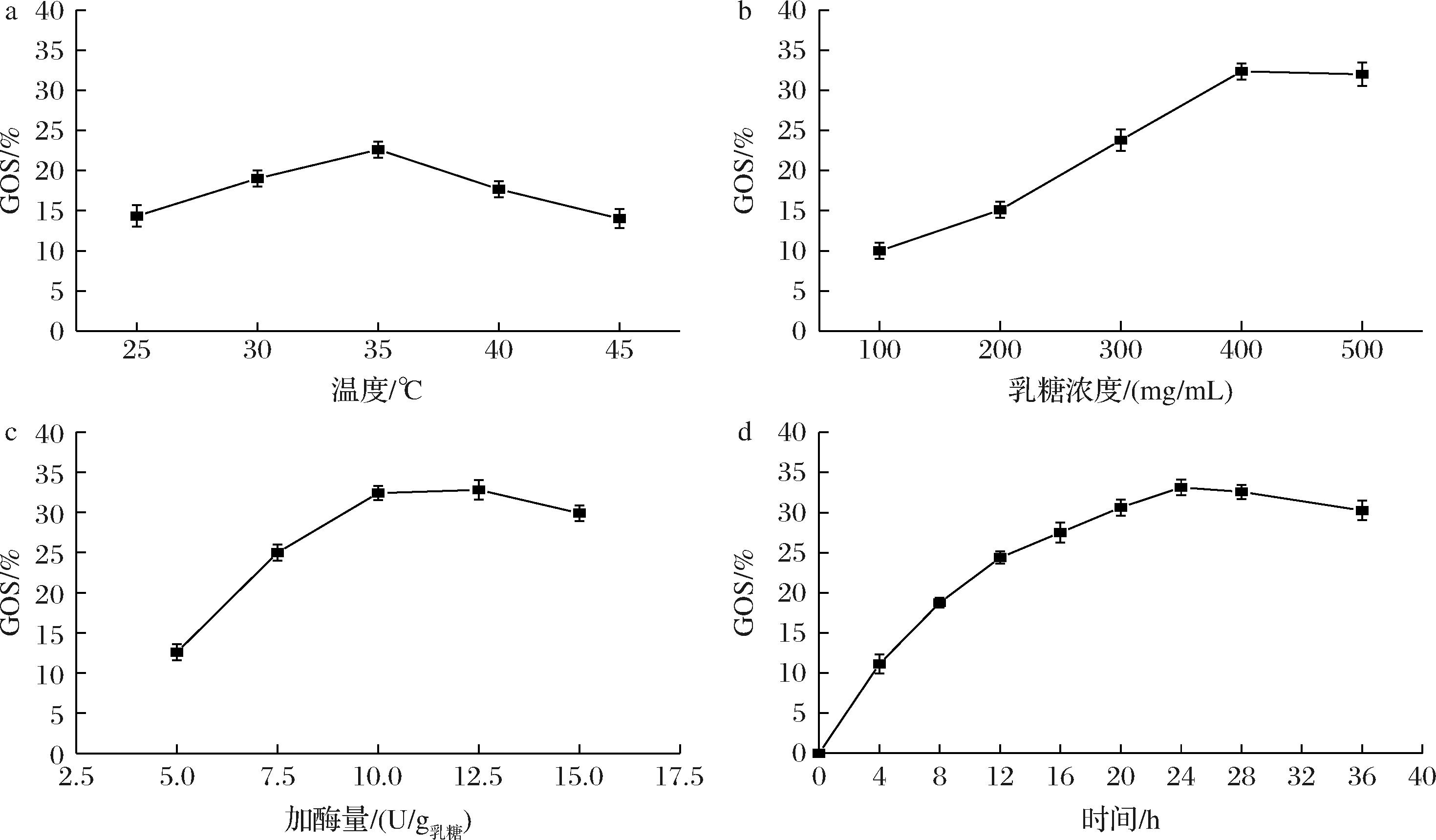
a-温度;b-乳糖浓度;c-加酶量;d-时间
图8 Lac-ELP合成GOS的条件优化
Fig.8 Optimization of the conditions for Lac-ELP synthesis of GOS
目前,已报道过多种不同来源的乳糖酶用于合成GOS,产率通常在10%~40%之间。例如,一种芽孢杆菌来源乳糖酶(BABgal35A)在乳糖质量浓度为400 g/L,加酶量5 U/mL,40 ℃反应12 h时,GOS产率为34%[18]。另外一种乳酸克鲁维酵母来源的乳糖酶的GOS产率为23.4%[19],一种米曲霉来源的乳糖酶的GOS产率为26.73%[20]。而来自环状芽孢杆菌和棘孢曲霉的乳糖酶GOS产率分别为41%和13%[21]。对比之下,本研究所用的产马乳酒乳杆菌来源的乳糖酶具有较好的转糖苷活性,可以作为GOS生产工业中的一种选择。
4 结论
本研究实现了来源于产马乳酒乳杆菌ZW3的乳糖酶基因在大肠杆菌DH5α中的异源表达。并通过SpyTag和SpyCatcher的自发连接,以及ELP标签的ITC纯化技术,实现了对乳糖酶的快速分离纯化。随后,对纯化获得Lac-ELP进行了酶学性质表征,结果表明Lac-ELP和Lac的最适温度均为50 ℃,最适pH值均为7,但Lac-ELP比Lac表现出更好的热稳定性和pH稳定性。最后,以400 mg/mL的乳糖为底物时,Lac-ELP添加量10 U/g乳糖,35 ℃反应时间24 h后,GOS产率可达33.23%。
[1] RUIZ-RAM REZ S, JIMÉNEZ-FLORES R.Invited review:Properties of β-galactosidases derived from Lactobacillaceae species and their capacity for galacto-oligosaccharide production[J].Journal of Dairy Science, 2023, 106(12):8193-8206.
REZ S, JIMÉNEZ-FLORES R.Invited review:Properties of β-galactosidases derived from Lactobacillaceae species and their capacity for galacto-oligosaccharide production[J].Journal of Dairy Science, 2023, 106(12):8193-8206.
[2] LU L L, GUO L C, WANG K, et al.β-Galactosidases:A great tool for synthesizing galactose-containing carbohydrates[J].Biotechnology Advances, 2020, 39:107465.
[3] 何熹, 耿伟涛, 韩宁, 等.马奶酒样乳杆菌乳糖酶LacZ基因的克隆, 原核表达及活性分析[J].食品与发酵工业, 2016, 42(4):28-31.
HE X, GENG W T, HAN N, et al.Cloning, expression and characterization of LacZ gene from Lactobacillus kefiranofaciens[J].Food and Fermentation Industries, 2016, 42(4):28-31.
[4] 刘宁, 崔梅英, 王明月, 等.类弹性蛋白多肽-红色荧光蛋白融合蛋白的表达纯化及细胞相容性[J].北华大学学报(自然科学版), 2021, 22(1):42-46.
LIU N, CUI M Y, WANG M Y, et al.Prokaryotic expression, purification and cell compatibility of ELP-mCherry fusion protein[J].Journal of Beihua University (Natural Science), 2021, 22(1):42-46.
[5] 朱月蓉, 陈星宇, 冯娇燕, 等.ELP-SOD融合蛋白的纯化及其脂质体制备[J].江苏大学学报(医学版), 2024, 34(1):44-51;66.
ZHU Y R, CHEN X Y, FENG J Y, et al.Purification of ELP-SOD fusion protein and liposome encapsulation[J].Journal of Jiangsu University (Medicine Edition), 2024, 34(1):44-51;66.
[6] WOOD D W.New trends and affinity tag designs for recombinant protein purification[J].Current Opinion in Structural Biology, 2014, 26:54-61.
[7] MEYER D E, TRABBIC-CARLSON K, CHILKOTI A.Protein purification by fusion with an environmentally responsive elastin-like polypeptide:Effect of polypeptide length on the purification of thioredoxin[J].Biotechnology Progress, 2001, 17(4):720-728.
[8] ZHOU Y, LI X F, YAN D D, et al.Multifunctional elastin-like polypeptide renders β-glucosidase enzyme phase transition and high stability[J].Biotechnology for Biofuels, 2019, 12:157.
[9] KAYUKAWA C T M, OLIVEIRA M A S, KASPCHAK E, et al.Quillaja bark saponin effects on Kluyveromyces lactis β-galactosidase activity and structure[J].Food Chemistry, 2020, 303:125388.
[10] ZHAO Y N, SINGH M K, KREMER K, et al.Why do elastin-like polypeptides possibly have different solvation behaviors in water-ethanol and water-urea mixtures?[J].Macromolecules, 2020, 53(6):2101-2110.
[11] WANG S S, LIN R, REN Y Y, et al.Non-chromatographic purification of thermostable endoglucanase from Thermotoga maritima by fusion with a hydrophobic elastin-like polypeptide[J].Protein Expression and Purification, 2020, 173:105634.
[12] HEIDARI-JAPELAGHI R, HADDAD R, VALIZADEH M, et al.Elastin-like polypeptide fusions for high-level expression and purification of human IFN-γ in Escherichia coli[J].Analytical Biochemistry, 2019, 585:113401.
[13] CHEN Z, WU T, YU S, et al.Self-assembly systems to troubleshoot metabolic engineering challenges[J].Trends in Biotechnology, 2024,42(1):43-60.
[14] LIN Y Q, JIN W H, WANG J D, et al.A novel method for simultaneous purification and immobilization of a xylanase-lichenase Chimera via SpyTag/SpyCatcher spontaneous reaction[J].Enzyme and Microbial Technology, 2018, 115:29-36.
[15] PEPRAH ADDAI F, WANG T T, KOSIBA A A, et al.Integration of elastin-like polypeptide fusion system into the expression and purification of Lactobacillus sp.B164 β-galactosidase for lactose hydrolysis[J].Bioresource Technology, 2020, 311:123513.
[16] 王丽军, 牟元珍, 关波, 等.传统奶酪中产转糖基活性β-半乳糖苷酶乳酸菌的筛选鉴定及其合成低聚半乳糖条件[J].食品科学, 2019, 40(22):88-95.
WANG L J, MOU Y Z, GUAN B, et al.Screening and identification of lactic acid bacteria producing β-galactosidases with transglycosylation activity from traditional cheese, and optimization of conditions for galacto-oligosaccharides synthesis[J].Food Science, 2019, 40(22):88-95.
[17] 竺胜权. 生物催化法制备低聚半乳糖的研究[D].杭州:浙江工业大学, 2020.
ZHU S Q.Research on the preparation of oligosaccharides by biocatalytic method [D].Hangzhou:Zhejiang University of Technology, 2020.
[18] 王建宇, 李婷, 李敬, 等.芽孢杆菌35家族β-半乳糖苷酶的性质及其在合成低聚半乳糖中的应用[J].食品科学技术学报, 20, 41(6):29-38.
WANG J Y, LI T, LI J, et al.Bacillus 35 family β-The properties of galactosidase and its application in the synthesis of oligosaccharides[J].Journal of Food Science and Technology, 20, 41 (6):29-38.
[19] 付文佳, 姜淑娟, 钱方, 等.乳酸克鲁维酵母乳糖酶合成低聚半乳糖的研究[J].食品科技, 2016, 41(6):2-6.
FU W J, JIANG S J, QIAN F, et al.Synthesis of galactooligosaccharides by lactase from Kluyveromyces lactis[J].Food Science and Technology, 2016, 41(6):2-6.
[20] CINAR K, GUNES G, ALI GULEC H.Enzymatic synthesis of prebiotic carbohydrates from lactose:Kinetics and optimization of transgalactosylation activity of β-galactosidase from Aspergillus oryzae[J].Journal of Food Process Engineering, 2020, 43(8):e13435.
[21] FRENZEL M, ZERGE K, CLAWIN-R DECKER I, et al.Comparison of the galacto-oligosaccharide forming activity of different β-galactosidases[J].LWT - Food Science and Technology, 2015, 60(2):1068-1071.
DECKER I, et al.Comparison of the galacto-oligosaccharide forming activity of different β-galactosidases[J].LWT - Food Science and Technology, 2015, 60(2):1068-1071.