传统谷物发酵食醋是以高粱、大米、小麦等谷物原料通过固态发酵、液态发酵或者固稀发酵的方式酿制而成。我国食醋的酿造工艺多采用开放式多菌混合固态发酵,通过自然接种的方式让各种微生物自然竞争生长,长期的自然驯化形成自身独特的菌群结构,或直接以生物强化醋醅发酵或通过强化大曲进而强化食醋发酵[1-2],均在提高食醋品质上有良好的作用效果。四川麸醋[3],以独特的药曲为糖化剂、发酵剂,酿造工艺大多以经验为主,存在标准化程度低、生产周期长、风味品质不稳定等问题,因此食醋酿造工艺亟待改善。
酵母菌作为四川麸醋发酵过程中的功能微生物之一[4],是酒精发酵阶段必不可少的微生物,可代谢生成醇、醛、酸、酯、酚、酮等骨架香气成分,这些物质对食醋的风味品质起着关键的作用。目前国内外报道高产酯酵母(又称生香酵母)包括汉逊酵母属(Hansenula)、毕赤酵母属(Pichia)、假丝酵母属(Candida)、异常威克汉姆酵母(Wickerhamomyces anomalus)等[5-7],这些酵母可合成以乙酸乙酯为主的香味物质[8],同时还产生醇、醛、酮、酸等多种香味物质,丰富食醋的风味,直接或间接影响食醋的品质[9-10]。ZHANG等[11]将一株毕赤酵母接种于大曲发酵,利用GC-MS分析发现,乙醇、乙酸乙酯和乙酸异戊酯含量从31.91%、9.83%、1.02%分别提高至39.86%、22.707%和1.291%,此外,强化发酵产物中额外产生37种挥发性香气成分。LIU等[12]利用热带假丝酵母和生香酵母进行果醋混菌发酵,结果显示,总酯、总醇和总酚分别提高10.70%、42.20%、24.12%,强化效果明显。陈嘉等[13]从山西老陈醋发酵过程的酒醅中分离筛选产酯酵母,得到的3株产酯酵母中,其中毕赤酵母(Pichia pastoris)Y14与大曲混合发酵后,酿制的老陈醋乙酸乙酯含量较对照组提高了1.3倍。
近年来,对四川麸醋微生物研究偏向于优势产酸细菌的筛选及微生物菌群结构,而对醋源生香酵母菌的研究及应用相对较少,因此,本研究利用醋源生香酵母—异常威克汉姆酵母进行麸醋强化发酵,监测发酵过程中关键理化因子并解析醋醅菌群演替规律,对改善四川麸醋的风味品质,丰富菌群结构理论研究具有重要意义。
1 材料与方法
1.1 材料与主要仪器
1.1.1 试验材料
醋醅、曲药、麸皮、小麦等谷物发酵原料由四川某麸醋厂提供;生香酵母菌编号D13-Y2,异常威克汉姆酵母(Wickerhamomyces anomalus),源自醋曲,保存于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为CGMCC 27008。
1.1.2 培养基
PDA培养基:马铃薯浸出粉0.6%(质量分数,下同)、葡萄糖2%、氯霉素0.01%、琼脂2%,pH 5.4~5.8,溶解于蒸馏水,121 ℃灭菌20 min。
YEPD培养基:蛋白胨2%、酵母膏1%、葡萄糖2%、蒸馏水;固体培养基加2%琼脂,121 ℃灭菌20 min。
1.1.3 仪器及设备
DHG-9162电热恒温培养箱,上海一恒科技有限公司;1300 Series A2生物安全柜,美国Thermo Fisher Scientific公司;UV1800PC紫外可见光分光光度计,上海美谱达仪器有限公司;DVB/CAR/PDMS三极萃取纤维头,美国Supelco公司;7890A-5975C气相-质谱联用仪,安捷伦科技有限公司。
1.2 生香酵母强化发酵四川麸醋的研究
1.2.1 发酵用种子液准备
勾取一环保存于PDA斜面培养基上的生香酵母D13-Y2纯培养物,接种于盛有10 mL YEPD液体培养基的试管中,28 ℃振荡培养1 d,使用无菌生理盐水重悬菌液并调整菌体浓度107 CFU/mL。
1.2.2 食醋固态发酵投料及发酵试验
参照四川麸醋发酵现行工艺[14]为对照组(K),在对照组K基础上添加质量分数为1%的生香酵母D13-Y2种子液为生香菌组或称实验组(B)。主要发酵原料如表1所示,总质量约为6 kg。每个处理组做3个平行。
表1 食醋固态发酵主要原料 单位:kg
Table 1 Main raw materials for solid-state fermentation of vinegar
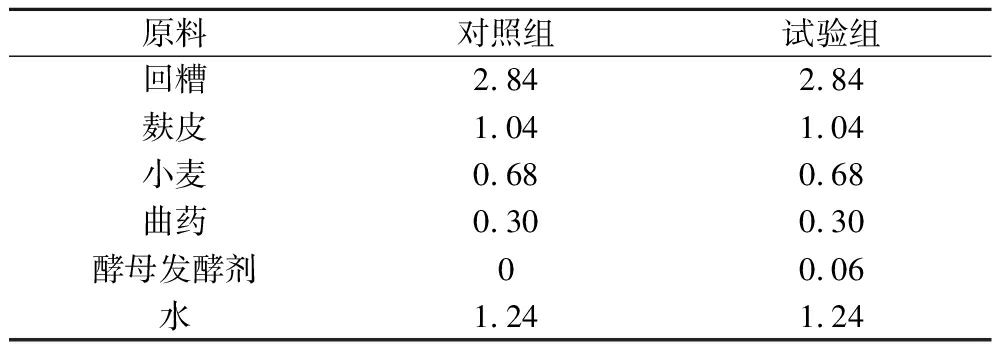
原料对照组试验组回糟2.842.84麸皮1.041.04小麦0.680.68曲药0.300.30酵母发酵剂00.06水1.241.24
按照试验设计,将拌匀的物料装罐发酵,分别于1、5、9、13、17、20 d进行翻醅并取样,自然状态下约发酵20 d,每天不定时监测发酵罐内上、中、下层醅温,控制1~5 d醅温≤35 ℃,6~20 d醅温为35~40 ℃,发酵结束后进行淋醋并收集醋液。
1.2.3 生香酵母强化发酵过程中醋醅理化指标分析
(a)醅温
利用温度探测器每日监测发酵罐内上层(距醋醅表层约10 cm处)、中心(距醋醅表层约20 cm处)、下层(距醋醅底层约10 cm处)醅温。
(b)总酸含量的测定
参照GB 12456—2021《食品安全国家标准 食品中总酸的测定》进行测定。
(c)水分含量的测定
利用水分快速测定仪测定醋醅中的水分含量。
(d)淀粉和还原糖含量的测定
参照GB 5009.9—2023《食品安全国家标准 食品中淀粉的测定》进行测定。
(e)酒精含量的测定
参照GB 5009.225—2023《食品安全国家标准 酒和食用酒精中乙醇浓度的测定》进行测定。
以上试验分别做3个平行。
1.2.4 生香酵母强化发酵过程中醋醅菌群解析
1.2.4.1 总DNA的提取及高通测序分析
参考LIU等[15]方法,对发酵时间为1、9、20 d的醋醅样品均匀采样,称取10 g样品置于装有100 mL生理盐水的三角瓶中,于无菌室中用灭过菌的4层纱布过滤,收集滤液,滤液300 r/min离心5 min,收集上清液;10 000 r/min高速离心5 min,弃上清液,收集沉淀,用生理盐水洗涤3次;按照Fast DNA土壤试剂盒说明书步骤提取醋醅总DNA,委托上海美吉生物医药科技有限公司完成高通量测序。
1.2.4.2 微生物多样性解析
分别对细菌的16S rDNA V3~V4区(338F:5′-ACTCCTACGGGAGGCAGCAG-3′;806R:5′-GGACTACHVGGGTWTCTAAT-3′)和真菌的ITS1区(ITS1F:5′-CTTGGTCATTTAGAGGAAGTAA-3′;ITS2R:5′-GCTGCGTTCTTCATCGATGC-3′)进行PCR扩增,然后对扩增产物进行磁珠纯化回收并进行荧光定量,将各样本按相应比例进行混合,采用Illumina公司的TruSeq Nano DNA LT Library Prep Kit制备测序文库,构建好的文库在Agilent Bioanalyzer上进行质检并采用Quant-iT PicoGreen dsDNA Assay Kit在Promega QuantiFluor荧光定量系统定量,将合格的文库梯度稀释后按所需测序量按相应比例混合,并经NaOH变性为单链进行Illumina NovaSeq双端测序,得到原始下机序列。
1.2.5 醋液中的挥发性风味物质分析
待醋醅发酵结束,经淋醋工艺得到生醋液,生醋液再经熬制浓缩得到熟醋液(浓缩至酸度为6 g/100 mL)。
参考文献[16-17]的方法并稍作修改。取4 mL醋液与1 g NaCl于15 mL顶空瓶中,同时加入20 μL 0.1 mg/mL庚酸甲酯内标物,置于水浴锅中40 ℃平衡30 min后,将萃取头插入顶空瓶萃取40 min。
色谱条件:HP-5MS弹性毛细管柱(30 m×250 μm,0.25 μm);以He为载气(纯度99.999%);流量1.2 mL/min,不分流;进样口温度250 ℃;柱初温30 ℃,以3 ℃/min升至150 ℃,以5 ℃/min的速度升至180 ℃,再以10 ℃/min速度升至250 ℃并保持3 min。
质谱条件:离子源温度230 ℃;传输线温度280 ℃;四级杆温度150 ℃;电子能量70 eV;扫描范围m/z 30~400。
数据分析:检索NIST谱库。通过内标物的含量及对应峰面积对样品中挥发性风味物质的含量进行半定量计算。
1.2.6 醋液感官品评
参考GB/T 18187—2000《酿造食醋》,通过定量描述对醋液进行感官评价分析,其色泽、体态、香气、滋味均采取10点刻度法打分,记录12位专业感官评价人员的打分结果,取各感官项目的平均值作感官评价雷达图(见表2)。
表2 熟醋感官品评评分表
Table 2 Sensory evaluation score sheet of cooked vinegar

指标评分/分0~34~67~9色泽暗红色、无杂质红棕色、光泽暗淡红棕色、光泽明显体态悬浮物、杂质较多较澄清,少量悬浮物和杂质体态澄清,无悬浮、无杂质香气醋香较弱,有不良气味有较浓郁醋香酯香、醋香浓郁滋味有酸味,伴有异味味鲜,酸甜适口滋味柔和,酸甜适口
1.3 数据处理
文中数据通过Excel 2021进行计算,通过Origin 2021绘图,基于美吉生信云平台(www.majorbio.com)对醋醅中菌群结构进行数据可视化分析。
2 结果与分析
2.1 强化发酵过程中醋醅的理化特征
2.1.1 固态生料麸醋发酵过程中醅温的变化
温度是影响微生物代谢的关键因素,是酵母菌、醋酸菌等生长繁殖的必要条件,合适的温度利于菌群的生长及代谢物产生[18]。由图1知,在醋醅发酵期间,对照组(K)与生香菌组(B)中醅温的变化趋势无显著性差异;发酵初期,微生物迅速生长繁殖,醅温迅速上升,发酵中、后期醅温保持在35~40 ℃。
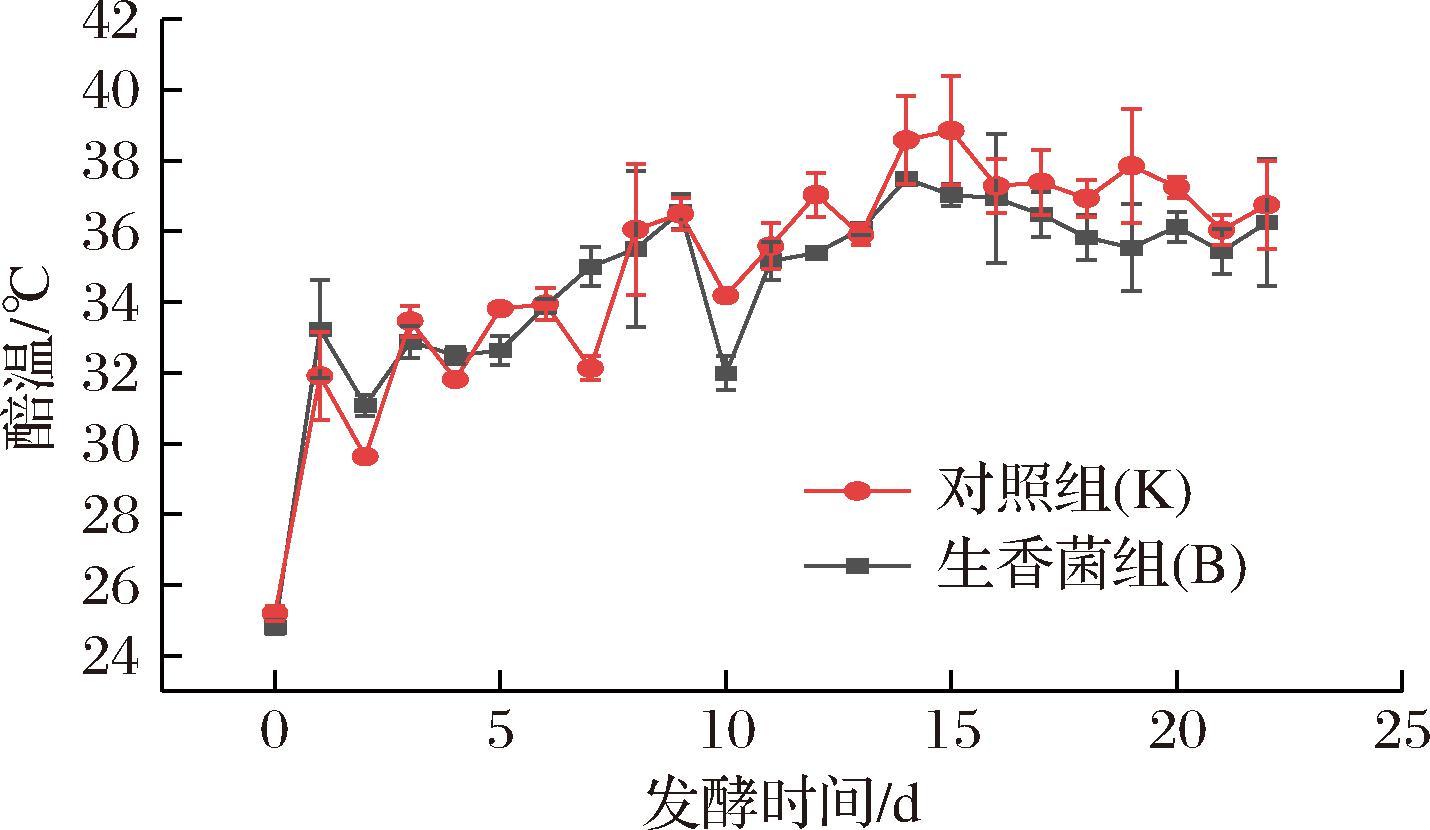
图1 固态生料麸醋发酵过程中醅温的变化
Fig.1 Changes of temperature during fermentation of solid raw bran vinegar
2.1.2 固态生料麸醋发酵过程中其他理化因子的变化
在四川麸醋发酵过程中水分的变化规律如图2-a所示。醋醅中水分的变化与微生物代谢、醋醅温度升高等相关[19],发酵过程中B、K组的水分含量变化趋势相近,均呈先增后降的趋势,保持在59.09%~69.70%,满足微生物菌群正常代谢的水分条件,相较于K组,发酵期间B组水分较高。
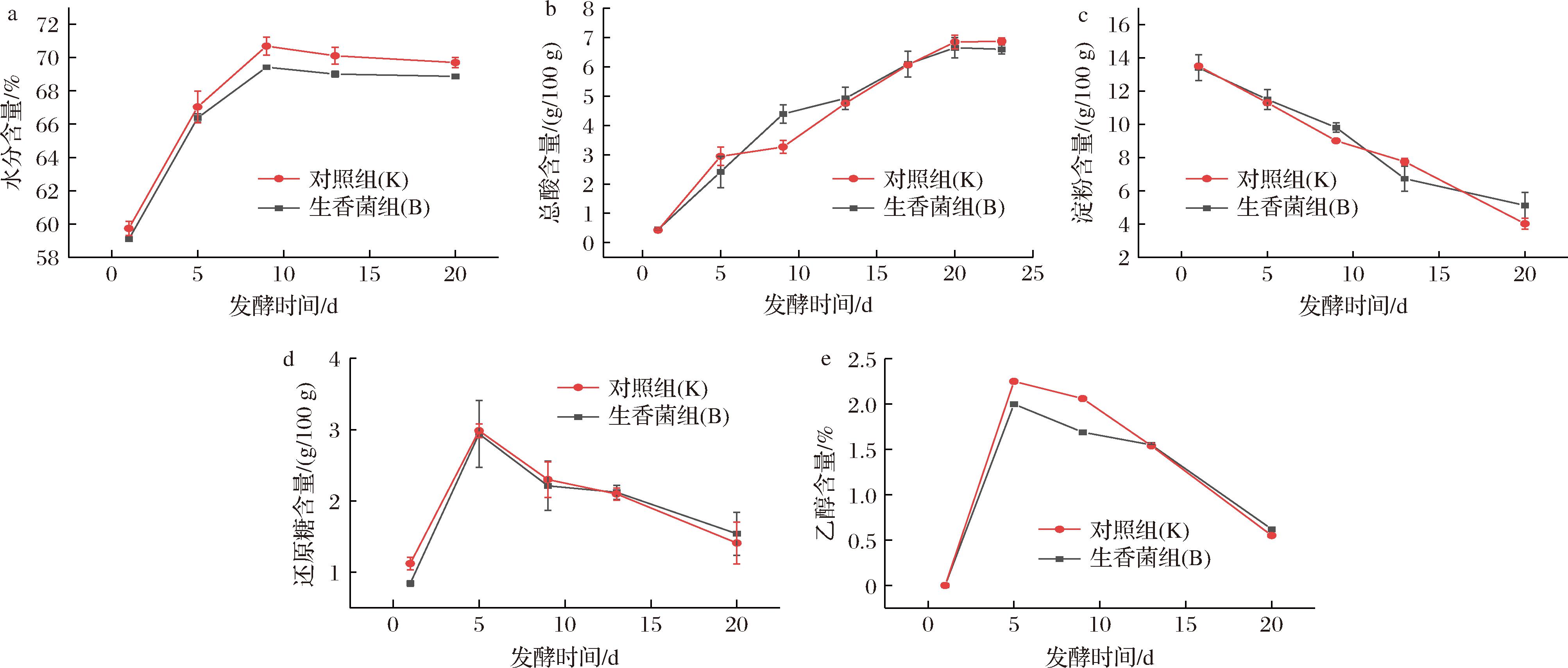
a-水分含量;b-总酸含量;c-淀粉含量;d-还原糖含量;e-乙醇含量
图2 固态生料麸醋发酵过程中理化因子的变化
Fig.2 Changes of physical and chemical factors during fermentation of solid raw vinegar
麸醋发酵过程中总酸含量变化趋势如图2-b所示。总酸含量是发酵过程的一个重要指标,也可初步判断麸醋发酵情况[20-21]。麸醋酿造过程中,B、K组总酸在发酵前、中期迅速积累,至发酵20 d,酸度增加速度减缓并有一定下降趋势,此时意味着发酵终点,结果显示,B、K组的醅酸分别为(6.87±0.11)、(6.59±0.15) g/100 g,强化发酵后的醋醅总酸含量提高了4.7%。
生料固态发酵过程中淀粉含量变化如图2-c所示。随着发酵的进行,淀粉含量持续减少,B组淀粉含量(质量分数)由13.50 g/100 g减少至4.03 g/100 g,K组淀粉含量由13.40 g/100 g减少至4.43 g/100 g,实验组淀粉利用率提高4.80%。还原糖含量呈波动的趋势(图2-d),可能原因是固态生料发酵采用边糖化边发酵的多边发酵模式,较低温发酵方式更适宜醋醅中的微生物生长及代谢,从而使得醋醅中还原糖含量较低,发酵结束时B、K组淀粉含量分别为1.41%、1.53%。
乙醇作为醋酸转化的前体物质,发酵前期酿酒酵母能快速发酵糖类物质产生乙醇。由图2-e知,醋醅中乙醇含量在发酵前期快速增加,发酵5 d时B组、K组乙醇含量最高达2.25%、2.0%(体积分数),B组较K组高出12.5%,整个发酵过程乙醇的含量不高,这可能与醅量、人工翻醅等发酵方式有关。
相较于于华等[19]对四川麸醋的研究,基础理化中淀粉含量、还原糖含量在发酵结束时较高(分别为27、7 g/100 g),这与原料添加量有关,而总酸含量(4.35 g/100 g)低于本研究,这与发酵情况有很大关系,各项理化指标变化趋势与本研究基本一致。
2.2 醋液中的风味物质分析
食醋的挥发性风味主要由醇、酸、酯、羰基类、杂环类等物质组成。采用HS-SPME-GC-MS方法对醋液中的挥发性风味物质进行检测,选取匹配度>80%的物质为代表,对样品中挥发性风味物质进行分析,结果如表3所示。与NIST谱库中的数据进行匹配,共检测到挥发性成分125种,其中包括酯类物质40种、醇类物质20种、酸类物质10种、羰基类物质34种、杂环类物质21种。由表2知,醋液中苯乙醇、2,3-丁二醇、异丁醇等为主要醇类物质,醇类物质可起改善食醋风味的作用,其中,苯乙醇和2,3-丁二醇可为食醋提供蜂蜜和玫瑰香气[22-23],与K组相比,B组苯乙醇和2,3-丁二醇相对含量分别提高112.88%、214.94%,总醇类物质相对含量增加187.34%。醋液中挥发性酸类物质主要为乙酸(K组:31.96%、B组:44.02%),其次为己酸、丙酸、异丁酸、异戊酸,B组挥发性酸类物质相对含量增加45.75%,乙酸作为食醋中主要酸味物质,可以给食醋带来刺激性风味,与非挥发性酸共同形成食醋特殊风味[24]。酯类物质是食醋中重要的呈香物质,醋液中共检测到40种酯类物质,包括乙酸乙酯、乳酸乙酯、2-羟基丙酸乙酯、乙酸苯乙酯、乙酸异戊酯等,丰富的酯类物质可使食醋具有浓郁的香味[16],其中,乙酸乙酯是典型的香气成分之一,能够赋予食醋水果香及花香[25-26];经生香菌强化发酵后,B组乙酸乙酯含量提高68.28%,总挥发性酯类物质含量增加128.99%。与醇、酸、酯类物质相比,醋液中羰基与杂环类物质含量及种类较少,包括3-羟基-2-丁酮、糠醛、3,5-二叔丁基苯酚、2,3,5,6-四甲基吡嗪等。综上,通过引入生香菌强化发酵,明显增加生香菌组醋液中香味物质,可有效提高食醋风味品质。
表3 醋液中主要挥发性风味物质相对含量 单位:%
Table 3 Relative content of main volatile flavor compounds in vinegar
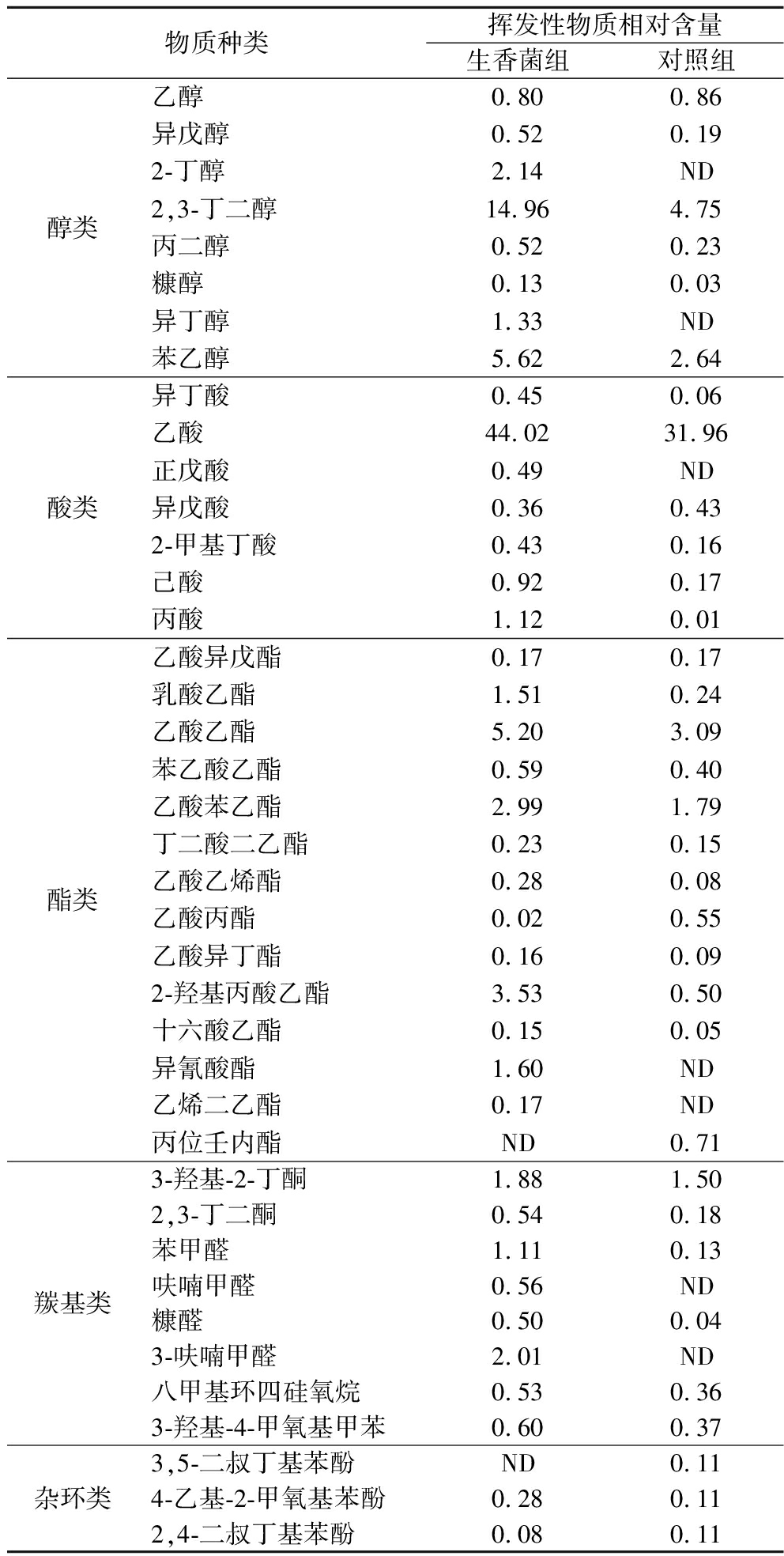
物质种类挥发性物质相对含量生香菌组对照组醇类乙醇0.800.86异戊醇0.520.192-丁醇2.14ND2,3-丁二醇14.964.75丙二醇0.520.23糠醇0.130.03异丁醇1.33ND苯乙醇5.622.64酸类异丁酸0.450.06乙酸44.0231.96正戊酸0.49ND异戊酸0.360.432-甲基丁酸0.430.16己酸0.920.17丙酸1.120.01酯类乙酸异戊酯0.170.17乳酸乙酯1.510.24乙酸乙酯5.203.09苯乙酸乙酯0.590.40乙酸苯乙酯2.991.79丁二酸二乙酯0.230.15乙酸乙烯酯0.280.08乙酸丙酯0.020.55乙酸异丁酯0.160.092-羟基丙酸乙酯3.530.50十六酸乙酯0.150.05异氰酸酯1.60ND乙烯二乙酯0.17ND丙位壬内酯ND0.71羰基类3-羟基-2-丁酮1.881.502,3-丁二酮0.540.18苯甲醛1.110.13呋喃甲醛0.56ND糠醛0.500.043-呋喃甲醛2.01ND八甲基环四硅氧烷0.530.363-羟基-4-甲氧基甲苯0.600.37杂环类3,5-二叔丁基苯酚ND0.114-乙基-2-甲氧基苯酚0.280.112,4-二叔丁基苯酚0.080.11
注:ND表示未检出。
2.3 固态生料发酵过程中微生物菌群的动态变化
2.3.1 微生物群落在门水平的动态变化
对各样本中细菌物种在门水平进行注释,得到的物种丰度柱形图如图3-a所示,厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteriota)是固态发酵阶段中丰度最高的3个细菌门。发酵初期,以厚壁菌门、变形菌门、放线菌门为优势菌,K组、B组厚壁菌门相对丰度分别为87.85%、82.40%,变形菌门丰度分别为10.80%、14.27%,2个处理组放线菌门丰度均较低(K组:1.17%、B组:2.78%)。发酵过程中,不同组厚壁菌门演变规律存在差异性变化,随发酵进行,K组厚壁菌门相对丰度不断上升,发酵结束时丰度为95.73%,而B组厚壁菌门相对丰度最高为发酵第9天,发酵结束时丰度为90.78%,该差异性可能与加入强化菌造成的生物扰动有关,整个发酵过程中,始终以厚壁菌门、变形菌门为醋醅优势菌。
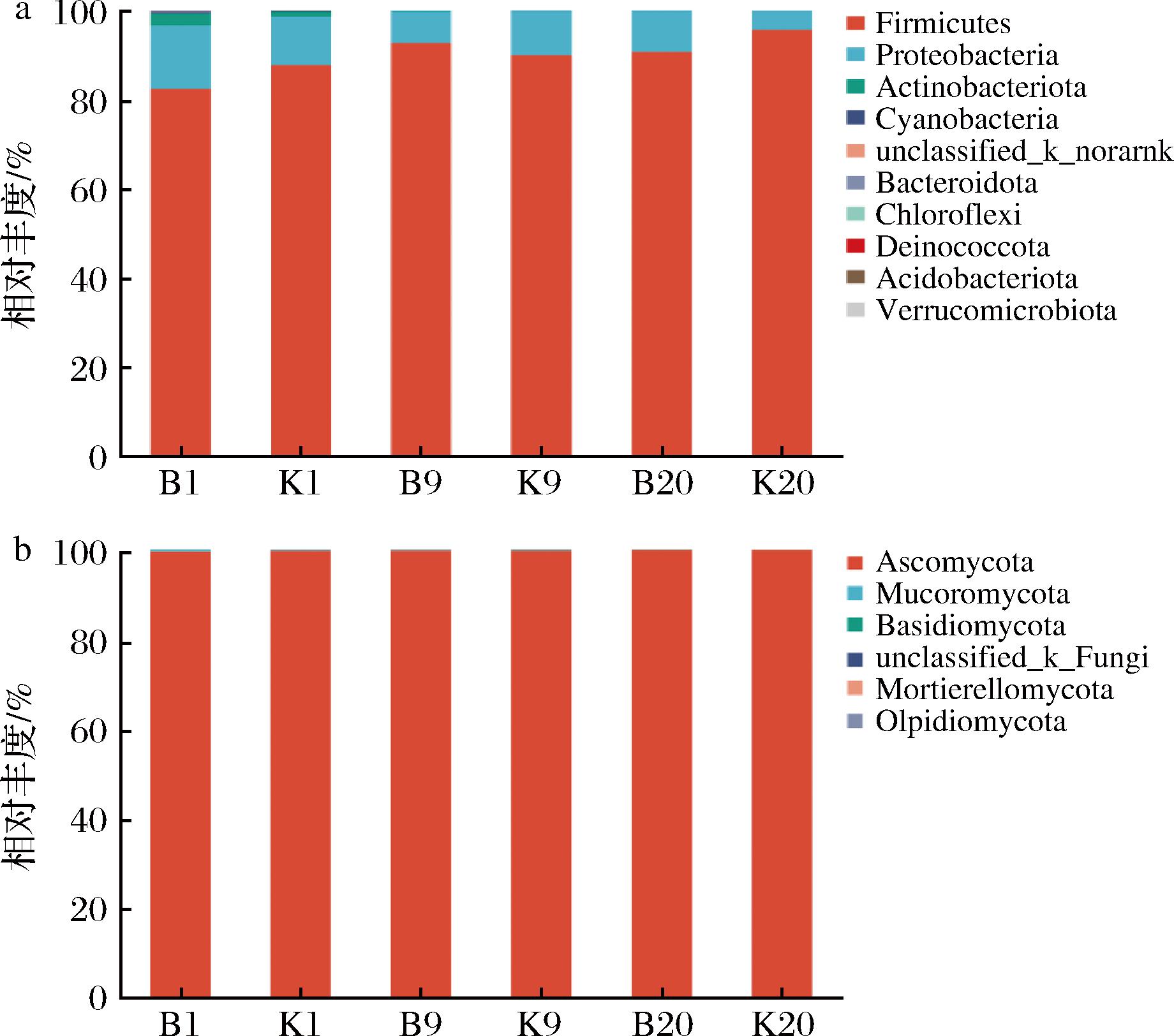
a-细菌;b-真菌
图3 固态生料食醋发酵过程中醋醅样品门水平细菌和真菌相对丰度
Fig.3 Relative abundance of bacteria and fungi at the level of vinegar fermented grains during fermentation of solid raw vinegar
注:“B1、B9、B20”分别代表B组发酵第1、9、20天,“K1、K9、K20”同理(下同)。
对各样本中真菌物种在门水平进行注释,得到的物种丰度柱形图如图3-b所示,子囊菌门(Ascomycota)、毛霉亚门(Mucoromycota)、担子菌门(Basidiomycota)是固态发酵阶段丰度相对最高的3个真菌门,其中子囊菌门是醋醅中的绝对优势菌,不同样本不同发酵时期的相对丰度均占99%以上,发酵结束时,K、B组子囊菌门丰度分别占99.88%、99.89%,无显著性差异。其次为毛霉亚门,发酵过程中其相对丰度逐渐减少,K组中相对丰度占比由0.20%减少至0.00%,但B组中仍保留一定丰度毛霉亚门(0.10%),担子菌门在发酵中丰度无明显变化。
在张雅琳等[26]研究中,麸醋发酵前期细菌门相对丰度与本研究存在较大差异,发酵1 d时厚壁菌门相对丰度为23.73%,至发酵23 d,厚壁菌门达到最大值98.88%,而本研究中食醋发酵初期厚壁菌门丰度可达82.40%~87.85%;张雅琳研究中醋醅真菌门主要由子囊菌门和担子菌门组成,2个门在真菌菌群中总占比始终在98%以上,该情况与本研究相似。
2.3.2 微生物群落在属水平的动态变化
对各样本中细菌物种在属水平进行注释,得到的物种丰度柱形图如图4-a所示,各样本的细菌群落主要由乳杆菌属(Lactobacillus)、醋杆菌属(Acetobacter)、魏斯氏菌属(Weissella)、链霉菌属(Streptomyces)、葡萄球菌属(Staphylococcus)、芽孢杆菌属(Bacillus)、糖多孢菌属(Saccharopolyspora)、不动杆菌属(Acinetobacter)等组成。发酵过程中,乳杆菌属是K、B组绝对优势菌属,其相对丰度始终保持在70%以上。随发酵时间延长物种多样性减少,至发酵结束时K、B组乳杆菌属成为绝对优势菌属,其相对丰度分别为94.70%、88.30%,醋杆菌属丰度分别为4.17%、9.08%,芽孢杆菌属丰度分别为0.70%、1.65%。乳杆菌属和醋杆菌属演变规律与张雅琳等[26]的研究结果存在差异,同时,利用生香酵母强化醋醅发酵,造成了生物扰动。
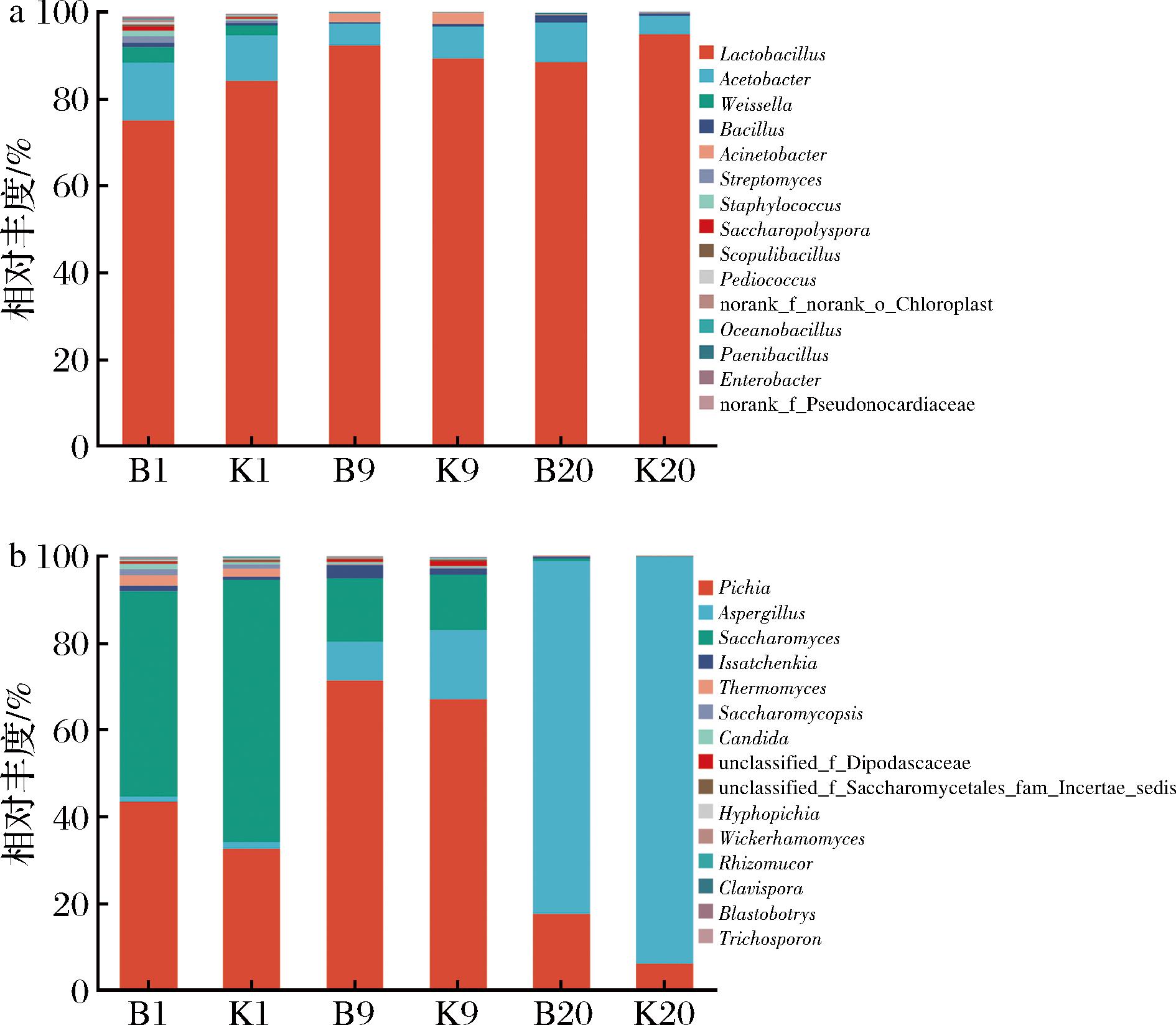
a-细菌;b-真菌
图4 固态生料食醋发酵过程中醋醅样品属水平细菌和真菌相对丰度
Fig.4 Relative abundance of bacteria and fungi at genus level during solid raw material vinegar fermentation
对各样本中真菌物种在属水平进行注释,得到的物种丰度柱形图如图4-b所示,各样本的真菌群落主要包括毕赤酵母属(Pichia)、酵母菌属(Saccharomyces)、曲霉属(Aspergillus)、伊萨酵母属(Issatchenkia)、嗜热真菌属(Thermomyces)、覆膜孢酵母属(Saccharomycopisis)、念珠菌属(Candida)、威克汉姆酵母属(Wickerhamomyces)、根毛霉属(Rhizomucor)以及未被分类的双足囊菌科、酵母菌目等。发酵初期,毕赤酵母属、酵母菌属是B、K组绝对优势菌属,其相对丰度共占90%以上,随发酵时间延长,毕赤酵母属相对丰度在K、B组中变化趋势相近(先增后减),至发酵结束时,K、B组毕赤酵母属相对丰度分别为5.98%、17.53%,酵母菌属丰度始终逐渐减少,至发酵结束时K、B组酵母菌属丰度分别为0.04%、0.59%,该结果与张奶英[27]研究结果相似,发酵过程中毕赤酵母属、酵母菌属、覆膜孢酵母属等丰度逐渐减小;发酵初期曲霉属的丰度相对较低,随发酵时间延长逐渐成为绝对优势菌属,K、B组曲霉属丰度分别由1.43%、1.27%增加至93.44%、80.96%,曲霉属作为重要的功能种属,该属可分泌多种水解酶,尤其是大量的糖化酶[28-29]。与对照组相比,B组引入生香酵母菌(威克汉姆酵母属)强化发酵,增加了此菌属在发酵前、中期的相对丰度,分别为0.28%、0.30%,发酵后期减少为0.03%(K组中威克汉姆酵母属相对丰度始终维持在0.01%~0.08%),由此说明强化菌株在发酵前、中期生长并发挥强化生香作用。强化菌株的引入导致毕赤酵母属、酵母菌属、曲霉属、威克汉姆酵母属等优势真菌属产生扰动,群落结构发生改变。
综上所述,在固态生料麸醋发酵过程中,以乳杆菌属(Lactobacillus)、醋杆菌属(Acetobacter)、魏斯氏菌属(Weissella)、链霉菌属(Streptomyces)、葡萄球菌属(Staphylococcus)、芽孢杆菌属(Bacillus)、毕赤酵母属(Pichia)、酵母菌属(Saccharomyces)、曲霉属(Aspergillus)、伊萨酵母属(Issatchenkia)、嗜热真菌属(Thermomyces)、覆膜孢酵母属(Saccharomycopisis)、念珠菌属(Candida)、威克汉姆酵母属(Wickerhamomyces)为优势菌属,随发酵时间延长,细菌、真菌多样性减少,发酵末期以乳杆菌属、醋杆菌属、毕赤酵母属、曲霉属为绝对优势菌群;引入生香酵母强化发酵(B组),导致优势菌群结构发生差异性变化,包括乳杆菌属、醋杆菌属、毕赤酵母属、酵母菌属、曲霉属、威克汉姆酵母属等,而微生物扰动也是关键理化因子和风味物质发生变化的原因。
2.4 理化及风味物质与微生物相关性分析
对不同发酵阶段醋醅中优势菌群与理化因子进行Pearson相关性分析,通过绘制相关性系数热图,将相关性系数R>0.8视为正相关,R<-0.8视为负相关,直观表示了各优势微生物与理化因子的相关性,如图5所示。如图5-a所示,醅酸含量与乳杆菌属、醋杆菌属呈显著正相关,与覆膜孢酵母属、念珠菌属呈显著负相关;水分含量与6种菌属强相关,其中仅与魏斯氏菌属、嗜热真菌属、覆膜孢酵母属呈显著负相关,与乳杆菌属、醋杆菌属呈正相关但不显著,该结果与刘敏芳等[30]、鲁梅等[31]研究相似;乙醇和还原糖在食醋发酵过程中仅与少数菌属呈现出相关性但不显著;淀粉是发酵中的重要碳源,其含量与多数微生物表现出相关性,包括乳杆菌属、醋杆菌属、魏斯氏菌属、芽孢杆菌属、曲霉属、念珠菌属、威克汉姆酵母属等,其中淀粉含量与曲霉属呈显著负相关,曲霉属可分泌多种水解酶对淀粉进行分解。实验组中(图5-b),醅酸含量与醋杆菌属、曲霉属呈显著正相关,与念珠菌属、威克汉姆酵母属呈显著负相关;水分含量仅与乳杆菌属呈显著正相关,与魏斯氏菌属、嗜热真菌属、覆膜孢酵母属呈显著负相关;乙醇和还原糖含量与少数菌属呈现显著相关性;淀粉含量与菌属相关性和对照组情况相似。
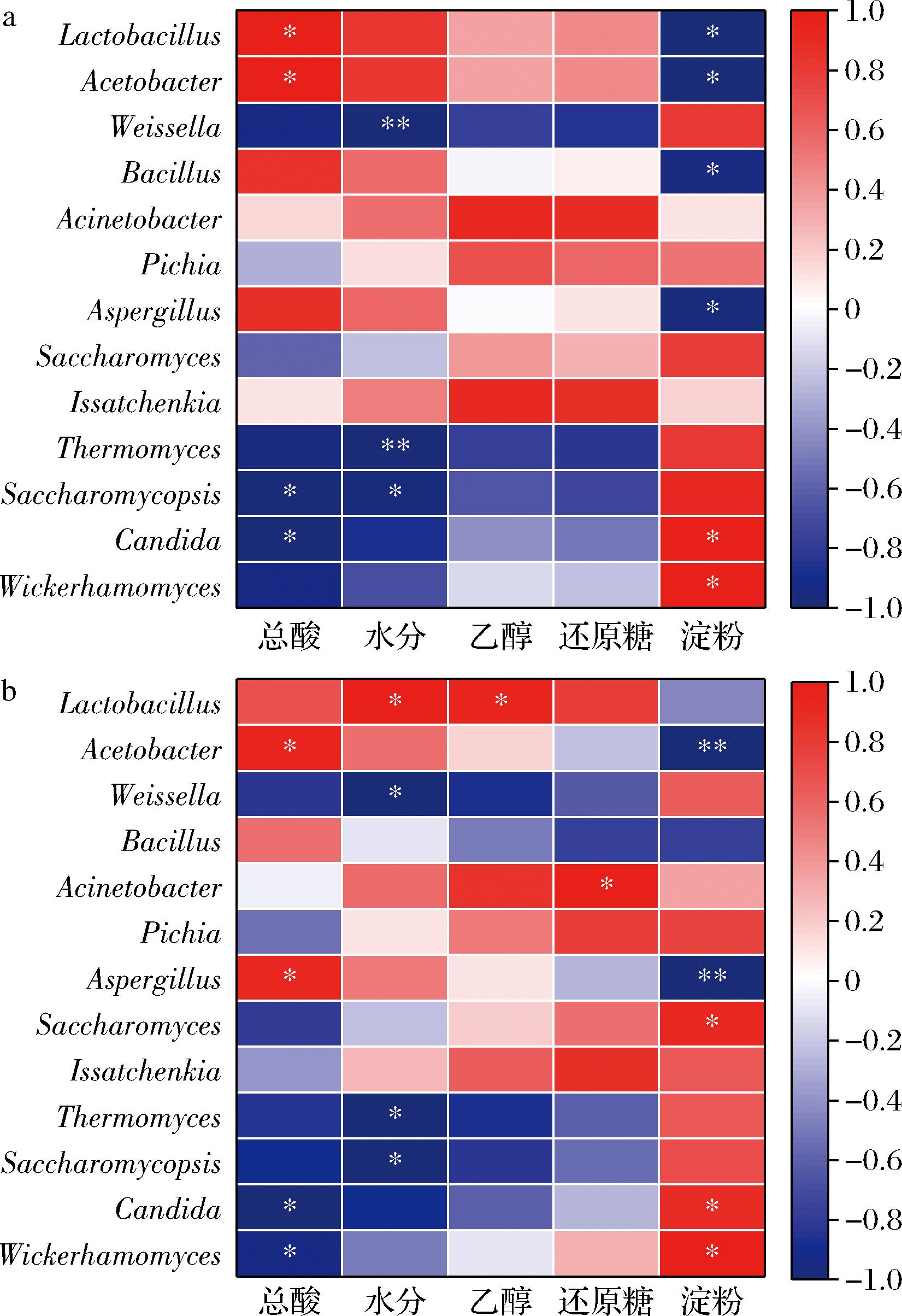
a-对照组;b-实验组
图5 优势菌群与理化因子间的Pearson相关性系数热图
Fig.5 Heatmap of Pearson correlation coefficient between dominant flora and physicochemical factors
注:*P<0.05,**P<0.01,***P<0.001。
结合优势菌属与醋液中主要风味物质进行分析,相较于K组,发酵前期B组乳杆菌属、醋杆菌属相对丰度更高,而乳杆菌属、醋杆菌属以产乳酸、乙酸为主[32-33],形成食醋主体酸味,同时B组醋液中乙酸含量显著大于K组,由此说明乙酸与乳杆菌属、醋杆菌属对产酸具有重要作用;B组毕赤酵母属、酵母菌属、威克汉姆酵母属在发酵前、中期相对丰度均更高,通过对醋液中挥发性物质分析,实验组酯含量增加128.99%、醇含量增加187.34%,说明了该类菌属对产酯、产醇具有重要作用[34]。引入生香酵母强化发酵,导致毕赤酵母属、酵母菌属、曲霉属、乳杆菌属、醋杆菌属等发生生物扰动,使实验组与对照组醋液中酯类、醇类、羰基类等物质发生显著性差异变化,可见微生物菌群和风味物质密切相关。
2.5 感官品评
对熟醋液的色泽、香气、滋味、体态进行感官定量分析,结果如图6所示,B组除体态以外,色泽、香气、滋味得分均高于K组,而B组“体态”得分较低,可能与还原糖、淀粉、可溶固形物含量有关,在后续研究中可进一步探究;通过单因素方差分析,结果表明K、B组间仅香气存在显著性差异(P<0.01),说明B组经生香酵母强化发酵后,风味品质得到一定改善。
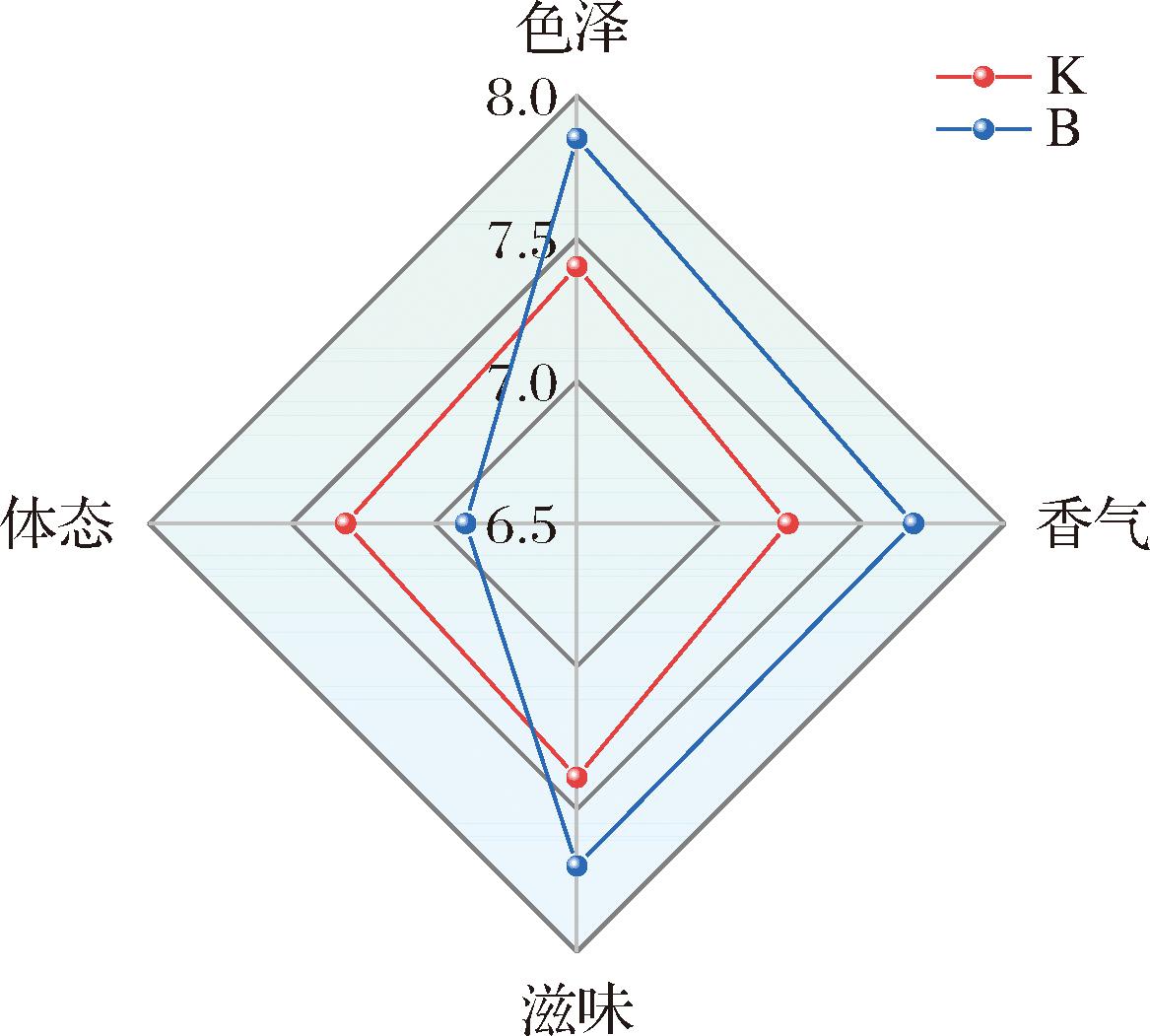
图6 熟醋液感官品评得分
Fig.6 Sensory evaluation score of cooked vinegar taste
3 结论
本研究模拟四川麸醋的固态生料发酵模式,将生香酵母-异常威克汉姆酵母应用于醋醅发酵阶段进行实验室小型发酵试验。结果表明,发酵过程中对照组与生香菌组之间醅温、水分变化趋势相近,而总酸、乙醇含量、淀粉含量、还原糖含量存在差异性变化,生香菌组醋醅总酸含量提高了4.7%,淀粉利用率提高4.80%,同时,生香酵母强化发酵有效提高了醋液中风味物质种类及含量,其中,醇类物质相对含量增加187.34%、挥发性酸类物质相对含量增加109.44%、酯类物质相对含量增加45.75%。此外,乳杆菌属、醋杆菌属、芽孢杆菌属、毕赤酵母属、曲霉属、酵母属、伊萨酵母属、威克汉姆酵母属等是发酵过程中主要优势菌属,引入生香酵母强化发酵,增加了威克汉姆酵母属在发酵前、中期的相对丰度,导致乳杆菌属、醋杆菌属、毕赤酵母属、酵母菌属、曲霉属、威克汉姆酵母属产生扰动,菌群结构发生变化,也因此提高了麸醋风味品质。本试验为深入探究四川麸醋菌群结构、改善麸醋风味品质提供了参考依据。
[1] HO C W, LAZIM A M, FAZRY S, et al.Varieties, production, composition and health benefits of vinegars:A review[J].Food Chemistry, 2017, 221:1621-1630.
[2] FAN S W, PAN T H, LI G Q.Evaluation of the physicochemical content and solid-state fermentation stage of Zhenjiang aromatic vinegar using near-infrared spectroscopy[J].International Journal of Food Engineering, 2020, 16(12):20200127.
[3] 杨宇昊. 四川麸醋生醋后处理工序对醋沉淀形成及醋品质的影响[D].雅安:四川农业大学, 2020.
YANG Y H.Effect of post-treatment process of raw vinegar fermentation on tne formation and quality of vinegar precipitation[D].Ya’an: Sichuan Agricultural University, 2020.
[4] VILELA A.Microbial dynamics in sour-sweet wine vinegar:Impacts on chemical and sensory composition[J].Applied Sciences-Basel, 2023, 13(13):7366.
[5] 袁海珊, 刘功良, 白卫东, 等.产酯酵母在发酵食品中的应用研究进展[J].中国酿造, 2023, 42(1):15-20.
YUAN H S, LIU G L, BAI W D, et al.Research progress on the application of ester-producing yeast in fermented food[J].China Brewing, 2023, 42(1):15-20.
[6] 刘薇, 栾春光, 王德良, 等.高产酯酵母的筛选、鉴定及其发酵特性研究[J].食品与发酵工业, 2021, 47(23):311-318.
LIU W, LUAN C G, WANG D L, et al.Screening, identification and fermentation characteristics of yeast with high-yield of ester[J].Food and Fermentation Industries, 2021, 47(23):311-318.
[7] FU Z L, SUN B G, LI X T, et al.Isolation and characterization of a high ethyl acetate-producing yeast from Laobaigan Daqu and its fermentation conditions for producing high-quality Baijiu[J].Biotechnology &Biotechnological Equipment, 2018, 32(5):1218-1227.
[8] TEKARSLAN-SAHIN S H.Adaptive laboratory evolution of yeasts for aroma compound production[J].Fermentation, 2022, 8(8):372.
[9] MINA M, TSALTAS D.Contribution of Yeast in Wine Aroma and Flavour[M]. Yeast-Industrial Applications. London:InTech, 2017.
[10] PARAPOULI M, VASILEIADIS A, AFENDRA A S, et al.Saccharomyces cerevisiae and its industrial applications[J].AIMS Microbiology, 2020, 6(1):1-31.
[11] ZHANG Q, HUO N R, WANG Y H, et al.Aroma-enhancing role of Pichia manshurica isolated from Daqu in the brewing of Shanxi Aged Vinegar[J].International Journal of Food Properties, 2017, 20(9):2169-2179.
[12] LIU Q, LI X J, SUN C C, et al.Effects of mixed cultures of Candida tropicalis and aromatizing yeast in alcoholic fermentation on the quality of apple vinegar[J].3 Biotech, 2019, 9(4):128.
[13] 陈嘉, 冯志宏, 施俊凤.传统山西老陈醋增香酵母菌的筛选及其特性研究[J].保鲜与加工, 2020, 20(1):120-126.
CHEN J, FENG Z H, SHI J F.Screening and characteristics study of flavoring yeast from traditional Shanxi aged vinegar[J].Storage and Process, 2020, 20(1):120-126.
[14] 周楠, 黄钧, 周荣清, 等.生物强化和中间代谢物扰动对四川麸醋微生物群落结构及代谢组分的影响[J].食品与发酵工业, 2022, 48(24):211-219.
ZHOU N, HUANG J, ZHOU R Q, et al.Effects of bioaugmentation and intermediate metabolite disturbance onmicrobial community and metabolite in Sichuan bran vinegar[J].Food and fermentation Industries, 2022, 48(24):211-219.
[15] LIU A P, PENG Y, AO X L, et al.Effects of Aspergillus niger biofortification on the microbial community and quality of Baoning vinegar[J].LWT, 2020, 131:109728.
[16] FANG G Y, CHAI L J, ZHONG X Z, et al.Deciphering the succession patterns of bacterial community and their correlations with environmental factors and flavor compounds during the fermentation of Zhejiang rosy vinegar[J].International Journal of Food Microbiology, 2021, 341:109070.
[17] 张林祥, 张蕾, 秦子涵, 等.顶空-固相微萃取-气质联用法分析玫瑰醋挥发性风味物质及特征[J].食品与发酵工业, 2022, 48(21):269-275.
ZHANG L X, ZHANG L, QIN Z H, et al.Analysis of volatile flavor profile and characteristics of rosy vinegar based on HS-SPME-GC-MS profiles[J].Food and fermentation Industries, 2022, 48 (21):269-275.
[18] 张强, 赵翠梅, 李晓伟, 等.温度和翻醅对食醋固态发酵产酸的影响[J].中国酿造, 2020, 39(4):159-164.
ZHANG Q, ZHAO C M, LI X W, et al.Effect of temperature and Cupei-turning on acids production of vinegar by solid-state fermentation[J].China Brewing, 2020, 39(4):159-164.
[19] 于华, 唐姣, 赵佳丽, 等.四川麸醋发酵过程中醋醅理化指标及有机酸变化分析[J].中国酿造, 2020, 39(7):51-55.
YU H, TANG J, ZHAO J L, et al.Analysis of physicochemical indexes and organic acid changes of Cupei during Sichuan bran vinegar fermentation process[J].China Brewing, 2020, 39(7):51-55.
[20] NIE Z Q, ZHENG Y, DU H F, et al.Dynamics and diversity of microbial community succession in traditional fermentation of Shanxi aged vinegar[J].Food Microbiology, 2015, 47:62-68.
[21] 梁楷, 闫裕峰, 郎繁繁, 等.食醋总酸近红外快速检测方法的研究[J].中国酿造, 2020, 39(2):94-97.
LIANG K, YAN Y F, LANG F F, et al.Rapid detection method of total acid in vinegar by near infrared spectroscopy[J].China Brewing, 2020, 39(2):94-97.
[22] 陈旭峰, 朱丹, 郭宏萍, 等.山西老陈醋酿造过程中理化指标动态变化及新淋醋品质分析[J].中国酿造, 2021, 40(12):52-57.
CHEN X F, ZHU D, GUO H P, et al.Dynamic change of physicochemical indexes in brewing process of Shanxi aged vinegar and quality of new leaching vinegar[J].China Brewing, 2021, 40(12):52-57.
[23] 于静, 孙娅娜, 孙翔宇, 等.基于有机酸高效液相色谱的葡萄酒品质分析[J].农业机械学报, 2017, 48(12):354-362.
YU J, SUN Y N, SUN X Y, et al.Wine quality analysis based on organic acids detected by HPLC[J].Transactions of the Chinese Society for Agricultural Machinery, 2017, 48(12):354-362.
[24] ZHANG B, XIA T, DUAN W H, et al.Effects of organic acids, amino acids and phenolic compounds on antioxidant characteristic of Zhenjiang aromatic vinegar[J].Molecules, 2019, 24(20):3799.
[25] DUMITRIU G D, L PEZ DE LERMA N, ZAMFIR C I, et al.Volatile and phenolic composition of red wines subjected to aging in oak cask of different toast degree during two periods of time[J].LWT, 2017, 86:643-651.
PEZ DE LERMA N, ZAMFIR C I, et al.Volatile and phenolic composition of red wines subjected to aging in oak cask of different toast degree during two periods of time[J].LWT, 2017, 86:643-651.
[26] 张雅琳, 李婧, 刘廷锐, 等.四川麸醋发酵过程中有机酸及细菌解析[J].中国调味品, 2022, 47(11):61-6.
ZHANG Y L, LI J, LIU T R, et al.Analysis of organic acids and bacteria in Sichuan bran vinegar during fermentation[J].Chinese condiment, 2022, 47(11):61-6.
[27] 张奶英. 四川麸醋发酵过程中微生物群落与风味物质变化分析[D].雅安:四川农业大学, 2016.
ZHANG N Y.Analysis on the variation of the microbial community diversity and the flavor substances during fermentation process of Sichuan bran vinegar[D].Ya’an:Sichuan Agricultural University, 2016.
[28] ZHAO L N, WANG Y, XING J L, et al.Distinct succession of abundant and rare fungi in fermented grains during Chinese strong-flavor liquor fermentation[J].LWT, 2022, 163:113502.
[29] 李兵, 张超, 王玉霞, 等.白酒大曲功能微生物与酶系研究进展[J].中国酿造, 2019, 38(6):7-12.
LI B, ZHANG C, WANG Y X, et al.Research progress on functional microbes and enzymes in Daqu of Baijiu[J].China Brewing, 2019, 38(6):7-12.
[30] 刘敏芳, 王昊乾, 唐艺婧, 等.后火曲制作过程中理化、生化指标和微生物菌群变化及其相关性分析[J].中国酿造, 2023, 42(5):70-77.
LIU M F, WANG H Q, TANG Y J, et al.Changes of physicochemical and biochemical indexes and microbial community and analysis during the preparation of Houhuoqu[J].China Brewing, 2023, 42(5):70-77.
[31] 鲁梅, 宋从从, 石桂珍, 等.赤水晒醋醋酸发酵过程原核微生物群落及理化因子相关性分析[J].食品与发酵工业, 2021, 48(10):219-225.
LU M, SONG C C, SHI G Z, et al.Correlation analysis of prokaryotic microbial community and physicochemical factors during the acetic acid fermentation of Chishui sun-dried vinegar[J].Food and fermentation Industries, 2021, 48(10):219-225.
[32] 方冠宇, 穆晓静, 蒋予箭.浙江玫瑰醋发酵过程中细菌菌群结构变化与有机酸形成相关性分析[J].食品科学, 2019, 40(22):177-184.
FANG G Y, MU X J, JIANG Y J.Correlation between structural shifts of bacterial community and organic acid formation during the fermentation of Zhejiang rosy vinegar[J].Food Science, 2019, 40(22):177-184.
[33] WU Y F, XIA M L, ZHANG X F, et al.Unraveling the metabolic network of organic acids in solid-state fermentation of Chinese cereal vinegar[J].Food Science &Nutrition, 2021, 9(8):4375-4384.
[34] 程伟, 彭兵, 汪焰胜, 等.清香型酒醅中一株产乙酸乙酯酵母菌的筛选及其应用性能分析[J].酿酒, 2018, 45(5):43-47.
CHENG W, PENG B, WANG Y S, et al.Screening of one yeast strain with high-yield of ethyl acetate from Fen-flavor liquor fermenting-grains and analysis of its application performance[J].Liquor Making, 2018, 45(5):43-47.