发酵普洱茶(fermented Pu-erh tea,FPT)是以云南大叶种晒青毛茶为原料渥堆发酵制成的后发酵茶[1-2]。与未经发酵的普洱生茶相比,其具有涩味降低、口感顺滑、口味醇厚、汤色红亮等优点[3-4]。在普洱茶发酵过程中,真核与原核菌群是渥堆发酵的主体[3,5],其在特定理化条件下以晒青毛茶为主要营养原料代谢降解其中的茶多酚、游离氨基酸、纤维素等,生成茶褐素、可溶性多糖等风味成分。发酵原料作为普洱茶发酵培养基和发酵程度直接影响发酵菌群的生长。首先,发酵菌群在生长代谢时进行不同生化反应[6-7],故不同的菌群结构会展现不同的代谢功能,使得发酵普洱茶菌群结构、理化参数变化,进而导致作为代谢产物的风味成分变化,最终影响普洱茶的发酵品质[8-11]。其次,发酵菌群经过不同程度的发酵形成不同风味的茶,如传统未发酵绿茶、全发酵红茶和后发酵普洱茶的群落结构和风味成分具有显著差异。以普洱茶为例,普洱生茶风味成分中茶多酚与游离氨基酸的含量以及真核菌群的多样性较高[5,12];而普洱熟茶的风味成分中可溶性多糖与茶褐素的含量以及原核菌群的多样性较高[3,5]。此外,研究发现在单独发酵普洱茶特定部位(如茶梗)或在普洱茶原料中添加其他碳源(柑橘、香草)有助于提高后发酵品质,而其发酵过程中的菌群结构尚未明确[13-15]。基于普洱茶原料作为普洱茶发酵过程中的培养基对发酵菌群的生长代谢具有重要影响,并且发酵程度直接决定生长代谢的进度,因而有必要详细分析不同发酵程度、不同原料对菌群结构、理化参数和主要风味成分的影响。
本研究为探究发酵程度、原料(不同品级、不同部位叶片、额外添加蜂蜜)对发酵普洱茶菌群结构、理化参数与主要风味成分的影响进行了以下研究:首先,检测各普洱茶样本的理化参数与主要风味成分,以分析不同发酵程度普洱茶间与不同原料发酵普洱茶间的理化参数与主要风味成分差异;然后,通过16S rRNA、内源转录间隔区(internally transcribed spacer,ITS)扩增子高通量测序分析不同发酵程度普洱茶与不同原料发酵普洱茶的菌群结构及其差异;进而,通过PICRUSt2功能预测分析其菌群结构功能差异;最后,通过冗余分析(redundancy analysis,RDA)菌群与理化参数的相关性。本研究发现发酵程度与原料对普洱茶发酵菌群结构、理化参数与主要风味成分具有显著影响,为普洱茶发酵工艺改良提供理论参考。
1 材料与方法
1.1 材料、试剂与仪器
茶叶鲜叶和茶梗材料于2020年4月采自云南勐海茶山;黄片茶叶于2019年秋采自云南勐海茶山;大益-益原素与大益-七子茶茶饼于2020年购自云南大益茶业集团有限公司。
没食子酸、L-茶氨酸、芦丁等标准品,上海麦克林生化科技股份有限公司;其余试剂均为分析纯,生工生物工程(上海)股份有限公司与国药集团化学试剂有限公司。
100pro pH计,上海力辰邦西仪器科技有限公司;V5000可见分光光度计,上海元析仪器有限公司;tecator digestor 20消化炉,丹麦福斯公司。
1.2 普洱茶发酵与品评
按图1所示工艺进行发酵,分别制成绿茶、红茶和发酵普洱茶,以研究不同发酵程度普洱茶的差异。发酵结束后,分别使用7号长抖筛、5号圆孔筛和3号圆孔筛将发酵后的发酵普洱茶筛分,得到特级、3级和7级发酵普洱茶;同时,在特级发酵普洱茶的基础上,人工分筛出芽头,作为宫廷级发酵普洱茶;以研究不同品级普洱茶差异。在“特级”普洱茶原料中添加20 g/kg蜂蜜发酵,以分析额外添加蜂蜜碳源对普洱茶影响。茶梗、黄片茶叶的发酵工艺与鲜叶发酵工艺相同(图1),以研究不同原料差异。绿茶为鲜叶萎凋、揉捻、晒干后直接制成;红茶为鲜叶萎凋、揉捻后发酵4 h后晒干制成;发酵普洱茶渥堆发酵35 d。发酵在云南书剑茶叶有限公司进行,发酵后,分别取样100 g。此外,以大益-益原素与大益-七子茶茶饼作为对照。样本详情如表1所示,每个样本3个重复。依据GB/T 23776—2018《茶叶感官审评方法》泡茶,并聘请12名有资历的专业品茶师(男女比为1∶1)对本研究发酵普洱茶的色泽、香气、滋味、汤色进行品鉴。此外,参照GB/T 22111—2008《地理标志产品 普洱茶》与NY/T 779—2004《普洱茶》进一步确认发酵普洱茶SF_1~4的品级。其中,金色毫毛数量愈多,香气愈浓,滋味愈醇厚柔和,汤色愈红的发酵普洱茶级别愈高。

图1 发酵普洱茶的发酵工艺
Fig.1 Fermentation process of fermented Pu-erh tea
表1 发酵普洱茶样本的详细信息
Table 1 Information of fermented Pu-erh tea samples
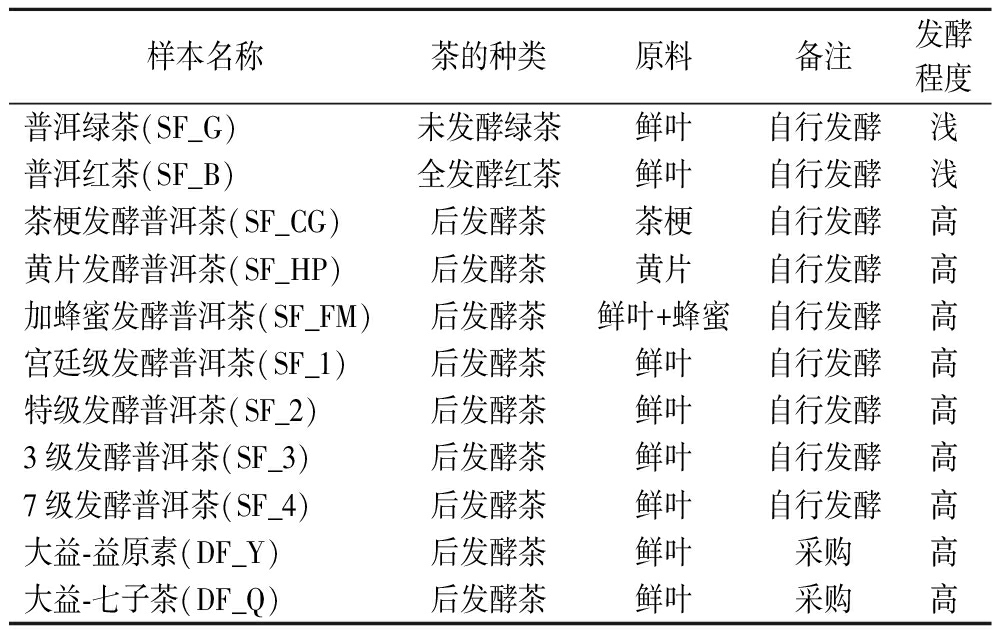
样本名称茶的种类原料备注发酵程度普洱绿茶(SF_G)未发酵绿茶鲜叶自行发酵浅普洱红茶(SF_B)全发酵红茶鲜叶自行发酵浅茶梗发酵普洱茶(SF_CG)后发酵茶茶梗自行发酵高黄片发酵普洱茶(SF_HP)后发酵茶黄片自行发酵高加蜂蜜发酵普洱茶(SF_FM)后发酵茶鲜叶+蜂蜜自行发酵高宫廷级发酵普洱茶(SF_1)后发酵茶鲜叶自行发酵高特级发酵普洱茶(SF_2)后发酵茶鲜叶自行发酵高3级发酵普洱茶(SF_3)后发酵茶鲜叶自行发酵高7级发酵普洱茶(SF_4)后发酵茶鲜叶自行发酵高大益-益原素(DF_Y)后发酵茶鲜叶采购高大益-七子茶(DF_Q)后发酵茶鲜叶采购高
表2 不同品级普洱茶样本的感官品质特征
Table 2 Sensory quality characteristics of different grades of Pu-erh tea samples
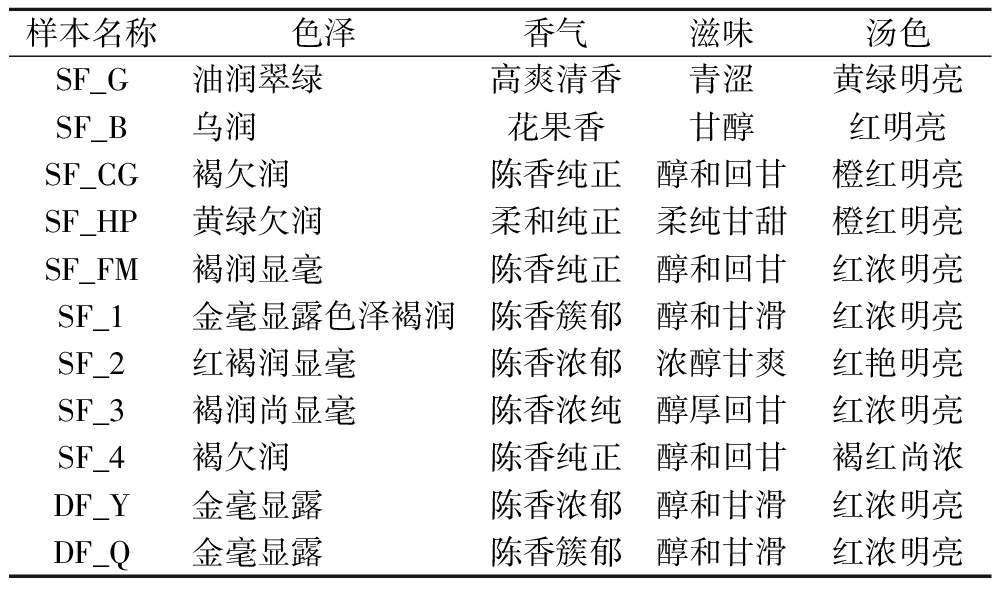
样本名称色泽香气滋味汤色SF_G油润翠绿高爽清香青涩黄绿明亮SF_B乌润花果香甘醇红明亮SF_CG褐欠润陈香纯正醇和回甘橙红明亮SF_HP黄绿欠润柔和纯正柔纯甘甜橙红明亮SF_FM褐润显毫陈香纯正醇和回甘红浓明亮SF_1金毫显露色泽褐润陈香簇郁醇和甘滑红浓明亮SF_2红褐润显毫陈香浓郁浓醇甘爽红艳明亮SF_3褐润尚显毫陈香浓纯醇厚回甘红浓明亮SF_4褐欠润陈香纯正醇和回甘褐红尚浓DF_Y金毫显露陈香浓郁醇和甘滑红浓明亮DF_Q金毫显露陈香簇郁醇和甘滑红浓明亮
表3 发酵普洱茶菌群结构的α多样性参数
Table 3 The alpha diversity parameters of FPT microbiota structure

样品名称真核多样性指数原核多样性指数Chao1指数Shannon指数Simpson指数Chao1指数Shannon指数Simpson指数SF_G98.91±4.22a2.57±0.96a0.61±0.20a151.89±59.51e2.18±0.61cd0.56±0.20cdSF_B39.43±12.69c2.34±1.41a0.60±0.37a162.22±50.90e1.81±0.18de0.43±0.08deSF_CG34.28±4.04cd1.98±0.47a0.66±0.10a162.16±14.59e1.49±0.28e0.35±0.09eSF_HP33.77±7.13cd1.44±0.64a0.48±0.24a209.12±15.19cde2.77±0.69bc0.71±0.10bcSF_FM37.24±5.79cd1.99±0.39a0.55±0.13a305.55±117.52bce3.77±0.66ab0.85±0.06abSF_141.89±1.21bc1.88±0.40a0.61±0.15a458.92±144.81ab4.69±0.71a0.91±0.03aSF_239.55±8.33c2.14±0.20a0.66±0.06a579.26±273.87a5.20±1.06a0.92±0.04aSF_325.64±2.16d1.04±0.22a0.38±0.12a205.37±5.79de3.27±0.18ab0.82±0.02abSF_441.13±4.00c2.05±0.49a0.65±0.10a252.16±78.57bcde3.73±0.41ab0.86±0.02abDF_Y54.24±7.58b1.75±0.20a0.47±0.07a444.89±19.80abc4.00±0.27ab0.85±0.03abDF_Q39.87±5.58c1.21±0.42a0.34±0.15a418.30±37.93abcd4.27±0.34a0.88±0.03a
注:表中参数值为平均值±标准差;上标有不同字母标记的即为差异显著(P<0.05)。
1.3 DNA提取、文库构建、扩增子高通量测序
通过DNA试剂盒(M5635-02)提取样本DNA,通过ITS5~ITS2引物(ITS5:5′-GGA AGT AAA AGT CGT AAC AAG G-3′;ITS2:5′-GCT GCG TTC TTC ATC GAT GCT-3′)扩增真核ITS 1区目标序列;通过338F-806R引物(338F:5′-ACT CCT ACG GGA GGC AGC A-3′;806R:5′-GGA CTA CHV GGG TWT CTA AT-3′)扩增原核16S rRNA V3~V4区目标序列。委托上海派森诺生物技术有限公司进行扩增子高通量测序。
1.4 高通量测序原始数据处理及分析
测序原始数据已上传至美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)。ITS与16S的登录号分别为SRR25302837~SRR25302847,SRR25318907~SRR25318917。使用QIIME2软件对原始数据进行质控、去噪、拼接、去嵌合体得到优质序列,进一步抽平后,100%相似度聚类得到扩增序列变体(amplicon sequence variants,ASVs)。分别通过真核的比对数据库(UNITE,Release 8.0)、原核的比对数据库(Silva,Release132)数据库注释得到ASVs列表。剔除线粒体、叶绿体等非目标ASVs后,用Origin 8.5绘制各样本菌群结构柱状图。计算α多样性指数,并通过方差分析评估α多样性指数的差异显著性。通过R语言进行主成分分析(principal component analysis,PCA),以分析各样本之间菌群结构、理化参数与主要风味成分的差异。通过正交偏最小二乘法判别分析(orthogonal partial least squares-discriminant analysis,OPLS-DA)等多元数据分析不同发酵程度普洱茶中的差异菌属。使用PICRUSt2对样本菌群的潜在代谢功能进行预测,并通过R语言绘制相对丰度前10的代谢通路的聚类热图。通过Canoco 5软件进行RDA相关性分析。
1.5 理化参数和主要风味成分检测
可溶性多糖含量:蒽酮-硫酸比色法[16]。纤维素与木质素含量:浓硫酸法[17]。黄酮含量:三氧化氯法[18-19]。游离氨基酸含量:茚三酮比色法[20]。蛋白质含量:凯氏定氮法[21]。茶多酚含量:福林酚比色法[20]。茶褐素含量:萃取比色法[22]。茶汤pH:pH计[9]。
2 结果与讨论
2.1 后发酵普洱茶品评结果
经品茶师就色泽、香气、滋味、汤色进行品鉴可知传统后发酵普洱茶(SF_1~4)与对照组(DF_Y、DF_Q)差异较小。与传统后发酵普洱茶相比,浅发酵普洱茶(SF_G、SF_B)金毫偏少,香气偏清香,滋味偏清爽,汤色偏浅;茶梗(SF_CG)、黄片(SF_HP)发酵普洱茶汤色偏浅;蜂蜜发酵普洱茶(SF_FM)香气偏淡。此外,宫廷级普洱茶(SF_1)的综合指标优于特级(SF_2)、3级(SF_3)与7级发酵普洱茶(SF_4),其金色毫毛最多,香气最浓,滋味最醇厚柔和,茶汤红色最浓郁。特级、3级和7级发酵普洱茶的金色毫毛依次减少,口感滑度依次较低,7级发酵普洱茶汤色相对最浅。
2.2 发酵普洱茶的理化参数和非挥发性风味成分
首先通过PCA对发酵普洱茶样本理化参数和非挥发性风味成分进行分析(图2)。发酵普洱茶(SF_1~4)与对照样本(DF_Y、DF_Q)聚类更接近,表明4个后发酵普洱茶样本的理化参数与主要风味成分与大益发酵普洱茶样本相似度较高。其中,宫廷级发酵普洱茶(SF_1)相似度最高,7级发酵普洱茶(SF_4)的相似度最低。其余样本按照如下顺序相似度依次降低:加蜂蜜发酵普洱茶(SF_FM)、普洱红茶(SF_B)、黄片发酵普洱茶(SF_HP)、普洱绿茶(SF_G)和茶梗发酵普洱茶(SF_CG)。
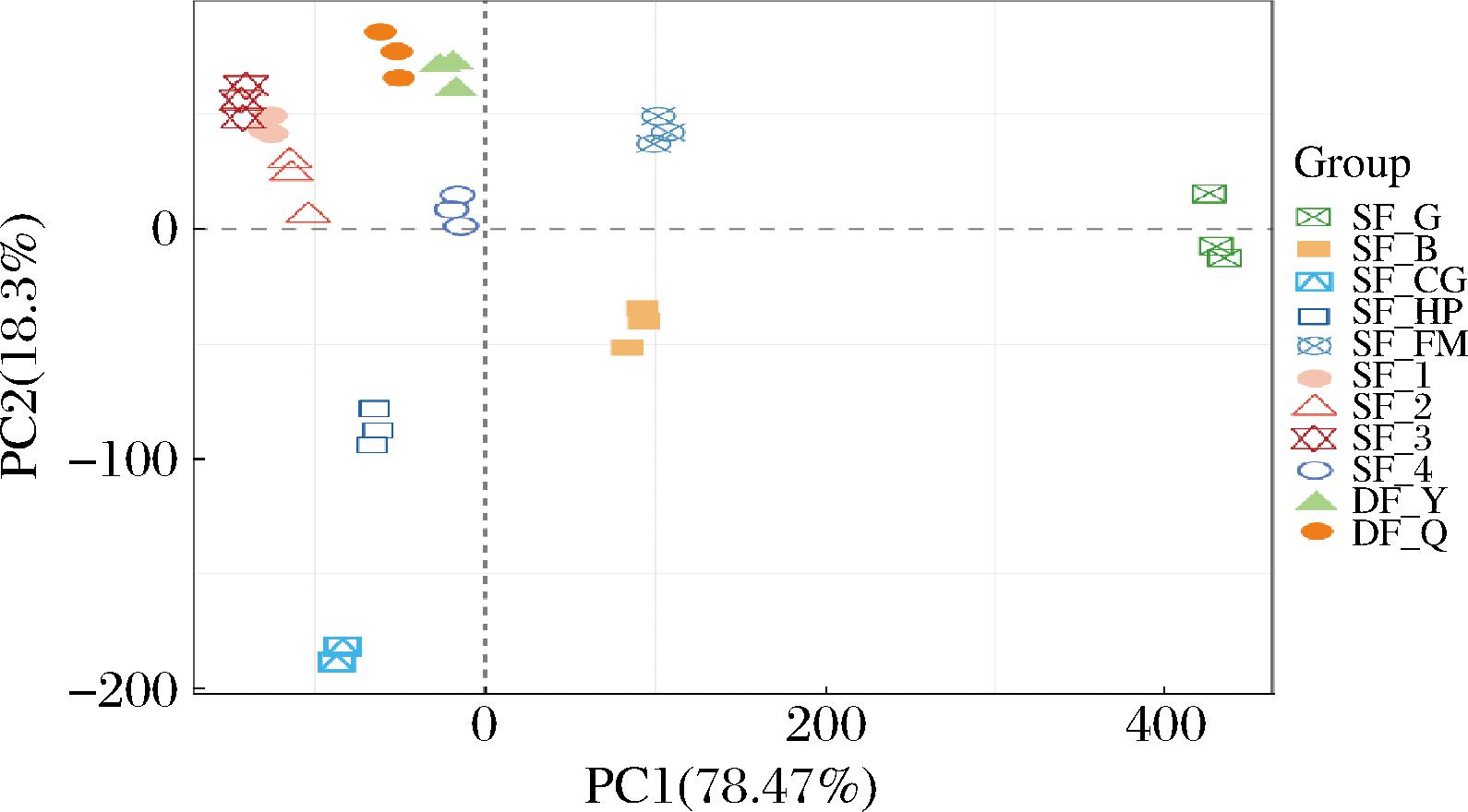
图2 发酵普洱茶理化参数与主要风味的PCA
Fig.2 PCA of physicochemical parameters and main flavors of FPT
发酵普洱茶理化参数与风味成分含量值如图3所示,随发酵程度的增高,纤维素(图3-b)、游离氨基酸(图3-f)和茶多酚(图3-g)含量呈降低趋势;可溶性多糖(图3-a)、木质素(图3-c)、总黄酮(图3-d)、蛋白质(图3-e)和茶褐素(图3-h)含量呈增加趋势;pH值(图3-i)呈先降低再增加的趋势,普洱红茶(SF_B)pH值最低,为4.8。推测普洱茶样本中纤维素、游离氨基酸和茶多酚含量的降低与渥堆发酵时真核菌群的分解代谢有关[3-4,9,23-24],已知Aspergillus、Rasamsonia可降解纤维素生成可溶性多糖[5]与木质素[25-26],Aspergillus、Pseudomonas可分解茶多酚生成茶褐素[9]。其中,推测普洱茶样本中蛋白质含量的增加可能与真核、原核菌群的代谢有关,已知LI等[3]通过分析证实Blastobotrys、Thermomyces和Staphylococcus与蛋白质合成呈正相关。此外,总黄酮值的提高,推测与渥堆发酵时黄酮及黄酮醇的生物合成途径有关[11];而pH先降后增的结果,则与LI等[9]的研究结果一致,推测发酵普洱茶中pH的升高与茶碱的生成有关。推测延长普洱茶发酵时间有助于提高可溶性多糖与茶褐素并降低茶多酚含量,即有助于降低普洱茶的苦涩味,加深普洱茶汤色,与现有研究结论一致[27]。

a-可溶性多糖;b-纤维素;c-木质素;d-总黄酮;e-蛋白质;f-游离氨基酸;g-茶多酚;h-茶褐素;i-pH
图3 发酵普洱茶理化指标
Fig.3 The physicochemical indexes of FPT
此外,茶梗发酵普洱茶(SF_CG)蛋白质含量(图3-e,175.00 mg/g)相对传统发酵普洱茶(SF_1~4,340.89 mg/g)偏少,仅为其含量的51.61%。推测是茶梗中碳源(如纤维素)较鲜叶高,导致茶梗发酵普洱茶中微生物分解碳源产生的CO2量高于传统发酵普洱茶[28],又已知,高碳导致微生物细胞产生的蛋白质含量降低[29],故茶梗发酵普洱茶中的蛋白质相对于传统发酵普洱茶少。黄片发酵普洱茶(SF_HP)可溶性多糖含量(图3-a,44.91 mg/g)相对传统发酵普洱茶(SF_1~4,37.64 mg/g)偏多,是其含量的1.19倍。推测是黄片的叶质较软,更易于微生物分解利用生成糖所致。推测原料中适当添加黄片,有助于提高发酵普洱茶中可溶性多糖的含量,将来可通过向原料中添加适量黄片对普洱茶进行调味。加蜂蜜的发酵普洱茶(SF_FM)中木质素(图3-c,454.17 mg/g)相对传统发酵普洱茶(SF_1~4,643.40 mg/g)偏少,仅为其含量的70.59%;而游离氨基酸(图3-f,9.74 mg/g)、茶多酚(图3-g,148.12 mg/g)和茶褐素(图3-h,102.98 mg/g)相对偏多,分别是传统发酵普洱茶(SF_1~4;6.44、68.98和85.63 mg/g)的1.51、2.15、1.20倍。推测是蜂蜜中葡萄糖和果糖的含量较多,微生物优先利用结构较简单的葡萄糖和果糖所致。
2.3 发酵普洱茶菌群结构的α多样性参数
11种发酵普洱茶样本彼此之间真核菌群丰度Shannon值(1.04~2.57)与多样性Simpson值(0.34~0.66)均无显著差异(P>0.05);其中,普洱绿茶(SF_G)的真核物种丰度值Chao1指数(98.91)显著较高(P<0.05)。随发酵程度的增高,原核物种丰度值Chao1指数、原核菌群丰度Shannon值与多样性Simpson值呈增高趋势。其中,茶梗发酵普洱茶(SF_CG)的原核物种丰度值Chao1指数(162.16)、菌群丰度Shannon值(1.49)与多样性Simpson值(0.35)偏低,推测是茶梗难分解,不利于微生物的生长导致。XUE等[5]与LI等[3]研究表明普洱熟茶真核菌群的多样性低于晒青毛茶(等同本研究普洱绿茶),普洱熟茶原核菌群丰度和多样性高于晒青毛茶(等同本研究普洱绿茶),与本文研究结论一致。
2.4 发酵普洱茶菌群结构差异
各样本扩增子高通量测序覆盖率(Coverage)均高于99.69%,表明测序序列具备代表性。数据分析得到50 058个真核ASVs、29 427个原核ASVs,其中,真核ASVs 98.58%注释到属,原核ASVs 97.55%注释到属。本研究把相对丰度>1%的菌属定义为优势菌属,分析真核与原核菌群结构差异。
首先通过主成分分析发酵普洱茶菌群结构的差异(图4)。图4-a中,传统后发酵普洱茶(SF_1~4)与对照样本(DF_Y、DF_Q)聚类一起,表明两者真核菌群结构相似;浅发酵普洱茶中普洱红茶(SF_B)的真核菌群结构与后发酵普洱茶(SF_1~4)相似度较高;茶梗(SF_CG)、黄片(SF_HP)、加蜂蜜(SF_FM)发酵普洱茶与传统发酵普洱茶(SF_1~4)的真核菌群结构的相似度逐次降低。进一步通过OPLS-DA等多元数据分析发现,Gibberella、Penicillium、Mycosphaerella、Cyberlindnera、Fusarium、Plectosphaerella、Thermomyces、Rasamsonia、Blastobotrys对不同发酵程度普洱茶的真核菌群结构差异影响较大(VIP>1)。图4-b中,传统后发酵普洱茶(SF_1~4)与对照样本(DF_Y、DF_Q)聚类一起,表明两者原核菌群结构相似;浅发酵普洱茶(SF_G、SF_B)的原核菌群结构与后发酵普洱茶(SF_1~4)差异较大;蜂蜜(SF_FM)、黄片(SF_HP)、茶梗(SF_CG)发酵普洱茶与传统发酵普洱茶(SF_1~4)的原核菌群结构的相似度逐次降低。进一步通过OPLS-DA等多元数据分析发现,Bosea、Methylobacterium、Allorhizobium-Neorhizobium-Pararhizobium-Rhizobium、Amycolatopsis、Sphingomonas、Chryseobacterium、Acidovorax等对不同发酵程度普洱茶的原核菌群结构差异影响较大(VIP>1)。

a-真核菌群结构的PCA;b-原核菌群结构的PCA;c-优势真核菌属相对丰度;d-优势原核菌属相对丰度;e-共有优势真核菌属相对丰度;f-共有优势原核菌属相对丰度
图4 发酵普洱茶菌群结构差异分析
Fig.4 Differences in microbiota structure analysis of FPT
注:Others包括非优势菌、未分类及未定义菌;SF_A为SF_1~4合并后。
发酵普洱茶样本菌群结构组成差异如图4-c~4-f所示。传统后发酵普洱茶(SF_1~4)与对照样本(DF_Y、DF_Q)以真核菌属Blastobotrys(22.87%~78.87%)、Thermomyces(3.30%~33.45%)、Aspergillus(5.17%~31.76%)与Rasamsonia(2.86%~14.44%)共同占优势(图4-c),进一步表明两者真核菌群结构相似。传统浅发酵程度的普洱绿茶(SF_G)、普洱红茶中(SF_B)Penicillium(49.22%)与Mycosphaerella(32.59%)分别占优势。与普洱绿茶(SF_G)相比,后发酵普洱茶(SF_1~4)中Penicillium相对丰度降低(49.22%→0.005 8%),推测与其不适于渥堆发酵的高温环境(50 ℃)有关[30-31]。
此外,不同发酵原料普洱茶中(图4-c),茶梗发酵(SF_CG)提高了Rhizomucor的相对丰度(0.86%→17.55%);黄片发酵(SF_HP)综合提高了Aspergillus(14.60%→31.90%)、Thermomyces(29.40%→41.91%)与Rhizomucor(0.86%→20.09%)的相对丰度;加蜂蜜发酵(SF_FM)提高了Aspergillus(14.60%→87.47%)的相对丰度。黄片发酵普洱茶中Aspergillus、Thermomyces与Rhizomucor相对丰度提高,推测黄片中的碳源更利于Aspergillus和嗜热菌(Thermomyces、Rhizomucor)的生长[32-33]。
传统后发酵普洱茶(SF_1~4)、添加蜂蜜发酵普洱茶(SF_FM)与对照样本(DF_Y、DF_Q)以原核菌属Staphylococcus(20.90%~59.64%)、Kocuria(13.57%~28.63%)与Brevibacterium(4.71%~29.56%)共同占优势(图4-d),进一步表明其原核菌群结构相似。传统浅发酵程度的普洱绿茶(SF_G)、普洱红茶(SF_B)中Pseudomonas(43.26%、73.02%)占优势。
此外,不同发酵原料普洱茶中(图4-d),茶梗发酵(SF_CG)显著提高了Pseudomonas的相对丰度(2.81%→86.78%),与普洱红茶(SF_B)菌群组成较接近,推测可能与茶梗较难分解,原核菌群发酵程度较低有关。黄片发酵(SF_HP)显著提高了Pseudomonas(2.81%→40.46%)和Bacillus(8.35%→21.44%)的相对丰度。添加蜂蜜后其中的葡萄糖、果糖等额外碳源对于原核菌群生长基本无影响。
进一步分析发酵普洱茶菌群中的共有优势真核和原核菌属组成,如图4-e和图4-f所示。为便于分析,将一起发酵的4种后发酵普洱茶样本(SF_1~4)合并为SF_A,用于后续分析。后发酵普洱茶(SF_A)86.17~99.64%的优势真核菌属与普洱绿茶(SF_G,41.47%)和普洱红茶(SF_B,37.14%)的优势真核菌属为共有菌属(图4-e),推测后发酵普洱茶渥堆发酵优势真核菌属主要来自于发酵初期。此外,Penicillium与Mycosphaerella(图4-c)共同存在于浅发酵程度普洱茶(SF_G、SF_B)中,与普洱红茶(2.06%)相比,普洱绿茶(49.22%)相对特异性大量存在真核Penicillium;与普洱绿茶(0.14%)相比,普洱红茶中相对特异性大量存在Mycosphaerella(32.59%)。11种普洱茶中81.14%~98.89%的优势原核菌属为共有原核菌属(图4-f),表明普洱茶发酵菌群中的原核菌属同源,发酵过程使其原核菌群丰度发生变化,进而使其原核菌群结构发生变化。
进一步分析合并后8种发酵普洱茶菌群的特异性ASVs在属水平上(差异特征菌属)的丰度发现(图5),其普洱茶样本的差异特征真核菌属的相对丰度为0%~3.812 3%(图5-a);其中,普洱绿茶(SF_G)中的差异特征真菌属相对最多(3.812 3%,图5-a),茶梗发酵普洱茶(SF_CG)无差异特征真核菌属(数字为0,图5-a中无展示)。8种发酵普洱茶样本的差异特征原核菌属的相对丰度为0.023 8%~0.138 3%(图5-b)。以上结果表明发酵普洱茶样本的真核菌群差异性大于原核菌群。
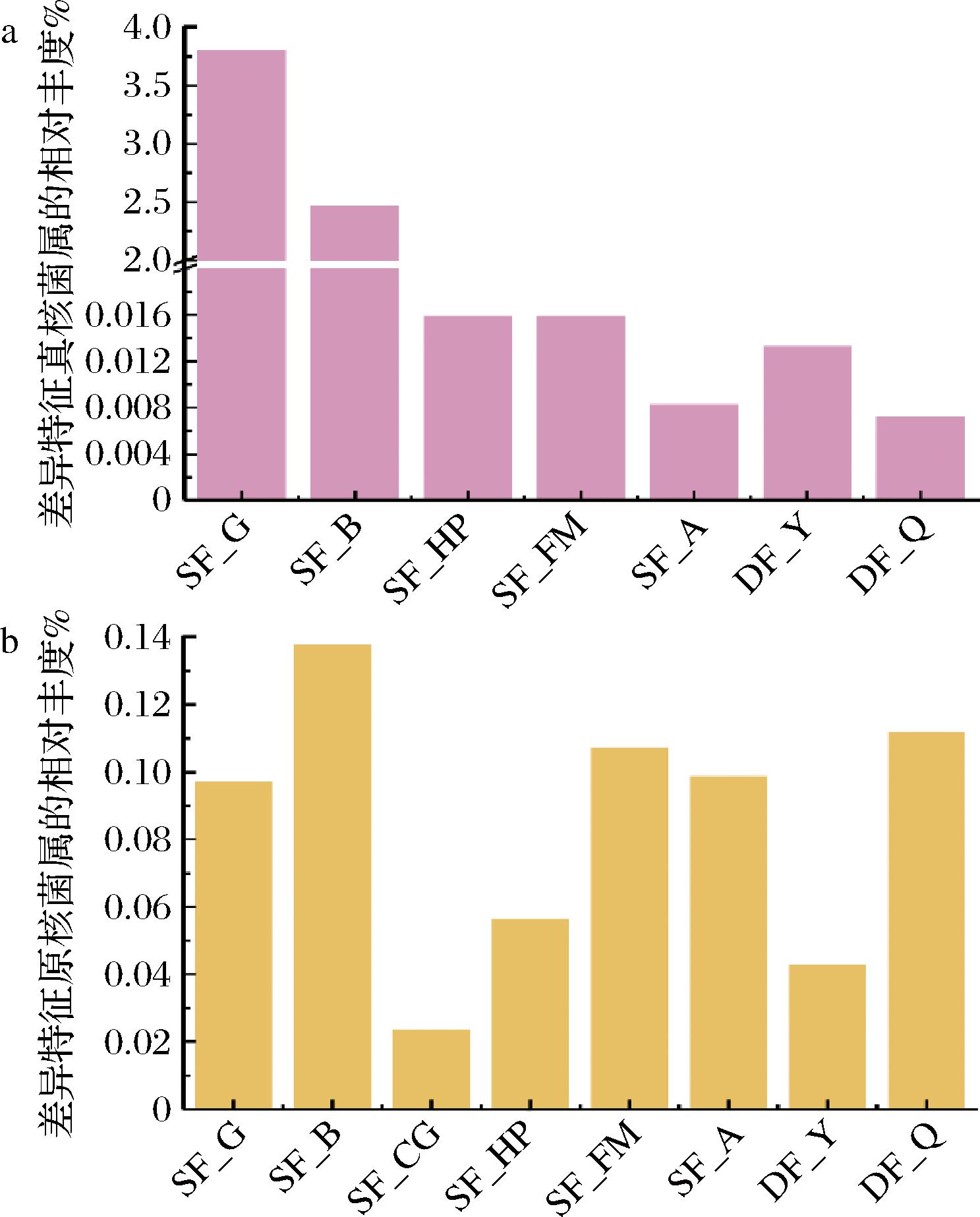
a-真核菌属;b-原核菌属
图5 发酵普洱茶差异特征真核与原核菌属的相对丰度
Fig.5 Relative abundance of exclusive eukaryotic genera and exclusive prokaryotic genera of FPT
注:1-SF_G;2-SF_B;3-SF_CG;4-SF_HP;5-SF_FM;6-SF_A;7-DF_Y;8-DF_Q;因茶梗发酵普洱茶无差异特征真核菌属,故a中无“SF_CG”。
2.5 发酵普洱茶差异特征菌属潜在代谢功能预测
进一步通过PICRUSt2分别对各样本的差异特征真核、原核菌属的ITS序列、16S rRNA序列进行潜在功能预测,以分析各普洱茶样本差异特征菌群的潜在代谢功能差异(茶梗普洱茶无差异特征真核菌属,故图6-a中无“SF_CG”)。本研究后发酵普洱茶(SF_A)、加蜂蜜发酵普洱茶(SF_FM)的差异特征菌群的潜在代谢功能接近(图6),而与对照组(DF_Y、DF_Q)有差异(图6-a),推测可能与发酵环境不同有关。浅发酵程度的普洱绿茶(SF_G)、红茶(SF_B)菌群的潜在代谢功能更接近,其与后发酵普洱茶菌群的潜在代谢功能差异较大。以上分析表明,与发酵原料相比,发酵程度对差异特征菌属的潜在代谢功能的影响更大,差异特征菌属代谢功能呈现一定的冗余性[34]。

a-真核菌属;b-原核菌属
图6 差异特征真核菌属与原核菌属功能预测聚类热图
Fig.6 Heatmap of functional prediction clusters for exclusive eukaryotic genera and exclusive prokaryotic genera
2.6 发酵普洱茶菌属与理化参数及主要风味成分间的RDA相关性
通过RDA发现,与真核菌群的相关性具有显著贡献的参数如图7-a所示:游离氨基酸(34.40%)、木质素(22.40%)、纤维素(14.10%)和茶褐素(13.30%),表明真核菌群对普洱茶发酵过程中游离氨基酸、木质素、纤维素和茶褐素的代谢贡献较大。此外,总黄酮、蛋白质、茶褐素的值与SF_1(宫廷级发酵普洱茶)、SF_3(3级发酵普洱茶)、DF_Y(大益-益原素)、DF_Q(大益-七子茶)的真核菌属Blastobotrys与Rasamsonia呈强正相关,pH、可溶性多糖的值与SF_CG(茶梗发酵普洱茶)、SF_2(特级发酵普洱茶)、SF_4(7级发酵普洱茶)的真核菌属Thermomyces、Rhizomucor呈强正相关。与原核菌群的相关性具有显著贡献的参数如图7-b所示:蛋白质(65.10%)、可溶性多糖(16.00%),表明原核菌群对普洱茶发酵过程中蛋白质、可溶性多糖的代谢贡献较大。此外,总黄酮的值与SF_1(宫廷级发酵普洱茶)、SF_2(特级发酵普洱茶)、DF_Y(大益-益原素)、DF_Q(大益-七子茶)的原核菌属Brachybacterium、Bacillus呈强正相关,木质素的值与SF_4(7级发酵普洱茶)的原核菌属Staphylococcus呈强正相关。
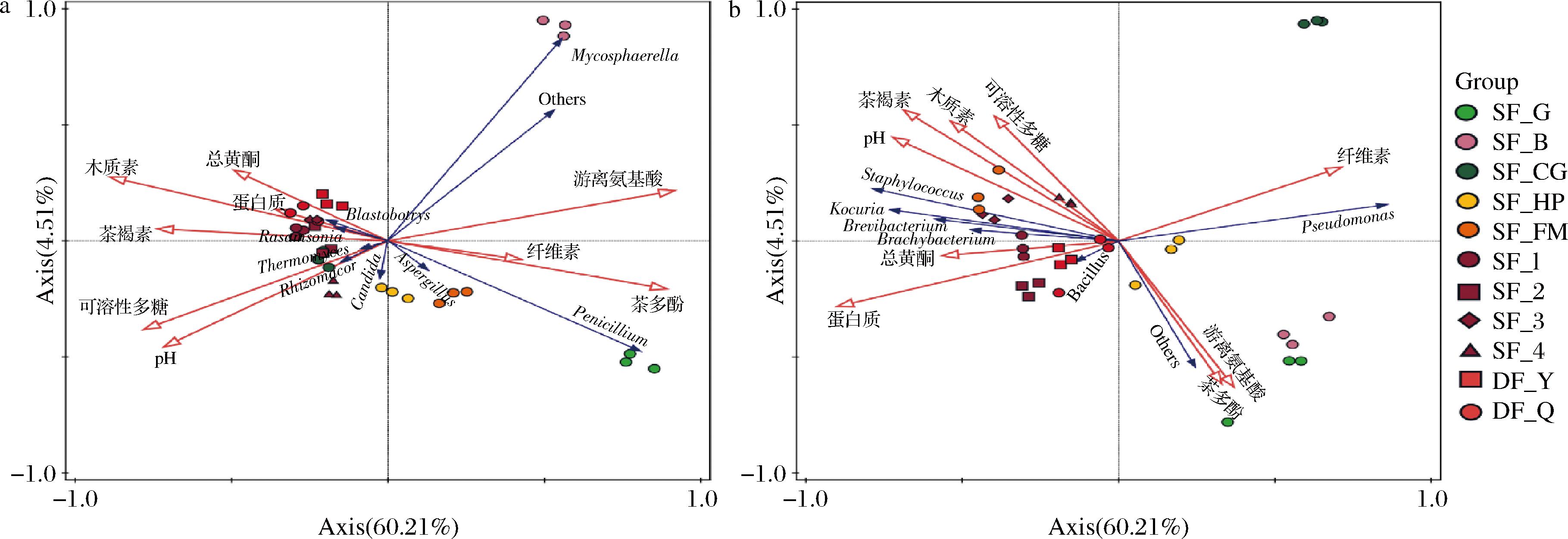
a-优势真核菌属与生化指标的RDA;b-优势原核菌属与生化指标的RDA
图7 发酵普洱茶优势真核菌属、优势原核菌属与生化指标的RDA
Fig.7 RDA of eukaryotic microbiota structure and prokaryotic microbiota structure with biochemical indicators of FPT
3 结论与展望
为探究发酵程度、原料对普洱茶菌群结构、理化参数与品质的影响,本研究通过理化检测方法及16S rRNA、ITS扩增子测序技术对不同发酵普洱茶进行了研究。发酵普洱茶的优势真核菌属主要来自于发酵初期,其真核菌群差异性大于原核菌群。随发酵程度的提高,发酵普洱茶的优势真核菌属由Penicillium(普洱绿茶)、Mycosphaerella(普洱红茶)转变为Blastobotrys、Thermomyces、Aspergillus和Rasamsonia;优势原核菌属由Pseudomonas(普洱绿茶、红茶)转变为Staphylococcus和Kocuria。发酵降低真核菌群丰度同时显著提高普洱茶原核菌群丰度和多样性以及影响品质的可溶性多糖、木质素、总黄酮、蛋白质、茶褐素的含量。茶梗发酵可提高菌群中Rhizomucor、Pseudomonas的相对丰度,降低蛋白质的含量。蜂蜜发酵可提高菌群中Aspergillus的相对丰度与茶褐素的含量。黄片发酵可提高菌群中Aspergillus、Thermomyces、Rhizomucor、Pseudomonas与Bacillus的相对丰度与可溶性多糖的含量。最后本研究发现,发酵程度和发酵原料对菌群结构的影响较大,而对代谢功能的影响较小。其中,发酵程度对发酵普洱茶菌群与差异特征菌属的潜在代谢功能的影响大于发酵原料。此外,游离氨基酸、木质素、纤维素和茶褐素与真核菌群显著相关,蛋白质、可溶性多糖与原核菌群显著相关。综上,发酵程度、原料对发酵普洱茶菌群结构、理化参数与品质的影响较大。本研究为将来通过改变发酵原料增加目标风味成分的含量或富集目标发酵菌种以改善普洱茶的品质与工艺提供理论参考。基于发酵程度与原料对普洱茶菌群结构与品质的影响,此后有必要深入分析其发酵过程中菌群结构与风味成分的演变规律。
[1] 王桥美, 彭文书, 杨瑞娟, 等.普洱茶发酵过程中可培养微生物的群落结构分析[J].食品与发酵工业, 2020, 46(20):88-93.
WANG Q M, PENG W S, YANG R J, et al.Community structure of culturable microbes during the fermentation of Pu-erh tea[J].Food and Fermentation Industries, 2020, 46(20):88-93.
[2] ZHU J Y, CHEN L, CHEN Y, et al.Effect of geographical origins and pile-fermentation on the multi-element profiles of ripen Pu-erh tea revealed by comprehensive elemental fingerprinting[J].Food Control, 2023, 154:109978.
[3] LI J, WU J, XU N F, et al.Dynamic evolution and correlation between microorganisms and metabolites during manufacturing process and storage of Pu-erh tea[J].LWT, 2022, 158:113128.
[4] XU J, WEI Y, LI F L, et al.Regulation of fungal community and the quality formation and safety control of Pu-erh tea[J].Comprehensive Reviews in Food Science and Food Safety, 2022, 21(6):4546-4572.
[5] XUE J, YANG L, YANG Y, et al.Contrasting microbiomes of raw and ripened Pu-erh tea associated with distinct chemical chemical profiles[J]. LWT, 2020, 124:109147.
[6] YILMAZ C, FERAMUZ Ö, GÖKMEN V.Investigation of free amino acids, bioactive and neuroactive compounds in different types of tea and effect of black tea processing[J].LWT, 2020, 117:108655.
[7] LIN F J, WEI X L, LIU H Y, et al.State-of-the-art review of dark tea:From chemistry to health benefits[J].Trends in Food Science &Technology, 2021, 109:126-138.
[8] HU S, HE C, LI Y C, et al.The formation of aroma quality of dark tea during pile-fermentation based on multi-omics[J].LWT, 2021, 147:111491.
[9] LI Z Y, FENG C X, LUO X G, et al.Revealing the influence of microbiota on the quality of Pu-erh tea during fermentation process by shotgun metagenomic and metabolomic analysis[J].Food Microbiology, 2018, 76:405-415.
[10] ZHAO M, SU X Q, NIAN B, et al.Integrated meta-omics approaches to understand the microbiome of spontaneous fermentation of traditional Chinese Pu-erh tea[J].mSystems, 2019, 4(6):e00680-19.
[11] LI T H, WEI Y M, FENG W Z, et al.Exploring the mysterious effect of piling fermentation on Pu-erh tea quality formation:Microbial action and moist-heat action[J].LWT, 2023, 185:115132.
[12] CHEN S S, FU Y, BIAN X Q, et al.Investigation and dynamic profiling of oligopeptides, free amino acids and derivatives during Pu-erh tea fermentation by ultra-high performance liquid chromatography tandem mass spectrometry[J].Food Chemistry, 2022, 371:131176.
[13] XU Y, LIANG P L, CHEN X L, et al.The impact of citrus-tea cofermentation process on chemical composition and contents of Pu-erh tea:An integrated metabolomics study[J].Frontiers in Nutrition, 2021, 8:737539.
[14] WU J X, WU X R, YUAN G A, et al.Comparative analysis of aroma substances of vanilla co-fermented black tea[J].IOP Conference Series:Earth and Environmental Science, 2021, 651(4):042047.
[15] NI H, HAO S, ZHENG F P, et al.Effects of two enzyme extracts of Aspergillus niger on green tea aromas[J].Food Science and Biotechnology, 2017, 26(3):611-622.
[16] GAO Y, XU Y Q, YIN J F.Black tea benefits short-chain fatty acid producers but inhibits genus Lactobacillus in the gut of healthy Sprague-Dawley rats[J].Journal of the Science of Food and Agriculture, 2020, 100(15):5466-5475.
[17] CHEN Y, LI P, HE W W, et al.Analysis of microbial community and the characterization of Aspergillus flavus in Liuyang Douchi during fermentation[J].LWT, 2022, 154:112567.
[18] LIU Z B, WANG Z Y, SUN J Y, et al.The dynamics of volatile compounds and their correlation with the microbial succession during the traditional solid-state fermentation of Gutian Hong Qu glutinous rice wine[J].Food Microbiology, 2020, 86:103347.
[19] MA C Q, ZHOU B X, WANG J C, et al.Investigation and dynamic changes of phenolic compounds during a new-type fermentation for ripened Pu-erh tea processing[J].LWT, 2023, 180:114683.
[20] LI J, WU S M, YU Q Y, et al.Chemical profile of a novel ripened Pu-erh tea and its metabolic conversion during pile fermentation[J].Food Chemistry, 2022, 378:132126.
[21] ZHAO F, QIAN J, LIU H, et al.Quantification, identification and comparison of oligopeptides on five tea categories with different fermentation degree by Kjeldahl method and ultra-high performance liquid chromatography coupled with quadrupole-orbitrap ultra-high resolution mass spectrometry[J].Food Chemistry, 2022, 378:132130.
[22] WANG Q P, PENG C X, GONG J S.Effects of enzymatic action on the formation of theabrownin during solid state fermentation of Pu-erh tea[J].Journal of the Science of Food and Agriculture, 2011, 91(13):2412-2418.
[23] CHEN Y Y, ZENG L T, LIAO Y Y, et al.Enzymatic reaction-related protein degradation and proteinaceous amino acid metabolism during the black tea (Camellia sinensis) manufacturing process[J].Foods, 2020, 9(1):66.
[24] 刘琨毅, 王利妍, 安江珊, 等.接种地衣芽孢杆菌发酵的普洱茶品质与微生物群落分析[J].食品科学技术学报,2022, 40(2):108-118.
LIU K Y, WANG L Y, AN J S, et al.Analysis of quality and microbial communities of Pu-erh tea through inocu-lation fermentation with Bacillus licheniformis[J].Journal of Food Science and Technology, 2022, 40(2):108-118.
[25] ZHU D C, QARIA M A, ZHU B, et al.Extremophiles and extremozymes in lignin bioprocessing[J].Renewable and Sustainable Energy Reviews, 2022, 157:112069.
[26] RAZA S, WDOWIAK M, GROTEK M, et al.Enhancing the antimicrobial activity of silver nanoparticles against ESKAPE bacteria and emerging fungal pathogens by using tea extracts[J].Nanoscale Advances, 2023, 5(21):5786-5798.
[27] WANG T, LI R Y, LIU K Y, et al.Changes in sensory characteristics, chemical composition and microbial succession during fermentation of ancient plants Pu-erh tea[J].Food Chemistry:X, 2023, 20:101003.
[28] GEISEN S, HU S R, DELA CRUZ T E E, et al.Protists as catalyzers of microbial litter breakdown and carbon cycling at different temperature regimes[J].The ISME Journal, 2021, 15(2):618-621.
[29] WANG W, LU W Y, PAPADAKIS V G, et al.Microbial protein production under mixotrophic mode:Ammonium assimilation pathway and C/N ratio optimization[J].Journal of Environmental Chemical Engineering, 2024, 12(1):111727.
[30] CAO C W, LI R Y, WAN Z, et al.The effects of temperature, pH, and salinity on the growth and dimorphism of Penicillium marneffei[J].Medical Mycology, 2007, 45(5):401-407.
[31] ZHU Y C, LUO Y H, WANG P P, et al.Simultaneous determination of free amino acids in Pu-erh tea and their changes during fermentation[J].Food Chemistry, 2016, 194:643-649.
[32] TU T, WANG Y, HUANG H Q, et al.Improving the thermostability and catalytic efficiency of glucose oxidase from Aspergillus niger by molecular evolution[J].Food Chemistry, 2019, 281:163-170.
[33] WANG Y, YAN H, NENG J, et al.The influence of NaCl and glucose content on growth and ochratoxin a production by Aspergillus ochraceus, Aspergillus carbonarius and Penicillium nordicum[J].Toxins, 2020, 12(8):515.
[34] WANG T, WEISS A, AQEEL A, et al.Horizontal gene transfer enables programmable gene stability in synthetic microbiota[J].Nature Chemical Biology, 2022, 18(11):1245-1252.