颜色作为红葡萄酒重要的感官指标之一,也是影响消费者评判葡萄酒质量的关键视觉因素[1-2]。但是,红葡萄酒中主要呈色物质花色苷对外界环境十分敏感,易受媒介pH、温度等因素的影响,使其色泽易发生改变甚至失色,进而影响葡萄酒的质量[3]。关于如何加深红葡萄酒颜色以及提高颜色稳定性的研究持续增加,其中利用辅色作用增强花色苷的色泽强度已成为该领域关注的焦点。
辅色反应通过花色苷与辅色素间的相互作用形成一种“三明治”结构复合体,在芳香环之间的π-π堆积、氢键和范德华相互作用的驱动下,形成涉及花青素和共色素化合物的非共价络合物,引起颜料颜色性质的变化[4]。可阻断水分子对花青素的亲核攻击,从而防止它们形成查尔酮结构和降解[5],进而达到增强葡萄酒色泽、提高颜色稳定性的效果。特别是在新鲜红葡萄酒中辅色作用可以贡献30%~50%颜色总量,而在陈酿葡萄酒中也有8%~30%的颜色贡献[5]。研究认为辅色作用还可能是形成聚合色素的第一步[6],对陈酿红葡萄酒的颜色稳定起着重要的作用。许多物质都可以作为辅色素因子参与相应的化学反应,例如有机酸、氨基酸、核苷酸、金属离子、多酚化合物等。其中,只有少数研究了氨基酸与花色苷之间的相互作用。ASEN等[7]报道了模拟条件下丙氨酸、精氨酸等对矢车菊素-3,5-二葡萄糖苷的辅色作用,发现在pH 2~5的条件下最大吸收波长增大且具有红移作用,在pH 3~5时辅色作用最明显。TÜRKYILMAZ等[8]研究了脯氨酸、缬氨酸与天冬氨酸对橙汁与石榴汁中矢车菊-3-葡萄糖苷颜色稳定性的影响,发现添加这3种氨基酸可提高总花花色苷含量高达4.7倍,由于氨基酸与花色苷的疏水相互作用和氢键导致的辅色反应使得Amax的增大和花青素的稳定性提高,因此在含高浓度花青素的产品中这3种氨基酸具有很高的辅色潜力。CHUNG等[9]研究了L-苯丙氨酸、L-酪氨酸、L-色氨酸和多肽在40 ℃贮藏模型饮料中延长紫色胡萝卜花青素颜色的稳定性,其中L-色氨酸最为明显,添加L-色氨酸后,花青素颜色的平均半衰期从2 d增加到6 d。表明添加氨基酸或肽可能会延长花青素的颜色稳定性。
综上所述,氨基酸是否在葡萄中同样具有辅色作用还未有研究报道,因此,假设L-苯丙氨酸、L-酪氨酸、L-色氨酸在模拟酒环境下可锦葵素-3-O-葡萄糖苷(malvidin-3-O-glucoside, M3OG)存在辅色反应,为了验证这一假设并了解辅色的可能机制,本研究借助傅里叶红外光谱(Fourier transform infrared, FT-IR)、分子对接和分子动力学模拟等方法探索所选氨基酸与M3OG之间的氢键和范德华力等相互作用力。因未深入研究芳香族氨基酸对葡萄酒中花色苷稳定性的影响,花色苷的具体辅色作用机制仍然存在许多未知之处。本研究不仅可以发现氨基酸的辅色效果,而且可以阐明葡萄酒中M3OG与所选氨基酸之间的分子相互作用。可能对芳香族氨基酸对花色苷的辅色作用的深入研究产生重要的理论和应用意义。希望未来有更多的研究能够揭示芳香族氨基酸对花色苷辅色作用的具体机制,为提高葡萄酒颜色稳定性提供更多的理论支持和技术指导。
1 材料与方法
1.1 材料与试剂
锦葵素-3-O-葡萄糖苷(M3OG)、L-苯丙氨酸、L-色氨酸、L-酪氨酸(HPLC≥95%)标准品,上海泰坦科技有限公司;酒石酸、柠檬酸、无水乙醇,银川昕泰昌盛生物有限公司。
1.2 仪器与设备
UV-2450紫外分光光度计,日本岛津公司;PHS-3C型 pH计,上海雷磁公司;Nicolet iS50傅里叶红外光谱仪,赛默飞世尔科技公司。
1.3 试验方法
1.3.1 模型葡萄酒溶液的配置
参考张波[10]葡萄酒模型溶液中含有5 g/L酒石酸和体积分数12%乙醇,通过加入NaCl使离子强度调整到0.2 mol/L。以0.20 mmol/L的浓度将花色苷溶于该模型葡萄酒溶液中,用3种不同氨基酸溶液以体积比1∶1稀释。得到1∶0、1∶1、1∶10、1∶20、1∶40、1∶80、1∶100物质的量比的M3OG/氨基酸混合溶液(其中酪氨酸因溶解度较低最高物质的量比为1∶20),完全溶解后立即用少量强酸或强碱溶液将(L-苯丙氨酸/M3OG、L-色氨酸/M3OG和L-酪氨酸/M3OG)溶液调节至pH=3.6。所有溶液一式三份制备,并在黑暗中保存30 min以达到平衡。
1.3.2 辅色效果比色测量
以蒸馏水作为对照,用2 mm玻璃比色皿,紫外可见光条件下对各试验溶液以恒定间隔(Δλ=1 nm)进行全波长扫描(400~700 nm)。根据BOULTON[5]提出的方法确定辅色作用的大小,在λ520nm下吸收值的增加表示增色效应(ΔAmax-520),红移效应为各样品的最大吸收波长(Δλmax-520)。
1.3.3 热力学参数测定
氨基酸/M3OG系统热力学数据通过文献[11]的方法计算,反应平衡常数K、吉布斯自由能ΔG°由公式(1)、公式(2)测定。
(1)
ΔG°=-RTlnK
(2)
式中:A,不添加任何辅色剂的桑椹花色苷溶液在520 nm处的吸光值;A0,添加不同浓度的氨基酸混合溶液在室温下暗反应30 min后520 nm处的吸光值;[Cp]0,辅色剂的浓度;lnK,拟合方程的截距,用于计算两个热力学参数平衡常数(K)和吉布斯自由能变化(ΔG°);共色素沉着反应的K值表示为[AH(Cp)n+]/([AH+][Cp]n);n,辅色剂与花色苷的化学计量比。
1.3.4 颜色参数测定
参考李伟等[12]的方法。
1.3.5 FT-IR分析
花色苷-氨基酸复合物样品制备[13]:根据辅色效果以及热力学参数的结果选择辅色效果最好的一种氨基酸,用柠檬酸缓冲液(pH 3.6)制备氨基酸溶液和M3OG溶液。将M3OG溶液与氨基酸溶液等体积混合得到物质的量比为1∶40的混合液并搅拌30 min。将制备好的“M3OG-氨基酸”溶液冷冻干燥,研磨成粉末密封干燥保存。
对复合物冻干粉进行FT-IR分析,取样品1 mg,与200 mg色谱级KBr粉混合,充分研磨后压制成透明片状。使用红外光谱仪在4 000~1 000 cm-1范围内获得FT-IR,分辨率2 cm-1。
1.3.6 分子对接
参考LI等[14]的方法,并稍作修改。在对接过程中,从PubChem分子库中获得的M3OG(PubChem CID:11249520)分子的结构作为受体,L-色氨酸(PubChem CID:6305)、L-酪氨酸(PubChem CID:6057)和L-苯丙氨酸(PubChem CID:6140)分子结构作为配体。AutoDockTools 1.5.6软件用来处理M3OG和氨基酸分子,合并非极性氢原子。AutoDockVina软件用于柔性对接M3OG和氨基酸分子,以获得最佳的结合构象。PyMOL 4.3.0软件用于绘制2个小分子结合的构象。根据操作结果中结合能最低、结合数最大的原则,得到最佳对接结果,并用于分子动力学计算和分析[15]。
1.3.7 分子动力学计算
本研究使用GROMACS 2020版软件对分子对接所得的M3OG-氨基酸复合物体系进行分子动力学模拟[16-17],力场采用AMBER99 sb-ildn[18]。以分子对接中得到的最佳构像作为分子动力学的初始几何。使用Gaussian 16 W对小分子进行加氢和计算RESP电势操作,电势数据会添加到分子动力学体系拓扑文件中,原子距离溶剂盒子的距离至少为1.2 nm(12 Å),并通过添加适当数量的Na+和Cl-中和模拟系统电荷。为了获得稳定的系统,采用最陡峭下降算法进行能量最小化[19]。随后,在等温等容系综中对溶质进行限制,将系统从0 K加热到300 K,然后在等温等压系综中以300 K的温度和0.1 MPa的压力进行平衡[20]。对M3OG以及M3OG-氨基酸复合物进行10 ns的动力模拟,步长为2 fs。
1.3.8 数据处理和统计分析
每组实验均平行进行3次,用Excel 2019进行数据处理;SPSS 27软件显著性分析;Origin 2024软件作图。
2 结果与分析
2.1 三种氨基酸对M3OG的辅色效果
如图1所示,在pH值为3.6时,随着M3OG/氨基酸物质的量比从1∶1到1∶100(酪氨酸最高物质的量比为1∶20)升高,反应体系的Aλ520和Amax呈不断上升趋势,在最高物质的量比时达到最大值,且λmax伴随着溶液的Amax逐渐向长波长的方向发生移动。这一现象表明添加这3种氨基酸可以促使模拟酒体系发生分子间的辅色作用。在BROUILLARD等[19]的研究结果相似,使用绿原酸与锦葵素3,5-二葡萄糖苷的相互作用,随绿原酸浓度的增大Amax值逐渐升高,即分子间辅色作用通常随摩尔比的增大而增强,说明同绿原酸辅色效果一致,本研究中3种氨基酸也能起到同样的辅色作用。相较这3种芳香族氨基酸,色氨酸的辅色效果较为明显(图1-b),例如在物质的量比为1∶40时λmax提高了17.61%,同时波长红移7 nm,相同物质的量比时苯丙氨酸λmax提高了12.86%,具有5 nm的红移变化,酪氨酸因浓度较低其效果并不明显。对比侧链基团相似的酪氨酸和苯丙氨酸,在酪氨酸最高物质的量比1∶20时,有空白组相比,添加酪氨酸与苯丙氨酸体系Amax分别增大7.62%和8.30%,其辅色效果可能与芳香环的取代基或溶解度有关。色氨酸在其他研究中也表现出卓越的辅色效果,其在紫色胡萝卜模拟汁中对花青素的辅色效果最好[9]。胡能兵[21]等对紫色辣椒叶片的辅色作用研究中也得出色氨酸的效果最佳。色氨酸相对于其他氨基酸的护色差异可能和氨酸酸侧链基团的不同有关。
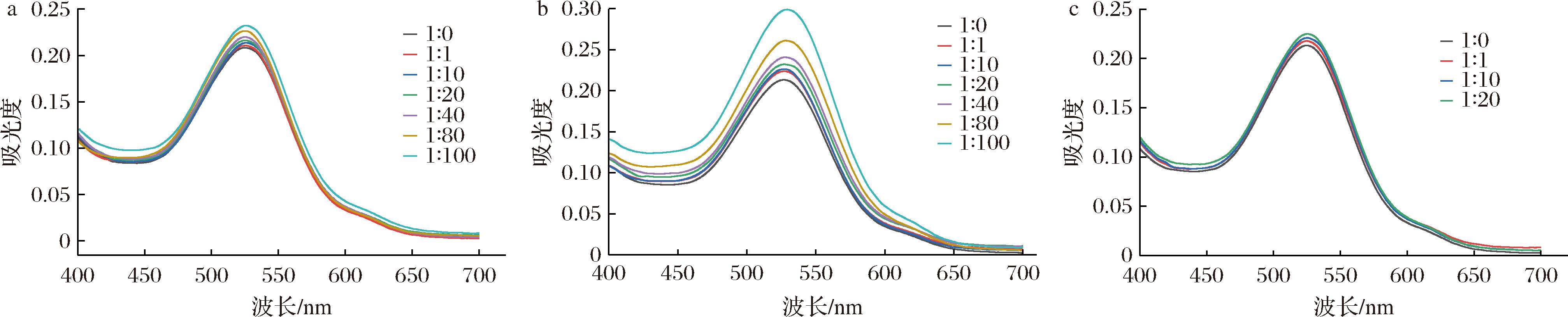
a-苯丙氨酸;b-色氨酸;c-酪氨酸
图1 不同物质的量比氨基酸/M3OG辅溶液紫外吸收光谱
Fig.1 Absorption spectra of amino acid/M3OG solutions at different molar ratios
如上所述,氨基酸浓度会影响辅色效果,同时,不同氨基酸在反应中产生不同的效果,因此,为了更好地理解实验结果,需要通过计算辅色反应过程的平衡常数(K)来量化氨基酸与M3OG之间的结合强度。取T=293 K,拟合ln[(A-A0)/A0]与ln[Cp]0的方程(R2>0.96),获得的线性方程中每条曲线的斜率和截距计算得M3OG和3种氨基酸共色素沉着反应的化学计量比(n)和ln K值。n值是能够与复合物中M3OG的黄素阳离子相连的每种共色素的分子数,它表明花青素的黄酮阳离子与所涉及的共色素之间的结合强度[23],越接近于1证明反应是1∶1配合反应[9]。比较3种氨基酸的n值。如表1苯丙氨酸和色氨酸与M3OG的n值相对较高,证明其和M3OG的结合强度较大。
表1 M3OG与3种氨基酸辅色反应的热力学参数
Table 1 Thermodynamic parameters of the co-pigmentation reaction of M3OG with three amino acids
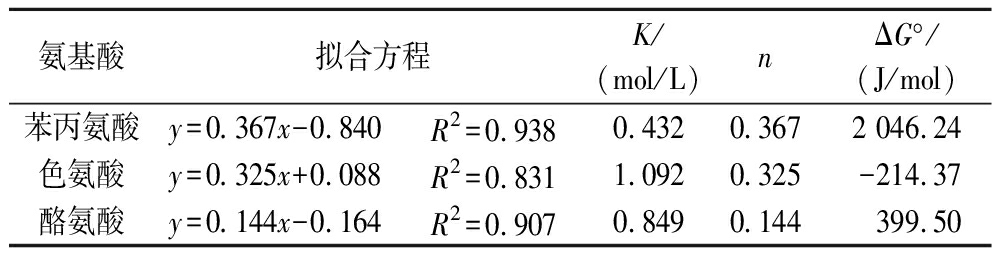
氨基酸拟合方程K/(mol/L)nΔG°/(J/mol)苯丙氨酸y=0.367x-0.840R2=0.9380.4320.3672 046.24色氨酸y=0.325x+0.088R2=0.8311.0920.325-214.37酪氨酸y=0.144x-0.164R2=0.9070.8490.144399.50
比较K值的大小,发现3种氨基酸中色氨酸的K值最大,与LI等[14]得出的结论一致,推测这可能是造成呈色差异的原因之一。研究认为,辅色效应的大小同物质结构有关,对比供试的3种氨基酸,尽管均属于芳香族氨基酸,具有芳香母核结构,但是其侧链和母核上取代基团种类和数目不同,可能对辅色性能大小有不同的影响。
ΔG°表示辅色反应所需的能量,其中只有色氨酸的ΔG°为负值,表明色氨酸参与的过程为自发的放热反应。与汤晓宏等[24]研究发现,色氨酸与花青素在25 ℃、pH=3的条件下反应后ΔG°为-14.981 kJ/mol小于0,与本实验研究的结论一致,但ΔG°的差异较大,可能是由于pH值、乙醇和花色苷浓度等不同因素而导致。其余2种氨基酸在20 ℃时不能自发反应。一般来说,ΔG°越小表示反应越快且越容易发生,ΔG°值的大小依次为苯丙氨酸<酪氨酸<色氨酸,平衡常数K值和ΔG°与氨基酸辅色效果表现出一致性,表明色氨酸在3种氨基酸中辅色作用较强。化学计量比n值为0.144~0.367,与文献中相比n值较低[9],可能是本试验反应体系中存在乙醇,是影响因素之一。
2.2 辅色反应对颜色参数的影响
由3种氨基酸酸引起的共色素现象不仅导致在λ520处吸光度增加的变化,还在可见吸收光谱中产生了λmax的变化。因此,为了评估色度特性对辅色过程的影响,考虑了CIELab空间中的色度分析。原模型酒中M3OG的浓度为![]()
![]() 和Hab=-2.85)。表现出红蓝色外观较差,明亮度较高的浅色。在体系中加入3种不同氨基酸后,随着物质的量比的增加,ΔL*呈现下降趋势,在物质的量比达到最大时,
和Hab=-2.85)。表现出红蓝色外观较差,明亮度较高的浅色。在体系中加入3种不同氨基酸后,随着物质的量比的增加,ΔL*呈现下降趋势,在物质的量比达到最大时,![]() 达到最高值,L*达到最低值,呈现出饱和度最高最暗的颜色特征[25]。总的来说,L*和a*值较低涉及的暗度可能是由辅色素诱导的增色效应引起的,与此同时,Hab和b*的变化被证明是这种反应的深色位移结果[26]。
达到最高值,L*达到最低值,呈现出饱和度最高最暗的颜色特征[25]。总的来说,L*和a*值较低涉及的暗度可能是由辅色素诱导的增色效应引起的,与此同时,Hab和b*的变化被证明是这种反应的深色位移结果[26]。
然而,如表2所示,添加氨基酸后ΔL*为(-5.052~-0.06),ΔHab为(-0.434~0.241),ΔL*相比ΔHab更明显,表明氨基酸诱导的色度特征更具量变性而不是质变性[27]。尽管这3种氨基酸的颜色参数表现出相似的演变模式,但在测定条件下,色氨酸的结合能力高于苯丙氨酸与酪氨酸,从物质的量比为1∶1到1∶100,其L*下降了![]() 上升了34.21%,而苯丙氨酸L*下降了
上升了34.21%,而苯丙氨酸L*下降了![]() 上升了7.96%。对比表1中K值,发现辅色效果与K值的顺序相同,因此,可能与结构特征有关,这与CHUNG等[9]得出的结论相对应。为了确定观察到的色度变化是否与视觉相关,计算了模型酒之间的颜色差异色差
上升了7.96%。对比表1中K值,发现辅色效果与K值的顺序相同,因此,可能与结构特征有关,这与CHUNG等[9]得出的结论相对应。为了确定观察到的色度变化是否与视觉相关,计算了模型酒之间的颜色差异色差![]() 当色氨酸的物质的量比达到1∶40时,
当色氨酸的物质的量比达到1∶40时,![]() 表明色氨酸参与反应可以产生人眼可识别的差异[10]。而苯丙氨酸与酪氨酸在最高浓度时
表明色氨酸参与反应可以产生人眼可识别的差异[10]。而苯丙氨酸与酪氨酸在最高浓度时![]() 仍小于3,证明其辅色效果较差。和前述的结果相似,在浓度最高时
仍小于3,证明其辅色效果较差。和前述的结果相似,在浓度最高时![]() 差值最大,相比之下,色氨酸辅色较为明显,在1∶100 时
差值最大,相比之下,色氨酸辅色较为明显,在1∶100 时![]() 达到7.559。
达到7.559。
表2 不同物质的量比的氨基酸与M3OG反应后CIELab参数
Table 2 The CIELab indexes of M3OG with amino acids at different molar ratio
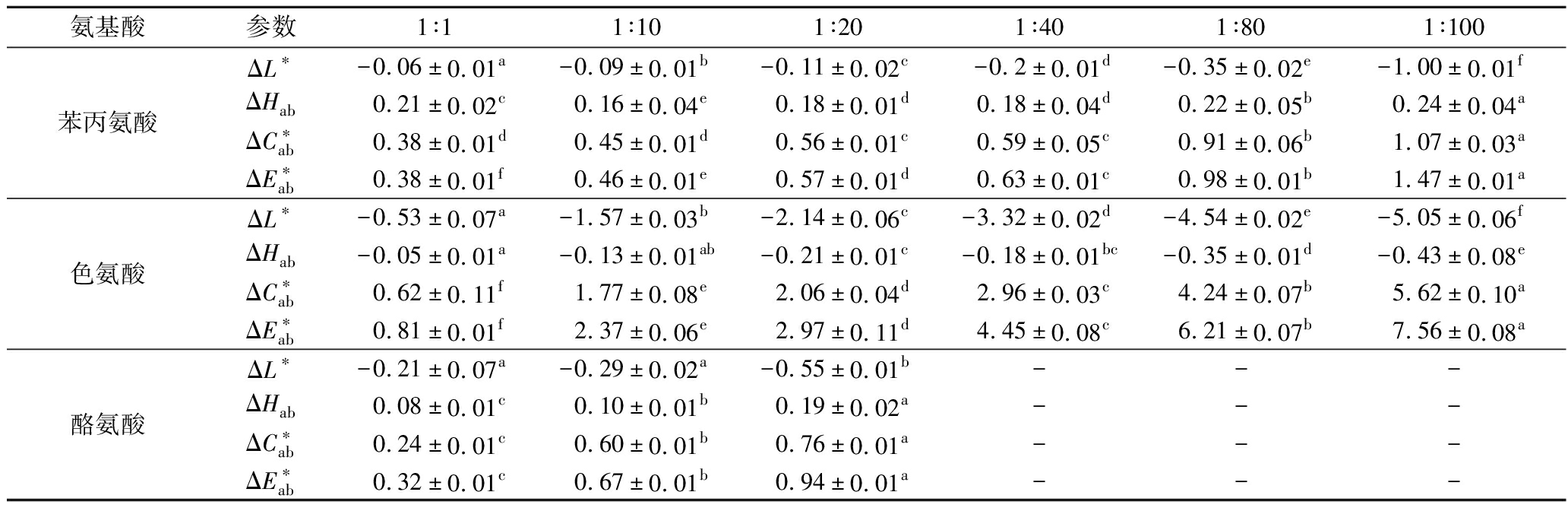
氨基酸参数1∶11∶101∶201∶401∶801∶100苯丙氨酸ΔL∗-0.06±0.01a-0.09±0.01b-0.11±0.02c-0.2±0.01d-0.35±0.02e-1.00±0.01fΔHab0.21±0.02c0.16±0.04e0.18±0.01d0.18±0.04d0.22±0.05b0.24±0.04aΔC∗ab0.38±0.01d0.45±0.01d0.56±0.01c0.59±0.05c0.91±0.06b1.07±0.03aΔE∗ab0.38±0.01f0.46±0.01e0.57±0.01d0.63±0.01c0.98±0.01b1.47±0.01a色氨酸ΔL∗-0.53±0.07a-1.57±0.03b-2.14±0.06c-3.32±0.02d-4.54±0.02e-5.05±0.06fΔHab-0.05±0.01a-0.13±0.01ab-0.21±0.01c-0.18±0.01bc-0.35±0.01d-0.43±0.08eΔC∗ab0.62±0.11f1.77±0.08e2.06±0.04d2.96±0.03c4.24±0.07b5.62±0.10aΔE∗ab0.81±0.01f2.37±0.06e2.97±0.11d4.45±0.08c6.21±0.07b7.56±0.08a酪氨酸ΔL∗-0.21±0.07a-0.29±0.02a-0.55±0.01b---ΔHab0.08±0.01c0.10±0.01b0.19±0.02a---ΔC∗ab0.24±0.01c0.60±0.01b0.76±0.01a---ΔE∗ab0.32±0.01c0.67±0.01b0.94±0.01a---
2.3 FT-IR分析
采用FT-IR检测,并根据其振动谱带的强弱、峰的位置分析两者之间的相互作用。有不同浓度颜色参数以及热力学参数结果可知,色氨酸的辅色效果较好,因此对色氨酸、M3OG及其复合物进行FT-IR分析。
结果如图2所示,在色氨酸的FT-IR图中,3 496 cm-1和3 459 cm-1表示O—H键伸缩振动,2 918 cm-1表示C—H键伸缩振动,在1 613 cm-1处与C![]() O的伸缩振动有关[28],而1 525 cm-1表示芳环骨架的C
O的伸缩振动有关[28],而1 525 cm-1表示芳环骨架的C![]() C伸缩振动。1 490 cm-1、1 458 cm-1、1 405 cm-1和1 352 cm-1表示C—H键与N—H键的伸缩振动,1 302 cm-1和1 276 cm-1属于NH2键的伸缩振动,1 128 cm-1和1 067 cm-1表示芳环取代基的C—H的伸缩振动[28]。与FAIZAN等[29]研究结果相似,均属于芳香氨基酸的典型特征。在M3OG的红外光谱图中,3 467 cm-1(O—H拉伸),2 921 cm-1和2 853 cm-1(C—H拉伸),1 633 cm-1(C
C伸缩振动。1 490 cm-1、1 458 cm-1、1 405 cm-1和1 352 cm-1表示C—H键与N—H键的伸缩振动,1 302 cm-1和1 276 cm-1属于NH2键的伸缩振动,1 128 cm-1和1 067 cm-1表示芳环取代基的C—H的伸缩振动[28]。与FAIZAN等[29]研究结果相似,均属于芳香氨基酸的典型特征。在M3OG的红外光谱图中,3 467 cm-1(O—H拉伸),2 921 cm-1和2 853 cm-1(C—H拉伸),1 633 cm-1(C![]() O拉伸),1 488 cm-1(芳烃骨架的C
O拉伸),1 488 cm-1(芳烃骨架的C![]() C伸缩振动)在1 138 cm-1处的强谱带表示吡喃环OH取代基的C—O伸缩振动,1 063 cm-1和1 040 cm-1处的弱谱带则归因于芳香环的C—O—C伸缩振动,这些均属于黄酮类化合物的典型特征[30]。与色氨酸和M3OG单独的红外光谱相比,色氨酸-M3OG复合物红外光谱图的O—H键拉伸由3 467 cm-1和3 496 cm-1变化到3 488 cm-1,并且特征吸收峰强度增强,表明色氨酸和M3OG分子之间可以形成氢键[13,27]。类似的研究表明,在色氨酸存在的情况下,花色苷稳定性能够有所提高是因为二者通过氢键和疏水相互作用发生反应[9]。此外,与色氨酸的红外光谱图相比,1 128~1 067 cm-1处的谱带朝向高波数的方向移动。相对于M3OG的红外光谱,在2 921 cm-1和2 852 cm-1处特征吸收强度减弱,表明色氨酸和M3OG可能存在π-π堆积或其他相互作用[1]。
C伸缩振动)在1 138 cm-1处的强谱带表示吡喃环OH取代基的C—O伸缩振动,1 063 cm-1和1 040 cm-1处的弱谱带则归因于芳香环的C—O—C伸缩振动,这些均属于黄酮类化合物的典型特征[30]。与色氨酸和M3OG单独的红外光谱相比,色氨酸-M3OG复合物红外光谱图的O—H键拉伸由3 467 cm-1和3 496 cm-1变化到3 488 cm-1,并且特征吸收峰强度增强,表明色氨酸和M3OG分子之间可以形成氢键[13,27]。类似的研究表明,在色氨酸存在的情况下,花色苷稳定性能够有所提高是因为二者通过氢键和疏水相互作用发生反应[9]。此外,与色氨酸的红外光谱图相比,1 128~1 067 cm-1处的谱带朝向高波数的方向移动。相对于M3OG的红外光谱,在2 921 cm-1和2 852 cm-1处特征吸收强度减弱,表明色氨酸和M3OG可能存在π-π堆积或其他相互作用[1]。
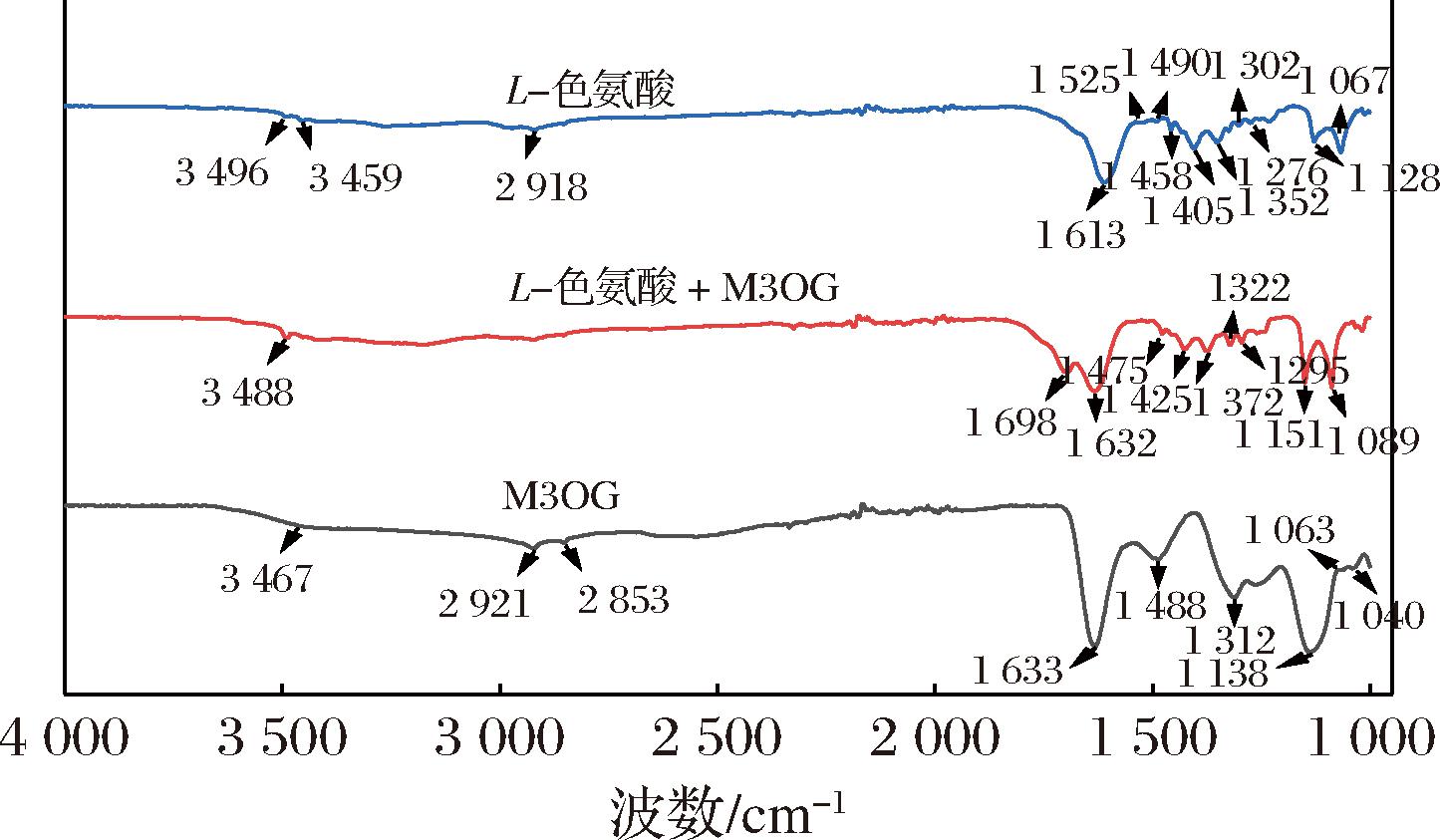
图2 L-色氨酸、L-色氨酸和M3OG复合物、M3OG的红外光谱图
Fig.2 FT-IR spectra of L-Trp, M3OG and their mixture
2.4 分子对接分析
利用AutoDockVina分子对接技术模拟M3OG分子与L-色氨酸的结合,可以有效排除人为因素的干扰[31],对所得构象进行打分评价,进一步补充验证实验结果。M3OG与色氨酸的对接结果见表3,根据最低亲和力和均方根偏差(root mean square deviation,RMSD),模型1选为分子最佳模型。模型1表明,在M3OG与L-色氨酸之间形成了2个氢键,距离分别为2.3和3.0 Å,与红外光谱得出的结论一致。氢键是分子之间重要的相互作用力之一[32],稳定了M3OG与L-色氨酸二元复合物的结合构像,进而提高了二元复合物的稳定性,与之前的研究结果一致。这种氢键主要发生在M3OG羟基上的O原子和L-色氨酸的N原子与碳氧双键的O原子之间,同时ZHOU等[33]发现色氨酸的O原子与G3G分子B环的羟基之间形成氢键,与本实验研究结果相似。由分子对接的结合构像可以看出,氨基酸分子以近似平行的方式堆叠在M3OG分子的结构上方,形成“π-π”堆叠的双层结构,这与NIE等[13]研究的色氨酸与G3G的结合构像结果相似。色氨酸以苯环单位与M3OG分子叠合,较大单位重叠排布在M3OG分子中部,提供了与M3OG分子之间较大的作用面积,有利于分子间氢键的产生,加强两者之间的相互作用,起到加强复合物稳定性的作用[1]。这一结果进一步证明了色氨酸相较苯丙氨酸与酪氨酸为效果较强的辅色因子,以及产生较高K值的原因。同时,有研究表明花色苷稳定性与分子间相互作用力有关,辅色因子可通过氢键和非共价作用力使得花色苷的氧正离子更加稳定[34],减弱其与水分子之间的相互作用,从而达到稳定溶液颜色的作用,使得溶液颜色损失程度降低。
表3 M3OG与L-色氨酸分子对接结果Table 3 Results of molecular docking between M3OG and L-Trp
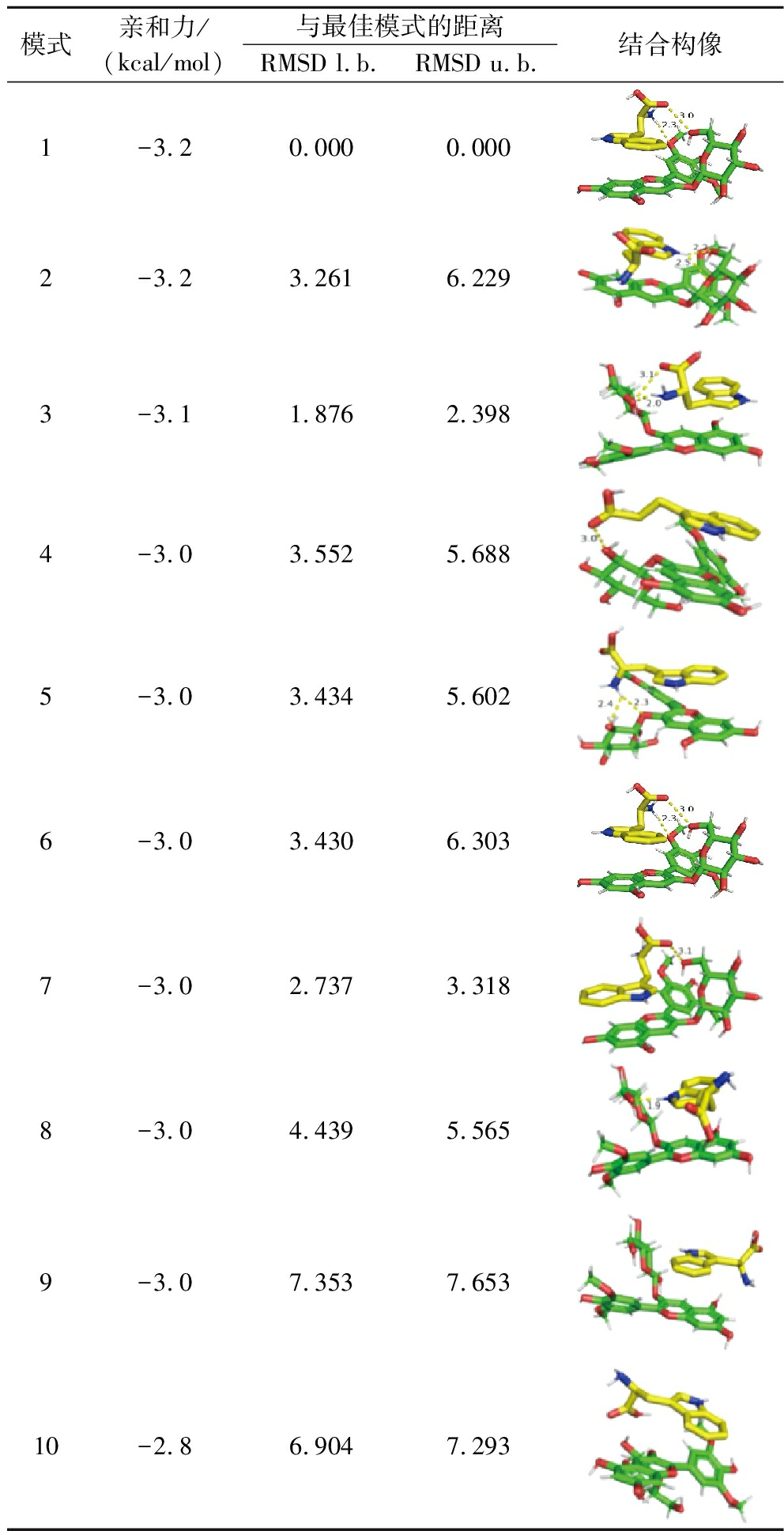
模式亲和力/(kcal/mol)与最佳模式的距离RMSD l.b.RMSD u.b.结合构像1-3.20.0000.0002-3.23.2616.2293-3.11.8762.3984-3.03.5525.6885-3.03.4345.6026-3.03.4306.3037-3.02.7373.3188-3.04.4395.5659-3.07.3537.65310-2.86.9047.293
2.5 分子动力学模拟分析
根据分子对接结果,本研究选取了第1组M3OG与L-色氨酸对接复合物及M3OG进行10 ns的分子动力学模拟,以研究分子对接得到的动态特性。通常采用RMSD衡量体系是否稳定。如图3-a所示,M3OG与L-色氨酸复合物的RMSD曲线在2 000~3 500 ps波动范围为1.1~1.3 nm,随着模拟时间的进行,复合物的相对稳定性逐渐提高,其在5 000~7 500 ps时间段内波动范围为1.1~1.2 nm,因此,M3OG与L-色氨酸复合物在5 000~7 500 ps的稳定性较2 000~3 500 ps的高。M3OG分子体系的总体虽然也趋于稳定,但其RMSD值全程处于0.3~0.8,M3OG与L-色氨酸复合物相较M3OG苷单独存在时RMSD值浮动范围更窄,运动较平稳,这表明加入L-色氨酸的复合物体系更加有利于M3OG稳定。
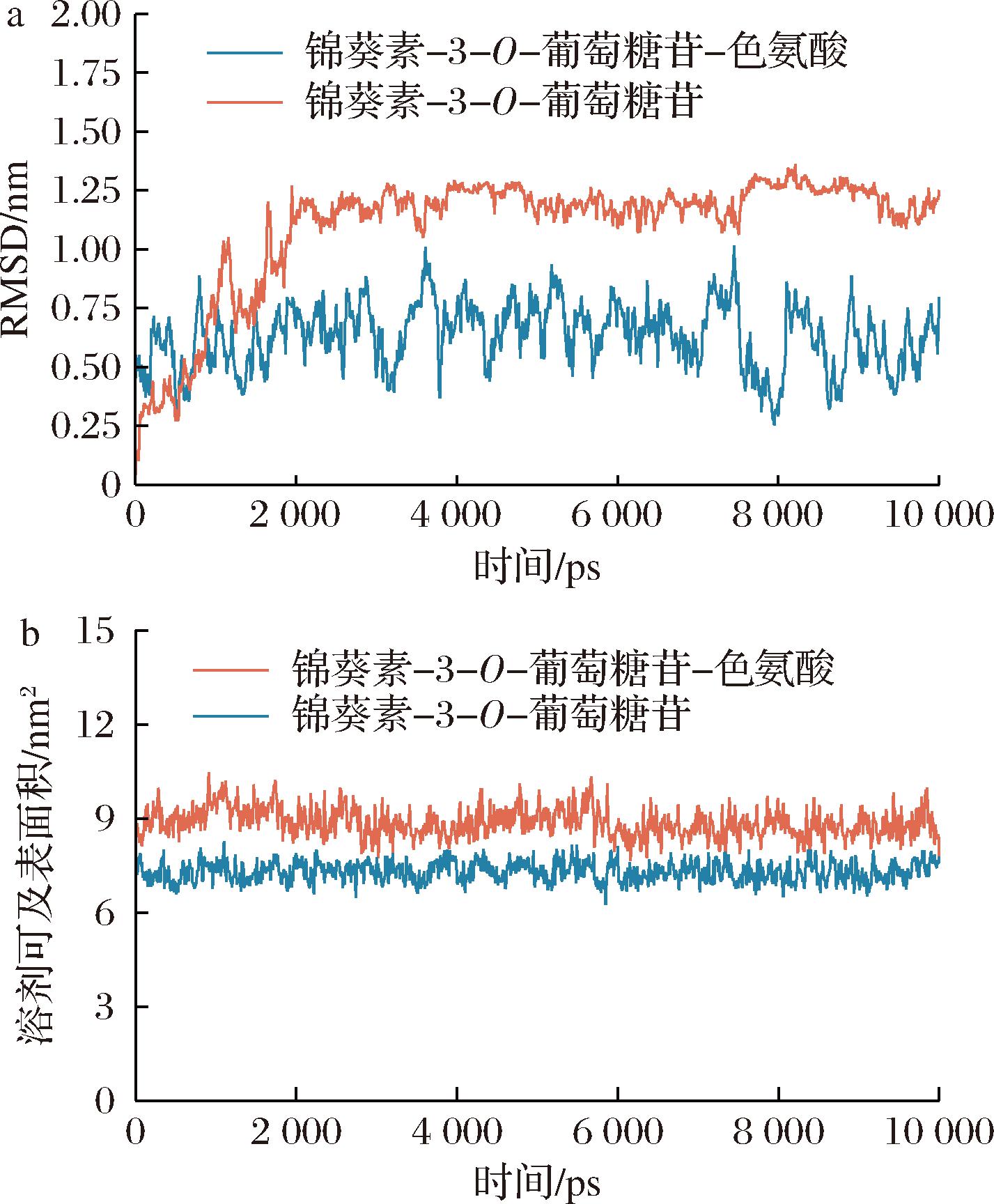
a-RMSD;b-溶剂可及表面积
图3 锦葵素-3-O-葡萄糖苷和L-色氨酸二元络合物体系及锦葵素-3-O-葡萄糖苷体系的分子动力学模拟
Fig.3 Molecular dynamic simulation obtained for M3OG-Trp binary composite system
通过对分子动力学模拟结果的分析,计算了M3OG与L-色氨酸复合物以及M3OG的溶剂可及表面积(solution accessible surface area,SASA)值。SASA值是分子表面与溶剂分子相互作用比例的参数,计算SASA值可以确定M3OG残基溶剂可及性变化,从而预测结合过程中的构象变化程度[35]。如图3-b所示,M3OG与色氨酸复合物的SASA值稳定在9 nm2,色氨酸的SASA值稳定在8 nm2。M3OG与色氨酸复合物的SASA值比单个M3OG分子的更大,表明与色氨酸结合的情况下,与溶剂可以更好的结合,加强了整个体系的稳定性。观察到复合物的SASA值在模拟过程中保持稳定,这表明M3OG与L-色氨酸复合物的结构相对稳定并且没有明显的结构变化。表明溶液的疏水相互作用可能也是M3OG与L-色氨酸的相互作用之一。
3 结论
本研究通过在模拟葡萄酒条件下对3种氨基酸(L-苯丙氨酸、L-色氨酸、L-酪氨酸)与M3OG分子间的辅色作用研究,表明了这3种氨基酸具有辅色作用,其中L-色氨酸辅色作用最显著。通过颜色参数结果研究表明,氨基酸浓度增加会导致混合溶液的吸光度增加。其中L-色氨酸在最高物质的量比时的效果最为明显,FT-IR、分子对接和分子动力学模拟结果表明,模拟葡萄酒溶液中L-色氨酸存在条件下M3OG溶液吸光度值增加是由于产生氢键和范德华力相互作用,是提高氨基酸-M3OG复合物稳定性的主要驱动力。除此之外,氨基酸相对于其他辅色剂具有更高的营养作用,其作为辅色剂添加到葡萄酒中不仅不会带来健康危害,反而会增加葡萄酒营养价值。因此,用氨基酸,尤其是色氨酸来补充葡萄汁进行颜色保护具有更高的工艺价值和产品价值。
[1] 张波. 红葡萄酒中橡木多酚辅色化机制研究[D].北京:中国农业大学, 2016.
ZHANG B.Research on the mechanism of cochromatisation of oak polyphenols in red wines [D].Beijing:China Agricultural University, 2016.
[2] 张扬, 彭晶晶, 李坤一, 等.发酵前添加有机酸对西拉红葡萄酒颜色和感官质量的影响[J].食品与发酵工业, 2023, 49(7):90-98.
ZHANG Y, PENG J J, LI K Y, et al.Effects of organic acid added before fermentation on color and sensory quality of Syrah red wine[J].Food and Fermentation Industries, 2023, 49(7):90-98.
[3] CZIBULYA Z, HORV TH I, KOLL
TH I, KOLL R L, et al.The effect of temperature, pH, and ionic strength on color stability of red wine[J].Tetrahedron, 2015, 71(20):3027-3031.
R L, et al.The effect of temperature, pH, and ionic strength on color stability of red wine[J].Tetrahedron, 2015, 71(20):3027-3031.
[4] SUN X Y, SHOKRI S, GAO B H, et al.Improving effects of three selected co-pigments on fermentation, color stability, and anthocyanins content of blueberry wine[J].LWT, 2022, 156:113070.
[5] BOULTON R.The copigmentation of anthocyanins and its role in the color of red wine:A critical review[J].American Journal of Enology and Viticulture, 2001, 52(2):67-87.
[6] BROUILLARD R, DANGLES O.Anthocyanin molecular interactions:The first step in the formation of new pigments during wine aging?[J].Food Chemistry, 1994, 51(4):365-371.
[7] ASEN S, STEWART R N, NORRIS K H.Co-pigmentation of anthocyanins in plant tissues and its effect on color[J].Phytochemistry, 1972, 11(3):1 139-1 144.
[8] TÜRKY LMAZ M, HAMZAO
LMAZ M, HAMZAO LU F, HANDENUR Ü, et al.Influence of amino acid addition on the thermal stability of anthocyanins in pomegranate (Punica granatum L., cv.Hicaznar) and orange (Citrus sinensis L.Osbeck, cv.Valencia) juice blend[J].Food Chemistry, 2022, 370:131061.
LU F, HANDENUR Ü, et al.Influence of amino acid addition on the thermal stability of anthocyanins in pomegranate (Punica granatum L., cv.Hicaznar) and orange (Citrus sinensis L.Osbeck, cv.Valencia) juice blend[J].Food Chemistry, 2022, 370:131061.
[9] CHUNG C, ROJANASASITHARA T, MUTILANGI W, et al.Stability improvement of natural food colors:Impact of amino acid and peptide addition on anthocyanin stability in model beverages[J].Food Chemistry, 2017, 218:277-284.
[10] ZHANG B, HE F, ZHOU P P, et al.Copigmentation between malvidin-3-O-glucoside and hydroxycinnamic acids in red wine model solutions:Investigations with experimental and theoretical methods[J].Food Research International, 2015, 78:313-320.
[11] MALAJ N, DE SIMONE B C, QUARTAROLO A D, et al.Spectrophotometric study of the copigmentation of malvidin 3-O-glucoside with p-coumaric, vanillic and syringic acids[J].Food Chemistry, 2013, 141(4):3614-3620.
[12] 李伟, 席晓敏, 李辉, 等.贺兰山东麓赤霞珠干红葡萄酒陈酿过程中颜色变化研究[J].食品科学技术学报, 2020, 38(2):41-47.
LI W, XI X M, LI H, et al.Determination of color change during aging of cabernet sauvignon in eastern foothill of Helan Mountain[J].Journal of Food Science and Technology, 2020, 38(2):41-47.
[13] NIE M, WANG L, LU S M, et al.Protective effect of amino acids on the stability of bayberry anthocyanins and the interaction mechanism between L-methionine and cyanidin-3-O-glycoside[J].Food Chemistry, 2022, 396:133689.
[14] LI C X, WANG J X, LE Y, et al.Studies of bicalutamide-excipients interaction by combination of molecular docking and molecular dynamics simulation[J].Molecular Pharmaceutics, 2013, 10(6):2362-2369.
[15] ST NCIUC N, OANCEA A M, APRODU I, et al.Investigations on binding mechanism of bioactives from elderberry (Sambucus nigra L.) by whey proteins for efficient microencapsulation[J].Journal of Food Engineering, 2018, 223:197-207.
NCIUC N, OANCEA A M, APRODU I, et al.Investigations on binding mechanism of bioactives from elderberry (Sambucus nigra L.) by whey proteins for efficient microencapsulation[J].Journal of Food Engineering, 2018, 223:197-207.
[16] VAN DER SPOEL D, LINDAHL E, HESS B, et al.GROMACS:Fast, flexible, and free[J].Journal of Computational Chemistry, 2005, 26(16):1701-1718.
[17] DONNELLY S M, LOPEZ N A, DODIN I Y.Steepest-descent algorithm for simulating plasma-wave caustics via metaplectic geometrical optics[J].Physical Review, 2021, 104(2-2):025304.
[18] 赵磊, 潘飞, 周娜, 等.提高黑米花色苷颜色稳定性辅色剂的筛选及其作用机制[J].食品科学, 2021, 42(14):16-23.
ZHAO L, PAN F, ZHOU N, et al.Screening of co-pigments to improve color stability of black rice anthocyanins and underlying mechanism[J].Food Science, 2021, 42(14):16-23.
[19] BROUILLARD R, MAZZA G, SAAD Z, et al.The co-pigmentation reaction of anthocyanins:A microprobe for the structural study of aqueous solutions[J].Journal of the American Chemical Society, 1989, 111(7):2604-2610.
[20] CHUNG C, ROJANASASITHARA T, MUTILANGI W, et al.Enhanced stability of anthocyanin-based color in model beverage systems through whey protein isolate complexation[J].Food Research International, 2015, 76:761-768.
[21] 胡能兵, 隋益虎, 何克勤, 等.多糖、有机酸、氨基酸及其复配对紫色辣椒叶片色素辅色效果研究[J].基因组学与应用生物学, 2016, 35(3):715-720.
HU N B, SUI Y H, HE K Q, et al.Study of polysaccharides, organic acid, amino acid and its compound on copigmentation of leaf pigment in purple pepper[J].Genomics and Applied Biology, 2016, 35(3):715-720.
[22] KANHA N, SURAWANG S, PITCHAKARN P, et al.Copigmentation of cyanidin 3-O-glucoside with phenolics:Thermodynamic data and thermal stability[J].Food Bioscience, 2019, 30:100419.
[23] ACHARYA D P, SANGUANSRI L, AUGUSTIN M A.Binding of resveratrol with sodium caseinate in aqueous solutions[J].Food Chemistry, 2013, 141(2):1050-1054.
[24] 汤晓宏, 丁燕, 高德艳, 等.基于CIELab色空间法分析海底陈酿对葡萄酒色泽的影响[J].中外葡萄与葡萄酒, 2022(5):88-92.
TANG X H, DING Y, GAO D Y, et al.Effect of seafloor storage on wine colour based on CIELab colour space system[J].Sino-Overseas Grapevine &Wine, 2022(5):88-92.
[25] SOCRATES G.Infrared and Raman characteristic group frequencies:tables and charts[M].3rd ed.Chichester:Wiley, 2001.
[26] HERN NDEZ B, PFLÜGER F, ADENIER A, et al.Vibrational analysis of amino acids and short peptides in hydrated media.VIII.Amino acids with aromatic side chains:L-phenylalanine, L-tyrosine, and L-tryptophan[J].2010, 114(46):15319-15330.
NDEZ B, PFLÜGER F, ADENIER A, et al.Vibrational analysis of amino acids and short peptides in hydrated media.VIII.Amino acids with aromatic side chains:L-phenylalanine, L-tyrosine, and L-tryptophan[J].2010, 114(46):15319-15330.
[27] 聂铭. 氨基酸对杨梅花色苷稳定性的影响及相互作用研究[D].舟山:浙江海洋大学, 2022.
NIE M.Effects of amino acids on the stability of poplar plum anthocyanosides and the study of interactions [D].Zhoushan:Zhejiang Ocean University, 2022.
[28] AHMAD BHAT S, AHMAD S.FTIR, FT-Raman and UV-Vis spectral studies of D-tyrosine molecule[J].Journal of Molecular Structure, 2016, 1105:169-177.
[29] FAIZAN M, AHMAD S.Experimental vibrational spectroscopy (FTIR and FT-Raman) of D-tryptophan and its anharmonic theoretical studies using density functional theory[J].Journal of Molecular Structure, 2018, 1171:315-322.
[30] ZHANG B, WANG Q, ZHOU P P, et al.Copigmentation evidence of oenin with phenolic compounds:A comparative study of spectrographic, thermodynamic and theoretical data[J].Food Chemistry, 2020, 313:126163.
[31] 吴健妹, 张国文.三种糖基化中间产物与小牛胸腺DNA相互作用的多光谱和分子动力学模拟[J].南昌大学学报(理科版), 2023, 47(3):243-254.
WU J M, ZHANG G W.Multispectral and molecular dynamics simulation studies of the interaction of three glycosylation intermediates with calf Thymus DNA[J].Journal of Nanchang University (Natural Science), 2023, 47(3):243-254.
[32] XU X J, FANG S, LI Y H, et al.Effects of low acyl and high acyl gellan gum on the thermal stability of purple sweet potato anthocyanins in the presence of ascorbic acid[J].Food Hydrocolloids, 2019, 86:116-123.
[33] ZHOU R, DONG X Y, SONG L L, et al.Interaction mode and nanoparticle formation of bovine serum albumin and anthocyanin in three buffer solutions[J].Journal of Luminescence, 2014, 155:244-250.
[34] ZHAO L, PAN F, MEHMOOD A, et al.Improved color stability of anthocyanins in the presence of ascorbic acid with the combination of rosmarinic acid and xanthan gum[J].Food Chemistry, 2021, 351:129317.
[35] ZHAO L, PAN F, MEHMOOD A, et al.Protective effect and mechanism of action of xanthan gum on the color stability of black rice anthocyanins in model beverage systems[J].International Journal of Biological Macromolecules, 2020, 164:3800-3807.