咖啡酸苯乙酯(caffic acid phenethyl ester, CAPE)是蜂胶中重要的活性成分之一,具有抗炎和抗肿瘤等生物活性[1]。同时,CAPE还具有抗氧化特性,表现出对抗自由基、抑制黄嘌呤氧化酶活性和阻断脂质过氧化物的剂量依赖效应[2]。此外,CAPE的细胞毒性作用通常对癌细胞具有选择性,研究表明CAPE可以有效地杀死癌细胞,但对正常细胞不造成损伤[3]。为了达到治疗效果,CAPE必须能够在特定浓度下到达靶组织,并且必须维持较长时间。CAPE是通过含有酯基和(E)-碳-碳双键的链把邻苯二酚和苯环连接起来,而苯环结构使其极难在水中分散,同时苯环上的酚羟基也容易氧化,这使得其难以在人体中有效发挥功效[4]。开发出合适的给药方式和给药剂型,寻找有效的载药材料对提高CAPE的生物利用度有深远意义。
聚合物纳米颗粒是递送难溶性生物活性化合物的优良载体[5]。食品来源的多糖和蛋白质,有其独特得生物相容性、低毒性和安全性,已广泛应用于食品和制药行业,作为活性物质或药物的纳米传输载体[6-7]。然而,口服给药作为一种最便利、最为人们所接受的给药方式,会使得这些单层的纳米载体面临胃肠道中pH值、多种酶及胆盐的降解,从而导致CAPE在胃液中释放,而无法达到肠道以便于被人体吸收[8]。目前,利用胃肠道中自身pH值和酶的变化,开发响应性药物控释体系,是提高口服给药效率和药物生物利用度的热门研究方向[9-10]。
海藻酸钠分子由α-L-古洛糖醛酸(G)和β-D-甘露醛酸 (M) 的线性共聚物通过1,4-糖苷键连接[11]。海藻酸钠可通过Ca2+等多价阳离子与—COOH之间的静电作用力,形成凝胶。因为结构中大量自由—COOH的存在,使得海藻酸钠水凝胶具有在低pH条件下收缩,在较高pH值条件下溶胀的特性。因此在胃肠道的pH环境下,海藻酸钠是一种在胃液中保护药物、在肠液中控释药物的天然的pH响应性药物包封递送载体。然而,海藻酸钠水凝胶球网络较为松散,容易造成对药物的包封率不高,以及在胃液中对药物的保护作用有限,而在肠道中爆发性释放药物,因此海藻酸钠往往会和其他载体材料相结合,才能获得较好的药物控释动力学效果[12]。LIM等[13]和SARIYER等[14]用海藻酸钠结合卡拉胶,分别对胰岛素和牛血清白蛋白进行了负载,形成水凝胶小球,很好的实现了胃肠道环境的pH响应性释放,对多肽药物活性进行了很好的保护。
淀粉含有直链淀粉和支链淀粉,是一种广泛应用于食品和医药工业的天然多糖,支链淀粉是以α-D-(1,4)糖苷键连接的葡萄糖单位为主骨干和α-D-(1,6)糖苷键连接的葡萄糖单位为分支,而直链淀粉只有α-D-(1,4)糖苷键连接的葡萄糖单位[11]。多孔淀粉是一种改性淀粉,因其高比表面积和优秀的负载能力,在药物和活性物质的包封和递送方面具有广阔的应用前景。WANG等[15]以纳米颗粒的形式将紫杉醇负载到多孔淀粉中,将紫杉醇的生物利用度提高了5.42倍,且显示良好的Lewis肺癌细胞抑制作用。LI等[16]以多孔玉米淀粉为微胶囊,研究植物乳杆菌299v在酸、胆汁和热处理后的存活情况。与游离细胞相比,微囊化的益生菌的耐酸能力有显著提高,并对各种应激条件提供更强的保护。多孔淀粉能被α-淀粉酶进一步消化,然而针对此性质特征,将其作为药物或活性物质的载体,并进一步研究载药体系的释放行为,目前还鲜有报道。
因此,本研究为了提高CAPE在水溶液中的分散性和口服生物可及性,首先从大麦粉中提取大麦醇溶蛋白(hordein),并将玉米淀粉通过酶解法制备成多孔淀粉(porous starch,PS)。利用反溶剂分散法,将CAPE与大麦醇溶蛋白结合,以CAPE-大麦醇溶蛋白纳米颗粒(CAPE-hordein nanoparticles,CAPE-HD)的形式被负载于多孔淀粉中,再包覆于果胶(pectin) - 海藻酸钠(alginate)水凝胶之中,形成复杂的载CAPE胃肠道控释水凝胶体系(CAPE-hordein nanoparticles/porous starch-pectin-alginate, CAPE-HD/PS-PA)。对CAPE-HD/PS-PA水凝胶的形成机制以及对CAPE的包覆效率进行了考察,并进一步研究了此复杂水凝胶在模拟胃肠液中的溶胀行为,以及在胃肠道中对pH值变化和肠道中α-淀粉酶的响应性释放行为。
1 材料与方法
1.1 实验材料
1.1.1 材料试剂
玉米淀粉、咖啡酸苯乙酯、海藻酸钠,上海阿拉丁生化科技股份有限公司;低甲氧基果胶,汇泉生物科技有限公司;大麦粉,上海大润发超市;α-淀粉酶(枯草杆菌来源)、α-淀粉酶(猪胰腺来源)源叶生物科技有限公司;HCl、NaOH、无水氯化钙、正己烷、异丙醇等试剂均为分析纯,国药集团化学试剂有限公司。
1.1.2 仪器设备
MYP11-2电动搅拌器,上海梅颖浦仪器仪表制造有限公司;蠕动泵,保定兰格恒流泵有限公司;DZF-6024真空干燥箱,上海一恒科学仪器有限公司;UV1800紫外分光光度计,日本岛津仪器有限公司;Regulus8100扫描电子显微镜(scanning electron microscope,SEM),日本 Hitachi 公司;Nicolet iS10红外光谱仪,美国 Thermo Fisher 科技有限公司。
1.2 实验方法
1.2.1 PS的制备
根据文献[16],制备PS。称量20 g玉米淀粉,溶于PBS中形成50 g/L的淀粉浆,α-淀粉酶(枯草杆菌来源)以0.5 U/mg淀粉的浓度加入淀粉浆中。将上述混合物置于烧瓶中,在37 ℃的水浴锅中,以250 r/min的速率分别水解5、6、7和8 h。到达反应时间后,加入适量无水乙醇终止酶解反应,4 000 r/min离心10 min,随后用无水乙醇洗涤沉淀离心3次。取出沉淀,真空干燥12 h得到多孔淀粉。除了不加α-淀粉酶以外,按照上述水解6 h的步骤制备多孔淀粉对照样。
1.2.2 CAPE-HD/PS-PA复杂水凝胶的制备
首先,参考文献[17]方法制备大麦醇溶蛋白,简要来说,大麦粉用正己烷脱脂2 h,用NaCl溶液和去离子水洗涤后,溶于55%(体积分数)异丙醇溶液,离心取上清液并浓缩后,冷冻干燥得大麦醇溶蛋白粉末。
称量1.5 g多孔淀粉溶解在10 mL pH=3的水溶液中,在660 r/min转速下搅拌30 min制成淀粉浆备用。取20 mg CAPE溶于1 mL无水乙醇中,作为CAPE母液备用。称取30 mg大麦醇溶蛋白溶于5 mL 70%(体积分数)乙醇溶液中,加入100 μL CAPE母液并搅拌均匀,4 000 r/min离心10 min,取上清液3 mL,用蠕动泵缓慢滴加至660 r/min搅拌的多孔淀粉浆中,制得CAPE-HD/PS。另一方面,将果胶和海藻酸钠以等质量比混合制备成1.5%(质量分数)的果胶-海藻酸钠胶浆(PA),再将上述CAPE-HD/PS分散液加入并继续搅拌均匀。最后,借助蠕动泵将混合胶浆滴入30 g/L的CaCl2溶液(100 r/min轻轻搅拌),制备成CAPE-HD/PS-PA水凝胶球。在CaCl2溶液中硬化30 min后取出,大量超纯水冲洗后,放入4 ℃冰箱冷藏保存备用。
1.2.3 多孔淀粉、CAPE-HD/PS以及CAPE-HD/PS-PA的理化性质表征
1.2.3.1 多孔淀粉、CAPE-HD/PS以及CAPE-HD/PS-PA的微观形态观察
采用SEM观察多孔淀粉、冻干CAPE-HD/PS和CAPE-HD/PS-PA水凝胶球的微观形貌。样品在真空条件下用喷金2 min,以增强样品的导电性,用SEM观察并拍摄图片。
取1.5 g多孔淀粉与10 mL去离子水混合并搅拌均匀,制备成多孔淀粉浆,并将其与20 g/L的海藻酸钠溶液混合,500 r/min 搅拌30 min,将混合物滴入30 g/L CaCl2溶液中,制备成水凝胶球,将此水凝胶球切片,并用激光共聚焦显微镜(confocal laser scanning microscope,CLSM)观察多孔淀粉的微观形貌并拍摄图片。
1.2.3.2 傅里叶红外光谱(Fourier transform infrared spectroscopy,FTIR)测试
将CAPE和冻干的CAPE-HD/PS以及CAPE-HD/PS-PA分别与KBr混合研磨并压成片状,用傅里叶红外光谱仪获得FTIR光谱。频率范围为4 000~400 cm-1,分辨率为4 cm-1。
1.2.3.3 X射线衍射(X-ray diffraction,XRD)测试
用XRD在Cu靶和40 mA电流的条件下测量了CAPE, CAPE-HD/PS, CAPE-HD/PS-PA的晶体形态,扫描过程在2θ范围为5°~60°。扫描速度0.02 °/s。
1.2.3.4 差示扫描量热(differential scanning calorimetry,DSC)测试
称取5 mg样品置于在标准铝盘中,在连续通入N2(20 mL/min)的条件下,以10 ℃/min的速度从50 ℃升温至300 ℃,并使用空的密封铝盘作为基线,得到了每个样品的DSC热图。
1.2.4 CAPE浓度标准曲线
根据文献[18],CAPE的最大吸收波长为323 nm,以无水乙醇做溶剂和空白对照,通过紫外分光光度计检测CAPE浓度并绘制标准曲线。称取0.100 g CAPE加入至无水乙醇中,定容于250 mL容量瓶,得到400 μg/mL母液;梯度浓度设置为:4、6、8、10、12 μg/mL,进行稀释,在323 nm的波长下测量各样品的紫外吸光度,绘制紫外吸光度-CAPE浓度标准曲线。
1.2.5 CAPE-HD/PS-PA包封率
用紫外分光光度计测量制备水凝球的CaCl2滤液中的CAPE残余浓度,计算水凝胶球的CAPE包封效率。计算如公式(1)所示:
包封率![]()
(1)
1.2.6 CAPE-HD/PS-PA溶胀行为研究
模拟胃液(simulated gastric fluid,SGF)和模拟肠液(simulated intestinal fluid,SIF)采用先前报道的方法制备[19]。将7 mL盐酸(质量分数37%)和2.0 g氯化钠溶解于1 000 mL去离子水中,调节pH值为1.2,制备SGF。将6.8 g KH2PO4溶解于650 mL去离子水中,与190 mL 0.2 mol/L NaOH混合,用1.0 mol/L NaOH溶液调节pH值至7.4,再稀释至1 000 mL,得到SIF。
采用质量法研究了水凝胶球的溶胀行为[13]。取约1 g水凝胶球在37 ℃下的SGF中浸泡2 h,随后再置于SIF中2 h。在预先设定的时间间隔内,取出水凝胶球轻轻拭去多余的水分后,对样品进行称重。计算如公式(2)所示:
溶胀度![]()
(2)
式中:Ws,某时间点的水凝胶球质量,g;Wi,水凝胶球的初始质量,g。
1.2.7 CAPE-HD/PS-PA释放行为研究
将约2 g的载CAPE水凝胶球分成两组,分别置于两个250 mL的带塞锥形瓶中,先在SGF中37 ℃ 100 r/min释放2 h,然后分别转入两份添加和不添加α-淀粉酶(猪胰腺来源,8 U/mL) 的50 mL SIF中,释放2 h。在不同的时间点,取出1 mL释放介质,并加入等量的新鲜释放介质以保持体积不变。所得样品与等体积的乙醇混合均匀后,离心,用紫外-分光光度法检测上清中CAPE的浓度。CAPE累计释放量的计算如公式(3)所示[20]:
CAPE累计释放量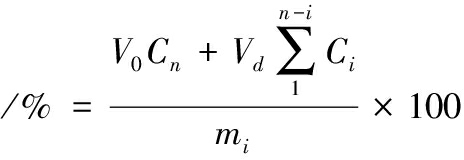
(3)
式中:V0,释放介质的体积,50 mL;Cn,某时间点下释放CAPE浓度,μg/mL;Vd,取出的释放介质体积,1 mL;mi,水凝胶珠中的CAPE的总含量,μg。
1.2.8 统计分析
所有实验至少进行3次,数据以平均值±标准差表示。组间差异性采用t检验分析(P<0.05为显著性差异)。
2 结果与分析
2.1 多孔淀粉微观形貌观察
通过SEM观察不同放大倍数下经不同酶解时间后的多孔淀粉微观形态,结果如图1-a所示。首先,未经酶解处理的对照样玉米淀粉图像显示,淀粉表面相对光滑完整,无孔洞,说明不加淀粉酶的对照样制备过程不影响淀粉的形态。在高倍镜下,对照样的淀粉表面可见细小的裂缝。相比之下,经淀粉酶水解5~8 h的淀粉颗粒,均呈现多孔结构,表面具有多个近圆形微孔。淀粉颗粒内部的无定形层和晶态层的交替产生不同类型的结晶(如A、B和C型),玉米淀粉即属于A类淀粉[10],相比较B型淀粉,A型淀粉中的支链分子分支点更集中的分布于结晶区的特点,决定了A型淀粉易于形成多孔结构,并会表现出“由内向外”的酶解模式[21]。从图1-b的CLSM观察图可以看出多孔玉米淀粉颗粒呈现出内部孔道和空腔的结构,从而形成便于药物或活性物质装载的内部空间。随着酶解时间的延长,淀粉表面水解的孔隙增多增大(图1-a)。5 h的水解时间可能过短,淀粉水解不充分,孔隙的密度和大小程度不够。而7 h,8 h水解后,淀粉颗粒呈现出孔洞之间的消化联通,甚至破损碎裂,这两种情况都不利于药物的包封,根据实验结果和之前的研究报道[10, 22],本文选择酶解时间为6 h的多孔玉米淀粉作为载体材料。

a-不同酶解时间的多孔淀粉SEM观察图;b-酶解6 h多孔淀粉CLSM观察图
图1 多孔淀粉微观形貌SEM和CLSM观察图
Fig.1 SEM and CLSM observations of porous starch micromorphology
2.2 CAPE-HD/PS和CAPE-HD/PS-PA微观形貌观察
根据图2制备了载CAPE的复杂水凝胶体系。将CAPE-HD/PS和CAPE-HD/PS-PA水凝球冻干后,用SEM进行观察,结果如图3所示。图3-a~图3-c为CAPE-HD/PS 的微观形貌,多孔淀粉的形貌与载药前基本一致,证明在水凝胶球的制备过程中,多孔淀粉的结构得到了很好的保持。从图3-a~图3-c可见CAPE与大麦醇溶蛋白很好地形成了纳米颗粒(CAPE-HD),并成功地负载于多孔淀粉的表面和孔隙中,形成CAPE-HD/PS。之前的研究表明,多孔淀粉表面狭窄的孔隙以及多孔淀粉与活性物质之间的氢键,会阻碍纳米颗粒的聚集[15],表明了多孔淀粉对CAPE-HD纳米颗粒的形成和稳定起到了重要的作用。
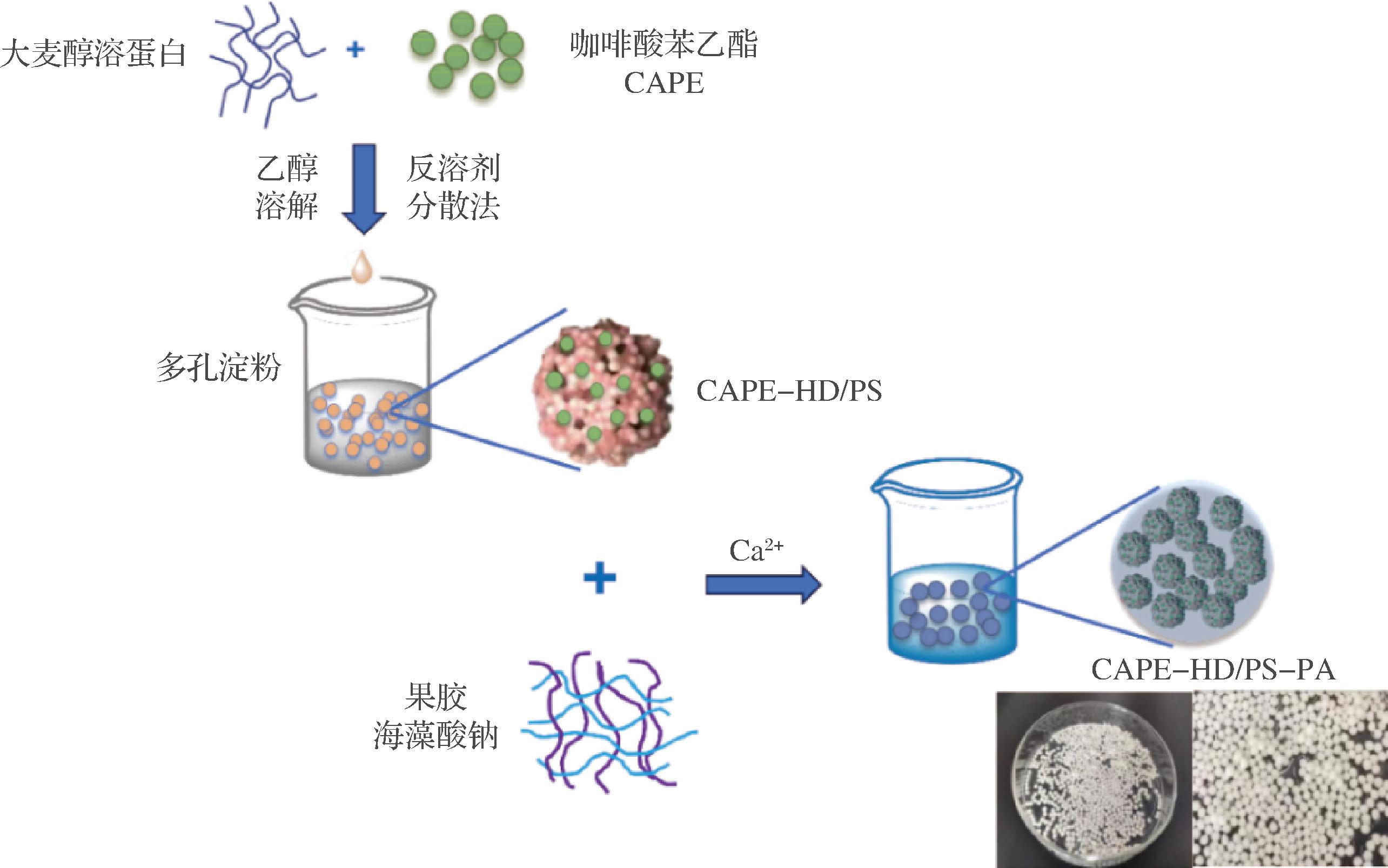
图2 CAPE-HD/PS-PA复杂水凝胶球的制备过程示意图
Fig.2 Schematic diagram of the preparation process of CAPE-HD/PS-PA complex hydrogel beads
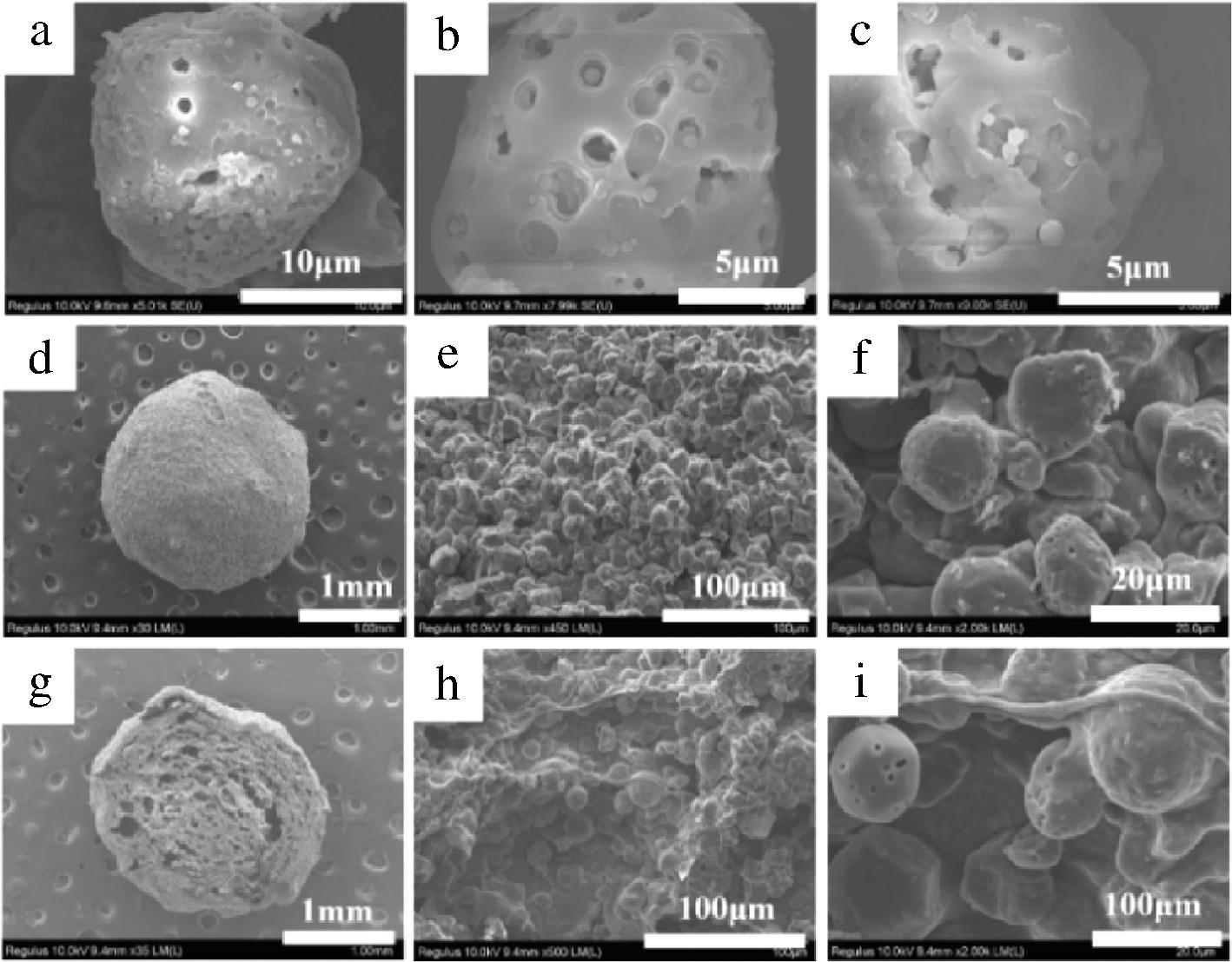
a~c-CAPE-HD/PS;d~f-CAPE-HD/PS-PA水凝胶球;g~i-CAPE-HD/PS-PA水凝胶球横截面
图3 SEM观察图
Fig.3 SEM images
当CAPE-HD/PS包覆海藻酸钠-果胶形成CAPE-HD/PS-PA水凝胶后,如图3-d~图3-f,以及水凝胶球横截面图(图3-g~图3-i)所示,CAPE-HD/PS均匀填充在果胶-海藻酸钠所形成的凝胶网络中,并因为CAPE-HD/PS的填充,CAPE-HD/PS-PA水凝胶球在冻干失去水分后仍然保持着球形的外形和致密的内部结构。本文选用的低甲氧基果胶主要由α-(1,4)糖苷键连接的酯化程度小于50%的半乳糖醛酸残基线性组成,而海藻酸钠由α-L-古洛糖醛酸(G)和β-D-甘露醛酸(M)的线性共聚物通过1,4-糖苷键连接,两者都可由Ca2+通过静电作用连接不同聚合物链中的—COO-形成桥梁,进而形成网络状凝胶[11]。并且有研究表明,海藻酸钠和果胶或卡拉胶等形成的复合水凝胶,相较单组分海藻酸钠水凝胶具有更好的结构稳定性、药物包覆效率和控释行为[13,23]。
2.3 FTIR测试结果分析
如图4所示,游离的CAPE的一个特征峰在3 478 cm-1处,由酚羟基(—OH)伸缩振动产生,1 600 cm-1~1 400 cm-1有多个峰,表明存在多个苯环,1 678 cm-1处出现的峰值是因为CAPE中的C![]() O伸缩振动产生[24]。CAPE-HD/PS和CAPE-HD/PS-PA光谱中3 500 cm-1~3 200 cm-1处的峰,为淀粉、果胶、海藻酸钠等多糖中—OH的伸缩振动,并表明—OH处于缔合状态[10]。1 015 cm-1和1 018 cm-1附近的峰是由于淀粉中C—O键和C—C键的振动引起的,2 930 cm-1附近的波段是淀粉中—CH2—基团的C—H键的不对称伸缩振动的表现,而其附近的肩峰也与分子间的氢键有关[25]。此结果表明,CAPE-HD/PS-PA复杂水凝胶中各组分之间存在氢键等非共价的相互作用力。
O伸缩振动产生[24]。CAPE-HD/PS和CAPE-HD/PS-PA光谱中3 500 cm-1~3 200 cm-1处的峰,为淀粉、果胶、海藻酸钠等多糖中—OH的伸缩振动,并表明—OH处于缔合状态[10]。1 015 cm-1和1 018 cm-1附近的峰是由于淀粉中C—O键和C—C键的振动引起的,2 930 cm-1附近的波段是淀粉中—CH2—基团的C—H键的不对称伸缩振动的表现,而其附近的肩峰也与分子间的氢键有关[25]。此结果表明,CAPE-HD/PS-PA复杂水凝胶中各组分之间存在氢键等非共价的相互作用力。
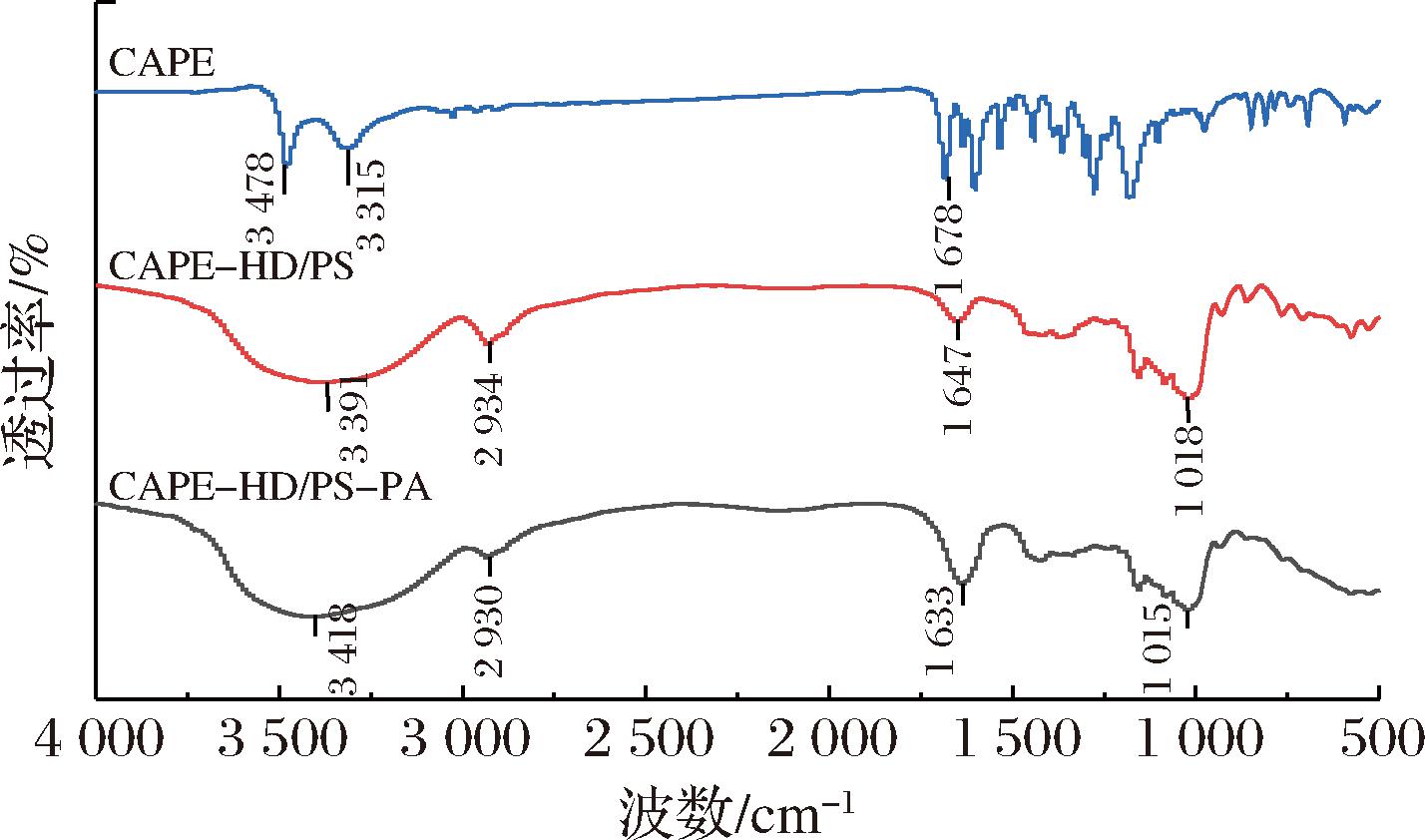
图4 CAPE、CAPE-HD/PS和CAPE-HD/PS-PA的红外光谱图
Fig.4 FTIR spectra of CAPE,CAPE-HD/PS, and CAPE-HD/PS-PA
2.4 XRD测试结果分析
如图5所示,游离状态的CAPE特征峰比较明显。根据文献[26]报道,在 5.0 °与 30.0 °之间均存在尖峰,其中6.5°、18.5°、19.4°、22.5°、26.3°所处的位置都可以看作CAPE的特征峰,表明CAPE具有明显的晶体结构。但在CAPE与大麦醇溶蛋白结合,包埋于多孔淀粉以后,形成的CAPE-HD/PS图谱中未见明显的峰型,这表明各组分之间存在相互作用力,导致晶型发生变化。在CAPE-HD/PS-PA复杂水凝胶体系中,上述CAPE的特征峰同样消失,无明显衍射峰。XRD的表征结果说明在形成CAPE-HD/PS-PA复合水凝胶的过程中,CAPE的晶型结构发生变化,不再以游离状态存在,而是形成了新的结合物。
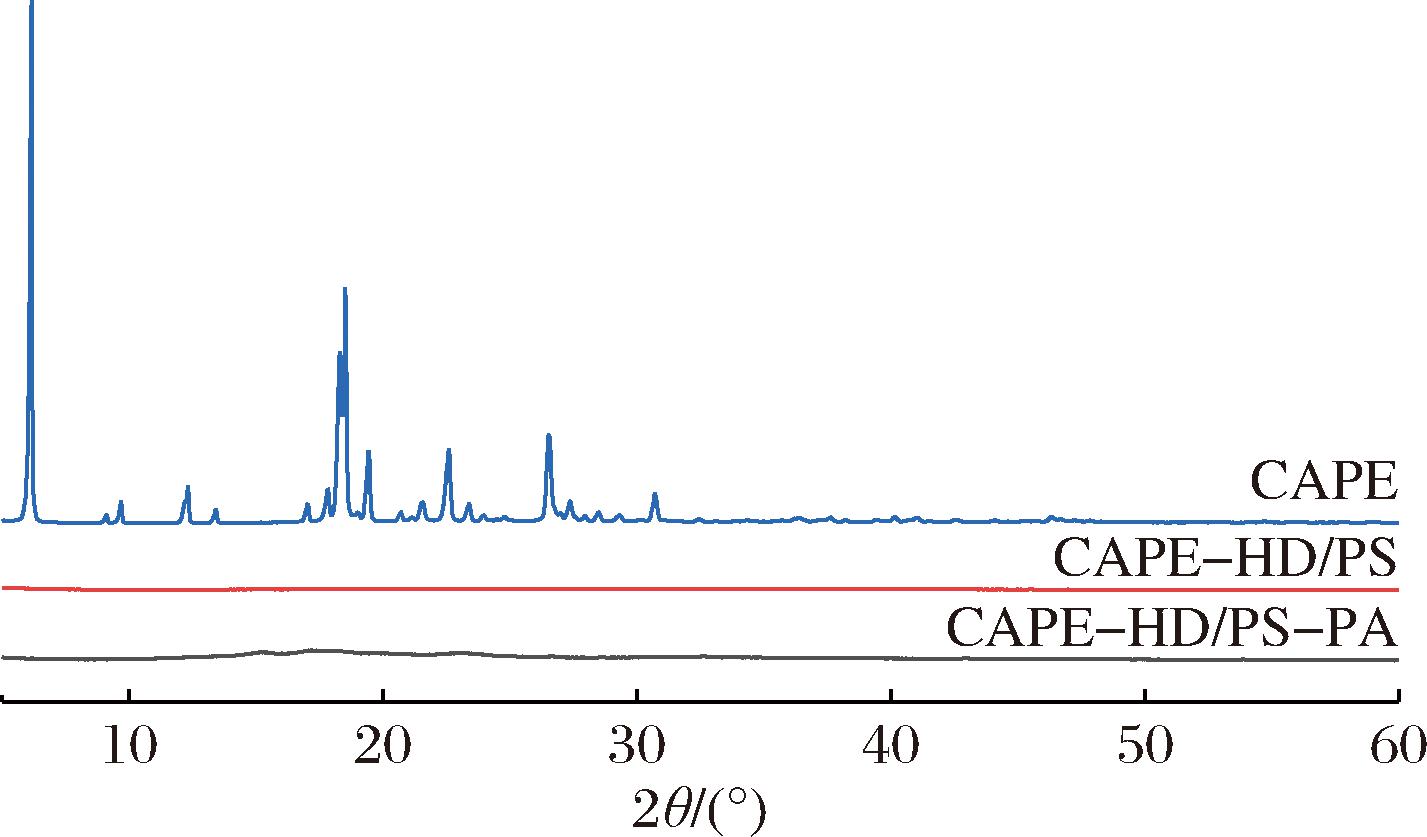
图5 CAPE、CAPE-HD/PS和CAPE-HD/PS-PA的X射线衍射光谱图
Fig.5 XRD patterns of CAPE,CAPE-HD/PS, and CAPE-HD/PS-PA
2.5 DSC测试结果分析
如图6所示,单纯的CAPE在129 ℃处有一个吸热熔融峰,可视为CAPE的特征吸热峰[24],但是和大麦醇溶蛋白和多孔淀粉结合形成CAPE-HD/PS后未见此吸收峰,同样,CAPE-HD/PS-PA中也未出现明显的CAPE特征吸收峰。此研究结果表明CAPE与大麦醇溶蛋白和多孔淀粉已经形成了一种新的复合物,而不仅仅是简单的物理混合。这一结果与前面的FTIR和XRD结果一致,并进一步论证了上述结果,3项检测结果都表明了CAPE-HD/PS-PA新型复杂水凝胶体系的成功制备。
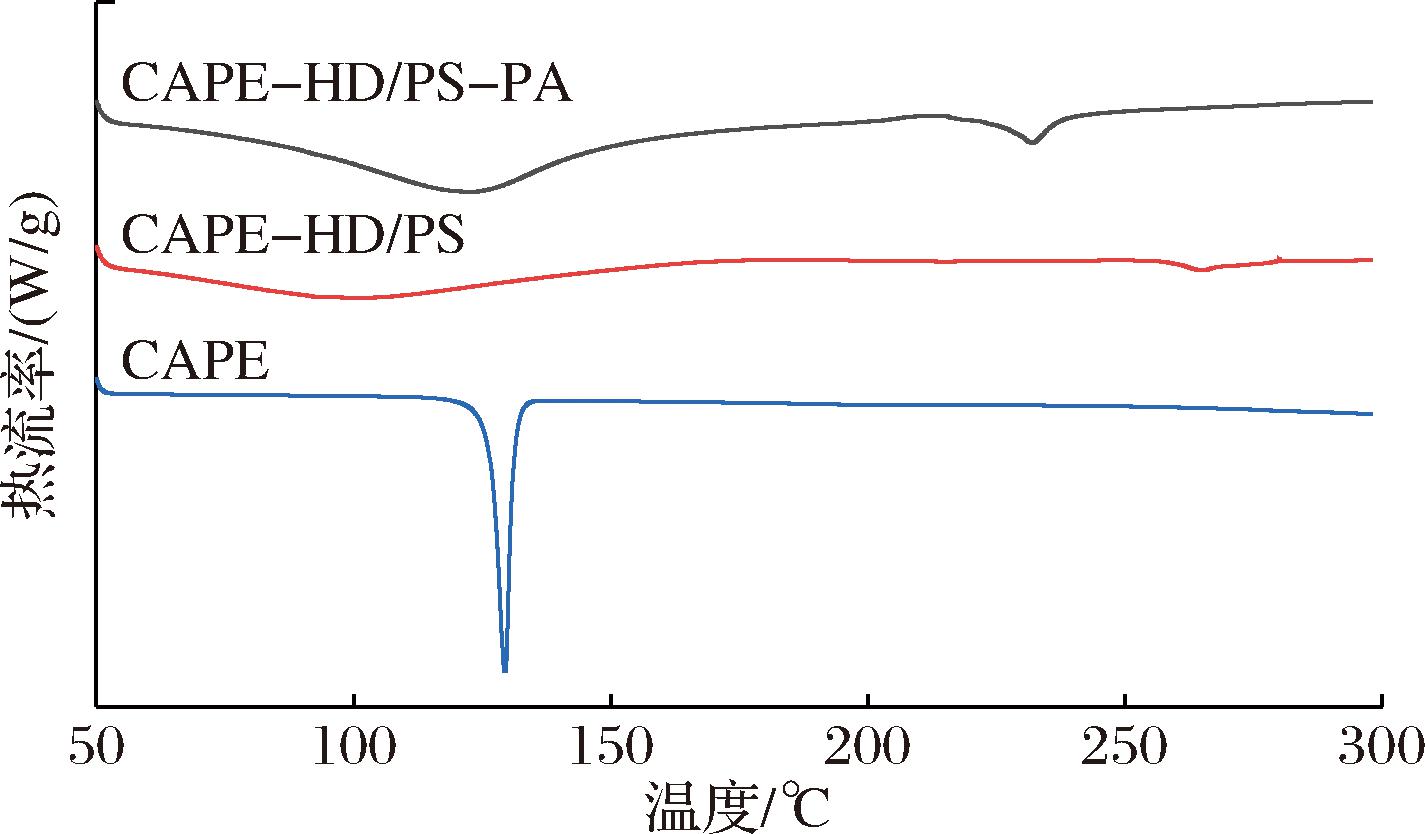
图6 CAPE、CAPE-HD/PS和CAPE-HD/PS-PA的差示扫描量热分析图
Fig.6 DSC thermograms of CAPE,CAPE-HD/PS, and CAPE-HD/PS-PA
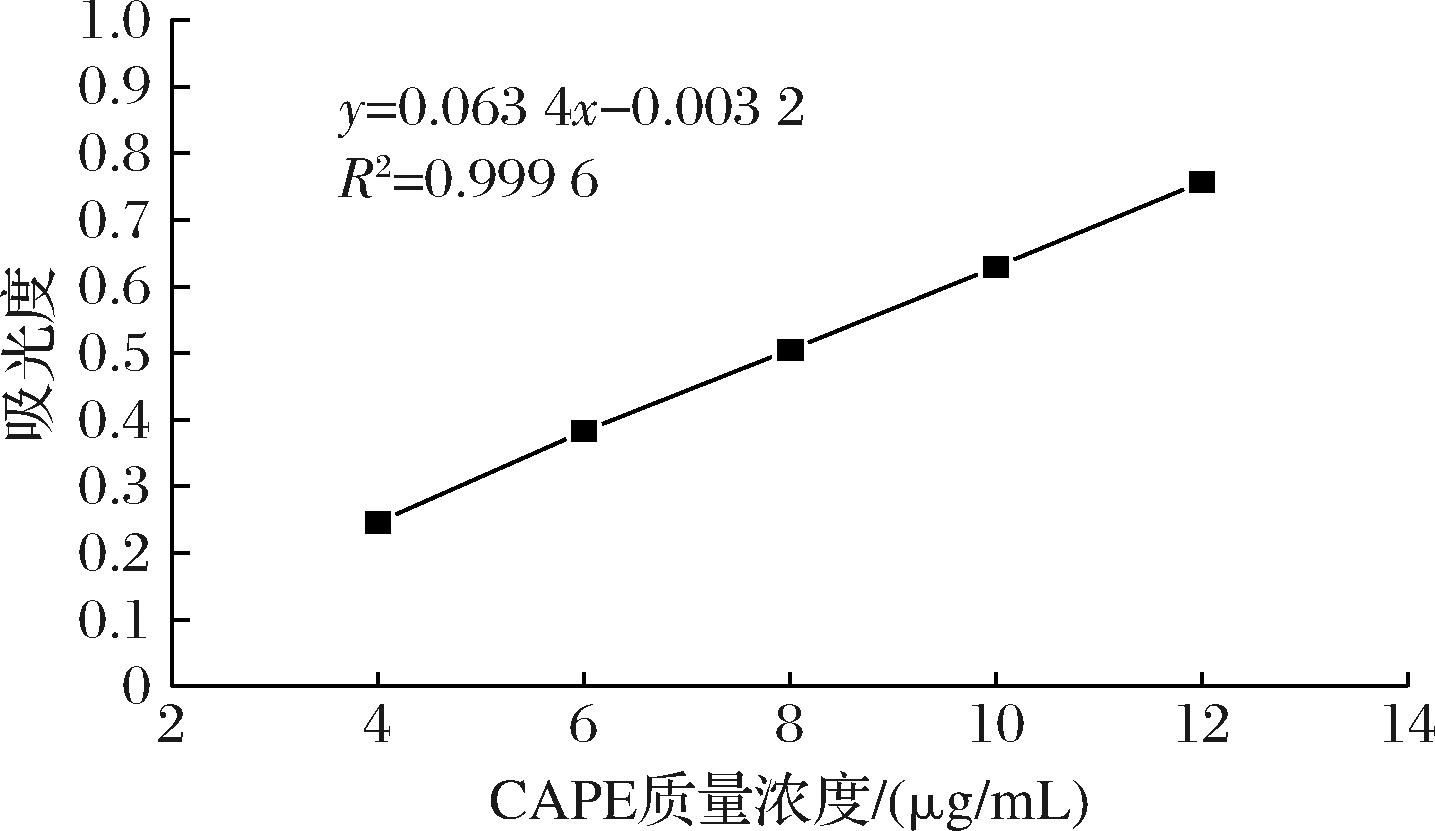
图7 紫外吸光度-CAPE标准曲线
Fig.7 Standard curve of UV absorbance with CAPE
2.6 CAPE的包封率评价
使用紫外分光光度计在323 nm的波长下检测梯度浓度的CAPE样品对应的吸光度,并拟合曲线。得到标准曲线为:y=0.063 4x-0.003 2,R2=0.999 6,标准曲线线性关系良好。
经紫外分光光度法测出制备CAPE-HD/PS-PA水凝胶球滤液中CAPE的浓度后,带入标曲计算出所包封CAPE的质量,并利用公式(1)计算得到CAPE-HD/PS-PA对CAPE的包封率为77.35%±0.64%。此结果说明复合水凝胶体系对CAPE的包封效果良好。靳祖珑等[18]利用燕麦肽对CAPE包封形成的纳米颗粒的包封率为71.71%,之前研究报道中多孔淀粉对难溶性活性物质紫杉醇的包封率为73.92%[15],与本研究的结果基本一致。海藻酸钠和果胶单独形成水凝胶载药体系时,会因凝胶结构的相对松散而导致包封效率不高,而在与其他多糖或聚合物形成复合凝胶时,会获得较为理想的包封效果[13, 27]。因此本研究中果胶-海藻酸钠复合水凝胶体系使得载药系统更加稳定,同时因多孔淀粉的大比表面积的特殊结构有利于药物的有效吸附和包封,使得CAPE-HD/PS-PA水凝胶球对CAPE有着较好的包封效果。此外,此复合水凝胶所用材料均来自于食品,且制备流程简单,制备过程中不引入化学交联剂或有机溶剂,保障了水凝胶载体的安全性和生物相容性,这对口服给药载体的制备,具有重要的意义。
2.7 CAPE-HD/PS-PA溶胀行为研究结果
为了研究水凝胶球在胃肠道的溶胀行为,将适量的CAPE-HD/PS-PA水凝球相继置于SGF和SIF介质中,考察其在胃肠道的溶胀行为。从图8中可看出,在SGF环境中,水凝胶的溶胀率呈现负数形式,说明水凝胶球呈现“收缩”状态。这是因为在低pH环境下,果胶和海藻酸钠中的—COO-质子化成—COOH,形成大量氢键,使交联密度和相互作用力增大,静电斥力减弱,有利于结构收缩。这促进了水凝胶球三维网络结构中水分的流失,导致水凝胶球中的水被排出,最终导致水凝胶载体质量的降低[20]。当将收缩的水凝胶球放入pH值为7.4的SIF中时,由于—COOH的脱质子作用,—COO-的含量增加,增强了果胶和海藻酸钠聚合物链间的排斥力,导致聚合物网络松弛,水从介质中进入凝胶,使溶胀率增加。同时,随着水凝胶球的溶胀,水凝胶球中的Ca2+更容易与Na+交换并与PO43-结合,破坏了凝胶形成的内在动力,这也导致水凝胶球的崩解和溶解[13]。因此,CAPE-HD/PS-PA水凝胶球在SIF迅速溶胀,并从SIF中的第20 min后开始逐渐溶解。实验结果表明,CAPE-HD/PS-PA水凝胶球在胃肠道中呈现出pH响应性溶胀行为,即在胃酸的低pH环境下收缩、在肠道的近中性pH环境下溶胀,此特性对药物的口服递送至关重要,可有效实现在胃液的恶劣pH和酶环境下有效保护药物,而在肠道中控制性释放药物。
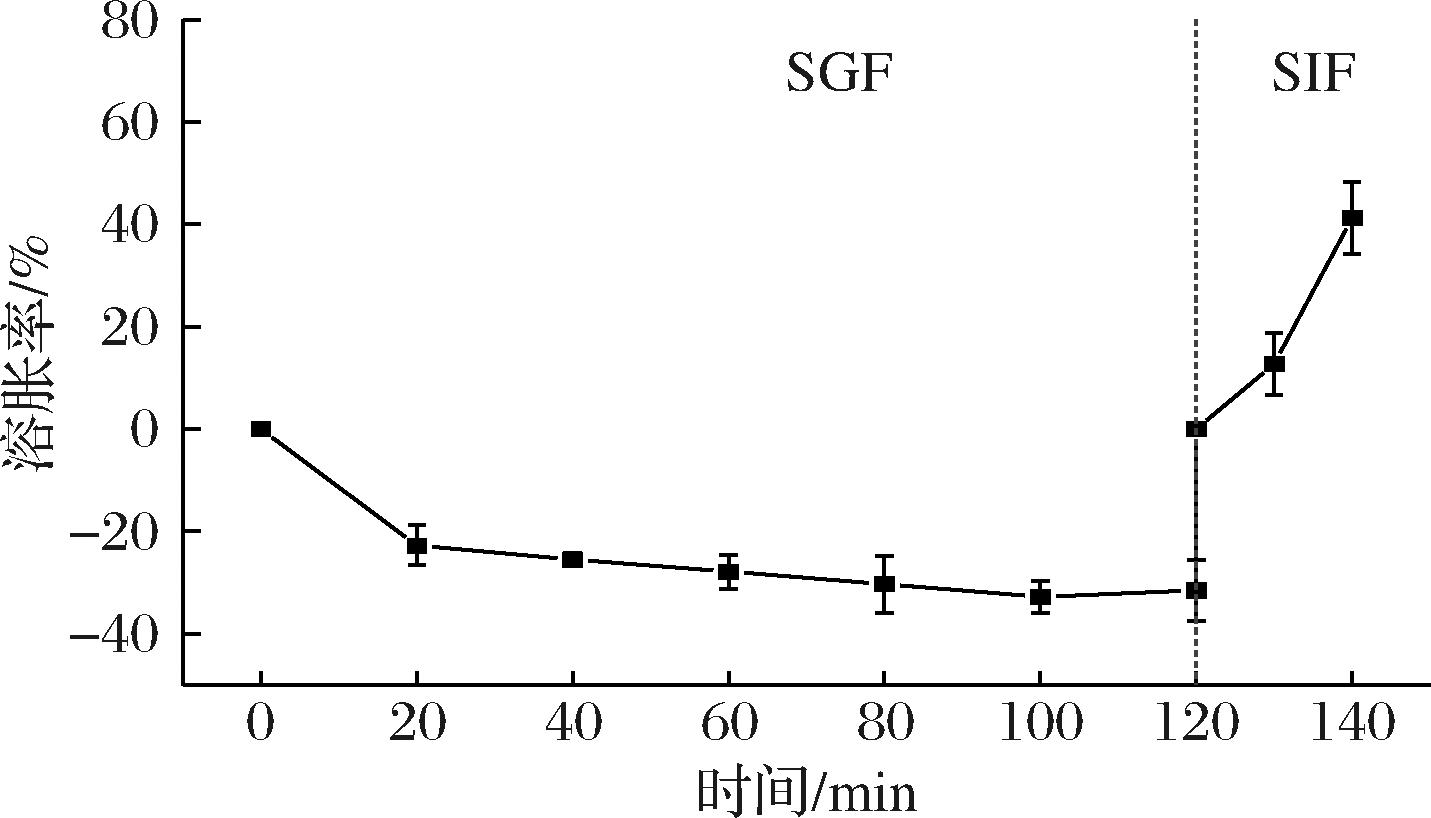
图8 CAPE-HD/PS-PA水凝胶球在模拟胃液和肠液中的溶胀度
Fig.8 Swelling degrees of CAPE-HD/PS-PA beads in SGF (pH=1.2) and SIF (pH=7.4)
2.8 CAPE-HD/PS-PA释放行为研究结果
先在pH=1.2的SGF释放介质中孵育2 h,再置于添加或没有添加α-淀粉酶的pH=7.4的SIF释放介质中孵育2 h,考察CAPE-HD/PS-PA在胃肠道中对CAPE的释放行为,研究结果如图9所示。在SGF环境下,CAPE释放缓慢,2 h累计释放量几乎都小于10%,这是因为水凝球在SGF的酸性环境中皱缩(图8),形成了以果胶和海藻酸钠交联而成的网络,阻碍了药物的释放。相比较之前研究报道中的单纯海藻酸钠水凝胶球在SGF中的释放行为,2 h的药物释放量约在60%~80%[10,13],而本研究中一方面果胶和海藻酸钠的复合水凝胶三维网络较单组分更稳定,另一方面因为多孔淀粉的填充,维持了水凝胶球的完整性(图3-d~图3-i),使得水凝胶球不会因过度“收缩”而将药物“挤压”出水凝胶球[10]。因此,上述两种效应相结合,让CAPE在胃液中随着CAPE-HD/PS很好地被保留在水凝胶的三维网络中。CAPE具有酚羟基的结构,使其在胃液的强酸性条件下会结构不稳定[28-29],而CAPE-HD/PS-PA水凝胶球的保护,为保留CAPE的生物活性、提高CAPE的口服生物利用度提供了保障。在接下来的SIF介质释放中,随着水凝胶球的溶胀及进一步的崩解,CAPE的释放速率增加,在不添加α-淀粉酶时,在2 h内累计释放量超过20%。而在添加α-淀粉酶后,CAPE释放速率进一步加速,2 h后超过了40%,这是由于多孔淀粉被α-淀粉酶逐步水解,CAPE 随着CAPE-HD纳米粒子被进一步释放,显示出α-淀粉酶触发式释放行为。并且,因为果胶和海藻酸钠形成的复合式水凝胶以及多孔淀粉的填充,无论有无α-淀粉酶的存在,CAPE-HD/PS-PA都呈现出对CAPE的可控式缓慢释放,无爆发式释放行为。
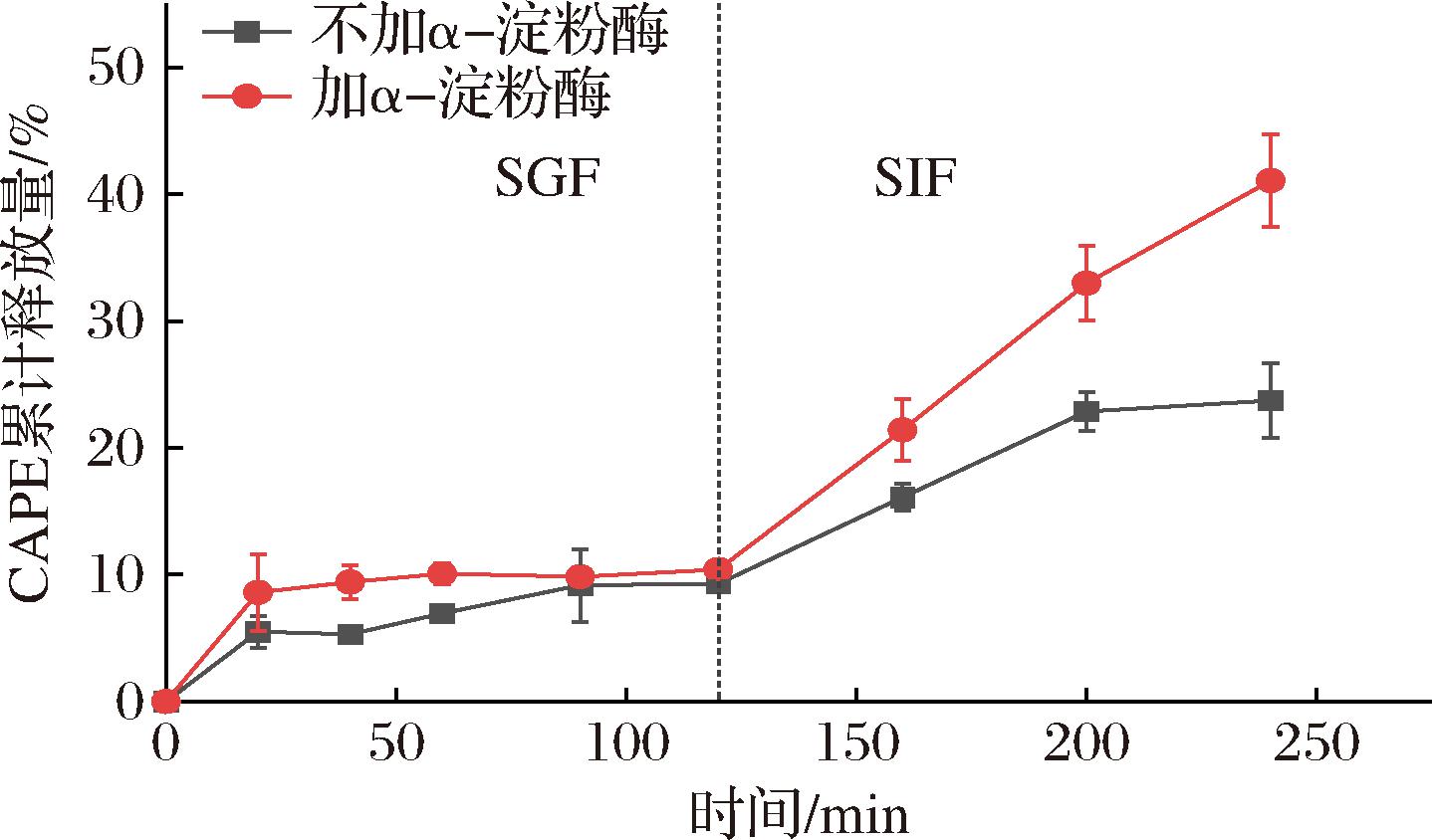
图9 水凝胶球在SGF(pH=1.2)和SIF(pH=7.4)(加酶和不加酶)中的CAPE的累积释放量
Fig.9 Cumulative release profiles of CAPE from beads in SGF (pH=1.2) and SIF (pH=7.4) with α-amylase or without α-amylase
通过果胶-海藻酸钠和多孔淀粉的包封,CAPE-HD/PS-PA水凝胶球实现了CAPE对胃肠道pH和α-淀粉酶的双重响应性释放,在胃液中保护CAPE的同时,在肠道中实现对CAPE控释。另一方面,CAPE是以CAPE-HD纳米颗粒的形式存在的,CAPE-HD/PS-PA加强了CAPE-HD的稳定性,为其屏蔽了胃肠道中的不稳定因素,这为CAPE-HD进一步利用纳米效应进入人体循环提供了可能性。
3 结论
本文制备了一种新型的复杂水凝胶体系,用于包封和口服递送难溶性活性物质CAPE。通过酶解法制备多孔玉米淀粉,再利用反溶剂分散法,将CAPE和大麦醇溶蛋白以纳米颗粒的形式负载于多孔淀粉中(CAPE-HD/PS),并进一步包覆果胶和海藻酸钠的复合凝胶,形成载CAPE复杂水凝胶体系CAPE-HD/PS-PA。CAPE-HD/PS-PA对CAPE的包封效果良好,包封率达到了(77.35±0.64)%。SEM观察发现CAPE-HD/PS 中,CAPE与大麦醇溶蛋白成功地形成了纳米颗粒,并分布在多孔淀粉的表面和孔径内部,且CAPE-HD/PS均匀填充在果胶-海藻酸钠所形成的凝胶网络中。FTIR、XRD、DSC三种测试表明,CAPE-HD/PS-PA中CAPE的存在状态较游离态时发生了变化,组分之间因氢键等非共价相互作用力的连接,形成了一种新的结合产物。水凝胶球具有在胃液中收缩和肠液中膨胀的溶胀特性。释放行为实验表明,CAPE-HD/PS-PA具有对 pH和α-淀粉酶的双重响应性释放行为,实现了在胃液中对CAPE的保护,以及在肠液中触发性控释CAPE,这对提高CAPE口服生物利用度有着重要的意义。
[1] NAI X, CHEN Y R, HAO S Y, et al.Temperature, pH and additives effects on the binding of caffeic acid phenethyl ester to the native state of bovine serum albumin[J].The Journal of Chemical Thermodynamics, 2022, 168:106724.
[2] PAGNAN A L, PESSOA A S, TOKUHARA C K, et al.Anti-tumour potential and selectivity of caffeic acid phenethyl ester in osteosarcoma cells[J].Tissue and Cell, 2022, 74:101705.
[3] KALINOVA R, YORDANOV Y, TZANKOV B, et al.Cinnamyl modified polymer micelles as efficient carriers of caffeic acid phenethyl ester[J].Reactive and Functional Polymers, 2020, 157:104763.
[4] ARMUTCU F, AKYOL S, USTUNSOY S, et al.Therapeutic potential of caffeic acid phenethyl ester and its anti-inflammatory and immunomodulatory effects (Review)[J].Experimental and Therapeutic Medicine, 2015, 9(5):1582-1588.
[5] 魏雪林, 钟艳, 刘雪, 等.疏水性功能性因子纳米包埋体系研究进展[J].食品与发酵工业, 2021, 47(14):300-306.
WEI X L, ZHONG Y, LIU X, et al.Review of hydrophobic functional factor nano-embedding system[J].Food and Fermentation Industries, 2021, 47(14):300-306.
[6] LABIB G.Overview on zein protein:A promising pharmaceutical excipient in drug delivery systems and tissue engineering[J].Expert Opinion on Drug Delivery, 2018, 15(1):65-75.
[7] LAYEK B, MANDAL S.Natural polysaccharides for controlled delivery of oral therapeutics:A recent update[J].Carbohydrate Polymers, 2020, 230:115617.
[8] WEI X L, DAI J, DU Y W, et al.Caffeic acid phenethyl ester loaded in a targeted delivery system based on a solid-in-oil-in-water multilayer emulsion:Characterization, stability, and fate of the emulsion during in vivo digestion[J].Food Research International, 2022, 161:111756.
[9] LIU L, ZHANG Y, YU S J, et al.pH- and amylase-responsive carboxymethyl starch/poly(2-isobutyl-acrylic acid) hybrid microgels as effective enteric carriers for oral insulin delivery[J].Biomacromolecules, 2018, 19(6):2123-2136.
[10] CHEN Y Q, SONG H D, HUANG K, et al.Novel porous starch/alginate hydrogels for controlled insulin release with dual response to pH and amylase[J].Food &Function, 2021, 12(19):9165-9177.
[11] NUR M, VASILJEVIC T.Can natural polymers assist in delivering insulin orally?[J].International Journal of Biological Macromolecules, 2017, 103:889-901.
[12] MENEGUIN A B, SILVESTRE A L P, SPOSITO L, et al.The role of polysaccharides from natural resources to design oral insulin micro- and nanoparticles intended for the treatment of Diabetes mellitus:A review[J].Carbohydrate Polymers, 2021, 256:117504.
[13] LIM H P, OOI C W, TEY B T, et al.Controlled delivery of oral insulin aspart using pH-responsive alginate/κ-carrageenan composite hydrogel beads[J].Reactive and Functional Polymers, 2017, 120:20-29.
[14] SARIYER S, DURANO LU D, DO
LU D, DO AN Ö, et al.pH-responsive double network alginate/kappa-carrageenan hydrogel beads for controlled protein release:Effect of pH and crosslinking agent[J].Journal of Drug Delivery Science and Technology, 2020, 56:101551.
AN Ö, et al.pH-responsive double network alginate/kappa-carrageenan hydrogel beads for controlled protein release:Effect of pH and crosslinking agent[J].Journal of Drug Delivery Science and Technology, 2020, 56:101551.
[15] WANG L L, ZHAO X H, YANG F J, et al.Loading paclitaxel into porous starch in the form of nanoparticles to improve its dissolution and bioavailability[J].International Journal of Biological Macromolecules, 2019, 138:207-214.
[16] LI H T, VAN THI THUY HO, TURNER M S, et al.Encapsulation of Lactobacillus plantarum in porous maize starch[J].LWT, 2016, 74:542-549.
[17] GUAN X, LYU X L, HUANG K, et al.Adsorption of Cu(Ⅱ) ion by a novel hordein electrospun nanofiber modified by β-cyclodextrin[J].International Journal of Biological Macromolecules, 2019, 135:691-697.
[18] 靳祖珑, 冯思怡, 胡亚雯, 等.燕麦耐消化肽纳米载体的制备表征及其对咖啡酸苯乙酯的包埋作用研究[J].食品与发酵工业, 2022, 48(15):169-175.
JIN Z L, FENG S Y, HU Y W, et al.Preparation and characterization of oat digestive resistant peptide nanocarrier and its embedding effect on caffeic acid phenethyl ester[J].Food and Fermentation Industries, 2022, 48(15):169-175.
[19] LI L, JIANG G H, YU W J, et al.A composite hydrogel system containing glucose-responsive nanocarriers for oral delivery of insulin[J].Materials Science &Engineering.C, Materials for Biological Applications, 2016, 69:37-45.
[20] FEKI A, HAMDI M, JABALLI I, et al.Conception and characterization of a multi-sensitive composite chitosan-red marine Alga-polysaccharide hydrogels for insulin controlled-release[J].Carbohydrate Polymers, 2020, 236:116046.
[21] KARIM A A, SUFHA E H, ZAIDUL I M.Dual modification of starch via partial enzymatic hydrolysis in the granular state and subsequent hydroxypropylation[J].Journal of Agricultural and Food Chemistry, 2008, 56(22):10901-10907.
[22] CHEN J H, WANG Y X, LIU J, et al.Preparation, characterization, physicochemical property and potential application of porous starch:A review[J].International Journal of Biological Macromolecules, 2020, 148:1169-1181.
[23] GUO J X, KALETUNÇ G.Dissolution kinetics of pH responsive alginate-pectin hydrogel particles[J].Food Research International, 2016, 88:129-139.
[24] QIN J J, YANG M, WANG Y C, et al.Interaction between caffeic acid/caffeic acid phenethyl ester and micellar casein[J].Food Chemistry, 2021, 349:129154.
[25] L PEZ C
PEZ C RDOBA A, DELADINO L, MARTINO M.Effect of starch filler on calcium-alginate hydrogels loaded with yerba mate antioxidants[J].Carbohydrate Polymers, 2013, 95(1):315-323.
RDOBA A, DELADINO L, MARTINO M.Effect of starch filler on calcium-alginate hydrogels loaded with yerba mate antioxidants[J].Carbohydrate Polymers, 2013, 95(1):315-323.
[26] 秦娟娟. 酪蛋白胶束及其乳液凝胶在咖啡酸苯乙酯递送中的应用[D].兰州:甘肃农业大学, 2022.
[27] ZHANG F L, PEI X J, PENG X X, et al.Dual crosslinking of folic acid-modified pectin nanoparticles for enhanced oral insulin delivery[J].Biomaterials Advances, 2022, 135:212746.
[28] HU B, LIU X X, ZHANG C L, et al.Food macromolecule based nanodelivery systems for enhancing the bioavailability of polyphenols[J].Journal of Food and Drug Analysis, 2017, 25(1):3-15.
[29] JAKOBEK L.Interactions of polyphenols with carbohydrates, lipids and proteins[J].Food Chemistry, 2015, 175:556-567.