溃疡性结肠炎是一种慢性非特异性炎症性肠病,目前临床上主要依靠氨基水杨酸类和糖皮质激素等对其进行治疗,然而这类药物的长期使用会伴随严重的副作用[1]。因此迫切需要设计一种对结肠炎安全有效的给药系统。
表没食子儿茶素没食子酸酯[(-)-epigallocatechin-3-gallate,EGCG]是绿茶中含量最丰富(>40%)的活性成分,具有抗氧化、抗炎、抗肿瘤和保护心脏等生理功能[2]。但EGCG稳定性差及消化前期过快降解是其难以发挥生理活性功能的主要原因之一,因此研究人员尝试利用各类运载体系实现其稳态负载与控释增效[3],但以油包水(water in oil,W/O)高内相乳液(W/O high internal phase emulsions,W/O HIPEs)包埋EGCG实现结肠递送的研究较少,需要进一步研究。
研究表明,壳聚糖是是由几丁质脱乙酰化获得的一种碱性多糖,具有乳化性、无毒性、生物相容性和可降解性等。同时作为自然界少有的阳离子天然聚合物,能与广泛存在的阴离子化合物通过静电相互作用聚集,从而具备优良的物理化学性能,在新兴功能性载体开发应用中潜力巨大[4]。黄原胶是由野油菜黄单胞菌发酵产生的阴离子多糖,因其在温度、pH、盐离子和酶降解等方面表现出良好的稳定性,常被添加到水相中以提高乳液的稳定性[5]。此外相关研究证实黄原胶分子侧链乙酸或丙酮酸上的COO—基团能与壳聚糖的NH3+基团存在电荷相互作用[6],并被用于构建水凝胶[7]、纳米纤维[8]、微胶囊[9]等运载体系,以期实现负载活性成分的缓释。然而,上述体系由于自身的高通透性无法阻止消化环境对负载活性成分的降解破坏,从而难以实现真正意义上的消化稳定与可控释放。而W/O HIPEs的内水相含量≥74%,具有半固态食品的质构特性,其脂肪含量与热量比传统高脂肪食品要低得多[10],且包埋和保护水溶性活性成分的载荷空间更大,是应用于功能性半固态食品和脂肪替代物开发的良好载体[11]。
本研究以W/O乳液为模板,结合蜂蜡(bee wax,BW)油相凝胶因子,并利用壳聚糖与黄原胶静电相互作用在内水相内部形成微囊,探索构建具有囊壳结构(microcapsule-shell structure,MS)的新兴W/O HIPEs运载体系。首次评估其负载EGCG的体外控释特性与对右旋糖酐硫酸钠(dextran sulfate sodium,DSS)诱导的小鼠溃疡性结肠炎模型的功效特性,旨在实现EGCG的结肠递送并更好的发挥其生理功能特性。
1 材料与方法
1.1 材料与试剂
魔芋胶(≥95%),陕西森朗生化有限公司;EGCG(≥98%,E107404),阿拉丁生化科技有限公司;壳聚糖(448869)、黄原胶(G1253)、猪黏液蛋白(M2378)、胃蛋白酶(P7125,≥400 U/mg蛋白质)、胰酶(P1750,4×USP 98规范),脂肪酶(L3126,100~500 U/mg蛋白质),美国Sigma-Aldrich公司;蜂蜡,美国Sky Organics公司;甘露聚糖酶(S27580),上海源叶生物有限公司;牛胆盐(B8210),索莱宝科技有限公司;玉米油,益海嘉里食品股份有限公司;TNF-α、IL-1β、IL-6、IL-10酶联免疫吸附(ELISA)试剂盒,江苏酶免实业有限公司;其他试剂均为分析纯。
1.2 仪器与设备
T18 digital高速分散机,德国IKA公司;827 pH台式pH计,瑞士Metrohm公司;1260LC高效液相色谱仪,美国Agilent公司;MCR302流变仪,德国Anton Paar公司;FEI Quanta 450冷冻扫描电子显微镜,荷兰Quanta公司;HCJ-4A恒温水浴锅,江苏东鹏仪器制造有限公司。
1.3 试验方法
1.3.1 负载EGCG的MS-W/O HIPEs的制备
分别称取2.0 g魔芋胶(konjac glucomannan,KGM)与1.0 g黄原胶(xanthan gum,XG)溶解于100 g蒸馏水中,分别获得质量分数为1.0% KGM溶液与2.0% XG溶液。称取0.5 g壳聚糖(chitosan,CS)溶解于100 g质量分数为0.5%乙酸溶液中获得质量分数为0.5% CS溶液。将1.2 g EGCG粉末(最终在W/O HIPEs的含量2 mg/g)溶解在100 g蒸馏水溶液中获得EGCG溶液。将15 g油相(含0.3 g聚甘油蓖麻醇酸酯与0.6 g BW)预热至80 ℃,随后在4 000 r/min条件下分别加入预热至80 ℃的5 g KGM溶液与10 g EGCG溶液获得EGCG-W/O初级乳液,并冷却至常温。随后EGCG-W/O初级乳液升温至60 ℃,在8 000 r/min、60 ℃条件下缓慢加入5 g XG溶液,随后逐滴5 g CS溶液,并加入适量0.25 mol/L NaOH溶液使其内水相pH值为6,并再次冷却至常温。最后升温至80 ℃,进一步加入KGM溶液直至最终的水相质量分数为75%,并持续剪切2 min,获得具有囊核结构的MS-W/O HIPEs。同时分别按照上述方法,制备不含XG、CS与BW的W/O HIPEs与不含XG、CS的BW-W/O HIPEs作为对照。
1.3.2 微观结构分析
使用冷冻扫描电子显微镜对样品的形貌特征进行观察[12]。先将样品置于涂有导电胶的样品台上,置于液氮中速冻30 s,并在真空状态下将其传输至样品制备室进行升华镀金处理,即得样品微观结构图。
1.3.3 流变学分析
使用流变仪在25 ℃下测定乳液的静态和动态流变学特性[13]。取约2 mL新制备的乳液样品于测试台上,平衡10 min后,使用(pp-50,直径50 mm)平板夹具,测试时平板间距为1 mm,剪切速率范围为0.1~100 s-1,测定其表观剪切黏度变化曲线,并使用幂律模型方程(1)进行拟合:
(1)
式中:η,表观黏度,Pa·s;k,一致性指数,![]() 剪切速率,s-1;n,流态特性指数。
剪切速率,s-1;n,流态特性指数。
然后对乳液进行1~100 rad/s的动态频率扫描,记录其储能模量(storage modulus,G′)和损耗模量(loss modulus,G″)的变化。
1.3.4 模拟体外消化
参照文献[14]中的模拟胃肠道模型并做适当修改,考察负载EGCG W/O HIPEs的胃肠道耐受与吸收特性。为了便于观察在模拟胃肠道消化过程中乳液性质的变化,在制样过程中加入1 mL甲基橙(水溶性pH指示剂)标准溶液,pH变色范围3.1(红)~4.4(黄)。
1.3.4.1 模拟口腔消化
将7.5 g适当稀释的样品与7.5 mL模拟唾液混合。将混合物的pH值调节至6.8,并在37 ℃,100 r/min连续搅拌条件下孵育10 min。
1.3.4.2 模拟胃消化
将模拟口腔消化后的样品与模拟胃液按照质量比1∶1混合。使用NaOH溶液将样品的pH值调节至pH 2,并在37 ℃,100 r/min持续搅拌下孵育2 h。
1.3.4.3 模拟小肠消化
首先用NaOH溶液将模拟胃消化阶段获得的混合物调节至pH 7,分别加入2.5 mL 4.8 mg/mL脂肪酶、2.5 mL 4.8 mg/mL胰酶、3.5 mL 5 mg/mL牛胆盐和1.5 mL模拟肠液。并利用低浓度NaOH溶液使其在小肠消化2 h内pH恒定为7.0。
1.3.4.4 模拟结肠消化
在模拟小肠消化将后模拟小肠消化阶段混合物调节至pH 6.8,加入2.5 mL模拟结肠液,并利用低浓度NaOH溶液使其在结肠消化4 h内pH保持恒定。
1.3.5 EGCG在体外消化各阶段稳定性的测定
参照文献[15]的方法对消化各阶段EGCG含量进行测定。取出适量的消化物,加入二甲基亚砜并通过适当的加热涡旋进行破乳,并使用乙腈进行适当的稀释,使用高效液相色谱仪对EGCG含量进行测定。流动相组成为1%乙酸-乙腈溶液(体积比55∶45),流速1.0 mL/min,样品经0.45 μm滤膜过滤,在30 ℃条件下通过C18柱(250 mm×4.6 mm,5 μm)进行分离,在280 nm记录EGCG色谱信号。
EGCG的保留指数按公式(2)计算:
保留指数![]()
(2)
式中:CInitial,乳液中EGCG的初始浓度;CDigesta,消化阶段后收集的总消化物中EGCG的浓度。
1.3.6 实验分组及结肠炎动物模型的构建
选取7~8周龄,体重22~24 g的雄性C57BL/6小鼠。保持温度(25±1) ℃,相对湿度(50±5)%并执行12/12 h灯光/黑暗循环光周期饲养。适应性喂养7 d后采用随机数字表法分为6组,每组8只,给所有小鼠喂食标准数量。使用DSS进行溃疡性结肠炎小鼠模型的建立,其中正常组(Control)给予不含DSS的蒸馏水14 d,模型组(DSS)、EGCG组(EGCG)、W/O组(W/O)、5-氨基水杨酸阳性药物(5-ASA)组、EGCG-W/O组(EGCG-W/O)给予3% DSS溶液连续7 d,第8天开始饮用不含DSS的蒸馏水,并在余下7 d内每天向Control组、DSS组、EGCG组、W/O组、5-ASA组和EGCG-W/O组分别灌胃0.2 g/kg小鼠体重的蒸馏水、EGCG溶液(100 mg/kg)、不含EGCG的MS-W/O HIPEs、5-ASA溶液(100 mg/kg)以及负载EGCG的MS-W/O HIPEs(EGCG质量浓度为100 mg/kg)。
1.3.7 症状观察及组织分析
每日确定和评价小鼠的3个主要结肠炎症状,包括体重变化、大便性状、便血情况,并记录评分,标准采用疾病活动指数(disease activity index,DAI)[16]。最后采用颈椎脱臼法处死小鼠,剖开小鼠腹腔后分别收集脾和结肠,将脾称重并记录,将结肠段从盲肠下端至小鼠肛门处剪下,测量其长度并记录。
1.3.8 炎症因子测定
利用PBS制备10%结肠组织匀浆,3 000 r/min 离心10 min(4 ℃),取上清液待测。根据ELISA试剂盒说明书对炎症因子TNF-α、IL-1β、IL-6、IL-10进行测定。
1.3.9 数据统计与分析
所有数据均使用SPSS V22.0软件进行分析,以平均值±标准差表示,使用置信区间为95%的最小显著差数法来比较平均值是否存在显著性差异。
2 结果与分析
2.1 MS-W/O HIPEs的制备及微观结构分析
如图1-a所示,W/O HIPEs、BW-W/O HIPEs和MS-W/O HIPEs具有不同的质构特性。其中,W/O HIPEs呈流动态,BW-W/O HIPEs呈半固态,这归因于BW在乳液连续相中形成了包裹分散相的凝胶外壳,进而降低了乳液流动性。而MS-W/O HIPEs呈更高凝胶强度的软固体,这可能是由于BW在形成凝胶外壳的基础上,与壳聚糖与黄原胶发生静电相互作用有关[17]。利用冷冻扫描电镜观察W/O HIPEs、BW-W/O HIPEs和MS-W/O HIPEs的微观结构(图1-b),与W/O HIPEs相比,BW-W/O HIPEs具有更小的液滴且堆积更加紧密,这主要是由于BW在连续相中形成三维网状结构紧密包裹液滴所致。值得注意的是,MS-W/O HIPEs内水相存在近似球形的微球结构,这表明利用W/O乳液模板法成功制备载EGCG微囊,其囊壁由壳聚糖与黄原胶通过静电相互作用沉积形成。

a-表观图;b-冷冻扫描电镜图
图1 W/O HIPEs、BW-W/O HIPEs和MS-W/O HIPEs的表观图和冷冻扫描电镜图
Fig.1 Visual appearance and cryo-SEM micrographs of W/O HIPEs, BW-W/O HIPEs, and MS-W/O HIPEs
2.2 MS-W/O HIPEs流变学特性分析
如图2所示,W/O HIPEs的表观黏度、储能模量(G′)与损耗模量(G″)均较低,且损耗因子(tanδ)>1,呈现典型的黏性流体特征。而BW-W/O HIPEs的表观黏度、G′与G″在整个应力范围与频率范围均显著高于W/O HIPEs,且tanδ<1,样品由黏性主导转变为弹性主导。有趣的是,MS-W/O HIPEs的表观黏度、G′与G″仅略高于BW-W/O HIPEs,且tanδ无明显变化,表明内水相微囊的形成不会显著影响乳液体系的感官质量。通过内水相形成微球以期实现对活性成分的可控释放。WANG等[18]也尝试利用W/O乳液制备聚丙烯酰胺微球用于水溶性5-氟尿嘧啶的负载,并成功实现5-氟尿嘧啶释放在前12 h内的相对稳定。
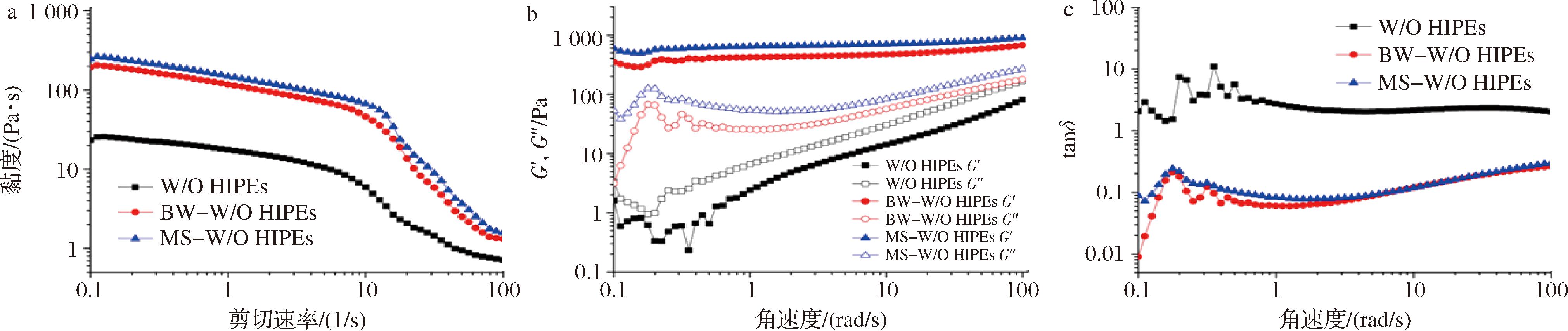
a-表观剪切黏度;b-振荡频率扫描曲线;c-损耗因子
图2 W/O HIPEs、BW-W/O HIPEs和MS-BW-W/O HIPEs的表观剪切黏度、振荡频率扫描曲线和损耗因子
Fig.2 Apparent shear viscosity, oscillatory frequency sweep curves, and loss factor of W/O HIPEs,BW-W/O HIPEs and MS -W/O HIPEs
2.3 MS-W/O HIPEs的消化特性
采用模拟消化模型评价EGCG在不同运载体(EGCG溶液、W/O HIPEs、BW-W/O HIPEs、MS-W/O HIPEs)中的消化稳定性。如图3所示,通过内水相负载亲水性甲基橙pH指示剂可明显观察到:与EGCG溶液相比,W/O HIPEs、BW-W/O HIPEs和MS-W/O HIPEs在胃部无明显变色现象,说明W/O结构可保护包埋活性成分,避免其与胃部接触。经过模拟小肠阶段后,W/O HIPEs的结构被完全破坏,BW-W/O HIPEs和MS-W/O HIPEs仍能保持不同程度的乳液凝胶形态,这主要得益于致密的脂肪晶体网络减弱了外界环境对乳液结构的破坏。PRICHAPAN等[19]也发现米糠硬脂醇形成的脂肪晶体网络能有效改善W/O乳液负载FeSO4的氧化稳定性。模拟结肠消化2 h后,BW-W/O HIPEs已被完全消化为油滴,而MS-W/O HIPEs仍具有较小的凝胶颗粒,直至模拟结肠消化4 h后才被消化殆尽,表明MS-W/O HIPEs具有最高的消化稳定性。
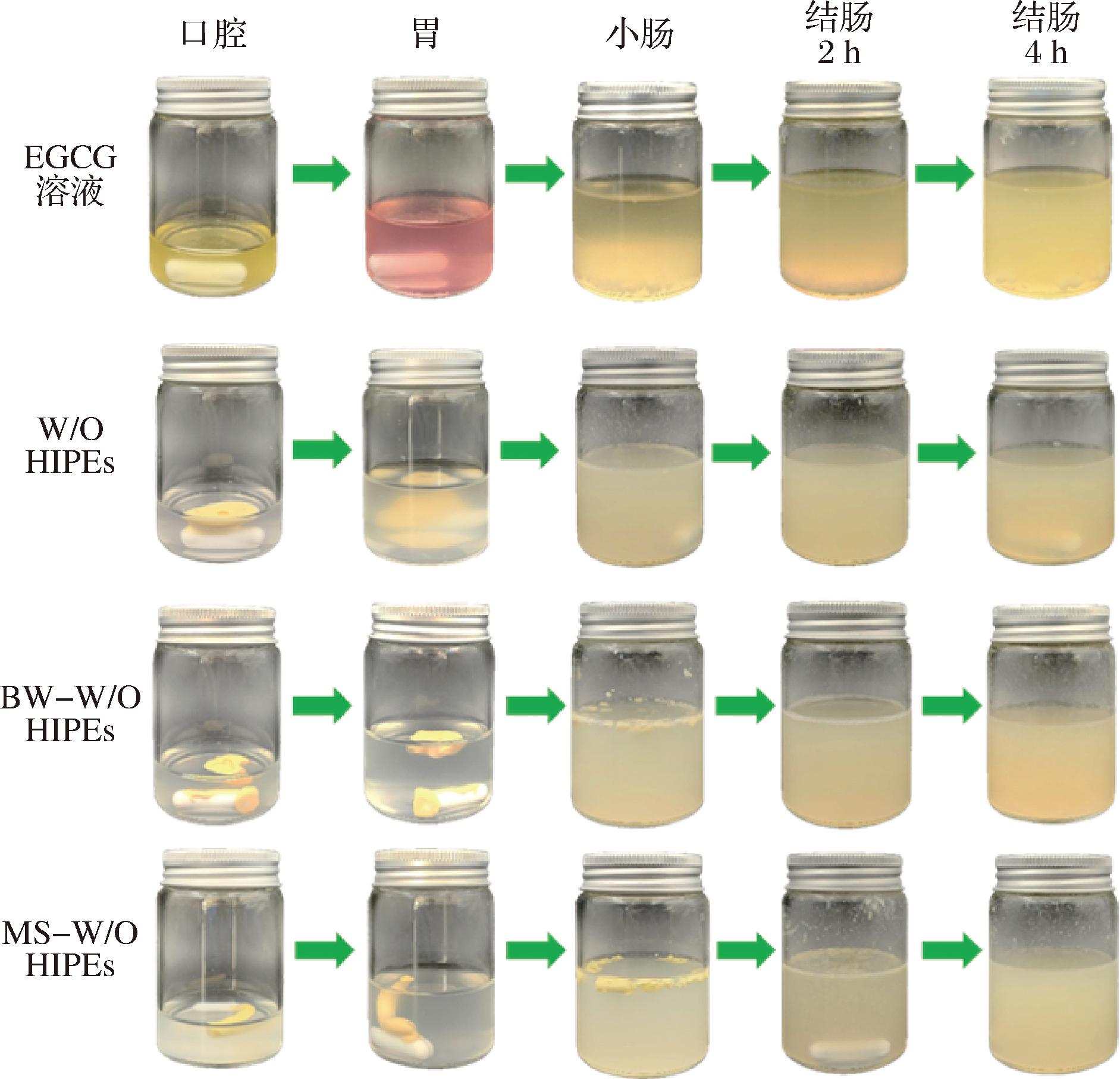
图3 EGCG溶液、W/O HIPEs、BW-W/O HIPEs和MS-W/O HIPEs在每个消化阶段的表观图
Fig.3 Visual appearance of EGCG solution, W/O HIPEs, BW-W/O HIPEs, and MS-W/O HIPEs from each digestion stage
2.4 EGCG的消化稳定性
如图4所示,所有样品负载的EGCG在体外消化过程中均发生不同程度的降解。在模拟口腔消化阶段,所有样品中的EGCG均未出现明显降解,这可能是由于消化时间较短。模拟胃消化结束后,仅EGCG溶液的保留率降至(82.3±4.1)%,而其余样品仍保持95%以上,这可能是由于模拟胃液中不含脂肪酶使得W/O乳液结构很好地阻隔了外部环境对内水相EGCG的影响。在模拟小肠消化后,EGCG溶液中的EGCG降解最为显著,其保留率迅速降至(6.45±1.9)%,并在模拟结肠消化过程中几乎完全被降解。这与ZOU等[20]研究结果一致,主要是由于EGCG的酚羟基在中性条件下易氧化失稳所致。而MS-W/O HIPE在模拟小肠消化后具有最高的保留率,W/O HIPEs、BW-W/O HIPEs、MS-W/O HIPEs在模拟小肠消化后EGCG的保留率分别为(30.4±4.7)%、(56.4±5.5)%、(83.4±4.3)%。
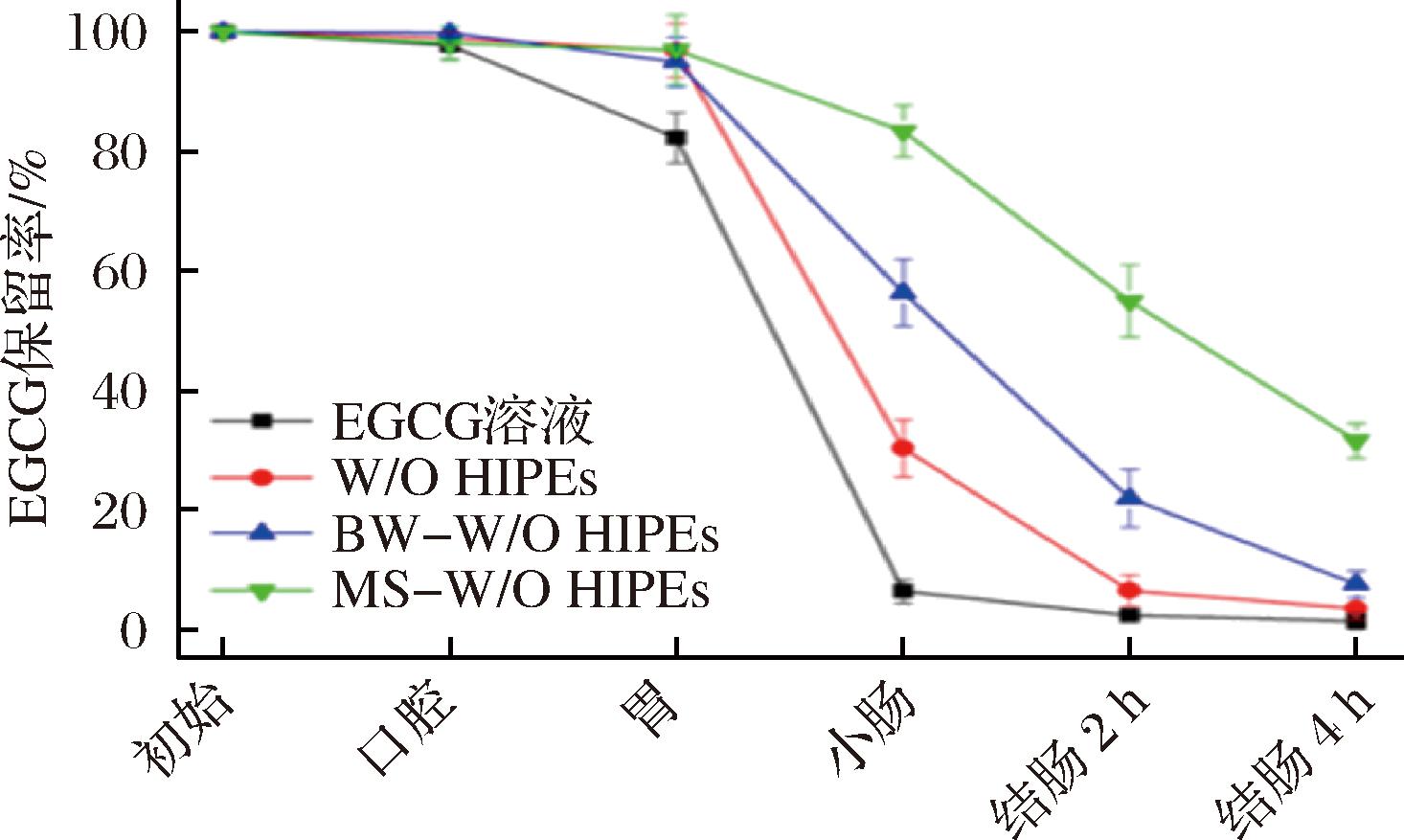
图4 EGCG溶液、W/O HIPEs、BW-W/O HIPEs和MS-W/O HIPEs在每个消化阶段的EGCG的保留率
Fig.4 EGCG retention in the EGCG solution, W/O HIPEs, BW-W/O HIPEs, and MS-W/O HIPEs
2.5 EGCG-W/O HIPEs对结肠炎症状的影响
图5-a对比了灌胃后各组小鼠的质量变化情况,其中Control组的小鼠体重稳定增长,而DSS诱导的其他组小鼠体重在前7 d逐渐下降。DSS诱导的结肠炎往往会导致小鼠体重下降,这与临床症状较为一致[21]。DSS组与W/O组小鼠体重均在第11天达到最低值(P>0.05),这主要与空白载体未负载活性成分有关。而5-ASA组、EGCG组和EGCG-W/O组小鼠体重均在第10天达到最低值,且较DSS组与W/O组小鼠体重下降程度更轻,对结肠炎引起的体重下降具有不同程度的改善作用,其中以第14天EGCG-W/O组与5-ASA组的改善效果最为显著(P<0.001)。图5-b为每组小鼠DAI评分随时间的变化趋势,DAI评分越高代表结肠炎症状越严重。DSS组与W/O组DAI评分在第8天达到最大,随后逐渐减小,而EGCG组、5-ASA组和EGCG-W/O组则在第7天DAI评分达到了最高值,其中5-ASA组和EGCG-W/O组的DAI评分在14 d后显著低于其他处理组。脾脏系数的上升与结肠炎严重程度呈正相关,如图5-c所示,其中Control组为(0.23±0.03)%,此外5组DSS诱导结肠炎模型小鼠的脾脏系数均呈不同程度的上升,而DSS组[(0.59±0.06)%]与W/O组[(0.57±0.04)%]的脾脏系数则显著高于5-ASA组[(0.46±0.03)%]、EGCG组[(0.49±0.03)%]。值得注意的是,EGCG-W/O组[(0.41±0.04)%]最低,表明其对小鼠结肠炎症状改善效果最佳。
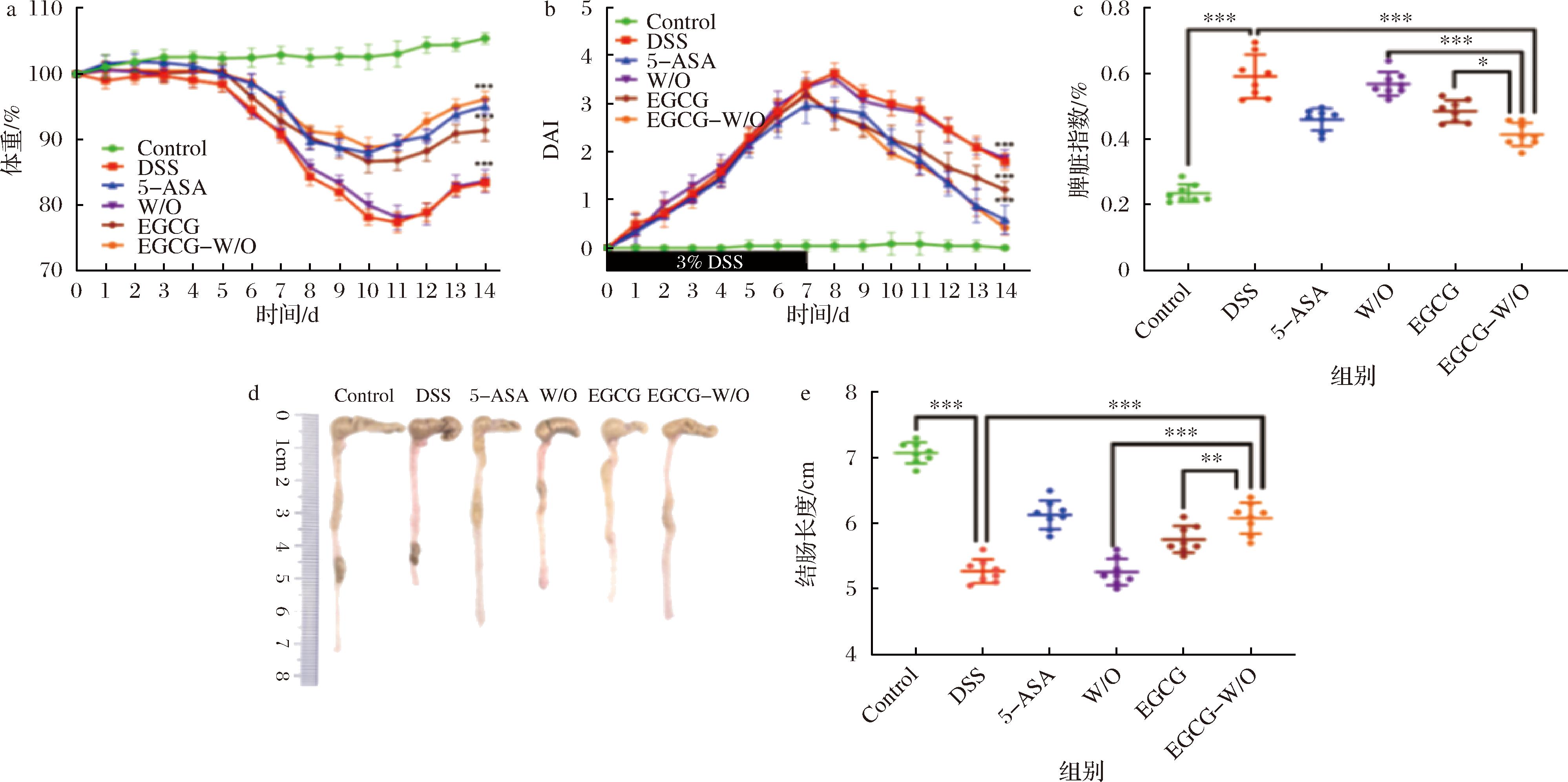
a-体重;b-DAI;c-脾脏指数;d-小鼠结肠代表照片;e-结肠长度
图5 不同处理组对结肠炎症状的影响
Fig.5 Effect of different treatment groups on the symptom of the colitis
注:实验组上方标注的*数量表示不同差异水平,*:P<0.05,**:P<0.01,***:P<0.001(下同)。
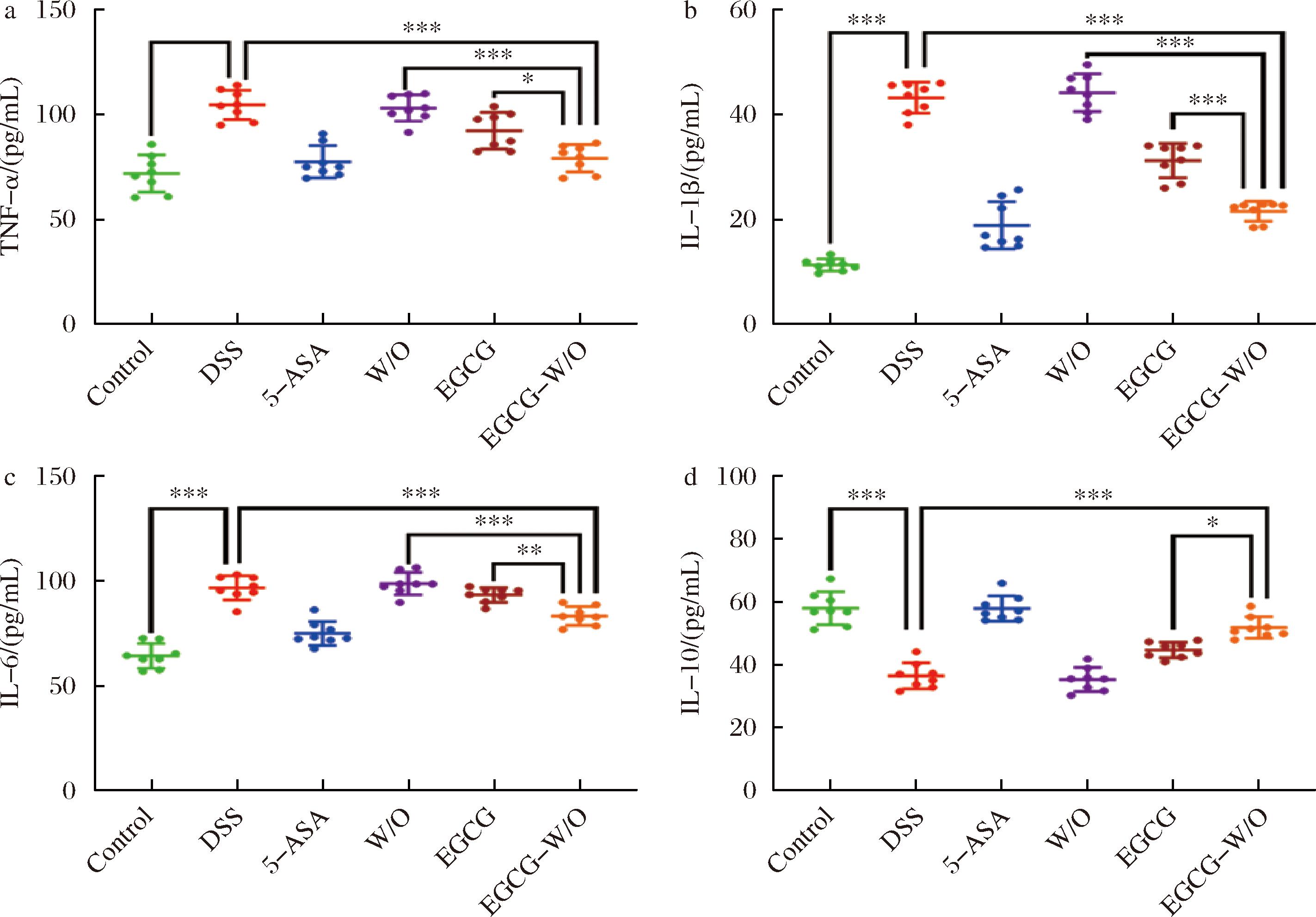
a-TNF-α;b-IL-1β;c-IL-6;d-IL-10
图6 不同处理组对炎症细胞因子的影响
Fig.6 Effects of different treatment groups on inflammatory cytokines
结肠长度与结肠炎严重程度成反比。图5-d显示Control组、5-ASA组、EGCG组与EGCG-W/O组小鼠结肠基本不红肿,而DSS组小鼠结肠与W/O组小鼠结肠相较呈浅红色。如图5-e所示,与Control组[(7.075±0.16) mm]相比,经DSS处理的小鼠结肠长度显著缩短,其结果为DSS组[(5.26±0.18) mm]≈W/O组[(5.26±0.20) mm] 为了评估EGCG-W/O HIPEs对小鼠炎症因子的影响,通过ELISA测定了TNF-α、IL-1β、IL-6和IL-10的含量。如图6-a、图6-b和图6-c所示,DSS组和W/O组小鼠的促炎细胞因子(TNF-α、IL-1β和IL-6)水平均显著高于Control组(P<0.05),而5-ASA组、EGCG组和EGCG-W/O组的TNF-α、IL-1β和IL-6水平均显著降低(P<0.05)。其中EGCG-W/O组的TNF-α、IL-1β和IL-6水平与5-ASA组均无显著性差异,均显著低于EGCG组(P<0.05)。如图6-d所示,DSS组与W/O组的IL-10含量下降最多,分别为Control组的63.0%与61.0%。而EGCG组、5-ASA组、EGCG-W/O组IL-10含量呈现不同程度的回升,分别为Control组的77.1%、99.7%与89.5%。可以看出:与EGCG相比,EGCG-W/O HIPEs可以更有效的减少促炎因子TNF-α、IL-1β和IL-6的表达量并增加抗炎因子IL-10的表达量,进而发挥抗炎作用。GOU等[22]研究表明:相比于EGCG,卵清蛋白组装形成的EGCG纳米粒子具有更强的抑制促炎因子(TNF-α、IL-6、IL-12)表达和促进抗炎因子(IL-10)产生的能力。 本研究利用W/O乳液模板在内水相制备微囊,构建MS-W/O HIPEs,并开展对负载EGCG体外消化和对小鼠结肠炎改善特性研究。结果表明:与W/O HIPEs、BW-W/O HIPEs相比,MS-W/O HIPEs内水相中存在微球结构且具有最高的凝胶强度,在模拟小肠消化后仍能保持一定程度的乳液凝胶形态。与EGCG溶液相比,MS-W/O HIPEs能减缓EGCG在消化过程中的降解速率,具有良好的消化控释性能。此外DSS诱导的结肠炎模型表明,页载EGCG的MS-W/O HIPEs能进一步改善小鼠的体重减轻、结肠红肿和缩短等症状,有效降低促炎因子TNF-α、IL-1β与IL-6的表达并促进抗炎因子IL-10的产生。本研究为合理开发利用W/O HIPEs内水相载荷空间,设计构建新兴食品高内相乳液运载体系具有积极的促进作用,为后续应用于保健食品与膳食补充剂拓宽了设计思路与方法。 [1] SANDBORN W J.Current directions in IBD therapy:What goals are feasible with biological modifiers?[J].Gastroenterology, 2008, 135(5):1442-1447. [2] BRAICU C, LADOMERY M R, CHEDEA V S, et al.The relationship between the structure and biological actions of green tea catechins[J].Food Chemistry, 2013, 141(3):3282-3289. [3] DUBE A, NG K, NICOLAZZO J A, et al.Effective use of reducing agents and nanoparticle encapsulation in stabilizing catechins in alkaline solution[J].Food Chemistry, 2010, 122(3):662-667. [4] CHEUNG R C F, NG T B, WONG J H, et al.Chitosan:An update on potential biomedical and pharmaceutical applications[J].Marine Drugs, 2015, 13(8):5156-5186. [5] SANTOS J, ALCAIDE-GONZ [6] PHAECHAMUD T, RITTHIDEJ G C.Sustained-release from layered matrix system comprising chitosan and xanthan gum[J].Drug Development and Industrial Pharmacy, 2007, 33(6):595-605. [7] ARGIN-SOYSAL S, KOFINAS P, LO Y M.Effect of complexation conditions on xanthan-chitosan polyelectrolyte complex gels[J].Food Hydrocolloids, 2009, 23(1):202-209. [8] SHEKARFOROUSH E, AJALLOUEIAN F, ZENG G H, et al.Electrospun xanthan gum-chitosan nanofibers as delivery carrier of hydrophobic bioactives[J].Materials Letters, 2018, 228:322-326. [9] GONÇALVES A, ESTEVINHO B N, ROCHA F.Microencapsulation of retinoic acid by atomization into biopolymeric matrices:Binary and ternary blends of alginic acid sodium, xanthan gum and modified chitosan[J].Food Hydrocolloids, 2022, 124:107310. [10] ZHANG R X, LI B, WAN L T, et al.Fabrication and characterization of fat crystal-stabilized W/O high internal phase Pickering emulsions (HIPPEs) as a low-fat alternative margarine[J].LWT, 2024, 196:115798. [11] HUANG X N, ZHOU F Z, YANG T, et al.Fabrication and characterization of Pickering high internal phase emulsions (HIPEs) stabilized by chitosan-caseinophosphopeptides nano complexes as oral delivery vehicles[J].Food Hydrocolloids, 2019, 93:34-45. [12] GAO H X, MA L, SUN W X, et al.Impact of encapsulation of probiotics in oil-in-water high internal phase emulsions on their thermostability and gastrointestinal survival[J].Food Hydrocolloids, 2022, 126:107478. [13] MA L, ZOU L Q, MCCLEMENTS D J, et al.One-step preparation of high internal phase emulsions using natural edible Pickering stabilizers:Gliadin nanoparticles/gum Arabic[J].Food Hydrocolloids, 2020, 100:105381. [14] MAO Y Y, MCCLEMENTS D J.Influence of electrostatic heteroaggregation of lipid droplets on their stability and digestibility under simulated gastrointestinal conditions[J].Food &Function, 2012, 3(10):1025-1034. [15] 成策. 食品高内相乳液运载体的构建及其负载活性成分的生物利用[D].南昌:南昌大学, 2022. [16] 李艾欣, 国立东, 于栋华, 等.灵芝多糖对葡聚糖硫酸钠诱导小鼠溃疡性结肠炎的影响[J].辽宁中医药大学学报, 2024, 26(10):40-44. [17] ANA [18] WANG L Y, GAO J P, AN Z L, et al.Polymer microsphere for water-soluble drug delivery via carbon dot-stabilizing W/O emulsion[J].Journal of Materials Science, 2019, 54(6):5160-5175. [19] PRICHAPAN N, MCCLEMENTS D J, KLINKESORN U.Iron encapsulation in water-in-oil emulsions:Effect of ferrous sulfate concentration and fat crystal formation on oxidative stability[J].Journal of Food Science, 2018, 83(2):309-317. [20] ZOU L Q, PENG S F, LIU W, et al.Improved in vitro digestion stability of (-)-epigallocatechin gallate through nanoliposome encapsulation[J].Food Research International, 2014, 64:492-499. [21] ARMUZZI A, LIGUORI G.Quality of life in patients with moderate to severe ulcerative colitis and the impact of treatment:A narrative review[J].Digestive and Liver Disease, 2021, 53(7):803-808. [22] GOU S Q, CHEN Q B, LIU Y, et al.Green fabrication of ovalbumin nanoparticles as natural polyphenol carriers for ulcerative colitis therapy[J].ACS Sustainable Chemistry &Engineering, 2018, 6(10):12658-12667.2.6 EGCG-W/O HIPEs对小鼠炎症因子的影响
3 结论与讨论
 LEZ M A, TRUJILLO-CAYADO L A, et al.Development of food-grade Pickering emulsions stabilized by a biological macromolecule (xanthan gum) and zein[J].International Journal of Biological Macromolecules, 2020, 153:747-754.
LEZ M A, TRUJILLO-CAYADO L A, et al.Development of food-grade Pickering emulsions stabilized by a biological macromolecule (xanthan gum) and zein[J].International Journal of Biological Macromolecules, 2020, 153:747-754.
CHENG C.Fabrication and loaded active ingredients bioavailability of food high internal phase emulsion delivery systems[D].Nanchang:Nanchang University, 2022.
LI A X, GUO L D, YU D H, et al.Effect of Ganoderma lucidum polysaccharides on dextran sodium sulfate induced ulcerative colitis in mice[J].Journal of Liaoning University of Traditional Chinese Medicine, 2024, 26(10):40-44. , MEDAREVI
, MEDAREVI
 , BOJAN
, BOJAN  , et al.Effect of ibuprofen entrapment procedure on physicochemical and controlled drug release performances of chitosan/xanthan gum polyelectrolyte complexes[J].International Journal of Biological Macromolecules, 2021, 167:547-558.
, et al.Effect of ibuprofen entrapment procedure on physicochemical and controlled drug release performances of chitosan/xanthan gum polyelectrolyte complexes[J].International Journal of Biological Macromolecules, 2021, 167:547-558.