魔芋葡甘露聚糖(konjac glucomannan, KGM)[1]是一种源自魔芋块茎的中性亲水性多糖,具有降低血糖和胆固醇、改善肠道微生物菌群等作用[2]。同时还具有优良的成膜性、亲水性和溶胀特性以及可生物降解性,可作为营养补充剂,也可应用于功能食品开发[3]。但KGM制成的食品凝胶强度较差,黏性太大,研究发现KGM主链上约5%~10%的乙酰基可以被去除,以显著增强其凝胶性能,从而得到更光滑、更有嚼劲的脱乙酰魔芋葡甘露聚糖(deacetylation konjac glucomannan, DKGM)凝胶[4]。此外,DKGM热量低,可以增加饱腹感,适合健身爱好者以及控制血糖的人群。因此,DKGM食品在市场上具有巨大的潜力。食品企业通过碱改性生产了多种DKGM凝胶食品,如魔芋粉丝、魔芋豆腐和魔芋仿生食品[1,5]。DKGM食品的生产和应用取得了这些进展。然而,目前仍然存在提高凝胶冷冻后的品质这一关键性问题。因为在冷冻状态下储存和运输这些产品会导致内部结构损伤、水分损失,解冻后凝胶的感官品质变差[6]。这对食品行业构成了重大挑战。因此,提高DKGM凝胶的冻融稳定性势在必行。
明胶(gelatin, GEL),是一种大分子亲水胶体,具有凝胶特性、增稠特性,良好的水结合能力和稳定性,可用于开发功能性食品和提高加工食品的质量[7]。目前已有许多学者将GEL与多糖或蛋白共混,以提高其凝胶特性。有研究表明将草鱼鱼鳞GEL加入到鱼肉中,能够在一定程度上减少冻融对肌球蛋白的破坏[8]。余文杰[9]研究发现,猪皮GEL能有效延缓冷冻面团品质的劣变。基于GEL凝胶性的特点,其也可用于制备稳定性更好的新型凝胶糖果壁材[10]。WANG等[11]发现GEL和壳聚糖制成的复合物具有抗菌、抗氧化等优良的理化性质,可用于食品保鲜。此外,GEL的提取工艺简单,来源广泛,含有蛋白质等营养物质,能够提供人体所需营养元素[12]。但目前将GEL和DKGM制成复合凝胶以改善DKGM冻融稳定性的研究尚未发现。因此,基于GEL的特性和以上其他学者的研究结果,其有望抑制DKGM凝胶因冻融而出现的品质劣变。
本研究以GEL和DKGM为研究对象,混合制备复合凝胶,样品分别经历0、1、3、5次冻融循环,以GEL的添加量作为变量,研究复合凝胶的持水性、质构、流变等性质的变化,通过红外光谱分析、X射线衍射分析和微观结构的观察,初步探究复合凝胶冻融稳定性改善的机理,以期为DKGM凝胶食品的冻融稳定性改善提供一定的理论指导。
1 材料与方法
1.1 实验材料
KGM(纯化度>90%),中国湖北十堰花仙子魔芋制品有限公司;GEL(食品级),中国上海泰坦科技股份有限公司;其余化学试剂均为分析纯。
1.2 仪器与设备
TA-XT plus质构仪,英国Stable Micro Systems公司;DHR-1流变仪,美国TA公司;LGJ-10型冷冻干燥机,北京松源华兴科技有限公司;AXTG16G型离心机,盐城市安信实验仪器有限公司;IRTracer-100红外光谱仪,日本岛津公司;D8 ADVANCE型X射线衍射仪,德国布鲁克公司;DSC 4000差示扫描量热仪,美国铂金埃尔默公司;Phenom Pro扫描电镜,荷兰Phenom World公司。
1.3 DKGM的制备
参考范天琴等[13]的方法并稍作修改。将24 g KGM粉末和720 mL体积分数为30%的乙醇溶液的混合体系在50 ℃下搅拌30 min,然后加入52 ml 0.1 mol/L的NaOH溶液继续搅拌30 min进行脱乙酰反应。反应结束后用30%的乙醇洗脱3次,每次间隔2 h,最后用无水乙醇溶液静置过夜。之后经真空冷冻干燥24 h得DKGM,按LI等[14]的方法测得脱乙酰度为62.57%。
1.4 复合凝胶的制备
参考徐聪[15]的方法并稍作修改。准确称取1 g冷冻干燥后的DKGM粉末和适量的GEL均匀溶解在装有25 mL纯水的烧杯中得复合物溶胶,50 ℃水浴30 min使其充分溶胀,90 ℃水浴1 h,取出冷却至室温得复合凝胶。根据GEL不同添加量分别为0 g、0.1 g(10%)、0.2 g(20%)和0.3 g(30%),把样品分别标记为DK、DK-G1、DK-G2、DK-G3。
1.5 冻融循环
参考YE等[16]的方法并稍作修改。所有凝胶样品在-20 ℃冰箱中冷冻21 h,在25 ℃恒温培养箱中解冻3 h为1个冻融循环。此循环分别再重复0、1、3、5次。
1.6 持水性
根据谢仁香等[17]的方法并做适当修改。冷冻前,将凝胶的原始质量记录为m1,将冻融循环后的所有凝胶样品放入离心管中,然后以5 000 r/min的转速离心10 min。离心后,用滤纸轻轻擦去凝胶表面的水分,并将凝胶质量记录为m2,每个样品重复5次,取平均值。持水率的计算如公式(1)所示:
持水率![]()
(1)
式中:m1,凝胶初始质量,g;m2,凝胶离心后质量,g。
1.7 质构
参考杨悦[18]的方法并稍作修改。用质构仪对样品的硬度、咀嚼性、弹性、内聚性及回复性进行测定,实验参数设定为:TPA模式,P/0.5探头,测试前速度1.5 mm/s,测试中速度1 mm/s,测试后速度1 mm/s,触发力5.0 g,压缩形变量50%,试样每份平行测3次,各测6个点,共18个点。
1.8 流变学分析
1.8.1 频率扫描
参考范天琴等[13]的方法并稍作修改。使用流变仪测定冻融前后不同组分凝胶的储能模量(G′)和损耗模量(G″)随着剪切频率增大的动态流变曲线。测试条件:平板直径25 cm,温度25 ℃,测试间隙1 mm,剪切速率0.1~100 s-1,平衡时间120 s。加载样品后去除平板边缘多余样品,并在平板的边缘涂抹二甲基硅油,防止测试过程中样品的蒸发损失。
1.8.2 温度扫描
使用流变仪测定冻融前后不同组分凝胶的储能模量(G′)和损耗模量(G″)随温度变化的曲线。选择PP 25平板,平板间隙1 mm,应变为0.5%,加载样品后去除平板边缘多余样品,再沿平板边缘涂抹二甲基硅油,防止实验过程中水分蒸发。测试条件:设置温度从20 ℃升至90 ℃,升温速率为5 ℃/min,监测样品G′和G″随温度变化的趋势。
1.9 差示扫描量热法
参考LI等[19]的方法,并稍作修改。称取20 mg冻融后的热不可逆凝胶密封在铝盘中,以空铝盘为参照,使用差示扫描量热仪以5 ℃/min的冷却速率从20 ℃降温至-30 ℃,静置5 min后升温至30 ℃,记录温度变化过程中的热流量曲线。
1.10 X射线衍射分析
参考WANG等[20]的方法,并稍作修改。将经不同冻融循环次数的DKGM凝胶和复合凝胶冷冻干燥。仪器参数为:管电流40 mA,管电压40 kV,Cu靶波长是1.540 6 Å,Co靶波长是1.790 26 Å。在 5°~60°(2θ)范围内,以0.02°的步长测定冷冻干燥凝胶样品的X射线衍射图谱。
1.11 红外光谱分析
参考SU等[21]的方法,并稍作修改。将冷冻干燥的凝胶样品打成粉末后研磨,过100目筛,取5 mg样品与100倍质量的KBr混合研磨成细粉,取适量粉末压片,以空气为背景扫描,设置光谱扫描范围为4 000~600 cm-1,分辨率为32 cm-1。
1.12 扫描电镜
参考CHAROENREIN等[5]的方法,并做适当修改。将冻干的凝胶样品切成0.1 cm厚的薄片,安装在铜支架上用液氮固定并喷金进行观测,记录放大倍数为300倍的图像。
1.13 数据处理与分析
实验重复3次,结果以平均值±标准偏差表示。采用SPSS 26.0对实验数据进行方差分析,Origin 2021b作图。
2 结果与分析
2.1 持水性
持水性是表征冻融稳定性的关键性指标,反映食品冷冻后的水分含量以及食品的品质。如图1所示,未冻融前所有凝胶的持水性能没有显著性差异(99.21%、99.48%、99.74%和100%)。冻融1次后,DK组凝胶的持水率明显下降(96.83±1.32)%,是因为冷冻使DKGM凝胶中分子的运动被限制,相互接触而紧密结合,形成高分子聚集微区和非聚集微区,解冻时非聚集区因凝胶网络被破坏而大量失水[6]。但复合凝胶的持水在冻融1次后已经有了改善,其随着添加量的增加先增后减,DK-G2的持水率最高(99.74±0.45)%。冻融3次和5次后,随着GEL添加量的增加,复合凝胶的改善尤为明显,DK-G3的持水率最高(96.37±0.41)%,(93.93±0.48)%[22]。但DKGM凝胶的持水性最差(83.50±2.06)%,(84.28±0.33)%。以上结果表明GEL的添加能有效改善冻融对DKGM凝胶分子链的破坏,提高DKGM凝胶的持水能力,且在冻融5次时,DK-G3的持水性能最好。
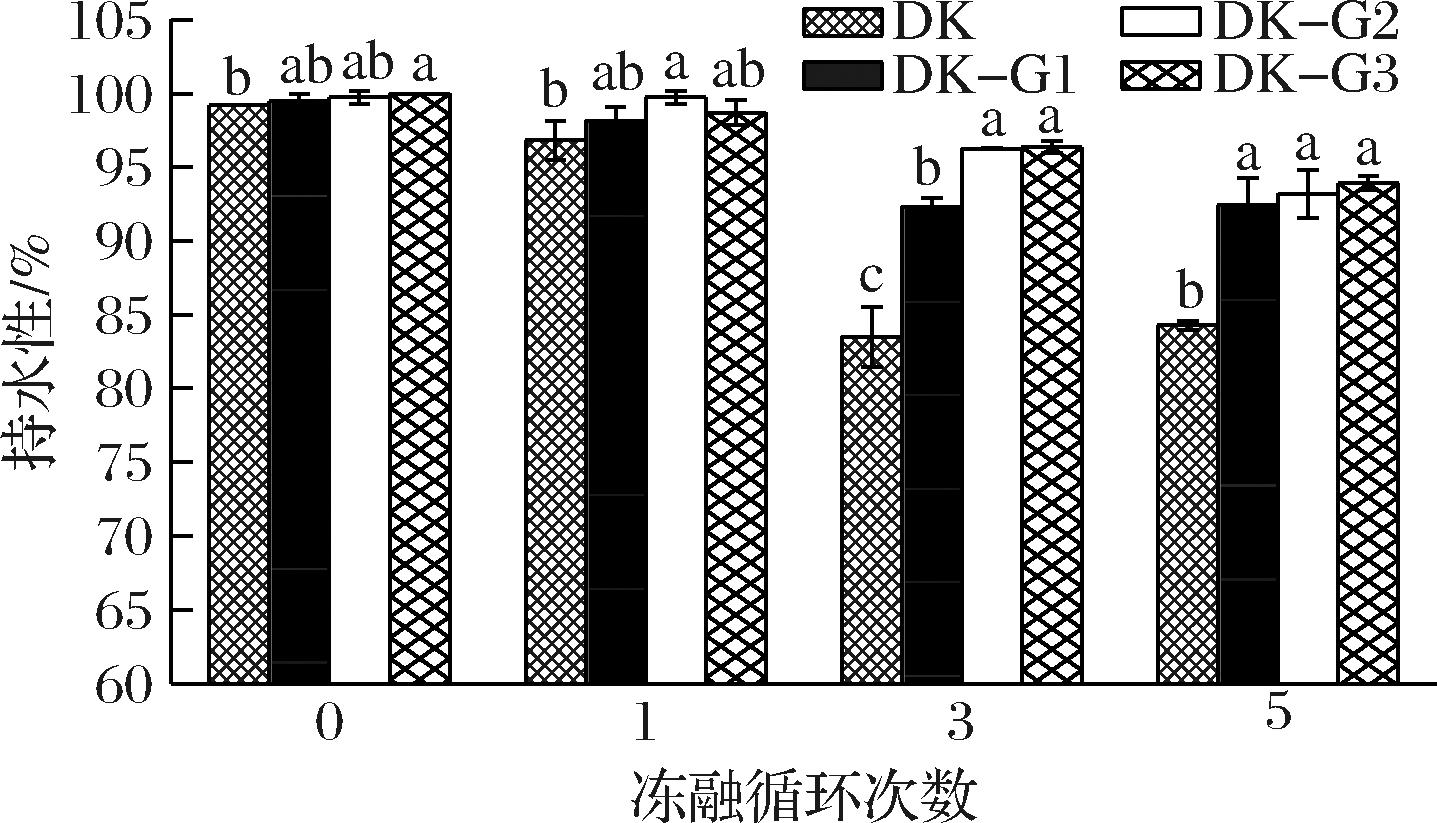
图1 在不同冻融循环下GEL的添加量对DKGM凝胶持水性的比较
Fig.1 Comparison of GEL additions on DKGM gel water holding capcity under different freeze-thaw cycles
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.2 质构特性
质构特性可从多个维度对凝胶品质进行客观评价。GEL的添加对DKGM凝胶的硬度、黏度、弹性以及回复性的影响较为显著。冻融前,DKGM凝胶的硬度最小,硬度值随着GEL的添加量的增加而增大(图2-a)。说明GEL的加入增强了DKGM的凝胶强度。冻融后,DK组的硬度显著增加,在冻融5次时达到最大(2 178.39±47.31) g,可能是冻融导致凝胶水分的流失,致使其硬度增大。添加了GEL的复合凝胶的硬度也明显上升,可能是冷冻使GEL和DKGM结合更加紧密,分子间产生聚集,使凝胶的硬度大大增加[23]。如图2-b所示,冻融前,添加GEL后,DK-G3的黏度明显高于其他组。冻融1次和3次后,DK-G1的黏度最大(322.66±19.24,837.77±105.27),冻融5次后,DK-G2的黏度最大(1 821.72±85.86),这可能是由于冷冻使多糖分子产生缠结,蛋白的加入增加了缠结行为,从而使内聚性增加,因而黏度增大[24]。回复性趋势与黏度相同(图2-d)。弹性与硬度相关,冻融前,弹性随着GEL的添加逐渐减小,可能是GEL维持住了凝胶中的水分,水分含量越多,弹性越小(图2-c)。总的来说,GEL增加了凝胶强度,使其具有更好的口感,同时维持住了凝胶的水分,改善了凝胶的品质。
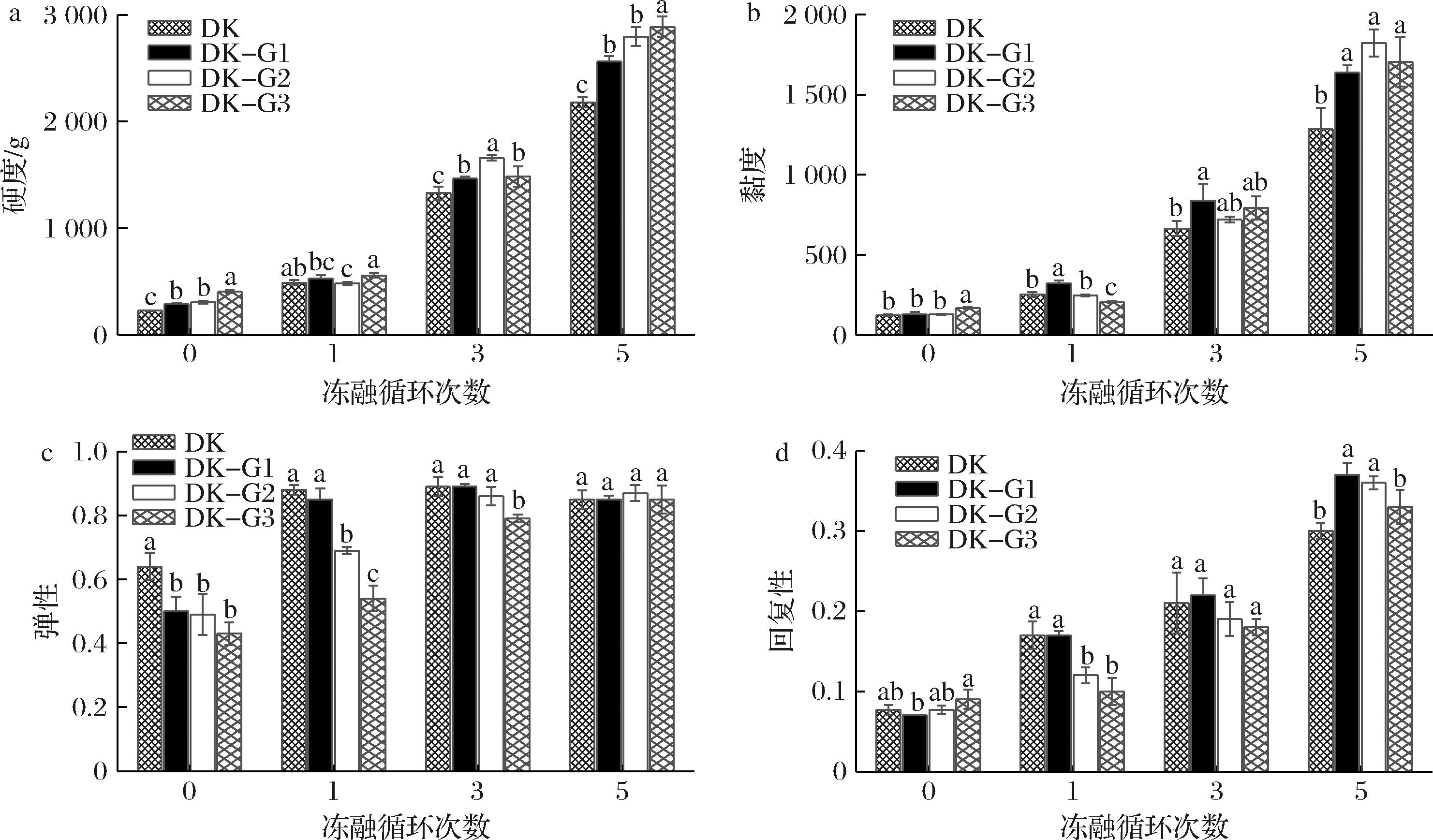
a-硬度;b-黏度;c-弹性;d-回复性
图2 GEL的添加量在不同冻融循环下对凝胶的硬度、黏度、弹性和回复性的影响
Fig.2 Effect of GEL addition on hardness, gumminess, springing, and resilience of gels under different freeze-thaw cycles
2.3 流变特性
2.3.1 频率扫描
凝胶样品冻融循环后的频率扫描如图3所示,G′和G″分别表示凝胶的弹性特性和黏性特性。图3-a~图3-d显示,所有凝胶的G′值均大于G″,表明凝胶的弹性特性均大于黏性特性,且冻融不影响这种性质。如图3-a所示,冻融前,DK的G′值一直小于复合凝胶,这可能是由于GEL的加入增加了复合凝胶的硬度,提升了弹性[25]。冻融1、3和5次后,DK组的弹性特性随着角频率的增加逐渐大于复合凝胶组,且随着GEL添加量的增加,G′值逐渐减小,表明GEL能抵抗冷冻对凝胶弹性产生的影响。而G″值的变化较不明显,仅在冻融5次时初始值明显大于其余冻融组数,这是由于冻融次数的增加使凝胶分子产生缠结,因此黏性特性增加,但随剪切频率增大,G″值也逐渐减小。在图3-a~图3-c中,G″值变化较为平缓,表明角频率对复合凝胶的黏性特性影响较小。
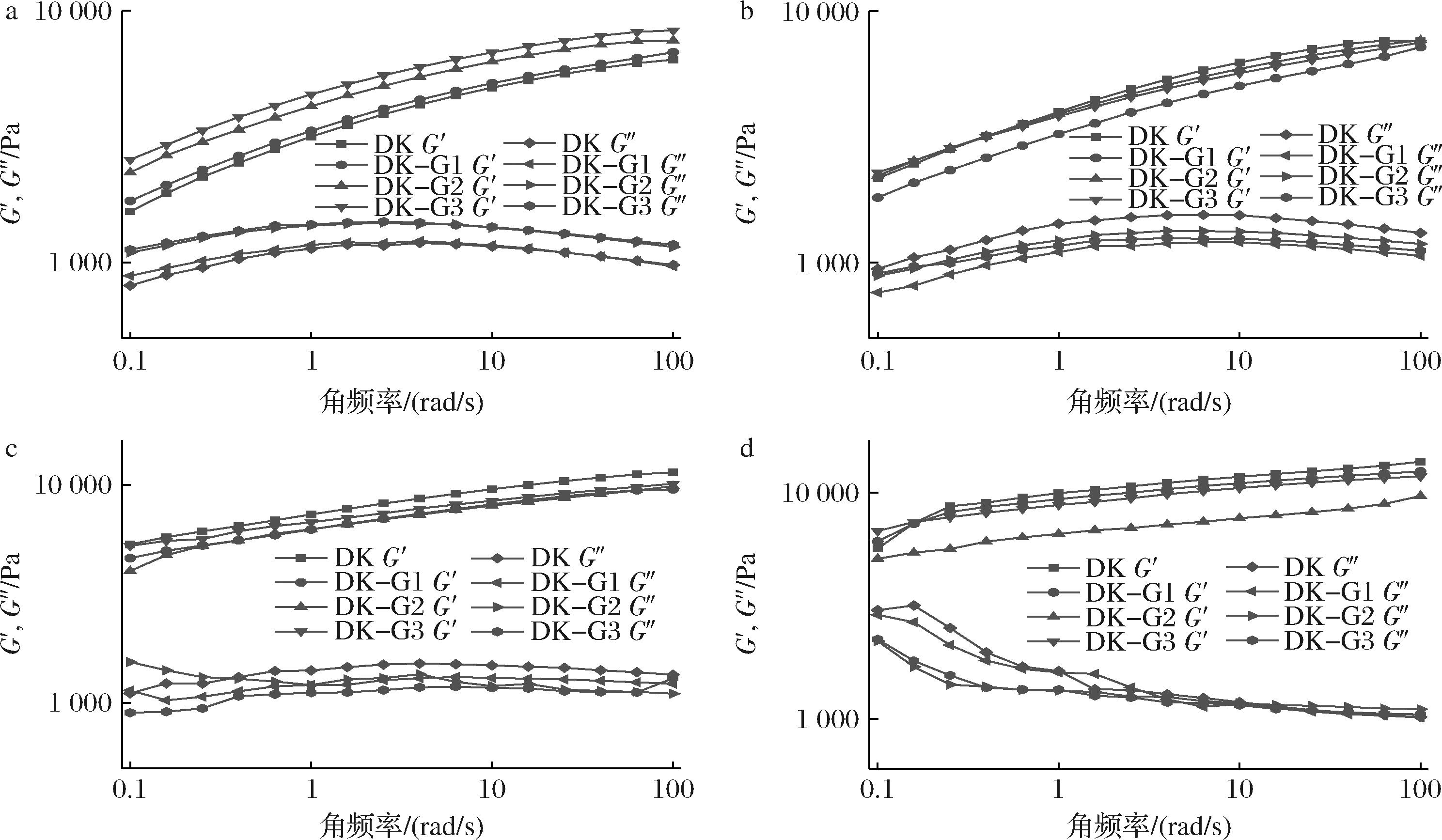
a-冻融0次;b-冻融1次;c-冻融3次;d-冻融5次
图3 复合凝胶在不同冻融循环下的动态频率扫描曲线
Fig.3 Dynamic frequency scanning curves of composite gels under different freeze-thaw cycles
在0.1~100的角频率下得到的G′值和G″值,计算tanδ(G″/G′)值,结果如图4所示,所有凝胶在此频率范围内都表现出类固体状态(tanδ<1)。在冻融0、1、3和5次后,凝胶的tanδ值随着角频率的增大而逐渐减小,冻融1次后,tanδ值也呈现减小的趋势,表明角频率和冻融次数的增加都会使凝胶性质更偏向于固体[16]。在图3-b~图3-d中,DK组的G′值始终大于复合凝胶组,这可能是冻融和角频率破坏了DKGM凝胶分子内部的结构,导致水分子流失,凝胶硬度增加,而复合凝胶本身就具有良好的弹性行为,即使是冻融也并没有影响G′值变化。而在图4-a~图4-d中,DK-G3的tanδ值始终处于最小状态,明显区别于对照组,表明30%添加量的GEL使DKGM凝胶的内部结构更加稳固,再次证明GEL的加入能有效减少凝胶中水分的流失,维持住凝胶的弹性特性[26],此结果与质构结果(图2)相符合。
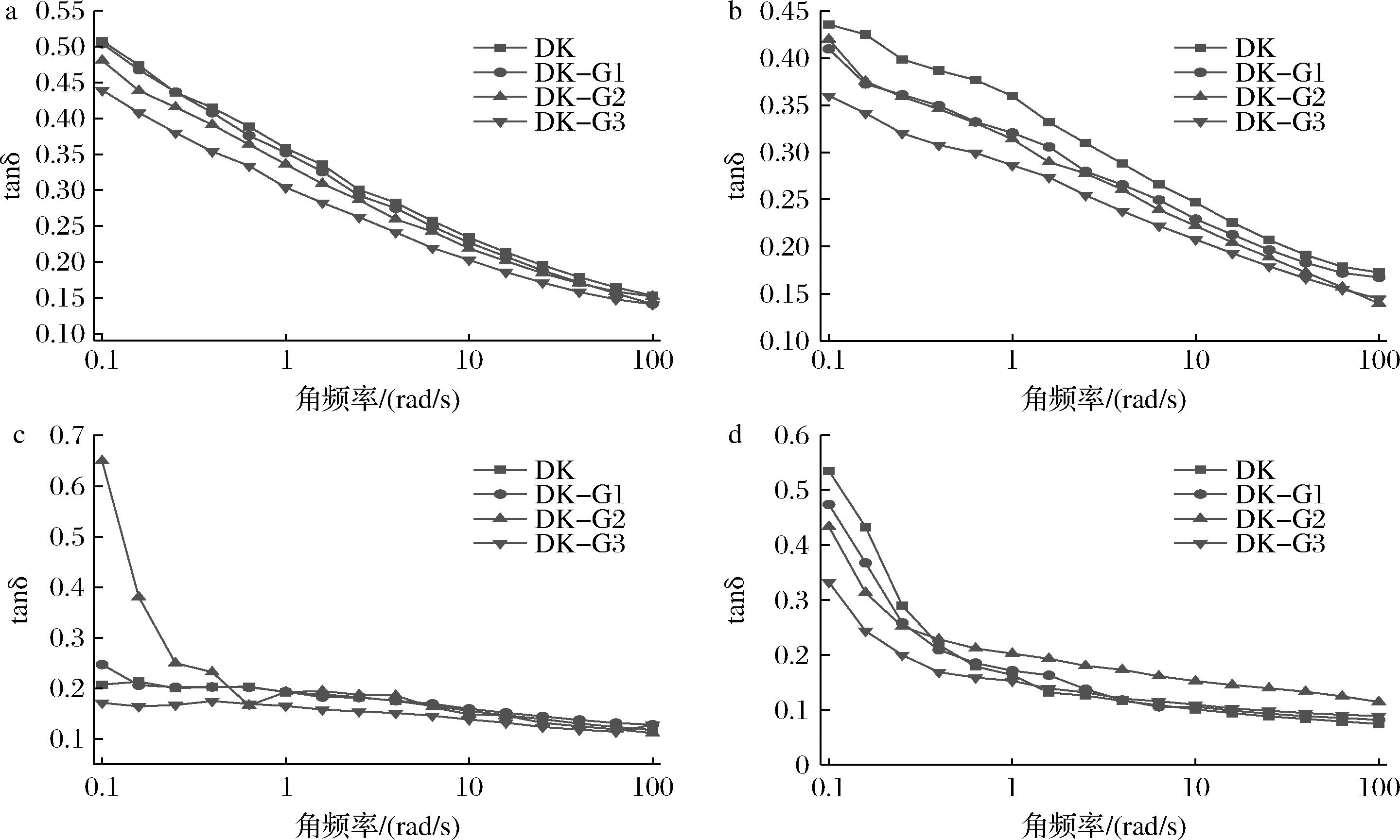
a-冻融0次;b-冻融1次;c-冻融3次;d-冻融5次
图4 复合凝胶在不同冻融循环下tanδ值随着角频率的变化曲线
Fig.4 Variation curves of tanδ value with angular frequency for composite gels under different freeze-thaw cycles
2.3.2 温度扫描分析
为探究温度对凝胶的影响,在20~90 ℃范围内对凝胶进行流变学分析。所有凝胶的G′始终大于G″(图5),说明温度上升不改变凝胶的类固体性质[27]。冻融前(图5-a),DKGM凝胶的G′值随着温度升高先先降后升,表明其弹性特性随着温度的升高而增强。
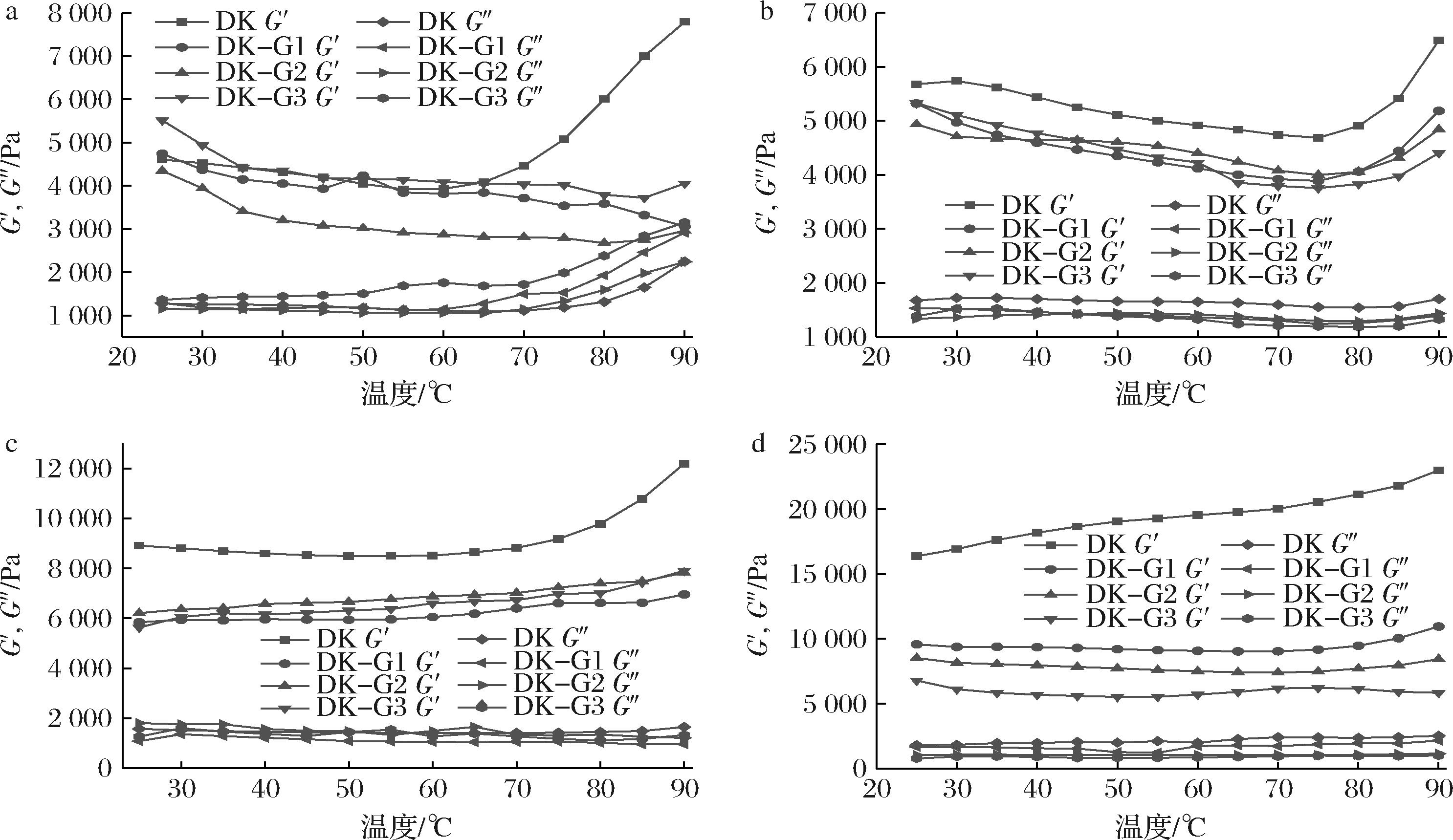
a-冻融0次;b-冻融1次;c-冻融3次;d-冻融5次
图5 复合凝胶在不同冻融循环下的温度扫描曲线
Fig.5 Temperature scanning curves of composite gels under different freeze-thaw cycles
这可能与高温破坏DKGM凝胶的结构,水分流失有关,因而凝胶的硬度增大,弹性特性增加。添加了GEL的复合凝胶在温度变化时G′变化相对平缓,这是由于GEL增加了复合凝胶内部的水分含量,增强了刚性结构,减弱了高温对其内部结构的破坏,维持了其中的水分[16],在温度升高时出现轻微的黏胶状特征。当温度升至70 ℃时,G″值显著上升,因为高温破坏了部分内部结构,从而产生分子间交联,黏性增加。
如图5-b~图5-d显示,DKGM凝胶冻融后G′值随冻融次数增加显著上升,尤其在冻融5次时达最大值,说明冻融严重改变了其的内部结构,伴随着温度的升高,内部结构轻易被破坏,凝胶内部水分流出,硬度增加。而添加了GEL的复合凝胶在冻融和高温下G′值仍然保持相对平稳,冻融5次且添加量为30%时效果最好。这表明GEL有效抑制了冻融和高温对DKGM凝胶内部的破坏,减少了水分流失。这可能因为GEL的加入使复合凝胶内部的某些结构更加稳固,因此升温时凝胶内部的损耗和储能比例发生轻微改变。
2.4 热稳定性分析
所有凝胶样品经历降温和升温,模拟冻融过程得到的热流量曲线(图6)。冻融前(图6-a),在降温过程中,DK组的峰值温度最低(-17.53 ℃),表明DKGM凝胶内的冰晶最少。冻融1次后(图6-b),DK-G1(-17.61 ℃),DK-G2(-18.89 ℃)和DK-G3(-15.16 ℃)的峰值温度均低于DK(-14.75 ℃)组,表明GEL的存在抑制了DKGM凝胶中冰晶的形成,从而显示出了良好的低温保护效果。同时,DK-G1(-224.26 J/g),DK-G2(-227.81 J/g),和DK-G3(-234.18 J/g)的焓值均小于DK(-247.17 J/g)组,说明在此过程中,复合凝胶释放出了更少的能量。冻融3次(图6-c)和5次(图6-d)也表现出相似的结果,复合凝胶的峰值温度和焓值低于DKGM凝胶。在升温过程中,DK-G1(6.15 ℃),DK-G2(6.27 ℃)和DK-G3(6.34 ℃)的峰值温度均低于DK(7.38 ℃)组,表明GEL的存在延缓了冰晶的熔融。此外,DK-G1(254.59 J/g),DK-G2(265.98 J/g),和DK-G3(255.74 J/g)的焓值均低于DK(273.01 J/g)组,表明在此过程中,复合凝胶所需要的能力更少。冻融0次和冻融5次得到的结果与之相似,复合凝胶的峰值温度和焓值均低于DKGM凝胶。
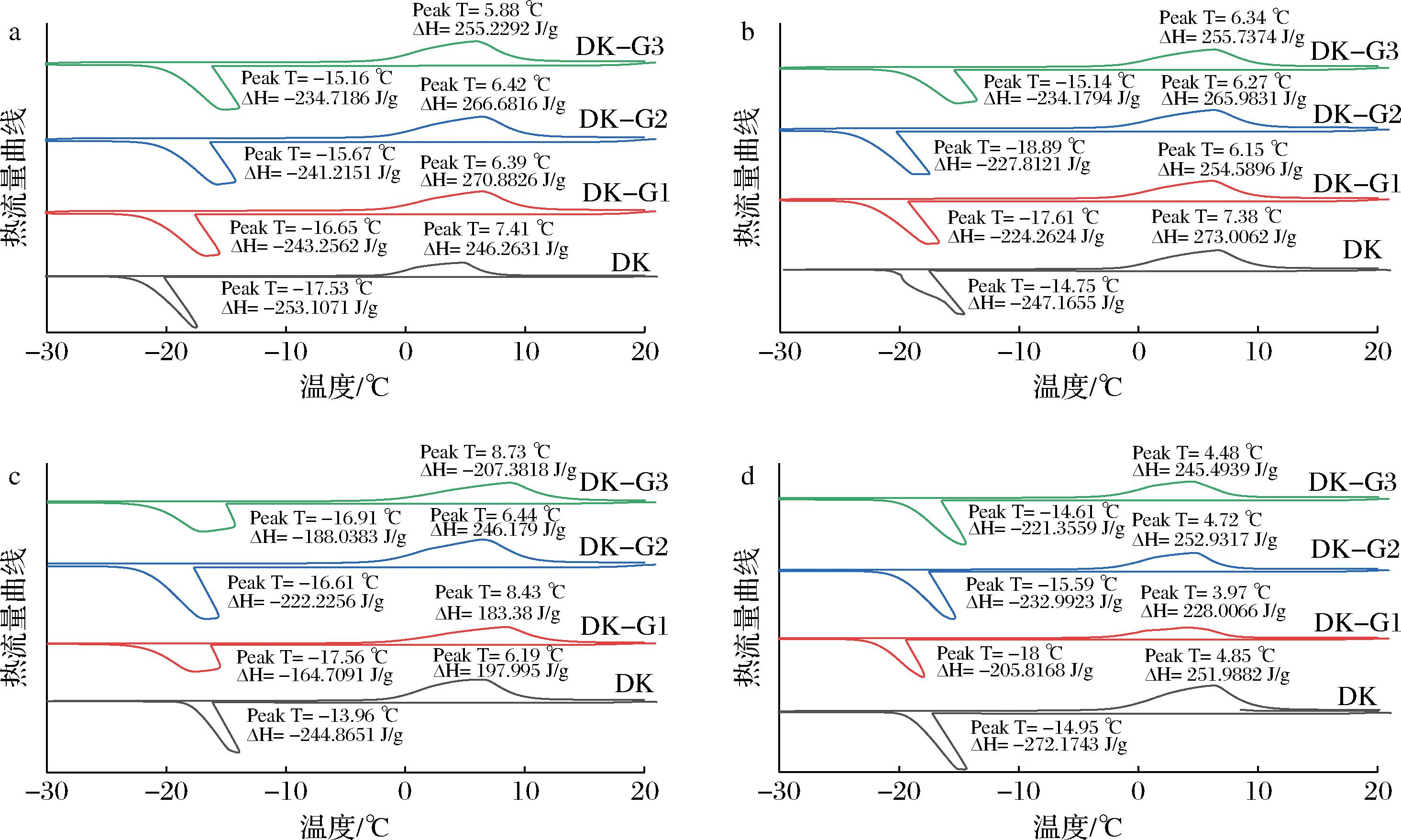
a-冻融0次;b-冻融1次;c-冻融3次;d-冻融5次
图6 GEL在不同冻融循环下对DKGM凝胶热稳定性的影响
Fig.6 Effect of GEL on the thermal stability of DKGM gels under different freeze-thaw cycles
多糖和水在冷冻过程中,温度下降至结晶点后,水开始形成冰晶,非冻结微区的水与多糖发生缔合作用,多糖浓缩于非冻结微区中,而DK组凝胶由于冻融导致凝胶的网络结构被破坏,水分与多糖的相互作用降低,水分子大量析出,凝胶冻结微区中的水分含量增加[28]。复合凝胶中GEL和DKGM分子互作产生交联,形成有序的空间结构,交联物和水分子紧密结合,在冻融的过程中其结构难以被破坏,从而分子内保留了大量的水分,在冷冻的过程中与多糖分子缔合转变成不可冻结水,因而使其峰值温度降低。因此,低添加量的GEL能显著降低DKGM凝胶中的可冻结水的含量,减少降温过程中的能量损失,降低了升温过程中对能量的需求,维持DKGM凝胶中的水分从而保持其冻融稳定性。
2.5 X射线衍射分析
X射线衍射可分析物质的内部结构成分。如图7所示,所有凝胶组分在20°~22°之间有较大的弥散峰,没有明显的特征峰,表明凝胶没有固定的晶型,并且冻融次数对凝胶晶体的形态没有明显改变。未冻融前,DK的峰宽明显大于复合凝胶(图8-a),冻融5次后尤其明显,峰宽变大,说明晶体的晶相变差,晶体一致性较差,这可能是由于冻融对晶体结构产生了破坏。通过MDI jade 6.5软件分析发现冷冻对凝胶分子的结晶度有显著影响。随着GEL添加量的增加,复合凝胶的结晶度逐渐降低,如图8-a~图8-d所示,冻融0、1、3和5次后,DK组的结晶度最大(69.85%、77.48%、60.77%、80.40%),DK-G3的结晶度最小(31.94%、55.51%、21.05%、40.61%)。这可能是因为DK组中的杂晶体较多,因而产生的峰值强度也最大。随着GEL的添加,复合凝胶的峰强变小,结晶度减小,与GEL的添加量呈正比。其次,可能是GEL中的蛋白质与DKGM中的多糖相互交联,与水分子结合能力增强,分子间作用力更加稳定,杂晶体的结晶度随之降低[29]。复合凝胶由于交联产物和水分子紧密结合,结构稳定不易被破坏,结晶度远远小于DK组。以上结果表明GEL的添加能够改变DKGM凝胶的空间网络结构,促进多糖分子和水分子的缔合,改善凝胶的冻融稳定性。
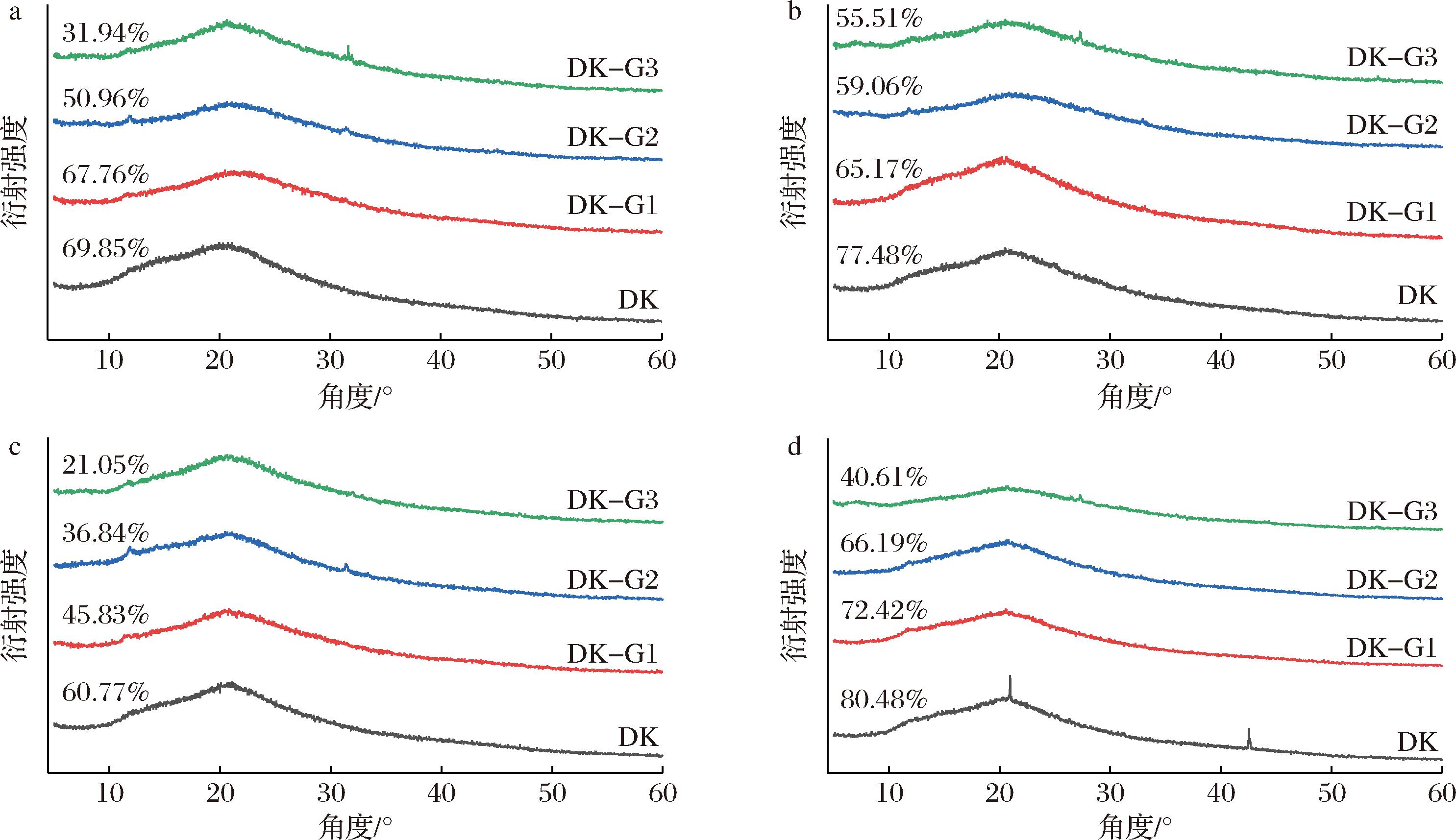
a-冻融0次;b-冻融1次;c-冻融3次;d-冻融5次
图7 GEL对DKGM凝胶冻融循环过程中热流量曲线的影响
Fig.7 Effect of GEL on heat flow curve during freeze-thaw cycling of DKGM gels

a-冻融0次;b-冻融1次;c-冻融3次;d-冻融5次
图8 GEL在冻融循环过程中对DKGM凝胶红外光谱的影响
Fig.8 Effect of GEL on infrared spectra of DKGM gels during freeze-thaw cycles
2.6 红外光谱分析
红外光谱测定通常用于鉴定多糖中的有机官能团以及蛋白质中的二级结构,通过吸收带的移动、吸收峰的增强或减弱来判断基团的变化。1 400、1 600、2 900、3 400 cm-1附近的吸收峰分别是![]() CH2的变形吸收峰,分子内氢键的伸缩振动C—H的伸缩振动和—OH(羟基)的伸缩振动。如图8所示,冻融前后的所有样品均产生了以上吸收峰,表明冻融循环并不会改变DKGM凝胶中特征基团的吸收带位置[30]。但添加了GEL的所有复合凝胶的样品在1 540 cm-1产生了一个微弱的吸收峰,DK组均没有此峰的产生,经历冻融循环后,其吸收峰仍然存在。GEL是一种胶原蛋白,其上可能存在的R基团中含有的N元素与DKGM中的C发生反应,产生C
CH2的变形吸收峰,分子内氢键的伸缩振动C—H的伸缩振动和—OH(羟基)的伸缩振动。如图8所示,冻融前后的所有样品均产生了以上吸收峰,表明冻融循环并不会改变DKGM凝胶中特征基团的吸收带位置[30]。但添加了GEL的所有复合凝胶的样品在1 540 cm-1产生了一个微弱的吸收峰,DK组均没有此峰的产生,经历冻融循环后,其吸收峰仍然存在。GEL是一种胶原蛋白,其上可能存在的R基团中含有的N元素与DKGM中的C发生反应,产生C![]() N,因此复合凝胶在1 550 cm-1附近产生了一个微弱的吸收峰。这一吸收峰的出现可以作为多糖分子和蛋白质分子之间产生交联的证明。此外,未冻融前,DK组和复合凝胶组在3 400 cm-1附近产生的吸收峰面积差别不大,而冻融后,DK-G3组的峰面积略小于DK组,这可能是由于DK组的水分因冻融而流失,导致—OH的振动动收缩变大,而GEL的加入使复合凝胶很好的束缚住了凝胶中的水分,但GEL的存在本身就使凝胶的硬度变大,因此峰面积差异变小。
N,因此复合凝胶在1 550 cm-1附近产生了一个微弱的吸收峰。这一吸收峰的出现可以作为多糖分子和蛋白质分子之间产生交联的证明。此外,未冻融前,DK组和复合凝胶组在3 400 cm-1附近产生的吸收峰面积差别不大,而冻融后,DK-G3组的峰面积略小于DK组,这可能是由于DK组的水分因冻融而流失,导致—OH的振动动收缩变大,而GEL的加入使复合凝胶很好的束缚住了凝胶中的水分,但GEL的存在本身就使凝胶的硬度变大,因此峰面积差异变小。
2.7 微观结构分析
所有凝胶切片在电子显微镜下放大300倍观察(图9),DK组凝胶在未冻融前内部结构排列较为整齐,但孔洞较大且分布不均。复合凝胶组的内部结构呈现层层交联的蜂窝网状,孔洞减小且排列逐渐有序稳定,DK-G1的排列最整齐,也最致密[31]。DK组凝胶经过1、3、5次冻融循环后,孔洞结构发生显著改变,随着冻融次数的增加,凝胶内部空腔变大,冻融5次时最大,束水能力变差。DK-G1组经历1、3、5次冻融后内部结构发生轻微改变,凝胶内部空腔有增大,但依然排列有序,呈现蜂窝网状。DK-G2和DK-G3组经历冻融循环后凝胶内部空腔也有增大的现象,但始终小于DK组,这可能是因为蛋白分子和多糖分子之间产生了致密的交联,形成了稳固的网状结构,因此在冻融时能够维持凝胶中的空隙[32-33]。以上结果表明GEL能改变DKGM凝胶的内部网络结构,30%添加量的效果最好,能使其结构更加致密,在冷冻和解冻的过程中能维持内部网状结构的相对稳定,减少水分的流失。
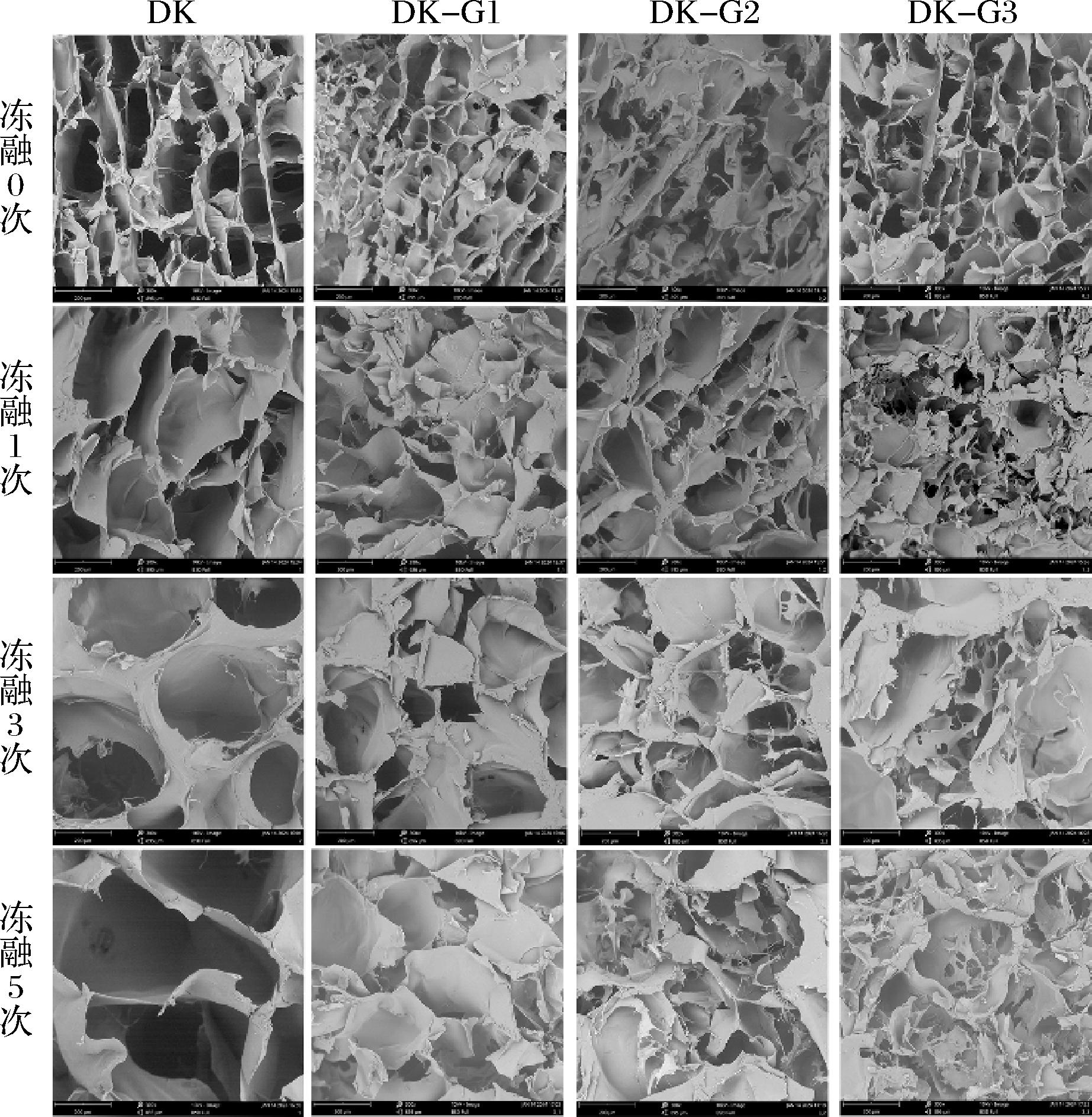
图9 GEL在不同冻融循环下对DKGM凝胶微观结构的影响
Fig.9 Effect of GEL on the microstructure of DKGM gels under different freeze-thaw cycles
3 结论
GEL的添加能够有效改善DKGM凝胶的冻融稳定性,具体表现在:冻融5次时,持水性明显优于对照组;添加量为30%时,改善了冻融过程中质构和流变的劣变;冻融5次,添加量为10%时,显著减少了可冷冻水的产生;冻融5次,GEL添加量为30%时,具有明显的抗冻效果,维持住了凝胶的稳定性以及内部的蜂窝网状结构。总体而言,添加30%的GEL增强了复合凝胶的水结合能力,改善了凝胶的品质,具有明显的抗冻融效果,能够改善冻融5次的DKGM凝胶的品质。但可冷冻水含量增加,抗冻效果减弱。因此,未来的研究可聚焦在添加改性GEL以进一步提高凝胶性食品的抗冻融能力,提高其感官品质。
[1] SONG Q H, WU L L, LI S H, et al.Aggregation of konjac glucomannan by ethanol under low-alkali treatment[J].Food Chemistry:X, 2022, 15:100407.
[2] GAMBOA-G MEZ C I, GUERRERO-ROMERO F, S
MEZ C I, GUERRERO-ROMERO F, S NCHEZ-MERAZ M A, et al.Hypoglycemic and antioxidant properties of konjac (Amorphophallus konjac) in vitro and in vivo[J].Journal of Food Biochemistry, 2020, 44(12):e13503.
NCHEZ-MERAZ M A, et al.Hypoglycemic and antioxidant properties of konjac (Amorphophallus konjac) in vitro and in vivo[J].Journal of Food Biochemistry, 2020, 44(12):e13503.
[3] YE S X, ZONGO A W, SHAH B R, et al.Konjac glucomannan (KGM), deacetylated KGM (da-KGM), and degraded KGM derivatives:A special focus on colloidal nutrition[J].Journal of Agricultural and Food Chemistry, 2021, 69(44):12921-12932.
[4] 高珊珊. 脱乙酰魔芋葡甘聚糖对小麦淀粉糊化和老化特性的影响[D].郑州:郑州轻工业大学, 2022.
GAO S S.Effects of deacetyl konjac glucomannan on gelatinization and retrogradation properties of wheat starch[D].Zhengzhou:Zhengzhou University of Light Industry, 2022.
[5] CHAROENREIN S, TATIRAT O, RENGSUTTHI K, et al.Effect of konjac glucomannan on syneresis, textural properties and the microstructure of frozen rice starch gels[J].Carbohydrate Polymers, 2011, 83(1):291-296.
[6] GENEVRO G M, DE MORAES M A, BEPPU M M.Freezing influence on physical properties of glucomannan hydrogels[J].International Journal of Biological Macromolecules, 2019, 128:401-405.
[7] SAID M I.Role and function of gelatin in the development of the food and non-food industry:A review[J].IOP Conference Series:Earth and Environmental Science, 2020, 492(1):012086.
[8] 祝邹. 草鱼鱼鳞明胶水解物的制备及其抗冻效果的研究[D].南昌:南昌大学, 2020.
ZHU Z.Preparation of grass carp fish scale gelatin hydrolysate and study on its antifreeze effect[D].Nanchang:Nanchang University, 2020.
[9] 余文杰. 猪皮明胶对冷冻面团及其面包品质的影响与机理研究[D].无锡:江南大学, 2020.
YU W J.Effect of pigskin gelatin on frozen dough and its bread quality and mechanistic study[D].Wuxi:Jiangnan University, 2020.
[10] 曹智琨, 王吉祥, 张连正.基于明胶-卡拉胶复合基材的新型凝胶糖果制备及性能研究[J].食品与发酵工业, 2024, 50(16):132-141.
CAO Z K, WANG J X, ZHANG L Z.Preparation and properties of new gel candy based on gelatin carrageenan composite substrate[J].Food and Fermentation Industries, 2024, 50(16):132-141.
[11] WANG H X, DING F Y, MA L, et al.Recent advances in gelatine and chitosan complex material for practical food preservation application[J].International Journal of Food Science &Technology, 2021, 56(12):6279-6300.
[12] WU J T, XIAO J, ZHU M Y, et al.Study of physicochemical and gelation properties of fish gelatin from different sources[J].Applied Sciences, 2023, 13(9):5337.
[13] 范天琴, 覃小丽, 谢勇, 等.氧化魔芋葡甘露聚糖对脱乙酰魔芋葡甘露聚糖凝胶特性的影响[J].食品与发酵工业, 2023, 49(22):251-257.
FAN T Q, QIN X L, XIE Y, et al.Effect of oxidized konjac glucomannan on gel properties of deacetylated konjac glucomannan[J].Food and Fermentation Industries, 2023, 49(22):251-257.
[14] LI Y, LIU H B, XIE Y, et al.Preparation, characterization and physicochemical properties of konjac glucomannan depolymerized by ozone assisted with microwave treatment[J].Food Hydrocolloids, 2021, 119:106878.
[15] 徐聪. 超声波辅助冷冻协同木薯淀粉对魔芋葡甘聚糖凝胶特性的影响及应用研究[D].郑州:郑州轻工业大学, 2022.
XU C.Effects of ultrasonic assisted freezing combined with cassava starch on gel properties of konjac glucomannan and research on its application[D].Zhengzhou:Zhengzhou University of Light Industry, 2022.
[16] YE J P, YANG R, LIU C M, et al.Improvement in freeze-thaw stability of rice starch gel by inulin and its mechanism[J].Food Chemistry, 2018, 268:324-333.
[17] 谢仁香, 覃小丽, 谢勇, 等.氧化魔芋葡甘露聚糖的添加量对乳清分离蛋白凝胶性能的影响[J].食品与发酵工业, 2024, 50(13):116-122.
XIE R X, QIN X L, XIE Y, et al.Effect of the concentration of oxidized konjac glucomannan on gel properties of whey protein isolate gel[J].Food and Fermentation Industries, 2024, 50(13):116-122.
[18] 杨悦. 强碱性电解水对魔芋溶胶及魔芋凝胶性质影响[D].重庆:西南大学, 2022.
YANG Y.Effects of strong alkaline electrolyzed wateron properties of konjac sol and gel[D].Chongqing:Southwest University, 2022.
[19] LI J H, ZHU M, GU L P, et al.Freeze-thaw stability of konjac glucomannan hydrogels supplemented with natural tapioca/corn starch[J].LWT, 2023, 182:114841.
[20] WANG L, YIN Z H, WU J, et al.A study on freeze-thaw characteristics and microstructure of Chinese water chestnut starch gels[J].Journal of Food Engineering, 2008, 88(2):186-192.
[21] SU Y J, ZHANG M Z, CHANG C H, et al.The effect of citric-acid treatment on the physicochemical and gel properties of konjac glucomannan from Amorphophallus bulbifer[J].International Journal of Biological Macromolecules, 2022, 216:95-104.
[22] 江莎. 魔芋葡甘聚糖/黄原胶/海藻酸钠复合凝胶强度及各向异性调控[D].武汉:华中农业大学, 2022.
JIANG S.Strength and anisotropy regulation of konjac glucomannan/xanthan gum/sodium alginate composite gels[D].Wuhan:Huazhong Agricultural University, 2022.
[23] LI H C, HU K L, CHEN J R, et al.Effect of trehalose on the properties of potato starch-Lycium barbarum polysaccharide composite gel[J].Food Biophysics, 2023, 19:85-95.
[24] MEI J Y, HUANG T, BAI C H, et al.Influences of chitosan on freeze-thaw stability of Arenga pinnata starch[J].International Journal of Food Science &Technology, 2021, 56(2):692-699.
[25] ENRIONE J, CHAR C, PEPCZYNSKA M, et al.Rheological and structural study of salmon gelatin with controlled molecular weight[J].Polymers, 2020, 12(7):1587.
[26] ZHAO S C, LI X, HU G S, et al.Rheological behaviors, structural properties and freeze-thaw stability of normal and waxy genotypes of barley starch:A comparative study with mung bean, potato, and corn starches[J].Food Science and Biotechnology, 2021, 30(9):1171-1181.
[27] HE L, LI S, XU C Z, et al.A new method of gelatin modified collagen and viscoelastic study of gelatin-collagen composite hydrogel[J].Macromolecular Research, 2020, 28(9):861-868.
[28] ARUNYANART T, CHAROENREIN S.Effect of sucrose on the freeze-thaw stability of rice starch gels:Correlation with microstructure and freezable water[J].Carbohydrate Polymers, 2008, 74(3):514-518.
[29] LIU Y, GAO J M, WU H, et al.Molecular, crystal and physicochemical properties of granular waxy corn starch after repeated freeze-thaw cycles at different freezing temperatures[J].International Journal of Biological Macromolecules, 2019, 133:346-353.
[30] YANG D, YUAN Y, WANG L, et al.A review on konjac glucomannan gels:Microstructure and application[J].International Journal of Molecular Sciences, 2017, 18(11):2250.
[31] WILLIAMS P D, OZTOP M H, MCCARTHY M J, et al.Characterization of water distribution in xanthan-curdlan hydrogel complex using magnetic resonance imaging, nuclear magnetic resonance relaxometry, rheology, and scanning electron microscopy[J].Journal of Food Science, 2011, 76(6):E472-E478.
[32] ZHOU G W, LIU J N, WANG G R, et al.Effect of ultrasonic treatment on freeze-thaw stability of soy protein isolate gel[J].Journal of Oleo Science, 2019, 68(11):1113-1123.
[33] OUYANG H, KILCAWLEY K N, SONG M, et al.Effect of konjac glucomannan and soy soluble polysaccharides on the rheological, microstructural and syneretic properties of rennet gels[J].LWT, 2022, 168:113905.