锌是人体所必需的微量元素[1],在体内含量仅次于铁,为过渡金属第2位。锌在人体生长、发育、伤口愈合、免疫调控、蛋白质和核酸合成以及胰岛素分泌等过程都有着重要作用,同时也在维持正常味觉和食欲方面起着关键作用[2-4]。尽管锌元素的作用和重要性越来越被重视,但据有关数据显示仍有17%的世界人口面临缺锌的风险[4]。因为人体内并无固定的锌存储区域,摄入锌是保持身体内部锌稳态的关键。目前,锌补充剂可主要分为三类:无机锌补充剂、有机锌补充剂和以氨基酸或肽为载体的食源性蛋白肽锌补充剂。常见的无机锌补充剂为硫酸锌和氯化锌,对胃肠道刺激较大[3]。有机锌补充剂包括葡萄糖酸锌、乳酸锌和柠檬酸锌等,其口感较无机锌补充剂有所改善,但易与其他营养素拮抗[5],不宜长期摄入。与前2种补充剂相比,食源性蛋白肽可与锌螯合制备肽锌螯合物,具有稳定性好、安全性高、易吸收等特点[4],如郑义等[6]制备的银杏肽锌螯合物经体外模拟胃肠道消化后,与无机锌盐相比其Zn2+溶解率和渗透率更高。张胥卿[7]研究发现,酪蛋白磷酸肽-锌螯合物的锌螯合率为92.95%,其对缺锌小鼠的体重、血锌含量的改善效果要优于甘氨酸-锌螯合物。银杏肽[6]、章鱼肽[8]、花生肽[9]、核桃肽[10]以及乳清肽[11]等均可与锌结合,其锌螯合率分别为49.23%、52.06%、53.01%、77.70%以及82.61%。但当前研究报道的大多数肽锌螯合物其锌螯合率偏低即载锌量不够高,因此亟需开发新的高锌载量的肽锌螯合物。
卵黄高磷蛋白(phosvitin,PV)是鸡蛋中的磷糖蛋白,由217个氨基酸残基构成主体,磷酸化的丝氨酸残基为123个[12]。卵黄高磷蛋白磷酸肽(phosvitin phosphopeptide,PPP)为PV经酶解后得到的酸性氨基酸残基暴露的多肽片段,容易与金属离子结合[12],且肽的磷酸化丝氨酸在结合二价金属离子如Zn2+、Ca2+、Fe2+时也起主要作用[13]。使用胰蛋白酶单酶酶解制备PPP时其水解度(degree of hydrolysis,DH)为10.25%,而使用碱性蛋白酶与胰蛋白酶分步酶解后其DH可提高至18.12%,且螯合钙的能力增强了2.93%[14]。宋丽等[15]利用高温高压预处理PV后使用胰蛋白酶与碱性蛋白酶复合酶解制备PPP,DH提高至25.45%,钙螯合率为93.41%。宋璐杉等[16]利用碱性蛋白酶与胰蛋白酶复合酶解制备PPP,亚铁螯合率为96.35%,且螯合物具备优良的稳定性。以上研究表明,复合酶解可有效提高PV的DH且增强酶解物的金属离子螯合能力。但利用复合酶解技术制备卵黄高磷蛋白磷酸肽-锌螯合物(phosvitin phosphopeptide-zinc chelate,PPP-Zn)的相关研究尚未见报道。因此,本研究为开发出高锌载量的肽锌螯合物,首先通过正交试验优化复合酶解法制备PPP,再利用响应面试验优化PPP-Zn的最佳制备工艺,最后借助Zeta电位、红外光谱和荧光光谱等分析仪器对PPP-Zn进行结构表征。
1 材料与方法
1.1 材料与设备
1.1.1 材料与试剂
鸡蛋(褐壳鸡蛋);ZnSO4·7H2O、乙二胺四乙酸二钠(ethylene diamine tetraacetic acid disodium salt,EDTA-2Na)、胰蛋白酶(250 U/mg),北京索莱宝生物技术有限公司;碱性蛋白酶(200 U/mg)、α-糜蛋白酶(1 000 U/mg),上海麦克林生物化工科技股份有限公司;改良Lowry法蛋白定量试剂盒,上海源叶生物技术有限公司。
1.1.2 仪器与设备
DF-101S恒温电热水浴锅,郑州卓诚仪器有限公司;FE22-酸度计,梅特勒-托利多国际有限公司;Synergy HTX酶标仪,安捷伦科技(中国)有限公司;H1850R高速冷冻离心机,湘仪试验室仪器开发有限公司;BILON-FD50A冷冻干燥机,上海比朗仪器制造有限公司;F-7100荧光分光光度计,日本Shimadzu公司;iS50 FTIR光谱仪,美国赛默飞公司;SU1510扫描电子显微镜,日本Hitachi公司。
1.2 实验方法
1.2.1 PPP的制备
参照张晓维[17]的聚乙二醇沉淀法提取PV。采用3步复合酶解法制备PPP,前2步酶解工艺参照徐彩娜[14]的方法,即称取PV溶于蒸馏水中配制成底物质量分数为1%的溶液,调节溶液pH至9.0,加入质量分数为5%碱性蛋白酶在40 ℃下酶解1.5 h,而后100 ℃加热10 min灭活。调节酶解液pH至8.0后加入质量分数为5%的胰蛋白酶,50 ℃下酶解4 h,100 ℃加热10 min灭活。在此2步酶解法的基础上优化第3步酶解的工艺,调整样品溶液的pH,加入一定量的α-糜蛋白酶,在固定的温度下酶解一定时间,于100 ℃加热10 min灭活。酶解液冷却后在10 000×g条件下离心10 min,取上清液,冻干后所得样品即为PPP。
1.2.1.1 酶解单因素试验
由于酶解pH、酶解时间、酶解温度和加酶量都会对PV的酶解效果产生一定的影响[15],因此以底物质量分数1%、pH 7.0、酶解时间4 h、酶解温度50 ℃和加酶量5%为固定酶解条件,以DH为主要参考指标,锌螯合率为次要参考指标,考察各单因素对α-糜蛋白酶酶解效果的影响。各单因素水平设置如下:酶解pH为6.5、7.0、7.5、8.0和8.5;酶解时间为3.0、3.5、4.0、4.5和5.0 h;酶解温度为40、45、50、55和60 ℃;加酶量为5%、6%、7%、8%和9%。
1.2.1.2 正交优化
基于单因素结果分析,以酶解时间、酶解温度和加酶量为自变量,以DH为评价指标,设置三因素三水平的正交试验优化PPP的制备工艺,具体见表1。
表1 正交试验因素与水平
Table 1 Factors and levels of orthogonal test
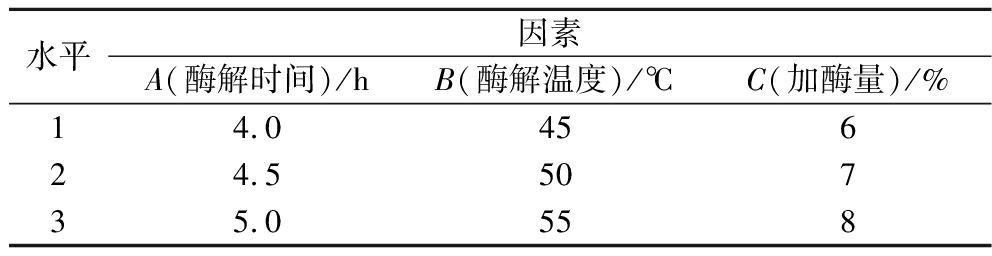
水平因素A(酶解时间)/hB(酶解温度)/℃C(加酶量)/%14.045624.550735.0558
1.2.2 DH测定
依据YOLANDANI等[18]的方法使用改良Lowry法蛋白定量试剂盒检测DH。
上清液中肽键含量测定:将2.5 mL酶解液与2.5 mL质量分数为20%的三氯乙酸(trichloroacetic acid,TCA)溶液混合均匀,静置10 min后在10 000×g的条件下离心10 min,取上清液。
酶解液中总肽键含量测定:取2.5 mL酶解液与等体积超纯水混合均匀后即为混合液。
上清液与混合液按照改良Lowry法蛋白定量试剂盒说明进行操作,在750 nm处进行检测。计算如公式(1)所示:
(1)
式中:C上清液,上清液中肽键含量,μg/mL;C酶解液,酶解液中总肽键含量,μg/mL。
1.2.3 锌螯合率的测定
通过EDTA滴定法[11]测定锌螯合率。取5 mL灭酶后的酶解液与等体积50 mmol/L的ZnSO4·7H2O溶液混合,调pH至7.0,60 ℃恒温水浴反应1 h得到肽锌螯合溶液。取5 mL肽锌螯合溶液等待后续总锌含量检测。另取5 mL肽锌螯合溶液加入7倍体积无水乙醇醇沉4 h,10 000×g离心15 min弃去上清液,所得沉淀进行冷冻干燥后得到肽锌螯合物。
总锌含量测定:取5 mL上述肽锌螯合溶液,超纯水定容至50 mL。
肽锌螯合物中锌含量测定:将得到的肽锌螯合物用超纯水溶解并定容至50 mL。
EDTA法滴定:分别取15 mL上述定容后的样品溶液,加入二甲酚橙指示剂,再加入质量分数为20%的六亚甲基四胺溶液,直到体系变成稳定的紫红色。随后,再添加1 mL六亚甲基四胺,并使用0.01 mol/L EDTA-2Na进行滴定。滴定过程中,当溶液由紫红色变为黄色时,即为滴定终点。空白试验将样品溶液替换为超纯水进行滴定。锌螯合率按公式(2)计算:
锌螯合率![]()
(2)
式中:V螯合,肽锌螯合物中锌含量测定所消耗EDTA-2Na体积,mL;V总,总锌含量溶液测定所消耗EDTA-2Na体积,mL;V空白,超纯水测定所消耗EDTA-2Na体积,mL。
1.2.4 PPP-Zn制备工艺的优化
由于肽锌螯合受肽锌比、螯合pH、螯合温度和螯合时间的影响[19],故利用单因素与响应面试验考察各因素对PPP-Zn制备的影响。PPP用超纯水溶解,配制1 mg/mL的溶液10 mL,等体积加入不同浓度的ZnSO4·7H2O溶液混合,调整至所需pH,恒温水浴螯合一定时间得到肽锌螯合溶液,在反应终止后加入7倍体积无水乙醇醇沉4 h,10 000×g离心15 min弃去上清液,所得沉淀冷冻干燥即为PPP-Zn。
1.2.4.1 螯合单因素试验
以肽锌比1∶50(g∶mmol)、螯合pH 7.0、螯合时间60 min和螯合温度60 ℃为固定螯合条件,对肽锌比[1∶50、1∶60、1∶70、1∶80、1∶90和1∶100(g∶mmol)],螯合pH(3.0、4.0、5.0、6.0、7.0和8.0),螯合温度(30、40、50、60、70和80 ℃)和螯合时间(30、45、60、75、90和105 min)进行单因素试验,以锌螯合率为指标,探讨不同因素对肽锌螯合的影响。
1.2.4.2 响应面试验设计
根据单因素试验结果,以螯合pH、螯合时间和螯合温度为变量,以锌螯合率为评价指标设计响应面试验,研究PPP-Zn的最佳制备工艺,因素水平如表2所示。
表2 响应面试验因素与水平
Table 2 Factors and levels of response surface methodology
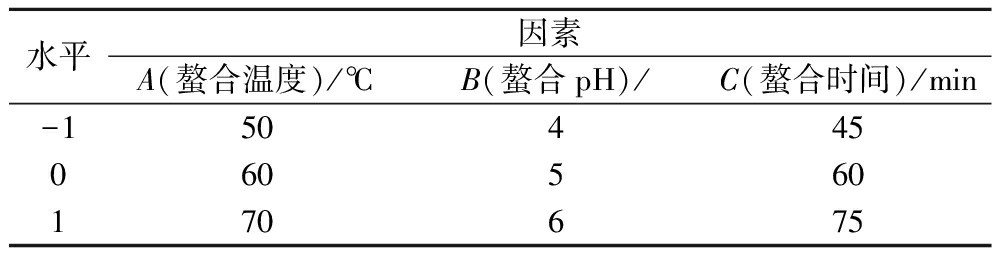
水平因素A(螯合温度)/℃B(螯合pH)/C(螯合时间)/min-150445060560170675
1.2.5 PPP-Zn的结构表征
1.2.5.1 Zeta电位分析
参考ZHAO等[10]的方法,将PPP和PPP-Zn用超纯水配成1 mg/mL溶液,进行检测。
1.2.5.2 荧光光谱
PPP和PPP-Zn分别用超纯水配制为1 mg/mL,采用荧光光谱仪测定锌对肽内源荧光及肽构象的影响。测定条件为:激发波长280 nm,发射波长300~500 nm,裂缝宽度5 nm[20]。
1.2.5.3 傅里叶红外光谱
称取1.5 mg的PPP和PPP-Zn样品,分别加入干燥的KBr 150 mg于研钵中混合研磨均匀,放入模具内压片,制成透明样品。波长采集范围为400~4 000 cm-1,分辨率为4.0 cm-1,每个样品扫描16次[9]。
1.2.5.4 扫描电子显微镜观察
将冻干后的PPP和PPP-Zn样品均匀涂抹在导电胶上,喷金,然后采集放大倍数500倍的画面[9]。
1.3 数据处理
所有试验重复进行3次,使用SPSS 20软件对数据进行分析,P<0.05为具有显著差异。响应面分析采用Design Expert 13软件,制图使用Origin 2019软件。
2 结果与分析
2.1 PPP的制备
由酶解预实验的结果(图1)显示,使用碱性蛋白酶和胰蛋白酶两步酶解PV时(第1组)其DH为19.03%,锌螯合率为75.79%;调换酶解顺序使用碱性蛋白酶、α-糜蛋白酶和胰蛋白酶三步酶解PV(第2组)时,DH为20.33%,较第3组略低。使用碱性蛋白酶、胰蛋白酶和α-糜蛋白酶三步酶解时(第3组)DH增加至22.73%,锌螯合率提高至80.39%。这可能是因为糜蛋白酶与胰蛋白酶的酶解切割位点互补,可得到更多的肽段[21]。第2组和第3组DH不同,由于胰蛋白酶可水解打断PV多聚磷酸化丝氨酸区域的Lys和Arg[15],有助于α-糜蛋白酶与PV结合。因此,为了得到高锌载量的PPP,本研究在碱性蛋白酶与胰蛋白酶两步酶解的基础上,优化使用α-糜蛋白酶进行复合酶解。
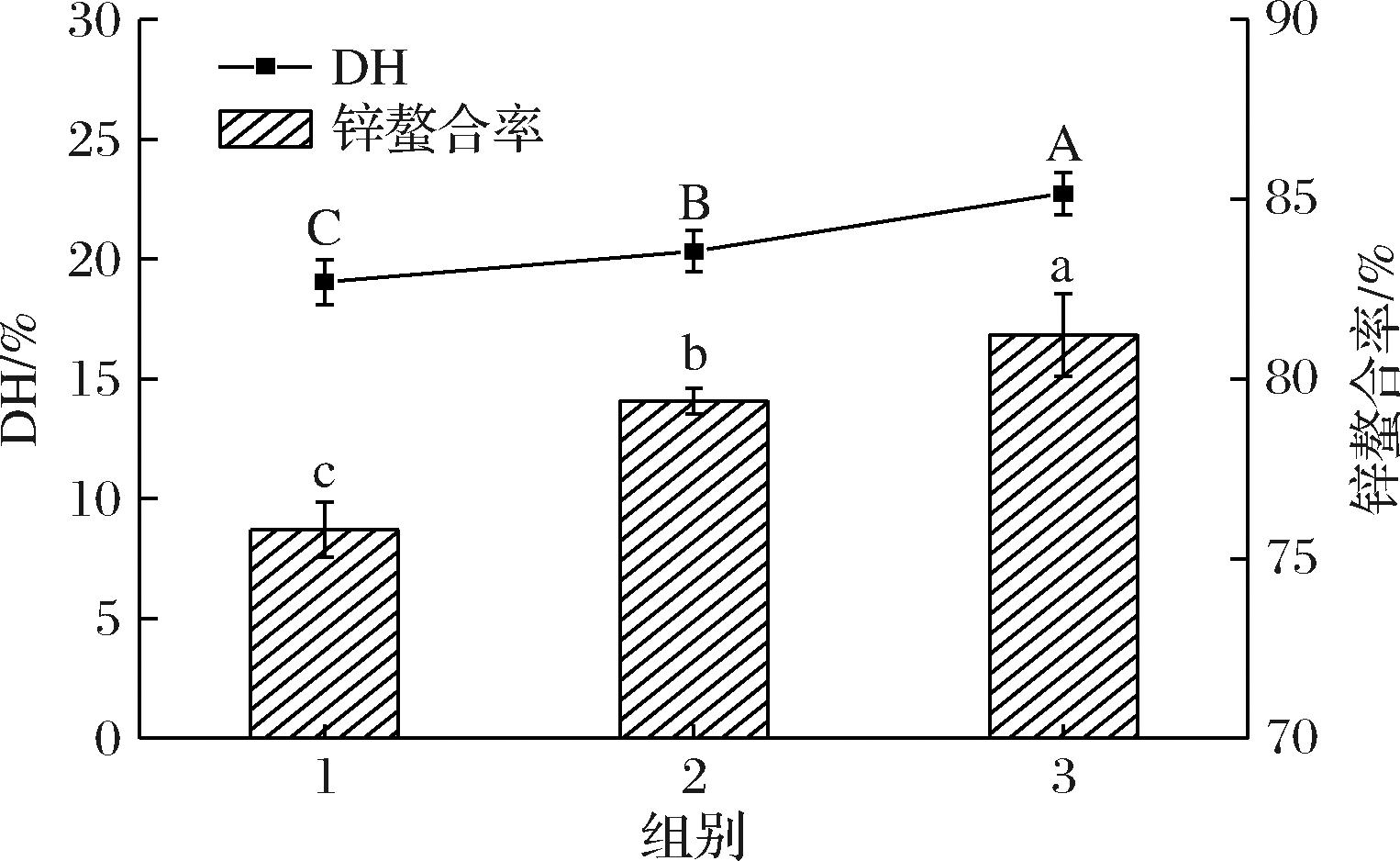
图1 预试验结果
Fig.1 Pre-test results
注:不同大写字母表示DH具有显著性差异(P<0.05),不同小写字母表示锌螯合率具有显著性差异(P<0.05)(图2同);第1组:碱性蛋白酶、胰蛋白酶两步酶解;第2组:碱性蛋白酶、α-糜蛋白酶、胰蛋白酶三步酶解;第3组:碱性蛋白酶、胰蛋白酶、α-糜蛋白酶三步酶解。
2.1.1 酶解单因素试验结果
通过单因素试验考察α-糜蛋白酶对PPP制备的影响。如图2-a所示,随着pH值的增加,DH和锌螯合率先递增后减小。在pH 7.5时二者同时达到最大,DH为(24.33±0.63)%,锌螯合率为(81.29±0.88)%。继续增加pH值,酶的空间结构被过量的碱破坏,酶活性降低,导致DH下降[22]。
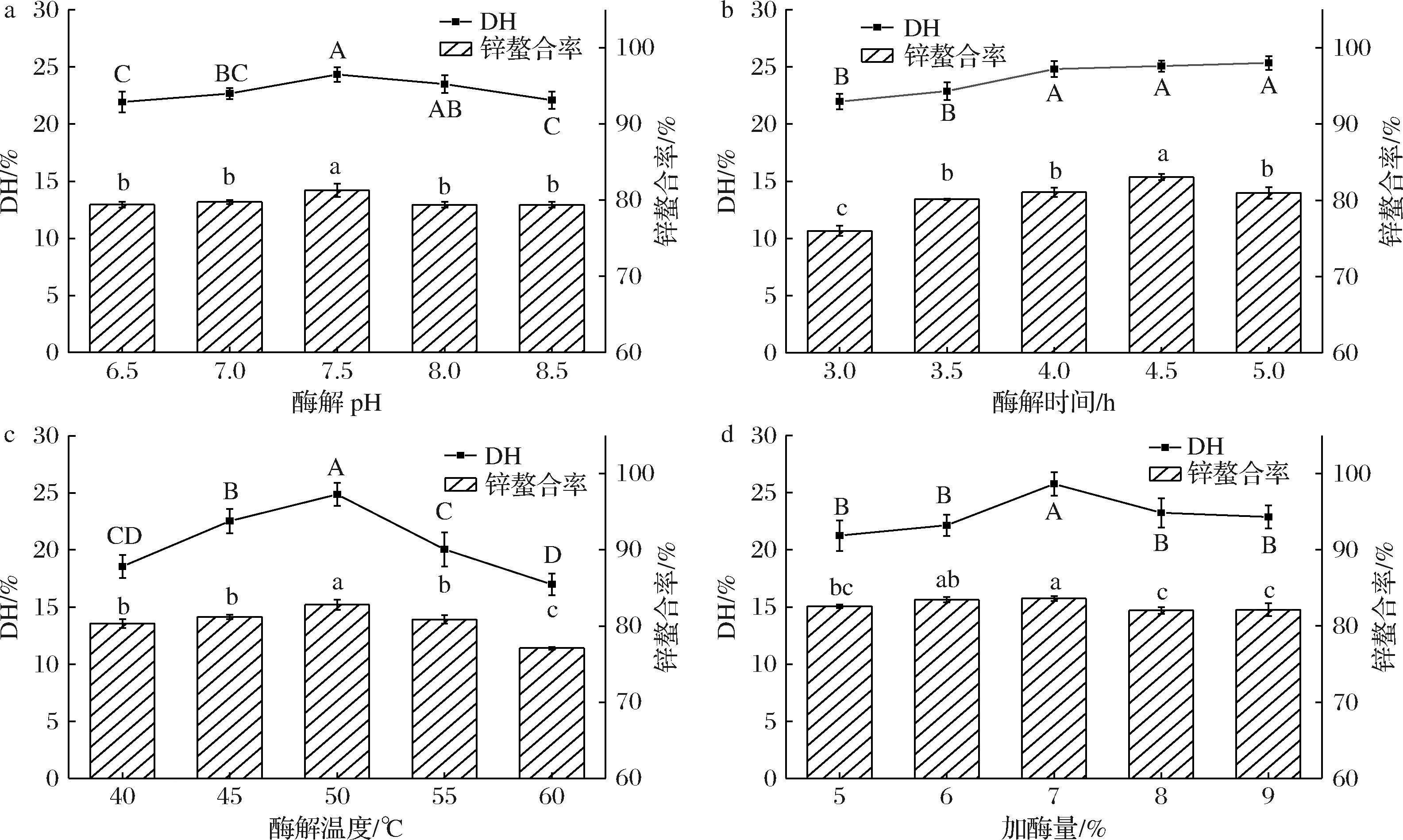
a-酶解pH;b-酶解时间;c-酶解温度;d-加酶量
图2 酶解单因素试验结果
Fig.2 Results of single factor tests
图2-b显示,随着酶解时间的增加,DH逐渐增加,4 h时达到最大值为(24.80±0.70)%,而后趋于稳定。锌螯合率先增加后降低,4.5 h时达到最大值(83.03±0.40)%。当酶解时间继续增加时,多肽会被水解成氨基酸,使螯合位点减少,导致螯合率下降[8]。
图2-c结果表明,酶解温度在40~60 ℃时,DH和锌螯合率呈现先升后降趋势,在50 ℃时出现最大值,分别为(24.87±1.02)%和(82.81±0.67)%,温度大于50 ℃后二者均显著降低。这是由于酶在超出适宜温度后会发生一定程度的变性[23],酶活性的降低使水解效率下降,导致小分子肽的产量降低,螯合位点减少。
由图2-d可知,随着加酶量增加,DH先增加后降低,在加酶量7%时DH为(25.76±1.00)%,此时锌螯合率为(83.02±0.32)%;随后,加酶量的进一步增加导致DH略有降低,这是由于酶浓度过高使中间产物过度分解而导致的[24]。综上可知,在制备PPP过程中酶解pH的影响较小。后续试验考虑固定酶解pH为7.50,以酶解时间4.5 h、酶解温度50 ℃以及加酶量7%为中位数进行酶解正交试验的优化。
2.1.2 正交优化结果
单因素结果显示,锌螯合率与DH变化趋势较为一致,这说明锌螯合率与多肽产量之间存在相关性。因此以DH去验证正交试验,研究各因素对α-糜蛋白酶酶解PV的影响,正交试验和分析结果如表3所示。
表3 正交试验设计及结果
Table 3 Orthogonal array design with response variables
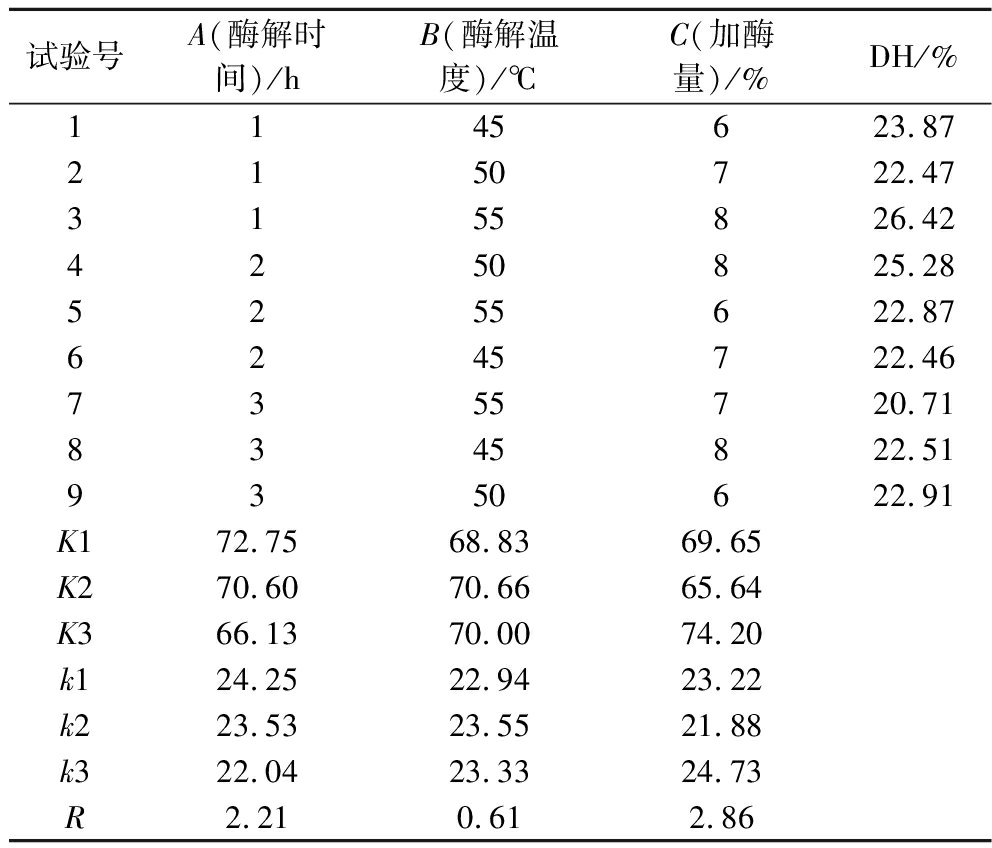
试验号A(酶解时间)/hB(酶解温度)/℃C(加酶量)/%DH/%1145623.87 2150722.47 3155826.42 4250825.28 5255622.87 6245722.46 7355720.71 8345822.51 9350622.91 K172.75 68.83 69.65 K270.60 70.66 65.64 K366.13 70.00 74.20 k124.25 22.94 23.22 k223.53 23.55 21.88 k322.04 23.33 24.73 R2.21 0.61 2.86
由表3可知,影响酶解效果的因素为C(加酶量)>A(酶解时间)>B(酶解温度)。参考k值,α-糜蛋白酶酶解最佳条件为A1B2C3,即酶解时间4 h,酶解温度50 ℃,加酶量为8%。以最佳条件进行验证试验,DH为(26.61±0.39)%,表明正交试验取得了预期结果[24]。
2.2 PPP-Zn制备工艺优化
2.2.1 螯合单因素试验结果
如图3-a所示,随着肽锌比的增加,锌螯合率先增加后持平。Zn2+含量过低时,不能与螯合位点充分结合,导致锌螯合率较低,50(g∶mmol)时仅为(80.98±0.88)%。当肽锌比大于1∶90(g∶mmol)时,肽链上与Zn2+螯合的位点饱和,锌螯合率为(91.15±0.79)%。肽锌比为1∶90(g∶mmol)与1∶100(g∶mmol)时,PPP的锌螯合率无明显差异。因此选择肽锌比1∶90(g∶mmol)进行响应面优化。
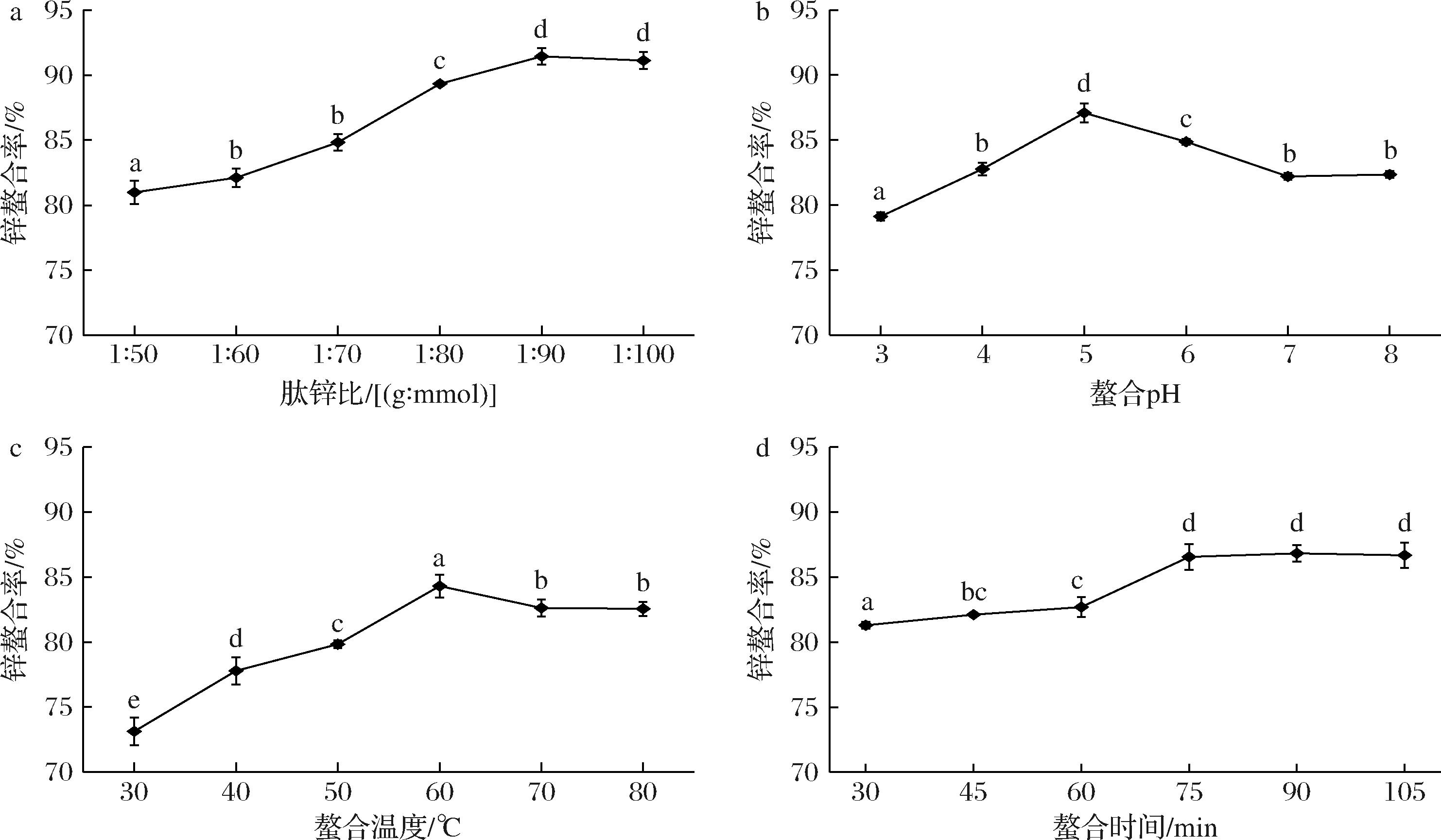
a-螯合肽锌比;b-螯合pH;c-螯合温度;d-螯合时间
图3 螯合肽锌比、螯合pH、螯合温度、螯合时间对锌螯合率的影响
Fig.3 Effects of chelating peptide-zinc ratio, chelating pH, chelating temperature, and chelating time on the chelating rate of zinc
注:不同小写字母表示具有显著性差异(P<0.05)。
如图3-b所示,锌螯合率受螯合pH的影响。随着pH的增加,锌螯合率先增加后降低,并最终趋于稳定。在pH为3的反应体系中,锌螯合率较低。这是因为大量的H+与Zn2+竞争肽链的电子,导致Zn2+较难与肽链发生螯合反应。锌螯合率在pH为5时达到最高值,为(87.08±0.72)%。如果继续增加pH值至碱性条件,Zn2+会与OH-反应,产生不利于与多肽链螯合的金属盐沉淀,导致锌螯合率下降。这种变化趋势与南极磷虾肽螯合Zn2+的变化相似[25],因此选择pH 5作为中位数进行响应面试验。
如图3-c所示,螯合温度对肽锌螯合产生影响。随着温度从30 ℃增加到80 ℃,锌螯合率呈现先上升后下降的趋势。当温度达到60 ℃时,锌螯合率达到最高水平,为(84.32±0.87)%。高温会导致分子运动加剧,增加多肽与锌碰撞的可能性,从而有利于螯合反应的进行。而将温度提升至80 ℃时,锌的螯合率降至(82.56±0.54)%,可能是由于过高的温度对锌与结合位点的结合产生不利影响[25]。因此选择螯合温度60 ℃为中位数进行响应面试验。
如图3-d所示,锌螯合率随着时间增加而升高最后归于平缓。反应75 min后,锌螯合率最大为(86.55±0.97)%,而后趋于稳定,这表明PPP与Zn2+结合可快速达到平衡态,相互作用迅速。该结果与猪骨胶原肽钙趋势相似,猪骨胶原肽的钙螯合能力在40~80 min时无显著差异[26]。由于75 min后肽锌螯合率无显著性差异,后续选择螯合时间60 min为中位数进行响应面试验。
2.2.2 响应面优化结果
单因素试验结果表明,当肽锌比为1∶90(g∶mmol)时,反应体系中的锌足以与肽结合。因此,将肽锌比固定在1∶90(g∶mmol),优化PPP-Zn的制备工艺,选取螯合温度(A)、螯合pH(B)、螯合时间(C)进行三因素三水平响应面试验。试验设计方案及结果如表4所示。
表4 响应面试验方案与结果
Table 4 Response surface methodology scheme and results
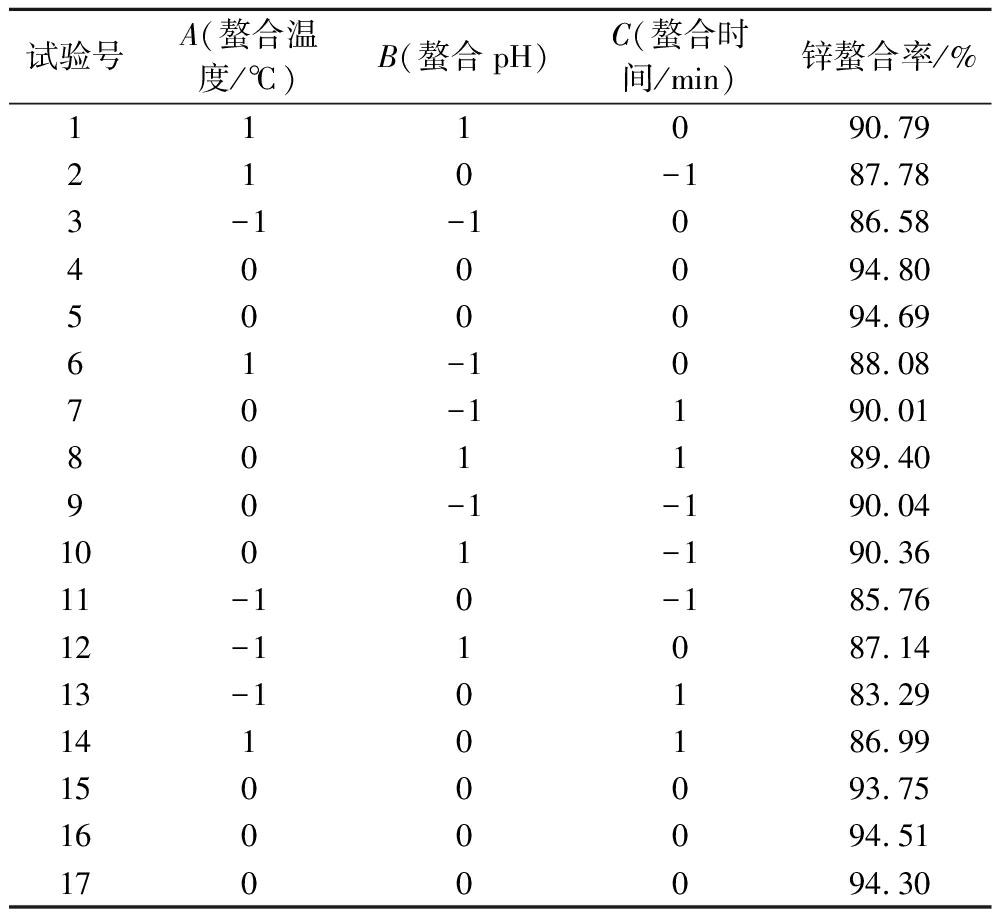
试验号A(螯合温度/℃)B(螯合pH)C(螯合时间/min)锌螯合率/%111090.79210-187.783-1-1086.58400094.80500094.6961-1088.0870-1190.01801189.4090-1-190.041001-190.3611-10-185.7612-11087.1413-10183.291410186.991500093.751600094.511700094.30
如表5所示,通过方差分析检验模型的显著性和相关性,模型(P<0.000 1)极显著,失拟项(P>0.05)不显著,说明模型与试验结果拟合较好。回归模型方程为Y=94.41+1.36A+0.372 5B-0.531 3C+0.537 5AB+0.420 0AC-0.232 5BC-5.13A2-1.13B2-3.32C2。响应面相关系数RAdj2为0.966 1,表明该模型具有较高的可信度,说明回归模型可以较好地描述螯合温度、螯合pH和螯合时间[10]。
表5 响应面模型的方差分析
Table 5 Analysis of variance of the response surface methodology model
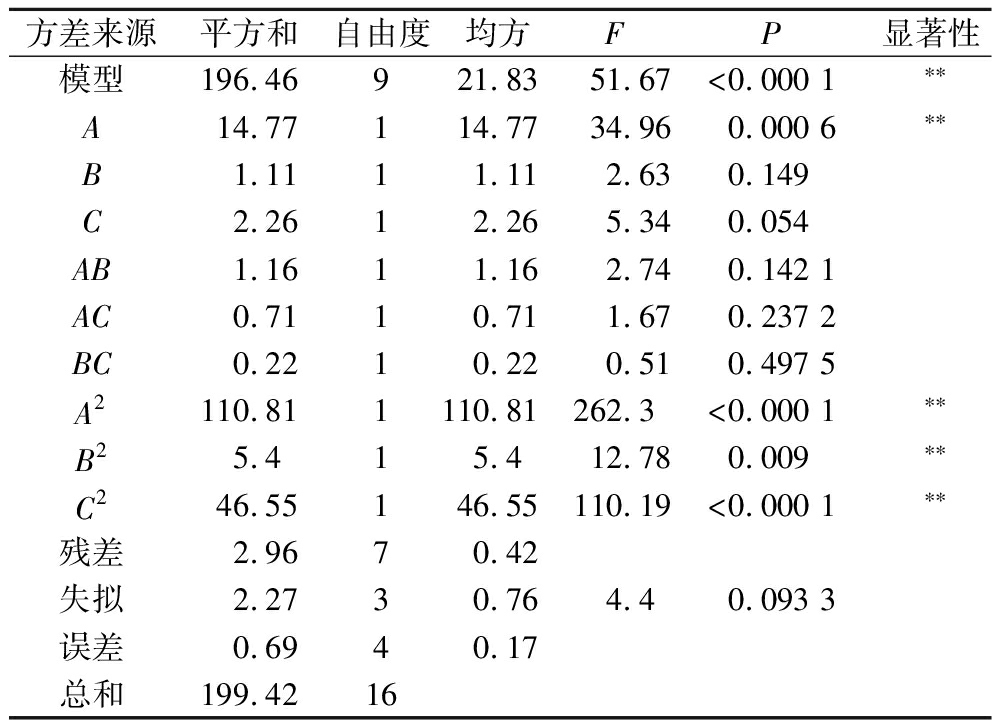
方差来源平方和自由度均方FP显著性模型196.46921.83 51.67<0.000 1∗∗A14.77114.7734.960.000 6∗∗B1.1111.112.630.149C2.2612.265.340.054AB1.1611.162.740.142 1AC0.7110.711.670.237 2BC0.2210.220.510.497 5A2110.811110.81262.3<0.000 1∗∗B25.415.412.780.009∗∗C246.55146.55110.19<0.000 1∗∗残差2.9670.42失拟2.2730.764.40.093 3误差0.6940.17总和199.4216
固定肽-锌比,通过响应面结果分析预测PPP-Zn的最优制备工艺为螯合温度61.40 ℃、螯合pH 5.21、螯合时间58.83 min时,锌螯合率为94.56%。考虑实际操作采用螯合温度60 ℃、螯合pH 5.20、螯合时间60 min进行验证后,实际锌螯合率为(94.18±0.38)%,与预测锌螯合率无显著性差异(P>0.05),表明模型有效合理[10]。许多研究已经表明,食源性肽具备一定锌螯合能力,章鱼肽的锌螯合率最高为52.06%。利用响应面法优化核桃肽锌的螯合工艺,优化后的锌螯合率为77.70%[10]。玄依凡[11]利用正交试验优化制备乳清蛋白肽锌螯合物,最佳锌螯合率为82.61%。锌的结合能力与食源性肽的氨基酸序列和结构多样性密切相关,含有金属配体如组氨酸(His)、半胱氨酸(Cys)、天冬氨酸(Asp)、谷氨酸(Glu)和丝氨酸(Ser)(以及磷酸化的Ser)的肽[13],表现出良好的螯合能力,可以形成可溶性锌螯合物[27]。PPP由于磷酸丝氨酸的存在,其锌螯合率显著高于研究报道的食源性肽。
2.3 PPP-Zn的结构表征
2.3.1 Zeta电位分析
Zeta电位是评估分散系统中粒子表面电荷状态的关键参数。如图4所示,PPP与Zn2+未结合时,其Zeta电位值为-(39±0.13) mV。在螯合Zn2+后,PPP-Zn电位值变为-(10±0.18) mV,与PPP相比增加了74.36%,具有显著性(P<0.05)。核桃肽与锌螯合后电位值由-29.90 mV变化至-12.40 mV,增加了58.53%[10],低于PPP-Zn。UDECHUKWU等[27]使用不同酶酶解的乳清蛋白肽制备得到肽锌螯合物,结果表明肽表面所带负电荷越高,与锌的结合能力越强,Zeta电位的变化就越明显。这是由于带正电荷的Zn2+结合肽中的磷酸基团和羧基基团等带负电荷的基团,使电位发生变化。PPP-Zn电位值变化也明显与PPP-Zn优异的锌螯合率结果相对应。
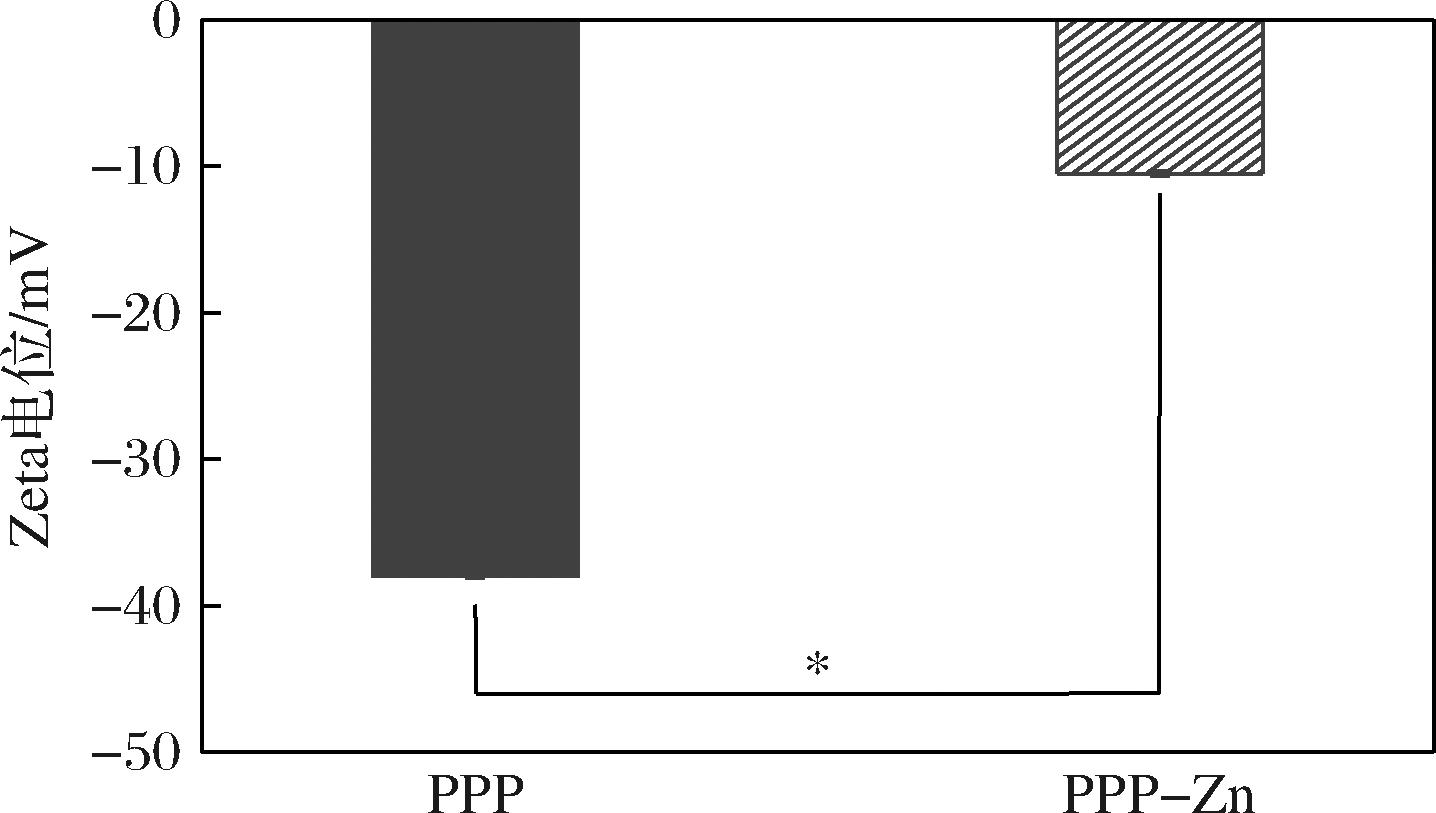
图4 PPP和PPP-Zn的Zeta电位分析图
Fig.4 Zeta potential analysis diagram of PPP and PPP-Zn
注:*表示组间具有显著性差异(P<0.05)。
2.3.2 荧光可见光谱分析
由于蛋白质中含有色氨酸(Trp)和酪氨酸(Tyr)等在特定波长下会产生内源荧光的氨基酸,当多肽与金属离子结合后,其结构发生变化,荧光强度也随之变化,通过内源荧光强度的改变可以间接了解多肽与金属的结合程度[20]。图5为Zn2+对PPP的影响,当激发波长为280 nm时,PPP在349 nm处出现明显吸收峰且荧光强度较高。在加入Zn2+离子后,PPP-Zn的峰值显著低于PPP产生荧光猝灭,且吸收峰发生红移,由349 nm移至354 nm。花生肽螯合锌后同样产生了吸收峰红移由353.30 nm变化至356.96 nm[9],且其吸收峰荧光强度降低。PPP-Zn与花生肽锌变化趋势相似,但PPP-Zn的变化更明显。这说明Zn2+的加入使PPP结构发生了折叠,并产生了新的显色集团导致激发态能量发生变化。
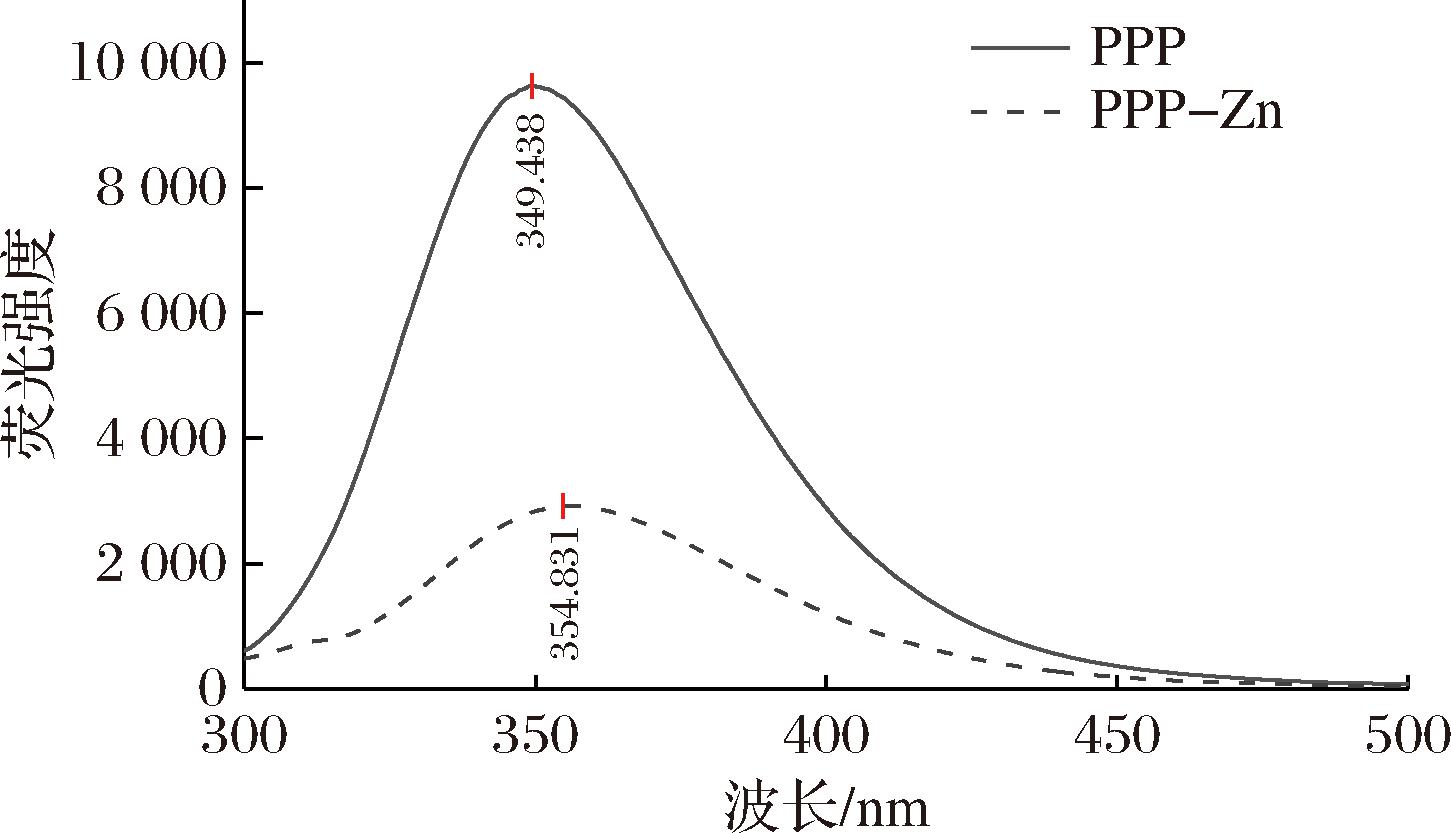
图5 PPP和PPP-Zn的荧光光谱图
Fig.5 Fluorescence spectra of PPP and PPP-Zn
2.3.3 红外光谱分析
金属离子与有机基团发生反应后可引起有机基团吸收峰发生变化。如图6所示,PPP-Zn与PPP的红外光谱相比有明显改变。PPP在3 402 cm-1处的特征峰与—NH的拉伸振动相对应[28],在与Zn2+结合后,其峰移至3 417 cm-1处,表明—NH参与了锌螯合,而后N—Zn键替代氢键。PPP在1 653 cm-1处是酰胺I带的特征吸收峰,主要由肽链中的C![]() O拉伸振动组成[28],肽锌结合后偏移到1 643 cm-1。N—H变形振动和C—N的拉伸构成了PPP在1 547 cm-1处酰胺Ⅱ带的峰[29],加入Zn2+后,PPP-Zn的吸收峰蓝移至1 542 cm-1处。PPP-Zn在酰胺Ⅰ带和酰胺Ⅱ带处的变化说明共价结合反应包含C
O拉伸振动组成[28],肽锌结合后偏移到1 643 cm-1。N—H变形振动和C—N的拉伸构成了PPP在1 547 cm-1处酰胺Ⅱ带的峰[29],加入Zn2+后,PPP-Zn的吸收峰蓝移至1 542 cm-1处。PPP-Zn在酰胺Ⅰ带和酰胺Ⅱ带处的变化说明共价结合反应包含C![]() O键,且Zn—N键取代了N—H键,这也与南极磷虾肽锌报道的变化一致[25]。PPP在1 466 cm-1处的振动为—COOH[15],结合Zn2+后此吸收峰强度减弱,表明—COO—Zn的形成。O—H变形振动引起1 284 cm-1处的峰,PPP-Zn在此处的峰基本消失,与卵黄高磷蛋白肽钙螯合物在此处的变化相似[15]。1 107 cm-1处为磷酸基团(HPO4)的P
O键,且Zn—N键取代了N—H键,这也与南极磷虾肽锌报道的变化一致[25]。PPP在1 466 cm-1处的振动为—COOH[15],结合Zn2+后此吸收峰强度减弱,表明—COO—Zn的形成。O—H变形振动引起1 284 cm-1处的峰,PPP-Zn在此处的峰基本消失,与卵黄高磷蛋白肽钙螯合物在此处的变化相似[15]。1 107 cm-1处为磷酸基团(HPO4)的P![]() O的伸缩振动峰[30],在肽锌中红移至1 112 cm-1且波峰变宽,可能为磷酸基团与Zn2+结合导致结构发生变化。因此,肽链中的羧基氧原子、氨基氮原子以及磷酸基团是肽锌的主要结合位点。
O的伸缩振动峰[30],在肽锌中红移至1 112 cm-1且波峰变宽,可能为磷酸基团与Zn2+结合导致结构发生变化。因此,肽链中的羧基氧原子、氨基氮原子以及磷酸基团是肽锌的主要结合位点。
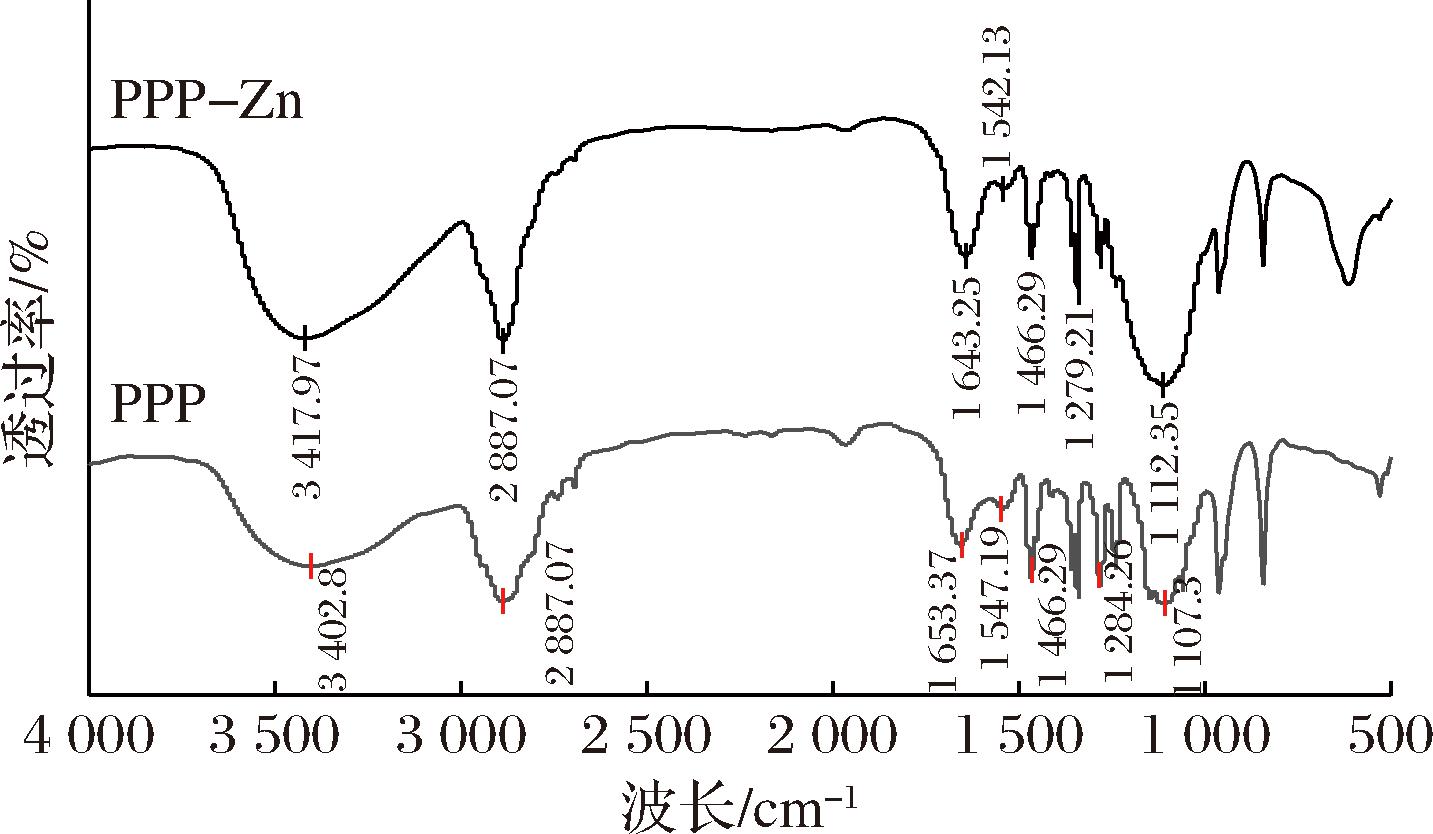
图6 PPP和PPP-Zn的红外光谱图
Fig.6 FTIR spectra of PPP and PPP-Zn
2.3.4 扫描电子显微镜分析
如图7所示,PPP和PPP-Zn表面形态明显不同。PPP呈现为片状结构,表面更均匀、光滑,且片状表面积较大。相比之下,PPP-Zn呈片状结构,表面分布有不均匀的裂隙和凹陷,且与PPP相比表面积减小,粗糙度增加。罗非鱼肽呈现为表面光滑的球形颗粒状,与锌螯合后表面出现凹陷和褶皱[29]。椰子肽锌螯合物表面的微观结构更加不规则和粗糙,且有大量颗粒聚集[1]。以上说明与锌螯合会使肽的表面粗糙度增加,不规则结构出现。图7中微观结构的变化也证实在PPP-Zn的形成过程中PPP和锌之间的相互作用破坏了原始肽表面的密集结构。

a-PPP;b-PPP-Zn
图7 PPP和PPP-Zn的扫描电镜图(×500)
Fig.7 SEM images of PPP and PPP-Zn(×500)
3 结论
α-糜蛋白酶的最佳酶解条件为pH 7.5,时间4 h,温度50 ℃,加酶量8%,在此条件下DH为(26.62±0.39)%。PPP-Zn制备工艺的最佳条件为肽锌比1∶90(g∶mmol)、螯合pH 5.2、螯合温度60 ℃、螯合时间60 min,经验证,锌螯合率为(94.18±0.38)%,表明PPP与锌结合良好。红外光谱结果表明,PPP和Zn2+的相互作用主要通过氨基氮原子、羧基氧原子和磷酸基团实现。扫描电镜显示,PPP和PPP-Zn具有不同的表面形貌。PPP与锌螯合制备了一种新型的高锌载量磷酸肽锌螯合物。本研究表明,PPP-Zn有作为一种新型食源性蛋白肽锌补充剂的潜力,并为卵黄高磷蛋白磷酸肽的开发利用提供新途径。有关PPP-Zn的胃肠道消化吸收需要进一步研究。
[1] ZHENG Y J, GUO M, CHENG C X, et al.Structural and physicochemical characteristics, stability, toxicity and antioxidant activity of peptide-zinc chelate from coconut cake globulin hydrolysates[J].LWT, 2023, 173:114367.
[2] 杨月欣, 葛可佑.中国营养科学全书[M].北京:人民卫生出版社, 2019:141-145.
YANG Y X, GE K Y.The Chinese Complete Book of Nutrition Science[M].Beijing:People’s Medical Publishing House, 2019:141-145.
[3] KHAN S T, MALIK A, ALWARTHAN A, et al.The enormity of the zinc deficiency problem and available solutions;an overview[J].Arabian Journal of Chemistry, 2022, 15(3):103668.
[4] DUAN M P, LI T, LIU B, et al.Zinc nutrition and dietary zinc supplements[J].Critical Reviews in Food Science and Nutrition, 2023, 63(9):1277-1292.
[5] PENG M Y, LU D, YU M, et al.Identification of zinc-chelating pumpkin seed (Cucurbita pepo L.) peptides and in vitro transport of peptide-zinc chelates[J].Journal of Food Science, 2022, 87(5):2048-2057.
[6] 郑义, 李诗颖, 李闯, 等.银杏肽锌螯合物的制备、体外消化及抗氧化活性分析[J].食品工业科技, 2023, 44(17):420-427.
ZHENG Y, LI S Y, LI C, et al.Preparation, in vitro gastrointestinal digestion and antioxidant activity of Ginkgo biloba peptides-zinc chelate [J].Science and Technology of Food Industry, 2023, 44(17):420-427.
[7] 张胥卿. 酪蛋白磷酸肽螯合锌的制备及补锌效应研究[D].安徽:安徽农业大学, 2014.
ZHANG X Q.Casein phosphopeptides chelating zinc phosphate preparation and the effect of zinc supplementation[D].Anhui:Anhui Agricultural University, 2014.
[8] FANG Z, XU L Z, LIN Y L, et al.The preservative potential of Octopus scraps peptides-Zinc chelate against Staphylococcus aureus:Its fabrication, antibacterial activity and action mode[J].Food Control, 2019, 98:24-33.
[9] LI C, BU G H, CHEN F S, et al.Preparation and structural characterization of peanut peptide-zinc chelate[J].CyTA - Journal of Food, 2020, 18(1):409-416.
[10] ZHAO F R, HOU W Y, GUO L X, et al.Novel strategy to the characterization and enhance the glycemic control properties of walnut-derived peptides via zinc chelation[J].Food Chemistry, 2024, 441:138288.
[11] 玄依凡. 乳清蛋白肽-锌离子螯合物的制备及特性研究[D].哈尔滨:哈尔滨工业大学, 2017.
XUAN Y F.Preparation and characterization of whey protein peptide-zinc chelate[D].Harbin:Harbin Institute of Technology, 2017.
[12] SAMARAWEERA H, ZHANG W G, LEE E J, et al.Egg yolk phosvitin and functional phosphopeptides:Review[J].Journal of Food Science, 2011, 76(7):R143-R150.
[13] HUANG X, MOON S H, LEE J, et al.Effective preparation method of phosphopeptides from phosvitin and the analysis of peptide profiles using tandem mass spectrometry[J].Journal of Agricultural and Food Chemistry, 2019, 67(51):14086-14101.
[14] 徐彩娜. 卵黄高磷蛋白磷酸肽的酶解制备及其持钙功能特性研究[D].吉林:吉林大学, 2009.
XU C N.Research on preparation of phosvitin phosphopeptides with enzymolysis technology and bonding Ca capacity[D].Jilin:Jilin University, 2009.
[15] 宋丽, 朱临娴, 宋璐杉, 等.钙结合卵黄高磷蛋白磷酸肽的制备及其肽钙螯合物的结构表征[J].食品科学, 2023, 44(6):125-133.
SONG L, ZHU L X, SONG L S, et al.Preparation of calcium-binding phosvitin phosphopeptide and structural characterization of its calcium chelate [J].Food Science, 2023, 44(6):125-133.
[16] 宋璐杉, 乔赛凤, 朱临娴, 等.卵黄高磷蛋白肽-亚铁螯合物的制备及其稳定性分析[J].食品安全质量检测学报, 2023, 14(14):27-34.
SONG L S, QIAO S F, ZHU L X, et al.Preparation and stability analysis of phosvitin peptide-ferrous chelate[J].Journal of Food Safety and Quality, 2023, 14(14):27-34.
[17] 张晓维. 卵黄高磷蛋白的分离纯化、结构表征及功能特性研究[D].武汉:华中农业大学, 2014.
ZHANG X W.Preparation, structure characterization and function of phosvitin from hen egg yolk[D].Wuhan:Huazhong Agricultural University, 2014.
[18] YOLANDANI, MA H L, LIU D D, et al.Ultrasound viscous reduction effects on the proteolysis of soy protein isolate at a limited degree of hydrolysis:Changes in the functional characteristics and protein structure[J].Ultrasonics Sonochemistry, 2024, 104:106847.
[19] 富天昕, 张舒, 盛亚男, 等.绿豆多肽锌螯合物的制备及其结构与体外消化的分析[J].食品科学, 2020, 41(4):59-66.
FU T X, ZHANG S, SHENG Y N, et al.Preparation, structure and in vitro digestibility of zinc-chelating mung bean peptide[J].Food Science, 2020, 41(4):59-66.
[20] ZHANG J N, YE Z.Pentapeptide-zinc chelate from sweet almond expeller amandin hydrolysates:Structural and physicochemical characteristics, stability and zinc transport ability in vitro[J].Molecules, 2022, 27(22):7936.
[21] 徐久翔, 郭斯宇, 钱衍霓, 等.短乳杆菌49蛋白提取及酶解条件优化[J].质谱学报, 2019, 40(4):325-334.
XU J X, GUO S Y, QIAN Y N, et al.Optimization of protein extraction methods and digestion conditions of Lactobacillus brevis 49[J].Journal of Chinese Mass Spectrometry Society, 2019, 40(4):325-334.
[22] ZHANG Y J, DING X J, LI M Q.Preparation, characterization and in vitro stability of iron-chelating peptides from mung beans[J].Food Chemistry, 2021, 349:129101.
[23] DU R, LI W, LI J W, et al.Dynamic changes of zinc chemical speciation and zinc-containing peptides release in oysters (Crassostrea hongkongensis) during enzymatic hydrolysis[J].Food Bioscience, 2024, 58:103649.
[24] 杜乾. 藜麦抗氧化肽制备及其杏仁复合饮料研制[D].河北:河北北方学院, 2023.
DU Q.Preparation of quinoa antioxidant peptide and development of almond compound beverage[D].Hebei:Hebei North University, 2023.
[25] SUN R N, LIU X F, YU Y, et al.Preparation process optimization, structural characterization and in vitro digestion stability analysis of Antarctic krill (Euphausia superba) peptides-zinc chelate[J].Food Chemistry, 2021, 340:128056.
[26] WU W M, HE L C, LIANG Y H, et al.Preparation process optimization of pig bone collagen peptide-calcium chelate using response surface methodology and its structural characterization and stability analysis[J].Food Chemistry, 2019, 284:80-89.
[27] UDECHUKWU M C, DOWNEY B, UDENIGWE C C.Influence of structural and surface properties of whey-derived peptides on zinc-chelating capacity, and in vitro gastric stability and bioaccessibility of the zinc-peptide complexes[J].Food Chemistry, 2018, 240:1227-1232.
[28] FAN C Z, GE X F, HAO J Y, et al.Identification of high iron-chelating peptides with unusual antioxidant effect from sea cucumbers and the possible binding mode[J].Food Chemistry, 2023, 399:133912.
[29] KE X, HU X, LI L H, et al.A novel zinc-binding peptide identified from tilapia (Oreochromis niloticus) skin collagen and transport pathway across Caco-2 monolayers[J].Food Bioscience, 2021, 42:101127.
[30] TIAN L J, XIONG D D, JIA J, et al.Mechanism study on enhanced emulsifying properties of phosvitin and calcium-binding capacity of its phosphopeptides by lactic acid bacteria fermentation[J].LWT, 2022, 155:113002.