二氢香芹酮,一种重要的天然萜类化合物,是留兰香精油的主要成分之一,具有驱虫、杀螨、抑菌等良好的生物活性,不仅可以作为风味添加剂用于食品工业,还可以作为抗菌剂、熏蒸剂、驱避剂用于农业生产和粮油储藏。此外,二氢香芹酮也是一种重要的中间体,可用于合成倍半萜内酯 (+)-decipienin A和 (-)-thujopsene、热塑性聚合物的前体单萜内酯衍生物 (+)-二氢卡维丁、驱虫剂十氢化萘衍生物、抗疟疾活性化合物双螺-1,2,4,5-四氧烷等,在医学和化工领域具有广阔的应用前景[1-3]。
由于其自然来源有限,二氢香芹酮的制备主要以化学合成为主,工艺过程复杂、环境不友好、成本高。相比之下,生物催化是利用酶或者微生物作为催化剂对底物进行催化转化,具有反应条件温和、高效以及针对性强等优势,已经受到了广泛的关注。烯还原酶(ene reductases, ERs)能够利用NAD(P)H还原α, β-不饱和烯烃的碳碳双键,将香芹酮还原生成二氢香芹酮,是生物催化合成的重要酶类之一[2,4]。迄今为止,研究人员已经挖掘鉴定出许多天然ERs,能催化还原香芹酮生成二氢香芹酮[5-7],然而天然ERs催化效率低、大多数酶稳定性和耐受性较差,缺少真正能用于大规模生产应用的酶。此外,产物的高效合成以及经济可行的生产过程也是实现大规模生产的关键。NAD(P)H是ERs介导催化过程中不可或缺的辅因子,NAD(P)H价格昂贵,是进行大规模生产的限制性因素。因此,工程改造ERs增强催化活性、构建辅酶循环系统降低生产成本对于ERs催化合成二氢香芹酮至关重要。
在前期研究中,本实验室成功鉴定和表征了一种源自克雷伯杆菌O852(Klebsiella sp.O852)的烯还原酶O852_GE000962(命名为KlebER1),该酶偏好NADPH,能催化香芹酮还原生成二氢香芹酮[8-9],并进一步通过半理性设计获得其活性增强的突变体KlebER1A303N,该突变体具有较高的稳定性、以及良好的pH和温度适应性,极具工业应用前景。但NADPH的高成本阻碍了其在二氢香芹酮合成中的应用,因此需要在其催化过程中引入辅酶再生反应,实现辅酶循环利用和原位再生。
基于此,本研究克隆表达了来自枯草芽孢杆菌(Bacillus subtilis)9902中的葡萄糖脱氢酶(glucose dehydrogenase,GDH),并通过共表达和融合表达技术实现KlebER1A303N与GDH在大肠杆菌(Escherichia coli)中的高效共表达,比较和分析了KlebER1A303N和GDH在2种不同策略下的蛋白表达差异和催化特性差异,构建具有辅酶再生功能的工程菌,建立了制备二氢香芹酮的偶联催化体系(图1)。
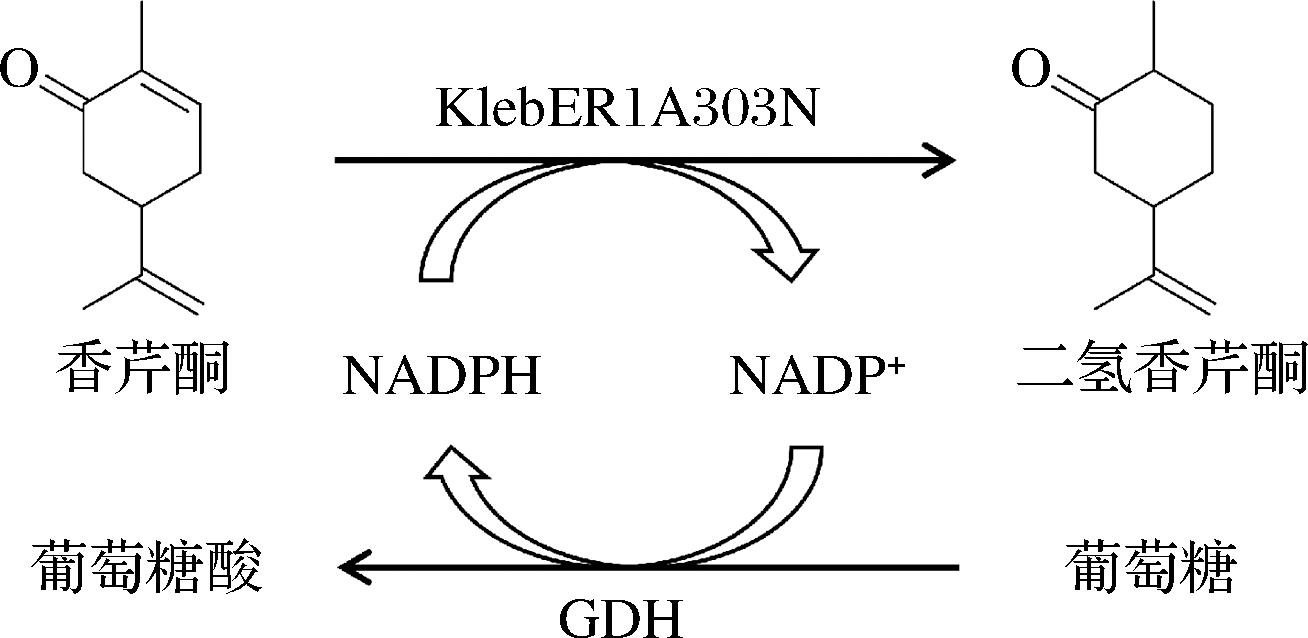
图1 合成二氢香芹酮的偶联催化体系
Fig.1 Coupling catalytic system for the production of dihydrocarvone
1 材料与方法
1.1 材料与设备
1.1.1 菌株和质粒
实验所用质粒pET-28a和pET-21a,以及菌株Bacillus subtilis 9902、Escherichia coli DH5α和E.coli BL21(DE3) 均为本实验室保存。
1.1.2 主要试剂和仪器
卡那霉素(kanamycin,Kan)、氨苄青霉素(ampicillin,Amp)、蛋白上样缓冲液、Marker、IPTG,北京索莱宝科技有限公司;Pfu DNA聚合酶、限制性内切酶、T4 DNA连接酶、EZ-10柱式PCR产物纯化试剂盒、EZ-10柱式DNA胶回收试剂盒、EZ-10柱式质粒小量抽提试剂盒,上海生工生物工程有限公司;香芹酮和二氢香芹酮,上海麦克林生化科技股份有限公司;氧化型辅酶NADP+,上海源叶生物科技有限公司;其他试剂均为国产分析纯;PCR引物设计和测序由上海生工生物工程有限公司完成,本研究中用到的引物如表1所示。
表1 本研究中用到的引物
Table 1 Primer used in the present study

引物引物序列(5′→3′)GDH-FATGTATCCGGATTTAAAAGGAAAAGTCGDH-RTTAACCGCGGCCTGCCTGKlebER1A303N-FCCATGGGCATGTCGGAAGCAKlebER1A303N-RCTCGAGCAGCGTAGGGTAGTKlebER1A303N-linker-GDH-FCCATGGGCATGTCGGAAGCAKlebER1A303N-linker-GDH-RCTCGAGACCGCGGCCTGGDH-linker-KlebER1A303N-FCCATGGGCATGTATCCGGATTGDH-linker-KlebER1A303N-RCTCGAGCAGCGTAGGGTAGT
T100 PCR仪,Bio-Rad生命医学产品有限公司;DYCZ-MINI 4型电泳仪,北京六一生物科技有限公司;ZF-258全自动凝胶成像分析系统,上海嘉鹏科技有限公司;H2050R大容量高速台式冷冻离心机,湖南湘仪实验室仪器开发有限公司;JY88-IIN超声波细胞粉碎机,宁波新芝生物科技股份有限公司;SP-DJ超净工作台,上海浦东物理光学仪器制造厂;双哈牌TX280型手提式不锈钢压力蒸汽灭菌器,上海三申医疗器械有限公司;THZ-98C恒温振荡器,上海一恒科技有限公司;Agilent 7890A型气相色谱仪(gas chromatography,GC),美国Agilent公司。
1.1.3 培养基
LB培养基(g/L):NaCl 10,蛋白胨10,酵母浸粉5,pH自然。对应的固体培养基添加20 g/L琼脂。LB液体与固体培养基使用前,根据需要添加Kan或Amp至终质量浓度分别为50 mg/L和100 mg/L。
1.2 实验方法
1.2.1 GDH的克隆与表达
以B.subtilis 9902基因组为模板,GDH-F和GDH-R为引物进行PCR扩增,PCR反应体系为:Pfu DNA聚合酶5 μL,上、下游引物各0.5 μL,模板1 μL,ddH2O 3 μL。PCR反应条件:95 ℃ 5 min;98 ℃ 10 s,55 ℃ 15 s,72 ℃ 10 s,30个循环;72 ℃ 1 min。经1%琼脂糖凝胶电泳后,利用试剂盒回收获取GDH基因片段。
使用限制性内切酶Nde I/Xho I对GDH基因片段和载体pET-21a进行双酶切,并通过T4 DNA连接酶将酶切后的产物和载体进行连接,构建重组质粒pET-21a-GDH,转化E.coli DH5α感受态,菌液PCR后筛选阳性克隆子进行测序验证。
将验证成功的重组质粒pET-21a-GDH转入E.coli BL21(DE3) 中表达,获得工程菌BL21-GDH。将工程菌接种于含Amp抗性的LB培养基,37 ℃、180 r/min培养至OD600值为0.5~0.7时,添加终浓度为0.8 mmol/L的IPTG进行诱导,20 ℃、100 r/min诱导20 h后,离心收集菌体,向菌体内加入适量的Tris-HCl缓冲液重悬,进行超声波破碎,离心收集破碎后的上清液和沉淀,分别取未诱导和诱导后的菌体、以及诱导后经过超声波破碎的上清液和沉淀,借助十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)分析蛋白GDH的表达情况。
1.2.2 烯还原酶KlebER1A303N的合成与表达
KlebER1A303N是在前期研究中通过半理性设计获得,即第303位丙氨酸A突变成天冬酰胺N,委托上海生工生物工程有限公司合成,片段大小为1 109 bp,并亚克隆到载体pET-28a上,获得重组质粒pET-28a-KlebER1A303N。将重组质粒转化E.coli BL21(DE3),获得工程菌BL21-KlebER1A303N。同样的,对该重组菌株进行低温IPTG诱导表达、超声波破碎、以及SDS-PAGE,分析蛋白KlebER1A303N的表达情况。
1.2.3 KlebER1A303N与GDH共表达体系的构建
利用双质粒共表达策略实现KlebER1A303N与GDH共表达,即在同一株菌中同时导入两个质粒,两个质粒上分别携带KlebER1A303N与GDH基因[10]。具体操作如下:将重组质粒pET-21a-GDH和pET-28a-KlebER1A303N共转化E.coli BL21(DE3) 感受态细胞,经菌液PCR和测序验证后,获得工程菌A(图2)。
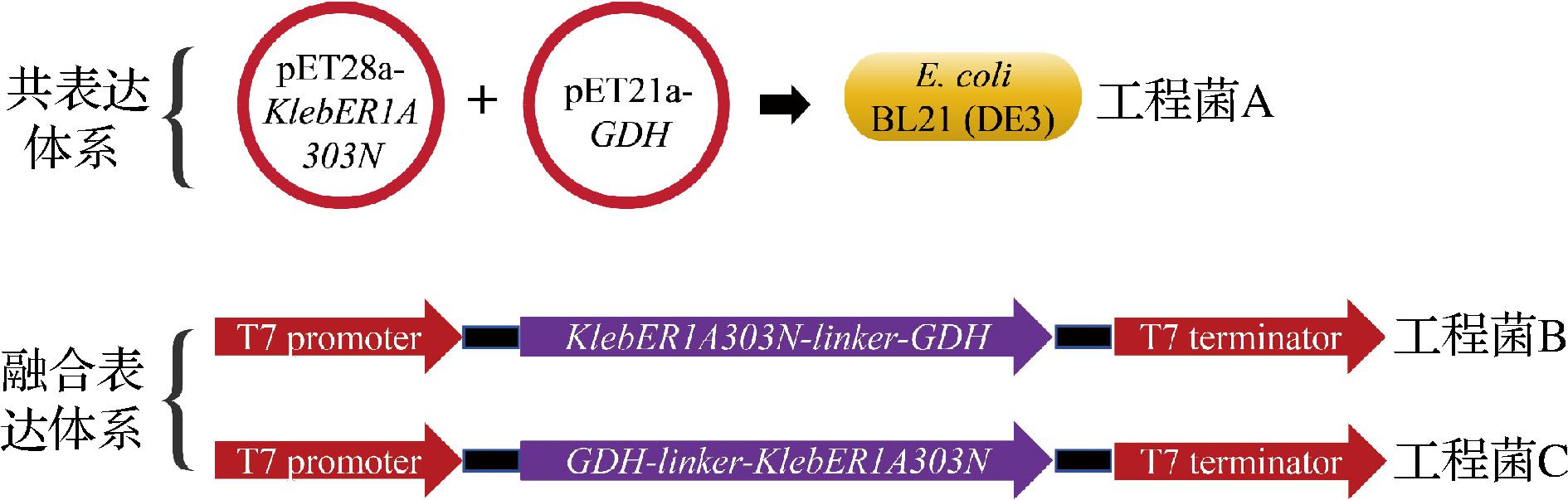
图2 KlebER1A303N与GDH共表达和融合表达构建策略
Fig.2 Construction strategies for the co-expression and fusion expression of KlebER1A303N and GDH
1.2.4 KlebER1A303N与GDH融合表达体系的构建
融合表达策略是利用柔性连接肽(linker)连接形成双功能蛋白,即在两个基因之间加上1个linker,从而实现单质粒融合表达[11]。具体操作如下:首先将KlebER1A303N和GDH的基因序列通过linker [GGCGGCGGCGGCAGC]连接,构建双酶融合基因序列KlebER1A303N-linker-GDH和GDH-linker-KlebER1A303N。然后,将融合基因亚克隆到载体pET28a上,构建重组质粒pET28a-KlebER1A303N-linker-GDH和pET28a-GDH-linker-KlebER1A303N。最后,将重组质粒分别转化E.coli BL21(DE3) 感受态细胞,经菌液PCR和测序验证后,获得工程菌B和工程菌C(图2)。
1.2.5 工程菌的蛋白表达
将成功构建好的工程菌A、B和C接种于含所需抗性的LB培养基中,于37 ℃、180 r/min培养至OD600值为0.5~0.7时,添加终浓度为0.8 mmol/L的IPTG进行诱导,20 ℃、100 r/min诱导20 h后,离心收集菌体,向菌体内加入适量的Tris-HCl缓冲液重悬,进行超声波破碎,离心收集破碎后的上清液和沉淀,分别取未诱导和诱导后的菌体、以及诱导后经过超声波破碎的上清液和沉淀,通过SDS-PAGE分析各工程菌中蛋白的表达情况。
1.2.6 工程菌催化合成二氢香芹酮
利用工程菌A、B和C进行催化底物香芹酮生成二氢香芹酮的反应。具体操作如下:对工程菌A、B和C进行低温IPTG诱导表达,离心收集菌体,用0.1 mol/L PBS洗涤菌体后再用等量PBS悬浮。随后添加0.5 mol/L葡萄糖,6 mmol/L香芹酮,0.5 mmol/L NADP+,在28 ℃、150 r/min的条件下进行反应,反应过程中定时取样,用于GC检测分析。
1.2.7 产物鉴定
利用GC对产物进行鉴定和分析。具体操作如下:将反应后的样品与萃取剂乙酸乙酯以1∶1的体积比例混合,萃取时长为60 s,萃取后收集上层有机相,经过无水硫酸钠吸水和0.22 μm滤膜过滤后,进行GC分析,实验重复3次。
GC条件:毛细管柱为HP-5(30 m×320 μm×0.25 μm),程序升温,起始温度40 ℃,保持3 min,以3 ℃/min升至160 ℃,保持2 min,再以8 ℃/min升至220 ℃,保持3 min。进样口温度250 ℃,氢火焰离子化检测器,检测器温度250 ℃[12]。
使用计算机谱和标准品(香芹酮和二氢香芹酮)进行定性分析,使用外标法进行香芹酮和二氢香芹酮定量分析,香芹酮标准曲线:y=2 817.2x-958.25,R2=0.991 6,y为峰面积,x为香芹酮浓度(mmol/L);二氢香芹酮标准曲线:y=2 274.9x,R2=0.998 9,y为峰面积,x为二氢香芹酮浓度(mmol/L)。
1.2.8 数据处理
使用Excel 2016和GraphPad Prism 8.0进行数据处理和绘图,使用Image J对SDS-PAGE条带的灰度值进行分析,使用SPSS 24.0对数据进行单因素方差分析,采用邓肯法进行显著性分析(*P<0.05,**P<0.01)。
2 结果与分析
2.1 GDH的克隆与表达
以B.subtili为模板、GDH-F/GDH-R为引物进行PCR扩增,琼脂糖凝胶电泳结果显示扩增条带大小与目的基因GDH片段大小(792 bp)一致(图3-a)。随后将获得的GDH基因和通过限制性内切酶处理的载体pET-21a连接,得到重组质粒pET-21a-GDH,图谱如图3-b所示,并对重组质粒进行Nde I/Xho I双酶切鉴定,结果如图3-c所示,酶切后得到2个大小分别为792 bp和5 400 bp的片段,与预期结果相符,表明重组质粒构建成功。最后,将重组质粒转化至E.coli DH5α感受态细胞,获得重组菌并进行菌液PCR和测序验证(图3-d)。
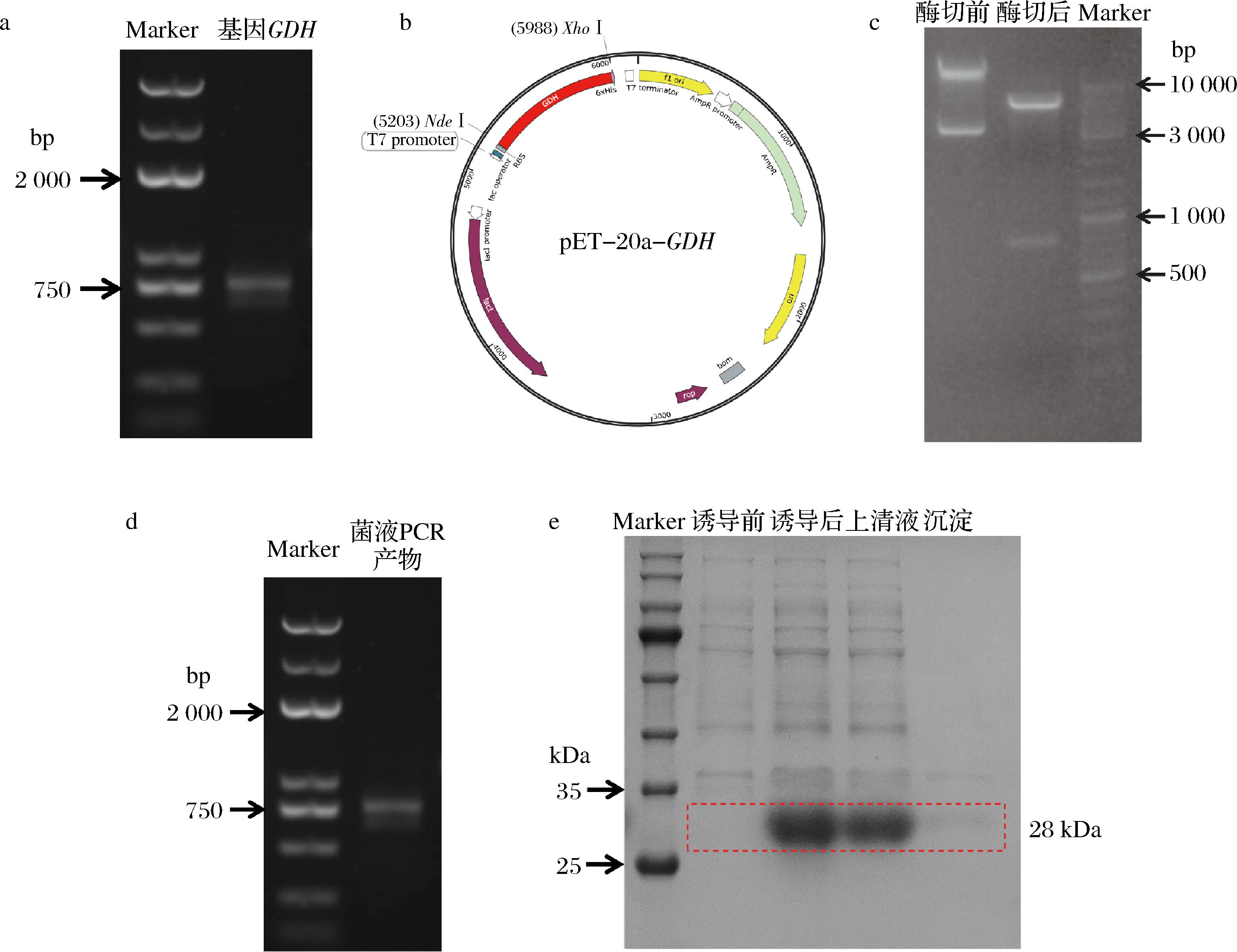
a-基因GDH电泳图;b-重组质粒pET-21a-GDH图谱;c-重组质粒及其酶切产物电泳图;d-菌液PCR电泳图;e-GDH表达蛋白电泳图
图3 GDH的克隆与表达
Fig.3 Cloning and expression of GDH
将验证成功的重组质粒pET-21a-GDH转化E.coli BL21(DE3),获得工程菌BL21-GDH,并对其进行低温诱导表达,SDS-PAGE结果如图3-e所示,在分子质量为25~35 kDa有一条明显的蛋白条带,在经过诱导之后该条带明显变粗,与GDH的分子质量(28 kDa)一致,说明GDH蛋白为可溶性表达。
2.2 烯还原酶KlebER1A303N的合成与表达
重组质粒pET-28a-KlebER1A303N的构建图谱如图4-a所示,对该重组质粒进行双酶切鉴定,琼脂糖凝胶电泳结果显示得到大小约为2 042 bp和5 200 bp的2个片段,与预期结果相符(图4-b),表明重组质粒构建成功。随后,将重组质粒转化E.coli BL21(DE3),获得工程菌并对其进行低温诱导表达,SDS-PAGE结果显示烯还原酶KlebER1A303N蛋白(分子质量39 kDa)为可溶性表达(图4-c)。
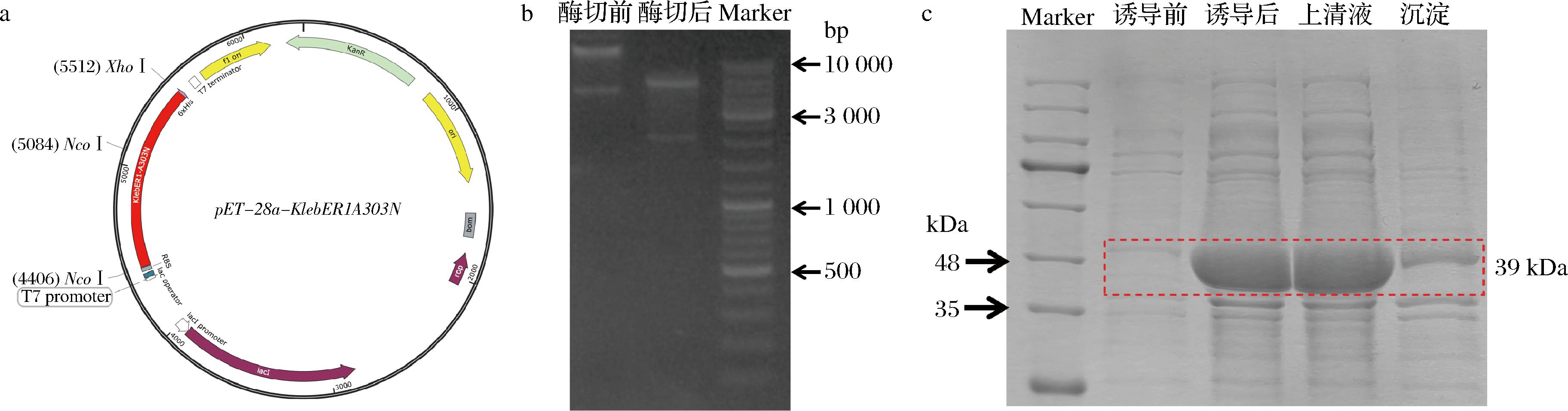
a-重组质粒pET-28a-KlebER1A303N图谱;b-重组质粒及其酶切产物电泳图;c-KlebER1A303N表达蛋白电泳图
图4 烯还原酶KlebER1A303N的合成与表达
Fig.4 Synthesis and expression of the ene reductase KlebER1A303N
2.3 KlebER1A303N与GDH共表达体系的构建与表达
将重组质粒pET-28a-KlebER1A303N和pET-21a-GDH共转化E.coli BL21(DE3),经菌液PCR和测序验证后,获得工程菌A(图5-a)。
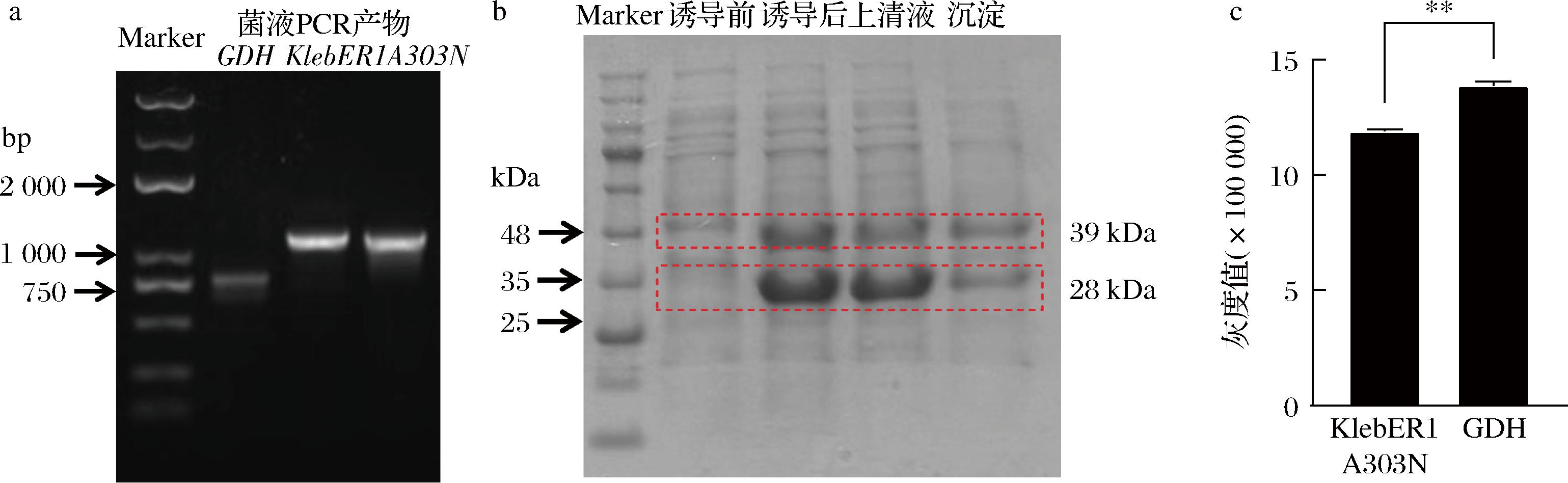
a-菌液PCR电泳图;b-KlebER1A303N与GDH共表达蛋白电泳图;c-SDS-PAGE电泳图灰度值
图5 KlebER1A303N与GDH共表达体系的构建与表达
Fig.5 Construction and expression of the co-expression system of KlebER1A303N and GDH
注:**表示P<0.01为极显著。
将工程菌A进行低温诱导表达,SDS-PAGE结果表明工程菌A诱导表达后,在获得的上清液中观察到2条与KlebER1A303N和GDH大小相对应的条带,分子质量分别为39 kDa和28 kDa,说明2种目的蛋白均显示出良好的表达效果(图5-b)。但他们的表达量存在差别,GDH表达量是明显高于KlebER1A303N表达量(图5-c)。徐建妙等[13]在亮氨酸脱氢酶(leucine dehydrogenase,LeuDH)和甲酸脱氢酶(formate dehydrogenase,FDH)共表达合成L-2-氨基丁酸的研究中,也发现FDH的表达量是多于LeuDH的表达量。然而研究人员在研究(S)-羰基还原酶II[(S)-carbonyl reductase II, SCRII]和GDH共表达、S-亚胺还原酶(S-Imine reductase,IRED)和GDH共表达、以及老黄酶(YqjM)和GDH共表达时发现,SCRII、IRED或YqjM的表达量是明显高于GDH的表达量[11,14-15]。在双质粒共表达中,目的基因的表达水平可能会受到表达条件的影响[10]。通过诱导温度、IPTG浓度、诱导时间等条件的优化,可以有效提高共表达体系中酶蛋白的表达量[13]。
2.4 KlebER1A303N与GDH融合表达体系的构建与表达
多个蛋白的共表达可能会出现细胞生长速率减少、蛋白表达效果差、酶催化性能低等问题。故而,将多个酶以单一的融合酶形式表达是一种更受青睐的策略,融合蛋白的“邻近效应”有利于实现更高效的级联反应[16]。此外,在融合蛋白中,不同的基因排列顺序可能会影响基因的表达效率、蛋白的正确折叠、酶的功能及活性、以及辅因子的协调等[17-18]。因此,研究基因的排列方式对于融合蛋白非常重要。本研究以pET-28a为载体,通过linker [GGCGGCGGCGGCAGC] 构建了基因顺序不同的重组质粒pET28a-KlebER1A303N-linker-GDH和pET28a-GDH-linker-KlebER1A303N,并将重组质粒转化E.coli BL21(DE3) 感受态,经菌液PCR和测序验证后,获得工程菌B和C(图6-a)。

a-菌液PCR电泳图;b-KlebER1A303N-linker-GDH融合表达蛋白电泳图;c-GDH-linker-KlebER1A303N融合表达蛋白电泳图
图6 KlebER1A303N与GDH融合表达体系的构建与表达
Fig.6 Construction and expression of the fusion expression system of KlebER1A303N and GDH
SDS-PAGE结果显示,工程菌B和C经诱导表达后,在融合酶KlebER1A303N-linker-GDH和GDH-linker-KlebER1A303N的上清液中都出现了明显的蛋白条带,分子质量为63~75 kDa,与预期相符(67 kDa),表明融合蛋白成功实现了可溶性表达(图6-b和6-c)。
2.5 工程菌催化合成二氢香芹酮
以工程菌A、B和C为催化剂,以氧化型辅酶NADP+为辅酶供体,催化香芹酮(6 mmol/L)的还原反应,反应完成后利用GC检测底物和产物的含量,结果如图7所示。在工程菌A、B和C中,底物香芹酮含量的变化趋势一致,随着反应进程的推进,其含量呈现逐渐下降的趋势。对于产物二氢香芹酮,在整个反应过程中,工程菌B和C产生的二氢香芹酮产量总体上是高于工程菌A,表明融合表达的效果优于共表达。此外,虽然工程菌B和C催化香芹酮生成二氢香芹酮的最高产量(3 mmol/L)相同,但工程菌B生成二氢香芹酮的速率较快,在反应3 h时转化率达到50%,而工程菌C则需要6 h,表明融合表达中基因的排列顺序对于工程菌催化合成二氢香芹酮有一定的影响。
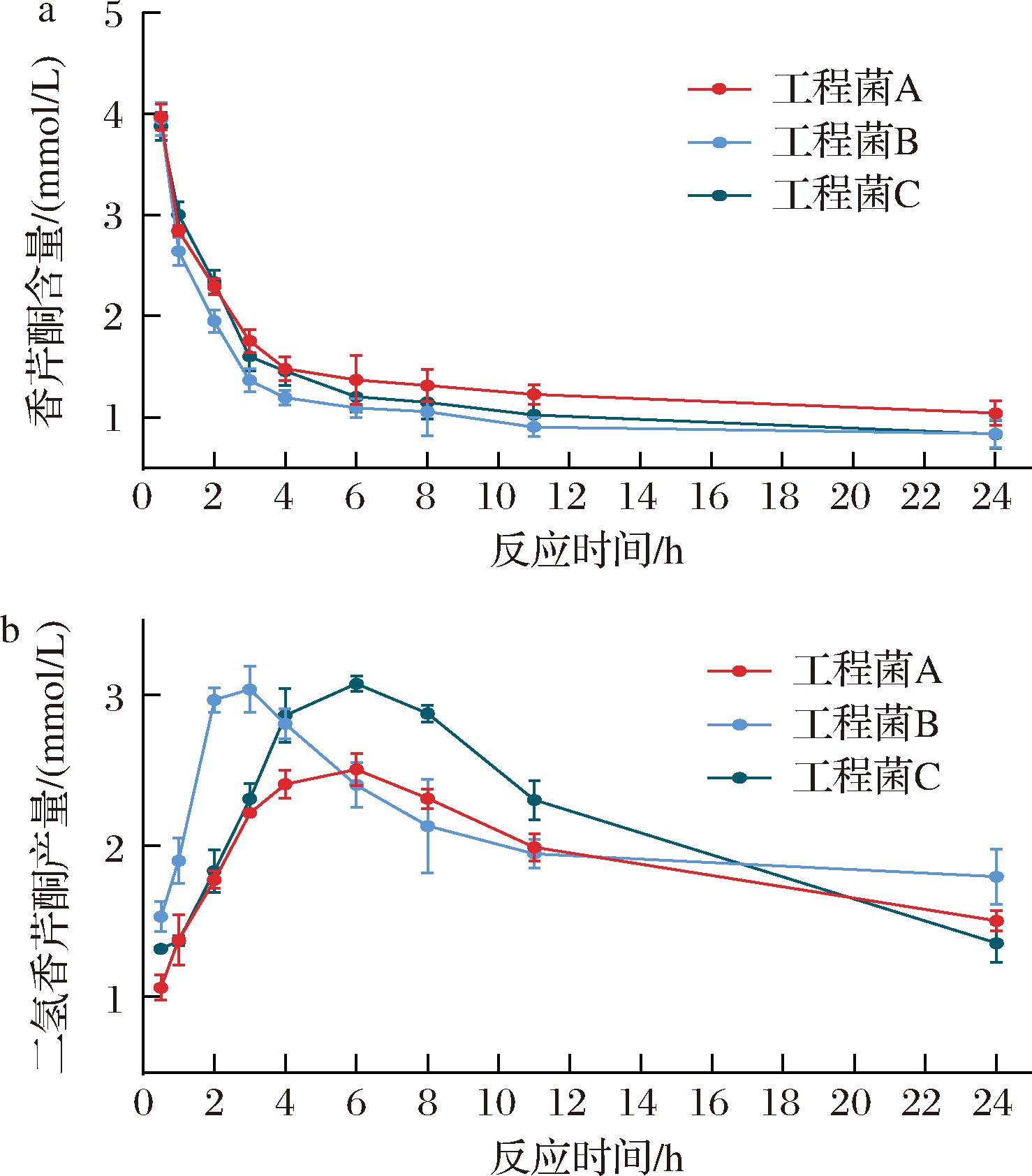
a-香芹酮浓度随时间变化曲线;b-二氢香芹酮浓度随时间变化曲线
图7 工程菌催化合成二氢香芹酮
Fig.7 Production of dihydrocarvone catalyzed by engineered bacteria
3 结论与讨论
前期研究结果表明KlebER1A303N具有较高的催化活性、以及良好的pH和温度适应性,在辅酶NADPH的参与下,能催化香芹酮还原生成二氢香芹酮。但NADPH的高成本阻碍了其在二氢香芹酮合成中的应用,构建辅酶再生循环体系是实现高效且低成本制备二氢香芹酮的有效手段。来自B.subtilis的GDH具有稳定性高、耐受性好、底物谱广泛等特点,可用于NAD(P)H辅酶的循环[19-20]。已有的研究表明,纯化后的ERs与GDH联用可以实现辅酶再生,有效减少辅酶在反应中的使用量。例如WU等[21]利用来自干酪棒杆菌(Corynebacterium casei)UCMA 3821的烯还原酶CcER与GDH体外偶联,以香芹酮(20 mmol/L)为底物,孵育12 h后转化率达到98%;GAO等[22]将来自干酪乳酪杆菌Zhang的烯还原酶LacER异源表达,同样利用LacER纯酶以及外源性添加GDH的辅酶再生体系反应12~16 h后,将香芹酮转化为二氢香芹酮(底物浓度42 mmol/L,转化率99%)。尽管游离的两种纯酶偶联也能实现辅酶再生,并且香芹酮转化率均高于本实验中全细胞催化的转化率,但该方法需要进行菌体收集、破碎和酶纯化等繁杂步骤,还存在反应后纯酶与产物难以分离,操作繁琐且成本高昂等问题。相较之下,全细胞催化操作简单、环保经济,可重复利用,具有显著优势。
本研究通过构建KlebER1A303N和GDH的双酶共表达菌株,实现两种酶在同一个细胞内的表达,并以该全细胞为催化剂催化二氢香芹酮的合成。然而,不同的共表达策略对于目的酶蛋白的表达量不同,从而致使双酶协同反应的效率和最终产物的产量有所差异[10]。因此,本文比较了双质粒共表达和融合表达策略对KlebER1A303N和GDH蛋白表达量以及产物二氢香芹酮产量的影响。结果指出共表达和融合表达均能成功表达出所需的目的蛋白,并且催化香芹酮生成二氢香芹酮。但融合表达工程菌产生的二氢香芹酮产量是高于共表达工程菌,这可能是因为融合蛋白的“邻近效应”,融合蛋白中两个酶的活性位点相互接近,能够有效提高催化反应的效率,从而增加产物的产量[23]。同时,蛋白融合表达也能够提高酶的稳定性,进一步促进产物的合成[24]。一些研究也指出融合酶相较于共表达酶,具有较高的表达量以及较强的催化活性。例如,李泳幸[11]发现YqjM与GDH融合表达比共表达有更强表达水平,且YqjM与GDH融合几乎不影响它们各自的催化活性。TORRES PAZMI O等[25]将亚磷酸脱氢酶(phosphite dehydrogenase,PTDH)与Baeyer-Villiger单加氧酶(Baeyer-Villiger monooxygenase, BVMO)进行融合表达,发现获得的融合蛋白能够更好地发挥双功能酶的催化能力,将酮类底物转化为酯或内酯。
O等[25]将亚磷酸脱氢酶(phosphite dehydrogenase,PTDH)与Baeyer-Villiger单加氧酶(Baeyer-Villiger monooxygenase, BVMO)进行融合表达,发现获得的融合蛋白能够更好地发挥双功能酶的催化能力,将酮类底物转化为酯或内酯。
基因的排列顺序也是融合表达设计的关键步骤,融合的顺序对酶蛋白的功能和活性至关重要。研究人员指出,在含有黄素单加氧酶(flavin-containing monooxygenase,FMO-E)和马肝醇脱氢酶(horse liver alcohol dehydrogenase,HLADH)的融合蛋白中,HLDH位于融合酶的C端时,其保留的活性比位于N端更多[17,26]。在本研究中,发现不论GDH位于融合酶的C端还是N段,都可以催化香芹酮合成二氢香芹酮,但GDH位于融合酶的N端时,其催化速率比位于C端更快。源于Bacillus sp.的GDH是四聚体,在与KlebER1A303N融合过程中,可能由于空间位阻的影响,导致GDH活性下降[27]。此外,C端His标签可能会抑制GDH的活性,进一步影响产物的合成[10]。本研究中使用的融合表达载体pET28a在C端含有His标签,可能对工程菌催化合成二氢香芹酮有一定的影响。
总体来说,本研究以KlebER1A303N在二氢香芹酮合成中原位辅因子再生循环的问题为出发点,构建了KlebER1A303N和GDH的共表达体系,实现了辅酶NADPH在胞内的循环再生。以双酶共表达的全细胞作为催化剂进行二氢香芹酮的合成反应,增加了酶对外部环境变化的适应性,减少了辅酶的用量,降低了二氢香芹酮的生产成本,为二氢香芹酮的规模化生产奠定了基础。然而共表达体系中双酶的表达量和活性还受到其他诸多因素的影响,如表达质粒、发酵条件、底物浓度等,后续将进一步对其进行研究,以提高双酶的催化效率和产物的产量。
[1] ZHANG L L, CHEN Y, LI Z J, et al.Bioactive properties of the aromatic molecules of spearmint (Mentha spicata L.) essential oil:A review[J].Food &Function, 2022, 13(6):3110-3132.
[2] FAN X Y, YU Y, YAO Y, et al.Applications of ene-reductases in the synthesis of flavors and fragrances[J].Journal of Agricultural and Food Chemistry, 2024, 72(33):18305-18320.
[3] YANG X, HAN H, LI B L, et al.Fumigant toxicity and physiological effects of spearmint (Mentha spicata, Lamiaceae) essential oil and its major constituents against Reticulitermes dabieshanensis[J].Industrial Crops and Products, 2021, 171:113894.
[4] FENG J C, YE H R, LU C X, et al.Application of protein engineering to ene-reductase for the synthesis of chiral compounds through asymmetric reaction[J].Critical Reviews in Biotechnology, 2024, 12:1-18.
[5] SHI Q H, JIA Y T, WANG H B, et al.Identification of four ene reductases and their preliminary exploration in the asymmetric synthesis of (R)-dihydrocarvone and (R)-profen derivatives[J].Enzyme and Microbial Technology, 2021, 150:109880.
[6] AREGGER D, PETERS C, BULLER R M.Characterization of the novel ene reductase ppo-Er1 from Paenibacillus polymyxa[J].Catalysts, 2020, 10(2):254.
[7] ZHANG B Q, SUN J L, ZHENG Y Q, et al.Identification of a novel ene reductase from Pichia angusta with potential application in (R)-levodione production[J].RSC Advances, 2022, 12(22):13924-13931.
[8] CHEN L, ZHANG L L, REN J N, et al.Screening a strain of Klebsiella sp.O852 and the optimization of fermentation conditions for trans-dihydrocarvone production[J].Molecules, 2021, 26(9):2432.
[9] ZHANG L L, FAN G, LI X, et al.Identification of functional genes associated with the biotransformation of limonene to trans-dihydrocarvone in Klebsiella sp.O852[J].Journal of the Science of Food and Agriculture, 2022, 102(8):3297-3307.
[10] 杨兴龙, 穆晓清, 聂尧, 等.亮氨酸脱氢酶与葡萄糖脱氢酶高效共表达制备L-叔亮氨酸[J].微生物学报, 2016, 56(11):1709-1718.
YANG X L, MU X Q, NIE Y, et al.High efficient co-expression of leucine dehydrogenase and glucose dehydrogenase in Escherichia coli[J].Acta Microbiologica Sinica, 2016, 56(11):1709-1718.
[11] 李泳幸. 老黄酶YqjM重组体系催化共轭烯酮的不对称还原[D].天津:河北工业大学, 2021.
LI Y X.Asymmetric reduction of conjugatedenones by biocatalytic system of oldyellow enzymes[D].Tianjin:Hebei University of Technology, 2021.
[12] ZHANG L L, HUANG J L, CHEN Y, et al.Transcription factor PdTP1 regulates the biotransformation of limonene to α-terpineol and the growth of Penicillium digitatum[J].Journal of Agricultural and Food Chemistry, 2024, 72(35):19447-19461.
[13] 徐建妙, 陈策, 张博, 等.亮氨酸脱氢酶与甲酸脱氢酶共表达菌株发酵产酶条件优化及其在L-2-氨基丁酸合成中的应用[J].食品与发酵工业, 2019, 45(10):29-35.
XU J M, CHEN C, ZHANG B, et al.Optimized conditions for Escherichia coli(LeuDH/FDH) co-expressing leucine dehydrogenase and formate dehydrogenase for producing L-2-aminobutyric acid[J].Food and Fermentation Industries, 2019, 45(10):29-35.
[14] 姜佳伟, 张荣珍, 周晓天, 等.(S)-羰基还原酶Ⅱ与葡萄糖脱氢酶共催化高效合成(S)-苯乙二醇[J].微生物学报, 2016, 56(10):1647-1655.
JIANG J W, ZHANG R Z, ZHOU X T, et al.Efficient biosynthesis of (S)-1-phenyl-1, 2-ethanediol catalyzed by (S)-carbonyl reductase Ⅱ and glucose dehydrogenase[J].Acta Microbiologica Sinica, 2016, 56(10):1647-1655.
[15] 李骥璇, 余磊, 李京美, 等.S-亚胺还原酶和葡萄糖脱氢酶共表达系统的构建及手性胺的合成[J].生物技术通报, 2019, 35(1):105-111.
LI J X, YU L, LI J M, et al.Construction of co-expression system of S-imine reductase and glucose dehydrogenase and synthesis of chiral amine[J].Biotechnology Bulletin, 2019, 35(1):105-111.
[16] WHEELDON I, MINTEER S D, BANTA S, et al.Substrate channelling as an approach to cascade reactions[J].Nature Chemistry, 2016, 8(4):299-309.
[17] AALBERS F S, FRAAIJE M W.Coupled reactions by coupled enzymes:Alcohol to lactone cascade with alcohol dehydrogenase-cyclohexanone monooxygenase fusions[J].Applied Microbiology and Biotechnology, 2017, 101(20):7557-7565.
[18] ELLEUCHE S.Bringing functions together with fusion enzymes-from nature’s inventions to biotechnological applications[J].Applied Microbiology and Biotechnology, 2015, 99(4):1545-1556.
[19] XU Z N, JING K J, LIU Y, et al.High-level expression of recombinant glucose dehydrogenase and its application in NADPH regeneration[J].Journal of Industrial Microbiology &Biotechnology, 2007, 34(1):83-90.
[20] ZHANG W, O’CONNOR K, WANG D I C, et al.Bioreduction with efficient recycling of NADPH by coupled permeabilized microorganisms[J].Applied and Environmental Microbiology, 2009, 75(3):687-694.
[21] WU S J, MA X J, YAN H D.Identification and characterization of an ene-reductase from Corynebacterium casei[J].International Journal of Biological Macromolecules, 2024, 264:130427.
[22] GAO X, REN J, WU Q, et al.Biochemical characterization and substrate profiling of a new NADH-dependent enoate reductase from Lactobacillus casei[J].Enzyme and microbial technology, 201, 51(1):26-34.
[23] MONTERREY D T, AYUSO-FERN NDEZ I, OROZ-GUINEA I, et al.Design and biocatalytic applications of genetically fused multifunctional enzymes[J].Biotechnology Advances, 2022, 60:108016.
NDEZ I, OROZ-GUINEA I, et al.Design and biocatalytic applications of genetically fused multifunctional enzymes[J].Biotechnology Advances, 2022, 60:108016.
[24] XU Z, CEN Y K, ZOU S P, et al.Recent advances in the improvement of enzyme thermostability by structure modification[J].Critical Reviews in Biotechnology, 2020, 40(1):83-98.
[25] TORRES PAZMI O D, DR R S, BAAS B J, et al.Self-sufficient Baeyer-Villiger monooxygenases:Effective coenzyme regeneration for biooxygenation by fusion engineering[J].Angewandte Chemie International Edition, 2008, 47(12):2275-2278.
O D, DR R S, BAAS B J, et al.Self-sufficient Baeyer-Villiger monooxygenases:Effective coenzyme regeneration for biooxygenation by fusion engineering[J].Angewandte Chemie International Edition, 2008, 47(12):2275-2278.
[26] HUANG D L, AALBERS F S, TANG W, et al.Convergent cascade catalyzed by monooxygenase-alcohol dehydrogenase fusion applied in organic media[J].ChemBioChem, 2019, 20(13):1653-1658.
[27] CHEN X J, DING H T, DU Y Q, et al.Cloning, expression and characterization of a glucose dehydrogenase from Bacillus sp.G3 in Escherichia coli[J].African Journal of Microbiology Research, 2011, 5(32):5882-5888.