骆驼是一种古老而神奇的动物,被誉为沙漠之舟。骆驼在极端恶劣的环境中生活了数千年,其独特的适应性和生存能力备受关注。驼乳具有丰富的营养成分,相较牛乳,驼乳与人乳一样均含有较高含量的β-酪蛋白,并且不含诱发过敏的β-乳球蛋白,骆驼乳中αS1-酪蛋白、αS2-酪蛋白、β-酪蛋白和κ-酪蛋白的质量比为26∶4∶67∶3,而牛乳中为38∶10∶36∶12[1]。不像牛乳中的乳清蛋白以β-乳球蛋白为主,其次为α-乳清蛋白(α-LA),占26.0%,而驼乳富含α-乳白蛋白(0.3~2.9 g/L,50%),其次为血清白蛋白(35%),缺少β-乳球蛋白,与人乳相似。研究发现,与其他哺乳动物的乳汁相比,驼乳的维生素C和钾盐含量更高,并且富含Zn、Se、Ca、Na、Mg、Fe、Cu等矿物质元素,ATWAA等[2]研究表明,驼乳中的脂肪球体积小,比牛乳更容易被人体消化吸收。并且根据目前相关的研究报道,还未发现有食用驼乳后出现乳糖不耐受相关症状的现象发生,因而驼乳可能是患有乳糖不耐症人群的最佳选择。驼乳比牛乳含有更多的游离氨基酸和多肽[3],乳中的非蛋白结合氨基酸容易被微生物消化,因此,驼乳在用作发酵剂时具有较高的代谢活性[4],并且驼乳脂肪球较小,这可能使得驼乳脂肪相对更易于被人体消化、吸收和利用。
驼乳中所含的人体必需氨基酸较平衡,含有高比例的易水解的β-酪蛋白,这使得驼乳在营养价值方面具有优势。除了富含多种营养成分外,驼乳也被认为对多种慢性疾病具有辅助治疗的效果,有研究显示,驼乳有助于降低患糖尿病的风险。例如,DEEPALI等[5]发现与其他不喝驼乳的地区相比,经常饮用驼乳的骆驼饲养员和牧民在预防糖尿病方面表现更佳。EJTAHED等[6]研究表明,在食用驼乳两个月后,胰岛素水平显著升高,从而有助于将血糖调节至健康范围。有研究表明,骆驼乳清蛋白(camel whey protein,CWP)及其水解物对二肽基肽酶IV(dipeptidyl peptidase Ⅳ,DPP-IV)和人胰岛素受体活性有抑制作用,有助于调节血糖水平。驼乳和发酵驼乳具有利尿排毒的功效,在辅助治疗肾病方面能发挥一定作用。在蒙古国就常采用埋沙和喝发酵驼乳相结合的方法,以促进肾脏疗养。与牛乳相比,驼乳对健康有诸多益处,如饱和脂肪酸、乳糖和酪蛋白等对健康有害化合物的含量较低,而维生素、矿物质和生物活性蛋白等有益化合物的含量较高,因其具有抗氧化潜力,驼乳有助于改善肾脏问题,其中的抗氧化剂或许也有助于调节人体血糖[7]。因其比牛乳具有更好的消化率和营养价值,驼乳成为人们日常饮用乳的优质选择[8]。而且越来越多的证据表明,骆驼乳蛋白的水解物表现出了许多与人类健康相关的生物活性功能,例如,它具有抗氧化[9]作用,有助于降低血糖[10-11],降低血压[12],在抵抗癌症[13]和抗菌活性[14-15]方面也能发挥一定作用。
在冷藏原料乳过程中,大约有90%的微生物属于嗜冷菌,该菌种来源广泛,易对原料乳品质产生负面影响。被划分为21个属,76个种。假单胞菌是主要污染菌种,可在低温条件下生长并产生多种活性酶。部分假单胞菌在热处理后仍具活性,甚至能形成生物膜增强自身的抵抗力,提高酶的表达量。原料乳在低温冷藏的条件下,其主要微生物嗜冷菌会大量生长繁殖产生脂肪酶和蛋白酶,导致脂肪及蛋白质分解,产生苦味、涩味、凝胶化、脂肪氧化和腐臭等问题。从而影响乳的品质,限制原料乳的货架期。这些菌种可能导致原料乳腐败,影响乳制品品质和货架期,所以在处理和保存过程中,需要采取适当的措施来保证产品的质量和安全性,常常采用冷藏的方式来延长货架期。因此,本研究对原料驼乳冷藏过程的理化性质及结构特征进行研究,从而分析冷藏原料驼乳的品质变化规律。
1 材料与方法
1.1 材料与试剂
原料驼乳样品于7月采自内蒙古阿拉善巴丹吉林镇当地牧场,连续3 d采集3个牧场的驼乳样品,将当天所有骆驼的鲜乳混合后(约25~30峰),无菌取样并在液氮中冷藏,运回实验室无菌分装,4 ℃下冷藏0、1、2、3、4、5、6 d。
VRBA琼脂、MRS琼脂培养基、蛋白胨-盐溶液、胰蛋白胨、酵母浸膏,青岛海博生物技术有限公司;葡萄糖、NaCl,福晨化学试剂有限公司;琼脂,索莱宝生物科技有限公司;脂肪酶酶联免疫试剂盒、蛋白酶酶联免疫试剂盒、脂蛋白酯酶酶联免疫试剂盒、过氧化氢酶酶联免疫试剂盒,上海酶联生物科技有限公司。
1.2 仪器与设备
SQ810C立式压力蒸汽灭菌器,重庆雅马拓科技有限公司;PX2202ZH电子分析天平(1%),奥豪斯仪器有限公司;MS7-H550-Pro恒温磁力搅拌器,北京大龙仪器有限公司;SPX-150B-ZII生化培养箱、HH.S21-4电热恒温水浴锅、BGZ-146电热恒温鼓风干燥箱、SW-CJ-2FD双人单面净化工作台,上海博迅实业有限公司;FE28 pH计,梅特勒托利多科技有限公司;C-32厌氧罐,上海徕仪生物科技有限公司;MasterTouch-RUVF超纯水机,上海和泰仪器有限公司;Milkoscan Mars乳成分快速分析仪,福斯华科贸有限公司;Ei三目生物显微镜摄像系统显微镜,尼康股份有限公司;SpectraMax® 190酶标仪,北嘉美仪生物科技有限公司。
1.3 实验方法
1.3.1 主要理化品质检测
使用乳成分快速分析仪通过超声波技术和红外全谱扫描法相结合的方式,对乳制品样品中的蛋白质、脂肪、乳糖等成分进行定量分析和检测。根据GB 5009.237—2016《食品安全国家标准 食品pH值的测定》,对样品的pH值进行检测。
1.3.2 微生物指标检测
菌落总数(total bacterial count,TBC)、大肠菌群数、嗜冷菌数(psychorophile bacterial count,PBC)及乳酸菌数分别按照GB 4789.2—2022《食品安全国家标准 食品微生物学检验 菌落总数测定》、GB 4789.3—2016《食品安全国家标准 食品微生物学检验 大肠菌群计数》、NY/T1331—2007《乳与乳制品中嗜冷菌、需氧芽孢及嗜热需氧芽孢数的测定》及GB 4789.35—2016《食品安全国家标准 食品微生物学检验 乳酸菌检验》进行检测。
1.3.3 关键酶活性测定
采用双抗体夹心法测定标本中驼乳总蛋白酶、脂肪酶、脂蛋白脂肪酶(lipoprotein lipase,LPL)和过氧化氢酶(catalase,CAT)水平。具体按照说明书操作,采用酶标仪在450 nm波长下测定吸光度(OD值),通过标准曲线计算样品中酶活性浓度。
1.3.4 傅里叶红外光谱测定
将热处理样品与KBr按质量比1∶100的比例充分混合均匀,进行研磨压片处理,随后使用傅里叶变换红外光谱仪扫描热处理驼乳蛋白的红外光谱。扫描范围为4 000~400 cm-1,扫描次数为64次,分辨率为8 cm-1。
1.3.5 SDS-PAGE
先制作12%分离胶和5%浓缩胶。然后取冷藏的原料乳样品和还原型上样缓冲液按体积比4∶1的比例进行混合,放置于水浴锅中100 ℃加热5 min,冷却至室温后上样7 μL,然后进行电泳,设置80 V的电压运行30 min,等到条带跑完浓缩液时再将电压设置成120 V直至胶体跑完,分离的蛋白用考马斯亮蓝染色,然后用脱色液在45 ℃下脱色3次,每次20 min,最后放入4 ℃冰箱脱色过夜,使用凝胶成像扫描分析。
1.3.6 相关性分析
通过Origin 2021进行Pearson相关性分析,对组间及组内差异进行主成分分析(principal components analysis,PCA)。
2 结果与分析
2.1 冷藏过程中原料乳主要理化性质变化
研究表明,中国双峰驼乳平均蛋白质含量为3.96%,根据内蒙古自治区卫生健康委员会发布的行业标准,驼乳平均蛋白质含量大于3.7 g/100 g,平均脂肪含量大于4.0 g/100 g,经测定,本研究中所采集的原料乳样品在蛋白质和脂肪含量方面均显著高于内蒙古双峰驼乳的平均水平,确保了本研究所使用的原料乳具有较高的品质水平,为后续的实验提供了可靠基础。如表1所示,原料乳脂肪含量在冷藏第2天(4.46 g/100 g)后开始显著下降至第6天的3.51 g/100 g。乳脂肪主要由甘油三酯、磷脂和甾醇组成[16],其中微生物产生的脂肪酶会将甘油三酯分解为游离脂肪酸,而磷脂则会被磷脂酶分解[17]。因此,冷藏后期原料乳中的脂肪含量下降可能与磷脂酶的作用有关。在蛋白质方面,初始时原料乳的蛋白质含量为4.4 g/100 g,随后在冷藏3 d时下降到最低点(3.96 g/100 g)。嗜冷微生物的内源性纤溶酶系统会分解产生耐热蛋白酶水解κ-酪蛋白,导致蛋白质含量下降,而κ-酪蛋白的水解会导致酪蛋白胶束的不稳定,并产生导致苦味的小肽。
表1 原料乳在冷藏6 d期间主要理化性质变化
Table 1 Changes of main physical and chemical properties of raw milk during cold storage for 6 days
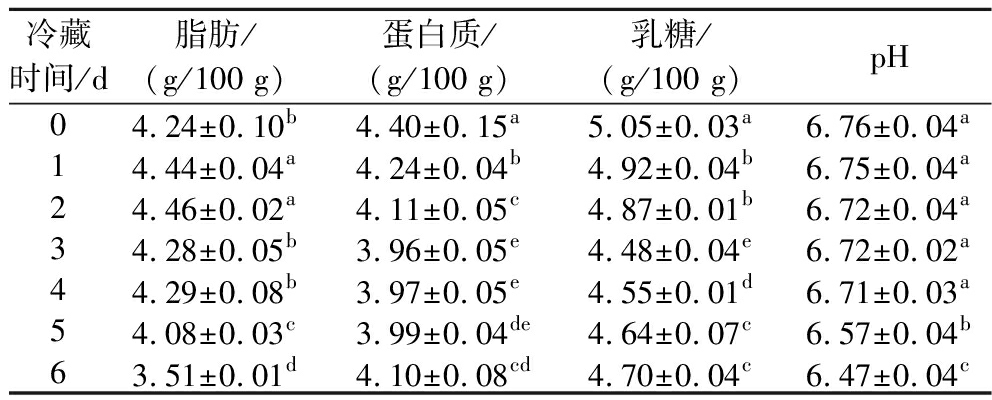
冷藏时间/d脂肪/(g/100 g)蛋白质/(g/100 g)乳糖/(g/100 g)pH04.24±0.10b4.40±0.15a5.05±0.03a6.76±0.04a14.44±0.04a4.24±0.04b4.92±0.04b6.75±0.04a24.46±0.02a4.11±0.05c4.87±0.01b6.72±0.04a34.28±0.05b3.96±0.05e4.48±0.04e6.72±0.02a44.29±0.08b3.97±0.05e4.55±0.01d6.71±0.03a54.08±0.03c3.99±0.04de4.64±0.07c6.57±0.04b63.51±0.01d4.10±0.08cd4.70±0.04c6.47±0.04c
注:不同小写字母表示差异显著(P<0.05)(下同)。
驼乳中主要的糖为哺乳动物合成的乳糖,乳糖含量在冷藏过程中呈现出一定的变化趋势。初次冷藏后,乳糖含量为5.05 g/100 g,冷藏第3天达到最低值4.48 g/100 g。而随后,在冷藏第6天时,乳糖含量略有上升至4.69 g/100 g。乳糖能够被乳酸菌乳糖酶分解生成葡萄糖和半乳糖,同时原料乳中的乳酸菌也会在乳糖的分解过程中起到积极影响,从而导致乳糖的含量变化。在本实验中,原料乳pH总体呈下降趋势,这可能由于冷藏过程微生物分解乳糖等物质,从而导致pH下降[18]。
2.2 冷藏过程中蛋白质含量变化分析
通过对不同冷藏时间原料乳蛋白样品进行SDS-PAGE结果如图1所示。条带从上到下依次为:乳铁蛋白(lactoferrin,LF)、血清白蛋白(serum albumin,SA)、酪蛋白(包括α-酪蛋白、β-酪蛋白、κ-酪蛋白)、糖基化依赖的细胞黏附分子(glycosylation-dependent cell adhesion molecule-1,GLYCAM-1)、肽聚糖识别蛋白(pcptidoglycan recognition protein,PGRP)和α-乳清蛋白。从图中可以观察到,不同冷藏时间下的原料乳中的蛋白质发生变化。第2天冷藏后,GLYCAM-1、PGRP和κ-酪蛋白、β-酪蛋白的条带开始变模糊。冷藏过程中条带模糊,这可能是由于冷藏过程中引发的物理和化学变化[19],导致了这些特定蛋白质的聚集或者降解。而乳铁蛋白在整个冷藏周期内保持了相对稳定的特征,这可能是因为乳铁蛋白对冷藏过程不敏感,在整个储存时间内未受到实质性影响。
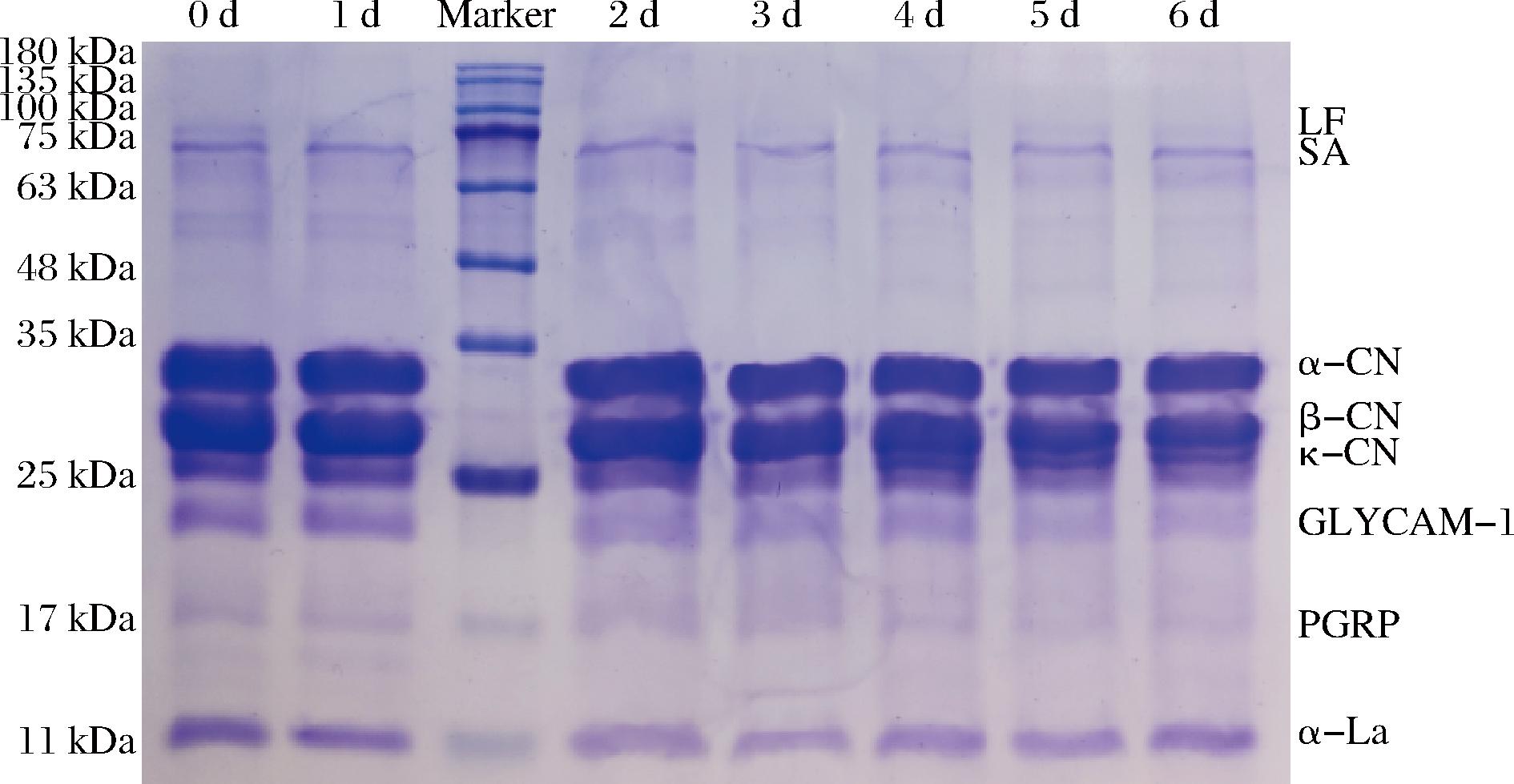
图1 原料乳在冷藏6 d期间蛋白SDS-PAGE
Fig.1 Protein SDS-PAGE in raw milk during 6 days of cold storage
2.3 冷藏过程中原料乳微生物变化
2.3.1 微生物变化情况
如图2所示,TBC从3.85 lg CFU/mL大幅增加到7.11 lg CFU/mL,超过了地方标准要求的2.0×106 CFU/mL,说明驼乳可能存在较高水平的细菌污染。超标的TBC可能对生乳的品质、稳定性和消费者的健康构成潜在风险,不适宜饮用。TBC的升高可能与驼乳中PBC的增加有关,PBC从3.12 lg CFU/mL增至7.48 lg CFU/mL。嗜冷菌可能产生耐热酶,从而分解蛋白质和脂肪,导致驼乳的变质、发酵或腐败[20]。先前的研究表明,冷藏期间原料牛乳TBC和PBC都会呈现增长趋势[21],这一点上驼乳与牛乳结果一致。O’CONNELL等[22]研究发现,在4 ℃下冷藏牛乳4 d,TBC的增长不显著,而PBC在冷藏前3 d增长不显著,第4天显著增加,而本研究观察到原料驼乳在4 ℃下冷藏4 d后,TBC和PBC均呈现显著增加,导致这种差异的原因可能与原料乳中初始微生物负荷有关。法国原料乳中大肠杆菌群数约为2 lg CFU/mL,国标中规定原料乳中大肠杆菌数量不超过2×102 CFU/mL,而本研究的结果显示,初始大肠杆菌群数均高于此限值,导致此结果的原因可能是采乳过程中器具卫生不合格及季节。
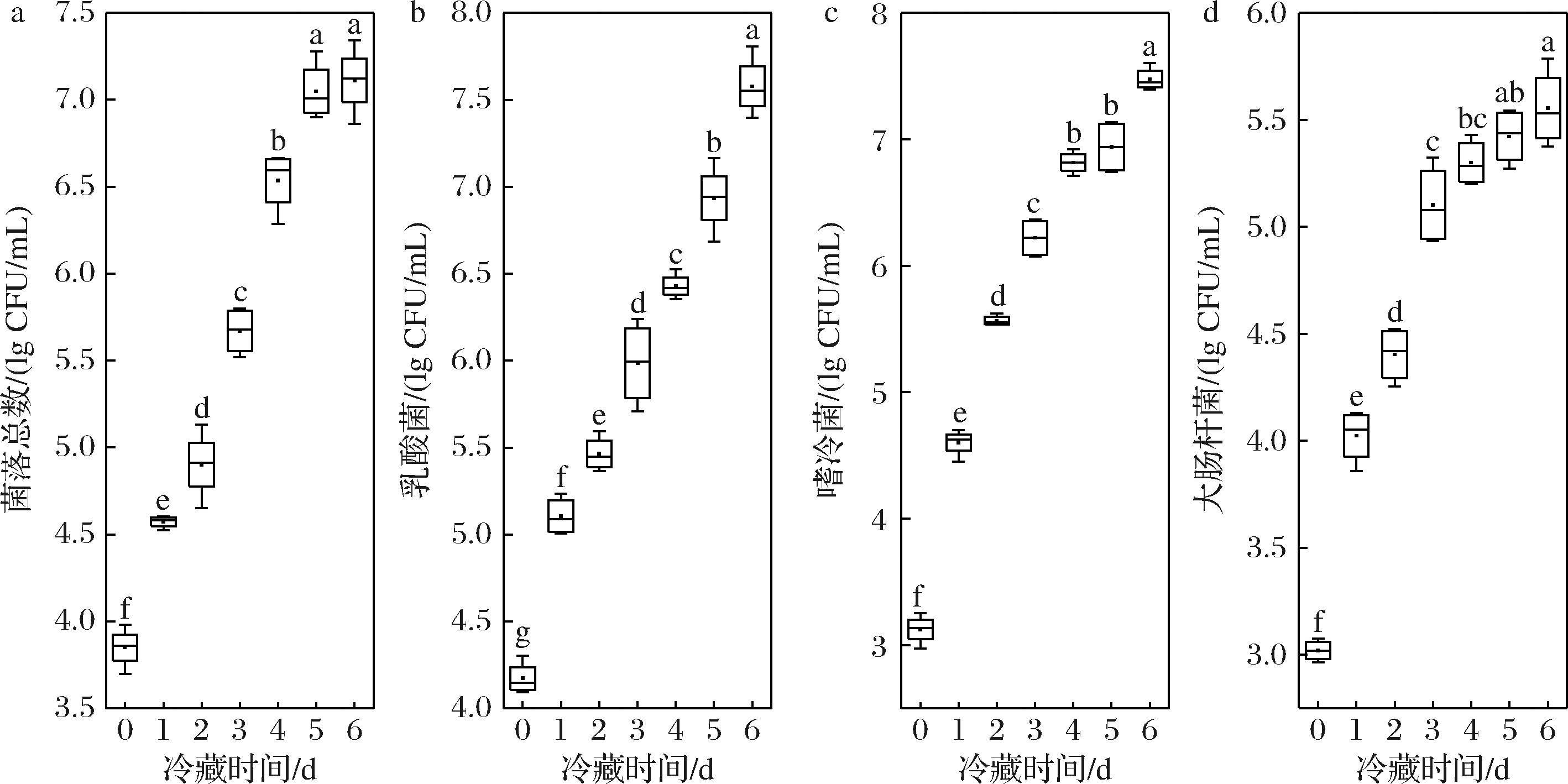
a-菌落总数;b-乳酸菌;c-嗜冷菌;d-大肠杆菌
图2 原料乳在冷藏6 d期间微生物变化
Fig.2 Microbial changes of raw milk during 6 days of cold storage
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.3.2 微生物与主要理化品质相关性分析
如图3所示,整体来说微生物与主要理化指标呈负相关,说明在冷藏期间随着微生物增长,会分解大量有机物质以获得能量和营养,其中包括原料乳中的蛋白质和脂肪,导致蛋白质和脂肪含量的减少。并且微生物的生长过程可能导致原料乳体系的pH值下降,其中乳酸菌是一类能够发酵乳糖生成乳酸的微生物,在这个过程中会产生酸性产物,从而降低原料乳的pH值。另外,微生物增加还可能影响乳糖含量的减少。乳糖是乳制品中一种常见的碳水化合物,但某些微生物具有乳糖酶活性,可以将乳糖分解为乳酸等代谢产物,微生物的生长也会消耗乳糖,从而降低乳糖含量,而随着白质、脂肪、乳糖的降低,乳中的pH也会受影响。
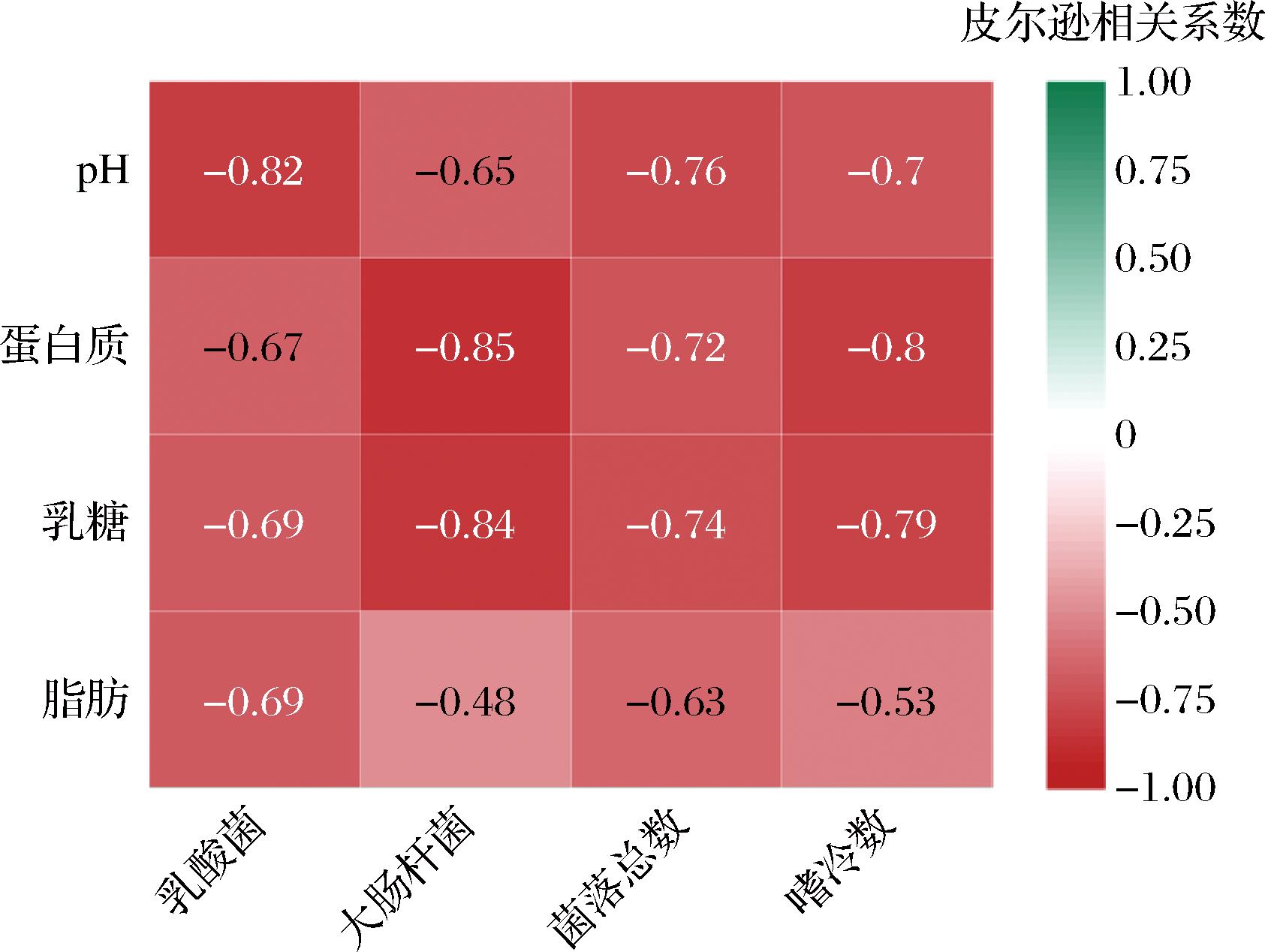
图3 冷藏期间微生物与主要理化品质相关性分析
Fig.3 Correlation analysis between microorganisms and main physical and chemical quality during cold storage
注:热图中数字表示相关性指数r,|r|约接近1,相关性约明显,|r|>0.8为高度相关(下同)。
2.4 原料乳冷藏过程关键酶活性变化
2.4.1 冷藏6 d酶活性变化情况
现有研究表明,脂肪酶,微生物是其主要来源,它可以将脂肪分解为甘油和脂肪酸,从而导致脂肪产生分解臭味,它在80 ℃加热20 s后可以完全失去活性。如表2所示,原料驼乳在冷藏6 d期间脂酶活性从冷藏0 d的0.055 7 U/100 mL增加到冷藏3 d的0.075 4 U/100 mL。另一个关键的酶是蛋白酶(存在于α-酪蛋白),具有较强的耐热性,在80 ℃加热10 min后,蛋白酶才会失去活性。实验结果显示,在原料乳冷藏期间,蛋白酶活性在冷藏第3天显著增加至1.230 3 U/100 mL。此外,原料乳中的脂蛋白脂酶同样作为一种重要的内源性脂肪酶,会诱导牛乳甘油三酯自发分解,并导致部分甘油酯和游离脂肪酸的积累,致使乳制品口感变差[23],也能够破坏脂肪球膜,释放出脂肪酸,引发脂肪酸败[24]。因此,本研究初步推断,原料乳在冷藏过程中,由于微生物的存在,导致一些酶类产生影响最终产品的质量。
表2 原料乳在冷藏6 d期间关键酶的酶活性变化 单位:U/100 mL
Table 2 The changes of enzyme activity of key enzymes in raw milk during 6 days of cold storage
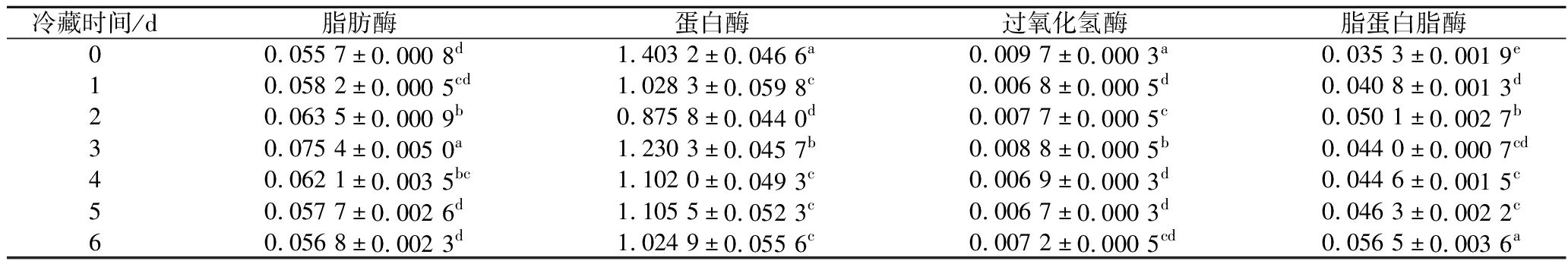
冷藏时间/d脂肪酶蛋白酶过氧化氢酶脂蛋白脂酶00.055 7±0.000 8d1.403 2±0.046 6a0.009 7±0.000 3a0.035 3±0.001 9e10.058 2±0.000 5cd1.028 3±0.059 8c0.006 8±0.000 5d0.040 8±0.001 3d20.063 5±0.000 9b0.875 8±0.044 0d0.007 7±0.000 5c0.050 1±0.002 7b30.075 4±0.005 0a1.230 3±0.045 7b0.008 8±0.000 5b0.044 0±0.000 7cd40.062 1±0.003 5bc1.102 0±0.049 3c0.006 9±0.000 3d0.044 6±0.001 5c50.057 7±0.002 6d1.105 5±0.052 3c0.006 7±0.000 3d0.046 3±0.002 2c60.056 8±0.002 3d1.024 9±0.055 6c0.007 2±0.000 5cd0.056 5±0.003 6a
2.4.2 酶活性与主要理化品质相关性分析
如图4所示,在脂肪含量方面,注意到在冷藏2~3 d期间,脂肪、蛋白和乳糖与脂酶、蛋白酶和过氧化氢酶之间呈现负相关性,而与脂蛋白脂酶呈现正相关性。这表明在早期的冷藏过程中,脂肪的分解、蛋白和乳糖的降解程度与这些酶的活性有关,脂蛋白脂酶可能在此过程中起到了一定的促进作用。

a-0~1 d;b-1~2 d;c-2~3 d;d-3~4 d;e-4~5 d;f-5~6 d
图4 相邻天数之间主要酶活性与主要理化品质相关性分析
Fig.4 Correlation analysis between main enzyme activity and main physical and chemical quality between adjacent days
在整个实验过程中,pH值的变化对酶活性起到重要的调节作用。pH值的波动会直接影响酶的最适生长环境,从而调控其活性的波动。
2.5 原料乳冷藏过程各指标间PCA
PCA是一种通过分析样本群落的组成来揭示样本间差异和距离的方法。在PCA图中,样本物种组成越相似,它们在图中的距离就越接近。因此,PCA能够将包含冷藏时间信息的数据降低到低维度空间。如图5所示,PCA通过将数据映射到具有最大方差的方向上进行降维。这意味着在第一主成分中,样本具有更大的方差,从而反映了它们在这个特征上的差异程度。通过PCA可视化了7个冷藏时间点的驼乳数据,直观地展示了不同组之间的差异。7 d的样本点之间无重叠现象,说明样本之间差异较大。此外,第3天及之后的时间点样本明显分开,表明冷藏初期(0~2 d)和中后期(3~6 d)样本之间存在明显的差异。
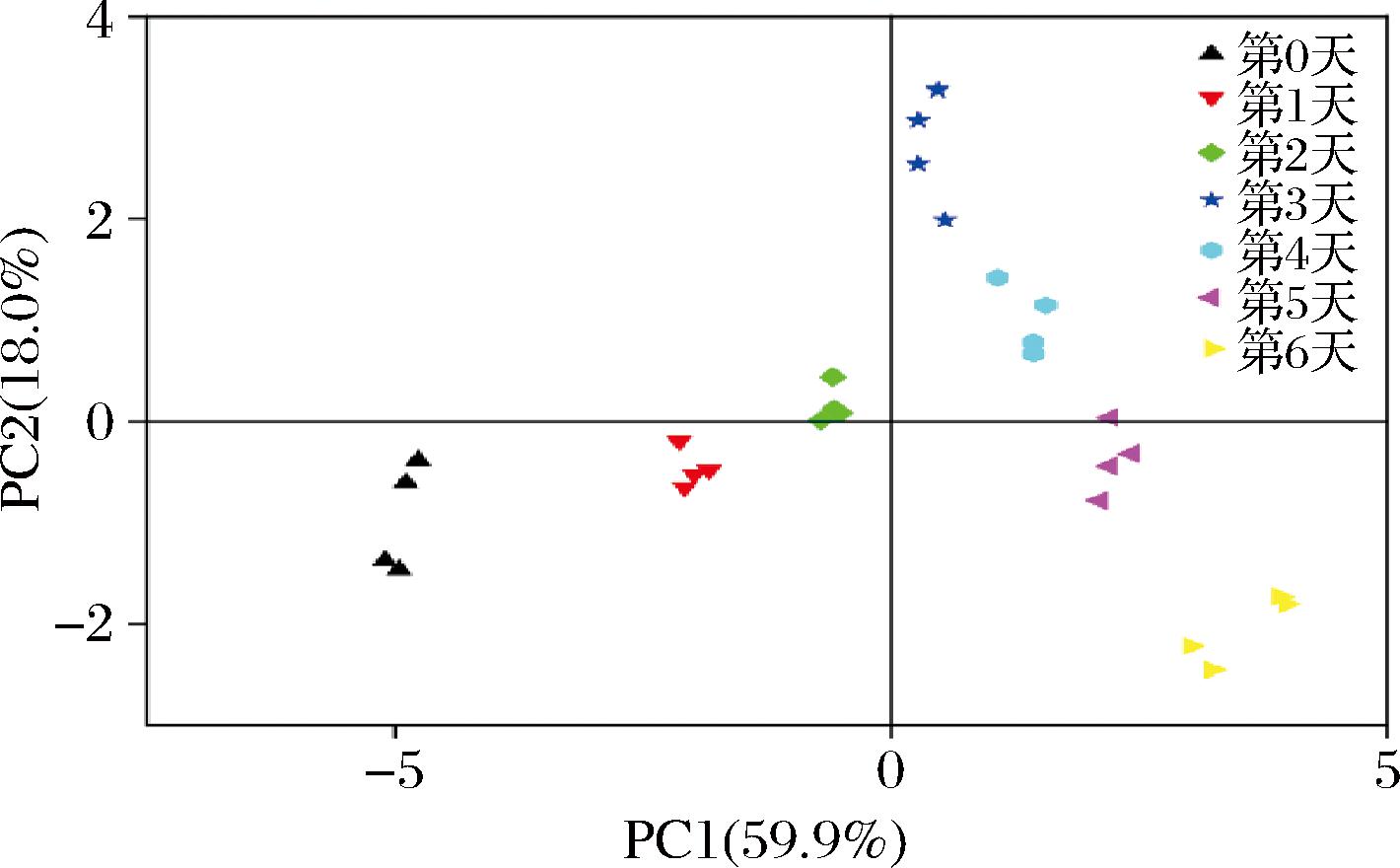
图5 各指标主成分分析
Fig.5 PCA of various index
2.6 原料乳冷藏过程各指标间结构分析
如图6所示,原料乳在不同冷藏时间下蛋白质谱型的变化并未呈现明显差异。这一结果通过研究得到,4 000~400 cm-1波数范围内的FTIR特征峰能够很好地反映出乳制品在营养成分方面的差异[25]。特别是在1 800~1 700 cm-1、1 700~1 600 cm-1和1 600~1 500 cm-1这几个波数范围内存在多个蛋白质特征峰,而在约1 650 cm-1附近的特征峰尤为明显。研究表明第4天的FTIR图谱在1 700~1 600 cm-1区域的峰值发生了偏移,这表明从第3天开始,蛋白质的结构发生了变化。此外,糖类等其他成分的特征峰在1 200~900 cm-1的范围内,从第3天开始发生了显著变化,尤其是在约1 080 cm-1附近。脂肪的特征峰则位于3 000~2 800 cm-1的区域内,在6 d内的最高峰值并无显著差异,但在约2 850 cm-1附近,从第3天开始发生了偏移,该结果与上述研究结果一致。
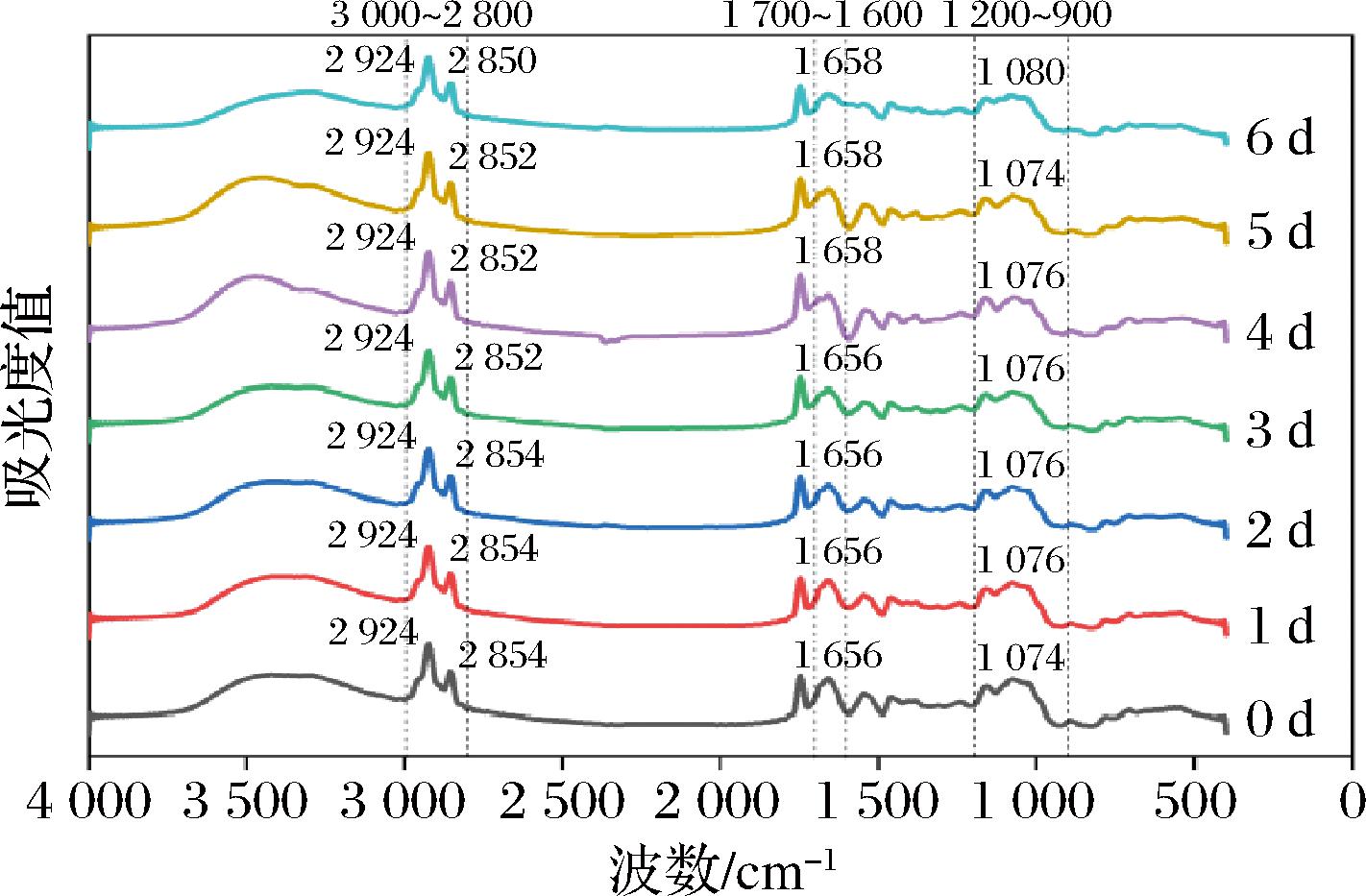
图6 不同冷藏天数下驼乳蛋白的红外光谱图
Fig.6 Infrared spectra of camel milk protein under different cold storage days
3 结论
驼乳在冷藏过程中脂肪、蛋白质和乳糖含量均发生了不同程度的变化。驼乳的pH值总体呈现下降趋势,而TBC、PBC、乳酸菌数和大肠菌群数等呈现上升趋势,主要微生物与主要理化性质(pH、蛋白、脂肪和乳糖)呈负相关性。脂肪酶、蛋白酶、过氧化物酶和脂蛋白脂酶的活性在冷藏3 d后呈现下降趋势。傅里叶红外光谱分析显示,驼乳在冷藏了2 d后脂肪、蛋白质和乳糖的吸收峰明显发生偏移,进一步证实了驼乳中成分的变化。综上可以确定冷藏3 d是驼乳冷藏的关键时间控制点。该结果为了解驼乳在冷藏过程中的变化、为原料驼乳质量控制提供科学依据。
[1] MOHAMED H, JOHANSSON M, LUNDH Å, et al.Short communication:Caseins and α-lactalbumin content of camel milk (Camelus dromedarius) determined by capillary electrophoresis[J].Journal of Dairy Science, 2020, 103(12):11094-11099.
[2] ATWAA E, HASSAN M A A, RAMADAN M.Production of probiotic stirred yoghurt from camel milk and oat milk[J].Journal of Food and Dairy Sciences, 2020, 11(9):259-264.
[3] MEENA S, RAJPUT Y S, SHARMA R.Comparative fat digestibility of goat, camel, cow and buffalo milk[J].International Dairy Journal, 2014, 35(2):153-156.
[4] MUDGIL P, KAMAL H, YUEN G C, et al.Characterization and identification of novel antidiabetic and anti-obesity peptides from camel milk protein hydrolysates[J].Food Chemistry, 2018, 259:46-54.
[5] BHAT D K, KANGA U, KUMAR N, et al.The Raikas-A unique combination of high prevalence of type 1 diabetes susceptibility genes and near zero incidence of the disease[J].Human Immunology, 2014, 75(12):1252-1258.
[6] ASHRAF A, MUDGIL P, PALAKKOTT A, et al.Molecular basis of the anti-diabetic properties of camel milk through profiling of its bioactive peptides on dipeptidyl peptidase IV (DPP-IV) and insulin receptor activity[J].Journal of Dairy Science, 2021, 104(1):61-77.
[7] LIMON A, GALLEGOS-PEREZ J L, REYES-RUIZ J M, et al.The endogenous GABA bioactivity of camel, bovine, goat and human milks[J].Food Chemistry, 2014, 145:481-487.
[8] MUDGIL P, BABY B, NGOH Y Y, et al.Molecular binding mechanism and identification of novel anti-hypertensive and anti-inflammatory bioactive peptides from camel milk protein hydrolysates[J].LWT, 2019, 112:108193.
[9] SOLEYMANZADEH N, MIRDAMADI S, KIANIRAD M.Antioxidant activity of camel and bovine milk fermented by lactic acid bacteria isolated from traditional fermented camel milk (Chal)[J].Dairy Science &Technology, 2016, 96(4):443-457.
[10] NONGONIERMA A B, PAOLELLA S, MUDGIL P, et al.Identification of novel dipeptidyl peptidase IV (DPP-IV) inhibitory peptides in camel milk protein hydrolysates[J].Food Chemistry, 2018, 244:340-348.
[11] BABA W N, MUDGIL P, KAMAL H, et al.Identification and characterization of novel α-amylase and α-glucosidase inhibitory peptides from camel whey proteins[J].Journal of Dairy Science, 2021, 104(2):1364-1377.
[12] SOLEYMANZADEH N, MIRDAMADI S, MIRZAEI M, et al.Novel β-casein derived antioxidant and ACE-inhibitory active peptide from camel milk fermented by Leuconostoc lactis PTCC1899:Identification and molecular docking[J].International Dairy Journal, 2019, 97:201-208.
[13] HOMAYOUNI-TABRIZI M, ASOODEH A, SOLTANI M.Cytotoxic and antioxidant capacity of camel milk peptides:Effects of isolated peptide on superoxide dismutase and catalase gene expression[J].Journal of Food and Drug Analysis, 2017, 25(3):567-575.
[14] ZOU Z Z, BOUCHEREAU-DE PURY C, HEWAVITHARANA A K, et al.A sensitive and high-throughput fluorescent method for determination of oxidase activities in human, bovine, goat and camel milk[J].Food Chemistry, 2021, 336:127689.
[15] WANG R X, HAN Z H, JI R, et al.Antibacterial activity of trypsin-hydrolyzed camel and cow whey and their fractions[J].Animals, 2020, 10(2):337.
[16] 梁志斌. 生鲜牛乳介电特性与脂肪含量关系的试验研究[D].杨凌:西北农林科技大学, 2014.
LIANG Z B.A study of experiment on the relationship between dielectric properties and fat content of raw milk[D].Yangling:Northwest A &F University, 2014.
[17] 辛亮. 原料乳中嗜冷菌多样性研究及LAMP快速检测方法的构建[D].哈尔滨:哈尔滨工业大学, 2017.
XIN L.Study of psychrotrophic bacteria diversity in raw cows’ milk and construction of LAMP method for its rapid detection[D].Harbin:Harbin Institute of Technology, 2017.
[18] 王柳. 酸乳发酵过程中还原糖和有机酸含量的变化[D].西安:陕西科技大学, 2014.
WANG L.The change of reducing sugar and organic acid content in yoghourt fermentation process[D].Xi’an:Shaanxi University of Science &Technology, 2014.
[19] 李荣蓉, 苗静, 杨洁.热处理对骆驼乳蛋白质影响的研究进展[J].中国乳品工业, 2020, 48(12):32-37.
LI R R, MIAO J, YANG J.Properties of camel milk proteins resulted from thermal treatment:A review[J].China Dairy Industry, 2020, 48(12):32-37.
[20] 吴杰, 郑楠, 王加启, 等.乳中嗜冷菌检测和分析方法的研究进展[J].食品科学, 2024, 45(13):356-364.
WU J, ZHENG N, WANG J Q, et al.Recent progress on methods for the detection and analysis of psychrophilic bacteria in milk[J].Food Science, 2024, 45(13):356-364.
[21] PALUDETTI L F, KELLY A L, O’BRIEN B, et al.The effect of different precooling rates and cold storage on milk microbiological quality and composition[J].Journal of Dairy Science, 2018, 101(3):1921-1929.
[22] O’CONNELL A, RUEGG P L, JORDAN K, et al.The effect of storage temperature and duration on the microbial quality of bulk tank milk[J].Journal of Dairy Science, 2016, 99(5):3367-3374.
[23] VANBERGUE E, PEYRAUD J L, GUINARD-FLAMENT J, et al.Effects of DGAT1 K232A polymorphism and milking frequency on milk composition and spontaneous lipolysis in dairy cows[J].Journal of Dairy Science, 2016, 99(7):5739-5749.
[24] GLANTZ M, ROSENLÖW M, LINDMARK-MÅNSSON H, et al.Impact of protease and lipase activities on quality of Swedish raw milk[J].International Dairy Journal, 2020, 107:104724.
[25] KAROUI R, MAZEROLLES G, BOSSET J O, et al.Utilisation of mid-infrared spectroscopy for determination of the geographic origin of Gruyère PDO and L’Etivaz PDO Swiss cheeses[J].Food Chemistry, 2007, 105(2):847-854.