越桔属(Vaccinium)樟叶越桔(Vaccinium dunalianum)是一种极具药用及健康价值的多年生常绿植物,由其叶芽炮制成的‘雀嘴茶’,常饮有舒筋活络、祛风除湿之功效。乌金苷[6′-O-咖啡酰基熊果苷(6′-O-caffioylarbutin,CA)]、绿原酸[3′-O-咖啡酰奎尼酸(3′-O-caffeoylquinic acid,CGA)]和熊果苷[对-羟基苯-β-D-吡喃葡萄糖苷(arbutin,Arb)]被证明是樟叶越桔叶芽中富含的3种主要次生代谢产物[1]。Arb是当前国际认可的理想皮肤美白祛斑活性剂[2-3]。绿原酸具有抗菌、抗炎、抗病毒和保护心血管等药理学作用[4]。CA作为樟叶越桔叶芽含量最高的主效成分,具有抑制黑色素合成[1]、抗氧化[5]、降血栓血脂[6]和治疗痛风[7]等活性功能。因此,在樟叶越桔叶芽加工成‘雀嘴茶’的过程中,高效保留CA、CGA和Arb等主效成分显得至关重要。
干燥是药用等植物产品加工的重要环节,干燥过程伴随着物理和化学变化,进而引起各类次生代谢产物含量及生物活性的变化[8-10]。樟叶越桔因富含CA、CGA和Arb等极具开发利用价值的化合物而倍受关注。在涉及樟叶越桔样品的干燥实验时,不同研究者采用的干燥方法不完全相同[11-12]。在不同干燥方法比较研究中,仅见李国泽等[13]探讨了2种干燥方式(45 ℃ HAD和NAD)对樟叶越桔成熟叶片、嫩叶、花芽3种组织主效成分含量的影响,显示2种干燥方法下3种主效成分含量存在显著差异,推测干燥方法显著影响着樟叶越桔中次生代谢产物的提取含量。但樟叶越桔叶芽主效成分高保留的干燥方法研究仍处于滞缓状态,这导致‘雀嘴茶’主效成分含量研究缺乏统一的干燥标准,也使得各研究结果的可比性降低。
本研究以‘雀嘴茶’加工原料樟叶越桔叶芽为试材,通过HPLC技术进行化合物定量分析,探究了9种干燥方法对3种主效成分保留含量的影响。其中真空冷冻干燥(freeze vacuum drying,FVD)[14]、热风干燥(hot air drying,HAD)[14]、微波干燥(microware drying,MD)[14]、真空干燥(vacuum drying,VD)[15]、日晒干燥(sun drying,SD)[15]和自然阴干(natural air drying,NAD)[16]是已知文献报道的植物样品干燥方法,蒸制阴干(steaming and natural air drying,S-NAD)、烫制阴干(quick-boiling and natural air drying,QB-NAD)和煮制阴干(boiling and natural air drying,B-NAD)是本研究组创新性设计的3种干燥方法。进一步对表现优秀的3种创新干燥方法的蒸制、煮制和烫制的预处理时间进行了优化探究。以期筛选出樟叶越桔叶芽3种主效成分高保留的最佳干燥工艺,服务于该植物下游产品‘雀嘴茶’的生产加工。
1 材料与方法
1.1 植物材料
试验植物材料樟叶越桔叶芽(图1)采自云南省楚雄彝族自治州武定县的樟叶越桔野生资源保护基地(经度:102.36°E,纬度:25.55°N,海拔:2 100 m)。叶芽混样于当日带回实验室。2022年4月采集的叶芽用于后续1.3.1节干燥试验,2023年4月采集的叶芽用于后续1.3.2节干燥试验。

图1 樟叶越桔叶芽
Fig.1 Leaf buds of V. dunalianum
1.2 试剂与仪器
CA为本课题组从樟叶越桔中提取分离得到(纯度≥95%);CGA、Arb标准品,上海源叶生物科技有限公司;纯甲醇,上海星可高纯溶剂有限公司,冰乙酸,天津市致远化学试剂有限公司;73%甲醇和1%乙酸水均现配现用,以上均为体积分数。HPLC测定用试剂经0.22 μm微孔过滤膜过滤、超声波清洗器脱气25 min。
1260型高效液相色谱仪,美国安捷伦科技有限公司;CF16RXⅡ台式高速冷冻离心机,日本HITACHI公司;LU10AT超声波清洗器,上海冠特超声仪器有限公司;101-1AB电热恒温鼓风干燥箱,天津市泰斯特仪器有限公司;DP43C型真空干燥箱,重庆大和科技有限公司;BTP-8ZL00X真空冷冻干燥机,美国SP科学公司;MK-2270M微波炉,青岛胶南海尔微波制品有限公司;FW-100高速万能粉碎机,北京中兴伟业仪器有限公司。
1.3 试验方法
1.3.1 樟叶越桔叶芽的干燥方法与处理条件
试验从混样中随机称取10 g叶芽,选用9种干燥方法进行干燥处理,3个生物学重复。各干燥方法和试验条件见表1。干燥后的样品用粉碎机破碎1 min,粉末过40目筛后装入离心管,置在玻璃干燥器内保存备用。
表1 应用于樟叶越桔叶芽干燥的9种干燥方法及试验条件
Table 1 9 drying methods and test conditions for leaf buds drying of V. dunalianum
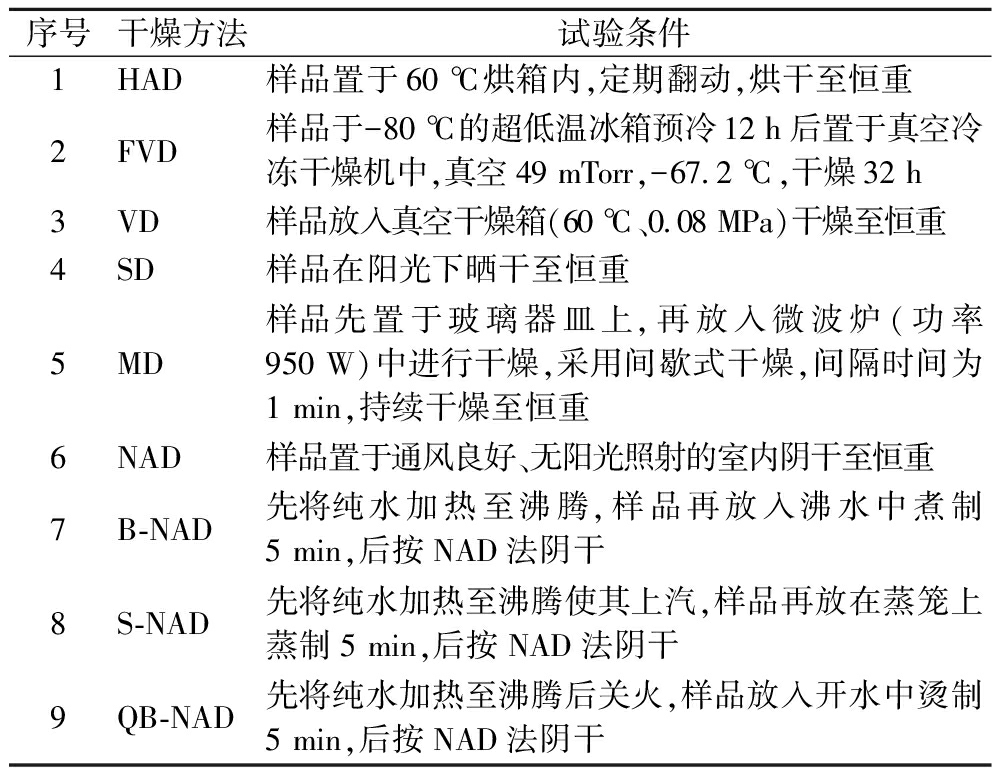
序号干燥方法试验条件1HAD样品置于60 ℃烘箱内,定期翻动,烘干至恒重2FVD样品于-80 ℃的超低温冰箱预冷12 h后置于真空冷冻干燥机中,真空49 mTorr,-67.2 ℃,干燥32 h3VD样品放入真空干燥箱(60 ℃、0.08 MPa)干燥至恒重4SD样品在阳光下晒干至恒重5MD样品先置于玻璃器皿上,再放入微波炉(功率950 W)中进行干燥,采用间歇式干燥,间隔时间为1 min,持续干燥至恒重6NAD样品置于通风良好、无阳光照射的室内阴干至恒重7B-NAD先将纯水加热至沸腾,样品再放入沸水中煮制5 min,后按NAD法阴干8S-NAD先将纯水加热至沸腾使其上汽,样品再放在蒸笼上蒸制5 min,后按NAD法阴干9QB-NAD先将纯水加热至沸腾后关火,样品放入开水中烫制5 min,后按NAD法阴干
1.3.2 创新干燥方法的预处理时间试验
试验分别设置S-NAD、QB-NAD和B-NAD 3种创新干燥方法的蒸制、烫制和煮制的6个不同预处理时间,1、2.5、5、7.5、10和12.5 min,以NAD法为对照。试验样品重复数和实验操作步骤同1.3.1节。
1.3.3 样品主效成分提取和HPLC测定
参照李国泽等[13]建立的方法步骤执行。
1.3.4 标准曲线绘制
参照李国泽等[13]建立的方法,以标准样品溶液质量浓度(μg/μL)为横坐标(X),峰面积为纵坐标(Y),绘制标准曲线,其线性方程:CA为Y=10 890X+388.070 0;CGA为Y=13 336X+23.754 0;Arb为Y=4 059.5X-1.021 1,通过标准曲线计算CA、CGA、Arb含量。
1.4 数据分析方法
根据HPLC测定的结果,采用Excel 2010处理原始数据,测定3种主效成分含量结果以平均值±标准误表示,用SPSS 26软件采用单因素ANOVA检验中的LSD法和Duncan法分析数据,GraphPad Prism 8作图。
2 结果与分析
2.1 干燥方法对樟叶越桔叶芽3 种成分含量高低规律的影响
9种干燥方法处理试验获得的樟叶越桔叶芽CA、CGA和Arb的保留含量如表2所示,显示不同干燥方法处理下3种主效成分含量高低规律一致,为CA>CGA>Arb,且两两化合物间的差异极显著(P<0.01)。表明樟叶越桔叶芽中这3种主效成分含量高低规律不受干燥方法的影响。
表2 九种干燥方法处理下樟叶越桔叶芽中乌金苷、绿原酸、熊果苷的含量(n=3) 单位:mg/g DW
Table 2 Contents of 6′-O-caffeoyl arbutin, chlorogenic acid and arbutin in leaf buds of V. dunalianum under nine drying methods(n=3)
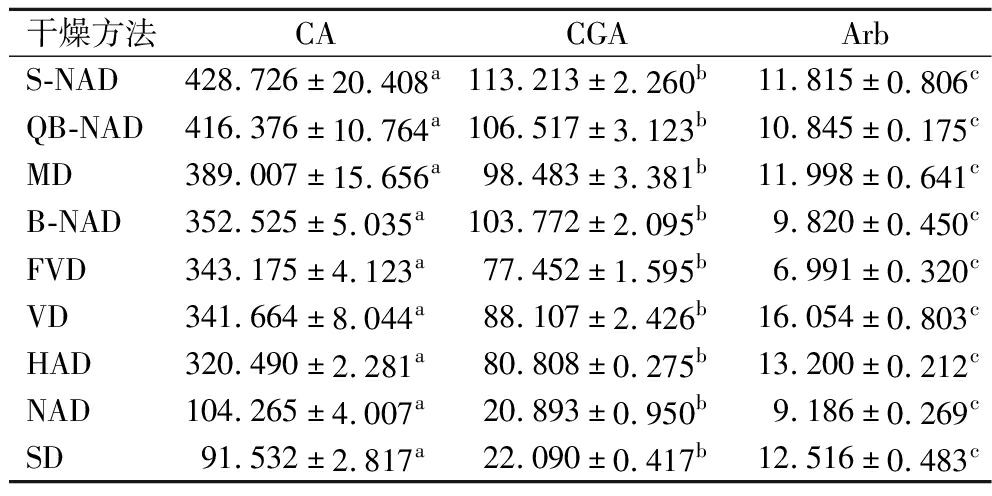
干燥方法CACGAArbS-NAD428.726±20.408a113.213±2.260b11.815±0.806cQB-NAD416.376±10.764a106.517±3.123b10.845±0.175cMD389.007±15.656a98.483±3.381b11.998±0.641cB-NAD352.525±5.035a103.772±2.095b9.820±0.450cFVD343.175±4.123a77.452±1.595b6.991±0.320cVD341.664±8.044a88.107±2.426b16.054±0.803cHAD320.490±2.281a80.808±0.275b13.200±0.212cNAD104.265±4.007a20.893±0.950b9.186±0.269cSD91.532±2.817a22.090±0.417b12.516±0.483c
注:不同小写字母表示横向表格中3种化合物含量差异显著(P<0.05)。
2.2 干燥方法对樟叶越桔叶芽 3 种主效成分保留含量的影响
樟叶越桔叶芽中CA、CGA和Arb的提取保留含量均受到干燥方法的影响,但变化规律不同(图2)。CA保留含量由高到低的干燥方法为:S-NAD>QB-NAD>MD>B-NAD>FVD>VD>HAD>NAD>SD(图2-a)。S-NAD法得到的CA含量显著高于除QB-NAD法以外的7种干燥方法(P<0.05),QB-NAD与S-NAD、MD间无显著差异(P>0.05),但显著高于其他6种干燥方法(P<0.05);B-NAD、FVD、VD和HAD 4种方法获得的CA含量相对居中,4者之间差异不显著(P>0.05);NAD和SD法得到的CA含量最低、且二者之间差异不显著(P>0.05),均极显著低于其他7种干燥方法(P<0.01);相比NAD,S-NAD和QB-NAD得到的CA含量提高了4倍,B-NAD也提高了3倍以上(表2和图2-a)。
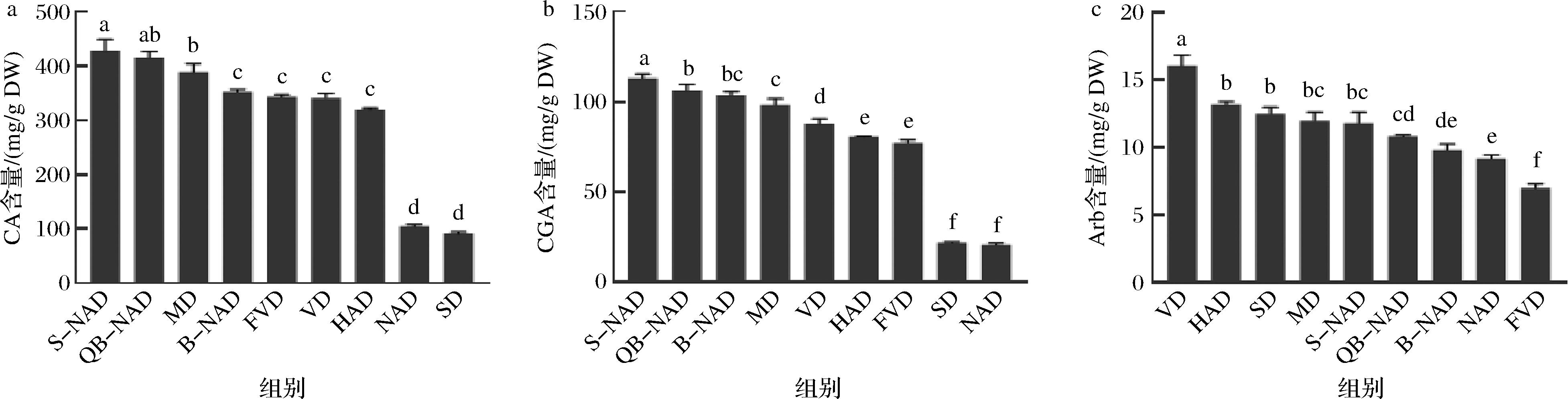
a-CA的保留含量;b-CGA的保留含量;c-Arb的保留含量
图2 樟叶越桔 3 种主效成分在9种不同干燥方式处理下的含量变化(n=3)
Fig.2 Content of three main components of V. dunalianum under nine different drying methods (n=3)
注:不同小写字母表示差异显著(P<0.05)(下同)。
CGA保留含量由高到低的干燥方法为:S-NAD>QB-NAD>B-NAD>MD>VD>HAD>FVD>SD>NAD(图2-b)。与不同干燥方法对CA含量的影响类似,S-NAD法得到的CGA含量显著高于其他8种方法的(P<0.05);QB-NAD和B-NAD得到的CGA含量相对较高,显著高于后续6种方法的(P<0.05);NAD和SD法得到的CGA含量最低,均极显著低于其他7种干燥方法(P<0.01);相比NAD,S-NAD、QB-NAD和B-NAD得到的CGA含量提高了5倍以上(表2和图2-b)。
Arb保留含量由高到低的干燥方法为:VD>HAD>SD>MD>S-NAD>QB-NAD>B-NAD>NAD>FVD(图2-c)。不同于CA和CGA受不同干燥方法的影响,VD法处理得到的Arb含量最高、且与其他8种干燥方法的差异显著(P<0.05);HAD、SD、MD和S-NAD四种方法间差异不显著(P>0.05),与其他干燥方法差异显著(P<0.05);FVD法获得的Arb含量最低,与其他8种方法存在差异(P<0.05);S-NAD、QB-NAD和B-NAD 3种干燥方法介于其他干燥方法之间。相比NAD,S-NAD和QB-NAD得到的Arb含量也提高了1.2倍~1.3倍;而VD法获得的Arb含量是FVD的2.3倍(表2和图2-c)。
综合上述结果分析,S-NAD法能同时最高保留樟叶越桔叶芽中CA和CGA含量,QB-NAD和B-NAD法也能同时使CA和CGA在叶芽中以高含量水平保留。VD却是樟叶越桔叶芽中Arb含量最高的保留方法,不过S-NAD、QB-NAD和B-NAD法也能使Arb含量在叶芽中保留在较高水平。CA、CGA和Arb是樟叶越桔叶芽富含的主要酚酸类化合物,创新的S-NAD、QB-NAD和B-NAD法中蒸、烫和煮制的高温高湿处理使植物细胞中的多酚氧化酶(polyphenol oxidase,PPO)瞬间钝化、丧失活性,使植物细胞壁快速软化、纹孔扩张、细胞膜结构破裂,更有利于细胞内次生代谢产物的释放。因此,为同时实现CA、CGA和Arb含量高效保留,可优先选择S-NAD、QB-NAD和B-NAD法对樟叶越桔叶芽进行干燥处理。
2.3 创新干燥方法的预处理时间对樟叶越桔叶芽3 种主效成分含量的影响
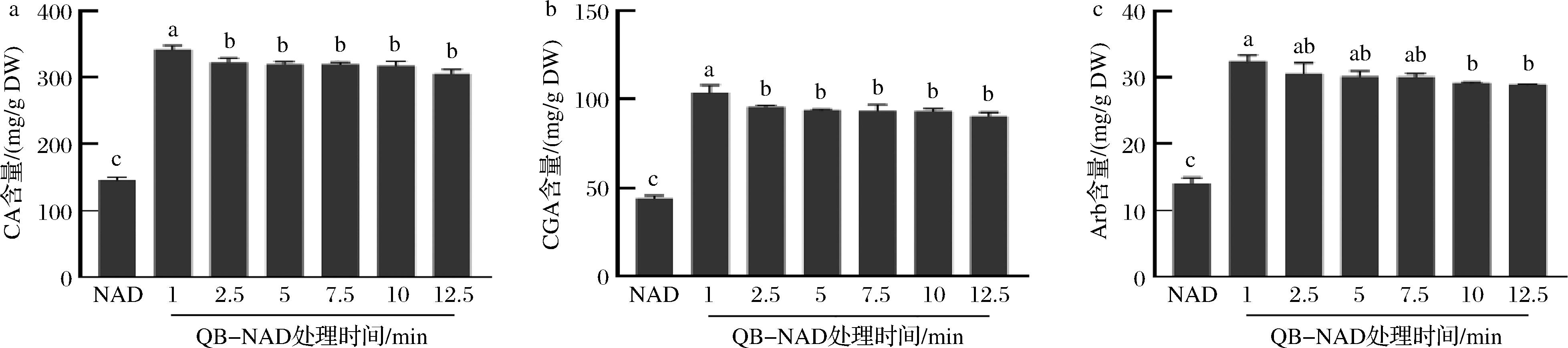
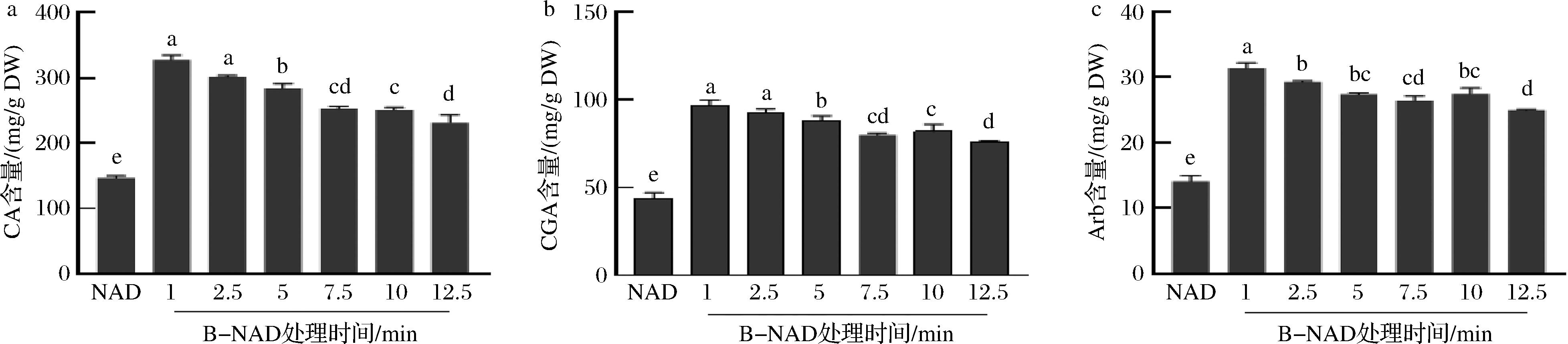
试验进一步探讨了S-NAD、QB-NAD和B-NAD方法6个不同预处理时间对3种化合物含量的影响,结果显示S-NAD、QB-NAD和B-NAD不同时间处理组的3种化合物含量均极显著高于NAD法的(图3~图5)。S-NAD试验组中(图3),CA、CGA和Arb 含量均随着蒸制时间的延长先升高再下降,均在5 min处理组最高,与7.5 min处理组的CA、Arb差异不显著(P>0.05),CGA差异显著(P<0.05),而5 min和7.5 min处理组均显著高于其他4个时间处理组(P<0.05)。表明,S-NAD干燥方法中,蒸制预处理时间在5~7.5 min时可以获得樟叶越桔叶芽3种主效成分最高保留含量。QB-NAD法试验组中(图4),3种主效成分含量也均在1 min组最高,并随烫制时间延长逐渐下降,但1 min处理组的CA和CGA含量显著高于其他时间处理组(P<0.05)。B-NAD法试验组中(图5),CA、CGA和Arb含量均在1 min处理组最高,并随煮制时间的延长呈逐渐下降趋势,但1 min处理组的CA和CGA含量与2.5 min处理组的差异不显著(P>0.05)。因此,3种创新干燥方法的预处理时间均显著影响着樟叶越桔叶芽3种主效成分的保留含量。S-NAD中,样品置于蒸汽中,随蒸制时间延长,植物细胞壁逐渐软化、纹孔逐渐扩张、细胞膜逐渐破裂,细胞内次生代谢产物逐渐释放,至5 min左右时达最大程度且次生代谢产物不流失,蒸制5 min后,蒸汽在样品中聚集成水并导致次生代谢产物逐渐流失。QB-NAD和B-NAD中,样品置于沸水中,植物细胞壁和细胞膜被快速软化、破裂,次生代谢产物快速(1 min)达到最大释放量,且逐渐流失到水中。因而创新干燥方法中,缩短样品与液态水接触的时间,是樟叶越桔叶芽的3种主效成分有效保留的关键之一。
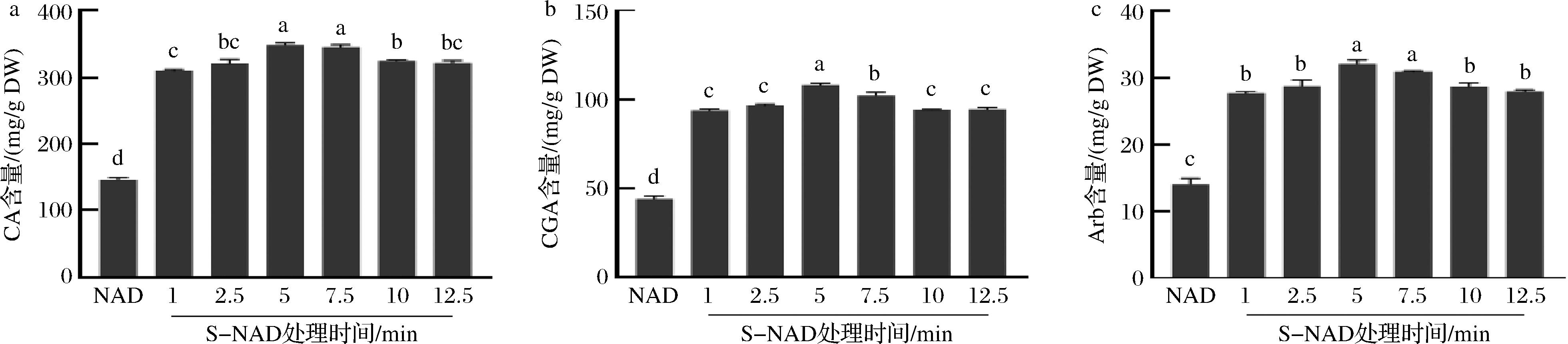
a-CA保留含量;b-CGA保留含量;c-Arb保留含量
图3 在S-NAD法不同处理时间下樟叶越桔中 3 种主效成分的含量变化
Fig.3 The content changes of three main components in V. dunalianum under different treatment time by S-NAD method
a-CA保留含量;b-CGA保留含量;c-Arb保留含量
图4 在QB-NAD法不同处理时间下樟叶越桔中 3 种主效成分的含量变化
Fig.4 Changes in the content of three main components in V. dunalianum under different treatment time of QB-NAD method
a-CA保留含量;b-CGA保留含量;c-Arb保留含量
图5 在B-NAD法不同处理时间下樟叶越桔中 3 种主效成分的含量变化
Fig.5 The content changes of three main components in V. dunalianum under different treatment time of B-NAD method
2.4 三种创新干燥方法最优预处理时间下的3种主效成分含量比较
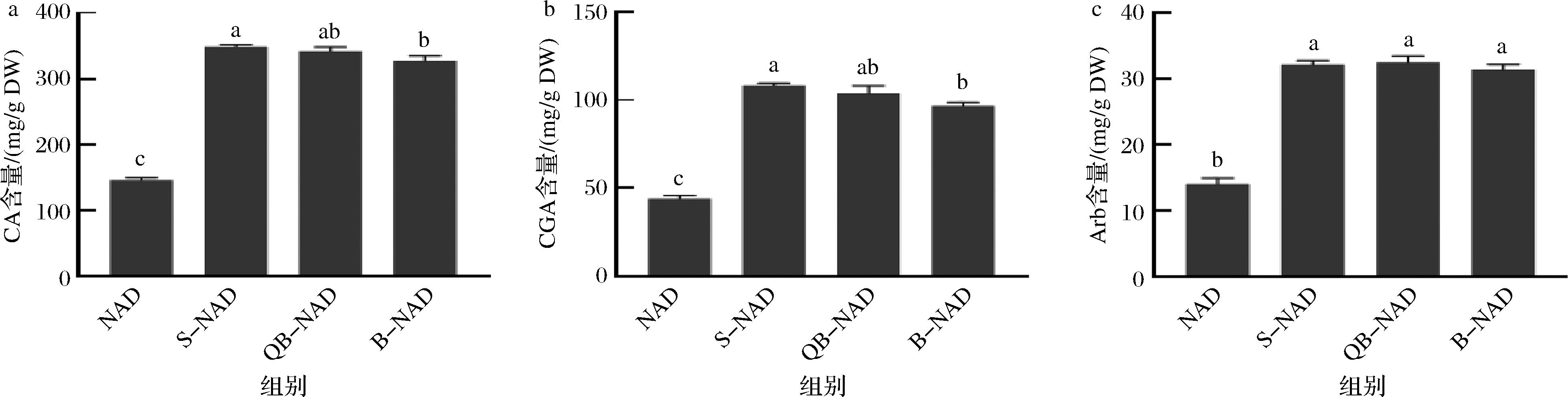
以上结果表明,3种创新干燥方法对CA、CGA和Arb中任一主效成分保留含量的高低均表现为S-NAD>QB-NAD>B-NAD,此结果中蒸制、烫制和煮制预处理时间均为5 min。2.3节实验结果显示S-NAD蒸制最优时间为5 min,但QB-NAD烫制和B-NAD煮制最优时间均为1 min。因此,进一步将3种创新干燥方法的最佳预处理时间获得的3种主效成分含量进行对比分析,结果显示(图6),对于CA和CGA保留含量的高低仍然表现为S-NAD>QB-NAD>B-NAD,且S-NAD和B-NAD间差异显著(P<0.05);对于Arb保留含量,B-NAD法仍然最低,QB-NAD法则高于S-NAD,但3种方法间差异不显著(P>0.05)。综合评价,3种创新干燥方法均可实现樟叶越桔叶芽3种主效成分的高保留,其中S-NAD是最理想的干燥方法。
a-CA保留含量;b-CGA保留含量;c-Arb保留含量
图6 创新干燥法最优预处理时间下樟叶越桔中3种主效成分的含量变化
Fig.6 Content changes of three main components in V. dunalianum under optimal pretreatment time of innovative drying method
3 讨论
樟叶越桔叶芽主效成分主要以CA和CGA为代表的酚酸类化合物为主。PPO是一种催化酚酸类物质形成醌类化合物的氧化还原酶[17]。越桔属植物中PPO存在很宽的活性温度(20~60 ℃),以35 ℃最佳[18]。本研究在考察9种干燥方法对樟叶越桔叶芽主效成分保留效果时发现,SD和NAD的处理温度处于PPO活性范围,CA和CGA等样品主效成分含量保留效果最差。S-NAD、QB-NAD、B-NAD和MD是获得CA和CGA保留含量最高的干燥方法,推测这4种干燥方法的高温使得样品中PPO快速钝化失活[19],因此有效成分含量保留效果突出;此外,还可能与高温诱导的化合物热转化有关,在越橘属植物蓝莓加工试验中,高温可使新绿原酸热转化成绿原酸[20-21]。本研究中S-NAD、QB-NAD、B-NAD和MD方法的高温也可能引起CA和CGA的热转化合成,导致其含量增加。FVD和VD法的CA和CGA主效成分含量保留效果紧次于S-NAD、QB-NAD、B-NAD和MD、FVD、VD法,主要受氧气影响,将叶芽样品与空气隔绝,阻断了PPO与O2作用,在一定程度上降低了PPO活性,使主效成分得到较好的保留。本研究中应用的HAD(60 ℃)法获得的主效成分含量高于NAD和SD法的,原因是在HAD 60 ℃条件下PPO处于低活性状态,相比较高的温度又加速叶芽水分流失,进一步抑制PPO活性[22],这表明樟叶越桔叶芽主效成分保留率受到了温度和氧分压的影响。后期需要进一步从不同干燥方法处理樟叶越桔叶芽后的PPO等相关酶活性等指标进行考察验证。
在樟叶越桔叶芽主效成分CA和CGA含量保留试验中,本文创新的S-NAD、QB-NAD和B-NAD 3种干燥方法相比已知6种干燥方法表现更优越,3种创新干燥方法预处理均与湿热有关,推测叶芽主效成分保留率还受到了水分的影响。CGA等植物次生代谢产物合成后主要存储于液泡中[23-24],3种创新干燥方法预处理样品时,高温高湿条件能软化细胞壁,扩张细胞壁纹孔,破坏细胞膜和液泡膜,有利于樟叶越桔主效成分CA和CGA的释放,提高了保留含量。QB-NAD和B-NAD方法的烫制和煮制试验中,样品直接浸入水中,释放的CA和CGA等主效成分会流失到水中,预处理时间越长,水沸腾越剧烈,主效成分流失越严重,因此主效成分随烫制和煮制时间的延长呈逐渐下降趋势。S-NAD方法的蒸制处理时,一定时间(5 min)内主效成分逐渐释放且不流失,主效成分含量逐渐升高;超过该时间,主效成分释放达到最佳且随着蒸汽形成的水而流失,主效成分含量又逐渐降低。因此,对于樟叶越桔抗氧化活性物质的保留,蒸制是最好的方法。
4 结论
试验考察了9种干燥方法(NAD、HAD、MD、FVD、VD、SD、S-NAD、B-NAD和QB-NAD)对樟叶越桔叶芽3种主效化合物(CA、CGA、Arb)的保留能力,樟叶越桔叶芽3种主效成分的保留受温度、氧分压和水分影响。S-NAD法能同时最高保留CA和CGA含量,VD是Arb含量最高的保留方法。为同时实现CA、CGA和Arb含量高效保留,S-NAD最适用于樟叶越桔叶芽的干燥,其中S-NAD(5 min)保留效果最佳。本研究为樟叶越桔主效成分的保留利用及提高‘雀嘴茶’产品质量提供理论指导,同时对药用、茶类产品最佳干燥工艺的探索提供方法参考,具有重要指导意义。
[1] ZHAO P, TANAKA T, HIRABAYASHI K, et al.Caffeoyl arbutin and related compounds from the buds of Vaccinium dunalianum[J].Phytochemistry, 2008, 69(18):3087-3094.
[2] HU Z M, ZHOU Q, LEI T C, et al.Effects of hydroquinone and its glucoside derivatives on melanogenesis and antioxidation:Biosafety as skin whitening agents[J].Journal of Dermatological Science, 2009, 55(3):179-184.
[3] LIM Y J, LEE E H, KANG T H, et al.Inhibitory effects of arbutin on melanin biosynthesis of alpha-melanocyte stimulating hormone-induced hyperpigmentation in cultured brownish guinea pig skin tissues[J].Archives of Pharmacal Research, 2009, 32(3):367-373.
[4] LUKITASARI M, SAIFUR ROHMAN M, NUGROHO D A, et al.Cardiovascular protection effect of chlorogenic acid:Focus on the molecular mechanism[J].F1000Research, 2020, 9:1462.
[5] WANG Y P, WANG Y D, LIU Y P, et al.6′- O-Caffeoylarbutin from Que Zui tea ameliorates acetaminophen-induced liver injury via enhancing antioxidant ability and regulating the PI3K signaling pathway[J].Food &Function, 2022, 13(9):5299-5316.
[6] YANG J H, BAI T C, SHI L L, et al.Antihyperlipidemic effect of Vaccinium dunalianum buds based on biological activity screening and LC-MS[J].Journal of Ethnopharmacology, 2023, 306:116190.
[7] 凌琳. 雀嘴茶降低血清尿酸的物质基础及机制研究[D].福州:福建医科大学, 2021.
LING L.The treatment and mechanism study of Vaccinium dunalianum W.in lowering serum uric acid[D].Fuzhou:Fujian Medical University, 2021
[8] AGHAEI Z, JAFARI S M, DEHNAD D.Effect of different drying methods on the physicochemical properties and bioactive components of saffron powder[J].Plant Foods for Human Nutrition, 2019, 74(2):171-178.
[9] ZHANG L W, ZHANG X M, BEGUM N, et al.Effects of different processing methods based on different drying conditions on the active ingredients of Salvia miltiorrhiza Bunge[J].Molecules, 2022, 27(15):4860.
[10] 何希瑞, 李永生, 杨芳, 等.不同采收时间及干燥方法对杜仲叶中绿原酸含量的影响[J].西北药学杂志, 2013, 28(2):130-132.
HE X R, LI Y S, YANG F, et al.The effect of different harvesting time and drying methods on the contents of chlorogenic acid in Eucommia ulmoides Oliv.leaves[J].Northwest Pharmaceutical Journal, 2013, 28(2):130-132.
[11] 谭亚婷, 尚俊可, 罗旭璐, 等.生长素对樟叶越桔离体培养物次生代谢物含量的影响[J].西部林业科学, 2020, 49(1):133-139.
TAN Y T, SHANG J K, LUO X L, et al.Effects of auxin on the content of secondary metabolites in vitro culture of Vaccinium dunalianum[J].Journal of West China Forestry Science, 2020, 49(1):133-139.
[12] 王文博, 袁甜甜, 吕玉秀, 等.基于UHPLC-Q-Orbitrap HRMS雀嘴茶醇提液的成分及活性研究[J].西南林业大学学报(自然科学), 2024, 44(1):176-184.
WANG W B, YUAN T T, LV Y X, et al.Composition and activity analysis of alcohol extract of Quezui tea based on UHPLC-Q-orbitrap HRMS[J].Journal of Southwest Forestry University (Natural Sciences), 2024, 44(1):176-184.
[13] 李国泽, 陈蔼仪, 李雪, 等.2种干燥方式对樟叶越桔3种主效成分含量的影响[J].西南林业大学学报(自然科学), 2021, 41(5):72-79.
LI G Z, CHEN A Y, LI X, et al.Effects of 2 drying methods on 3 effective ingredients contents in Vaccinium dunalianum[J].Journal of Southwest Forestry University (Natural Sciences), 2021, 41(5):72-79.
[14] ZHANG L, WANG Z G, SHI G Y, et al.Effects of drying methods on the nutritional aspects, flavor, and processing properties of Chinese chestnuts[J].Journal of Food Science and Technology, 2018, 55(9):3391-3398.
[15] YU D X, GUO S, WANG J M, et al.Comparison of different drying methods on the volatile components of ginger (Zingiber officinale Roscoe) by HS-GC-MS coupled with fast GC E-nose[J].Foods, 2022, 11(11):1611.
[16] JIANG Y, ZHAO Q L, DENG H L, et al.The nutrients and volatile compounds in Stropharia rugoso-annulata by three drying treatments[J].Foods, 2023, 12(10):2077.
[17] BALTACIO LU H, BAYINDIRLI A, SEVERCAN M, et al.Effect of thermal treatment on secondary structure and conformational change of mushroom polyphenol oxidase (PPO) as food quality related enzyme:A FTIR study[J].Food Chemistry, 2015, 187:263-269.
LU H, BAYINDIRLI A, SEVERCAN M, et al.Effect of thermal treatment on secondary structure and conformational change of mushroom polyphenol oxidase (PPO) as food quality related enzyme:A FTIR study[J].Food Chemistry, 2015, 187:263-269.
[18] SIDDIQ M, DOLAN K D.Characterization of polyphenol oxidase from blueberry (Vaccinium corymbosum L.)[J].Food Chemistry, 2017, 218:216-220.
[19] TEREFE N S, DELON A, BUCKOW R, et al.Blueberry polyphenol oxidase:Characterization and the kinetics of thermal and high pressure activation and inactivation[J].Food Chemistry, 2015, 188:193-200.
[20] DAWIDOWICZ A L, TYPEK R.Transformation of 5-o-caffeoylquinic acid in blueberries during high-temperature processing[J].Journal of Agricultural and Food Chemistry, 2014, 62(45):10889-10895.
[21] DAWIDOWICZ A L, TYPEK R.Thermal stability of 5-o-caffeoylquinic acid in aqueous solutions at different heating conditions[J].Journal of Agricultural and Food Chemistry, 2010, 58(24):12578-12584.
[22] 温雪珊, 时月, 郑煜焱, 等.马铃薯中多酚氧化酶酶促褐变及防控技术机制研究进展[J].农产品加工, 2022(15):70-75;82.
WEN X S, SHI Y, ZHENG Y Y, et al.Inhibition and its mechanism of enzymatic browning induced by polyphenol oxidase in potato[J].Farm Products Processing, 2022(15):70-75;82.
[23] MONDOLOT L, FISCA P L, BUATOIS B, et al.Evolution in caffeoylquinic acid content and histolocalization during Coffea canephora leaf development[J].Annals of Botany, 2006, 98(1):33-40.
[24] 孔德鑫. 金银花主要药用成分合成积累的动态规律和调控机制及其药材质量评价研究[D].广州:华南农业大学, 2020.
KONG D X.Study on the accumulation dynamics and regulatory mechanism of the main medicinal components in Lonicera japonica and quality evaluation of its related medicinal materials[D].Guangzhou:South China Agricultural University, 2020.