榅桲(Cydonia oblonga Mill.),又称木梨,是蔷薇科榅桲属中唯一的种类,已有超过4 000年的栽培历史。中国榅桲产量全球第二[1],地域性极强,主要分布在新疆。新疆榅桲的果实外形似梨,表皮附有绒毛,果肉坚硬,呈白色或淡黄色,口感涩酸,不适合生食。新疆榅桲一般在9~10月成熟,采摘期短,坏果率高;常温下贮藏期短,极易腐烂变质。新疆榅桲有令人愉悦的香气和独特的味道,脂肪含量低且富含有机酸、多酚、膳食纤维和矿物质等营养物质[2-3]。《本草纲目》记载榅桲主治水泻肠虚烦热。新疆榅桲是一种具有浓郁民族色彩的传统维药[4],具有促进心血管健康、促进消化、抗炎和抗癌等功效[5]。因此有必要提高新疆榅桲的市场认可度和加工利用率,考虑对新疆榅桲果肉进行干燥。
冷冻干燥(freeze drying,FD)通过冻结使水分直接升华,最大限度保留食品形态和营养,但成本极高且过程缓慢[6-7]。研究人员通常将FD与热风干燥(hot air drying,HAD)、远红外干燥、微波干燥和喷雾干燥等方法结合使用[8]。HAD通过循环热风去除水分,成本低,但容易导致营养损失和干燥不均[9]。因此考虑联合FD和HAD,先利用FD保持食品的结构和营养,再使用HAD快速去除残余水分,提高干燥效率。在联合干燥过程中,确定冷冻干燥结束时间对干制品品质至关重要。过早结束会导致冰融化造成样品损坏,而延迟结束会增加不必要的相关成本[10]。HARGUINDEGUY等[10]提出适当的水分转移点是基于冰晶升华的结束。低场核磁共振技术(low-field nuclear magnetic resonance,LF-NMR)可以直观高效的描述和判断不同FD时间后的水分分布和水分状态的变化[11]。因此本研究应用LF-NMR选择适宜的水分转换点,并且研究联合干燥对最终干制品的物理指标(色差、微观结构、硬度、体积收缩率)和活性物质[总酚、总黄酮、三萜及甾醇、维生素C和还原糖]的影响。
1 材料与方法
1.1 材料与试剂
2023年10月,从新疆喀什采购新鲜榅桲,4 ℃冷藏保存。干燥前用清水洗净表面的绒毛和污垢,去籽削皮,果肉切成4 mm圆片。果肉占整个果实的90%,新鲜果肉水分含量为86.48%。
没食子酸、芦丁、无水葡萄糖、维生素C、齐墩果酸,苏州格瑞特医药技术有限公司;福林酚、无水乙醇、高氯酸以及其他分析纯化学试剂,国药集团化学试剂有限公司。
1.2 仪器与设备
AR224CN电子分析天平,上海奥豪斯仪器有限公司;JYL-C022E九阳料理机,九阳股份有限公司;YQ-920D超声波清洗器,上海易净超声波仪器有限公司;SHJ-A6磁力搅拌水浴锅,常州市亿能实验仪器厂;XW-80A旋涡混合器,上海驰唐电子有限公司;DL-5-B低速离心机,上海安亭科学仪器有限公司;BC-R501C旋转蒸发器,上海贝凯生物化工设备有限公司;GZX-9140MBE电热鼓风干燥箱,上海博迅实业有限公司医疗设备厂;SCIENTZ-10N冷冻干燥机,宁波新芝生物科技股份有限公司;MesoMR23-060V-I核磁共振成像分析仪,上海纽迈电子科技有限公司;DS-410分光色差仪,杭州彩谱科技有限公司;SU8100冷场发射扫描电子显微镜,日本株式会社日立高新技术;TA-XT.Plus物性分析仪,英国SMS公司;DC-12型氮吹仪,上海安谱实验科技股份有限公司;UV-2100紫外可见分光光度计,上海尤尼可仪器有限公司。
1.3 实验方法
1.3.1 干燥方法
将新鲜榅桲果肉切片置于-80 ℃冰箱中冷冻并过夜。将预冻后的样品转移到冷冻干燥机中,设置冷阱温度为-40 ℃。在干燥过程中,压力维持0.10 mbar,FD时间为0、12、24、36、48 h,随后进行HAD。提前设定电热鼓风干燥箱温度为60 ℃,当干燥箱内温度基本恒定后,立即将冷冻干燥后榅桲放入其中,继续干燥直至最终含水量均为(0.30±0.05) g/g DW,热风干燥时间为7、5、3、2、0 h。按照顺序将联合干燥样品分别命名为HAD、FD12-HAD5、FD24-HAD3、FD36-HAD2、FD。联合干燥的不同阶段对应的干燥工艺和时间见表1。
表1 新疆榅桲果肉切片的联合干燥阶段和颜色参数
Table 1 Combined drying stages and color parameters of Xinjiang quince pulp slices
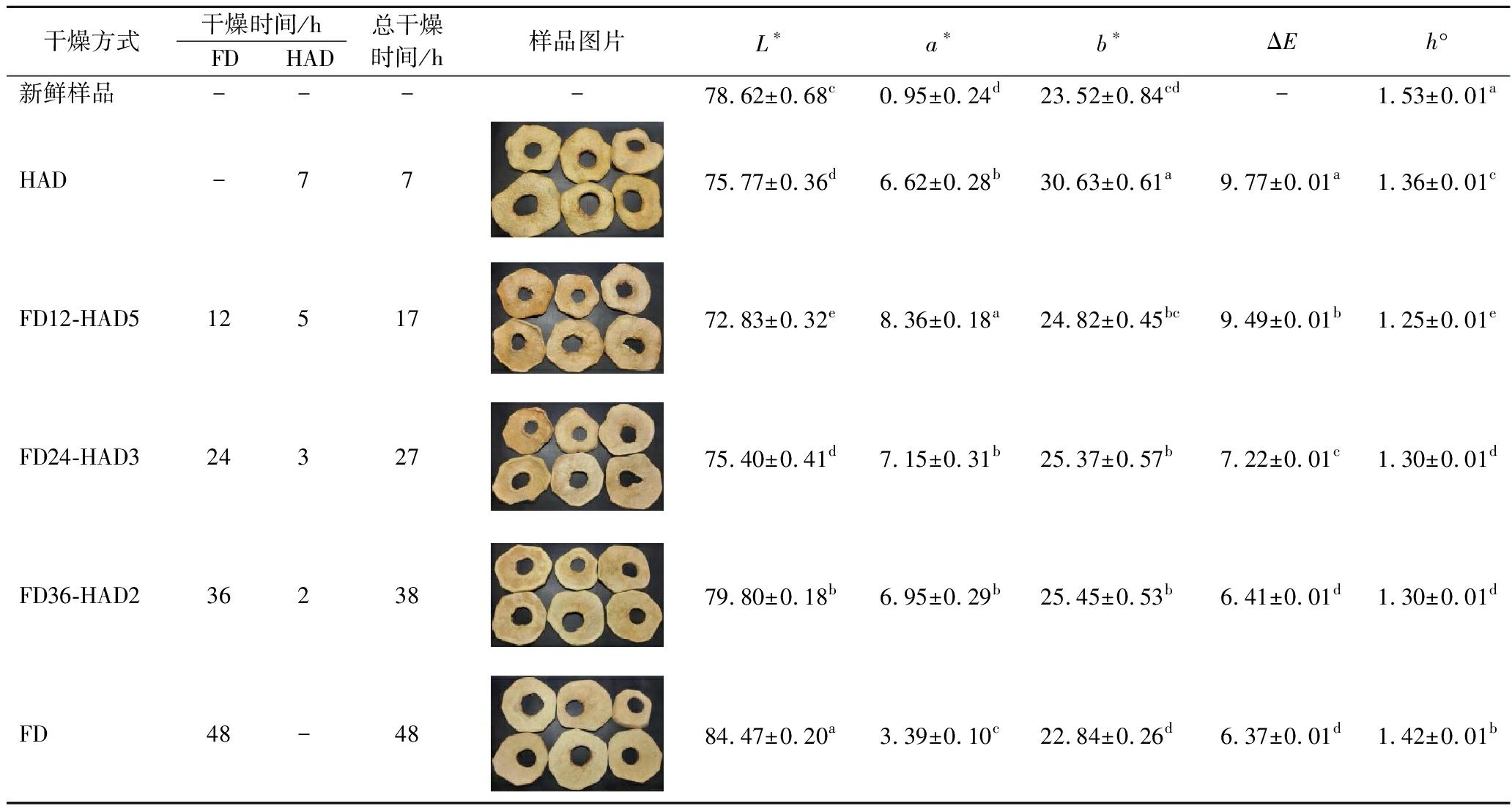
干燥方式干燥时间/hFDHAD总干燥时间/h样品图片L∗a∗b∗ΔEh°新鲜样品----78.62±0.68c0.95±0.24d23.52±0.84cd-1.53±0.01aHAD-7775.77±0.36d6.62±0.28b30.63±0.61a9.77±0.01a1.36±0.01cFD12-HAD51251772.83±0.32e8.36±0.18a24.82±0.45bc9.49±0.01b1.25±0.01eFD24-HAD32432775.40±0.41d7.15±0.31b25.37±0.57b7.22±0.01c1.30±0.01dFD36-HAD23623879.80±0.18b6.95±0.29b25.45±0.53b6.41±0.01d1.30±0.01dFD48-4884.47±0.20a3.39±0.10c22.84±0.26d6.37±0.01d1.42±0.01b
注:不同小写字母表示差异显著(P<0.05)(下同)。
1.3.2 水分状态和水分分布的测定
参考杨慧珍等[12]的方法,采用共振频率为23.2 MHz的LF-NMR测量不同冷冻干燥时间后的新疆榅桲果肉的水分状态和水分分布。每次测定均取0.8 g新疆榅桲果肉切片置于直径为25 mm的核磁线圈中。采用脉冲回波序列(carr-purcell-meiboom-gill,CPMG)采集衰减信号,操作参数如下:TW=4 500 ms,TE=0.5 ms,NECH=18 000,NS=4。随后采用MultiExp Inv分析软件通过多指数拟合分析CPMG衰减曲线进行拟合(迭代100万次)得到相应的LF-NMR参数。
1.3.3 物理指标的测定
1.3.3.1 色差的测定
用色差仪测量联合干燥后新疆榅桲果肉的色泽变化。用CIE-L*a*b*系统表示,其中L*代表亮度值,a*代表绿色/红色值,b*代表蓝色/黄色值。ΔE代表样品总色差,其数值越大表明样品颜色变化越大。按照公式(1)计算ΔE。
(1)
式中:ΔE,总色差;L*、L*分别代表待测样品及对照的亮度值;a*、a*分别代表待测样品及对照的绿/红色值;b*、b*分别代表待测样品及对照的蓝/黄色值。
色相角的计算如公式(2)所示:
(2)
式中:270°代表蓝色,180°代表绿色,90°代表黄色,0°代表红色。
1.3.3.2 微观结构的测定
参考马有川[13]的方法使用扫描电子显微镜(scanning electron microscope,SEM)观察样品横切面的显微结构。
1.3.3.3 体积收缩率的测定
参照CUI等[14]的方法测定新疆榅桲果肉的体积收缩率。
1.3.3.4 硬度的测定
参照戴雅等[15]的方法并稍作修改,采用直径为2 mm的圆柱形P/2探针进行穿刺测试。具体测试参数如下:位移=10 mm,触发力=10 g,测试前速度、测试中速度和测试后速度均为2 mm/s。
1.3.4 活性物质的测定
将干燥后的果肉切片进行液氮速冻,粉碎过20目筛,冷藏保存,用于后续新疆榅桲果肉中活性物质的测定。
1.3.4.1 总酚和总黄酮的提取和测定
准确称取1 g干燥后粉末于50 mL离心管中,加30 mL体积分数为70%乙醇超声波提取40 min,室温下静置冷却,在25 ℃、5 000 r/min的条件下离心10 min,取上清液,重复提取3次,合并上清液后定容至100 mL。即得质量浓度为10 mg/mL的样品70%醇提物。参照GB/T 8313—2018 《茶叶中茶多酚和儿茶素类含量的检测方法》采用福林酚法绘制总酚标准曲线并测定样品中总酚含量。参照NY/T 1295—2007 《荞麦及其制品中总黄酮含量的测定》采用氯化铝比色法绘制总黄酮标准曲线并测定样品中总黄酮含量。
1.3.4.2 三萜及甾醇的提取和测定
参照2020版《中华人民共和国药典》第1部采用高氯酸法测定样品中三萜及甾醇的含量。
1.3.4.3 维生素C的提取和测定
参考李军[16]的方法并作适当改动。精密量取0.2、0.3、0.4、0.5、0.6、0.7 mL的标准维生素C溶液(1 mg/mL)(维生素C提前在60 ℃下真空干燥2 h)于25 mL比色管中,加入草酸-EDTA溶液使总体积达到5 mL。依次加入0.5 mL的偏磷酸-醋酸溶液和1.0 mL体积分数5%的硫酸溶液,摇匀,加入2 mL的钼酸铵,用蒸馏水定容。静置15 min,在705 nm下测定吸光度,绘制标准曲线。
准确称取2 g干燥后粉末于25 mL棕色容量瓶中,加入草酸-EDTA溶液定容,离心取上清液5 mL于25 mL比色管中,照标准曲线制备的方法,自“依次加入”起,同法操作,测定吸光度,根据标准曲线计算样品中维生素C的含量。
1.3.4.4 还原糖的提取和测定
精密量取0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0 mL的标准葡萄糖溶液(10 mg/mL)(葡萄糖提前在105 ℃烘至恒重)于25 mL比色管中,加水使总体积达到1 mL。加入3 mL的3,5-二硝基水杨酸溶液,摇匀,置于沸水浴中煮沸6 min。立即置冰浴中冷却,取出,加水至刻度线,摇匀。以相应试剂为空白,在540 nm波长处测定吸光度,以吸光度为纵坐标、浓度为横坐标绘制标准曲线。
准确称取1 g干燥后粉末于具塞锥形瓶中,向其中加入30 mL蒸馏水,再置于50 ℃的水浴中15 min。取出,趁热过滤。取滤液定容至50 mL。移取上述溶液1 mL于1支洁净的25 mL比色管中,照标准曲线制备的方法,自“加入3 mL的3,5-二硝基水杨酸溶液”起,同法操作,测定吸光度,根据标准曲线计算样品中还原糖的含量[17-19]。
1.4 数据处理及分析方法
本文中活性物质含量以干基计(DW)。采用SPSS 27.0软件进行单因素方差分析(ANOVA)和Duncan多重比较显著性分析(P<0.05)。所有试验均至少进行3次独立重复,结果以“平均值±标准偏差”表示。采用Origin 2024软件进行实验数据相关的图形处理。
2 结果与分析
2.1 FD过程中的水分状态和水分分布
利用LF-NMR技术中的CPMG可以高效区分结合水、半结合水和自由水。CPMG通过连续应用一系列180°射频脉冲,对初始由90°脉冲激发的横向磁化进行重新聚焦,从而产生一系列的回波。这些回波随时间逐渐衰减,衰减过程主要由样品内部的横向弛豫控制。横向弛豫时间(T2)是描述核磁矩衰减到其平衡状态的指数衰减过程的时间常数,它反映了样品内部环境对核自旋相位退相干的影响。水分子与周围环境的相互作用程度和在样品中的运动自由度均影响其T2值。如图1-a所示,结合水是指非常紧密地与分子结构(如细胞壁、蛋白质等)相结合的水分。结合水的横向弛豫时间(T21)一般在几毫秒内,几乎没有自由度;半结合水指的是与大分子表面或较小的孔隙结合,但仍保有一定运动自由度的水分,半结合水的横向弛豫时间(T22)一般在几到几十毫秒范围内;自由水指的是在样品中运动自由度最高的水分子,通常位于样品的大孔隙或自由空间中,自由水的横向弛豫时间(T23)较长,一般大于几十毫秒。从图1-b和图1-d可以看出,随着FD时间延长,新疆榅桲果肉切片中自由水的信号峰顶点和总信号强度逐渐下降,而半结合水和结合水的信号峰顶点和总信号强度均先增大后减小。这表明在自由水除去的过程中,部分自由水转移为半结合水和结合水,并且样品中的湿度梯度也促进自由水的转移[20]。新鲜样品以自由水为主,自由水占92.77%,FD48样品以结合水为主,自由水仅剩7.36%。特别的,FD36样品中自由水为8.47%,这表明冷冻干燥36 h已经除去绝大部分自由水,有利于形成良好的空间结构,是适宜的水分转换点[10]。从图1-b和图1-c可以看出,FD干燥过程中T21、T22和T23趋向于沿着x轴向左移动,T21峰顶点时间从252.35 ms移动到51.11 ms、T22峰顶点时间从16.83 ms移动到9.01 ms、T23峰顶点时间从1.38 ms移动到0.52 ms。其他研究中也观察到类似现象[21-22],这表明随着FD进行,自由水减少导致大分子物质(如碳水化合物、蛋白质等)浓度增大,促使水与大分子紧密结合,水的自由度减小,这也可以合理解释FD48样品结合水的含量与新鲜样品相比增加了60%。

a-新鲜榅桲果肉的横向弛豫时间(T2)曲线;b-冻干过程中榅桲果肉的T2曲线;c、d-冻干过程中榅桲果肉的LF-NMR参数
图1 冻干过程中新疆榅桲果肉的水分状态和水分分布
Fig.1 Moisture status and moisture distribution of Xinjiang quince pulp during FD process
注:FD12:冻干时间为12 h;FD24:冻干时间为24 h;FD36:冷冻干燥时间为36 h;FD48:冷冻干燥时间为48 h;A21:T21对应的峰面积;A22:T22对应的峰面积;A23:T23对应的峰面积。
2.2 联合干燥对物理指标的影响
2.2.1 色差
联合干燥后样品色泽图片和参数变化如表1所示。参数中ΔE是指联合干燥果肉与新鲜果肉在色彩上的差异程度。ΔE越大,表示干燥后果肉的颜色变化越显著;h°值代表颜色的种类。h°值从1.57逐渐降低意味着颜色从黄色向红色方向转变。HAD果肉与新鲜果肉的颜色差异最大。对果肉进行不同联合干燥后,FD果肉的L*值(84.47±0.20)最高,a*值(3.39±0.10)和b*值(22.84±0.26)最低。FD果肉与新鲜果肉的色差最小,h°值(1.42±0.01)表明FD果肉与新鲜果肉类似最接近黄色。联合干燥FD12-HAD5、FD24-HAD3和FD36-HAD2均导致果肉的h°值减小,这意味着颜色向橙色甚至是红色的变化,其中FD12-HAD5果肉h°值(1.25±0.01)与FD果肉的差异最为显著。水分状态和水分分布结果表明FD12样品中仍有大量冰晶没有完全升华,并且后续热风干燥提供了加热和有氧环境,促使一系列反应造成颜色变化。
2.2.2 微观结构
通过SEM放大50倍显示出具有高分辨率的榅桲果肉横切面的立体图像,有助于通过果蔬内部构造理解不同干燥方式下榅桲果肉切片的差异。如图2-a所示,观察到大小不一的孔洞和严重的收缩。HAD效率受热量传递和水分扩散的共同影响。HAD通过对流方式将热量传递到果蔬表面,干燥过程中水分从内部向外部移动,内部的水分较难蒸发,最终导致不均匀干燥和结构损伤[23]。如图2-b和图2-c所示,FD12和FD24有不同程度的内部塌陷,果肉外部呈现出如图2-e中的大孔洞。这是因为FD持续24 h榅桲果肉切片仍含有较高的自由水含量(74.03%),果肉中仍有部分冰晶没有完全升华,在后续HAD过程中冰融化导致结构塌陷。如图2-d和图2-e所示,FD36和FD48均呈现出均一孔洞,这表明FD持续36 h基本实现冰晶完全升华,形成良好的空间结构,而FD持续时间延长会导致相关成本的不必要增加。

a-HAD;b-FD12-HAD5;c-FD24-HAD3;d-FD36-HAD2;e-FD
图2 联合干燥对新疆榅桲果肉微观结构的影响
Fig.2 Microstructure of Xinjiang quince pulp slices under five different drying technologies
注:放大倍数均为50倍。
2.2.3 体积收缩率
测定干燥后榅桲果肉的体积收缩率对于食品加工行业具有重要意义,因为它直接影响到产品的质量、口感、外观以及运输和包装的成本。如图3所示,HAD果肉体积收缩率(82.69±0.06)%最大,FD果肉体积收缩率(16.75±0.03)%最小。HAD在较高温度下使水分从液态蒸发成气态。这个过程中,热风直接作用于榅桲果肉,快速移除水分,导致细胞内外压力差增大,从而使细胞壁收缩或者塌陷[24],最终导致榅桲果肉体积显著减小。而在FD过程中,水分通过冰晶形式直接升华,绕过了液态阶段,细胞壁和细胞间质不会因为水分的液态流失而发生显著变形,有助于维持原有的细胞结构。联合干燥可以显著改善HAD对体积收缩的影响,其中FD36-HAD2果肉的体积收缩率仅为HAD的40%,这与干燥过程中水分状态和水分分布以及果肉微观结构的结果一致。
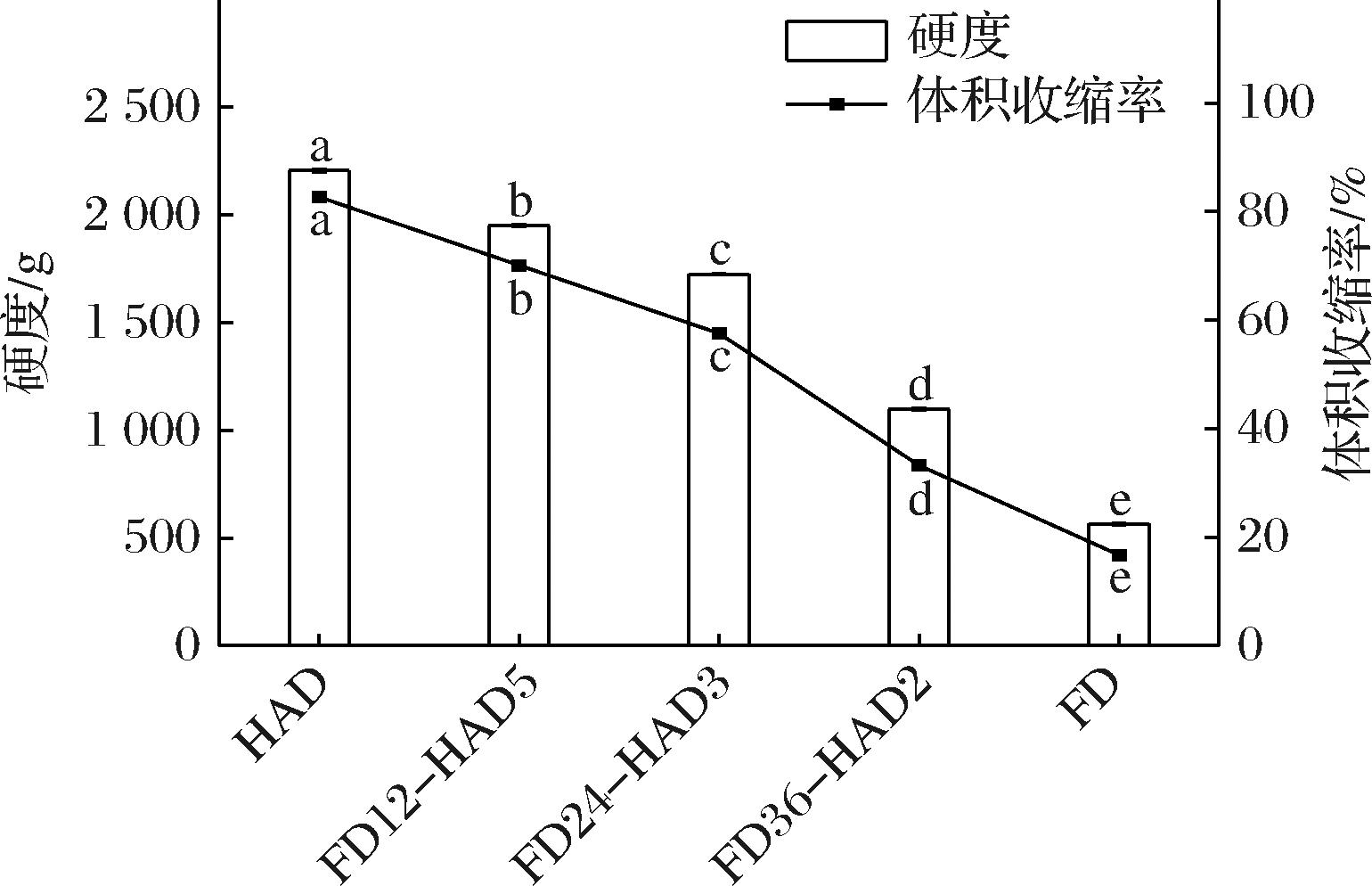
图3 联合干燥对新疆榅桲果肉硬度和体积收缩率的影响
Fig.3 Hardness and volume shrinkage ratio of Xinjiang quince pulp slices under five different drying technologies
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.2.4 硬度
硬度是指食品在受到外力作用时的抗变形性能。硬度的测定对干制品具有重要意义,因为它可以影响食品的口感、储存稳定性和消费者的接受程度。如图3所示,HAD果肉硬度(2 207.37±5.53) g最大,FD果肉硬度(565.22±2.61) g最小。FENG等[25]也得出类似结论。HAD果肉不仅严重收缩而且硬度高。FD果肉呈现出松软的质地可能是由于预冻阶段冰晶的形成破坏果肉的组织结构,随后冰晶升华使果肉内部形成类似海绵的多孔结构[26]。不同干燥后果肉硬度顺序如下:HAD>FD12-HAD5>FD24-HAD3>FD36-HAD2>FD48。其中FD36-HAD2果肉的硬度适中,仅为HAD的一半。
2.3 联合干燥对活性物质的影响
2.3.1 总酚和总黄酮
总酚和总黄酮物质是植物中广泛存在的次生代谢物,由于其抗氧化、抗炎、心血管保护和抗癌等多重功效,在食品、医药和健康产品开发中受到高度重视[27]。联合干燥对新疆榅桲果肉总酚和总黄酮含量的影响如图4所示。HAD果肉的总酚含量为(8.10±0.03) mg/g DW,FD果肉的总酚含量为(8.23±0.02) mg/g DW,高于SUT等[28]测得果肉的总酚含量4.18 mg/g,略低于ALTUNTAS等[29]测得榅桲果肉的总酚含量(9.06±0.41) mg/g。特别指出,FD12-HAD5果肉中的总酚含量显著低于HAD且低于新鲜果肉,约为HAD果肉的一半,FD24-HAD3果肉中总酚含量与FD果肉无显著差异,FD36-HAD2果肉中总酚含量甚至高于FD果肉。干燥后果肉中总黄酮含量均高于新鲜果肉。不同干燥方式联合后果肉中总黄酮含量顺序如下:FD36-HAD2>FD48>FD24-HAD3>FD12-HAD5>HAD,其中FD36-HAD2果肉中总黄酮含量是(2.31±0.01) mg/g DW。FD有助于保留总酚和总黄酮等营养成分,HAD可以提高干燥效率。通过合理控制2种干燥方式的条件和参数,即FD36-HAD2,可以最大限度地保持榅桲果肉中总酚和总黄酮的含量,同时提高干燥效率。
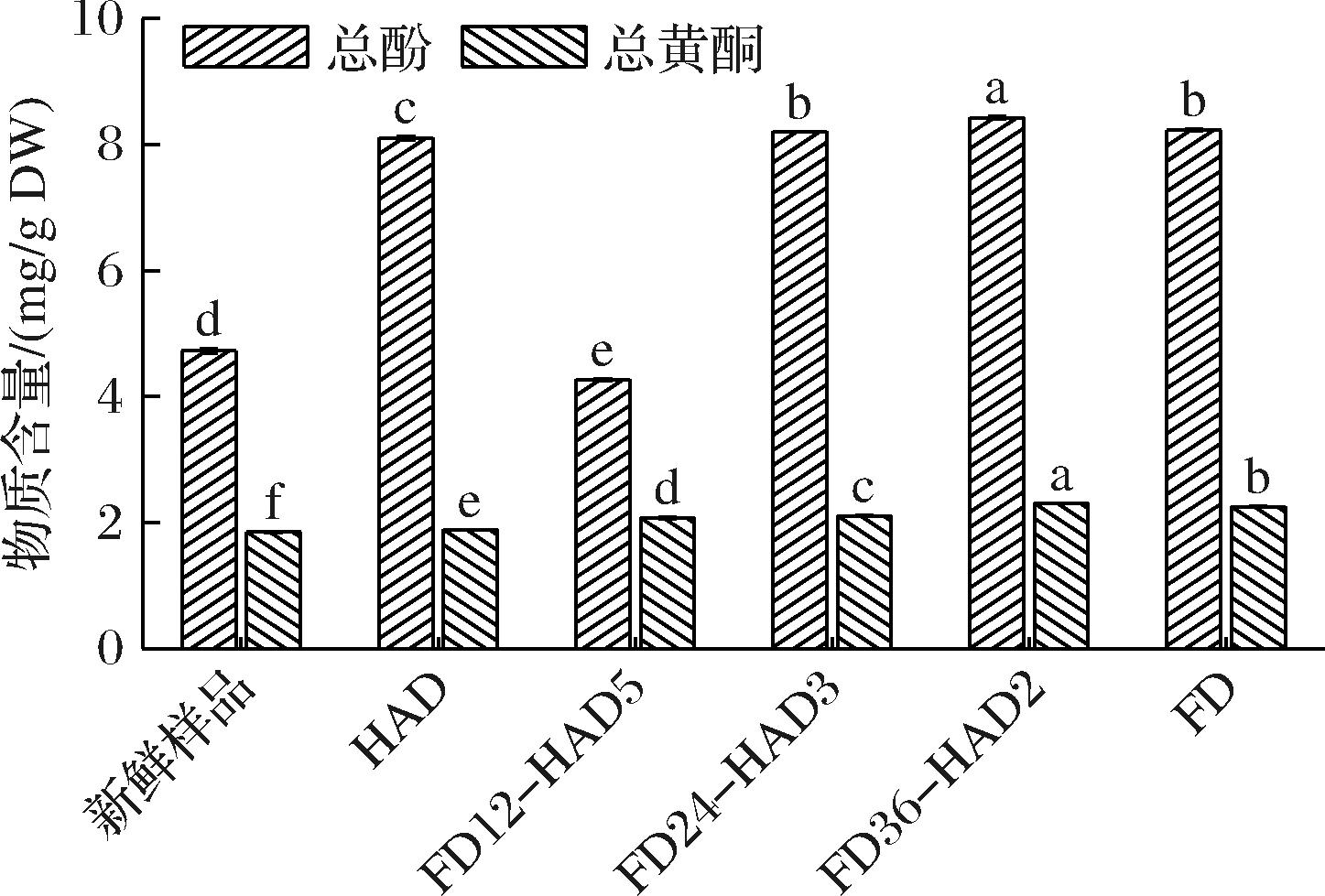
图4 联合干燥对新疆榅桲果肉总酚和总黄酮含量的影响
Fig.4 Total phenolics and total flavonoids content of Xinjiang quince pulp slices under five different drying technologies
2.3.2 三萜及甾醇
三萜和甾醇类化合物具有多种生物活性,如降低血脂、抗炎、抗病毒和免疫调节功能。这些成分的测定有助于评估干制品的营养和药用价值。联合干燥对新疆榅桲果肉三萜及甾醇含量的影响如图5所示。干燥后果肉中三萜及甾醇含量均显著高于新鲜果肉。HAD果肉三萜及甾醇含量[(83.83±2.95) mg/g DW]最低,FD果肉中三萜及甾醇含量为(87.09±0.03) mg/g DW并且与FD36-HAD2果肉无显著差异。FD12-HAD5和FD24-HAD3果肉三萜及甾醇无显著差异且为HAD果肉的1.14倍。三萜及甾醇是脂溶性化合物,在干燥过程中对热相对稳定。FD预冻过程形成的冰晶破坏了细胞壁和细胞膜,有助于释放细胞内的脂溶性化合物,由之前测定的水分状态和水分分布结果可知,FD12-HAD5和FD24-HAD3果肉中仍含有未完全升华的冰晶,HAD导致冰晶融化,原先因冻结而断裂或弱化的细胞壁进一步受到冲击,释放出更多细胞内的三萜和甾醇。同时,冰晶融化后,原来被冰封的脂溶性化合物如三萜和甾醇更易于从细胞内部流向细胞外部或更容易从细胞间隙中提取。
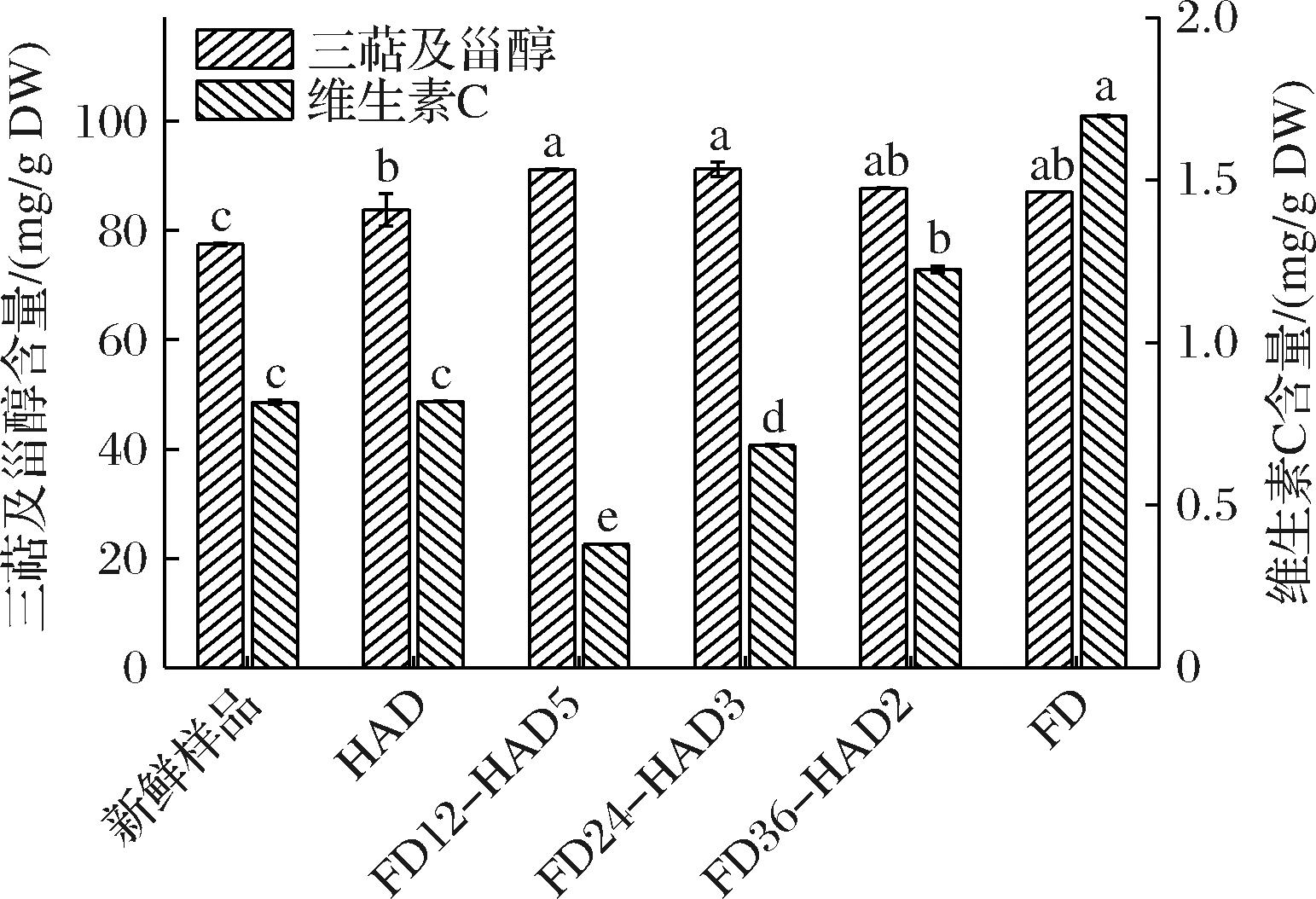
图5 联合干燥对新疆榅桲果肉三萜及甾醇和维生素C含量的影响
Fig.5 Triterpenes and sterols content and vitamin C content of Xinjiang quince pulp slices under five different drying technologies
2.3.3 维生素C
维生素C是一种强效的抗氧化剂,对增强免疫力、促进胶原蛋白合成、加速伤口愈合等方面具有重要作用。由于加工过程中维生素C易受破坏,测定干制品中的维生素C含量可以评估其营养保留情况。联合干燥对新疆榅桲果肉维生素C含量的影响如图5所示。HAD果肉维生素C含量为(0.82±0.01) mg/g DW,与新鲜果肉维生素C含量相比无显著差异,FD果肉维生素C含量是HAD果肉的2.1倍。因为HAD是在较高温度下进行的,容易导致维生素C的热降解和氧化。特别指出,FD36-HAD2果肉中维生素C含量显著高于HAD果肉,而FD12-HAD5果肉和FD24-HAD3果肉均显著低于HAD果肉中维生素C含量,甚至FD12-HAD5果肉中的维生素C含量仅为FD果肉的0.22倍。在联合干燥过程中,FD在初期阶段提供了低温和真空保护,使维生素C得以保存,FD36果肉转换为HAD后,由于样品中的水分已经大幅减少,热风干燥可以迅速完成剩余水分的去除,避免了维生素C长时间暴露在高温下。相反,FD12和FD24果肉中冰晶融化和结构破坏的影响导致维生素C大量损失。
2.3.4 还原糖
测定干制品中的还原糖含量对于评估食品的营养价值、口感特性和储存稳定性具有重要意义。这些信息对于产品的开发、生产和质量控制都是至关重要的。联合干燥对新疆榅桲果肉还原糖含量的影响如图6所示。干燥后果肉中还原糖含量均显著高于新鲜果肉。HAD果肉还原糖含量为(573.39±0.33) mg/g DW,与FD36-HAD2果肉无显著差异,FD果肉还原糖含量[(585.49±1.85) mg/g DW]最高,FD12-HAD5果肉还原糖含量[(549.22±1.91) mg/g DW]最低。联合干燥对还原糖含量的影响与维生素C含量的影响类似。
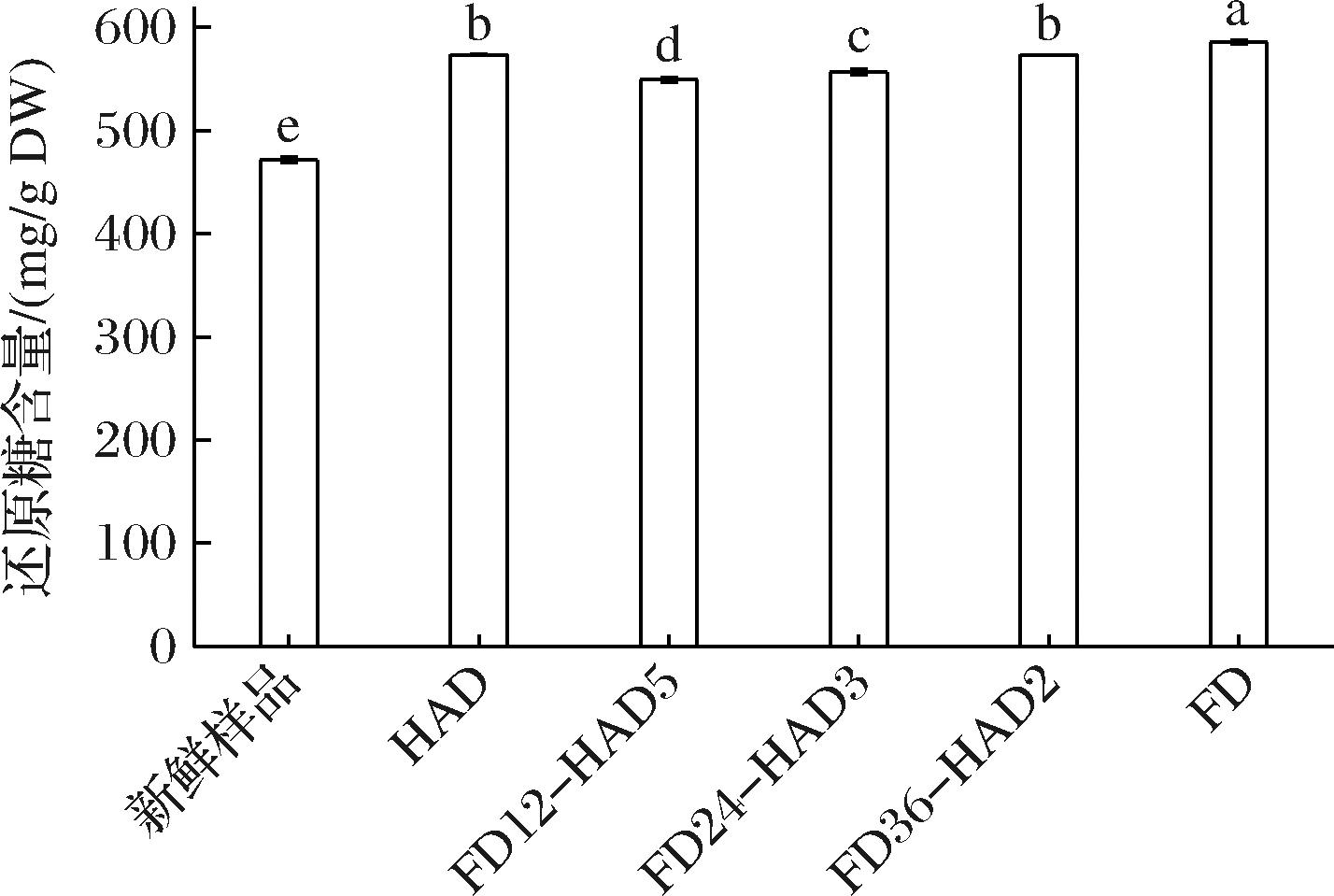
图6 联合干燥对新疆榅桲果肉还原糖含量的影响
Fig.6 Reducing sugar content of Xinjiang quince pulp slices under five different drying technologies
3 结论与讨论
为了补充单一FD和HAD的优势,采用FD-HAD技术对新疆榅桲果肉进行干燥。结果表明,联合干燥对最终干制品的物理指标(色差、微观结构、硬度、体积收缩率)和活性物质(总酚、总黄酮、三萜及甾醇、维生素C和还原糖)有很大影响。应用LF-NMR分析了脱水过程中的水分状态和水分分布,这有利于选择合适的联合干燥转换点。LF-NMR结果表明,当FD时间达到36 h时,大部分自由水被去除(仅剩8.47%),果肉的原始结构得以保留。在此基础上使用HAD对样品进行进一步干燥。FD36-HAD2果肉的体积收缩率仅为HAD的40%且硬度适中。FD12-HAD5对活性物质造成严重损失;而FD36-HAD2果肉总酚和总黄酮含量最高、三萜及甾醇含量与FD果肉无显著差异、维生素C含量是FD12-HAD5果肉的3.2倍、还原糖含量为(573.37±0.16) mg/g DW。总之,FD36-HAD2是新疆榅桲果肉的最佳联合技术。
[1] RATHER J A, YOUSUF S, ASHRAF Q S, et al.Nutritional and bioactive composition, nutraceutical potential, food and packaging applications of Cydonia oblonga and its byproducts:A review[J].Journal of Food Composition and Analysis, 2023, 115:105000.
[2] SZYCHOWSKI P J, LECH K, SENDRA-NADAL E, et al.Kinetics, biocompounds, antioxidant activity, and sensory attributes of quinces as affected by drying method[J].Food Chemistry, 2018, 255:157-164.
[3] 车玉红, 杨波, 艾沙江·买买提, 等.新疆莎车大果榅桲果实营养分析及评价[J].食品工业科技, 2015, 36(24):345-348;355.
CHE Y H, YANG B, MAIMAIT A S J, et al.Analysis and evaluation of nutritional composition of big quince in Shache county of Xinjiang[J].Science and Technology of Food Industry, 2015, 36(24):345-348;355.
[4] 罗华, 郝兆祥, 张忠涛, 等.国内榅桲种质资源研究现状[J].山西果树, 2018(6):18-22;27.
LUO H, HAO Z X, ZHANG Z T, et al.Research status of coing germplasm resources in China[J].Shanxi Fruits, 2018(6):18-22;27.
[5] AL-ZUGHBI I, KRAYEM M.Quince fruit Cydonia oblonga Mill nutritional composition, antioxidative properties, health benefits and consumers preferences towards some industrial quince products:A review[J].Food Chemistry, 2022, 393:133362.
[6] LENAERTS S, VAN DER BORGHT M, CALLENS A, et al.Suitability of microwave drying for mealworms (Tenebrio molitor) as alternative to freeze drying:Impact on nutritional quality and colour[J].Food Chemistry, 2018, 254:129-136.
[7] SUN Y J, SHEN Y, LIU D H, et al.Effects of drying methods on phytochemical compounds and antioxidant activity of physiologically dropped un-matured citrus fruits[J].LWT - Food Science and Technology, 2015, 60(2):1269-1275.
[8] 刘杨, 李保国, 程朝辉.水果真空冷冻干燥的预处理及其联合干燥技术研究进展[J].食品与发酵科技, 2023, 59(6):113-117.
LIU Y, LI B G, CHENG C H.Research progress of pretreatment and combined drying technology of vacuum freeze drying of fruits[J].Sichuan Food and Fermentation, 2023, 59(6):113-117.
[9] NAJMAN K, ADRIAN S, HALLMANN E, et al.Effect of various drying methods on physicochemical and bioactive properties of quince fruit (Cydonia oblonga Mill.)[J].Agriculture, 20, 13(2):446.
[10] HARGUINDEGUY M, FISSORE D.Temperature/end point monitoring and modelling of a batch freeze-drying process using an infrared camera[J].European Journal of Pharmaceutics and Biopharmaceutics, 2021, 158:113-122.
[11] SUN Q, ZHANG M, YANG P Q.Combination of LF-NMR and BP-ANN to monitor water states of typical fruits and vegetables during microwave vacuum drying[J].LWT, 2019, 116:108548.
[12] 杨慧珍, 肖亚冬, 王娟, 等.花椰菜超声波预处理工艺优化及干燥过程中水分状态分析[J].现代食品科技, 2022, 38(5):199-208.
YANG H Z, XIAO Y D, WANG J, et al.Optimization of ultrasonic pretreatment process for cauliflower and analysis of moisture status during drying[J].Modern Food Science and Technology, 2022, 38(5):199-208.
[13] 马有川. 预处理对苹果脆片真空冷冻干燥特性和品质的影响研究[D].北京:中国农业科学院, 2021.
MA Y C.Effect of pretreatment on vacuum freeze-drying characteristics and quality of apple chips[D].Beijing:Chinese Academy of Agricultural Sciences, 2021.
[14] CUI Z W, LI C Y, SONG C F, et al.Combined microwave-vacuum and freeze drying of carrot and apple chips[J].Drying Technology, 2008, 26(12):1517-1523.
[15] 戴雅, 谭兴怡, 李翔, 等.基于主成分分析的冰温气调包装对松露的品质指标及相关性影响[J].食品科学, 2024, 45(5):257-264.
DAI Y, TAN X Y, LI X, et al.Effect of superchilling combined with modified atmosphere packaging on quality indicators of truffle and correlation among them as analyzed by principal component analysis[J].Food Science, 2024, 45(5):257-264.
[16] 李军. 钼蓝比色法测定还原型维生素C[J].食品科学, 2000, 21(8):42-45.
LI J.Study on molybdenum blue method of L-VC test by spectrometry[J].Food Science, 2000, 21(8):42-45.
[17] 程柳, 李静.3,5-二硝基水杨酸法测定山楂片中还原糖和总糖含量[J].轻工科技, 2016, 32(3):25-28.
CHENG L, LI J.Determination of reducing sugar and total sugar in hawthorn tablets by 3,5- dinitrosalicylic acid method[J].Light Industry Science and Technology, 2016, 32(3):25-28.
[18] 赵凯, 许鹏举, 谷广烨.3,5-二硝基水杨酸比色法测定还原糖含量的研究[J].食品科学, 2008, 29(8):534-536.
ZHAO K, XU P J, GU G Y.Study on determination of reducing sugar content using 3,5-dinitrosalicylic acid method[J].Food Science, 2008, 29(8):534-536.
[19] 樊晓辉, 赵春玲, 张成军, 等.3, 5-二硝基水杨酸法测定枸杞提取液中多糖的含量[J].食品研究与开发, 2014, 35(21):77-80.
FAN X H, ZHAO C L, ZHANG C J, et al.Determination of polysaccharide content in extraction solution of lycrium barbarum with 3, 5-dinitrosalicylic acid method[J].Food Research and Development, 2014, 35(21):77-80.
[20] XU F F, JIN X, ZHANG L, et al.Investigation on water status and distribution in broccoli and the effects of drying on water status using NMR and MRI methods[J].Food Research International, 2017, 96:191-197.
[21] CUI L, CHEN Y N, LI M, et al.Detection of water variation in rosebuds during hot-air drying by LF-NMR and MRI[J].Drying Technology, 2020, 38(3):304-312.
[22] CHAO E P, TIAN J J, FAN L P, et al.Drying methods influence the physicochemical and functional properties of seed-used pumpkin[J].Food Chemistry, 2022, 369:130937.
[23] HUANG X P, LI W Q, WANG Y M, et al.Drying characteristics and quality of Stevia rebaudiana leaves by far-infrared radiation[J].LWT, 2021, 140:110638.
[24] 任广跃, 朱乐雯, 段续, 等.苹果丁冷冻-热风联合干燥体积收缩机制[J].农业工程学报, 2024, 40(2):63-71.
REN G Y, ZHU L W, DUAN X, et al.Volume shrinkage mechanism for combined vacuum freeze drying-hot air drying of diced apples[J].Transactions of the Chinese Society of Agricultural Engineering, 2024, 40(2):63-71.
[25] FENG Y B, XU B G, YAGOUB A E A, et al.Role of drying techniques on physical, rehydration, flavor, bioactive compounds and antioxidant characteristics of garlic[J].Food Chemistry, 2021, 343:128404.
[26] DUAN X, YANG X T, REN G Y, et al.Technical aspects in freeze-drying of foods[J].Drying Technology, 2016, 34(11):1271-1285.
[27] DE ARA JO F F, DE PAULO FARIAS D, NERI-NUMA I A, et al.Polyphenols and their applications:An approach in food chemistry and innovation potential[J].Food Chemistry, 2021, 338:127535.
JO F F, DE PAULO FARIAS D, NERI-NUMA I A, et al.Polyphenols and their applications:An approach in food chemistry and innovation potential[J].Food Chemistry, 2021, 338:127535.
[28] SUT S, DALL’ACQUA S, POLONIATO G, et al.Preliminary evaluation of quince (Cydonia oblonga Mill.) fruit as extraction source of antioxidant phytoconstituents for nutraceutical and functional food applications[J].Journal of the Science of Food and Agriculture, 2019, 99(3):1046-1054.
[29] ALTUNTAS S, KORUKLUOGLU M.Biological activity of optimized phenolic extracts of quince (Cydonia oblonga Miller) parts before and after simulated in vitro gastrointestinal digestion[J].Food Chemistry, 2024, 437:137846.