雷竹笋又名雷笋、早园笋,是雷竹的嫩芽,富含多种营养成分和微量元素。作为春笋市场上最早上市的笋种之一,雷竹笋备受广大消费者的青睐。春季新鲜雷竹笋大量上市,易造成市场饱和、竹笋滞销,严重影响笋农经济利益。而雷竹笋采后不耐储存,贮存不当会造成细胞壁增厚和组织木质化,产生褐变、笋体坚硬等问题[1]。因此,有效贮存雷竹笋,保持其品质特性、提高其商品价值显得至关重要。温度是影响食品贮存的重要因素之一,低温是果蔬采后贮存常用的技术,研究表明低温条件可以抑制果蔬在储存过程中酶的活性,从而降低质量损失延长贮存期,提高其品质特性和商品价值[2],但不适当的低温温度也会对果蔬产生冷应激使其次生代谢产物积累导致其品质外观恶化[3]。
冰温贮存指将新鲜的果蔬贮存在0 ℃及其冰点温度范围之间,在保证果蔬品质特性外,抑制果蔬内部酶、微生物等代谢调控作用从而达到保鲜目的。研究表明,冰温贮存可以有效保障莲藕[4]、玉露香梨[5]、西梅[6]、杏子[7]等的贮存品质,调控果实活性氧代谢平衡,提高抗氧化活性,延缓果实熟化风味物质形成,保持较高的营养水平,然而目前对于冰温贮存能否延缓竹笋木质化的研究鲜见报道。竹笋木质化是由于纤维素、半纤维素和木质素生物合成相关基因的上调,次生细胞壁形成的结果,其生物合成途径受到苯丙氨酸解氨酶(phenylalanine ammonolyase,PAL)、过氧化物酶(peroxidase,POD)等酶的高度调控[8]。PAL是启动苯丙烷类代谢途径的开关酶,POD是诱导木质素酶活力最后一步限速酶,苯丙素在PAL的作用下生成肉桂醛,肉桂醛经过转化生成肉桂醇,最后这些脂醇类物质在POD的作用下聚合生成木质素。因此,抑制PAL、POD活性可以使木质素含量降低[9]。论文以雷竹笋为研究对象,测定雷竹笋不同部位冰点温度,研究冰温贮存雷竹笋色泽、质地、质量损失率、可溶性蛋白、微观结构、丙二醛、木质素、总酚、PAL、POD的变化规律,分析贮存过程中木质素的产生与总酚、PAL、POD等的相关性,解析冰温贮存对雷竹笋木质化的影响,以期为竹笋保鲜提供一定技术支撑和理论方法。
1 材料与方法
1.1 材料与试剂
雷竹笋购自浙江省德清县泰源农贸市场(当天挖掘),选择均一无害,大小成熟度一致的雷竹笋,当天立即运回实验室进行处理。
愈创木酚、福林酚,上海源叶生物试剂有限公司;甲醇、聚乙二醇(polyethylene glycol, PEG)6 000、聚乙烯吡咯烷酮(polyvinylpyrrolidone, PVP),上海迈瑞尔生化科技有限公司);30%(质量分数)H2O2、硼酸、硼砂、磷酸、乙酸钠、硫代巴比妥酸、盐酸,国药集团化学试剂有限公司;三氯乙酸、冰乙酸、NaOH、盐酸羟胺、正己烷、乙酰溴,上海麦克林生化科技有限公司;无水乙醇,永华化学股份有限公司;考马斯亮蓝G-250,上海易恩化学技术有限公司;PAL酶试剂盒,上海酶联生物科技有限公司;聚乙二醇辛基苯基醚(polyethylene glycol p-isooctylphenyl ether, Triton-100),上海凌峰化学试剂有限公司。以上试剂均为分析纯。
1.2 仪器与设备
FA1204电子分析天平,常州市幸运电子设备有限公司;Color Quest XE色差仪,美国Hunter Lab公司;TU-1900紫外分光光度计,北京普析通用仪器;CHT210R台式冷冻离心机,湖南湘仪仪器开发公司;GeminiSEM500扫描电镜,Zeiss公司;Plus C质构仪,厦门超技仪器设备有限公司;Spark 20M多功能酶标仪,Tecan Spark;4 ℃冰箱,海尔集团;-1 ℃冰箱,福意联设备。
1.3 实验方法
挑选大小粗细均一且无虫害的雷竹笋置于“苹果牌”保鲜袋(450 mm×340 mm)中进行密封贮存,每袋放置20~25根,每组10袋,分别放4 ℃和-1 ℃内贮存。0、3、6、9、12、18、24、30 d各取样1次测定指标,每组实验重复3次。
1.3.1 冰点测定
参照文钰等[6]和李盛男[10]的方法并略有修改,将雷竹笋剥壳后放入(-18±2) ℃的冰箱中,用多路温度测定仪对雷竹笋的顶部、中部、基部进行测定,每隔30 s记录1次温度,当温度下降至某一温度出现平台期即为雷竹笋的冰点温度,冰点温度重复测定3次。
1.3.2 质量损失率
采用称量法进行测定,计算公式(1)如下:
质量损失率![]()
(1)
式中:m0,贮存前雷竹笋的质量,g;m1,贮存后雷竹笋的质量,g。
1.3.3 色泽
利用色差仪进行测定,采集数据前用白板对色差仪进行校准,分别记录雷竹笋的L*、a*、b*值,并测定其衍生值ΔE,每组样品平行测定3次,结果取平均值。L0、a0、b0表示每个样品贮存第0天时的色差值,ΔE按以下公式(2)进行计算:
(2)
1.3.4 微观结构观察
参考WANG等[11]的研究方法并稍有修改,将雷竹笋样品切成宽高各1 cm的方形,分别加入3 mL体积分数3.5%戊二醛溶液、3 mL pH值为7.4的磷酸缓冲溶液固定48 h,固定结束用磷酸缓冲液进行冲洗,并在乙醇(体积分数为30%、50%、70%、85%和95%)的每个稀释度中脱水,最后以无水乙醇洗脱2次结束脱水过程。脱水后,将组织置于真空冷冻干燥箱中,干燥5 h,最后将样品在离子镀膜机中溅射镀金2 min后置于扫描电镜下进行观察。
1.3.5 硬度测定
参照郑炯等[12]的方法并有所改动,将笋切成长、宽、高各2 cm的规格,置于质构仪P36R探头下。参数设定如下:测前速度2 mm/s,测试速率1 mm/s;返回速度2 mm/s;触发力5 g;压缩程度70%;数据采集速率400 pps。每个样品测试重复4次,取平均值。
1.3.6 可溶性蛋白含量
参考申德省[13]的方法,采用考马斯亮蓝染色法。
1.3.7 丙二醛含量
参照LI等[14]的方法,采用硫代巴比妥酸法。
1.3.8 总酚含量
参照黄程前[15]的方法,采用福林酚-比色法。
1.3.9 木质素含量测定
参照WANG等[16]方法,采用乙酰溴比色法。
1.3.10 PAL酶活力测定
采用PAL酶试剂盒,其操作步骤按照试剂盒说明书进行操作。
1.3.11 POD酶活力测定
参照LI等[17]并稍有修改,称取1 g样品加入5 mL提取液(含有1 mmol PEG、40 g/L PVP和体积分数为1% Triton-100),低温提取后于比色皿中加入0.1 mL酶液、2 mL 0.025 mol/L愈创木酚、1 mL 0.5 mol/L 的H2O2,以蒸馏水为参比,在反应15 s时开始记录反应体系在波长470 nm处吸光度值,每隔30 s记录1次,共计5 min内吸光度的变化值。
1.4 数据处理
使用Excel 2019版本进行数据初步处理,SPSS Statistics 26软件进行独立样本t检验、同一处理间用AONVA检验差异显著性(P<0.05表示差异显著),采用Origin 2023软件绘图。结果均以平均值±标准差表示。
2 结果与分析
2.1 雷竹笋冰点测定
冰温是一个狭窄的地带温度,稍有下降就会对组织体造成冷伤,温度轻微上升就会明显影响贮存期。为避免笋体不同部位存在较大温差而引起的冷害现象,本研究对雷竹笋的顶部、中部、基部的冰点温度进行测定,如图1所示,雷竹笋顶部、中部、基部的冰点曲线平台期出现范围为-1.1~-1.5 ℃,即为雷竹笋的冰点温度范围。考虑到冰温贮存温度略高于实际冰点温度,所以本文将竹笋贮存在-1 ℃的冰温点和常用的4 ℃对照温度进行比较研究。
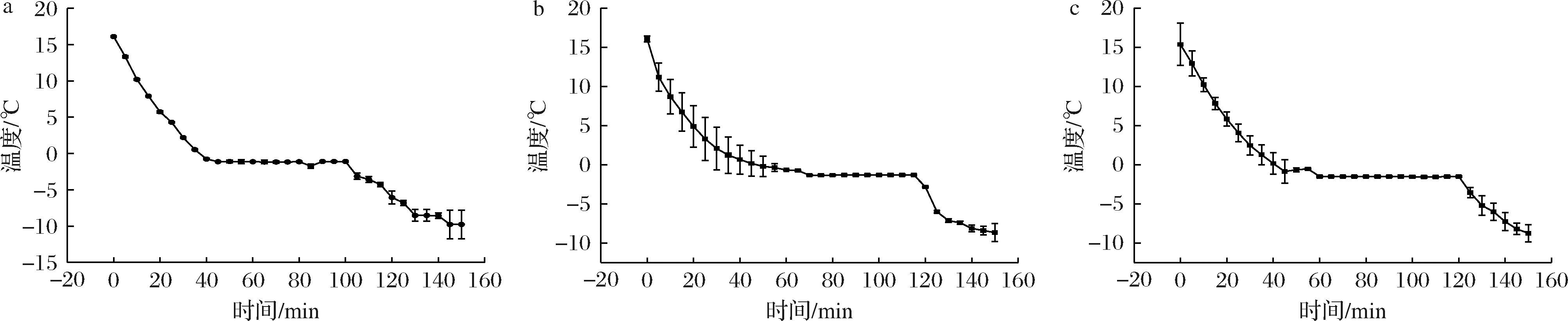
a-顶部;b-中部;c-基部
图1 雷竹笋顶部、中部、基部冰点温度测定曲线
Fig.1 Freezing point temperature measurement curves of the top, middle and base of Phyllostachys praecox shoots
2.2 雷竹笋贮存过程微观结构分析
图2扫描电镜图表明雷竹笋在第0天时细胞呈现蜂窝状且排列有序,在第6天时对照组出现细胞壁收缩;第12天时细胞壁塌陷、形态严重变形;而冰温细胞排列均匀,局部有轻微破裂但细胞壁结构完整。这可能是由于竹笋体在对照处理下新陈代谢较为活跃、氧化性损伤引起的干耗较大、水分蒸腾作用较强致使其内部结构随着贮存时间的延长失水而皱缩变形;而冰温条件下,一方面可能由于未达到果蔬的冰点,细胞内部结构不冻结,细胞结构及活性不会被破坏;另一方面冰温能够更好的抑制纤维素酶、果胶甲酯酶和多聚半乳糖醛酸酶等细胞壁降解酶的活性,使细胞内高分子物质的网状空间结构和植物细胞紧密排布成蜂窝状结构以此锁住内部水分子,水分子的自由扩散受到一定程度的阻碍,从而使细胞壁较少膨胀,果胶层较少溶解,维持较好的细胞结构[18]。

a-放大倍数1 000×;b-放大倍数2 000×
图2 雷竹笋第0天与在4、-1 ℃贮存6、12 d的微观结构图
Fig.2 Microstructure of P. praecox shoots at day 0 and storage at 4 ℃ and -1 ℃ for 6 days and 12 days
2.3 雷竹笋贮存过程色泽变化
不同处理雷竹笋色泽变化如表1所示。在贮存前12 d对照组竹笋L值下降趋势较明显,a*值和b*值升高较快,在贮存18 d,对照组L*值下降了36.97%,a*和b*值分别升高了77.29%、15.59%。这表明雷竹笋在贮存过程中随着时间的延长颜色逐渐变暗,此时雷竹笋色泽已为褐色且外观品质不可接受。这可能是由于竹笋采后产生的切口损伤暴露在空气中催化了多酚氧化酶的活性从而加速了竹笋褐变的速度[19]。冰温处理组色泽L*值变化趋势较慢,贮存24 d后其L*值仅下降15.62%,且色差ΔE显著低于对照组。由总酚含量趋势图(图4-b)可以推测出,在冰温条件下总酚含量下降缓慢,这可能与冰温抑制了酚类物质参与酶促褐变的过程有关,从而减少了褐色醌类聚合物的形成;且冰温条件下能通过抑制乙烯的生成来延缓衰老、维持色泽[20]。
表1 雷竹笋在4和-1 ℃贮存条件下L*、a*、b*、ΔE值的变化
Table 1 Changes in L*, a*, b*, and ΔE values of P. praecox shoots under storage conditions of 4 and -1 ℃
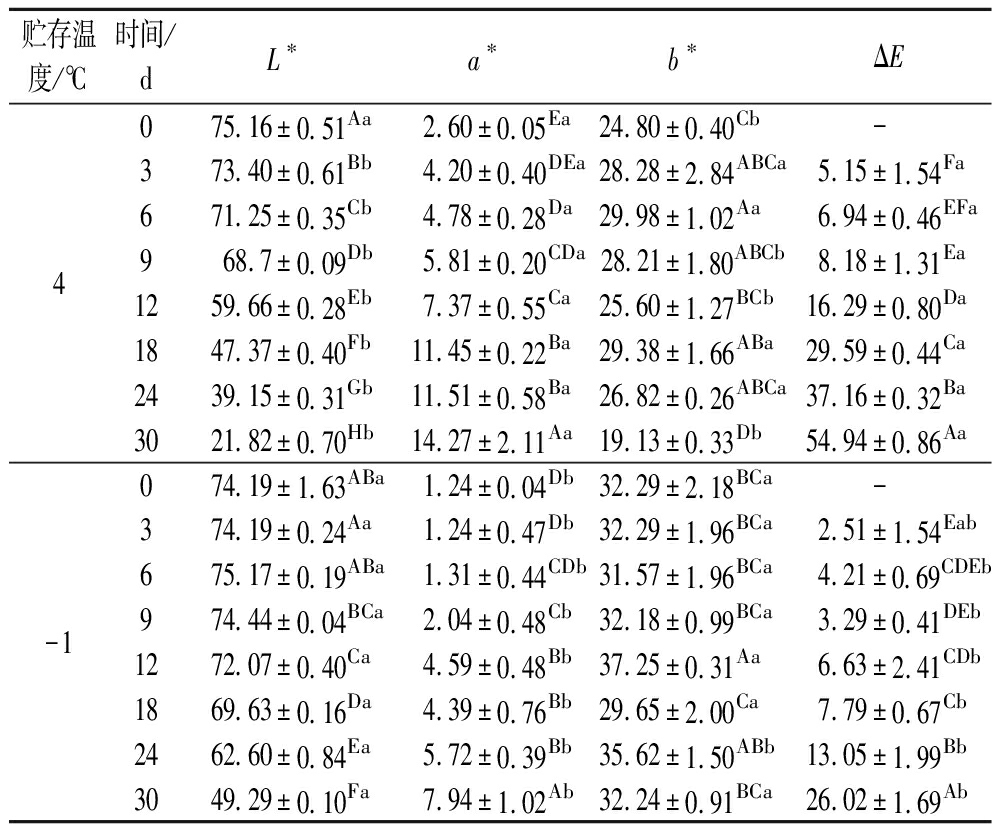
贮存温度/℃时间/dL∗a∗b∗ΔE4075.16±0.51Aa2.60±0.05Ea24.80±0.40Cb-373.40±0.61Bb4.20±0.40DEa28.28±2.84ABCa5.15±1.54Fa671.25±0.35Cb4.78±0.28Da29.98±1.02Aa6.94±0.46EFa968.7±0.09Db5.81±0.20CDa28.21±1.80ABCb8.18±1.31Ea1259.66±0.28Eb7.37±0.55Ca25.60±1.27BCb16.29±0.80Da1847.37±0.40Fb11.45±0.22Ba29.38±1.66ABa29.59±0.44Ca2439.15±0.31Gb11.51±0.58Ba26.82±0.26ABCa37.16±0.32Ba3021.82±0.70Hb14.27±2.11Aa19.13±0.33Db54.94±0.86Aa-1074.19±1.63ABa1.24±0.04Db32.29±2.18BCa-374.19±0.24Aa1.24±0.47Db32.29±1.96BCa2.51±1.54Eab675.17±0.19ABa1.31±0.44CDb31.57±1.96BCa4.21±0.69CDEb974.44±0.04BCa2.04±0.48Cb32.18±0.99BCa3.29±0.41DEb1272.07±0.40Ca4.59±0.48Bb37.25±0.31Aa6.63±2.41CDb1869.63±0.16Da4.39±0.76Bb29.65±2.00Ca7.79±0.67Cb2462.60±0.84Ea5.72±0.39Bb35.62±1.50ABb13.05±1.99Bb3049.29±0.10Fa7.94±1.02Ab32.24±0.91BCa26.02±1.69Ab
注:A~G分别表同一处理不同天数具有显著性差异;其中a~d表示不同处理同一天具有显著性差异;P<0.05。
2.4 雷竹笋贮存过程中质量、硬度、可溶性蛋白、丙二醛含量的变化
质量损失率是用来表征果蔬呼吸作用强度的参数。由图3-a得出对照组和冰温组的质量损失率均随着贮存时间的增加整体呈现上升趋势,并且冰温组的质量损失率始终低于对照组。这种现象可能是由于竹笋进行呼吸蒸腾作用,其中水分作为营养物质被消耗导致其质量损失率增加;在冰温条件下,竹笋内部呈现蜂窝状锁住水分减少了水分流失从而质量损失率低于对照组,这与微观结构的测定结果一致。贮存天数在18 d之后,2组的质量损失率继续升高,可能在贮存后期竹笋品质劣变产生了微生物呼吸致使质量损失大幅度增加,但第30天冰温组的质量损失率相对于对照组低46.76%,可能是冰温能有效抑制竹笋体的呼吸作用减缓了其腐败变质的过程。

a-质量损失率;b-硬度;c-可溶性蛋白含量;d-丙二醛含量
图3 雷竹笋在4 ℃和-1 ℃贮存条件下质量损失率、硬度、可溶性蛋白含量、丙二醛含量的变化
Fig.3 Changes in weight loss rate, hardness, soluble protein content and malondialdehyde content of P. praecox shoots under storage conditions of 4 ℃ and -1 ℃
果实硬度是评价果蔬耐贮存性的重要物理品质参数。但与一般果蔬不同的是,笋在贮存过程中由于其呼吸作用及木质化程度的增加会使笋体硬化,从图3-b可以看出对照和冰温条件下的硬度都呈现先增加后下降的趋势,但冰温组一直低于对照组。在贮存12 d后2组的硬度出现下降趋势,这是由于笋体组织的细胞壁代谢和纤维化会增加水分迁移,降低细胞持水能力导致水分流失,且雷竹笋的细胞壁多糖可能受到破坏,导致雷竹笋软化,硬度降低[21]。冰温条件下硬度上升趋势较为缓慢,可能是由于在冰温条件下雷竹笋细胞壁降解减慢或抑制所致,泡孔结构得到了更好的保持。相关性热图(图6)中表明木质素与硬度呈中度正相关,与硬度结果趋势相对应的是,2组处理的木质素含量(图4-a)在贮存前12 d呈现大幅增加,在后期硬度下降时2组木质素含量增加趋于平缓,且冰温组处理的木质素含量始终低于对照组。

a-木质素含量;b-总酚含量;c-PAL活力;d-POD活力
图4 雷竹笋在4 ℃和-1 ℃贮存条件下木质素含量、总酚含量、PAL活力、POD活力的变化
Fig.4 Changes in lignin content, total phenol content, PAL activity and POD activity of P. praecox shoots under storage conditions of 4 ℃ and -1 ℃
可溶性蛋白含量是评价雷竹笋营养品质的关键指标,与果蔬的成熟衰老有密切关系[22]。从图3-c可以看出对照条件和冰温条件可溶性蛋白质含量都呈现一定程度的下降趋势。其中冰温处理相对对照条件来说其可溶性蛋白含量水平较高。在贮存30 d,相较贮存初始可溶性蛋白含量,对照条件下可溶蛋白质含量下降了85.20%,冰温条件仅下降了36.28%,这是由于在冰温条件下,可溶性蛋白以网状结构存在,限制水分子移动,使笋体处于休眠状态,新陈代谢活动较低,从而达到减缓笋体可溶性蛋白含量降低的效果[23]。
竹笋在采收后会受到来自外界的各种胁迫其内部会产生一些活性氧(reactive oxygen species,ROS)等有害物质,使果蔬受到氧化性损伤导致膜脂过氧化,丙二醛就是该反应的最终产物[24]。图4-d中在贮存过程中对照组和冰温组都表现出丙二醛积累,冰温组的积累量始终低于对照组。研究表明在果蔬体内存在抗坏血酸-谷胱甘肽循环系统,其中抗坏血酸和谷胱甘肽都是重要抗氧化剂,能直接清除由ROS造成的氧化性损伤,冰温组温度低于对照组温度,在该条件下更好维持抗坏血酸含量,从而增强其抗氧化能力维持ROS代谢平衡,减缓了丙二醛累积,这与马齿苋对低温胁迫的生理响应及耐受性中的研究一致[25]。
2.5 雷竹笋贮存过程中木质素、总酚、苯丙氨酸解氨酶、过氧化物酶含量的变化
竹笋中木质素是以苯丙氨酸为前体物质经过酶促反应转化为木质素单体(对香豆醇、芥子醇、松柏醇等),这些中间产物在PAL、POD作用下发生莽草酸-苯丙烷酶促反应所形成。木质化的具体表现为硬度增加、木质素含量增加、营养成分流失、色泽变褐[26]。由图4-a可以看出2组木质素都是随着贮存时间的延长呈现上升趋势,具有显著性差异(P<0.05);但冰温组显著抑制木质素的累积,在30 d冰温组木质素含量比对照组低31.76%,结合冰温组能够延缓总酚含量的降低和抑制PAL、POD活性,即参与木质素合成途径的前体物较少、催化木质素合成的速度较慢,所以冰温组的木质素累积量低于对照组,即表明冰温处理能够减缓木质素的合成量从而达到延缓雷竹笋木质化的目的。
总酚含量与植物体褐变程度成正比,另外有研究表明总酚也可以直接参与木质素的合成[27]。由图4-b可以看出,2组处理的总酚含量都呈现下降趋势,这是由于笋体在贮存过程中总酚参与了笋体木质化和表面褐变的过程,对照组总酚含量较低且木质素含量较高、色泽下降较快,说明色泽、总酚含量、木质素含量三者之间存在关联性[28]。冰温条件下总酚含量下降缓慢,且果蔬中的总酚具有抗氧化、抵抗外界胁迫的作用,即冰温处理条件下雷竹笋抗氧化能力比较强,这可能也是在冰温条件下雷竹笋木质素含量上升较缓的原因之一[29]。
PAL是参与苯丙烷类代谢途径第一步反应的关键酶,POD是调控木质素形成的限速酶,其二者活性的变化反映竹笋木质化的速率[30]。由图4-c可知,对照组和冰温组的PAL活力呈现先上升后下降,这是由于新鲜植物体中PAL的活性在最初会呈现一个上升趋势,但当植物体在寒冷、干旱、水涝、高温、低温等各胁迫环境下,植物体会进行代谢,产生一些肉桂酸、富马酸等次级代谢产物,这些次级产物的积累反过来抑制PAL的活力使其下降[16]。对照组显著高于冰温组,在第9天对照组PAL活力值达到了峰值6.29 U/g,表明冰温组相较于对照组而言能进一步抑制酶的活力。
POD活力的增加可以加速木质素合成的初始物质苯丙素的氧化从而使木质素累积,对照组和冰温组的酶活力在贮存前期都增加,后期下降,对照组高于冰温组且具有显著性差异(P<0.05),在贮存前期随着贮存时间增加,竹笋发生木质化,其POD活力增加;后期由于竹笋内部合成了乙烯致使其老化,生命体活跃度低,其酶活力下降[31-32]。在冰温条件下能起到减缓竹笋的呼吸速率抑制乙烯的量产生,使酶的活力降低,从而起到延缓木质化的作用。
2.6 主成分分析、相关性分析
为了进一步探究对照组和冰温组对竹笋贮存品质的影响,通过主成分分析将贮存末期30 d不同指标进行可视化和量化得出成分分析图(图5)。
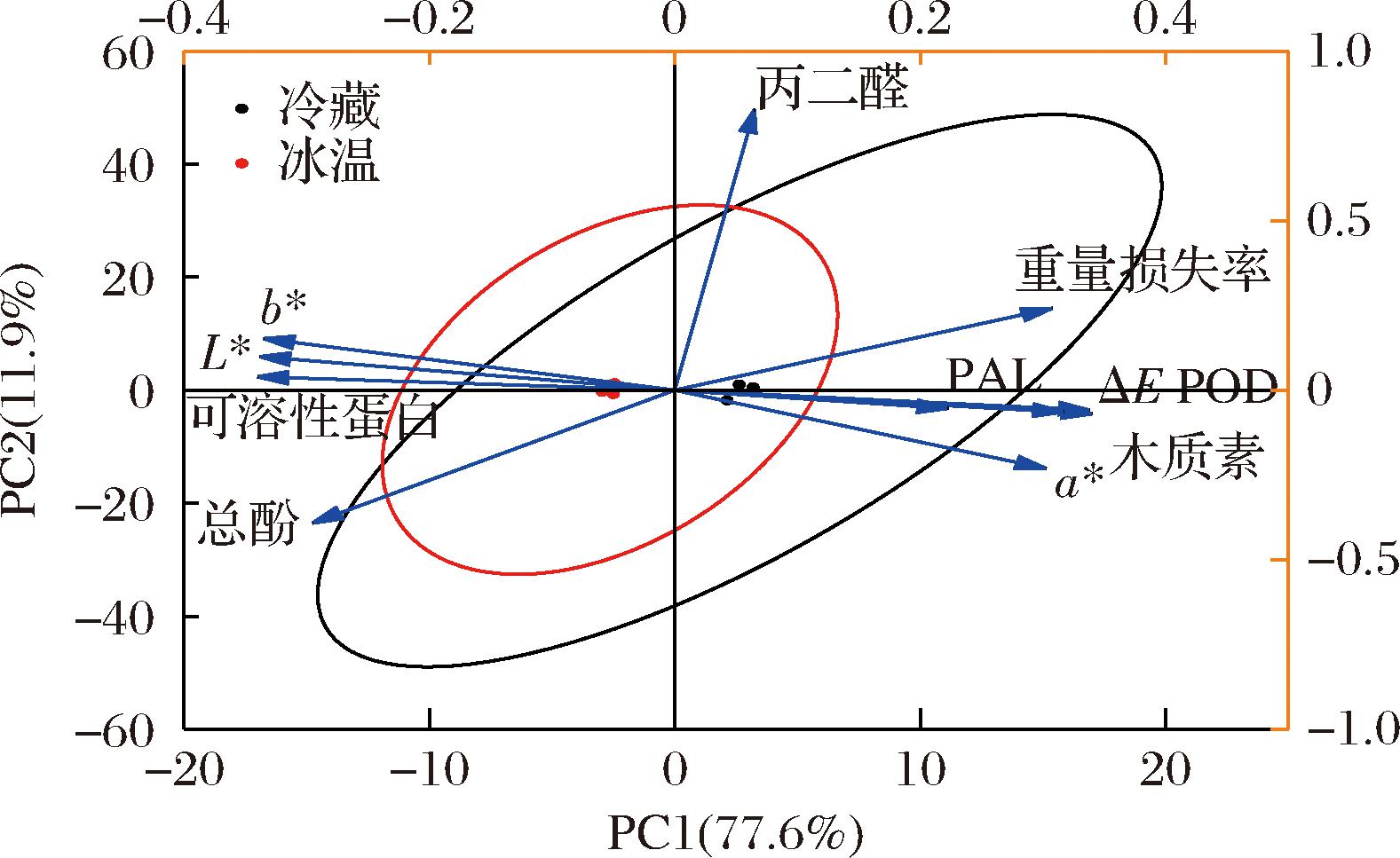
图5 雷竹笋在4 ℃和-1 ℃条件下主成分分析图
Fig.5 Principal component analysis diagram of P. praecox shoots under storage conditions of 4 ℃ and -1 ℃
如图5所示,前2个主成分累计贡献率为89.5%,从11个指标中提取出2个主成分,质量损失率、a*值、ΔE值、丙二醛、POD、PAL、木质素在第1主成分正坐标轴处具有较高载荷,说明第1主成分反应了这8个指标信息;可溶性蛋白在第2主成分有较高载荷,从主成分分析中能够反映不同温度对竹笋品质保鲜稳定性的影响,以-1 ℃贮存组的置信圈最窄小,表明在冰温条件下各保鲜指标在贮存期间变化最小。因此,从主成分分析图中可见竹笋品质保鲜效果冰温组优于对照组,与微冻对蚕豆籽粒保鲜效果一致[33]。
由图6相关性热图分析,对照组和冰温组木质素含量与质量损失率、硬度、ΔE、POD、丙二醛具有相关性,且结合上述主成分分析图POD、ΔE、木质素四者夹角最小趋于一致,说明表明以上指标与木质素累积量密切相关[34]。与上面所述:硬度增加木质化程度增强、POD是合成木质素最后一步关键酶,其活性越高,形成木质素含量越高相一致[35-36]。总酚、PAL活性与木质素含量呈负相关,由于在贮存期总酚向木质素发生了转化,所以总酚含量减少木质素含量增加;PAL虽是木质素合成途径的起始酶,但有研究表明PAL活性的增加不一定导致木质素合成的增加,苯丙醇途径具有网格状结构,通过该途径的通量受转录因子、酶表达模式、莽草酯中间体、蛋白质复合物形成、酶抑制途径中间体以及ATP等多方面调控[27]。
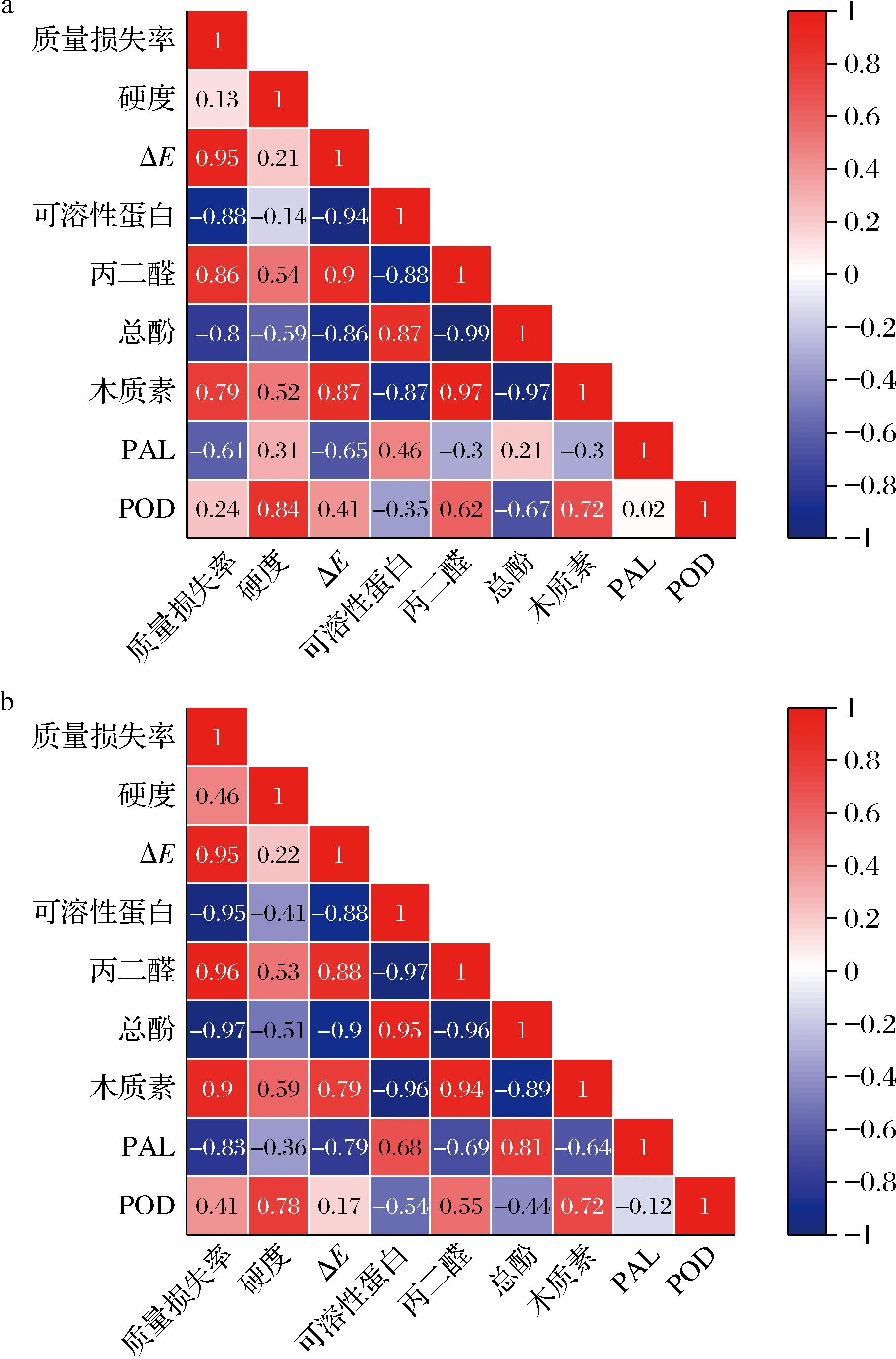
a-4 ℃;b--1 ℃
图6 雷竹笋在4 ℃和-1 ℃贮存条件下品质指标之间相关性热图
Fig.6 Correlation heat map of quality indexes of P. praecox shoots under storage conditions of 4 ℃ and -1 ℃
3 结论
本研究在测定雷竹笋不同部位冰点温度的基础上,选择-1 ℃作为雷竹笋贮存温度,并采用精准控温技术研究雷竹笋贮存品质变化规律及木质化程度。在该贮存温度下,雷竹笋不仅免受冷害保持果蔬原有的外观色泽、内部组织形态、营养品质,且在贮存末期,雷竹笋木质素含量比对照组低31.76%。由相关性热图分析表明,木质素含量与可溶性蛋白和总酚含量呈负相关,与质量损失率、丙二醛、色差、POD呈正相关。冰温处理能延缓可溶性蛋白含量和总酚含量的下降,从而减少参与木质素合成途径、酶促褐变的前体物质和底物,实现维持色泽,抑制木质化的效果。可溶性蛋白具有提高雷竹笋抵抗外界胁迫能力和保护细胞结构的作用;总酚作为抗氧化剂也能增强雷竹笋抗氧化能力,因此二者都能降低因细胞氧化性损伤而引起的丙二醛含量的累积,这与冰温处理组呈现完整排列有序的细胞壁结构的结果相一致;此外冰温组相较于对照组POD活力较低,从而限制了催化木质素最终合成的速度。由主成分分析结果表明,冰温组形成的置信椭圆较小,即在此处理条件下雷竹笋品质变化较小。综上所述,冰温贮存能实现延缓雷竹笋木质化、维持其品质特性的保鲜效果,从而打破季节限制,延长市场供应期;这也有助于提升竹笋产品附加值和市场竞争力,为农民带来更多经济收益,促进农业经济发展。
[1] LIU D J, WANG F, XIAO G S, et al.Effects of cold plasma treatment on maintaining the quality of fresh-cut bamboo shoots during shelf-life storage[J].LWT, 2023, 185:115151.
[2] XIAO Y N, XIE L H, LI Y L, et al.Impact of low temperature on the chemical profile of sweet corn kernels during post-harvest storage[J].Food Chemistry, 2024, 431:137079.
[3] LIU Y D, TANG N, LIN D B, et al.Integration of multi-omics analyses highlights the secondary metabolism response of tomato fruit to low temperature storage[J].Food Research International, 2023, 173:113316.
[4] 陈锦辉, 漆欣, 易阳, 等.冰温贮藏延缓莲藕的品质劣变[J].现代食品科技, 2022, 38(6):136-144.
CHEN J H, QI X, YI Y, et al.Delaying the quality deterioration of lotus roots by freezing storage[J].Modern Food Science and Technology, 2022, 38(6):136-144.
[5] 赵迎丽, 张微, 王亮, 等.冰温贮藏对玉露香梨果实挥发性有机物的影响[J].食品研究与开发, 2022, 43(9):15-22.
ZHAO Y L, ZHANG W, WANG L, et al.Effect of ice-temperature storage on volatile organic compounds of Yuluxiang pears[J].Food Research and Development, 2022, 43(9):15-22.
[6] 文钰, 杨莉玲, 刘岚, 等.近冰温贮藏对西梅的采后品质及活性氧代谢的影响[J].食品与发酵工业, 2024, 50(11):270-276.
WEN Y, YANG L L, LIU L, et al.Effects of near-freezing temperature storage on postharvest quality and reactive oxygen species metabolism of prunes[J].Food and Fermentation Industries, 2024, 50(11):270-276.
[7] 李亚玲. 近冰温贮藏对小白杏果实采后冷害的控制[D].乌鲁木齐:新疆农业大学, 2020.
LI Y L.Control of postharvest chilling injury of ‘Xiao Bai’ apricot fruits by storage at near-freezing point[D].Urumqi:Xinjiang Agricultural University, 2020.
[8] LI C T, SUO J W, XUAN L L, et al.Bamboo shoot-lignification delay by melatonin during low temperature storage[J].Postharvest Biology and Technology, 2019, 156:110933.
[9] LIU D J, WANG F, BRENNAN C, et al.Combined melatonin and UV-C treatment maintains the quality of fresh-cut bamboo shoots during storage by altering microbial diversity and metabolites[J].Postharvest Biology and Technology, 2023, 200:112327.
[10] 李盛男. 水果萝卜超冰温保鲜贮藏实验及模拟研究[D].哈尔滨:哈尔滨商业大学, 2023.
LI S N.Experimental and simulation study on ultra-freezing storage of fruit radish[D].Harbin:Harbin University of Commerce, 2023.
[11] WANG W J, LI Y, LI F H, et al.Polypropylene crisper and 1-MCP delay the softening, lignification and transcription levels of related enzyme genes of golden needle mushrooms (Flammulina velutipes)[J].Journal of Integrative Agriculture, 2022, 21(1):249-260.
[12] 郑炯, 宋家芯, 陈光静, 等.腌制加工对麻竹笋质构和微观结构及色泽的影响[J].食品科学, 2014, 35(1):85-88.
ZHENG J, SONG J X, CHEN G J, et al.Effects of pickling on the texture, microstructure and color of bamboo shoots(Dendrocalamus latiflorus)[J].Food Science, 2014, 35(1):85-88.
[13] 申德省. 鲜切雷竹笋木质化和褐变的控制研究[D].杭州:浙江工商大学, 2015.
SHEN D X.Study on control of lignification and browning of freshly cut bamboo shoots[D].Hangzhou:Zhejiang Gongshang University, 2015.
[14] LI L, LI C B, SUN J, et al.Synergistic effects of ultraviolet light irradiation and high-oxygen modified atmosphere packaging on physiological quality, microbial growth and lignification metabolism of fresh-cut carrots[J].Postharvest Biology and Technology, 2021, 173:111365.
[15] 黄程前. 鲜切毛竹笋生理生化变化及保鲜技术研究[D].杭州:浙江农林大学, 2015.
Huang C Q.Study on Physiological and biochemical changes and preservation technology of freshly cut hairy bamboo shoots[D].Hangzhou:Zhejiang A &F University, 2015.
[16] WANG J X, JIANG J, WANG J, et al.The influence of gamma irradiation on the storage quality of bamboo shoots[J].Radiation Physics and Chemistry, 2019, 159:124-130.
[17] LI X L, XING Y G, SHUI Y R, et al.Quality of bamboo shoots during storage as affected by high hydrostatic pressure processing[J].International Journal of Food Properties, 2021, 24(1):656-676.
[18] ELFALLEH W, GUO L, HE S D, et al.Characteristics of cell wall structure of green beans during controlled freezing point storage[J].International Journal of Food Properties, 2015, 18(8):1756-1772.
[19] LI R M, ROSADO-SOUZA L, SAMPATHKUMAR A, et al.The relationship between cell wall and postharvest physiological deterioration of fresh produce[J].Plant Physiology and Biochemistry, 2024, 210:108568.
[20] LI Y L, ZHAO Y T, ZHANG Z C, et al.Near-freezing temperature storage improves shelf-life and suppresses chilling injury in postharvest apricot fruit (Prunus armeniaca L.) by regulating cell wall metabolism[J].Food Chemistry, 2022, 387:132921.
[21] HU X X, SUN H, YANG X D, et al.Potential use of atmospheric cold plasma for postharvest preservation of blueberries[J].Postharvest Biology and Technology, 2021, 179:111564.
[22] 王娟紫, 王春芳, 乔勇进, 等.近冰温贮藏对鲜糯玉米采后品质的影响[J].食品工业科技, 2023, 44(14):336-345.
WANG J Z, WANG C F, QIAO Y J, et al.Effect of near-freezing temperature storage on the quality of postharvest fresh waxy corn[J].Science and Technology of Food Industry, 2023, 44(14):336-345.
[23] 徐艳艳. 苹果冰点温度贮藏品质及质构变化研究[D].福州:福建农林大学,2014.
XU Y Y.Study on the storage quality and texture of apple in freezing-point storage[D].Fuzhou:Fujian Agriculture and Forestry University 2014.
[24] WU Z, FAN G, WU C, et al.Dielectric barrier discharge plasma delayed the textural hardening of bamboo shoots by regulating cell wall metabolism[J].Scientia Horticulturae, 2023, 321:11.
[25] YE J T, YANG J Y, ZHENG R, et al.Physiological response and tolerance of Sesuvium portulacastrum L.to low temperature stress[J].Physiology and Molecular Biology of Plants, 2024, 30(2):269-285.
[26] 董春凤, 赵一鹤.竹笋采后木质化研究进展[J].安徽农业科学, 2020, 48(13):16-20.
DONG C F, ZHAO Y H.Research progress on post-harvest lignification of bamboo shoots[J].Journal of Anhui Agricultural Sciences, 2020, 48(13):16-20.
[27] CHEN X N, REN L P, LI M L, et al.Effects of clove essential oil and eugenol on quality and browning control of fresh-cut lettuce[J].Food Chemistry, 2017, 214:432-439.
[28] YANG B Q, HAN Y C, WU W J, et al.Impact of melatonin application on lignification in water bamboo shoot during storage[J].Food Chemistry:X, 2022, 13:100254.
[29] ALI A, YEOH W K, FORNEY C, et al.Advances in postharvest technologies to extend the storage life of minimally processed fruits and vegetables[J].Critical Reviews in Food Science and Nutrition, 2018, 58(15):2632-2649.
[30] WANG D, CHEN Q Y, CHEN W W, et al.Melatonin treatment maintains quality and delays lignification in loquat fruit during cold storage[J].Scientia Horticulturae, 2021, 284:110126.
[31] YU W Q, MA P H, SHENG J P, et al.Postharvest fruit quality of tomatoes influenced by an ethylene signaling component during long-term cold storage[J].Food Chemistry, 2023, 422:136087.
[32] LUO Z S, XU X L, CAI Z Z, et al.Effects of ethylene and 1-methylcyclopropene (1-MCP) on lignification of postharvest bamboo shoot[J].Food Chemistry, 2007, 105(2):521-527.
[33] 李蝶, 李海燕, 钟士宏, 等.微冻对蚕豆籽粒保鲜效果及成熟衰老的影响[J].食品科学, 2025,46(1):149-157.
LI D, LI H Y, ZHONG S H, et al.Effect of superchilling on preservation,ripening and senescence of broad bean seeds[J]. Food Science,2025,46(1):149-157.
[34] 梁钻好, 林华兴, 陈海强, 等.贮藏温度对鲜毛豆贮藏期品质的影响[J].食品工业科技, 2023, 44(19):382-389.
LIANG Z H, LIN H X, CHEN H Q, et al.Influence of storage temperature on the qualities of fresh soybeans during storage[J].Science and Technology of Food Industry, 2023, 44(19):382-389.
[35] WANG C L, DU J M, HOU D H, et al.Quality retention and delay postharvest senescence of figs (Ficus carica L.) using 1-methylcyclopropene and modified atmosphere packaging during cold storage[J].Food Bioscience, 2023, 53:102748.
[36] JIN M J, JIAO J Q, ZHAO Q X, et al.Dose effect of exogenous abscisic acid on controlling lignification of postharvest kiwifruit (Actinidia chinensis cv.Hongyang)[J].Food Control, 2021, 124:107911.