联合国粮食及农业组织(Food and Agriculture Organization of the United Nations,FAO)报告称,在食品供应链中,每年有超过13亿t的粮食损失或浪费,而这一损失主要与微生物污染有关,微生物污染可直接影响食品产品的感官特性、缩短产品保质期、增加食源性疾病的风险,尤其在非加工或最低限度加工食品如肉类、海鲜、蔬菜和水果等中尤为突出[1-2]。
近年来,通过加入植物精油(essential oils,EOs)制备活性生物基包装材料以延长易腐食品货架期逐渐成为研究热点[3]。有研究表明,加入花椒精油可显著降低玉米淀粉基薄膜的亲水性、提高薄膜的机械性能[4]。然而,EOs多为挥发性物质(酚类、烯类、醛类、醇类等化合物),易受空气、光照、湿度、温度和加工条件的影响,因此常利用脂质体、壳聚糖纳米粒子、环糊精、二氧化硅、固体脂质纳米粒子、纳米乳液、纳米纤维对EOs进行包封处理[5-6]。
其中,纳米乳液由于其优异的稳定性、可控和逐步释放、高生物相容性而被广泛应用于包封EOs[7]。与单独使用EOs相比,一方面,利用纳米乳液包封可提高EOs的可溶性和分散性,同时达到淀粉基薄膜中EOs的可控释放效果[8];另一方面,纳米乳液可提高EOs在食品体系中病原区域的分散,通过增加EOs与细菌细胞膜的接触面积和传递效率来提高EOs的生物利用度和生物活性;另外,纳米乳液还可延长EOs的持续释放行为,进一步延长了微生物灭活的可持续时间[9]。目前,纳米乳液的制备方法可分为低能耗法(自发乳化、膜乳化和相转变等)和高能耗法(超声、微流化、高速剪切和高压均质等),且常添加表面活性剂(如吐温-80)用以减少水相和EOs之间的界面张力,以提高纳米乳液的稳定性[10-13]。
淀粉是公认的安全无毒、可降解和可再生的天然高分子材料,具有良好的吸附性能。因此,以纳米淀粉为载体负载精油制备活性纳米乳液以提高精油稳定性,在活性食品包装领域前景广阔[14-15]。研究表明,辛烯基琥珀酸淀粉钠(sodium starch octenyl succinate,OSA)可与肉桂精油形成粒径为300~600 nm的纳米乳液,可有效提高普鲁兰糖基薄膜的断裂伸长率和抑菌性能[16];同时,OSA与丁香酚、香芹酚制备的纳米乳液提高了消化稳定性、生物可获得性和对鼠伤害沙门氏菌属的抑制作用[17]。
然而,目前淀粉基纳米乳液对EOs的负载常借助水溶性高的改性淀粉,而对原淀粉在纳米乳液中的应用研究较少。本团队成员前期已通过酶解联合高压微射流技术制备稳定性良好的淀粉/百里酚纳米乳液(waxy starch/thymol nanoemulsion,S-T-NE)[18-19],在此基础上本研究以普鲁兰糖为基体,添加S-T-NE制备活性食品包装薄膜,探讨添加S-T-NE前后薄膜多尺度结构和性能影响及对草莓滋味的影响,以期拓宽纳米淀粉基乳液在活性食品包装材料中的应用前景。
1 材料与方法
1.1 材料与仪器
蜡质玉米淀粉,东莞东美食有限公司;吐温-80试剂、无水乙醇,分析纯,国药集团化学试剂有限公司;普鲁兰糖、普鲁兰糖酶(2 000 U/g)、甘油、CaCl2、K2SO4、H2O2,上海阿拉丁生化科技股份有限公司。
MR Hei-Tec型磁力搅拌器,海道尔夫仪器设备有限公司;M-110EH30型动态高压微射流,美国Micro-fluidics有限公司;Zetasizer Nano-ZS90型纳米粒度与zeta电位分析仪,英国马尔文有限公司;NICOLET IS50型红外光谱仪,赛默飞世尔科技有限公司;DX-27 mini型X-射线衍射(X-ray diffraction,XRD)仪,丹东浩元精密机械科技有限公司;TGA8000型热重分析仪,珀金埃尔默股份有限公司;SA402B滋味分析系统,日本insent公司。
1.2 实验方法
1.2.1 普鲁兰糖基纳米活性薄膜的制备
19-T-NE的制备:参考黄佳卉等[18-19]的实验方法制备淀粉/百里酚纳米乳液(10 mg/mL,S-T-NE)。将10 g蜡质玉米淀粉于100 mL蒸馏水充分分散,置于沸水浴中搅拌30 min充分糊化,后置于室温冷却至58 ℃,加入6 U/g普鲁兰酶酶解0.5 h进行脱支处理,酶解完成后置于沸水浴30 min灭活。将淀粉酶解液稀释至10 mg/mL,取适量样品并加入2 g百里酚、2.5%(体积分数)的无水乙醇和0.1%(体积分数)的吐温-80(总体积为500 mL),于室温下磁力搅拌30 min,转速600 r/min,然后经动态高压微射流处理(压力10 000 PSI、循环次数1次)制成S-T-NE。
普鲁兰糖基活性薄膜的制备:称取1 g普鲁兰糖溶于15 mL(25 mL,对照组)蒸馏水并磁力搅拌30 min(500 r/min),加入0.2 g甘油搅拌30 min,然后加入10 mL的S-T-NE继续搅拌30 min以充分分散,后静置去除气泡,最后将成膜液平铺于低密度聚乙烯培养皿上,并于35 ℃烘箱中干燥48 h至恒重。将干燥后的薄膜平衡24 h(25 ℃,RH=50%)后置于干燥器中储存备用,制备的薄膜分别以P-F(对照组)、P-F+S-T-NE(实验组)命名。
1.2.2 分子结构分析
取适量的薄膜放置于傅里叶变换红外光谱仪(Fourier transform infrared spectrometer,FTIR)的ATR附件上,分辨率4 cm-1,扫描范围4 000~400 cm-1,扫描次数为32次。
1.2.3 结晶结构分析
将薄膜裁剪成尺寸为1 cm2的正方形,将样品压实平整并放置于XRD仪的样品槽中,工作电压30 kV,电流为15 mA,测量范围2θ=10°~60°,扫描步长0.02°,扫描速度4 °/min。
1.2.4 断面形貌分析
将薄膜裁剪成尺寸为0.25 cm2的正方形,并用马克笔对边缘进行标记,置于液氮中进行自然脆断处理(未标记断面即为脆断面),将薄膜断面朝上固定在SEM样品台的导电胶上,喷金处理1 min,置于扫描电子显微镜中,在一定放大倍数条件下观察并且拍摄下具有特征清晰的薄膜断面形貌,工作电压为5 kV。
1.2.5 水蒸气透过率
首先使用数字测微计(精确至0.001 mm)测量薄膜的厚度,随机挑选薄膜周围4~5个位置进行厚度测量,并取其平均值即为薄膜厚度。将薄膜密封在内径25 mm、深度55 mm玻璃瓶的顶部,其中填充2 g无水CaCl2的称量瓶封严称重,置于装有饱和硫酸钾溶液的密闭容器中,干燥器置于25 ℃的培养箱中,保持水分蒸气压Δp(约3 168 Pa)不变,使系统成为一个恒压环境,放置16 h后测量玻璃瓶质量。计算如公式(1)所示:
(1)
式中:Δm,测试前后薄膜的质量变化,g;A,玻璃瓶口面积,cm2;t,测试时间,h;d,测试厚度,mm;Δp,薄膜之间的分压差,kPa。
1.2.6 热稳定性
将薄膜裁剪成尺寸为0.09 cm2的正方形,置于热重分析仪的坩埚中,测定温度30~600 ℃,升温速率10 ℃/min,氮气流速20 mL/min。
1.2.7 滋味分析
草莓预处理:将成熟度和大小相似的新鲜草莓随机分为2组,每组设置5个平行以保证样品充分满足测试需求。使用H2O2溶液(2.5%,质量分数)浸泡草莓2 min以清除表面灰尘、虫卵、枯叶等,于室温下通风干燥2 h,将干燥后的草莓表面喷涂一层成膜液后,将其置于室温下通风干燥2 h,然后将所有样品分别于4 ℃冰箱和(25±1) ℃下储存2、4、6和8 d,拍照并每隔2 d取1次样品进行滋味分析。
使用味觉分析系统-SA402B电子舌分别检测鲜味,咸味,苦味,酸味和涩味。精确取出1 g样品加入锥形瓶中,向瓶中加入50 mL蒸馏水,并超声处理30 min;然后将样品放入离心机,转速5 000 r/min,时长5 min,并过滤出上清液,将过滤后的上清液(35 mL)倒入味觉感应杯中进行测量,每个样品测定4次以获得平行值。
1.2.8 数据处理
实验均进行3次平行测定,所有数据采用IBM SPSS Statistics 27进行方差分析与邓肯多重检验表示组间数据的显著性差异,结果采用平均值±标准差的形式表示,并通过Origin 2018进行绘图。
2 结果与分析
2.1 形貌观察
图1为添加S-T-NE前后普鲁兰糖基薄膜断面的微观形貌。未添加S-T-NE时,P-F组薄膜断面呈现致密、光滑和均一的状态,这主要与普鲁兰糖分子紧密排列有关[20];添加S-T-NE后,P-F+S-T-NE组薄膜的断面粗糙度明显增加,出现不同尺寸的孔洞和凸起,甚至可观察到少量的聚集体结构(如图1方框和箭头所示)。在薄膜进行烘干/脆断过程中,少量的百里酚不可避免地从薄膜中逸散出来,促使薄膜内部形成孔隙结构;另一方面,加入S-T-NE后,S-T-NE与普鲁兰糖分子间作用力减弱普鲁兰糖分子内作用力,分子排列紧密度降低,促使薄膜形成褶皱甚至聚集结构。

a-P-F,×300;b-P-F+S-T-NE,×300;c-P-F, ×1 000;d-P-F+S-T-NE,×1 000
图1 加入S-T-NE前(P-F)后(P-F+S-T-NE)普鲁兰糖基薄膜的断面形貌
Fig.1 Fractured surface morphology of pullulan based films without (P-F)/with (P-F+S-T-NE) adding S-T-NE
2.2 分子结构分析
图2为百里酚以及添加S-T-NE前后普鲁兰糖基薄膜的红外光谱图。百里酚中在3 000~3 400 cm-1的吸收带为O—H的伸缩振动吸收,在2 957、2 923 cm-1(浅灰色区域)和1 621 cm-1(灰色区域)附近的吸收峰分别表征C—H、—CH3和—C![]() C—的伸缩振动;1 419~1 242 cm-1(深灰色区域)表征百里酚中—CH(CH3)2的伸缩振动[19]。普鲁兰糖基薄膜在3 000~3 600 cm-1表征O—H振动吸收峰,2 930 cm-1为甲基中C—H键的振动峰,1 645 cm-1附近为普鲁兰糖中C
C—的伸缩振动;1 419~1 242 cm-1(深灰色区域)表征百里酚中—CH(CH3)2的伸缩振动[19]。普鲁兰糖基薄膜在3 000~3 600 cm-1表征O—H振动吸收峰,2 930 cm-1为甲基中C—H键的振动峰,1 645 cm-1附近为普鲁兰糖中C![]() O(蓝色区域)的伸缩振动,1 148、1 078、995 cm-1及929 cm-1处为糖苷键中C—O键和醚键的伸缩振动[21]。由于纳米淀粉与普鲁兰糖均为多糖分子,导致添加S-T-NE前后,薄膜谱型未发生明显变化,表明没有新的共价键形成,因此,百里酚/纳米淀粉/普鲁兰糖间的相互作用主要为物理作用。
O(蓝色区域)的伸缩振动,1 148、1 078、995 cm-1及929 cm-1处为糖苷键中C—O键和醚键的伸缩振动[21]。由于纳米淀粉与普鲁兰糖均为多糖分子,导致添加S-T-NE前后,薄膜谱型未发生明显变化,表明没有新的共价键形成,因此,百里酚/纳米淀粉/普鲁兰糖间的相互作用主要为物理作用。
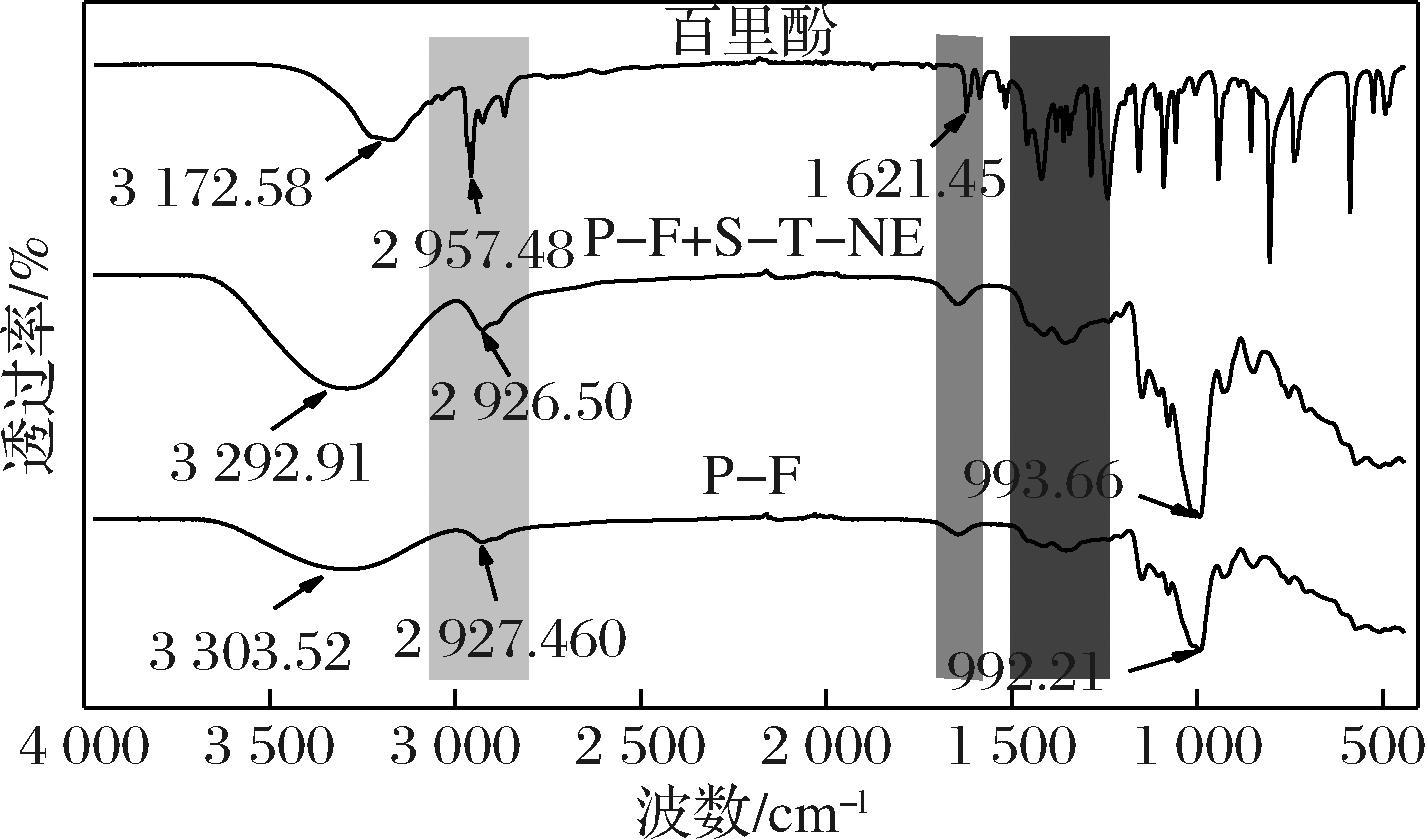
图2 加入S-T-NE前(P-F)后(P-F+S-T-NE)普鲁兰糖基薄膜的红外光谱图
Fig.2 FTIR spectra of pullulan based films without (P-F)/with (P-F+S-T-NE) adding S-T-NE
由图2可知,P-F+S-T-NE组薄膜在2 926 cm-1处(C—H键)的峰强较P-F组增加,同时羟基的振动吸收峰透过率明显增强,且二者均向低波数轻微移动,有研究表明,多酚的加入可使聚合物基体的羟基带发生位移[22]。因此,S-T-NE的加入促使百里酚/纳米淀粉与普鲁兰糖间形成新的分子间氢键,产生红移现象,而普鲁兰糖分子内氢键减弱,促使薄膜内部形成聚集结构(图1)。
2.3 结晶结构分析
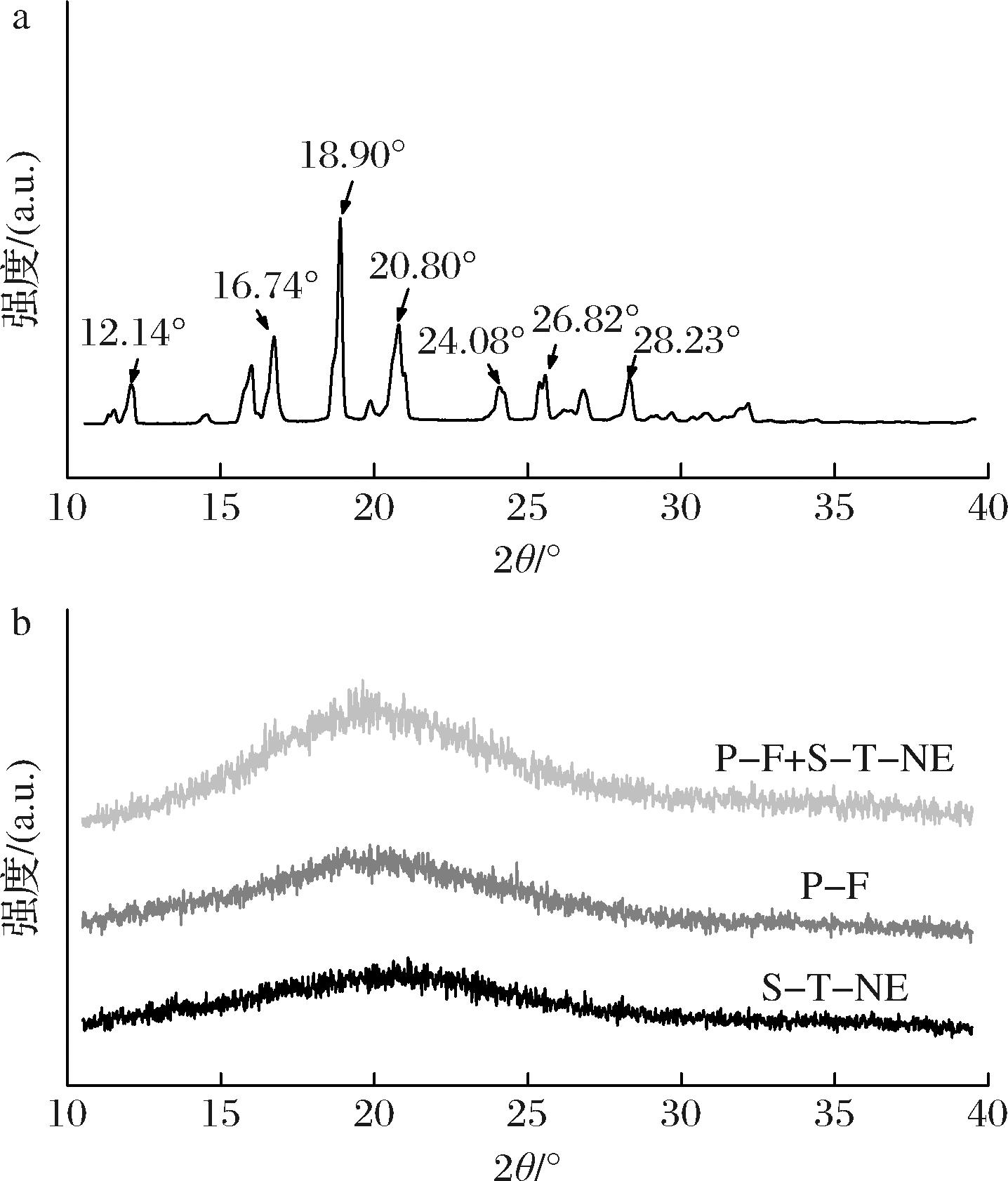
由图3-a可知,百里酚在2θ=12.14°、16.74°、18.90°、20.80°等处呈现明显尖锐的衍射峰;由图3-b可知,淀粉/百里酚纳米乳液(S-T-NE)呈现宽泛的衍射峰,在S-T-NE的制备过程中,淀粉首先经过糊化处理,促使淀粉颗粒中有序和无序态的淀粉分子间氢键断裂,导致淀粉结晶结构消失[18],而百里酚的加入未改变纳米淀粉的无定形态结构,故S-T-NE仍呈现无定形态;另外,图3-b中添加S-T-NE前后的普鲁兰糖基薄膜也均呈现宽泛的衍射峰,但加入P-F+S-T-NE组薄膜位于20°附近的宽泛衍射峰值强度明显增加,但并不改变薄膜的无定形结构。由FTIR结果可知,加入了S-T-NE后,一方面纳米淀粉/百里酚分子与普鲁兰糖分子间氢键作用增强,促使普鲁兰糖分子链发生重排;另一方面,淀粉纳米粒子在薄膜内部可形成插层或剥离形态,从而导致薄膜结晶结构发生变化,衍射峰强度增加[23]。
a-百里酚;b-普鲁兰糖基薄膜及纳米乳液
图3 百里酚[18]及添加S-T-NE前后普鲁兰糖基薄膜的X-射线衍射图谱
Fig.3 XRD data of thymol[18]and pulullan based film with/without S-T-NE
2.4 水蒸气透过率(water vapor permeability,WVP)
图4为加入S-T-NE前后普鲁兰糖基薄膜的厚度和WVP值变化。与P-F组相比,P-F+S-T-NE组薄膜厚度增加了0.015 mm,但变化十分微小。随着S-T-NE的加入,成膜液整个体系的溶质总量增加,淀粉纳米粒子与普鲁兰糖的比例增加,导致厚度轻微增加。此外,与P-F组相比,P-F+S-T-NE组薄膜的水蒸气透过率也略微升高,WVP值3.37×10-10 g/(m·s·Pa),(P-F)升高至6.39×10-10 g/(m·s·Pa),(P-F+S-T-NE)。这是因为加入S-T-NE后,淀粉纳米粒子/百里酚与普鲁兰糖分子间氢键作用增强,但普鲁兰糖分子内氢键作用减弱,薄膜内部形成缺陷(孔洞、聚集体,图1所示),导致薄膜致密度减弱、锁水能力减弱,促使水蒸气更容易渗透、WVP值增大[24]。
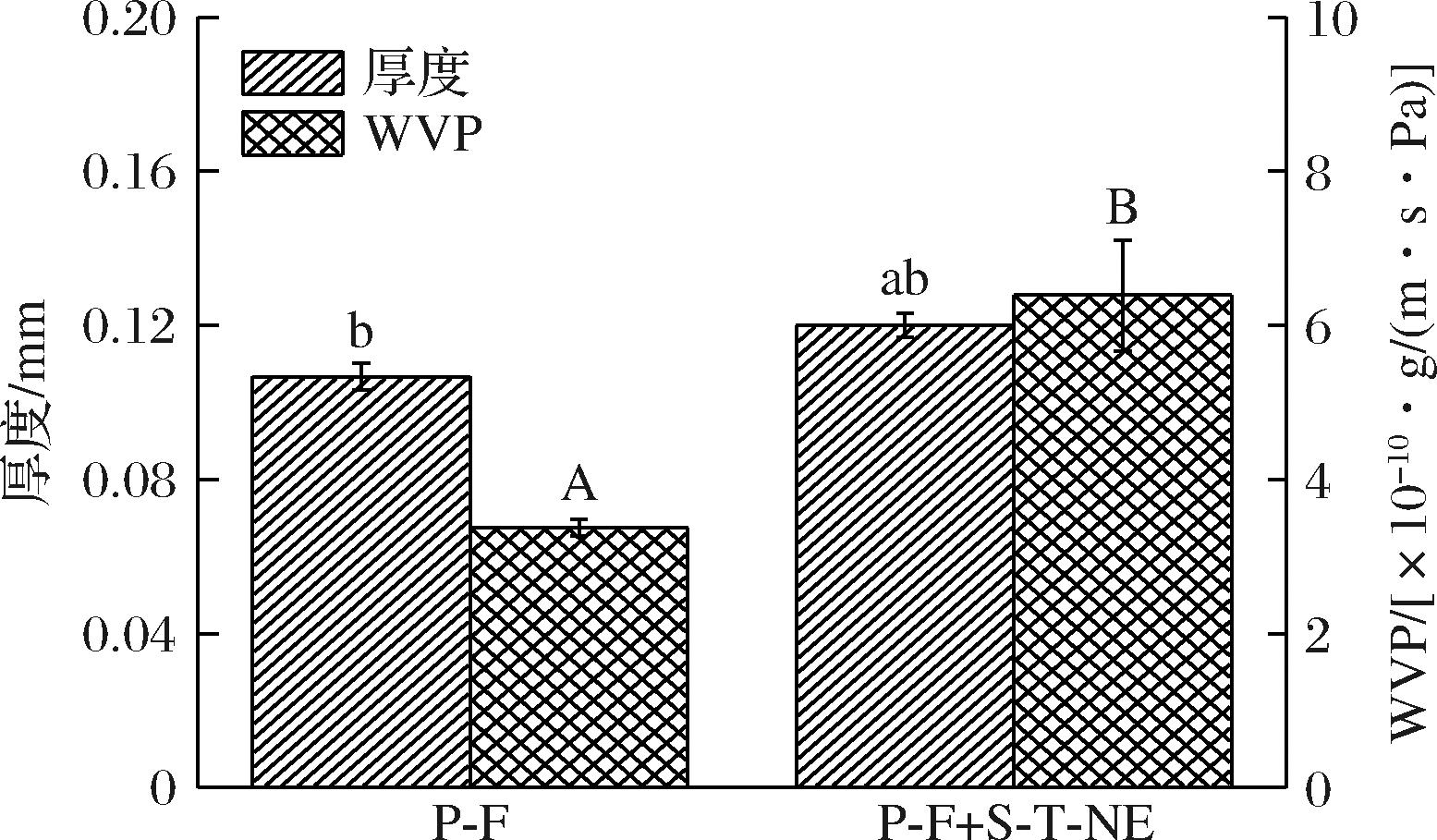
图4 添加S-T-NE前后普鲁兰糖基薄膜的水蒸气透过率
Fig.4 WVP values of pullulan based films with/without S-T-NE
注:不同小写字母表示厚度差异显著(P<0.05),不同大写字母表示WVP差异显著(P<0.05)。
2.5 热稳定性
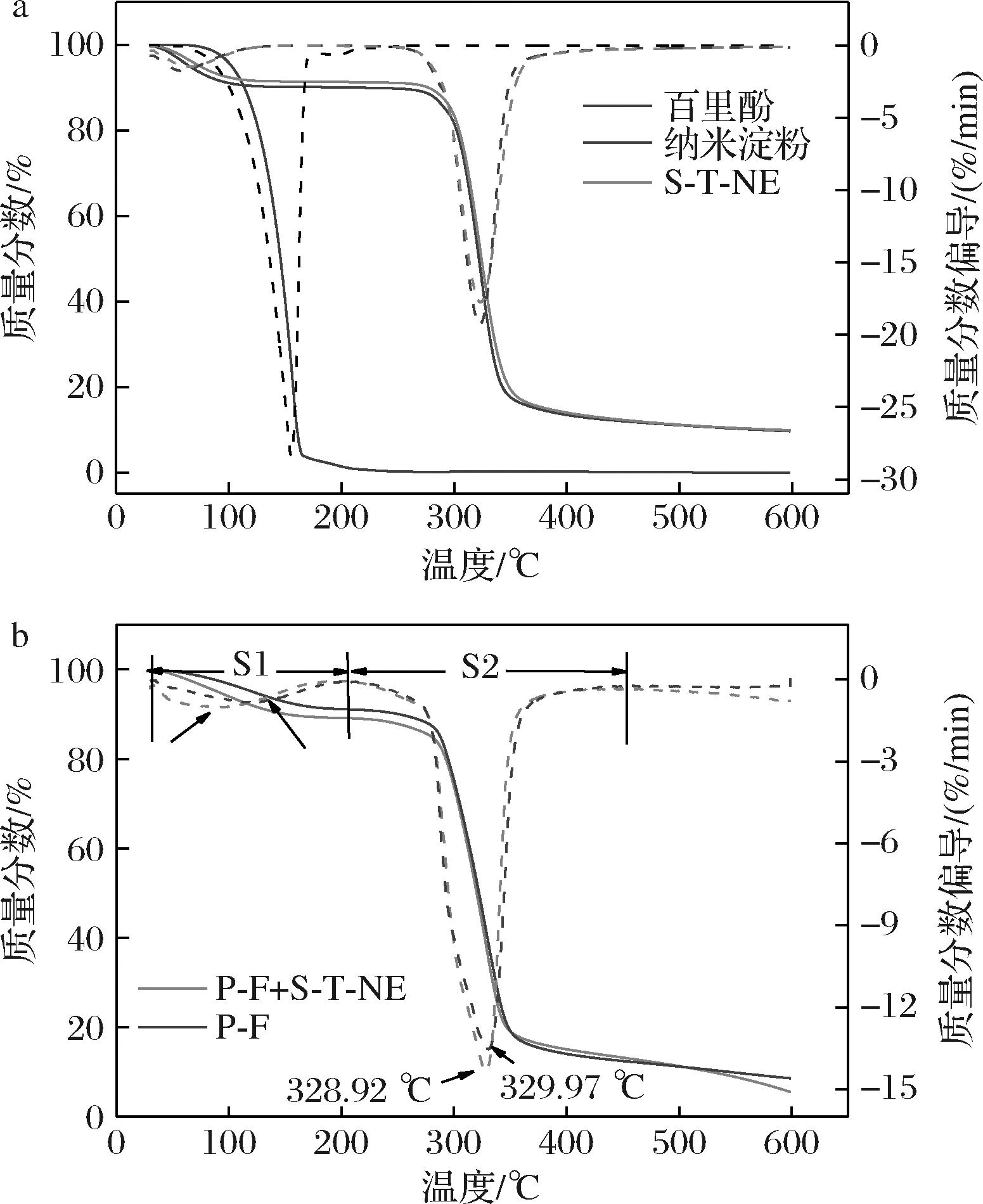
由图5可知,几种物质的质量损失均呈现两个阶段:S1阶段(<220 ℃)主要为水分子的蒸发、聚合物中与亲水基团结合的自由水蒸发以及百里酚的热逸散行为;S2阶段(>220 ℃)为甘油的挥发、生物基大分子普鲁兰糖和纳米淀粉粒子的热裂解过程。
a-百里酚、纳米淀粉、纳米乳液;b-普鲁兰糖基薄膜
图5 百里酚、纳米淀粉、S-T-NE及添加S-T-NE前后普鲁兰糖基薄膜的热失重和失重速率曲线
Fig.5 TGA and DTG curves for thymol, nanostarch, S-T-NE and pullulan based films with/without S-T-NE
由图5-a可知,S-T-NE中大分子裂解的峰值温度为323.31 ℃,略高于纳米淀粉(322.91 ℃),这是由于百里酚分子与纳米淀粉分子间形成的氢键作用一定程度上限制了淀粉分子的热裂解行为。另外,由图5-b中S1阶段可知,由于百里酚分子热逸散速率在155.24 ℃达到峰值(图5-a),促使P-F+S-T-NE组薄膜中水分蒸发/百里酚热逸散速率达到峰值的温度为126.84 ℃,高于P-F组(116.97 ℃);同样地,S2阶段中P-F+S-T-NE组薄膜中大分子的裂解峰值温度(329.97 ℃)略高于P-F组(328.92 ℃)。有研究表明,纳米粒子在材料基体中可以充当热屏障作用,阻碍了多糖链的运动性,促使多糖链分子裂解温度升高[25];此外,加入S-T-NE后,淀粉纳米粒子、百里酚与普鲁兰糖的氢键作用增强在也会限制普鲁兰糖分子的热裂解行为,促使大分子裂解峰值温度增大。
2.6 草莓保鲜及滋味分析
由图6可知,当草莓于4 ℃冷藏储存时,随着储存时间的延长,P-F+S-T-NE组草莓在整个储存周期内品相均保持良好,而P-F组草莓表面出现明显的皱缩(如框图所示);为了加速草莓质变实验,经处理后的草莓进一步于25 ℃(恒湿环境)储存,对比可知,P-F组草莓表面于第2天便开始出现皱缩和霉点(如图箭头所示);而P-F+S-T-NE组草莓表面于第6天才开始出现个别霉点和皱缩,表明加入S-T-NE明显有助于延长草莓的保鲜。
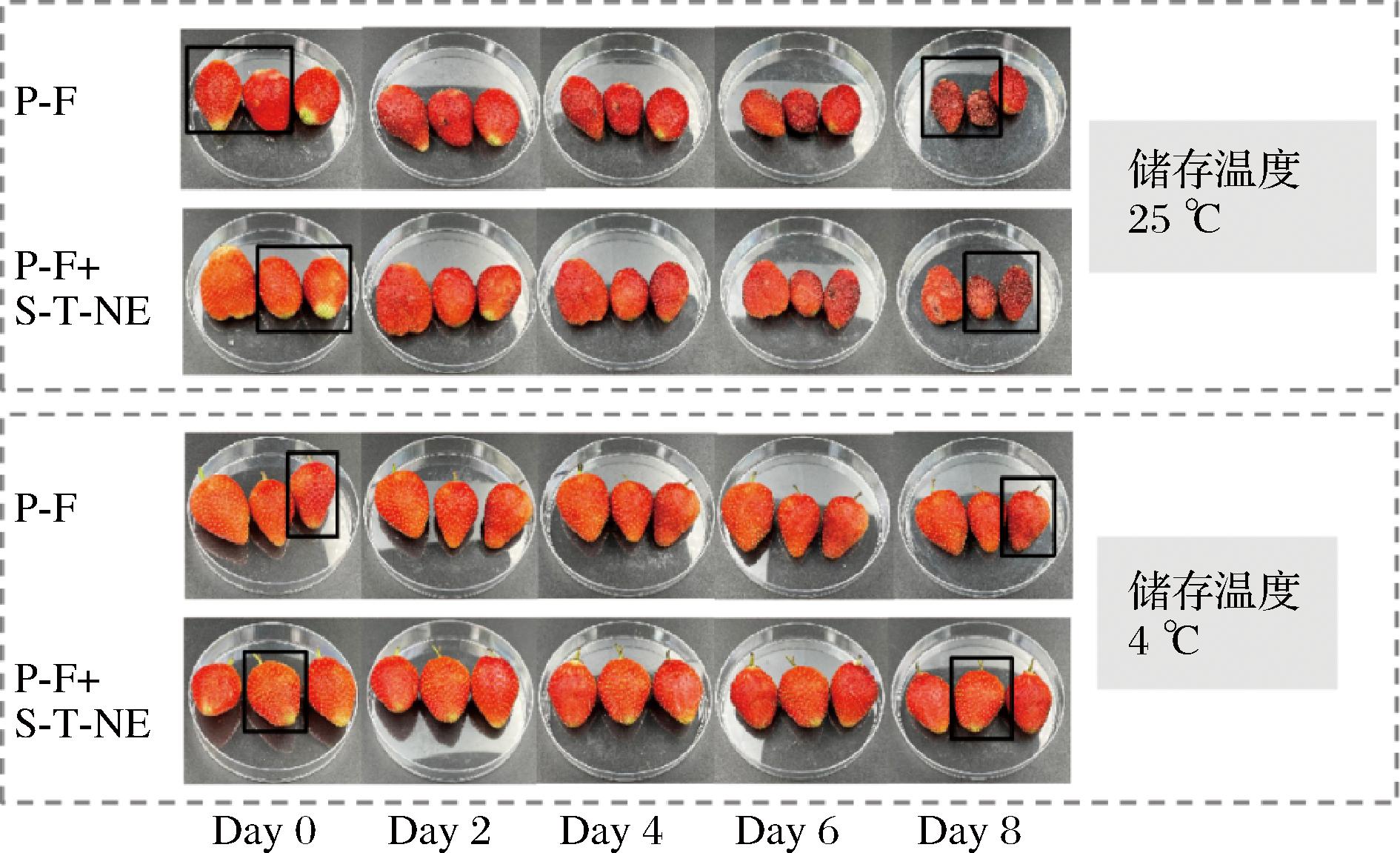
图6 添加S-T-NE前后普鲁兰糖基成膜液喷涂处理草莓的表面形貌变化
Fig.6 Morphological changes of strawberry sprayed by pulullan based film-forming solution with/without S-T-NE addition
电子舌是基于描述模仿人类味觉系统的数学模型的构建来识别6种基本味觉,相比于常规感官评价,能够克服人为主观意识对样品感官评价的影响,减小外界因素的影响,通常用酸味、苦味、涩味、咸味、鲜味等表示[26]。图7为基于草莓于25 ℃储存结果,进一步借助电子舌探讨添加S-T-NE前后普鲁兰糖薄膜对草莓滋味变化的影响。
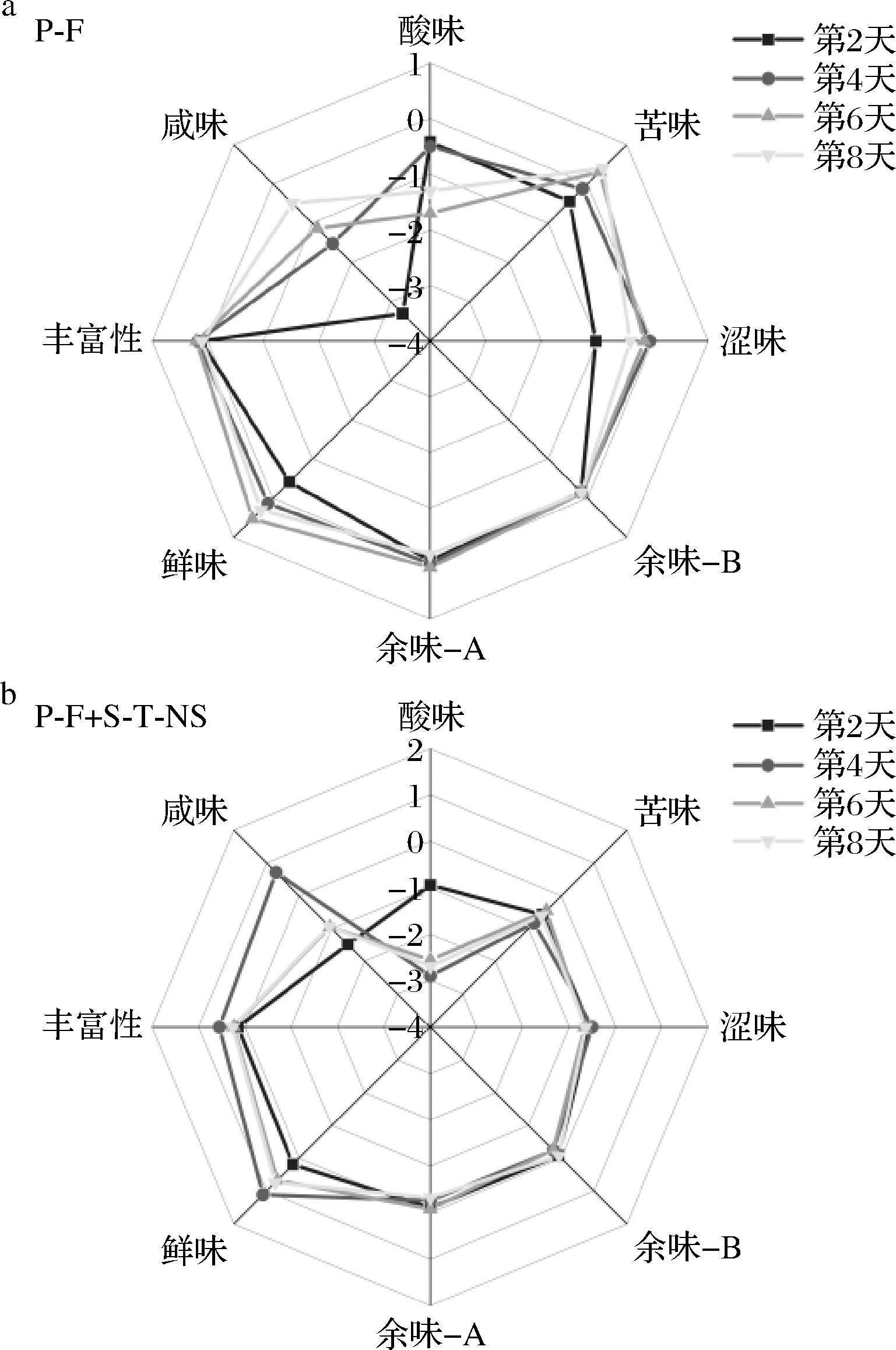
a-未添加纳米乳液处理组草莓;b-添加纳米乳液处理组草莓
图7 草莓于常温下储存8 d内的电子舌雷达图
Fig.7 Radar plot of scores for sensory evaluation of strawberry stored for 8 days at room temperature
酸味值:不同时间下,P-F+S-T-NE组草莓均呈现较低的酸味响应值,且P-F组草莓酸味响应值的增加速率较高。储存时间小于4 d时,添加了S-T-NE的成膜液在草莓表面形成薄膜后,有效减弱草莓的呼吸速率,减慢代谢作用,减少有机酸的消耗,溶出的酸较少,导致酸味响应值较低[27];储存时间大于4 d时,P-F组草莓已开始腐败变质,微生物侵染产生较多的酸味物质,导致该组草莓酸味相应值明显增加。
苦味、涩味、咸味值:相同储存时间下,P-F组草莓的苦味相应值均高于P-F+S-T-NE组。储存时间大于2 d时,P-F组已逐渐开始发生腐败变质,形成霉菌,导致草莓苦味相应值明显高于P-F+S-T-NE组,表明S-T-NE的添加有助于减少草莓内部苦味物质的形成。然而百里酚本身有涩味和咸味,一定程度上影响了2种味觉值的检测。
鲜味值变化:在储存期内,P-F+S-T-NE组草莓鲜味相应值均高于对P-F组,且随储存时间的延长而增大。P-F+S-T-NE组草莓喷涂液中的S-T-NE可加快谷氨酸钠或一些鲜味相关的核苷酸如5-GMP的合成;同时减缓草莓内部的羰氨反应,减少鲜味成分的消耗[27]。而P-F组草莓由于储存期间容易受到微生物侵染消耗了较多无机盐、氨基酸以及核苷酸类物质,促使鲜味值降低。以上结果表明,添加了S-T-NE的普鲁兰糖薄膜能有效延长草莓储存品质。
3 结论
本文得到了添加淀粉/百里酚纳米乳液(S-T-NE)前后对普鲁兰糖薄膜结构性质的影响规律,并将其成功应用于草莓保鲜且进一步得到对草莓滋味的影响规律。在薄膜中加入S-T-NE后,酚羟基、纳米淀粉羟基均与普鲁兰糖羟基形成分子间氢键,导致普鲁兰糖分子内氢键作用减弱,分子链发生重排,促使羟基振动吸收峰透过率增强、波数发生红移,这进一步导致普鲁兰糖薄膜的断面粗糙度增加、衍射峰强增大;同时,亲水性羟基的引入、薄膜内部形成的孔洞/聚集体结构促使水蒸气分子更易进入普鲁兰糖基薄膜内部,导致薄膜的WVP值由3.37×10-10 g/(m·s·Pa)增大至6.39×10-10 g/(m·s·Pa)。进一步地,加入S-T-NE后,具有热屏障作用的淀粉纳米粒子和疏水性的百里酚可阻碍薄膜中水分子的热逸散和普鲁兰糖链的运动性,促使薄膜热稳定性增加。而S-T-NE的加入减弱了草莓的呼吸作用和代谢作用,减缓草莓内部的羰氨反应,减少有机酸、鲜味成分的消耗,从而延长草莓的保鲜时间。以上结果可为负载活性物质的纳米淀粉在食品保鲜中的应用提供参考。
[1] SAPPER M, WILCASO P, SANTAMARINA M P, et al.Antifungal and functional properties of starch-gellan films containing thyme (Thymus zygis) essential oil[J].Food Control, 2018, 92:505-515.
[2] NILE S H, BASKAR V, SELVARAJ D, et al.Nanotechnologies in food science:Applications, recent trends, and future perspectives[J].Nano-Micro Letters, 2020, 12(1):45.
[3] ATARÉS L, CHIRALT A.Essential oils as additives in biodegradable films and coatings for active food packaging[J].Trends in Food Science &Technology, 2016, 48:51-62.
[4] WANG B, SUI J, YU B, et al.Physicochemical properties and antibacterial activity of corn starch-based films incorporated with Zanthoxylum bungeanum essential oil[J].Carbohydrate Polymers, 2021, 254:117314.
[5] ZHU Y L, LI C Z, CUI H Y, et al.Encapsulation strategies to enhance the antibacterial properties of essential oils in food system[J].Food Control, 2021, 123:107856.
[6] 邢承宇, 王璐, 陈星光, 等.香芹酚-壳聚糖纳米颗粒的制备及抑菌活性研究[J].食品与发酵工业, 2022, 48(22):82-88.
XING C Y, WANG L, CHEN X G, et al.Preparation and antifungal activity of chitosan nanoparticle loaded with carvacrol[J].Food and Fermentation Industries, 2022, 48(22):82-88.
[7] SEIBERT J B, VIEGAS J S R, ALMEIDA T C, et al.Nanostructured systems improve the antimicrobial potential of the essential oil from Cymbopogon densiflorus leaves[J].Journal of Natural Products, 2019, 82(12):3208-3220.
[8] WANG W, ZHANG W W, LI L, et al.Biodegradable starch-based packaging films incorporated with polyurethane-encapsulated essential-oil microcapsules for sustained food preservation[J].International Journal of Biological Macromolecules, 2023, 235:123889.
[9] MAJEED H, LIU F, HATEGEKIMANA J, et al.Bactericidal action mechanism of negatively charged food grade clove oil nanoemulsions[J].Food Chemistry, 2016, 197:75-83.
[10] DONS F, FERRARI G.Essential oil nanoemulsions as antimicrobial agents in food[J].Journal of Biotechnology, 2016, 233:106-120.
F, FERRARI G.Essential oil nanoemulsions as antimicrobial agents in food[J].Journal of Biotechnology, 2016, 233:106-120.
[11] QIN Y, XUE L, HU Y, et al.Green fabrication and characterization of debranched starch nanoparticles via ultrasonication combined with recrystallization[J].Ultrasonics Sonochemistry, 2020, 66:105074.
[12] HAN K, LIU Y F, LIU Y Y, et al.Characterization and film-forming mechanism of egg white/pullulan blend film[J].Food Chemistry, 2020, 315:126201.
[13] YAO S Y, MA S H, ZHU Q Q, et al.Ultrasmooth and uniform starch nanosphere with new microstructure formation via microfluidization-nanoprecipitation control[J].ACS Sustainable Chemistry &Engineering, 2023, 11(19):7475-7488.
[14] FERREIRA R R, SOUZA A G, QUISPE Y M, et al.Essential oils loaded-chitosan nanocapsules incorporation in biodegradable starch films:A strategy to improve fruits shelf life[J].International Journal of Biological Macromolecules, 2021, 188:628-638.
[15] SHANKAR S, KHODAEI D, LACROIX M.Effect of chitosan/essential oils/silver nanoparticles composite films packaging and gamma irradiation on shelf life of strawberries[J].Food Hydrocolloids, 2021, 117:106750.
[16] FENG X, WANG W Y, CHU Y F, et al.Effect of cinnamon essential oil nanoemulsion emulsified by OSA modified starch on the structure and properties of pullulan based films[J].LWT, 2020, 134:110123.
[17] MAJEED U, MAJEED H, LIU X H, et al.Succinylated starch emulsified Eugenol and Carvacrol nanoemulsions improved digestive stability, bio-accessibility and Salmonella typhimurium inhibition[J].International Journal of Biological Macromolecules, 2024, 259:129230.
[18] 黄佳卉, 赵雷, 朱杰, 等.酶解-动态高压微射流制备纳米淀粉及对其结构性质的影响[J].食品工业科技, 2024, 45(8):127-133.
HUANG J H, ZHAO L, ZHU J, et al.Nano-starch and its structural properties prepared from enzymolysis-dynamic high pressure micro-fluidization[J].Science and Technology of Food Industry, 2024, 45(8):127-133.
[19] 李黄炜, 梁茵瑜, 范佳欣, 等.酶解联合动态高压微射流制备淀粉/百里酚纳米乳液及其结构与性质分析[J].食品工业科技, 2024,45(23):121-128.
LI H W, LIANG Y Y, FAN J X, et al.Structure and property analysis of starch/thymol nano emulsion prepared by enzymolysis combined with dynamic high pressure micro-fluidization[J].Science and Technology of Food Industry, 2024,45(23):121-128.
[20] AHMADY A R, RAZMJOOE K, SABER-SAMANDARI S, et al.Fabrication of chitosan-gelatin films incorporated with thymol-loaded alginate microparticles for controlled drug delivery, antibacterial activity and wound healing:In-vitro and in-vivo studies[J].International Journal of Biological Macromolecules, 2022, 223(Part A):567-582.
[21] LEI Y L, WU H J, JIAO C, et al.Investigation of the structural and physical properties, antioxidant and antimicrobial activity of pectin-konjac glucomannan composite edible films incorporated with tea polyphenol[J].Food Hydrocolloids, 2019, 94:128-135.
[22] 刘颖. 羧甲基淀粉-壳聚糖复合膜的制备及性能研究[D].阜新:辽宁工程技术大学, 2017.
LIU Y.Preparation and performance research of carboxymethyl starch-chitosan composite membrane[D].Fuxin:Liaoning Technical University, 2017.
[23] ZHU J, ZHANG S Y, PU H Y, et al.Structural properties of propionylated starch-based nanocomposites containing different amylose contents[J].International Journal of Biological Macromolecules, 2020, 149:532-540.
[24] ZHOU W, HE Y X, LIU F, et al.Carboxymethyl chitosan-pullulan edible films enriched with galangal essential oil:Characterization and application in mango preservation[J].Carbohydrate Polymers, 2021, 256:117579.
[25] 张书艳, 刘宇佳, 朱杰, 等.纳米粒子对酯化淀粉基膜材多层次结构及热性能的影响[J].现代食品科技, 2018, 34(12):53-57;33.
ZHANG S Y, LIU Y J, ZHU J, et al.Characterization of nanofiller on multi-scale structures and thermal property of starch ester film[J].Modern Food Science and Technology, 2018, 34(12):53-57;33.
[26] LI H Y, WANG Y, ZHANG J X, et al.Prediction of the freshness of horse mackerel (Trachurus japonicus) using E-nose, E-tongue, and colorimeter based on biochemical indexes analyzed during frozen storage of whole fish[J].Food Chemistry, 2023, 402:134325.
[27] 朱金花. 海藻酸钠/纳米 CaCO3复含材料涂膜对冷藏草莓风味的影响[D].扬州:扬州大学, 2019.
ZHU J H.Effect of sodium alginate/nano-CaCO3 composite coating on flavor of strawberry under cold storage[D].Yangzhou:Yangzhou University, 2019.