青霉素酰化酶(penicillin acylase, PA)又称青霉素氨基水解酶[1]、青霉素酰胺酶,主要应用于生产β-内酰胺抗生素的关键中间体[2]、制备半合成β-内酰胺类抗生素[3]和制备手性药物等,在生物医药、食品分析等诸多领域具有重要作用。研究表明,在众多野生菌[4]中发现和提取出的青霉素酰化酶具有酶活性低、副产物多等缺陷,因而现多采用基因工程等方法改造菌株以克服其不足。其中,雷氏普罗威斯登菌(Providencia rettgeri)pga基因属于青霉素和头孢菌素酰胺酶家族,具有高度特异性的基因结构和产物成熟模式[5],通过在原核系统中异源表达P.rettgeri pga基因,证实其具有热稳定性高、酶活力强[6]等诸多优势。
毕赤酵母(Komagataella pastoris)是目前最常用的异源重组蛋白表达宿主之一[7],其相较于细菌、酿酒酵母、动物细胞等常见外源表达宿主具有更高的表达水平[8]而备受关注。毕赤酵母中含有AOX1(醇氧化酶基因)启动子,用甲醇[9]作为唯一碳源可严格调控外源基因的高效表达。目前,有超过上千种外源蛋白在毕赤酵母中成功表达[10],例如β-胡萝卜素[11]、人溶菌酶-速凝素I[12]、脂肪酶[13]等。因原核表达系统的产酶量低且极易形成包涵体,毕赤酵母表达系统可以正确对异源蛋白进行折叠,并使蛋白表达量增高,故该系统更适合表达重组蛋白。
综上,本研究拟利用基因工程手段,扩增P.rettgeri pga基因片段,密码子优化后与高拷贝胞外分泌质粒pPIC9k连接得到重组质粒pPIC9k-pga,经Sac I酶线性化后电转至毕赤酵母GS115感受态细胞中,筛选阳性转化子并利用甲醇诱导实现异源表达。通过单因素响应面试验对诱导条件进行了工艺优化,以优化后发酵上清液为研究对象,通过镍离子金属螯合亲和层析介质(Ni-NTA)[14]树脂纯化得到青霉素酰化酶,并对其酶学性质进行相关研究。本研究将为青霉素酰化酶的工业化生产提供理论支撑。
1 材料与方法
1.1 材料与设备
1.1.1 菌株和质粒
雷氏普罗威斯登菌(Providencia rettgeri)、毕赤酵母(Komagataella pastoris)GS115及pPIC9k质粒均保藏于本实验室。
1.1.2 主要试剂
遗传霉素(geneticin,G418),北京索莱宝科技有限公司;核酸分子质量Marker、EcoR I酶、Not I酶、SDS-PAGE试剂盒、Turecolor蛋白Marker、上样缓冲液,生物工程(上海)有限公司;胶回收试剂盒,Omega Bio-Tek公司;细菌DNA提取试剂盒,天根生化科技(北京)有限公司;其他相关试剂均为市售分析纯。
1.1.3 培养基
脑心浸液肉汤(brain heart infusion,BHI) 培养基(g/L):蛋白胨10,脱水小牛脑浸粉12.5,脱水牛心浸粉5,NaCl 5,葡萄糖2,Na2HPO4 2.5。
MD培养基(g/L):酵母基本氮源13.4,生物素0.4,葡萄糖20。
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基(g/L):酵母膏10,蛋白胨20,葡萄糖20。
甲醇酵母培养基(buffered methanol-complex medium for yeast,BMMY)培养基(g/L):蛋白胨20,酵母提取液10,酵母氮源基础(yeast nitrogen base,YNB) 100 mL/L,磷酸缓冲液100 mL/L,甲醇100 mL/L。
甘油酵母培养基(buffered glycerol-complex medium for yeast,BMGY)培养基(g/L):蛋白胨20,酵母提取液10,YNB 100 mL/L,磷酸缓冲液100 mL/L,甘油100 mL/L。
1.1.4 仪器与设备
ZD-85恒温振荡培养箱,上海力辰仪器科技有限公司;酶标仪,杭州优米仪器有限公司;VS-840-1超净工作台,苏净集团泰安公司;超纯水仪,国之源;Eppendorf Eporator 电转化仪,Eppendorf;T100TM PCR仪,Bio-Rad;C200紫外凝胶成像仪, aZure Biosystems;TG16-W小型离心机,湘仪实验室仪器开发有限公司;WM-069非接触式超声细胞破碎仪,上海微弥科技有限公司。
1.2 实验方法
1.2.1 产青霉素酰化酶重组毕赤酵母菌株的构建
试剂盒法提取P.rettgeri DNA,根据Penicillin G amidase gene(GenBank:M86533.1)设计引物pga-F和pga-R以扩增目的片段(如表1所示),将扩增片段送至上海生工根据毕赤酵母表达偏好进行密码子优化,优化后的基因片段与高拷贝质粒pPIC9k连接得到重组质粒pPIC9k-pga。随后,将线性化质粒电转至感受态细胞中并利用引物pga2-F和pga2-R进行单菌落PCR验证,挑选阳性转化用于后续发酵培养。
表1 引物设计
Table 1 Primer design
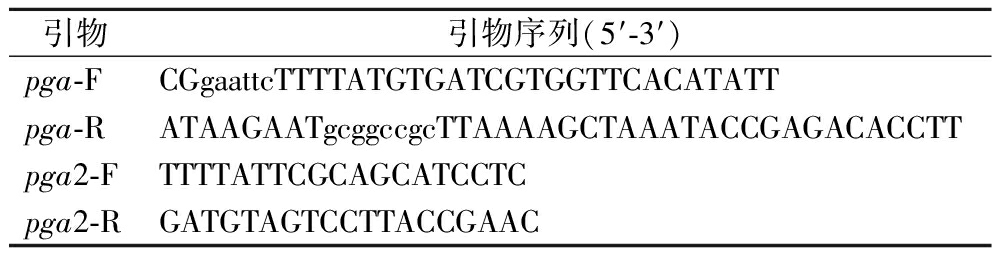
引物引物序列(5′-3′)pga-FCGgaattcTTTTATGTGATCGTGGTTCACATATTpga-RATAAGAATgcggccgcTTAAAAGCTAAATACCGAGACACCTTpga2-FTTTTATTCGCAGCATCCTCpga2-RGATGTAGTCCTTACCGAAC
1.2.2 重组菌株培养条件优化
1)单因素试验
将阳性转化子接种至BMMY液体培养基中,以诱导温度(28、29、30、31、32 ℃)、诱导时间(24、48、72、96、120 h)、甲醇诱导浓度(0.5%、1%、1.5%、2%、2.5%,体积分数,下同)作为自变量,以青霉素酰化酶酶活力作为评价指标,采用单因素试验方法,探究重组菌株适宜诱导条件。
2)响应面优化
在单因素试验基础上,以诱导温度(A)、诱导时间(B)和甲醇诱导浓度(C)为自变量,以青霉素酰化酶酶活力(Y)为响应值,设计3因素3水平Box-Behnken试验,响应面试验因素与水平见表2。
表2 因素水平
Table 2 Factor level
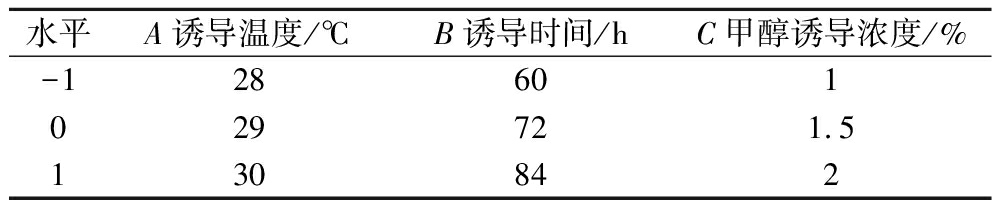
水平A诱导温度/℃B诱导时间/hC甲醇诱导浓度/%-128601029721.5130842
1.2.3 青霉素酰化酶活力测定
参考文献[15],采用对二氨基苯甲醛比色法对青霉素酰化酶活力进行测定。
酶活力定义:在37 ℃、pH 7.5、0.05 mol/L的磷酸缓冲液中催化20 mg/mL青霉素钾盐,每分钟生成1 μmol/L 6-氨基青霉烷酸所需要的酶量为1个单位青霉素酰化酶活力,单位为U。
1.2.4 重组青霉素酰化酶的分离纯化
质粒载体pPIC9k为分泌型表达载体,重组蛋白存在于发酵液中,取工艺优化发酵后上清液作为研究对象,利用Ni-NTA纯化上清液中的重组蛋白,纯化后分别利用透析袋和超滤管去咪唑、浓缩,最终得到重组青霉素酰化酶纯酶液。采用SDS-PAGE检验蛋白表达及纯化情况,BCA法测定纯化后蛋白浓度。
1.2.5 重组青霉素酰化酶酶学性质
通过测定不同温度(30、40、50、60、70 ℃)、不同pH值(4.0、5.0、6.0、7.0、8.0)下重组青霉素酰化酶的活性,对重组青霉素酰化酶的温度稳定性(30~70 ℃)及pH稳定性(pH 4~8)进行探究。其中,最高重组青霉素酰化酶活力为100%,其他以相对酶活力表示。
此外,将纯酶与不同金属离子溶液(Na+、K+、Ca2+、Mg2+、Fe2+、Mn2+、Zn2+、Cu2+、Al3+、Fe3+)混匀至终浓度为1 mmol/L,30 ℃孵育3 h,30 min取样1次,测定残余酶活力,以未经金属离子处理的重组蛋白酶活力为100%。
2 结果与分析
2.1 重组毕赤酵母菌株构建及验证
选择高拷贝外源表达载体pPIC9k以实现青霉素酰化酶高效胞外分泌表达,提取出雷氏普罗威登斯菌的DNA基因组后根据引物pga1-F及pga1-R扩增得到目的基因,克隆结果如图1-a所示。结果表明,2号泳道产物与理论PCR产物大小2 694 bp相符,说明目的基因扩增成功。将扩增产物胶回收并送至上海生工按照毕赤酵母表达偏好进行密码子优化,优化后的pga基因与质粒pPIC9k连接,得到重组质粒pPIC9k-pga。
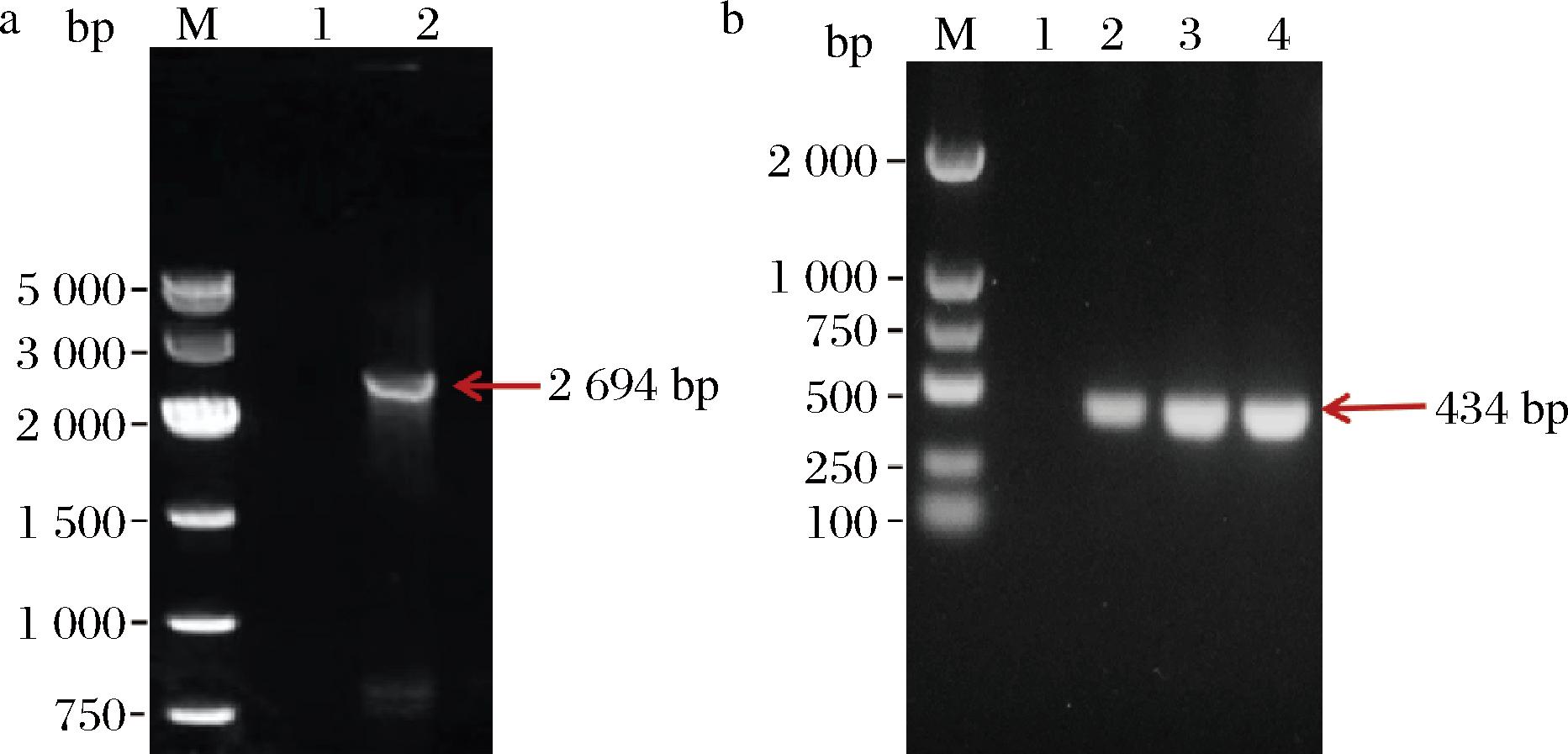
a-目的基因扩增;b-单菌落PCR
图1 基因扩增及单菌落PCR凝胶电泳图
Fig.1 Gene amplification and single colony PCR gel electropherograms
注:a图中M-DNA Marker,1、2-目的基因PCR扩增泳道;b图中M-DNA Marker,1-阴性菌株单菌落PCR对照,2、3、4-阳性菌株单菌落PCR。
利用Sac I酶对重组质粒线性化处理,可有效使目的基因插入酵母基因组。随后将线性化质粒电转至毕赤酵母GS115感受态细胞中,设计引物pga2-F和pga2-R,利用菌落PCR筛选阳性克隆。结果如图1-b所示,2~4泳道条带与预期产物大小434 bp接近,表明重组质粒成功转入毕赤酵母GS115中,之后挑选阳性转化子初步发酵并测定发酵液酶活力。结果表明,上清液酶活力为2 155.59 U/L,沉淀酶活力为1 375.75 U/L,说明产青霉素酰化酶毕赤酵母菌株构建成功。
2.2 重组菌株诱导条件优化
2.2.1 诱导温度对酶活力的影响
毕赤酵母高密度发酵过程中,培养温度是影响蛋白表达的关键因素之一[16]。如图2所示,在28~32 ℃之间,酶活力曲线呈现先上升再下降的趋势。诱导温度为28 ℃时,重组毕赤酵母生长活性不高且未达到最佳表达水平;当诱导温度为29 ℃时,重组菌酶活力达到了最大值[(3 588.94±144.16) U/L],蛋白表达量增加,这表明29 ℃有利于重组青霉素酰化酶蛋白的正确折叠及分泌[17],更有利于重组蛋白的积累。随着诱导温度的升高,重组菌酶活力呈现下降趋势,通常认为温度高于30 ℃时不利于重组蛋白表达[18],这可能是由于高温使菌株丧失生物活性甚至死亡。
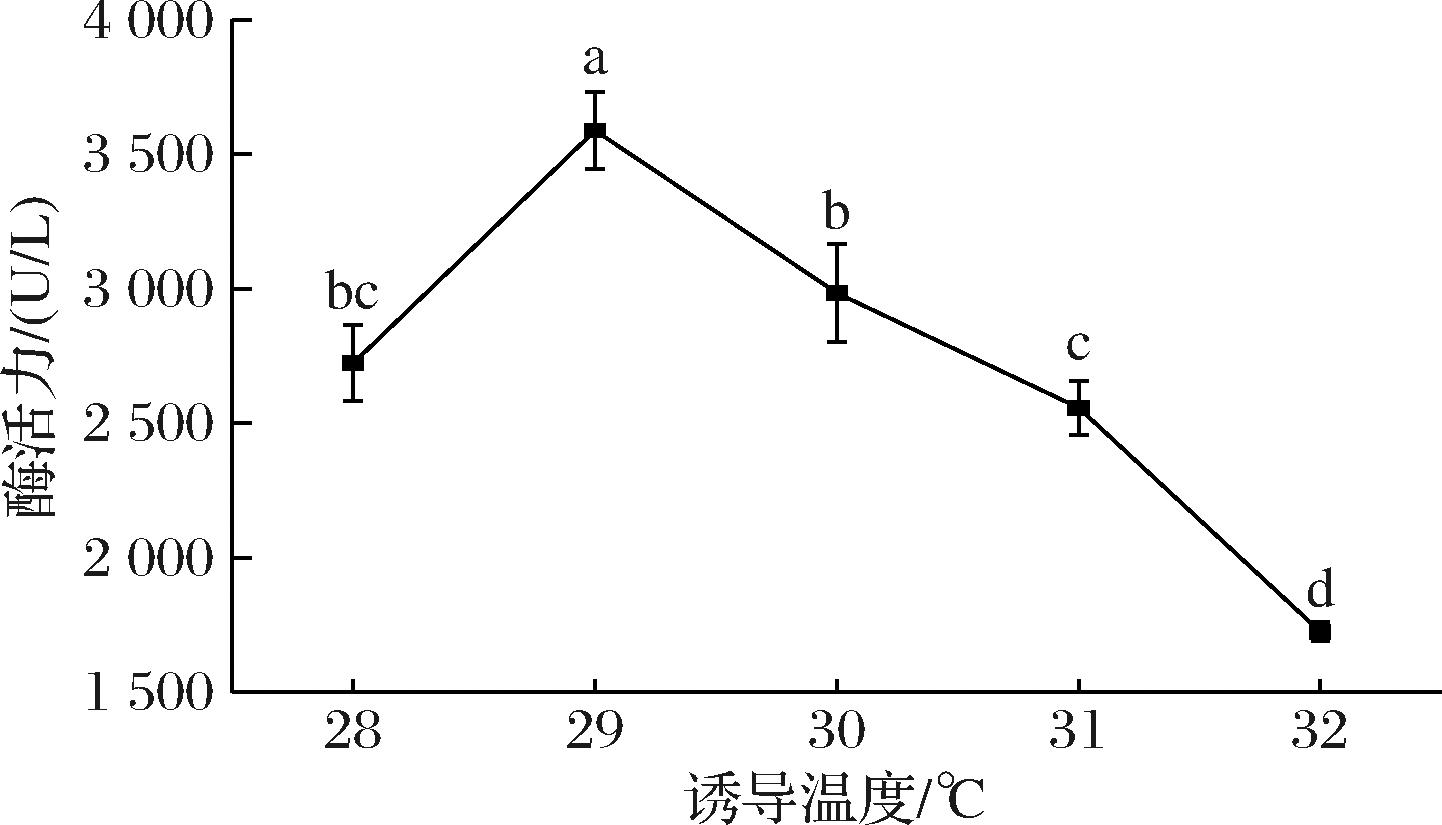
图2 诱导温度对重组青霉素酰化酶活力的影响
Fig.2 Effect of induction temperature on the enzyme activity of recombinant penicillin acylase
注:不同字母代表数据存在显著性,P<0.05(下同)。
2.2.2 诱导时间对酶活力的影响
诱导时间是毕赤酵母表达外源蛋白的一个重要影响因素。如图3所示,随着诱导时间的增加,重组菌酶活力呈现先上升后下降的趋势,在72 h存在最大酶活力,酶活力为(3 731.02±41.5) U/L。当诱导时间<72 h时,重组菌酶活力偏低,这可能是由于诱导时间过短,导致重组蛋白积累量较少。当诱导时间逐渐增大,重组菌酶活力呈现下降趋势,这是由于诱导时间过长,发酵液中蛋白酶等副产物大量堆积对重组菌酶活力产生消极影响[19]。
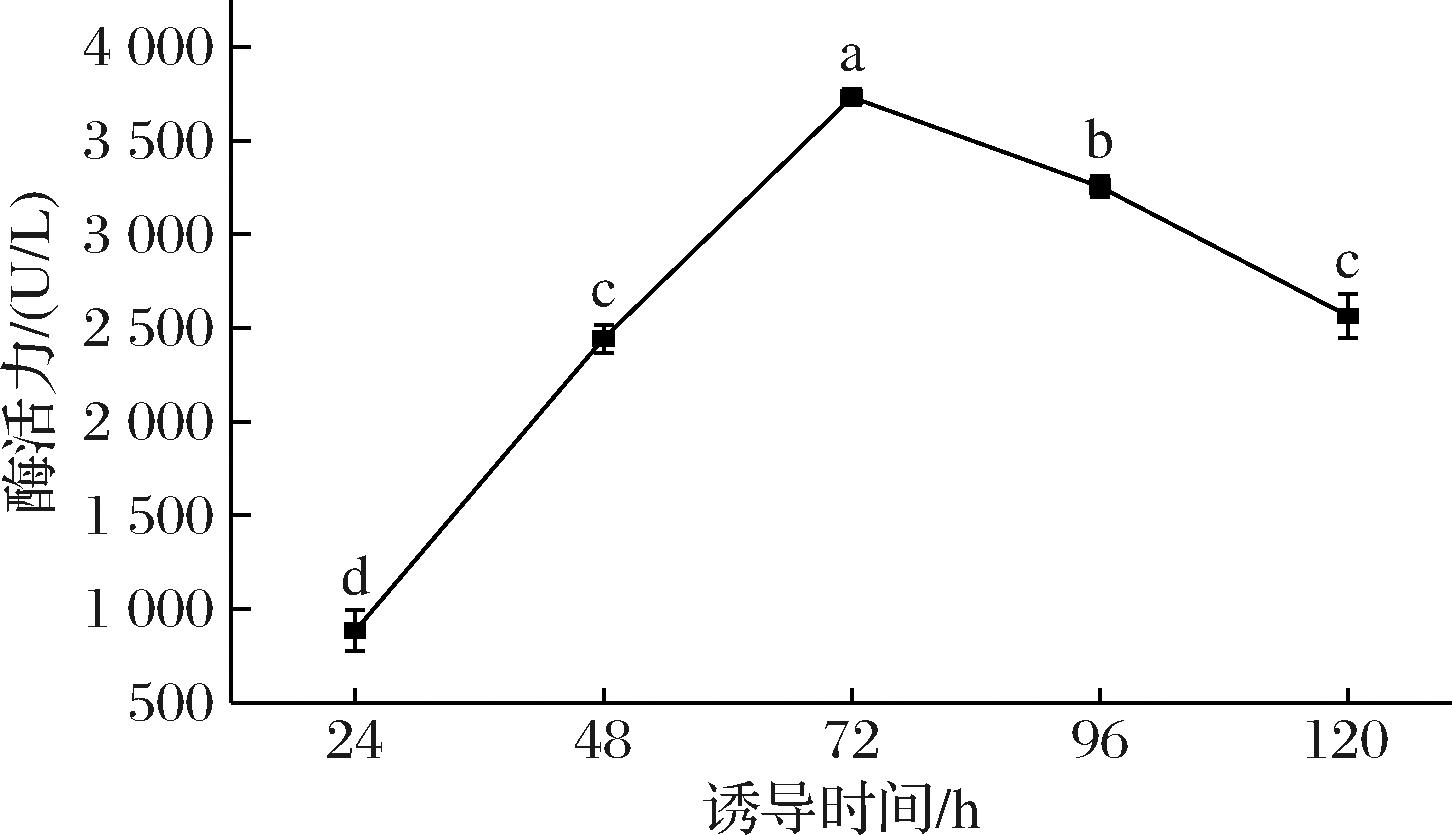
图3 诱导时间对重组青霉素酰化酶活力的影响
Fig.3 Effect of induction time on the enzyme activity of recombinant penicillin acylase
2.2.3 甲醇诱导浓度对酶活力的影响
毕赤酵母表达外源蛋白的另一个重要影响因素是甲醇诱导浓度。如图4所示,甲醇诱导浓度在0.5%~2.5%之间,重组菌酶活力呈现先上升后下降的趋势。当甲醇诱导浓度为1.5%时重组菌酶活力达到最高[(3 116.6±50.28) U/L],这是由于质粒pPIC9k具有AOX1启动子,在适宜甲醇诱导浓度时才会高效表达外源基因所致。当甲醇诱导浓度高于1.5%时重组菌酶活力呈下降趋势,这是因为诱导剂甲醇浓度过高产生的细胞毒性使重组菌大量死亡[20],从而导致酶活力降低。
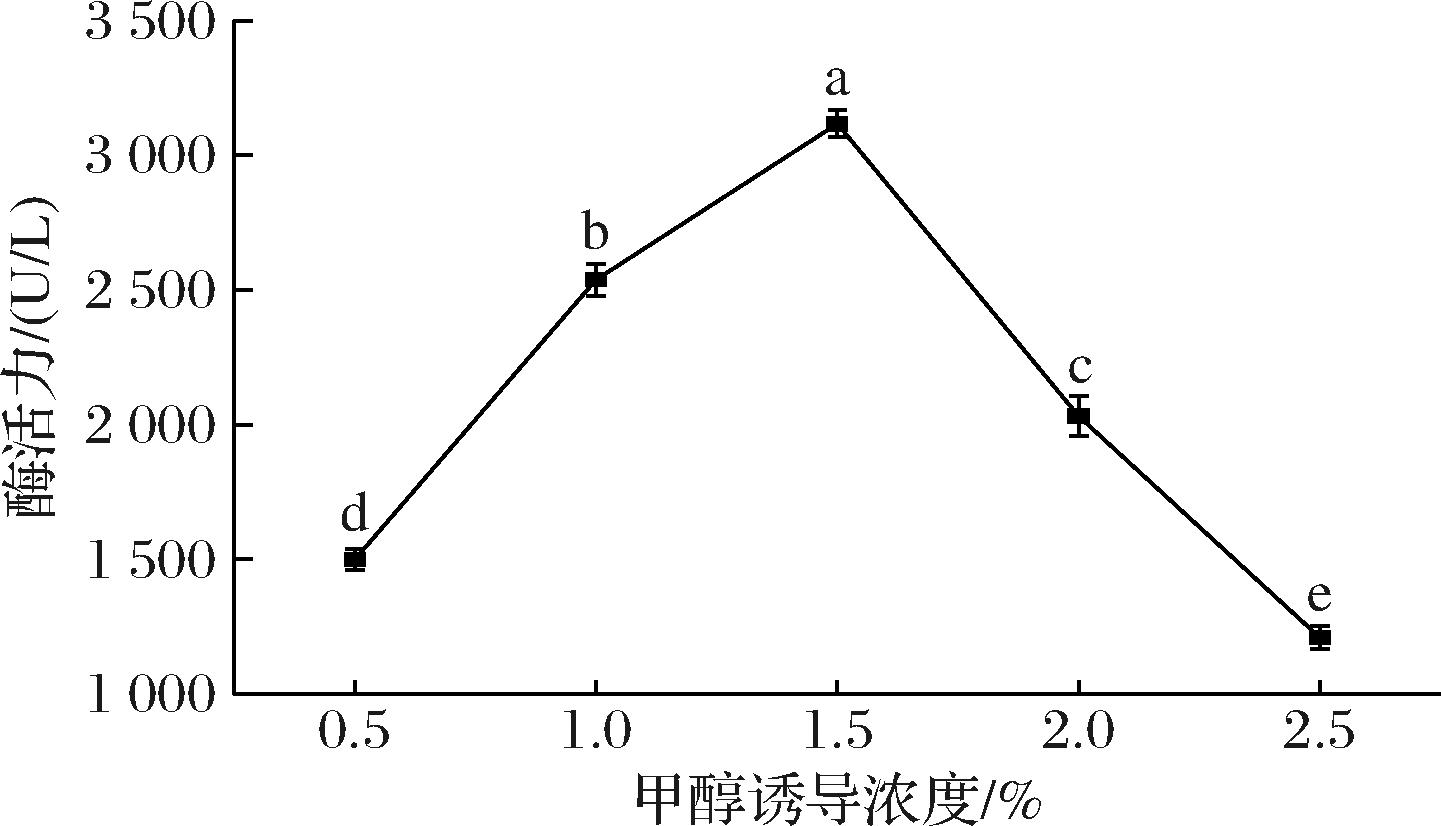
图4 甲醇诱导浓度对重组青霉素酰化酶活力影响
Fig.4 Effect of methanol-inducing concentration on the enzymatic activity of recombinant penicillin acylase
2.3 响应面试验结果及分析
在单因素试验基础上,以诱导温度(A)、诱导时间(B)和甲醇诱导浓度(C)为自变量,以酶活力(Y)为响应值,设计3因素3水平Box-Behnken试验,响应面试验结果见表3。
表3 试验设计结果
Table 3 Experimental design results
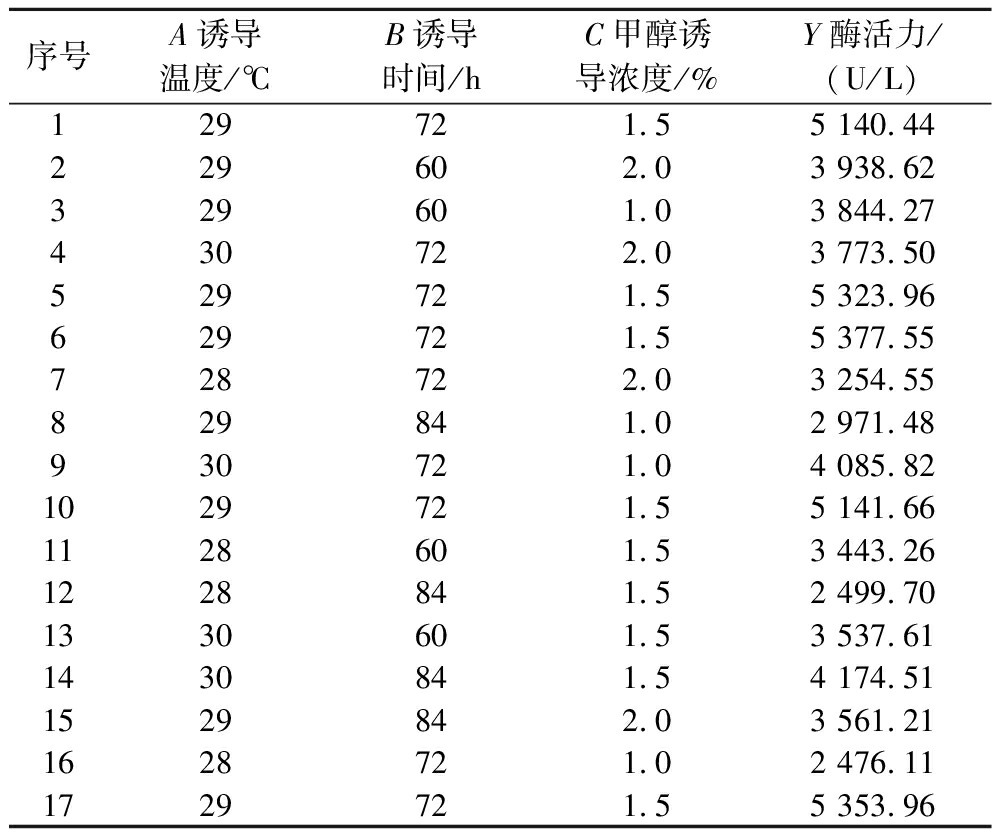
序号A诱导温度/℃B诱导时间/hC甲醇诱导浓度/%Y酶活力/(U/L)129721.55 140.44229602.03 938.62329601.03 844.27430722.03 773.50529721.55 323.96629721.55 377.55728722.03 254.55829841.02 971.48930721.04 085.821029721.55 141.661128601.53 443.261228841.52 499.701330601.53 537.611430841.54 174.511529842.03 561.211628721.02 476.111729721.55 353.96
根据响应面试验结果,二次多项回归方程为:Y=5 267.51+487.23A-194.61B+143.78C+395.12AB-272.69AC+123.85BC-1 017.57A2-836.17B2-852.45C2,其回归模型方差分析如表4所示。试验模型极显著(P<0.000 1),失拟项不显著![]() 说明方程拟合度较好,模型成立。根据回归模型方差分析显著性变化可知,一次项A及二次项A2、B2、C2对重组菌酶活力影响极显著,B、C、AB、AC对重组菌酶活力影响显著;此外,由F值可知各因素对酶活力的影响顺序为:诱导温度(A)>诱导时间(B)>甲醇诱导浓度(C)。
说明方程拟合度较好,模型成立。根据回归模型方差分析显著性变化可知,一次项A及二次项A2、B2、C2对重组菌酶活力影响极显著,B、C、AB、AC对重组菌酶活力影响显著;此外,由F值可知各因素对酶活力的影响顺序为:诱导温度(A)>诱导时间(B)>甲醇诱导浓度(C)。
表4 回归模型方差分析
Table 4 Regression model ANOVA
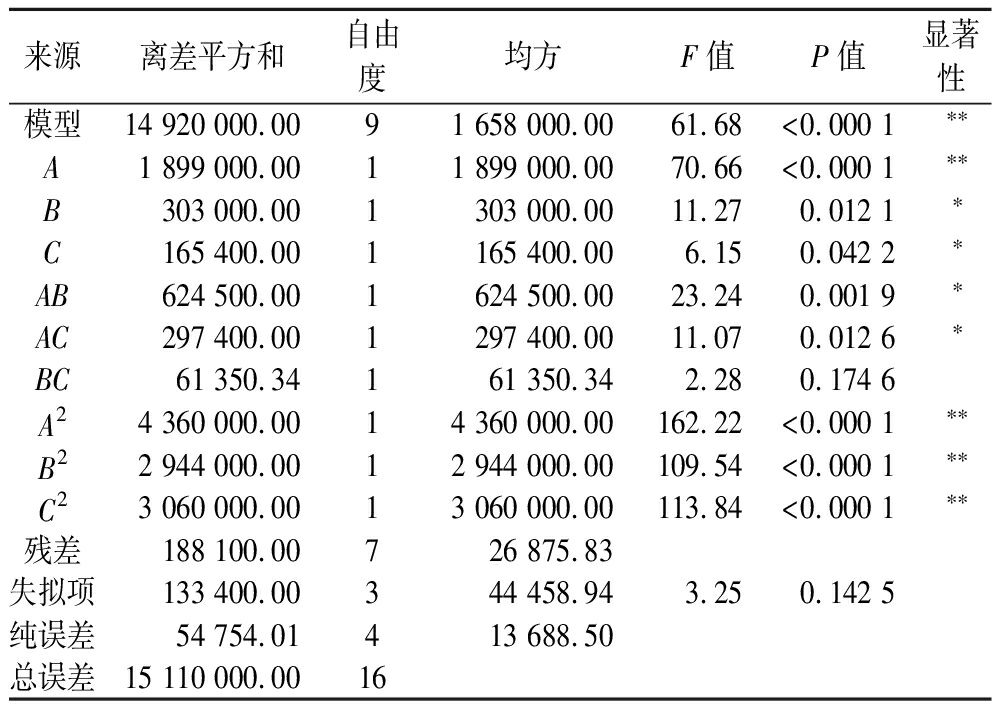
来源离差平方和自由度均方F值P值显著性模型14 920 000.0091 658 000.0061.68<0.000 1∗∗A1 899 000.0011 899 000.0070.66<0.000 1∗∗B303 000.001303 000.0011.270.012 1∗C165 400.001165 400.006.150.042 2∗AB624 500.001624 500.0023.240.001 9∗AC297 400.001297 400.0011.070.012 6∗BC61 350.34161 350.342.280.174 6A24 360 000.0014 360 000.00162.22<0.000 1∗∗B22 944 000.0012 944 000.00109.54<0.000 1∗∗C23 060 000.0013 060 000.00113.84<0.000 1∗∗残差188 100.00726 875.83失拟项133 400.00344 458.943.250.142 5纯误差54 754.01413 688.50总误差15 110 000.0016
注:P<0.05为显著,P<0.01为极显著,*表示显著,**表示极显著。
各因素交互作用对重组菌酶活力影响的响应面及等高线如图5所示。诱导温度(A)与诱导时间(B)、诱导时间(A)与甲醇诱导浓度(C)响应面坡度较陡,等高线性状趋向于椭圆形,而诱导时间(B)与甲醇诱导浓度(C)等高线性状趋于圆形,说明AB、AC交互作用对重组菌酶活影响显著,BC交互作用影响不显著。
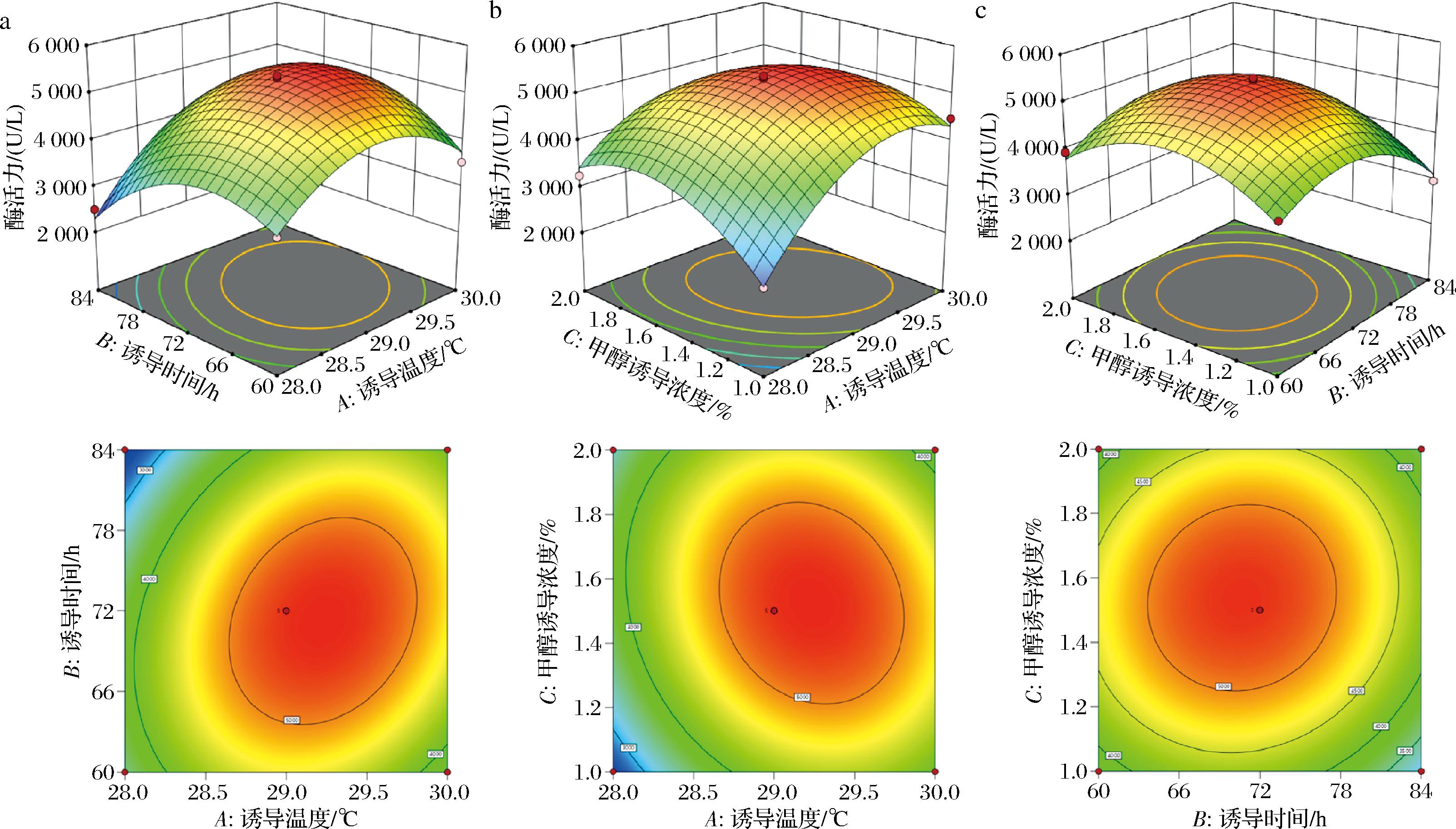
a-诱导温度与诱导时间;b-诱导温度与甲醇诱导浓度;c-诱导时间与甲醇诱导浓度
图5 各因素交互作用对重组青霉素酰化酶活力的影响
Fig.5 Effect of the interaction of factors on the enzyme activity of recombinant penicillin acylase
经Design-Expert 8.0.6软件响应面分析后得到的最佳诱导条件为:诱导温度29 ℃、诱导时间72 h、甲醇诱导浓度1.5%,在该条件下得到的重组青霉素酰化酶活力预测值为(5 067.14±110.036) U/L。在此条件下进行3次平行验证试验,得重组酶活力实际值为(5 003.72±50.623) U/L,与理论值相近,说明方程拟合度良好,模型可靠。本研究结果表明,重组菌酶活力较优化前提高了1.57倍,为毕赤酵母GS115产重组青霉素酰化酶的工业化生产提供了理论依据。
2.4 重组青霉素酰化酶的纯化
重组青霉素酰化酶在毕赤酵母GS115中表达时所选表达载体pPIC9k带有α-factor信号肽[17],可进行胞外分泌表达,所以目的重组蛋白应存在于发酵液上清液中。如图6泳道2所示,在72 kDa处存在与上清蛋白大小一致的条带,这说明细胞沉淀中仍有酶存在,可能是由于分泌表达的酶储存在毕赤酵母独有的细胞器微体[19]中导致。为了获得更多酶量,需要将酵母细胞破碎处理,取其上清液用于后续纯化,如图6泳道9所示,经Ni-NTA纯化后,洗脱液在72 kDa处有一明显条带,这与SEVO等[21]的研究结果一致。以纯化后重组青霉素酰化酶为研究对象,采用BCA法测定其蛋白浓度为1.58 mg/mL。
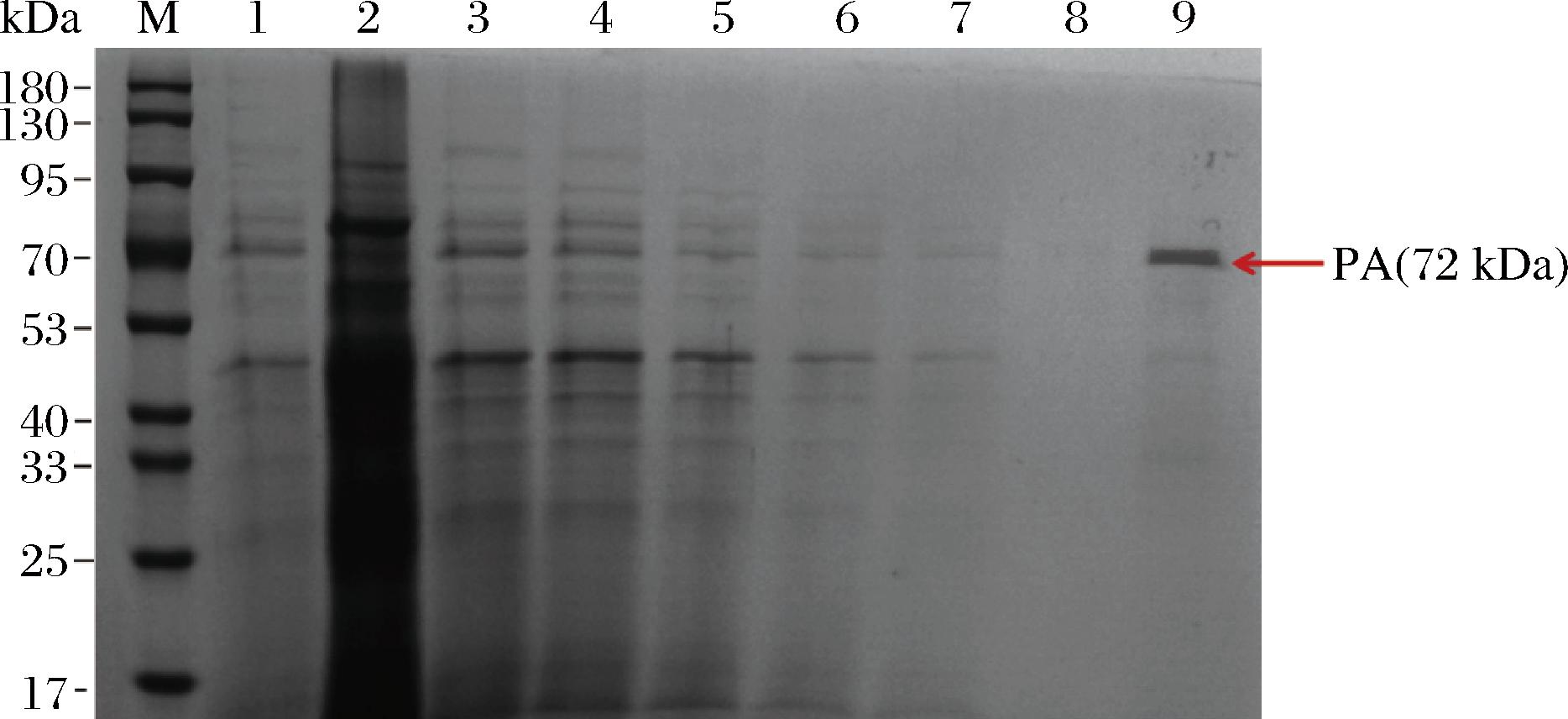
图6 重组蛋白纯化SDS-PAGE图
Fig.6 SDS-PAGE plot of recombinant protein expression
注:M-180 kDa Marker;1-未处理培养基上清液;2-未处理沉淀;3-超声波破碎后上清液;4-纯化流出液;5-2 mmol/L咪唑第一次纯化洗涤液;6-2 mmol/L咪唑第二次纯化洗涤液;7-2 mmol/L咪唑第三次纯化洗涤液;8-2 mmol/L咪唑第四次纯化洗涤液;9-纯 化蛋白(去咪唑)。
2.5 重组青霉素酰化酶酶酶学性质研究
2.5.1 重组青霉素酰化酶的最适温度及温度稳定性
温度是影响酶活力的关键因素之一。如图7-a所示,在30~60 ℃时,随着温度的升高青霉素酰化酶相对酶活力呈现上升趋势,当温度达到60 ℃时,其相对酶活力达到最高;当温度为70 ℃时,其相对酶活力只有60 ℃ 的21.7%。这可能是因为随着温度的不断升高,重组酶与底物结合的更加充分,使得酶促反应速率增大,反应效率提高;当温度超过60 ℃时,高温使得酶空间结构发生改变,无法与底物进行特异性结合,导致其相对酶活力降低。因此,重组青霉素酰化酶的最适反应温度为60 ℃。重组青霉素酰化酶的温度稳定性如图7-b所示,该酶在30~40 ℃之间酶活力相对平稳,在1 h处由于底物与重组酶充分结合,酶活力有一定提升,这表明预热对酶促反应存在激活作用。当重组酶在70 ℃下处理0.5 h后,酶活力直线下降,说明此时酶已经基本失活。因此,重组酶在30~40 ℃时有较好的温度稳定性。
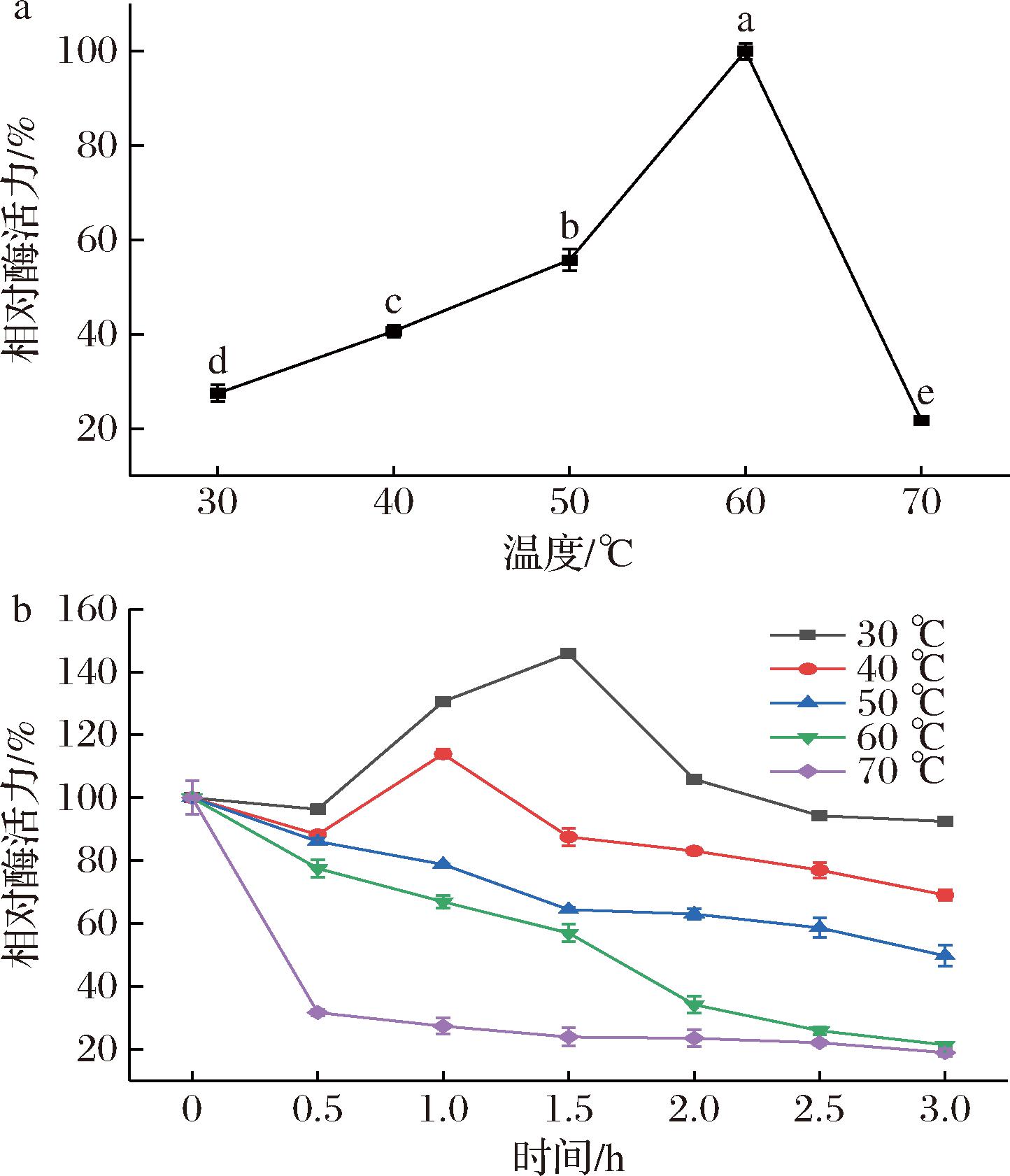
a-反应温度;b-温度稳定性
图7 温度对重组青霉素酰化酶活力的影响
Fig.7 Effect of temperature on the enzyme activity of recombinant penicillin acylase
2.5.2 重组青霉素酰化酶的最适反应pH及pH稳定性
pH改变会引起蛋白质基团及其空间结构的变化,从而影响酶与底物之间的结合和水解。如图8-a所示,在pH 4~8时,重组青霉素酰化酶相对酶活力呈现先上升后下降趋势,当pH=7时,其相对酶活力达到最高;此后随着pH值的逐渐增大,重组酶相对酶活力呈下降趋势,当pH=8时,相对酶活力仅为41.9%。因此,重组青霉素酰化酶的最适反应pH为7。重组酶的pH稳定性如图8-b所示,当pH=7时,在反应时间内酶活力相对稳定;当pH为4、5、8时,重组酶在反应0.5 h后其相对活性下降至30%~40%,这可能是由于在强酸强碱环境下,影响了重组酶的空间结构使之无法与底物充分结合,导致重组酶相对活性降低。由此可见,该酶在中性pH环境下有较好的稳定性。
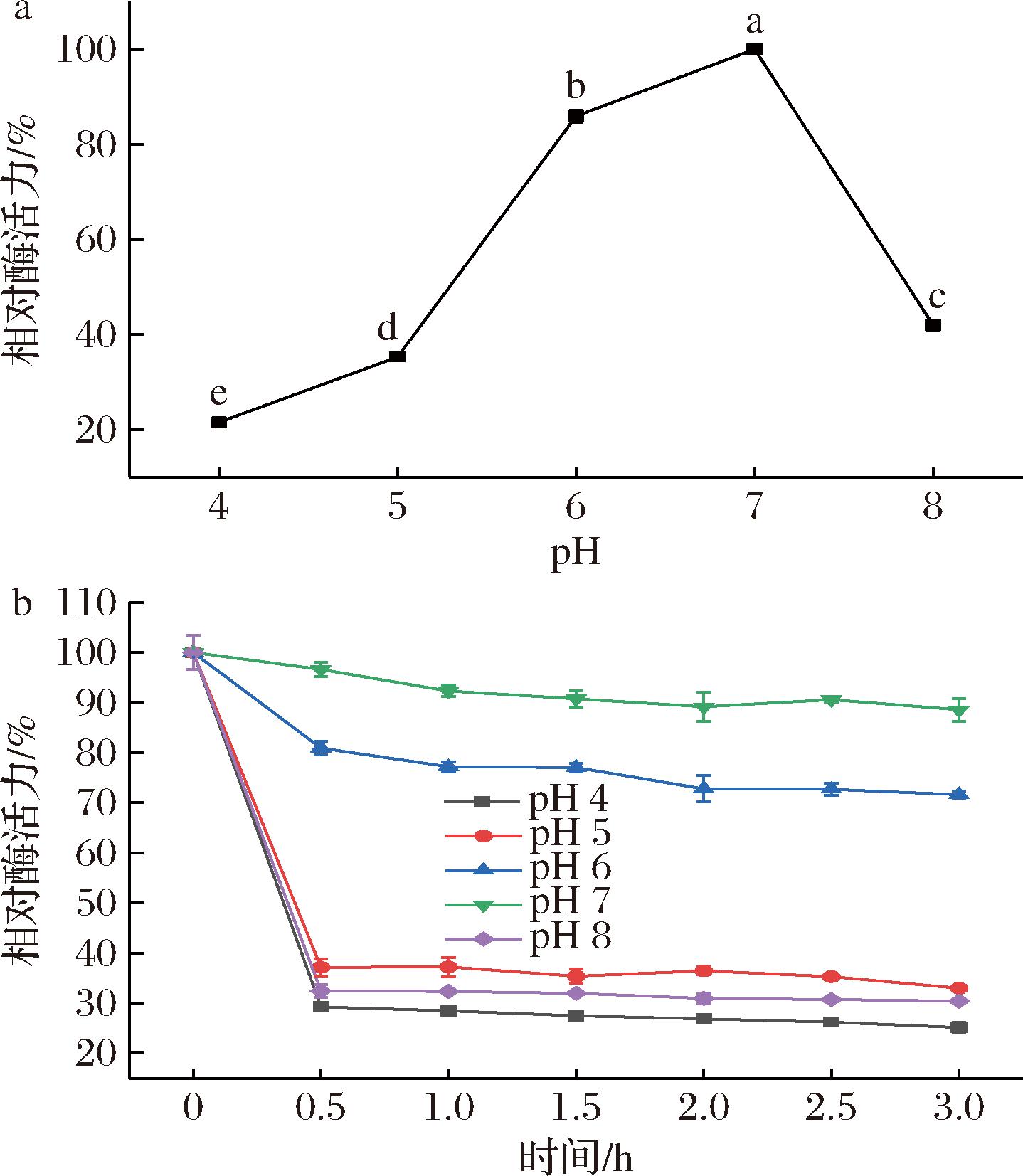
a-反应pH;b-pH稳定性
图8 pH对重组青霉素酰化酶活力的影响
Fig.8 Effect of reaction pH on the enzyme activity of recombinant penicillin acylase
2.5.3 金属离子对重组青霉素酰化酶的影响
金属离子也是影响酶促反应速率的重要因素之一,其通过改变酶的空间结构影响酶与底物之间的结合,最终对酶的催化稳定性及催化效率产生影响。如图9所示,与对照组相比,在1 mmol/L的金属离子溶液中,经Al3+处理的重组酶相对活性最高(150.12%)、Mn2+处理后相对活性最低(19.33%)。此外,相较于无金属离子溶液处理,一价金属离子处理后,重组酶相对酶活力具有一定提高;经二价金属离子溶液处理后,其对重组酶活相对活性影响大小顺序为:Mn2+
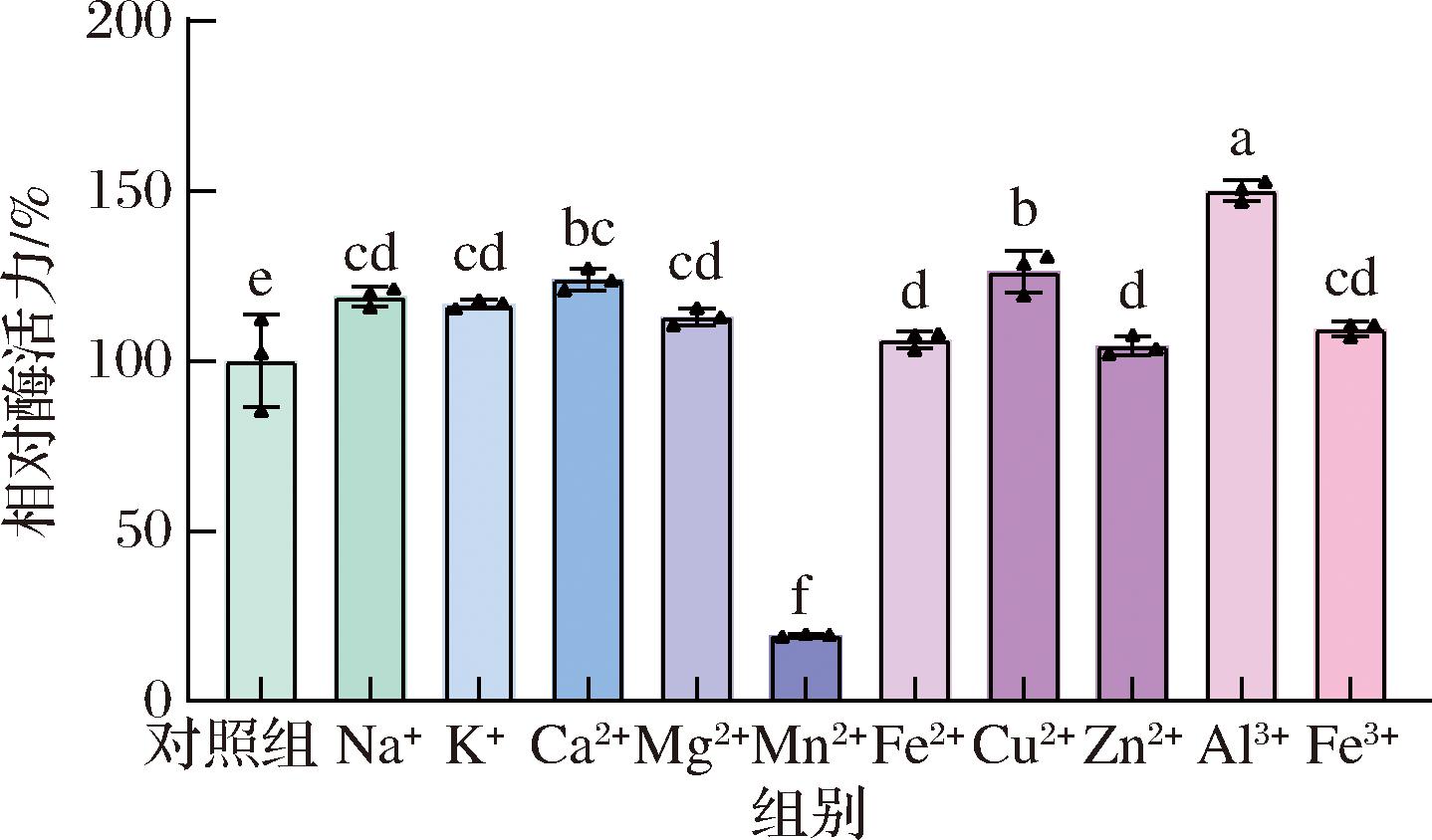
图9 金属离子对重组青霉素酰化酶活力的影响
Fig.9 Effect of metal ions on the enzyme activity of recombinant penicillin acylase
3 结论
本文扩增P.rettgeri pga基因片段在毕赤酵母GS115中成功实现异源表达。构建的产青霉素酰化酶重组毕赤酵母菌株最佳诱导条件为诱导温度29 ℃、诱导时间72 h、甲醇诱导浓度1.5%(体积分数),较优化前酶活提高了1.57倍;纯化后目的蛋白大小为72 kDa,蛋白浓度为1.58 mg/mL,重组蛋白具有良好的温度稳定性和pH稳定性,且Mn2+对酶促反应有显著抑制作用、Al3+呈现显著激活作用。本研究为青霉素酰化酶异源表达及其相关工业生产提供了理论支撑。
[1] PAN X, XU L, LI Y R, et al.Strategies to improve the biosynthesis of β-lactam antibiotics by penicillin G acylase:Progress and prospects[J].Frontiers in Bioengineering and Biotechnology, 2022, 10:936487.
[2] SAMBYAL K, SINGH R V.Exploitation of E.coli for the production of penicillin G amidase:A tool for the synthesis of semisynthetic β-lactam antibiotics[J].Journal, Genetic Engineering &Biotechnology, 2021, 19(1):156.
[3] KAMIYA T, TERAJI T, HASHIMOTO M, et al.Synthesis of new.beta.-lactam antibiotics[J].Journal of the American Chemical Society, 1975, 97(17):5020-5021.
[4] BRUNS W, HOPPE J, TSAI H, et al.Structure of the penicillin acylase gene from Escherichia coli:A periplasmic enzyme that undergoes multiple proteolytic processing[J].Journal of Molecular and Applied Genetics, 1985, 3(1):36-44.
[5] LJUBIJANKI G, KONSTANTINOVI
G, KONSTANTINOVI M, GLI
M, GLI IN V.The primary structure of Providencia rettgeri penicillin G amidase gene and its relationship to other gram negative amidases[J].DNA Sequence, 199, 3(3):195-200.
IN V.The primary structure of Providencia rettgeri penicillin G amidase gene and its relationship to other gram negative amidases[J].DNA Sequence, 199, 3(3):195-200.
[6] CHENG T F, CHEN M L, ZHENG H B, et al.Expression and purification of penicillin G acylase enzymes from four different micro-organisms, and a comparative evaluation of their synthesis/hydrolysis ratios for cephalexin[J].Protein Expression and Purification, 2006, 46(1):107-113.
[7] GASSLER T, SAUER M, GASSER B, et al.The industrial yeast Pichia pastoris is converted from a heterotroph into an autotroph capable of growth on CO2[J].Nature Biotechnology, 2020, 38(2):210-216.
[8] AHMAD M, HIRZ M, PICHLER H, et al.Protein expression in Pichia pastoris:Recent achievements and perspectives for heterologous protein production[J].Applied Microbiology and Biotechnology, 2014, 98(12):5301-5317.
[9] BOR INOV
INOV M, RASCHMANOV
M, RASCHMANOV H, ZAMORA I, et al.Production and secretion dynamics of prokaryotic Penicillin G acylase in Pichia pastoris[J].Applied Microbiology and Biotechnology, 2020, 104(13):5787-5800.
H, ZAMORA I, et al.Production and secretion dynamics of prokaryotic Penicillin G acylase in Pichia pastoris[J].Applied Microbiology and Biotechnology, 2020, 104(13):5787-5800.
[10] ZHANG X Y, CHEN S T, LIN Y, et al.Metabolic engineering of Pichia pastoris for high-level production of lycopene[J].ACS Synthetic Biology, 2023, 12(10):2961-2972.
[11] ARAYA-GARAY J M, FEIJOO-SIOTA L, ROSA-DOS-SANTOS F, et al.Construction of new Pichia pastoris X-33 strains for production of lycopene and β-carotene[J].Applied Microbiology and Biotechnology, 2012, 93(6):2483-2492.
[12] GAO Y, ZHAO H L, FENG X, et al.Expression of recombinant human lysozyme-tachyplesin i (hlyz-tp i) in Pichia pastoris and analysis of antibacterial activity[J].Biomedical and Environmental Sciences, 201, 26(4):319.
[13] VICI A C, DA CRUZ A F, FACCHINI F D A, et al.Beauveria bassiana Lipase A expressed in Komagataella (Pichia) pastoris with potential for biodiesel catalysis[J].Frontiers in Microbiology, 2015, 6:1083.
[14] WEN Y, SHI X L, YUAN Z Y, et al.Expression, purification, and characterization of His-tagged penicillin G acylase from Kluyvera citrophila in Escherichia coli[J].Protein Expression and Purification, 2004, 38(1):24-28.
[15] 吴卓颖. 产青霉素G酰化酶枯草芽孢杆菌工程菌株的构建及其发酵条件的优化[D].兰州:甘肃农业大学, 2015.
WU Z Y.Construction of Bacillus subtilis engineering strain producing penicillin G acylase and optimization of its fermentation conditions[D].Lanzhou:Gansu Agricultural University, 2015.
[16] 李成成, 黄义德.毕赤酵母表达系统及其发酵策略[J].福建轻纺, 2023(10):31-36.
LI C C, HUANG Y D.Pichia pastoris expression system and its fermentation strategy[J].The Light &Textile Industries of Fujian, 2023(10):31-36.
[17] AVELAR M, OLVERA C, ACEVES-ZAMUDIO D, et al.Recombinant expression of a laccase from Coriolopsis gallica in Pichia pastoris using a modified α-factor preproleader[J].Protein Expression and Purification, 2017, 136:14-19.
[18] 李怿韬, 曾伟主, 唐蕾.发酵过程优化提高毕赤酵母合成血红素[J].食品与发酵工业, 2024, 50(22):60-66.
LI Y T, ZENG W Z, TANG L.Enhancing heme biosynthesis in Pichia pastoris by fermentation process optimization[J].Food and Fermentation Industries, 2024, 50(22):60-66.
[19] 邓庆博. 细胞表面展示脲基酰胺水解酶降低黄酒中EC含量的研究[D].天津:天津科技大学, 2021.
DENG Q B.Study on Reducing the content of EC in Huangjiu by displaying urea amide hydrolase on cell surface[D].Tianjin:Tianjin University Of Science&technology,2021.
[20] KARBALAEI M, REZAEE S A, FARSIANI H.Pichia pastoris:A highly successful expression system for optimal synthesis of heterologous proteins[J].Journal of Cellular Physiology, 2020, 235(9):5867-5881.
[21] SEVO M, DEGRASSI G, SKOKO N, et al.Production of glycosylated thermostable Providencia rettgeri penicillin G amidase in Pichia pastoris[J].FEMS yeast research, 200, 1(4):271-277.
[22] 王婕妤. 阿魏酸酯酶在毕赤酵母中的异源表达及酶学特性分析[D].无锡:江南大学, 2021.
WANG J Y.Heterologous expression of feruloyl esterase in Pichia pastoris and analysis of its enzymatic characteristics[D].Wuxi:Jiangnan University, 2021.