芹菜(Apium graveolens),伞形科的一种,一年或两年生草本植物。人们食用芹菜以叶柄为主,通常熟食,也可作为沙拉蔬菜,或者作为调味剂在高汤中使用[1]。芹菜中含有大量生物活性物质,如有机酸、甾醇、多酚、脂肪酸、叶绿素和维生素。其中,多酚类物质如绿原酸等被报道具有参与促进细胞凋亡从而抗癌以及抑制雌激素等作用[2-4],是芹菜中重要的功能物质。由于芹菜富含营养且具有特殊的风味,因此,常将芹菜制成脱水芹菜粉用作调味原料以及各类面点和烘培制品的添加料[5-7]。例如,华长虹[8-9]研发了水芹味香饼以及早餐水芹粉的加工工艺,芹菜粉的加入既增加了多酚、复合物纤维素、矿物质等化合物的含量,同时还增加了芹菜特有的香气成分。
目前,脱水芹菜粉的制备工艺主要包括清洗、杀菌、漂烫、脱水、包装等步骤,以及在食用环节的复水。多酚类物质在这些加工过程中易发生酶促褐变,多酚氧化酶(polyphenol oxidase, PPO)和过氧化物酶(peroxidase, POD)是引起此类褐变的关键酶,这两种酶会催化芹菜组织中的多酚氧化生成醌类,并进一步聚合形成大分子褐色物质,发生快速褐变。因此,在加工过程中,分析PPO和POD的酶活性变化对控制脱水芹菜加工过程中多酚含量变化具有重要的意义。
本研究利用高效液相色谱串联质谱(high performance liquid chromatography tandem mass spectrometry, HPLC-MS/MS)方法同时测定脱水芹菜中芦丁、金丝桃苷、异鼠李素、儿茶素、莨菪亭、没食子酸以及绿原酸共7种关键的多酚化合物含量,并研究脱水芹菜加工过程中这7种多酚变化规律,结合漂烫过程酶活性分析,探究脱水工艺对芹菜中7种多酚含量的影响,为阐明脱水芹菜在加工过程中多酚类物质的变化以及优化生产工艺参数提供参考。
1 材料与方法
1.1 材料与仪器
芹菜,北京市某超市;甲醇、甲酸、芦丁、绿原酸、正己烷(色谱纯)、NaClO(5%有效氯)、NaCl(99.8%)、柠檬酸、Na2HPO4、NaH2PO4、H2O2、邻苯二酚(98%)、愈创木酚(99%),北京百灵威科技有限公司;金丝桃苷、异鼠李素、儿茶素、莨菪亭、没食子酸、大豆苷元(色谱纯),上海麦克林生化科技有限公司。
Agilent 1260-6460高效液相色谱串联质谱仪、EclipsePlusC18液相色谱柱(4.6 mm×250 mm,5 μm),美国安捷伦公司;KQ-500DE超声波清洗机,昆山市超声仪器有限公司;Milli-Q(18.3 MΩ)超纯水仪,美国MILLI-PORE公司;DHG-9070A电热恒温鼓风干燥箱,上海精密实验设备有限公司;UV-2550全波长扫描紫外分光光度计,日本岛津公司;MA37-1CN水分测定仪,赛多利斯科学仪器有限公司;FD-1A-50冷冻干燥机,北京博医康实验仪器有限公司。
1.2 实验方法
1.2.1 脱水芹菜粉加工工艺模拟
a)清洗:取新鲜芹菜,每棵约700 g,去除芹菜叶部分,并切除茎底端,取芹菜茎用水浸泡5 min后冲洗去除泥土等杂质,之后将芹菜放入超声波清洗机中,80 Hz清洗5 min,取出,用超纯水冲洗。
b)杀菌:根据GB 28233—2020《次氯酸钠发生器卫生要求》中对于次氯酸钠杀菌液在瓜果蔬菜洗清方面的使用方法规定,配制0.01 mg/mL的NaClO溶液1 000 mL,将芹菜浸泡在该溶液中20 min,取出,用超纯水冲洗3遍,吸水纸擦干。
c)漂烫:将杀菌后的芹菜切分成(5±0.5) mm大小的切块。从中取出约15 g,在10 g/L的NaCl溶液中进行漂烫,漂烫结束后立即取出,放入冷水中降温。
d)热风干燥:取漂烫后的芹菜块分散放入鼓风干燥烘箱中。调节温度为75 ℃,烘干4.5 h。干燥结束后用水分测定仪测定其水分含量<6%。符合NY/T 2320—2013《干制蔬菜贮藏导则》中关于干制蔬菜粉的水分含量要求。
e)粉碎:将干燥芹菜块放入粉碎机中粉碎20 s,停滞1 min,重复3次。粉碎过程中控制温度不超过40 ℃,之后过80目筛,锡纸包裹闭光,干燥储存。
f)复水:分别称取干制芹菜粉2.5 g放入烧杯中,用50 mL 100 ℃的纯水冲泡,自然冷却。
1.2.2 脱水芹菜漂烫过程PPO和POD活性的测定
PBS的配制:称取8.943 5 g Na2HPO4粉末于100 mL纯水中溶解,称取16.437 3 g NaH2PO4粉末在150 mL纯水中溶解,取63 mL Na2HPO4溶液以及137 mL NaH2PO4溶液混合配制成0.2 mol/L的pH值为6.5的PBS。
酶液的提取:取杀菌后切分好的鲜芹菜,每份约为15 g,进行漂烫处理,之后采用榨汁机打浆。称取10 g芹菜浆,加入10 mL上述配制的PBS,4 ℃下涡旋3 min,利用冷冻离心机在4 ℃,12 000×g条件下离心15 min,收集上清液用于酶活性测定。
1.2.2.1 PPO活性的测定
取0.2 mol/L pH值为6.5的PBS配制0.07 mol/L的邻苯二酚溶液,取2.5 mL在30 ℃下保温5 min,后加入0.5 mL的芹菜酶提取液,混匀后立即在420 nm处测定吸光度,并记录30 s后吸光值的变化。将鲜芹菜的空白样品酶活性设为100%,其他处理组用残余酶活性表示,具体计算如公式(1)和公式(2)所示[10]。
(1)
(2)
式中:EAPPO为PPO活性,U/(g·min);REAPPO为残余酶活性,U/(g·min);W为样品称取质量,g;t为反应时间,min;Vt为测定时加入的酶提取液量,mL;V0为酶提取液提取总量;ΔA为0 s和30 s的吸光值差值。
1.2.2.2 POD活性的测定
取0.2 mol/L pH值为6.5的PBS配制1%的愈创木酚溶液(体积分数,下同)和1.5%的H2O2溶液(体积分数,下同)。取1%愈创木酚溶液3 mL与2 mL的1.5%H2O2溶液混合,在30 ℃下保温5 min,再与0.8 mL芹菜酶提取液混合,混匀后立即在470 nm处测定吸光度,并记录30 s后吸光值的变化。将未漂烫处理的空白样品的酶活性设为100%,其他处理组用残余酶活性表示,具体计算如公式(3)和公式(4)所示[11]。
(3)
(4)
式中:EAPOD为POD活性,U/(g·min);REAPOD为残余酶活性,U/(g·min);m为样品称取质量,g;t为反应时间,min;Vt为测定时加入酶提取液的量,mL;V0为酶提取液提取总量,mL;ΔA为0 s和30 s的吸光值差值。
1.2.3 HPLC-MS/MS分析
1.2.3.1 七种多酚化合物混合标准溶液配制与样品制备
采用内标法定量,选择大豆苷元作为内标物。首先制备10、20、60、100、200 ng/mL的混标工作液。从不同浓度标准工作液中分别移取1 mL混标溶液入2 mL离心管中,再加入100 ng/mL的大豆苷元10 μL,涡旋1 min,进行测定。以标准化合物的进样浓度为横坐标,各化合物峰面积与大豆苷元峰面积之比为纵坐标绘制标准曲线。
芹菜鲜样在-80 ℃冰箱中预冷8 h后冻干24 h,之后使用粉碎机粉碎冻干芹菜块,过80目筛。取0.25 g冻干粉,料液比1∶100,80%(体积分数)甲醇溶液,超声提取30 min,测定样品中7种多酚含量,每组平行3次。
1.2.3.2 HPLC-MS/MS条件
流动相参数为A相:0.1%甲酸水溶液,B相:甲醇,流速为0.4 mL/min,进样量为10 μL,色谱柱为Aglient Eclipse Plus-C18(4.6 mm×250 mm,5 μm)反相色谱柱。
0~7.5 min时B相50%,7.6~23 min时B相40%,23~24 min时B相40%~90%,24~40 min时B相90%,40~45 min时B相50%。
采用ESI离子源,负离子模式下的多反应检测模式定量。其他质谱参数如表1所示。
表1 多酚化合物的质谱参数
Table 1 Mass spectrometry parameters of polyphenolic compounds
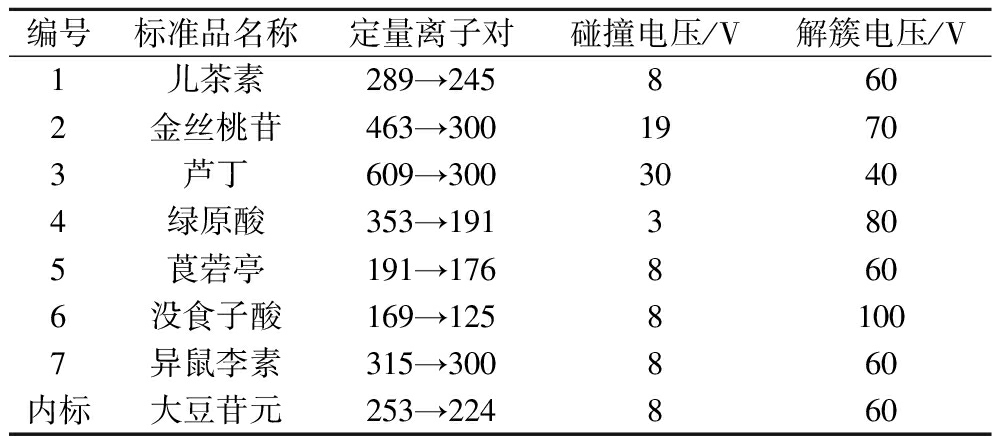
编号标准品名称定量离子对碰撞电压/V解簇电压/V1儿茶素289→2458602金丝桃苷463→30019703芦丁609→30030404绿原酸353→1913805莨菪亭191→1768606没食子酸169→12581007异鼠李素315→300860内标大豆苷元253→224860
1.3 数据处理
数据采用SPSS软件计算标准差,进行方差分析和LSD多重比较分析。对于方差分析,P<0.05表示差异显著,P>0.05表示差异不显著。使用Origin软件进行绘图。
2 结果与分析
2.1 脱水芹菜漂烫过程PPO和POD活性的变化
2.1.1 PPO活性的测定
PPO被认为是褐变的主要原因,它可以催化酚类化合物氧化成为邻苯二酚类化合物,再被氧化成邻醌类化合物,该类化合物聚合反应后会形成深色颜料。除此之外,酶促褐变还会导致异味,最终导致芹菜的营养价值和风味均降低。制备脱水芹菜中的漂烫工艺通常用来杀灭微生物以及灭活酶,向漂烫水中加入适量食盐还可以降低漂烫水中的含氧量,有效减少酶促反应。同时漂烫也会带来一些弊端,比如可能会影响芹菜的色泽、风味、质地和营养价值[12-13]。PPO在不同漂烫时间和温度下酶活性变化趋势见图1,在漂烫30 s后,4种不同温度加热条件下的PPO的酶活性均有显著下降(P<0.01),从85 ℃到100 ℃,残余酶活性分别为26.7%、21.2%、10.2%和6.1%,随着漂烫时间的延长,酶活性继续降低,但下降速率变缓,90 ℃和95 ℃漂烫90 s后酶活性无显著差别(P>0.05),平均酶活性为2.75%,而100 ℃漂烫90 s后酶活性虽已经降低到了0.5%。但此时肉眼可见漂烫后的芹菜块不再呈亮绿色,而有泛黄的趋势,说明此时温度过高或时间过久而导致叶绿素流失较大。
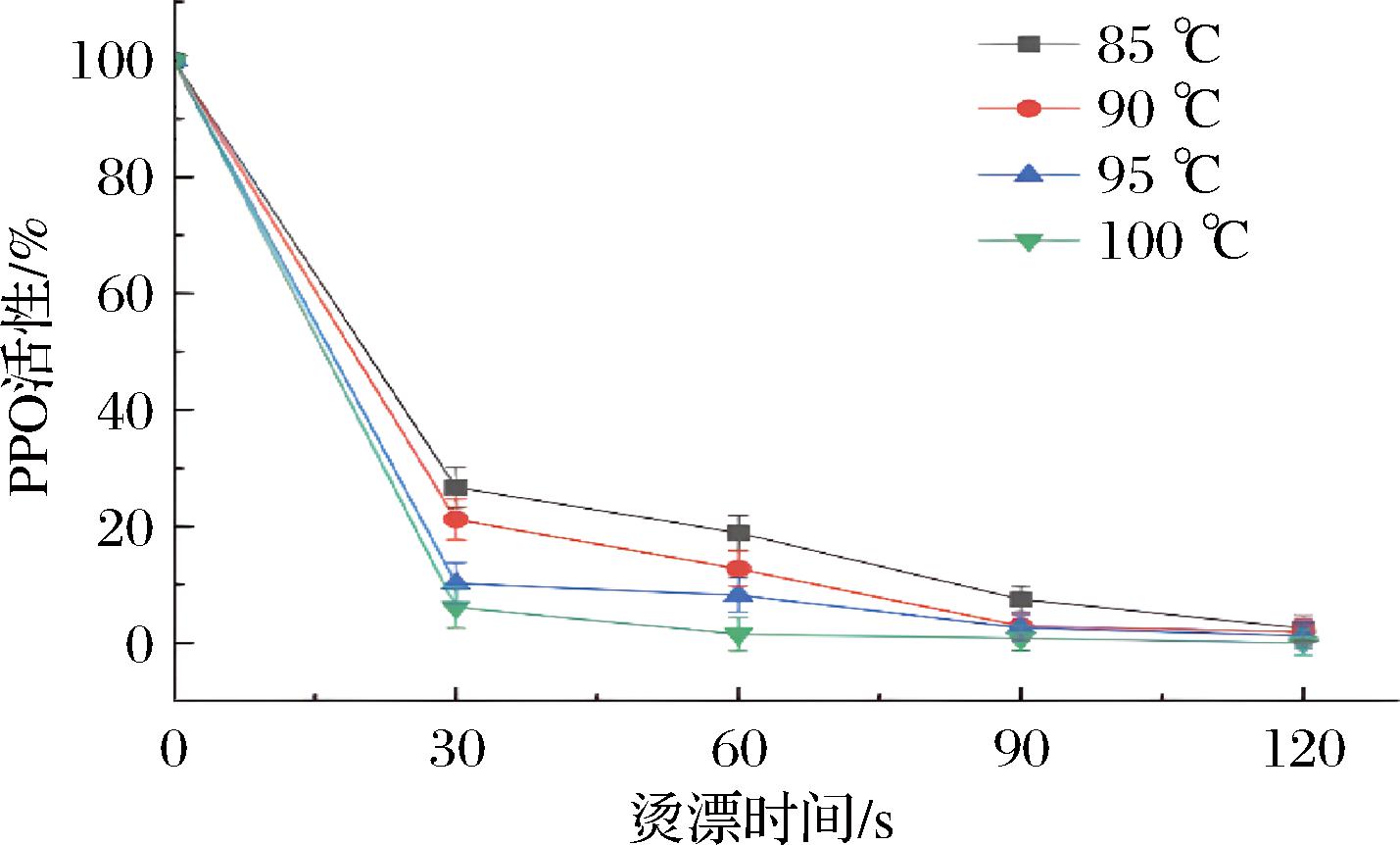
图1 不同漂烫时间和温度下PPO活性
Fig.1 PPO activity at different blanching times and temperatures
2.1.2 POD活性的测定
POD主要以H2O2为电子受体催化底物氧化[14],其在不同漂烫时间和温度下残余酶活性变化趋势见图2。在漂烫30 s后,4种不同温度加热条件下的POD活性均有显著下降,从85 ℃到100 ℃,酶活性分别为41.5%、32.4%、24.6%和3.2%,30~120 s下降速度变缓。85 ℃下漂烫0~90 s酶活性仍有18.6%,直到120 s后下降到3.7%,而更高温度的90 ℃和95 ℃条件下漂烫90 s后酶活性只有原来的2.8%和2.3%,100 ℃下漂烫120 s后酶活性降至0.2%。
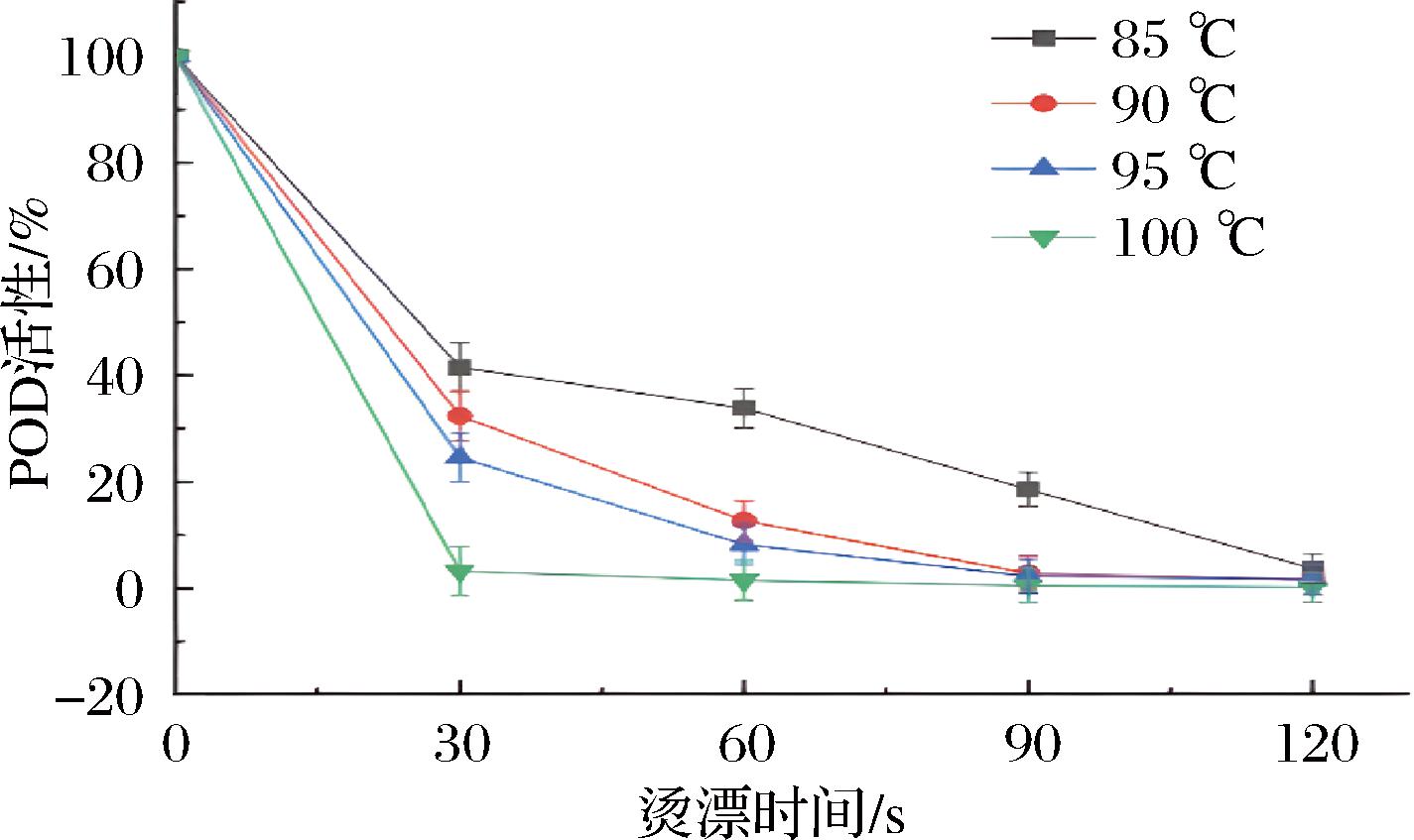
图2 不同漂烫时间和温度下POD的活性
Fig.2 POD activity at different blanching times and temperatures
2.2 脱水芹菜加工及复水过程7种多酚含量变化
2.2.1 七种多酚化合物标准曲线
由表2可得7种多酚化合物的标准曲线方程以及相关参数,其线性关系系数(R2)均大于0.99,线性良好,说明采用的方法适合芹菜中多酚化合物的定量分析。
表2 七种多酚化合物的标准曲线方程
Table 2 Standard calibration equations of seven polyphenol compounds
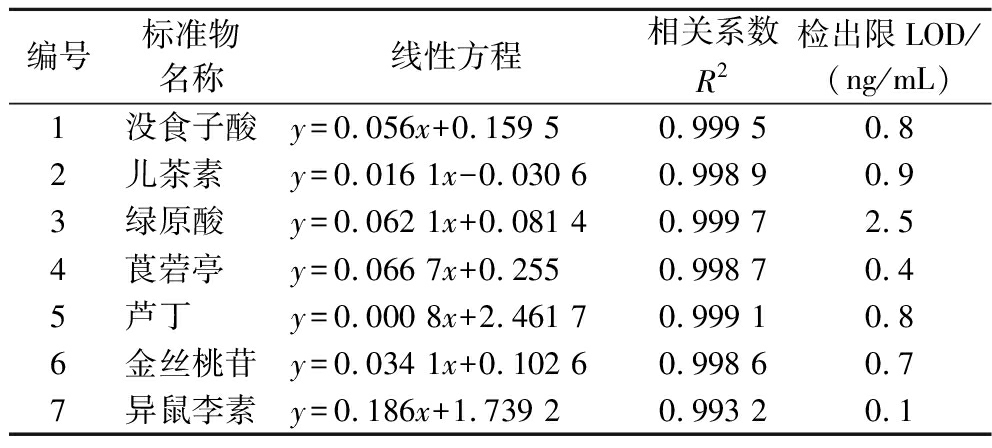
编号标准物名称线性方程相关系数R2检出限LOD/(ng/mL)1没食子酸y=0.056x+0.159 50.999 50.82儿茶素y=0.016 1x-0.030 60.998 90.93绿原酸y=0.062 1x+0.081 40.999 72.54莨菪亭y=0.066 7x+0.2550.998 70.45芦丁y=0.000 8x+2.461 70.999 10.86金丝桃苷y=0.034 1x+0.102 60.998 60.77异鼠李素y=0.186x+1.739 20.993 20.1
2.2.2 超声波清洗和杀菌对芹菜中多酚含量的影响
鲜芹菜在超声波清洗和杀菌后7种多酚含量变化如图3所示,可以得到超声波清洗前后芹菜样品中7种多酚含量没有显著差异(P>0.05),说明5 min超声波清洗可以洗去附着在芹菜茎上的泥渍,同时不会影响芹菜多酚的含量,这可能是因为此时芹菜茎相对完整,超声波时间短,细胞壁没有被破坏,所以多酚几乎没有损失。但杀菌操作会降低多酚的含量,7种多酚含量总和从351.19 ng/mg(新鲜芹菜)减少到348.85 ng/mg,损失率为0.67%,这可能是因为所用NaClO杀菌液可以电离出ClO-,其具有强氧化性,可以通过芹菜茎两端的切面进入芹菜内部并氧化部分多酚化合物。
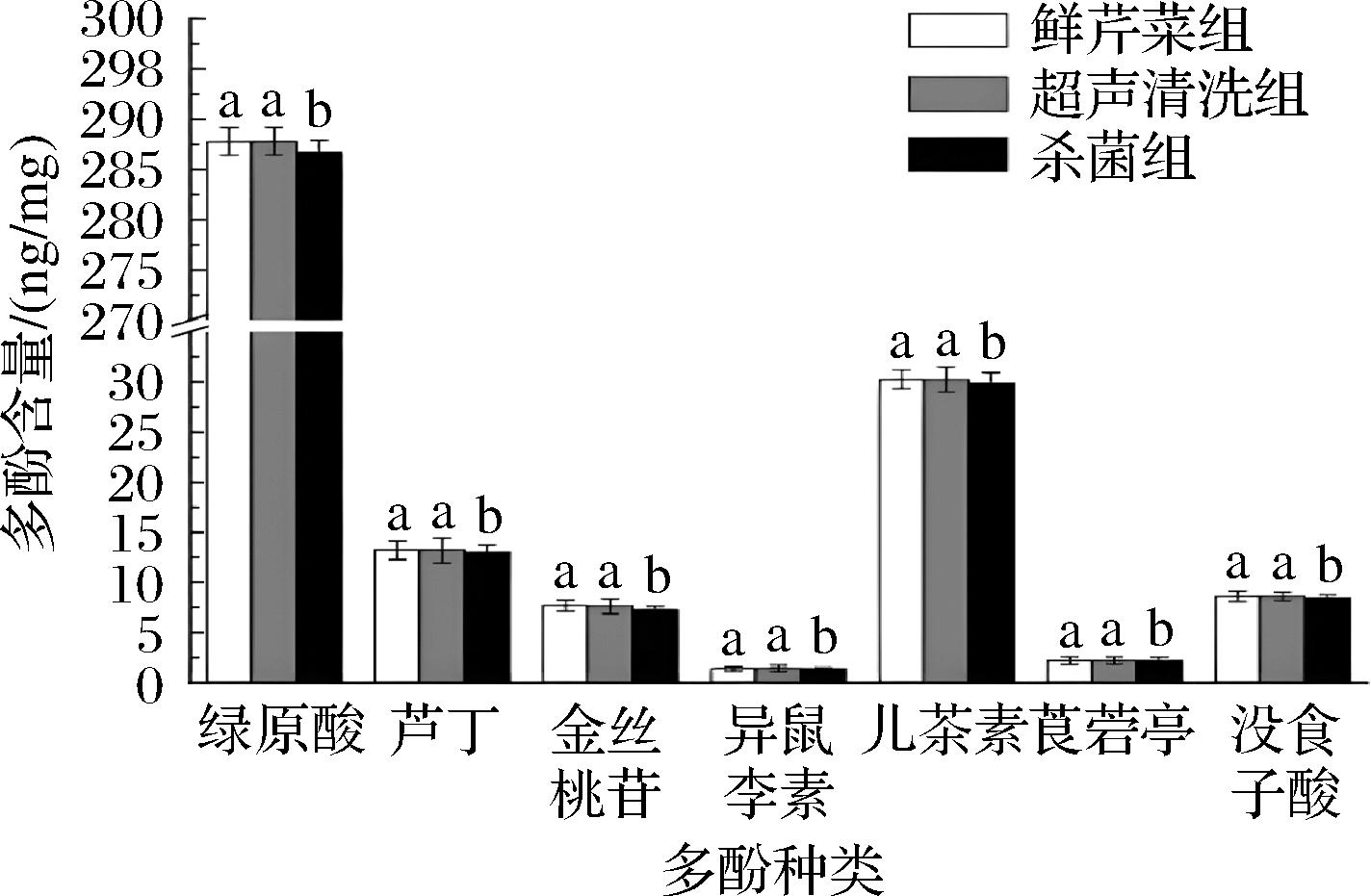
图3 鲜芹菜、超声波清洗和杀菌对芹菜中7种多酚化合物含量影响
Fig.3 Effects of fresh celery, ultrasonication and sterilization on the content of seven polyphenolic compounds in celery
注:不同小写字母表示不同处理下多酚含量有显著性差异(P<0.05)。
2.2.3 不同漂烫温度和时间对芹菜中多酚含量的影响
杀菌后的芹菜经过切分,在85、90、95、100 ℃条件下分别漂烫30、60、90、120 s,测定7种多酚化合物总含量的变化如图4所示。同一漂烫温度下的7种多酚总量随着漂烫时间的延长呈现先上升后下降的趋势。这可能是因为高温不仅可以有效钝酶,还有助于多酚与相结合的化合物如蛋白质,生物碱,多糖等之间的水解,释放出游离态的多酚[10]。同时结合酶活性测定结果,由于漂烫温度越高,PPO和POD活性损失均越大,此时酶活性更低,减少了对多酚的损失,所以在高温条件下多酚含量增加更高。在漂烫后期多酚含量下降可能是因为长时间的高温加热可能会导致植物的细胞结构和亚细胞结构被破坏,导致多酚在漂烫液中进一步溶解及分解,从而使得芹菜中测得的含量下降[15]。当漂烫时间为90 s,温度为85 ℃时,7种多酚的总量达到最大,为399.354 ng/mg,而90 s,90 ℃的漂烫参数下多酚总含量与该值之间无显著性差异(P>0.05)。高温钝酶后PPO和POD活性降低也可保护多酚,减少因酶促氧化导致的损失。结合酶活性和多酚总含量两个因素,当漂烫时间为90 s,温度为85 ℃时,PPO和POD活性分别为7.5%和18.6%;90 s,90 ℃的漂烫参数下2种酶活性分别为2.9%和2.8%,后者的平均酶活性更低。结合较低的酶活性和较高的多酚含量,为更好地保留多酚类物质,最终选择漂烫条件为:90 ℃,漂烫90 s。
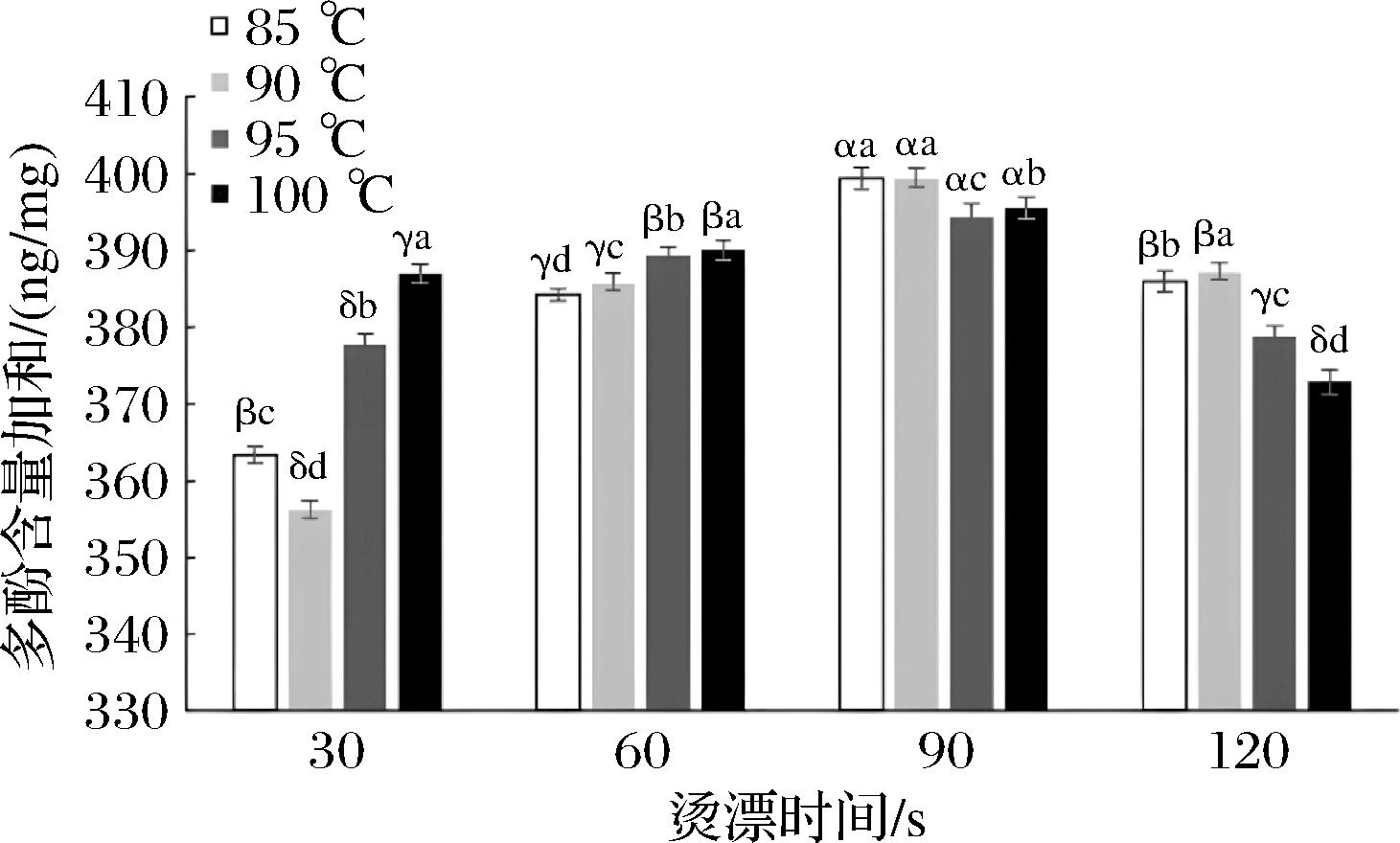
图4 不同漂烫参数下芹菜中7种多酚化合物含量合计
Fig.4 Total content of seven polyphenolic compounds in celery under different blanching parameters
注:不同字母a~d表示不同漂烫温度下有显著性差异(P<0.05),不同字母α~δ表示不同漂烫时间下有显著性差异(P<0.05)。
2.2.4 热风干燥以及复水过程中芹菜多酚含量的变化
将漂烫后的芹菜采用热风方式干燥,粉碎后制得芹菜粉。模拟芹菜粉在食用过程中的热水冲泡,测定其中7种多酚的含量,得到结果如表3所示。可知热风干燥后绿原酸、芦丁、金丝桃苷、莨菪亭和没食子酸分别损失了12.12%、19.70%、26.64%、45.74%和21.3%,儿茶素的损失最大,损失率为100%。异鼠李素的含量变化不显著(P>0.05)。热风干燥复水后绿原酸和芦丁的损失率为1.86%和10.83%,其他化合物的含量变化不显著(P>0.05)。从7种多酚含量加和情况来看,干燥前7种多酚总和为399.23 ng/mg,热风干燥后7种多酚总量损失率为19.46%,是脱水芹菜制造工艺中多酚含量损失的最主要环节。这可能是因为芹菜在热风干燥过程中,较长时间暴露在高温和氧气环境中,多酚不稳定,易被氧化所致[16-19]。脱水芹菜粉在复水使用过程中,多酚总含量损失为2.25%,远低于热风干燥环节的损失率。
表3 干燥和复水条件下的七种多酚含量 单位:ng/mg
Table 3 Content of seven polyphenols under drying and dehydration conditions
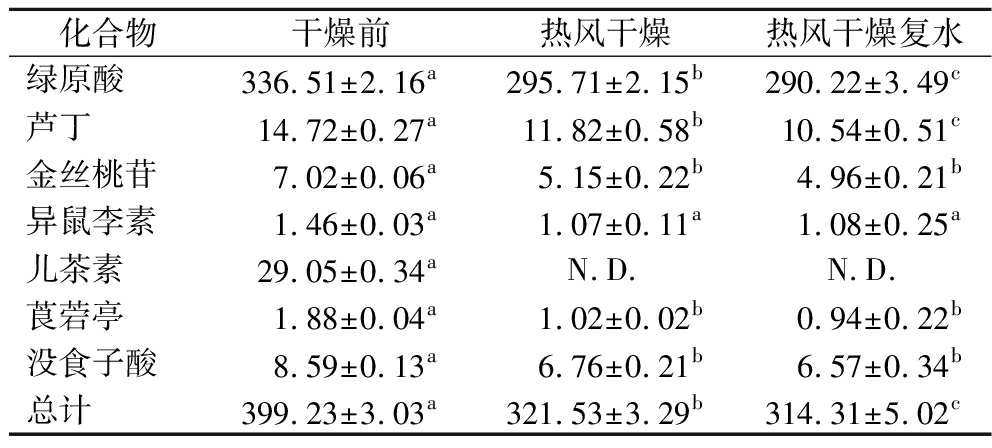
化合物干燥前热风干燥热风干燥复水绿原酸336.51±2.16a295.71±2.15b290.22±3.49c芦丁14.72±0.27a11.82±0.58b10.54±0.51c金丝桃苷7.02±0.06a5.15±0.22b4.96±0.21b异鼠李素1.46±0.03a1.07±0.11a1.08±0.25a儿茶素29.05±0.34aN.D.N.D.莨菪亭1.88±0.04a1.02±0.02b0.94±0.22b没食子酸8.59±0.13a6.76±0.21b6.57±0.34b总计399.23±3.03a321.53±3.29b314.31±5.02c
注:不同字母表示有显著性差异(P<0.05);N.D.表示该化合物含量低于检出限,未检出。
3 结论与讨论
本文围绕脱水芹菜加工工艺对芹菜中7种多酚化合物含量的影响,利用HPLC-MS/MS检测了芹菜分别在鲜样、清洗、杀菌、85、90、95、100 ℃下分别漂烫30、60、90、120 s、热风干燥以及复水条件下芹菜中主要的7种多酚物质绿原酸、芦丁、金丝桃苷、异鼠李素、儿茶素、莨菪亭和没食子酸的含量变化,同时研究了对多酚氧化有影响的PPO和POD在不同漂烫工艺下酶活性的变化。
新鲜芹菜在清洗后多酚含量均无显著差异,说明短时超声清洗不会损失多酚物质;NaClO杀菌后的芹菜中7种多酚含量平均下降了0.67%,说明杀菌过程对芹菜的多酚含量影响较小。漂烫工艺主要作用是钝酶护色,随着漂烫温度增加,7种多酚含量呈现先增加后减小的趋势,同时,漂烫显著降低了酶活性,PPO和POD两种酶的活性均与漂烫温度和时间负相关,综合多酚含量和酶活性两个因素得到最优漂烫参数为90 ℃时漂烫90 s。干燥方式对芹菜中7种多酚含量变化影响具有差异性,热风干燥后多酚总量损失较多,损失率为19.46%。热风干燥复水后总含量损失2.25%,说明复水环节对芹菜粉的多酚损失较小。该研究为脱水芹菜加工过程中工艺参数的优化提供了重要参考。
[1] SOROUR M A.Natural antioxidant changes in fresh and dried celery (Apium graveolens)[J].American Journal of Energy Engineering, 2015, 3(2):12.
[2] SHOJAEI Z A, EBRAHIMI A, SALIMI M.Chemical composition of three ecotypes of wild celery(Kelussia odoratissima)[J].Journal of Herbs, Spices &Medicinal Plants, 2011, 17(1):62-68.
[3] 王辉. 羽衣甘蓝和西芹中膳食纤维与黄酮联合使用对结肠炎的影响与潜在机制探究[D].南昌:南昌大学, 2022.
WANG H.Effect of dietary fiber combined with flavonoids in kale and celery on colitis and its potential mechanism[D].Nanchang:Nanchang University, 2022.
[4] 李薇茹. 芹菜粉的制备和多酚的纯化及活性研究[D].长春:吉林大学, 2019.
LI W R.Preparation of celery powder, purification and activity of polyphenols[D].Changchun:Jilin University, 2019.
[5] 胡萍, 刘凯.芹菜曲奇饼干工艺研究[J].食品工程, 2023(2):26-29.
HU P, LIU K.Study on the technology of celery-flour cookies[J].Food Engineering, 2023(2):26-29.
[6] 徐燕, 张敏, 晁慧梅, 等.芹菜粉对面团性质及面包品质的影响[J].安徽农业大学学报, 2019, 46(4):576-582.
XU Y, ZHANG M, CHAO H M, et al.Effect of celery powder on the dough property and bread quality[J].Journal of Anhui Agricultural University, 2019, 46(4):576-582.
[7] 赵敏, 于辉, 岳凤丽, 等.响应面法优化芹菜粉酥性饼干的加工工艺[J].现代食品, 2018, 24(20):158-162.
ZHAO M, YU H, YUE F L, et al.Optimization of processing technology of celery powder crisp biscuits by response surface methodology[J].Modern Food, 2018, 24(20):158-162.
[8] 华长虹. 一种水芹味香饼及其加工工艺.CN104938563A[P].2015-09-30.
HUA C H.A kind of water celery flavoured cake and its processing technique.CN104938563A[P].2015-09-30.
[9] 华长虹. 一种早餐水芹粉及其加工工艺.CN201510211322.5[P].2015-09-23.
HUA C H.A kind of breakfast water celery powder and its processing technique.CN201510211322.5[P].2015-09-23.
[10] KAISER A, CARLE R, KAMMERER D R.Effects of blanching on polyphenol stability of innovative paste-like parsley (Petroselinum crispum (Mill.) Nym ex A.W.Hill) and marjoram (Origanum majorana L.) products[J].Food Chemistry, 2013, 138(2-3):1648-1656.
[11] 丁皓玥. 超高压复合果蔬泥品质变化及货架期预测研究[D].北京:中国农业大学, 2019.
DING H Y.Study on quality change and shelf life prediction of high hydrostatic pressure composite fruit and vegetable puree[D].Beijing:China Agricultural University, 2019.
[12] 尚红梅, 王雪昭, 潘丹, 等.酶钝化处理对菊苣茎PPO活性和绿原酸含量的影响[J].食品科学, 2014, 35(22):78-83.
SHANG H M, WANG X Z, PAN D, et al.Influence of enzyme inactivation treatments on PPO activity and chlorogenic acid content in Cichorium intybus L.stem[J].Food Science, 2014, 35(22):78-83.
[13] 谢征芸, 谢杨, 庄萌, 等.不同处理方式对余甘子果多酚氧化酶和过氧化物酶活性的影响[J].现代食品, 2019, 25(19):132-137.
XIE Z Y, XIE Y, ZHUANG M, et al.Effects of different treatments on polyphenol oxidase and peroxidase activities in Phyllanthus emblica L[J].Modern Food, 2019, 25(19):132-137.
[14] SAETAN P, USAWAKESMANEE W, SIRIPONGVUTIKORN S.Influence of hot water blanching process on phenolic profile and antioxidant activity of Cinnamomum porrectum herbal tea[J].Functional Foods in Health and Disease, 2016, 6(12):836.
[15] 彭燕. 不同烹饪、配送方法对芹菜感官、营养和功能品质的影响[D].杭州:浙江大学, 2011.
PENG Y.Effects of different cooking and distribution methods on sensory, nutritional and functional quality of celery[D].Hangzhou:Zhejiang University, 2011.
[16] 白喜婷, 朱文学, 廉小梅.杀青和初炒对杜仲绿茶中绿原酸和总黄酮的影响[J].农业机械学报, 2009, 40(1):132-136;142.
BAI X T, ZHU W X, LIAN X M.Effect of fixing and drying process on the chlorogenic acid and total flavonoids contents in Eucommia green tea[J].Transactions of the Chinese Society for Agricultural Machinery, 2009, 40(1):132-136;142.
[17] 诸爱士, 成忠.西芹热风干燥工艺研究[J].浙江科技学院学报, 2006, 18(4):280-285.
ZHU A S, CHENG Z.On drying process of west celery with heated wind[J].Journal of Zhejiang University of Science and Technology, 2006, 18(4):280-285.
[18] 陈玮琦, 郭玉蓉, 张娟, 等.干燥方式对苹果幼果干酚类物质及其抗氧化性的影响[J].食品科学, 2015, 36(5):33-37.
CHEN W Q, GUO Y R, ZHANG J, et al.Effect of drying methods on polyphenol contents and antioxidant activities of unripe apple fruits[J].Food Science, 2015, 36(5):33-37.
[19] KAMILOGLU S, PASLI A A, OZCELIK B, et al.Influence of different processing and storage conditions on in vitro bioaccessibility of polyphenols in black carrot jams and marmalades[J].Food Chemistry, 2015, 186:74-82.