在过去的数十年里,壳聚糖作为一种天然生物聚合物,以其在各个领域应用的广泛研究而进入了黄金时代。几丁质和壳聚糖的化学结构与纤维素非常相似,如图1所示。几丁质是一种由n-乙酰-D-氨基葡萄糖残基组成的线性1,4链聚合物[1]。在几丁质和壳聚糖的分子结构中,类似于纤维素的羟基位置,它们分别含有乙酰胺基和氨基,而壳聚糖是几丁质的n-去乙酰化衍生物,通过将乙酰胺基团转化为氨基得到[2]。
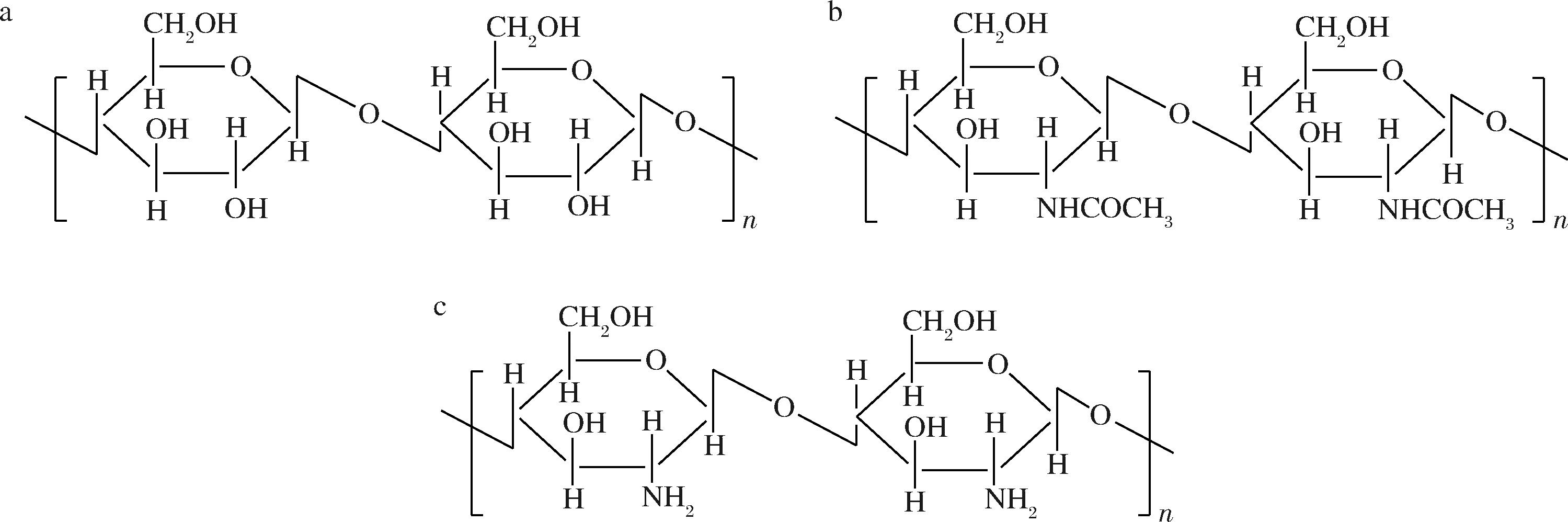
a-纤维素;b-几丁质;c-壳聚糖
图1 纤维素、几丁质和壳聚糖化学结构[3]
Fig.1 Chemical structure of cellulose, chitin and chitosan[3]
壳聚糖具有卓越的生物可降解性、生物相容性和抗菌活性[4],还具有中低分子质量和较高的生物活性[5]等特性,这些特性使得它在众多工业领域中得以广泛应用,壳聚糖的多种特性受到壳聚糖的分子质量(molecular weight, MW)和脱乙酰度(degree of deacetylation, DD)的影响[6],壳聚糖的应用主要取决于其脱乙酰度、分子质量和外观等特性[7]。市售壳聚糖的脱乙酰度一般达到或超过80%[8]。壳聚糖中存在氨基和羟基,使壳聚糖具有一定的络合能力,可以处理废水中的重金属[9]、有机化合物以及用于饮料的澄清[10]。它可以加工成多种形式,例如片剂、薄膜甚至还可以加工成线、微粒/纳米颗粒[4],这使得壳聚糖不仅可以用于各种食品[11]、农业[12]还可以应用于医疗和制药[13]。壳聚糖在生物医学领域具有广阔的前景特别是伤口愈合的应用以及作为生物治疗药物的载体[14],在食品领域使用还可以作为原料使用[4]。在农业领域,可以利用其对农用工业基质进行开发、创新和产生绿色技术[15]。
全球工业分析公司估计到2030年壳聚糖市场规模预计将达到249亿美元,在2022年至2030年期间以15.3%的复合年增长率增长[16]。中国预计将以14.2%的复合年增长率增长,预计到2030年市场规模将达到41亿美元。这一增长估计归因于这些聚合物在各个领域的应用不断增加。
传统上,几丁质和壳聚糖的商业供应依赖于甲壳类废弃物作为提取来源[17],然而,随着日本核废水排放的影响,会对海洋甲壳类生物造成生理损害、繁殖障碍和行为异常[18],这促使人们寻找替代来源。真菌细胞壁中的几丁质和壳聚糖的发现,为几丁质和壳聚糖的持续高效且绿色的提取开拓新的前景,因为它们不含致敏物质,产生的废物较少。此外传统几丁质和壳聚糖具有不稳定特性,而真菌生产不受季节的影响,可以精确地控制过程,从而获得更均匀的产品特性。本综述简要介绍了真菌壳聚糖生产菌和真菌壳聚糖的绿色提取、真菌培养因素对产量的影响以及提取真菌壳聚糖方法等,为提高真菌壳聚糖产量、降低生产成本提供了参考。
1 壳聚糖的来源及生产工艺
壳聚糖可以从各类的自然资源中提取,如海洋甲壳类动物、昆虫、无脊椎动物或软体动物、藻类和某些真菌[19]。目前,几丁质和壳聚糖的主要工业来源是海洋甲壳类动物[20]。这些海洋甲壳类动物的壳中几丁质占壳质量的13%~42%,蛋白质占30%~40%,矿物盐占30%~50%[21]。海洋甲壳类动物提取几丁质和壳聚糖大部分是通过脱矿、脱蛋白、脱色和脱乙酰4个步骤(图2)。这些步骤需要消耗大量的化学品,会导致严重的环境污染[22]。除了化学法,还可以利用微生物和酶进行生物提取几丁质[23],生物提取几丁质具有重复性高、操作简便、溶剂消耗少、能量投入低等优点,但是也存在耗时长、效率低、脱蛋白不充分等缺点,目前仅限于实验室规模的研究[23]。
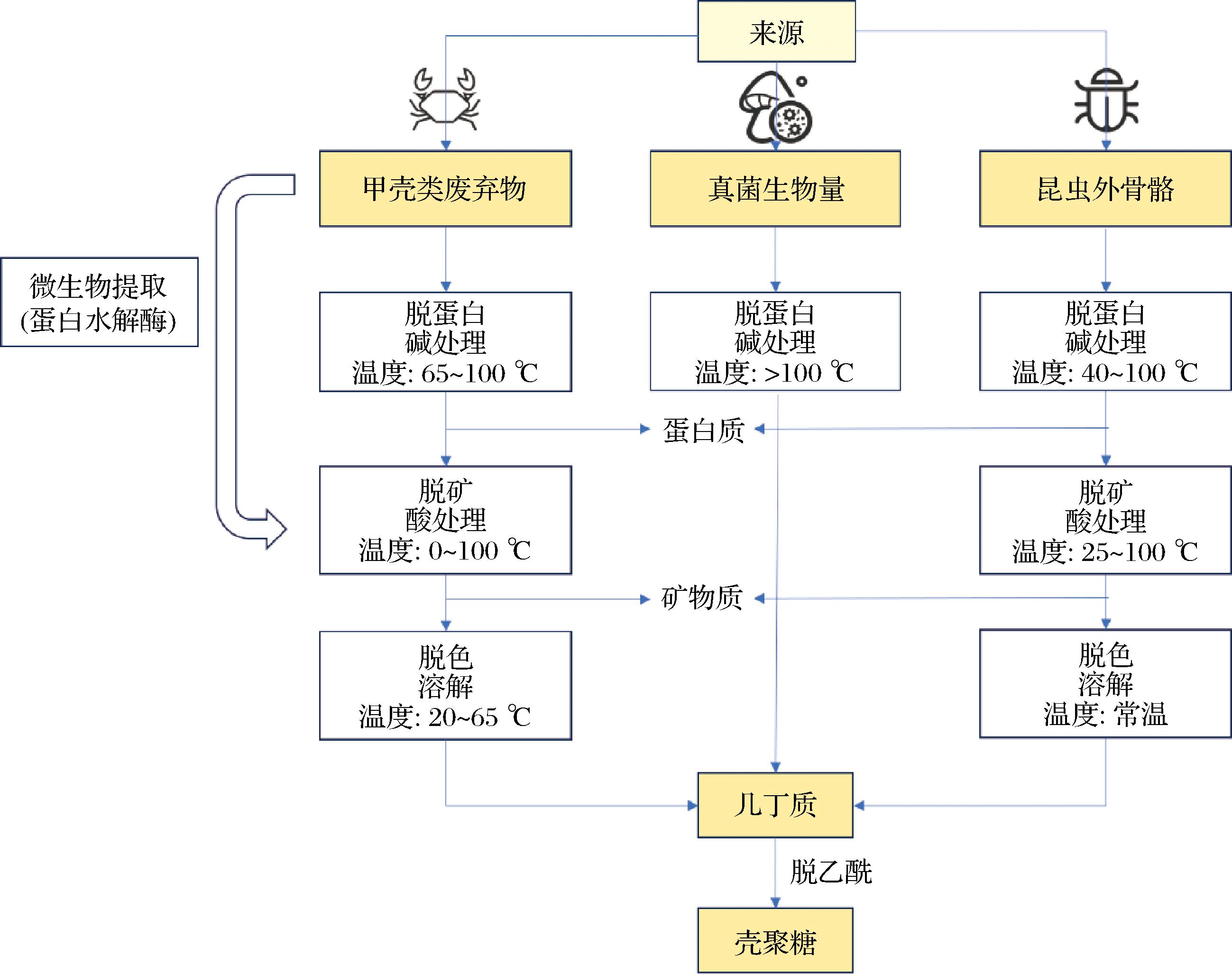
图2 从甲壳类、真菌和昆虫中提取甲壳素和壳聚糖的方法[19]
Fig.2 Methods for extracting chitin and chitosan from crustaceans, fungi, and insects [19]
昆虫外骨骼主要成分之一是几丁质和壳聚糖,昆虫很可能是一种非常有前途的几丁质和壳聚糖的提取来源[24],但昆虫外骨骼较为复杂,提取几丁质和壳聚糖需要更严格的步骤(图2)。几丁质和壳聚糖是真菌细胞壁的组成部分,通过在合适的培养基上培养真菌,可以获得大量的壳聚糖,这些培养基很可能来自食品加工业的残留物以及有机残留物。与现有的甲壳素和壳聚糖生产方法相比,该方法(图2)更有经济性和环保性[25],并且真菌壳聚糖拥有更好的生物特性。
真菌提取壳聚糖相较于传统的海洋甲壳类动物来源的壳聚糖具有显著的经济优势,真菌壳聚糖生产可以采用废弃物作为基质,大大降低了原料成本,提高了生产的经济可行性,利用废弃物资源不仅能够减少生产成本,还符合环保理念。真菌在培养基中能够利用多种廉价碳源和氮源,如农业废弃物,玉米浆[26],玉米湿磨作业[27]等;工业废弃物,如乳制品工业的主要副产品乳清[28],制糖业的主要副产品糖蜜[28]等废弃物材料,还可以使用造纸厂废水[29],木薯废水[27]作为液体生产介质。这些废弃物与传统的昂贵有机源相比,使成本更为可控。
海洋甲壳类壳聚糖中含有原肌球蛋白、肌球蛋白轻链和精氨酸激酶[30]以及致敏虾蛋白[5],这些容易引起过敏反应,而真菌壳聚糖不含这些,不容易引起过敏反应。真菌与海洋甲壳类动物来源相比,真菌含有与几丁质相关的低水平矿物杂质,故几丁质的提取条件更为温和,可以降低提取成本,并限制天然几丁质化学结构的降解[30],而海洋甲壳类壳聚糖则需要通过强酸强碱高温提取,通过这些处理获得的壳聚糖存在一些不一致的脱乙酰度和不一致的高分子质量,这导致了不同的物理化学特性[31],而真菌在受控条件下提取真菌壳聚糖更容易具有一致性[31]。真菌壳聚糖还拥有特有的抑菌特性。例如AFROZ等[32]研究发现酿酒葡萄球菌壳聚糖对金黄色葡萄球菌具有良好的抑菌性能。同样,TAJDINI等[33]的研究发现纯化后的真菌壳聚糖对大肠杆菌、铜绿假单胞菌、白色念珠菌和光秃念珠菌的抑菌和抑菌活性均优于海洋甲壳类壳聚糖。表1总结了不同来源壳聚糖特性[4,34]。
表1 不同来源壳聚糖特性比较
Table 1 Comparison of characteristics of chitosan from different sources

特性虾蟹壳来源昆虫外骨骼来源真菌来源几丁质含量13%~42%2.5%~20%30%~35%聚合度高中等中低原材料供应季节性和地域性限制,受渔业产量影响供应量较大,受物种多样性影响没有季节性和地域性限制,可通过发酵生产经济因素工业生产已建立,提取成本较低工业化生产成本较高,尚未广泛应用生产成本较高,但具备较大的环境和经济效益潜力化学处理需消耗大量强酸强碱,过程耗时且能耗较大需消耗酸碱,但过程较为温和生产过程相对清洁,不需要大量酸碱,能耗相对较低材料性质壳聚糖分子质量高,应用范围窄壳聚糖分子质量中等,应用范围较广壳聚糖分子质量为中低,应用范围广生物相容性生物相容性一般,取决于提取和处理方法生物相容性好,但仍需进一步研究和验证生物相容性好,适用于一些高端技术和医学应用环保性处理过程中会产生大量化学废物处理过程较为环保,但仍需消耗一定量的化学试剂处理过程环保,需要消耗少量化学试剂
2 真菌发酵生产壳聚糖的研究进展
2.1 真菌壳聚糖的一般来源情况
几丁质和壳聚糖广泛分布于许多种类的真菌中,真菌几丁质和壳聚糖是菌丝、茎和孢子的结构膜和细胞壁的组成部分[20]。在工业规模上,丝状真菌被认为是壳聚糖和几丁质的可靠来源,因为它可以在受控条件下生产[4]。丝状真菌在其细胞壁中合成天然壳聚糖,通过酶解几丁质链(糖链的修饰)去乙酰化产生[27]。ABD ELSOUD等[20]和DE SOUZA等[27]指出许多真菌种类已被研究用于生产几丁质和壳聚糖。包括Saccharomyces[32]、Penicillium[29,35]、Rhizopus[28, 36]、Absidia[37-38]、Aspergillus[8, 39]、Mucor[33, 40-41]、Rhizomucor[33]、Hericium[42]、Actinomucor[43]、Accimonueor[44]等。真菌提取壳聚糖的产量从2.0%到20.93%不等,这取决于各种变量,如真菌菌株、发酵过程、温度和培养基组成[5]。
SEBASTIAN等[25]的研究中发现在甲壳类动物,昆虫和真菌中遵循相同的一组反应,反应途径如下:葡萄糖-6-磷酸(glucose 6-phosphate, G6P)首先通过己糖激酶反应转化为果糖-6-磷酸(fructose 6-phosphate, F6P),随后在谷氨酰胺的协助下,F6P进一步转化为葡萄胺-6-磷酸(glucamine-6-phosphate, GA6P)。在乙酰辅酶A的存在下,GA6P被转化为N-乙酰葡糖胺-6-磷酸。一种变异酶促进N-乙酰葡糖胺-6-磷酸转化为N-乙酰葡糖胺-1-磷酸。利用尿苷三磷酸(glucamine-6-phosphate, UTP),尿苷二磷酸-N-乙酰葡糖胺被形成。最后几丁质合成酶参与了几丁质的去乙酰化过程,从而形成壳聚糖,如图3所示。

图3 几丁质的生物合成途径[21]
Fig.3 Biosynthetic pathways of chitin[21]
注:Trehalose,海藻糖;Trehalase,海藻糖酶;Glucose,葡萄糖;Glucose Kinase,葡萄糖激酶;Glucose 6-phosphate,葡萄糖-6-磷酸;Glucose 6-phosphate isomerase,葡萄糖-6-磷酸异构酶;Fructose 6-phosphate,果糖-6-磷酸;Fructose 6-phosphate aminotransferase,果糖-6-磷酸氨基转移酶;Glucosamine 6-phosphate,氨基葡萄糖-6-磷酸;Glucosamine 6-phosphate-N-acetyltransferase,氨基葡萄糖-6-磷酸-N-乙酰转移酶;N-acetyl glucosamine 6-phosphate,N-乙酰葡糖胺-6-磷酸;Phosphoacetylglucosamine mutase,磷酸乙酰氨基葡糖变位酶;N-acetyl glucosamine 1-phosphate,N-乙酰葡糖胺-1-磷酸;Pyrophosphorylase transferase,焦磷酸化酶转移酶;UDP-N-acetyl glucosamine,尿苷二磷酸-N-乙酰葡糖胺;Chitin synthetase,甲壳素合成酶;Chitin,几丁质。
如表2所示,真菌几丁质含量最高,真菌细胞壁中含有大量的几丁质和壳聚糖,尤其是接合菌类(Zygomycetes)中壳聚糖含量更为丰富。真菌壳聚糖的合成主要通过几丁质合成和几丁质去乙酰化来实现。几丁质的合成始于尿苷二磷酸-N-乙酰葡糖胺(UDP-GlcNAc)的聚合,这一过程由几丁质合成酶(chitin synthase)催化进行。几丁质合成酶通过将UDP-GlcNAc添加到几丁质链上,使其不断延伸。几丁质合成酶存在于细胞内特定的亚细胞器——几丁质体(chitosome)中,这些几丁质体将几丁质链转运到细胞壁中。几丁质合成后,几丁质去乙酰酶(chitin deacetylase,CDA)作用于未结晶化的几丁质,将其去乙酰化生成壳聚糖。需要注意的是,几丁质去乙酰酶只对未结晶化的几丁质有效,对结晶态几丁质无效。在接合菌类中,几丁质合成酶和去乙酰酶的串联作用,使得较大比例的几丁质被转化为壳聚糖,这也是接合菌类壳聚糖含量较高的原因[25]。
表2 真菌提取几丁质和壳聚糖菌种
Table 2 Chitin and chitosan strains were extracted from fungi
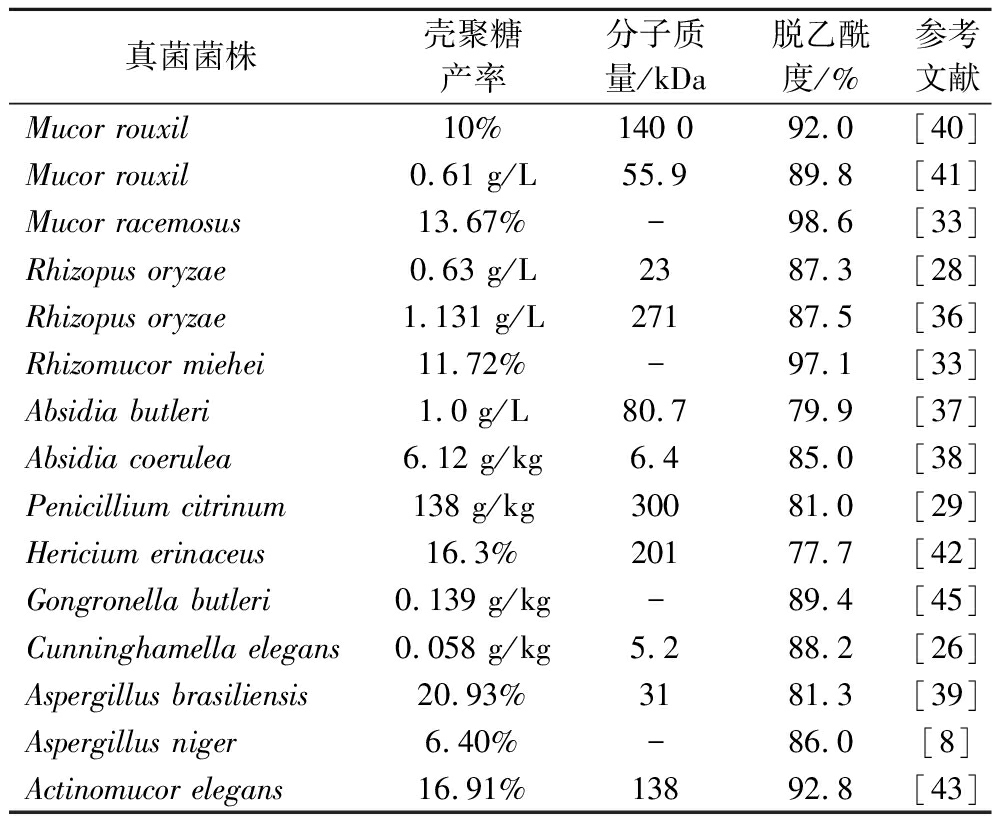
真菌菌株壳聚糖产率分子质量/kDa脱乙酰度/%参考文献Mucor rouxil10%140 092.0[40]Mucor rouxil0.61 g/L55.989.8[41]Mucor racemosus13.67%-98.6[33]Rhizopus oryzae0.63 g/L2387.3[28]Rhizopus oryzae1.131 g/L27187.5[36]Rhizomucor miehei11.72%-97.1[33]Absidia butleri1.0 g/L80.779.9[37]Absidia coerulea6.12 g/kg6.485.0[38]Penicillium citrinum138 g/kg30081.0[29]Hericium erinaceus16.3%20177.7[42]Gongronella butleri 0.139 g/kg-89.4[45]Cunninghamella elegans0.058 g/kg5.288.2[26]Aspergillus brasiliensis 20.93%3181.3[39]Aspergillus niger6.40%-86.0[8]Actinomucor elegans16.91%13892.8[43]
注:-表示文献中未提供相关数据。
2.2 提高真菌壳聚糖产率的研究进展
真菌几丁质和壳聚糖的生产水平可以通过增加生物质产量或增加其在细胞壁中的含量来实现。真菌的菌株、培养方法和培养参数均与这一目标相关,不仅影响壳聚糖的生产,还影响其物理化学性质[7]。为了增加真菌细胞壁中壳聚糖的比例,研究人员除了更改这些参数,还进行了多种菌种选育尝试。ISLAM等[46]通过紫外线诱变提高了CDA活性,诱变后的菌株壳聚糖提取量和CDA活性均是野生型菌株的两倍,许多专利涉及通过代谢工程提高真菌中壳聚糖生产的研究[46]。例如,通过突变几丁质合酶、谷氨酰胺-果糖-6-磷酸氨基转移酶(glutamino-fructose-6-phosphate aminotransferase, GFA)和CDA基因,以提高细胞内几丁质的生产,并改善酶的催化潜力和底物特异性,但要分离出具有商业可行性的真菌菌株仍比较困难。
2.2.1 真菌形态
真菌中的不同形态对几丁质和壳聚糖的生产有着深远的影响,ABASIAN等[22]在研究中发现真菌以丝状形态产生的几丁质和壳聚糖远大于其他形态。VEITER等[47]研究发现有些菌株有明显的形成球团的倾向,而增大的球团直径可能导致生长下降,因为向球团最内部传递的质量减少了。DE SOUZA等[27]研究发现,真菌形态不仅受到初始孢子浓度、糖浓度和大气因素等因素和机制影响外,还受到某些化合物添加的影响。KARAHALIL等[48]发现添加无机盐如NaCl和KCl也有助于控制真菌形态,可以通过这些因素的影响,将真菌形态变换成有利于提取几丁质和壳聚糖的形态模式。
2.2.2 培养基构成
尽管真菌壳聚糖有众多优势且真菌提取壳聚糖在技术上具有可行性,但其生产成本较高,成为推广应用的主要障碍之一。真菌生产壳聚糖使用的培养基和营养物质成本较高,特别是碳源和氮源。降低这些生产成本成为提高真菌壳聚糖经济性的重要途径,出于这个原因,一些研究调查了从废物中提取的廉价碳源和氮源的开发,以降低生产成本[28,48]。CHATTERJEE等[41]以制糖业的副产品糖蜜,作为一种廉价的碳源来构建培养基。当使用糖蜜盐培养基时,他们能够获得0.6 g/L的壳聚糖,并且发现这样得到的壳聚糖的多分散性较低,更具结晶性。后续CHATTERJEE等[28]不仅利用糖蜜作为廉价碳源,还使用食品加工副产物乳清来作为廉价碳源构建培养基,同样也得出了乳清壳聚糖的多分散性较低,具有较多的水合多晶和松散的晶体堆积。从而使他们对外界试剂的暴露程度高,反应性更强,这对特定的药物递送应用是有利的。BERGER等[49]利用玉米浆和糖蜜作为廉价碳氮源构建培养基来培养真菌来提取真菌壳聚糖,实验结果表明其可行性,并且发现提取的壳聚糖对某些致病菌有抗菌作用。
除了研究食品加工业的几种副产品作为生产壳聚糖的培养基,还可以将一些工业有机废水作为真菌壳聚糖生产的介质。如ABO ELSOUD等[20]以玉米浸泡液(corn steep liquor, CSL)和木薯废水(cassava wastewater, CWW)为碳氮源来构建培养基,较高浓度的CSL和较低浓度的CWW对菌株的生长有显著的促进作用,真菌壳聚糖产量最高达到0.449 g/kg,实验证明CSL和CWW的培养基组合是经济可行。DZURENDOVA等[50]研究发现,以酵母浸膏为氮源时,真菌的生物量产量几乎是其他菌株的2倍,这是因为酵母浸膏不仅仅是一种普通的氮源,酵母提取物还包含有微生物生长所必需的多种维生素,矿物质等微量元素[51]。SINGH等[52]研究发现有机氮源和无机氮源混合使用对真菌的生长有协同效应,能促进菌丝体的生长和提高壳聚糖产率,这是因为真菌的营养模式有关。JIANG等[53]研究不同的氮源对提取真菌壳聚糖的影响,发现以豆渣作为氮源其壳聚糖产量最高,达到3.14 g/L。实验中还发现细胞干重和壳聚糖产量随着氮源浓度的增加而增加,但当氮源过量时,细胞干重和壳聚糖产量下降。HABIBI等[54]还研究苹果渣作为廉价碳源的可行性。
除了碳氮源对真菌的生长以及后续的几丁质-壳聚糖提取可能有影响,pH的影响也是不可忽视的,DZURENDOVA等[50]研究中发现在生产介质为酸性的时候真菌细胞壁的几丁质会过量生产,这是因为一些真菌菌株激活了抗酸性胁迫的保护机制,导致细胞壁中几丁质和壳聚糖的产生增加,但RANE等[34]发现在较低的pH值下乙酰化程度较高,但pH对几丁质和壳聚糖产率没有十分显著的影响。
微量元素也是影响真菌生长和存活的重要因素之一。SAFAEI等[51]不仅发现磷酸盐的存在对细胞的生长有积极影响,而且发现微量金属元素会提高壳聚糖的产率。JAWORSKA等[55]发现培养基中添加Mn2+和Fe2+壳聚糖产量增加,这与生物量的增加有关,而Co2+则会抑制真菌的生长,但是在RANE等[34]实验中观察到,添加0.5 mg Co/100 mL培养基可使壳聚糖收率提高20%,但超过此水平后壳聚糖收率下降,同样实验中发现添加矿物质的培养基比未添加的培养基产生的壳聚糖最多。除了添加微量元素之外,TEJAS等[29]还发现添加低水平醋酸也可以使壳聚糖的产率提高。CHATTERJEE等[36]发现真菌发酵生产壳聚糖的过程中,添加某些植物生长激素,不仅能增加菌丝生长,还能提高壳聚糖的产量,脱乙酰度基本没有影响而且不同植物激素产生的脱乙酰度大致相同,但平均分子质量有所提高了,赤霉素酸的增强作用是最大的,还发现高剂量的激素对菌丝生长和壳聚糖含量均有抑制作用。
2.2.3 培养时间
真菌细胞壁与真菌的生长过程明显相关,几丁质和壳聚糖富含在真菌细胞壁中。CRESTINI等[56]发现壳聚糖产量在对数生长期时是最大的,而后缓慢下降,同样,SINGH等[52]发现壳聚糖的含量最高的阶段与真菌生长期的最高点基本重合,这是因为新生的壳聚糖主要在真菌的生长期合成,而在真菌生长期过后,壳聚糖产率则下降,可能是壳聚糖难以提取[57]或者壳聚糖含量的下降。大部分真菌最大几丁质和壳聚糖都在生物量峰值,随后保持平稳。HABIBI等[54]发现这可能是由于生长介质中的养分耗尽所致。RANE等[34]则认为是因为壳聚糖没有锚定在细胞壁上,也有可能是壳聚糖酶在细胞壁内分解壳聚糖,故普遍认为生长后期是最佳提取壳聚糖时间。
2.2.4 发酵工艺优化
真菌壳聚糖产率不仅受真菌形态,生长培养基和培养时间影响,还受到发酵工艺的影响。尽管在固态发酵中进行了多种壳聚糖生产工艺,但大多数研究主要依赖于液体深层发酵。
固态发酵通过真菌在固体基质上生长来生产壳聚糖,主要使用天然存在的基质,如小麦和水稻秸秆、大豆残渣、硬木锯末、红薯块、马铃薯片加工废弃物和棉籽壳等[34]。固态发酵具有经济可持续、高产量等优点[34]。例如,固态发酵在一些情况下能够实现基质干重的壳聚糖产量从1.6~17 g/kg不等;某些基质如马铃薯废料培养的Absidia coerulea能够直接生产低分子质量壳聚糖,适合农业和生物医学应用[34]。然而,固态发酵也存在基质异质性带来的质量转移限制、工艺控制难度大和真菌生物质回收困难等问题[34]。
相比固态发酵,液体浸没发酵在壳聚糖生产中更为普遍,主要是因为其在工艺参数控制、规模化生产和生物质回收方面具有显著优势[20]。液体发酵中使用的培养基主要分为合成培养基和废弃物培养基两类。在合成培养基中,研究表明Absidia属的菌株在壳聚糖生产中表现尤为出色[58]。为了优化液体发酵工艺,研究人员采用了多种策略,包括改良反应器设计、控制pH值和补充无机物。例如,用双网引水管改造的气升式反应器中,提高了氧气转移效率和壳聚糖产量[48]。
除了固态发酵和液体浸没发酵相关发酵工艺的优化,不少研究人员还提出通过数学模型来提高壳聚糖产率,如HABIBI等[54]通过面心中央复合设计实验,统计研究了温度、初始pH值和硝酸铵浓度对壳聚糖与底物产量比、壳聚糖与真菌生物量产量比以及真菌生物量与底物产量比的影响。除了单单研究单个产品,近几年来,多种增值产品联合生产的新趋势已经出现,以降低工艺成本,并能够与化学工艺竞争。比如ABO ELSOUD等[20]研究了柠檬酸、乳酸、草酸和酒精与各种真菌来源的几丁质联合生产过程。合作生产过程的优化是非常复杂的;因此,在这种情况下,传统的方法是不适用的,而统计方法将是有益的,并给出稳定可靠的结果。
2.3 真菌壳聚糖的提取方法
现在市场上销售的壳聚糖大部分是海洋甲壳类动物提取的壳聚糖,海洋类甲壳类动物壳聚糖提取的方法通常包括以下3个步骤[20]:脱矿/脱钙、脱蛋白、脱乙酰。在脱矿步骤中,碳酸钙被去除,而蛋白质在脱蛋白过程中被去除。脱矿和脱蛋白过程可以通过化学或酶处理来完成[59],但酶法提取是使用纯化酶,成本昂贵,且耗时[59]。与海洋甲壳动物相比,真菌几丁质的无机物含量较低,故不使用脱矿/脱钙处理,真菌提取壳聚糖的其他步骤和海洋类甲壳动物相似。真菌提取壳聚糖通常使用碱处理真菌,去除蛋白质脂质和碱性可溶性碳水化合物,并将真菌生物质中的壳聚糖保留在碱不溶性物质(alkali-insoluble material, AIM)中。然后将AIM用酸溶液处理,使壳聚糖溶解于酸性溶液中。随后用碱溶液将溶液的pH调至碱性,壳聚糖从溶液中沉淀出来。最后将沉淀的壳聚糖洗涤、干燥[60]。以下介绍3种不同的提取壳聚糖方法(表3)。
表3 壳聚糖提取方法
Table 3 Chitosan extraction methods
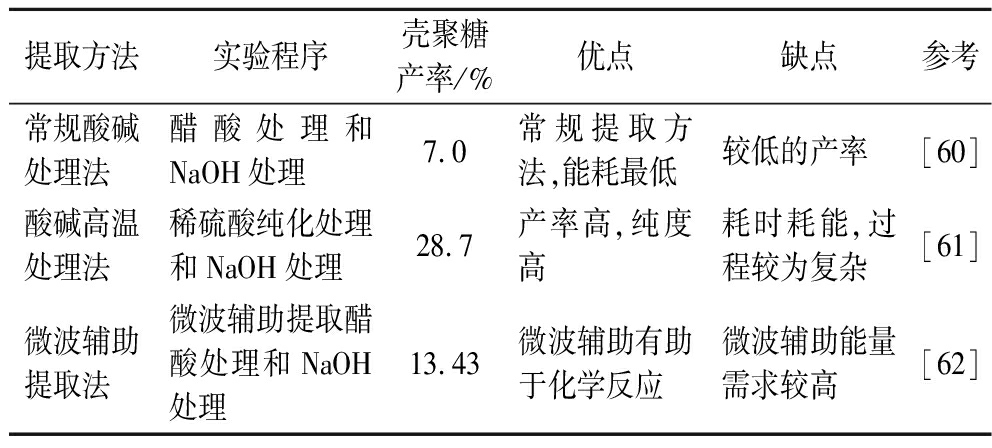
提取方法实验程序壳聚糖产率/%优点缺点参考常规酸碱处理法醋酸处理和NaOH处理7.0 常规提取方法,能耗最低较低的产率[60]酸碱高温处理法稀硫酸纯化处理和NaOH处理28.7产率高,纯度高耗时耗能,过程较为复杂[61]微波辅助提取法微波辅助提取醋酸处理和NaOH处理13.43微波辅助有助于化学反应微波辅助能量需求较高[62]
2.3.1 常规酸碱处理法
方法1是根据ABDEL-GAWAD等[60]的研究,采用常规酸碱法提取真菌性壳聚糖。这是文献中最常用的提取真菌性壳聚糖的方法,可获得良好的壳聚糖得率,该方法壳聚糖产率为7.0%(质量分数)。
首先将磨碎的真菌菌丝加入1 mol/L NaOH溶液,并在100 ℃下处理1 h。在6 000 r/min离心15 min后收集AIM,用蒸馏水洗涤离心至pH为中性。洗涤后得到的AIM进一步在10%的醋酸溶液在旋转摇床(室温)上提取6 h,然后将酸不溶性残留物真空过滤掉。用4 mol/L NaOH溶液调节滤液pH值至9.0,将沉淀的壳聚糖用蒸馏水洗涤,在60 ℃下干燥至恒重[60]。
2.3.2 酸碱高温处理法
大多数提取方法采用NaOH和醋酸相结合的组合,方法2是ZAMANI等[61]开发的方法,涉及使用NaOH和H2SO4结合处理。在这种提取方法中,用强矿物酸处理真菌生物量后,通过低温沉淀回收壳聚糖,该方法能获得纯化分子质量完整的真菌壳聚糖。壳聚糖得率为28.7%(质量分数)。
首先将磨碎的真菌菌丝放入0.5 mol/L NaOH溶液中,在120 ℃下处理20 min,随后得到AIM,AIM过滤分离,用蒸馏水洗涤直至中性,然后将AIM冷冻干燥并在室温下保存。对AIM进行两步处理,首先使用72 mmol/L的硫酸在室温下处理10 min后,将混合物离心洗涤并收集沉淀物。再将沉淀物在72 mmol/L的硫酸中,在120 ℃下处理45 min后热过滤并在冰上冷却,滤液中加入150 mmol/L NaOH溶液30 mL,调节pH值为8~10,从而提取并分离出壳聚糖,洗涤后冷冻干燥[61]。
2.3.3 微波辅助提取法
根据SEBASTIAN等[62]的研究,采用微波辅助提取真菌性壳聚糖。该方法采用微波加热代替传统加热。该方法与上述两种提取方法非常相似,只是采用微波辅助。微波处理可以提高壳聚糖的质量,因为微波加热发生在分子水平,促进温度均匀快速上升,而不像前面讨论的方法中使用的传统加热。壳聚糖得率为13.43%。
首先将磨碎的真菌菌丝加入1 mol/L NaOH溶液,并加入微波炉中,在微波功率300 W下提取时间22 min。在8 000 r/min离心15 min得到AIM,用蒸馏水洗涤至pH为中性。然后将AIM置于2%醋酸(体积分数)中,在95 ℃下提取8 h,提取液在8 000 r/min下离心15 min。然后用2 mol/L NaOH溶液调节上清液至pH值为10。沉淀后的壳聚糖用蒸馏水清洗,冷冻干燥过夜[62]。
3 结论
几丁质和壳聚糖种种特性使它们在各个领域中具有广泛的应用价值,使其需求不断增加,但有限的供应和复杂的提取过程导致其成本上涨。此外,目前原料海洋甲壳类的供应有限,使真菌生产壳聚糖成为一项具有广阔前景的研究领域。相比于传统的海洋甲壳类动物来源,真菌生产壳聚糖具有提取简单、品质优良等优势。到目前为止,已发表的研究工作已经证明了在实验室规模上从真菌来源生产几丁质和壳聚糖生物聚合物的可行性,但尚未实现商业化生产。主要的阻碍是低产量和高成本。限制产量的主要因素包括真菌的发酵过程中营养物质的供给和利用、培养条件的控制以及发酵后处理的效率。基于近年来的研究综述,可以通过以下几个发展方向来提高壳聚糖产量:菌株改造,通过基因编辑技术改造真菌菌株,提高其代谢效率和壳聚糖合成能力;培养基优化,利用廉价的废水废渣作为培养基成分,降低原料成本,同时优化营养物质配比以提高真菌生长和壳聚糖产量;发酵工艺优化,优化发酵条件如pH、温度、通气量等,提升发酵效率。在壳聚糖提取方面,不同的方法各有优劣,需要根据实际情况选择合适的提取方法。综合而言,通过深入研究真菌壳聚糖的生产与提取,可以为壳聚糖的应用提供更为可靠的来源和方法,促进其在各个领域的广泛应用。
[1] JAYAKUMAR R, PRABAHARAN M, SUDHEESH KUMAR P T, et al.Biomaterials based on chitin and chitosan in wound dressing applications[J].Biotechnology Advances, 2011, 29(3):322-337.
[2] ISLAM S, RAHMAN BHUIYAN M A, ISLAM M N.Chitin and chitosan:Structure, properties and applications in biomedical engineering[J].Journal of Polymers and the Environment, 2017, 25(3):854-866.
[3] MUZZARELLI R A A, BOUDRANT J, MEYER D, et al.Current views on fungal chitin/chitosan, human chitinases, food preservation, glucans, pectins and inulin:A tribute to Henri Braconnot, precursor of the carbohydrate polymers science, on the chitin bicentennial[J].Carbohydrate Polymers, 2012, 87(2):995-1012.
[4] DARWESH O M, SULTAN Y Y, SEIF M M, et al.Bio-evaluation of crustacean and fungal nano-chitosan for applying as food ingredient[J].Toxicology Reports, 2018, 5:348-356.
[5] TERKULA IBER B, AZMAN KASAN N, TORSABO D, et al.A review of various sources of chitin and chitosan in nature[J].Journal of Renewable Materials, 2022, 10(4):1097-1123.
[6] HOSSEINNEJAD M, JAFARI S M.Evaluation of different factors affecting antimicrobial properties of chitosan[J].International Journal of Biological Macromolecules, 2016, 85:467-475.
[7] CHEUNG R C F, NG T B, WONG J H, et al.Chitosan:An update on potential biomedical and pharmaceutical applications[J].Marine Drugs, 2015, 13(8):5156-5186.
[8] DHILLON G S, KAUR S, SARMA S J, et al.Integrated process for fungal citric acid fermentation using apple processing wastes and sequential extraction of chitosan from waste stream[J].Industrial Crops and Products, 2013, 50:346-351.
[9] 王曦宇, 哈斯.壳聚糖吸附剂对重金属的吸附研究[J].山东化工, 2023, 52(23):29-31;36.
WANG X Y, HA S.Study on adsorption of heavy metals by chitosan adsorbent[J].Shandong Chemical Industry, 2023, 52(23):29-31;36.
[10] 秦旭晨, 马占胜, 雷玉娟.壳聚糖在饮料澄清及抗性提升中的应用研究进展[J].食品与发酵工业, 2024, 50(11):389-395.
QIN X C, MA Z S, LEI Y J.Application research of chitosan in clarifying and improving antibacterial and antioxidant properties of beverage[J].Food and Fermentation Industries, 2024, 50(11):389-395.
[11] 连欢, 魏雯雯, 杨相政.壳聚糖-植物提取物复合涂膜对樱桃番茄保鲜效果的影响[J].保鲜与加工, 2022, 22(9):1-6.
LIAN H, WEI W W, YANG X Z.Effects of chitosan-plant extracts composite coating on preservation of cherry tomatoes[J].Storage and Process, 2022, 22(9):1-6.
[12] 陆建明, 黄小龙, 吴文嫱, 等.链霉菌和壳聚糖对淮山土壤微生物活性与群落的影响[J].热带作物学报, 2021, 42(10):3033-3041.
LU J M, HUANG X L, WU W Q, et al.Effect of Streptomyces and chitosan on the soil microbial activities and microbiome in Dioscorea oppositifolia L[J].Chinese Journal of Tropical Crops, 2021, 42(10):3033-3041.
[13] 董林红, 蔡昌兰, 刘亚.壳聚糖在生物医学和药物应用方面的研究进展[J].药物生物技术, 2019, 26(2):178-181.
DONG L H, CAI C L, LIU Y.Reaearch progress of chitosan in the biomedicine and pharmaceutical aplications[J].Pharmaceutical Biotechnology, 2019, 26(2):178-181.
[14] 衣振伟, 林浩东, 赵黎明.壳聚糖支架在周围神经修复中的应用研究进展[J].功能高分子学报, 2024, 37(3):251-261.
YI Z W, LIN H D, ZHAO L M.Research progress on application of chitosan scaffold in peripheral nerve repair[J].Journal of Functional Polymers, 2024, 37(3):251-261.
[15] 廖春燕, 马国瑞, 洪文英.壳聚糖诱导番茄对早疫病的抗性及其生理机制[J].浙江大学学报(农业与生命科学版), 2003, 29(3):280-286.
LIAO C Y, MA G R, HONG W Y.Induction effect of chitosan on suppression of tomato early blight and its physiological mechanism[J].Journal of Zhejiang Agricultural University (Agriculture and Life Sciences), 2003, 29(3):280-286.
[16] Chitin and Chitosan Derivatives:Global Strategic Business Report[Z].Global Industry Analysts, Inc, 2024.
[17] 申熙耀, 梅增霞, 李建庆.壳聚糖的提取及应用研究[J].现代园艺, 2018(11):13-14.
SHEN X Y, MEI Z X, LI J Q.Research on the extraction and application of chitosan[J].Xiandai Horticulture, 2018(11):13-14.
[18] LIANG X, YANG S L, LOU Z C, et al.The impact of Japan’s discharge of nuclear-contaminated water on aquaculture production, trade, and food security in China and Japan[J].Sustainability, 2024, 16(3):1285.
[19] JOSEPH S M, KRISHNAMOORTHY S, PARANTHAMAN R, et al.A review on source-specific chemistry, functionality, and applications of chitin and chitosan[J].Carbohydrate Polymer Technologies and Applications, 2021, 2:100036.
[20] ABO ELSOUD M M, EL KADY E M.Current trends in fungal biosynthesis of chitin and chitosan[J].Bulletin of the National Research Centre, 2019, 43(1):59.
[21] TEJAS NAMBOODIRI M M, PAKSHIRAJAN K.Valorization of Waste Biomass for Chitin and Chitosan Production[M].Waste Biorefinery.Amsterdam:Elsevier, 2020:241-266.
[22] ABASIAN L, SHAFIEI ALAVIJEH R, SATARI B, et al.Sustainable and effective chitosan production by dimorphic fungus Mucor rouxii via replacing yeast extract with fungal extract[J].Applied Biochemistry and Biotechnology, 2020, 191(2):666-678.
[23] 李理. 利用微生物制备几丁质及壳聚糖的工艺研究[D].上海:上海应用技术大学, 2019.
LI L.Study on the preparation of chitin and chitosan by microorganisms[D].Shanghai:Shanghai Institute of Technology, 2019.
[24] MOHAN K, GANESAN A R, MURALISANKAR T, et al.Recent insights into the extraction, characterization, and bioactivities of chitin and chitosan from insects[J].Trends in Food Science &Technology, 2020, 105:17-42.
[25] SEBASTIAN J, ROUISSI T, BRAR S K.Fungal Chitosan:Prospects and Challenges[M].Handbook of Chitin and Chitosan.Amsterdam:Elsevier, 2020:419-452.
[26] BERGER L R R, STAMFORD T C M, STAMFORD-ARNAUD T M, et al.Effect of corn steep liquor (CSL) and cassava wastewater (CW) on chitin and chitosan production by Cunninghamella elegans and their physicochemical characteristics and cytotoxicity[J].Molecules, 2014, 19(3):2771-2792.
[27] DE SOUZA A F, GALINDO H M, DE LIMA M A B, et al.Biotechnological strategies for chitosan production by mucoralean strains and dimorphism using renewable substrates[J].International Journal of Molecular Sciences, 2020, 21(12):4286.
[28] CHATTERJEE S, GUHA A K, CHATTERJEE B P.Evaluation of quantity and quality of chitosan produce from Rhizopus oryzae by utilizing food product processing waste whey and molasses[J].Journal of Environmental Management, 2019, 251:109565.
[29] TEJAS NAMBOODIRI M M, PAKSHIRAJAN K.Sustainable and green approach of chitosan production from Penicillium citrinum biomass using industrial wastewater as a cheap substrate[J].Journal of Environmental Management, 2019, 240:431-440.
[30] HASSAINIA A, SATHA H, BOUFI S.Chitin from Agaricus bisporus:Extraction and characterization[J].International Journal of Biological Macromolecules, 2018, 117:1334-1342.
[31] DHILLON G S, KAUR S, BRAR S K, et al.Green synthesis approach:Extraction of chitosan from fungus mycelia[J].Critical Reviews in Biotechnology, 2013, 33(4):379-403.
[32] AFROZ M M, KASHEM M N H, PIASH K M P S, et al.Saccharomyces cerevisiae as an untapped source of fungal chitosan for antimicrobial action[J].Applied Biochemistry and Biotechnology, 2021, 193(11):3765-3786.
[33] TAJDINI F, ALI AMINI M, NAFISSI-VARCHEH N, et al.Production, physiochemical and antimicrobial properties of fungal chitosan from Rhizomucor miehei and Mucor racemosus[J].International Journal of Biological Macromolecules, 2010, 47(2):180-183.
[34] RANE K D, HOOVER D G.Production of chitosan by fungi[J].Food Biotechnology, 1993, 7(1):11-33.
[35] AILI D, ADOUR L, HOUALI K, et al.Effect of temperature in chitin and chitosan production by solid culture of Penicillium camembertii on YPG medium[J].International Journal of Biological Macromolecules, 2019, 133:998-1007.
[36] CHATTERJEE S, CHATTERJEE S, CHATTERJEE B P, et al.Enhancement of growth and chitosan production by Rhizopus oryzae in whey medium by plant growth hormones[J].International Journal of Biological Macromolecules, 2008, 42(2):120-126.
[37] VAINGANKAR P N, JUVEKAR A R.Fermentative production of mycelial chitosan from Zygomycetes:Media optimization and physico-chemical characterization[J].Advances in Bioscience and Biotechnology, 2014, 5(12):940-956.
[38] WANG W P, DU Y M, QIU Y L, et al.A new green technology for direct production of low molecular weight chitosan[J].Carbohydrate Polymers, 2008, 74(1):127-132.
[39] TAYEL A A, IBRAHIM S I A, AL-SAMAN M A, et al.Production of fungal chitosan from date wastes and its application as a biopreservative for minced meat[J].International Journal of Biological Macromolecules, 2014, 69:471-475.
[40] ARCIDIACONO S, KAPLAN D L.Molecular weight distribution of chitosan isolated from Mucor rouxii under different culture and processing conditions[J].Biotechnology and Bioengineering, 1992, 39(3):281-286.
[41] CHATTERJEE S, ADHYA M, GUHA A K, et al.Chitosan from Mucor rouxii:Production and physico-chemical characterization[J].Process Biochemistry, 2005, 40(1):395-400.
[42] LIAO J, HUANG H H.Extraction of a novel fungal chitin from Hericium erinaceus residue using multistep mild procedures[J].International Journal of Biological Macromolecules, 2020, 156:1279-1286.
[43] 庞书彦, 赵华, 刘阳, 等.雅致放射毛霉壳聚糖提取方法的研究[J].中国食品添加剂, 2016, 27(3):116-121.
PANG S Y, ZHAO H, LIU Y, et al.Study on the extraction of chitosan from Actinomucor elegans[J].China Food Additives, 2016, 27(3):116-121.
[44] 陈忻, 赖兴华, 袁毅桦, 等.用丝状真菌制备壳聚糖的研究[J].精细化工, 2000, 17(3):132-134.
CHEN X, LAI X H, YUAN Y H, et al.Research on producing chitosan by fungus[J].Fine Chemicals, 2000, 17(3):132-134.
[45] VENDRUSCOLO F, NINOW J L.Apple pomace as a substrate for fungal chitosan production in an airlift bioreactor[J].Biocatalysis and Agricultural Biotechnology, 2014, 3(4):338-342.
[46] ISLAM N, HOQUE M, TAHARAT S F.Recent advances in extraction of chitin and chitosan[J].World Journal of Microbiology &Biotechnology, 2022, 39(1):28.
[47] VEITER L, RAJAMANICKAM V, HERWIG C.The filamentous fungal pellet-relationship between morphology and productivity[J].Applied Microbiology and Biotechnology, 2018, 102(7):2997-3006.
[48] KARAHALIL E, COBAN H B, TURHAN I.A current approach to the control of filamentous fungal growth in media:Microparticle enhanced cultivation technique[J].Critical Reviews in Biotechnology, 2019, 39(2):192-201.
[49] BERGER L R R, STAMFORD T C M, STAMFORD-ARNAUD T M, et al.Green conversion of agroindustrial wastes into chitin and chitosan by Rhizopus arrhizus and Cunninghamella elegans strains[J].International Journal of Molecular Sciences, 2014, 15(5):9082-9102.
[50] DZURENDOVA S, ZIMMERMANN B, KOHLER A, et al.Microcultivation and FTIR spectroscopy-based screening revealed a nutrient-induced co-production of high-value metabolites in oleaginous Mucoromycota fungi[J].PLoS One, 2020, 15(6):e0234870.
[51] SAFAEI Z, KARIMI K, ZAMANI A.Impact of phosphate, potassium, yeast extract, and trace metals on chitosan and metabolite production by Mucor Indicus[J].International Journal of Molecular Sciences, 2016, 17(9):1429.
[52] SINGH A, KUMAR V, ANAND S, et al.Mixed organic and inorganic nitrogen sources enhance chitosan yield in novel isolates of Penicillium[J].International Journal of Biological Macromolecules, 2024, 256:128115.
[53] JIANG L F, PAN S K, KIM J M.Influence of nitrogen source on chitosan production carried out by Absidia coerulea CTCC AF 93105[J].Carbohydrate Polymers, 2011, 86(1):359-361.
[54] HABIBI A, KARAMI S, VARMIRA K, et al.Key parameters optimization of chitosan production from Aspergillus terreus using apple waste extract as sole carbon source[J].Bioprocess and Biosystems Engineering, 2021, 44(2):283-295.
[55] JAWORSKA M M, KONIECZNA E.The influence of supplemental components in nutrient medium on chitosan formation by the fungus Absidia orchidis[J].Applied Microbiology and Biotechnology, 2001, 56(1-2):220-224.
[56] CRESTINI C, KOVAC B, GIOVANNOZZI-SERMANNI G.Production and isolation of chitosan by submerged and solid-state fermentation from Lentinus edodes[J].Biotechnology and Bioengineering, 1996, 50(2):207-210.
[57] STREIT F, KOCH F, LARANJEIRA M C M, et al.Production of fungal chitosan in liquid cultivation using apple pomace as substrate[J].Brazilian Journal of Microbiology, 2009, 40(1):20-25.
[58] CROGNALE S, RUSSO C, PETRUCCIOLI M, et al.Chitosan production by fungi:Current state of knowledge, future opportunities and constraints[J].Fermentation, 2022, 8(2):76.
[59] 王蒙, 李澜鹏, 张全, 等.生物法制备甲壳素/壳聚糖的研究进展[J].生物技术通报, 2019, 35(4):213-222.
WANG M, LI L P, ZHANG Q, et al.Research progress on the bio-production of chitin and chitosan[J].Biotechnology Bulletin, 2019, 35(4):213-222.
[60] ABDEL-GAWAD K M, HIFNEY A F, FAWZY M A, et al.Technology optimization of chitosan production from Aspergillus niger biomass and its functional activities[J].Food Hydrocolloids, 2017, 63:593-601.
[61] ZAMANI A, EDEBO L, NIKLASSON C, et al.Temperature shifts for extraction and purification of zygomycetes chitosan with dilute sulfuric acid[J].International Journal of Molecular Sciences, 2010, 11(8):2976-2987.
[62] SEBASTIAN J, ROUISSI T, BRAR S K, et al.Microwave-assisted extraction of chitosan from Rhizopus oryzae NRRL 1526 biomass[J].Carbohydrate Polymers, 2019, 219:431-440.