果胶是一类广泛存在于植物细胞初生壁和原生质体中的杂多糖,主要是由D-半乳糖醛酸(galacturonic acid, GalA)以α-1,4-糖苷键缩合而成的酸性糖主链,以及D-半乳糖(galactose,Gal)、L-鼠李糖(rhamnose,Rha)、D-阿拉伯糖(arabinose,Ara)等中性糖侧链构成,其单糖组成、结构和分子质量等根据来源各有不同,通常与其他细胞壁成分,如纤维素、半纤维素和木质素有较强的相关性[1]。果胶主要位于植物的初生细胞壁和中间层,属于含量最高的一种多糖,从初级细胞壁向质膜逐渐减少[2];且其通常在初级细胞壁生长的初始阶段产生,约占双子叶植物和一些单子叶植物细胞壁干物质的1/3[3]。果胶能够稳定植物组织的硬度和结构,参与细胞间黏附、维持细胞膨胀度、形成细胞壁机械阻力,并且能够为植物组织提供抗低温和干旱的能力[4]。果胶的结构具有多样性和复杂性,在植物和病原体的相互作用中发挥着关键作用[5],果胶的数量和性质对水果和蔬菜的生长、成熟、储存和加工过程中的质地也至关重要。由于果胶是聚合羧酸阴离子,根据pH值、离子强度和/或二价阳离子的存在,它们在水中具有静电效应,表现出增稠和胶凝特性,以及重要的水化和溶胀能力,这些特征对其在食品和制药行业的应用具有非常重要的意义[6]。
超高压处理(high pressure processing,HPP)是近年来兴起的一种新型低温食品加工技术,不仅具有良好的杀菌效果,且相比于传统的热处理更能保持食品的营养成分和风味,延长其保质期,在国内外学界和商界引起了广泛关注,但其对食品成分和结构的影响机制还有待进一步探索和研究。果胶作为一种广泛存在于植物来源食品的成分以及重要的食品添加剂,其结构和性质往往决定着食品的稳定性和质感。因此,本文将从果胶的分子结构及特性、HPP处理对果胶分子质量和酯化度的影响、HPP处理对果胶改性等的影响,揭示HPP对食品品质影响的内在机制,为果胶在食品及相关领域的应用提供理论指导。
1 HPP技术
HPP是近年来新兴的一种非热食品加工技术,它将食品(液体或固体)置于100 MPa以上的压力下,既能够保证食品的生物安全性,还能够一定程度上改善食品的品质[7]。1899年,HITE将HPP应用于牛奶的灭菌达到了较好的效果,使食品的非热力学灭菌成为可能,并于二十世纪八十年代日本首次进行了商业化生产[8]。大量研究表明,超高压环境能够破坏细胞膜、抑制酶的活性和影响遗传物质的复制等,对微生物具有较强的灭活或钝化作用。PRIETO-CALVO等[9]研究发现300 MPa的压力下,细胞膜的通透性和功能受损会导致氨基酸摄取异常,进而影响细胞内蛋白质的合成;SATO等[10]用100 MPa的压力处理裂殖酵母,发现其核膜出现破碎,加压到250 MPa,其核膜碎片及细胞器就消失了。相较于传统的热力学处理,HPP还具有能够保持食品原料新鲜特性、延长产品保质期的能力。如STINCO等[11]对胡萝卜浊汁进行HPP发现,450 MPa以上的压力处理5 min可使胡萝卜汁货架期延长14周左右,并能够有效抑制胡萝卜素的降解。MORTON等[12]将牛肉经175 MPa/3 min 和250 MPa/2 min处理后冷藏,发现HPP提高了牛肉的剪切力和最终pH,减少了烹饪损失,且处理组感官评分显著高于未处理组。由此可见,HPP具有广阔的应用前景和发展潜力,但其对食品内部组分具体的影响机制还尚不明确,待进一步研究。
2 果胶的结构和功能特性
果胶是一种复杂的嵌段共聚物,其明确的化学组成和结构仍存在争议。目前普遍认为,果胶主要由同型半乳糖醛酸聚糖(homogalacturonan,HG)、Ⅰ型鼠李半乳糖醛酸聚糖(type Ⅰ rhamngalacturonan,RG-Ⅰ)和Ⅱ型鼠李半乳糖醛酸聚糖(type Ⅱ rhamngalacturonan,RG-Ⅱ)这3种类型的结构域组成(图1)。此外还包括木糖-半乳糖醛酸聚糖(xylogalacturonans)、阿拉伯糖-半乳糖醛酸聚糖(arabinogalactans)、阿拉伯聚糖(arabinans)等,这些结构域通常只存在于特定的植物中[13]。
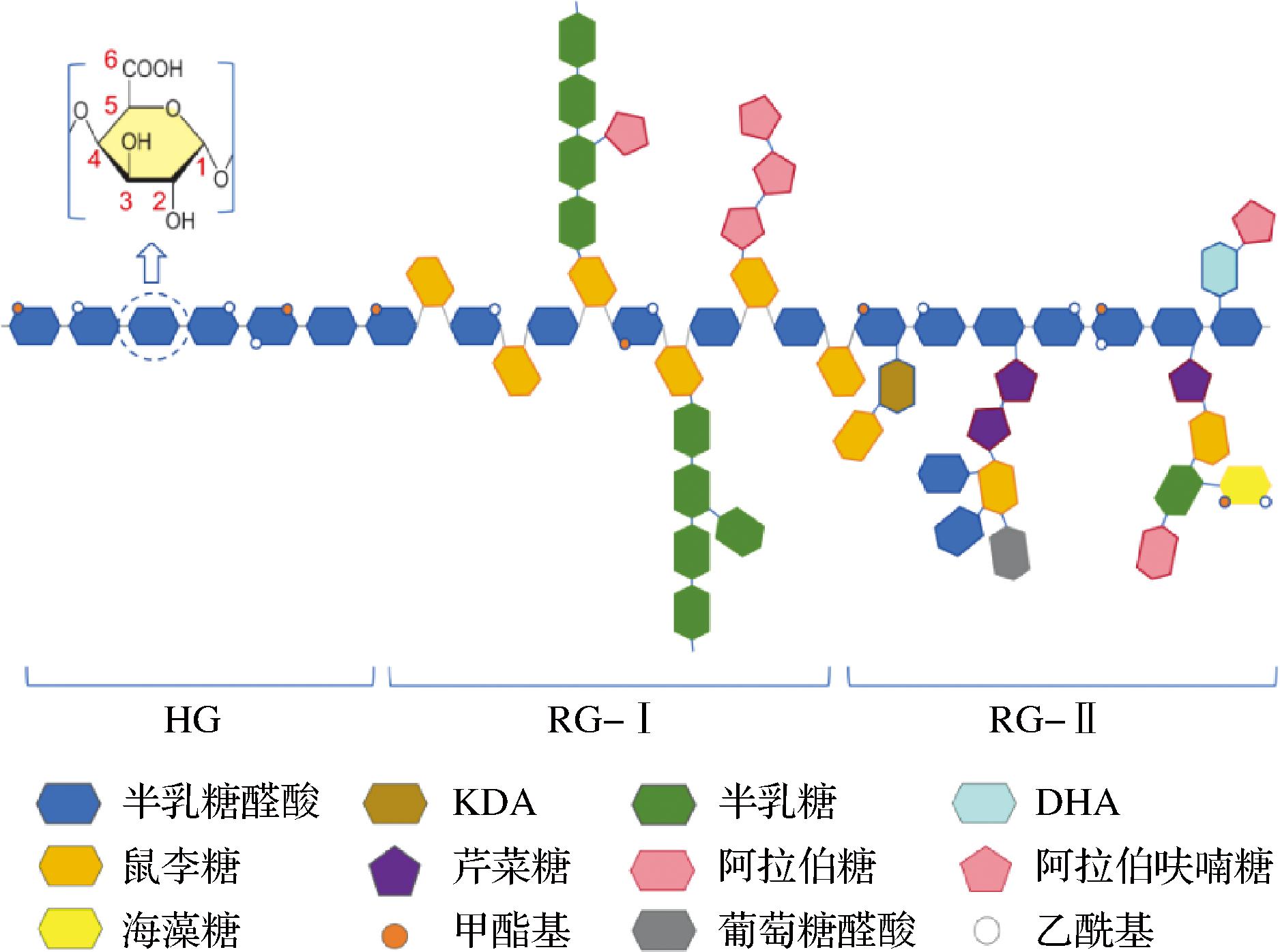
图1 HG、RG-Ⅰ和RG-Ⅱ的组分和结构
Fig.1 Composition and structure of HG, RG-Ⅰ, and RG-Ⅱ
果胶大分子中最丰富的结构域是HG,它约占细胞壁所有果胶成分的60%。HG分子由α-1,4-D-半乳糖醛酸单元的线性链组成,其中一些半乳糖醛酸的羧基与甲醇酯化,或在O-2和O-3上乙酰化(图2)。RG-Ⅰ是一个果胶多糖家族,包含一个由α-1,4-D-半乳糖醛酸和α-1,2-L-鼠李糖相连的重复残基组成[→α-D-GalpA-1,2-α-L-Rhap-1,4→]的主干,其长度根据果胶原料来源和提取方式不同存在着较大的差异[14]。RG-Ⅰ中存在大量阿拉伯糖和半乳糖等中性糖残基,在侧链上形成阿拉伯糖、半乳糖和阿拉伯-半乳糖及其聚糖组合链,主要附着在鼠李糖残基的O-4位置,RG-Ⅰ高度分支的性质使其被称为果胶中的“hairy region”[15]。RG-Ⅱ约占果胶大分子的10%,由一个短的半乳糖醛酸聚糖和通过20多个不同的共价键被12种不同的单糖取代的侧链组成,包括阿拉伯糖、葡萄糖、半乳糖、鼠李糖、3-脱氧-D-来苏-2-庚酮二酸(3-deoxy-D-lyxo-2-heptulosaric acid,DHA)和3-脱氧-D-甘露-2-辛酮糖酸(3-deoxy-D-manno-2-octulosonic acid,KDO)等[16],是果胶大分子中最复杂的结构域,且大多数在植物物种中都是较保守的结构。两个相邻果胶分子的RG-Ⅱ链之间的交联增加了果胶网络的完整性[17],且由于其结构特性,RG-Ⅱ具有自组装成共价二聚体的能力,对于细胞壁复杂结构的形成具有重要影响[18]。
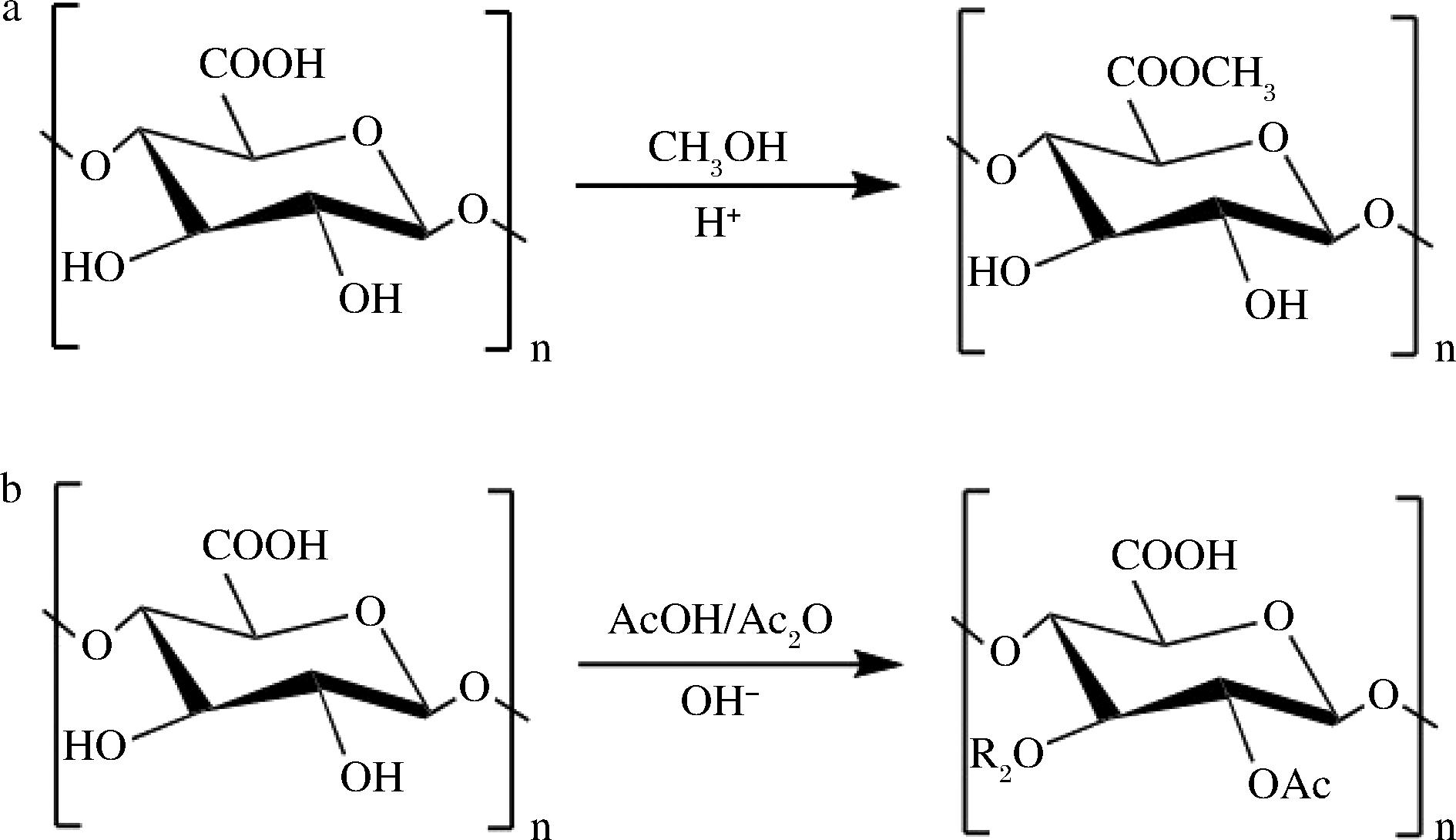
a-甲酯化;b-乙酰化
图2 半乳糖醛酸残基的甲酯化和乙酰化
Fig.2 Methylation and acetylation of galacturonic acid residues
果胶(图3)参与植物细胞的离子转运,维持细胞壁的孔隙度,并在植物组织的刚性和完整性以及植物免疫系统的激活中发挥重要作用[19]。果胶分子含有大量羧基和羟基,当其溶于水时,果胶分子间和分子内由于氢键和疏水相互作用,发生缠绕结合,使果胶溶液具有一定的黏性,表现出一定的流变学性质,这是果胶应用于食品加工的主要特征。对于酯化度较高的高甲氧基果胶而言,其胶凝过程通常需要特定的条件,如低pH值(2.5~3.5)和共溶质(蔗糖、山梨醇等)的存在等[20]。共溶质可促进疏水相互作用来降低水活性以稳定连接区,具体取决于共溶质分子的几何形状和与邻近的水分子的相互作用[21]。因此,高甲氧基果胶凝胶通常是热可逆的,且易水化。相比之下,酯化度较低的低甲氧基果胶对糖含量、水分含量、pH值则不是很敏感,其胶凝过程需要二价阳离子的存在,通常是Ca2+,且可通过添加一价阳离子如Na+、K+等逆转胶凝过程[22]。低甲氧基果胶凝胶的形成主要是通过二价阳离子介导的羧基离子键和静电相互作用,因此,其凝胶能力随着甲基化程度的降低而增加。
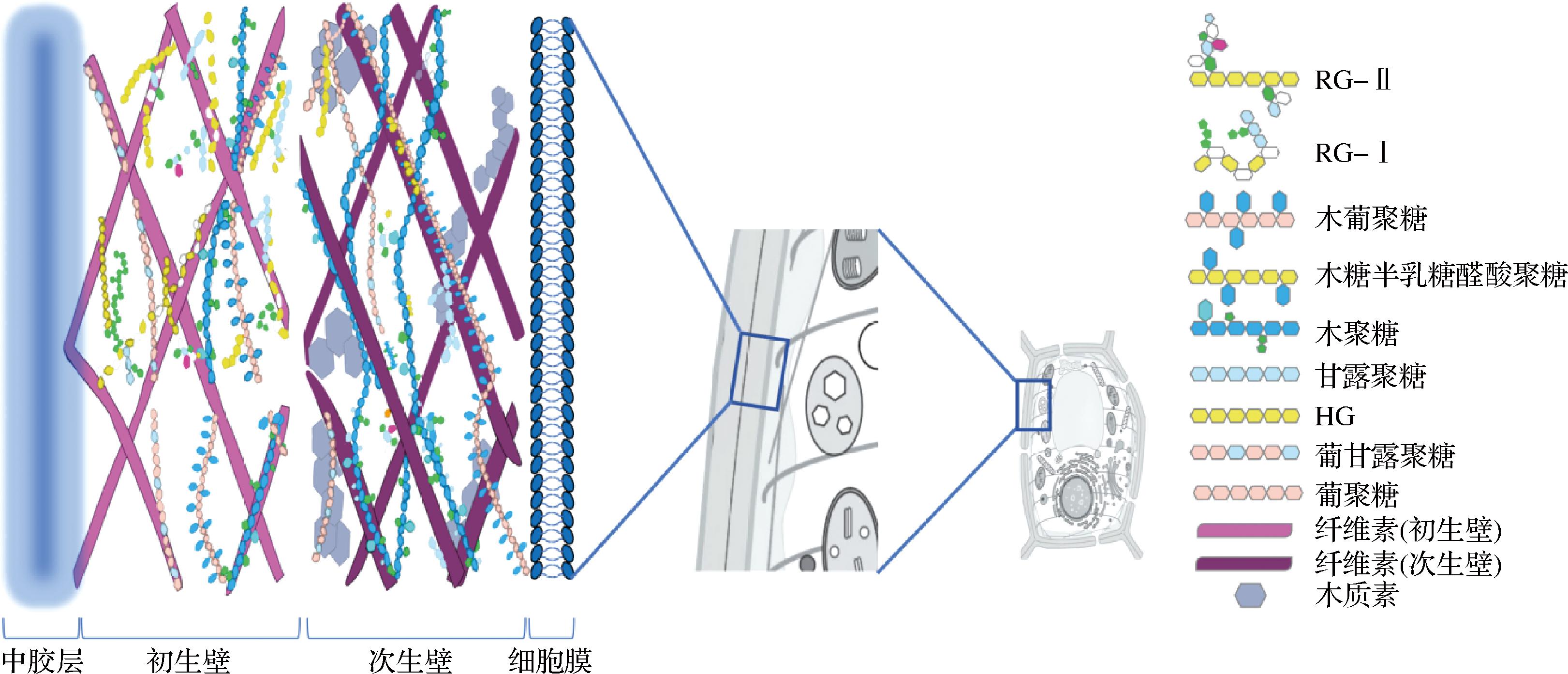
图3 植物细胞壁中果胶的存在形式及分布
Fig.3 Forms and distribution of pectin in plant cell walls
3 HPP对食品中果胶的影响
3.1 HPP对果胶酯化度的影响
果胶的酯化主要是指半乳糖醛酸单位羧基的甲酯化和O-2和O-3羟基的乙酰化,果胶的酯化度是评价果胶性能的最重要指标之一,HPP对果胶酯化度的影响与处理压力、时间、果胶来源以及pH值有关。陈丹等[23]在比较超高压和热处理不同果块竹笋的品质变化时发现,HPP和热处理均可显著降低竹笋果胶的酯化度,但HPP组样品酯化度要更低于热处理组,这使得果胶更易于与组织中的金属离子螯合形成稳定的网络结构,拥有更好的质地。赵文婷等[24]的研究也表明HPP和热处理均会使番茄酱样品的酯化度显著降低,由于番茄酱在制作过程中进行了钝酶处理,果胶甲酯酶(pectin methylesterase,PME)完全失活,因此HPP和热处理导致的酯化度降低完全是化学脱酯过程。TIAN等[25]研究发现,HPP能降低山楂汁果胶的酯化度,且随着压力升高和时间延长这种效果呈减弱趋势,这与PME的活性变化呈正相关,而热处理则会增加果胶的酯化度导致果胶的黏度降低。但是SUN等[26]将莴笋分别在100、300 MPa和500 MPa下处理5 min,发现与对照组相比100 MPa处理后的莴笋果胶酯化度显著增加,可能是由于在较低压力下GalA的提取率较低,但随着压力升高,果胶的酯化度呈下降趋势,研究人员通过LM19(一种特异性结合非乙氧基化果胶的抗同半乳糖醛酸抗体)免疫荧光强度的增强,进一步验证了下降趋势主要是由于超高压诱导的果胶去甲氧基化。ZHONG等[27]在研究200、400、600 MPa条件下处理30 min对苹果果胶的结构和性能的影响时也发现超高压会使果胶酯化度略有上升,推测是果胶在高压条件下暴露了更多的甲酯基,且随着压力上升这种趋势逐渐减弱。而PENG等[28]研究发现,HPP能够加速果胶酯的皂化反应,在用HPP处理pH值为3和7的甜菜果胶时,其酯化度没有明显变化,当pH值为8时甜菜果胶的酯化度显著降低。另外,也有研究表明HPP对果胶甲酯化度和乙酰化度的影响程度有所区别,ARACHCHIGE等[29]将甘薯果胶经过200 MPa、50 ℃、15 min的处理后发现甲酯化度下降了6.26%,乙酰化度下降了1.98%。
根据勒夏特列原理,当压力增大时,体系的体积会有减小趋势[30],但在封闭的HPP设备中,施加压力将缩小分子间距,促进水分子与果胶甲酯键的接触,水分子亲核攻击甲酯键,增强其水解作用。同时高压也会造成细胞壁和细胞膜损伤[31],有利于增加果胶的释放,且高压条件下果胶的大分子结构发生改变,使得果胶的甲酯基更多的暴露或掩藏,这与果胶的结构和处理条件密切相关。另外,压力还会引起酶促反应和温度等的变化,这些因素共同作用导致高压条件下果胶的酯化度上升或下降,具体的影响机制需要根据具体的实验条件和果胶的特性进行详细分析和验证。
3.2 HPP对果胶分子质量的影响
果胶是一类杂多糖,其分子质量从几十到几千kDa不等,果胶分子质量在果胶的溶解性、黏度和凝胶形成能力中发挥着重要作用,HPP对果胶分子质量的影响主要与处理压力和时间有关。李翔[32]研究显示HPP引起了部分分子质量较大的果胶分子交联、结合形成更大的分子结构,而随着压强的升高果胶的分子质量先上升后下降,且HPP会使果胶分子质量的分布变得不均匀。彭小燕等[33]研究发现HPP会破坏甜菜果胶结构,导致果胶分子质量随着处理压力升高和处理时间延长而逐渐下降。ZHONG等[27]的研究显示,较低压力处理会促进果胶分子间形成氢键和疏水相互作用,使果胶分子进一步结合和缠绕,而使果胶分子质量增加,但当压力达到600 MPa时会引起果胶链因机械应力发生断裂,而导致分子质量下降。ARACHCHIGE等[29]在对甘薯果胶进行高压改性时也发现,超高压能够引起甘薯果胶半乳糖醛酸残基之间糖苷键断裂,导致果胶分子质量下降。TIAN等[25]研究发现,山楂汁果胶在不同压力和时间处理后分子质量均显著增加,他们推测可能是由于HPP后果胶链之间交联结合,或者果胶裂解酶的失活防止了糖苷键的断裂,导致山楂汁黏度升高;但随着压力上升和时间延长这种趋势逐渐减弱,且相较于HPP,热处理使果胶分子聚集更明显、分子质量增加程度更大。PENG等[28]研究发现HPP可使甜菜果胶的分子质量降低而使其溶液的黏度增加,250 MPa处理30 min,不同pH甜菜果胶分子质量均有明显下降,且随着压力的增加,果胶分子质量持续降低,据SCHMELTER等[34]的研究推测,HPP可能破坏了果胶链之间的连接,从而导致果胶分子解聚或断裂。
此外,HPP对果胶分子质量的影响还体现在对果胶主链和支链的作用上。XIE等[35]研究发现,经过HPP后,马铃薯皮果胶的半乳糖醛酸含量和鼠李糖/半乳糖醛酸(Rha/GalA)比值没有显著变化,表明果胶HG和RG-Ⅰ结构域的主链没有发生明显变化,但阿拉伯糖、半乳糖和鼠李糖的比值即(Ara+Gal)/Rha下降,说明HPP能促使果胶RG-Ⅰ区的侧链降解,同时也说明果胶的侧链比主链更易受高压的影响。TIAN等[25]研究显示,未经过HPP的山楂汁果胶在原子力显微镜下呈现高度缠绕的长链和部分支链形成的网状结构,且随着处理压力的增加和时间的延长,果胶中的结合部分明显变短、变粗,最终形成球状聚合结构,说明HPP使果胶分子的主链和支链结构发生了明显变化。综上所述,HPP对果胶分子质量的影响主要表现为促进分子之间聚合交联,以及对果胶主链和支链结构的破坏等方面,导致果胶分子质量发生一定程度的变化,且这种变化与处理条件和工艺高度相关,显示出HPP技术在果胶可控改造方面广阔的应用前景。
3.3 HPP对果胶酶解的影响
食品中的果胶往往受到其内源性酶的调节,主要包括PME和聚半乳糖醛酸酶(polygalacturoase,PG),而HPP能够通过改变酶的活性来间接影响果胶的含量和结构。PME催化果胶甲酯基的水解使其形成脱甲氧基化果胶[36],而PG则催化脱甲氧基化果胶半乳糖醛酸单位之间α-1,4糖苷键的水解反应[37],如图4所示。两者的协同作用改变了果胶结构,最终引起植物性食品质地的变化。
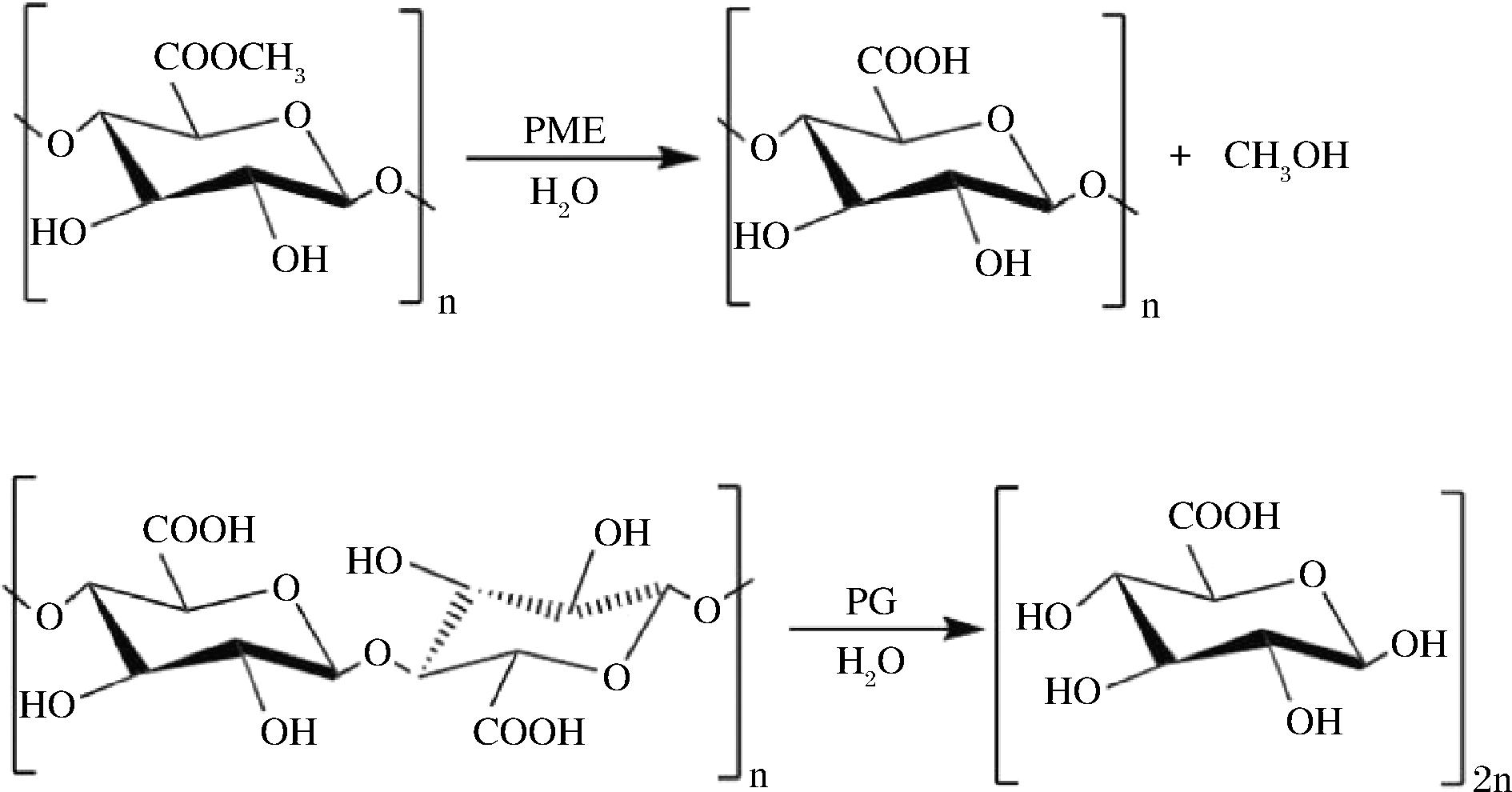
图4 PME和PG的作用原理
Fig.4 Principles of action of PME and PG
不同来源PME的压力稳定性差异较大,甚至同一来源的同工酶在相同的压力条件下也表现出不同的PME活性。李艳霞等[38]在研究HPP对荔枝果肉中PME活性的影响时发现,100 MPa处理会使荔枝果肉PME活性上升,而200~400 MPa处理则会使PME活性下降,通过Native-PAGE发现较低压力下出现了新的同工酶,较高压力下则新酶带消失。刘野等[39]研究表明,HPP前后PME蛋白的分子质量没有改变,但二级和三级结构均发生了显著变化,导致其活性随着压力升高而逐渐降低。但ZHANG等[40]研究发现柿子PME在500 MPa条件下,其一级结构没有发生变化,而体积被压缩、肽链展开、α-螺旋含量上升、β-折叠含量下降,使PME蛋白的构象发生了显著改变,导致柿子PME在300 MPa下稳定,却在500 MPa条件下活性显著上升。TIAN等[41]研究表明HPP使橙汁PME活性降低的原因是压力导致PME蛋白的α-螺旋转化为β-折叠,分子间氢键发生断裂并重新组合。因此,HPP对PME活性的影响主要是由于压力引起的PME分子内非共价相互作用的重组,改变了PME的催化活性中心,而PME的非保守性结构则导致了不同来源PME耐压能力的差异。
与PME不同,不同来源的PG及同工酶其压力稳定性是相似的,均易在高压条件下被灭活。VERLENT等[42]研究显示在恒温条件下,番茄PG活性随着压力的增加而降低,这种影响在较高的温度下更明显,压力达到500 MPa时,任何温度下均未检测到番茄PG活性。PEETERS等[43]测试了从番茄中纯化出的两种同工酶PG1(β亚基-PG2复合物)和PG2在0.1~500 MPa范围内的耐压能力,结果表明高压使PG1解聚,导致两者在所研究的压力范围内显示出相似的压力稳定性,较高压力条件下均失活。但也有研究显示HPP并不能有效灭活PG,XU等[44]研究表明超高压预处理(300 MPa/8 min)的柿子果肉榨汁后对果汁再进行HPP(550 MPa/5 min)能够显著降低PG活性,但并不能完全灭活。
3.4 HPP对果胶与其他分子相互作用的影响
食品中的果胶并不完全是独立存在,它还通过共价键或非共价键的方式与其他物质如蛋白质、酚类等相结合,共同组成食品果胶体系的三维网络[45]。果胶与酚类物质的结合主要包括氢键、范德华力、疏水作用和静电作用等非共价相互作用,以及由酶或自由基诱导的氧化结合、碳二亚胺交联等共价相互作用[46]。超高压引起的果胶-多酚相互作用的变化主要体现在非共价相互作用的断裂和重新组合,HOU等[47]研究发现超高压使RG-I果胶高度纠缠的阿拉伯糖侧链形成了一个疏水性区域,使得矢车菊素-3-葡萄糖苷(cyanidin-3-glucoside,C3G)与RG-Ⅰ果胶之间更易发生疏水相互作用,促进两者的结合,500 MPa/15 min处理后两者的结合率显著提高了32.8%。而处理压力和时间对果胶-多酚的结合具有“两重性”,即较低压力、较短时间的促进,以及较高压力、较长时间的抑制,TAN等[48]研究表明随着压力升高和时间延长,蓝莓果胶与C3G的结合率先上升后下降,通过粒径和zeta电位、扫描电子显微镜以及傅立叶变换红外光谱分析发现低压短时处理可使蓝莓果胶表面表现出光滑而疏松多孔的结构、C3G单体发生堆积,蓝莓果胶更多带负电基团被暴露与带正电的C3G通过静电相互作用结合,而高压长时处理则使蓝莓果胶分子链断裂,部分C3G从果胶包埋的形式中被释放出来,导致结合率下降。
蛋白质和果胶都是食品中的大分子成分,它们之间的相互作用是共价键、静电力、氢键、范德华力、疏水作用和离子键等多种作用的结果,这取决于蛋白质和果胶多样化的分子组成和结构特征,对食品的结构、质地和稳定性等有重要影响[49]。HPP对果胶-蛋白质相互作用的影响主要体现在对两者疏水微环境及带电状态的改变,从而导致果胶、蛋白质的大分子结构和相互作用发生变化。CHEN等[50]通过远紫外圆二色谱和表面疏水性分析研究表明,HPP会使大豆蛋白的α-螺旋含量上升、β-折叠含量下降、二级结构展开、色氨酸残基微环境非极性化,导致大豆蛋白的构象重排以及某些基团的暴露,这改善了其与其他小分子的结合。WANG等[51]通过粒径和zeta电位分析也发现,150 MPa处理能够屏蔽玉米醇溶蛋白某些氨基酸的表面电荷,减弱了分子间的静电斥力使其更容易发生聚集,聚集完成后再由带负电荷的果胶包裹使果胶-玉米醇溶蛋白之间存在足够的静电相互作用,从而形成更小、更稳定的包埋姜黄素的纳米颗粒。
3.5 HPP在果胶改性方面的应用
果胶在植物细胞壁中大多以原果胶的形式存在,而原果胶分子质量较高且溶解性较差,限制了其在一些特定领域的应用[52]。果胶的改性,即利用物理、化学和生物等多种手段对果胶的结构进行改造,以改善果胶的理化特性和生物活性,从而拓宽其应用潜力[53]。HPP使用液体介质以较高的压力破坏或促进食品成分中的相互作用,改变果胶的结构和表观特性,具有良好的应用前景。牟方婷等[54]用超高压辅助果胶酶对柑橘果胶进行改性,并对改性前后果胶的结构和理化性质进行了研究,结果发现与单独HPP和单独果胶酶酶解改性相比,2种方法协同改性提高了果胶的半乳糖醛酸含量,降低了酯化度,且没有改变单糖类型,提高了果胶的功能性,扩展了应用范围。赵文婷等[55]采用超高压辅助酶法制备低酯果胶,与传统碱法制备相比,两者半乳糖醛酸含量无显著差异,但碱法果胶的大分子含量减少而小分子含量增加,说明碱法脱酯会导致果胶分子发生降解,而超高压辅助酶法对果胶分子无降解作用。MUDUGAMUWA ARACHCHIGE等[56]利用超高压辅助果胶酶制备改性甘薯果胶,与天然甘薯果胶和柑橘果胶相比,改性甘薯果胶具有多孔的表面结构和更高的Pb2+吸附性能,吸附曲线符合Langmuir模型,表现出较高的环保应用价值。MA等[57]采用超高压辅助内聚半乳糖醛糖酶制备低聚苹果果胶,结果显示联合工艺的低聚果胶产率明显高于传统酶法,表明联合工艺是一种高效可行的制备低分子质量果胶的方法,且获得的低聚果胶具有良好的抑制肥大细胞脱颗粒的作用和潜在的过敏性疾病医疗价值。WAN等[58]分别比较了超高压辅助酶法、常压酶法和碱性脱酯法制备的低甲氧基果胶的流变性质和凝胶功能,结果表明在相同的Ca2+浓度下超高压辅助酶法制得的低甲氧基果胶具有更高的凝胶强度,且脱酯时间(12 min)远低于常压酶法(120 min)和碱性脱酯法(20 min),因此超高压辅助酶法可作为一种果胶去酯化的新型方法,生产出具有更好凝胶性能的低甲氧基果胶。未来,随着果胶结构的揭示和HPP方法的优化,超高压改性果胶具有巨大的应用潜力。
4 结语与展望
在食品工业中,果胶独特的物理和化学性质使其成为增稠剂、乳化稳定剂、凝胶剂、纤维补充剂等的理想选择,合理的应用和改造果胶,可以显著改善食品的质地、口感和营养价值,满足消费者对高质量和多样化食品的需求。HPP作为一种新兴的非热加工技术,已在食品工业中展示出广阔的应用前景。HPP能够显著影响果胶的分子质量和结构,改变其流变性质、功能特性以及与其他物质的相互作用,扩展果胶的应用范围;但由于不同来源和类型的果胶在HPP下表现出不同的反应特性,未来仍需深入探索不同类型果胶在超高压条件下的变化行为和机制。同时,为了更好地优化加工参数、提升产品品质,果胶与其他食品成分的相互作用及其对食品质量的综合影响也需进一步系统研究。以期通过深入的基础研究和技术创新,为有效调控果胶产品的质量和应用提供科学指导,为实现果胶的精细化加工和拓展果胶的应用范围发挥更大的效益。
[1] JESPER H, ANONGPAT S, HENRIK S V.Biosynthesis of pectin[J].Plant Physiology, 2010, 153(2):384-395.
[2] WILLATS W G T, MCCARTNEY L, MACKIE W, et al.Pectin:Cell biology and prospects for functional analysis[J].Plant Molecular Biology, 2001, 47(1):9-27.
[3] 刘佩佩, 张耿, 李晓娟.植物果胶的生物合成与功能[J].植物学报, 2021, 56(2):191-200.
LIU P P, ZHANG G, LI X J.Biosynthesis and function of plant pectin[J].Chinese Bulletin of Botany, 2021, 56(2):191-200.
[4] PARRE E, GEITMANN A.Pectin and the role of the physical properties of the cell wall in pollen tube growth of Solanum chacoense[J].Planta, 2005, 220(4):582-592.
[5] LARA-ESPINOZA C, CARVAJAL-MILL N E, BALANDR
N E, BALANDR N-QUINTANA R, et al.Pectin and pectin-based composite materials:Beyond food texture[J].Molecules, 2018, 23(4):942.
N-QUINTANA R, et al.Pectin and pectin-based composite materials:Beyond food texture[J].Molecules, 2018, 23(4):942.
[6] 汪海波, 徐群英, 汪芳安.低酯果胶的流变学性能研究[J].农业工程学报, 2006, 22(11):223-227.
WANG H B, XU Q Y, WANG F A.Rheological properties of low methoxyl pectin[J].Transactions of the Chinese Society of Agricultural Engineering, 2006, 22(11):223-227.
[7] 黄琴, 贺稚非, 龚霄, 等.超高压灭菌技术及其在食品工业中的应用[J].四川食品与发酵, 2008, 44(3):46-50.
HUANG Q, HE Z F, GONG X, et al.Application of ultra high pressure sterilization technology in food industry[J].Sichuan Food and Fermentation, 2008, 44(3):46-50.
[8] YAMAMOTO K.Food processing by high hydrostatic pressure[J].Bioscience, Biotechnology, and Biochemistry, 2017, 81(4):672-679.
[9] PRIETO-CALVO M, PRIETO M, L PEZ M, et al.Effects of high hydrostatic pressure on Escherichia coli ultrastructure, membrane integrity and molecular composition as assessed by FTIR spectroscopy and microscopic imaging techniques[J].Molecules, 2014, 19(12):21310-21323.
PEZ M, et al.Effects of high hydrostatic pressure on Escherichia coli ultrastructure, membrane integrity and molecular composition as assessed by FTIR spectroscopy and microscopic imaging techniques[J].Molecules, 2014, 19(12):21310-21323.
[10] SATO M, KOBORI H, ISHIJIMA S A, et al.Schizosaccharomyces pombe is more sensitive to pressure stress than Saccharomyces cerevisiae[J].Cell Structure and Function, 1996, 21(3):167-174.
[11] STINCO C M, SZCZEPA SKA J, MARSZA
SKA J, MARSZA EK K, et al.Effect of high-pressure processing on carotenoids profile, colour, microbial and enzymatic stability of cloudy carrot juice[J].Food Chemistry, 2019, 299:125112.
EK K, et al.Effect of high-pressure processing on carotenoids profile, colour, microbial and enzymatic stability of cloudy carrot juice[J].Food Chemistry, 2019, 299:125112.
[12] MORTON J D, PEARSON R G, LEE H Y Y, et al.High pressure processing improves the tenderness and quality of hot-boned beef[J].Meat Science, 2017, 133:69-74.
[13] CAFFALL K H, MOHNEN D.The structure, function, and biosynthesis of plant cell wall pectic polysaccharides[J].Carbohydrate Research, 2009, 344(14):1879-1900.
[14] RENARD C M G C, CRÉPEAU M J, THIBAULT J F.Structure of the repeating units in the rhamnogalacturonic backbone of apple, beet and citrus pectins[J].Carbohydrate Research, 1995, 275(1):155-165.
[15] MAXWELL E G, BELSHAW N J, WALDRON K W, et al.Pectin-An emerging new bioactive food polysaccharide[J].Trends in Food Science &Technology, 2012, 24(2):64-73.
[16] ZDUNEK A, PIECZYWEK P M, CYBULSKA J.The primary, secondary, and structures of higher levels of pectin polysaccharides[J].Comprehensive Reviews in Food Science and Food Safety, 2021, 20(1):1101-1117.
[17] MOHNEN D.Pectin structure and biosynthesis[J].Current Opinion in Plant Biology, 2008, 11(3):266-277.
[18] O’NEILL M A, BLACK I, URBANOWICZ B, et al.Locating methyl-etherified and methyl-esterified uronic acids in the plant cell wall pectic polysaccharide rhamnogalacturonan II[J].SLAS Technology, 2020, 25(4):329-344.
[19] BALDWIN L, DOMON J M, KLIMEK J F, et al.Structural alteration of cell wall pectins accompanies pea development in response to cold[J].Phytochemistry, 2014, 104:37-47.
[20] SUNDAR-RAJ A A, RUBILA S, JAYABALAN R, et al.A review on pectin:Chemistry due to general properties of pectin and its pharmaceutical uses[J].Scientific Reports, 2012, 1(12):1-4.
[21] LÖFGREN C, WALKENSTRÖM P, HERMANSSON A M.Microstructure and rheological behavior of pure and mixed pectin gels[J].Biomacromolecules, 2002, 3(6):1144-1153.
[22] MUNARIN F, TANZI M C, PETRINI P.Advances in biomedical applications of pectin gels[J].International Journal of Biological Macromolecules, 2012, 51(4):681-689.
[23] 陈丹, 郑炯, 张甫生, 等. 超高压及热处理后不同果块竹笋软罐头质地差异的研究[J]. 食品与发酵工业,2024,50(17):318-327.
CHEN D, ZHENG J, ZHANG F S, et al. Study on texture difference of bamboo shoots in pouches with different fruit pieces after ultra-high pressure and thermal processing[J]. Food and Fermentation Industries, 2024,50(17):318-327.
[24] 赵文婷, 程怡然, 马越, 等.超高压对番茄酱的汁液果胶结构的影响[J].食品科技, 2019, 44(3):85-91.
ZHAO W T, CHENG Y R, MA Y, et al.Effect of high hydrostatic pressure on serum pectin structure in tomato paste[J].Food Science and Technology, 2019, 44(3):85-91.
[25] TIAN H X, XIONG J J, YU H Y, et al.Characterize the physicochemical properties and microstructure of pectin from high-pressure and thermal processed cloudy hawthorn (Crataegus pinnatifida) juice based on acid heating extraction[J].Food Chemistry, 2023, 407:135199.
[26] SUN Y X, YAO J, ZHANG L, et al.New evidence on pectin-related instantaneous pressure softening mechanism of asparagus lettuce under high pressure processing[J].Food Science and Technology International, 2019, 25(4):337-346.
[27] ZHONG L J, LI X, DUAN M W, et al.Impacts of high hydrostatic pressure processing on the structure and properties of pectin[J].LWT, 2021, 148:111793.
[28] PENG X Y, MU T H, ZHANG M, et al.Effects of pH and high hydrostatic pressure on the structural and rheological properties of sugar beet pectin[J].Food Hydrocolloids, 2016, 60:161-169.
[29] ARACHCHIGE M P M, MU T H, MA M M.Structural, physicochemical and emulsifying properties of sweet potato pectin treated by high hydrostatic pressure and/or pectinase:A comparative study[J].Journal of the Science of Food and Agriculture, 2020, 100(13):4911-4920.
[30] LAMBADARIOS E, ZABETAKIS I.Does high hydrostatic pressure affect fruit esters?[J].LWT-Food Science and Technology, 2002, 35(4):362-366.
[31] XI J, SHEN D J, LI Y, et al.Micromechanism of ultrahigh pressure extraction of active ingredients from green tea leaves[J].Food Control, 2011, 22(8):1473-1476.
[32] 李翔. 超高压对高甲酯化果胶及其凝胶结构和功能特性的影响研究[D].厦门:厦门大学, 2019.
LI X.Study on the effect of ultra-high pressure on the structure and functional characteristics of high methyl esterified pectin and its gel[D].Xiamen:Xiamen University, 2019.
[33] 彭小燕, 木泰华, 孙红男, 等.超高压处理对甜菜果胶结构及乳化特性的影响[J].中国农业科学, 2015, 48(7):1405-1414.
PENG X Y, MU T H, SUN H N, et al.Effects of high hydrostatic pressure on the structural and emulsifying properties of sugar beet pectin[J].Scientia Agricultura Sinica, 2015, 48(7):1405-1414.
[34] SCHMELTER T, WIENTJES R, VREEKER R, et al.Enzymatic modifications of pectins and the impact on their rheological properties[J].Carbohydrate Polymers, 2002, 47(2):99-108.
[35] XIE F, ZHANG W, LAN X H, et al.Effects of high hydrostatic pressure and high pressure homogenization processing on characteristics of potato peel waste pectin[J].Carbohydrate Polymers, 2018, 196:474-482.
[36] GUO X Q, CHANG S, HU J P, et al.Research progress of pectin methylesterase and its inhibitors[J].Current Protein &Peptide Science, 2022, 23(10):684-696.
[37] LIU S Y, TIAN L F, CONG Y T, et al.Recent advances in polygalacturonase:Industrial applications and challenges[J].Carbohydrate Research, 2023, 528:108816.
[38] 李艳霞, 张水华, 刘仲明, 等.超高压加工对荔枝果肉中两种品质酶的影响[J].食品工业科技, 2005, 26(11):49-52.
LI Y X, ZHANG S H, LIU Z M, et al.Effect of high pressure on soluble proteins and two enzymes if litchi polp[J].Science and Technology of Food Industry, 2005, 26(11):49-52.
[39] 刘野, 张超, 赵晓燕, 等.高压二氧化碳和超高压对多酚氧化酶和果胶甲酯酶结构的影响[J].食品科学, 2011, 32(11):83-87.
LIU Y, ZHANG C, ZHAO X Y, et al.Effect of high pressure carbon dioxide and ultra-high pressure on structure of polyphenol oxidase and pectin methylesterase[J].Food Science, 2011, 32(11):83-87.
[40] ZHANG X Y, XU J Y, TIAN X Z, et al.Mechanisms of persimmon pectin methyl esterase activation by high pressure processing based on chemical experiments and molecular dynamics simulations[J].Food Chemistry, 2024, 432:137239.
[41] TIAN X Z, LIU Y X, ZHAO L, et al.Inhibition effect of high hydrostatic pressure combined with epigallocatechin gallate treatments on pectin methylesterase in orange juice and model system[J].Food Chemistry, 2022, 390:133147.
[42] VERLENT I, VAN LOEY A, SMOUT C, et al.Purified tomato polygalacturonase activity during thermal and high-pressure treatment[J].Biotechnology and Bioengineering, 2004, 86(1):63-71.
[43] PEETERS L, FACHIN D, SMOUT C, et al.Influence of β-subunit on thermal and high-pressure process stability of tomato polygalacturonase[J].Biotechnology and Bioengineering, 2004, 86(5):543-549.
[44] XU J Y, WANG Y L, ZHANG X Y, et al.A novel method of a high pressure processing pre-treatment on the juice yield and quality of persimmon[J].Foods.2021, 10(12):3069.
[45] WANG L J, ZHAO S, LIAO T Y, et al.Polysaccharide selection and mechanism for prevention of protein-polyphenol haze formation in beverages[J].Journal of Food Science, 2020, 85(11):3776-3785.
[46] 王丽颖, 李福香, 杨雅轩, 等.多糖与多酚相互作用机制及其对多酚特性的影响研究进展[J].食品科学, 2017, 38(11):276-282.
WANG L Y, LI F X, YANG Y X, et al.Interaction mechanism between polyphenols and polysaccharides and effect on polyphenolic properties:A review[J].Food Science, 2017, 38(11):276-282.
[47] HOU Z Q, LUAN L Q, HU X X, et al.Beneficial effects of high pressure processing on the interaction between RG-I pectin and cyanidin-3-glucoside[J].Food Chemistry, 2022, 383:132373.
[48] TAN C, LI D N, WANG H, et al.Effects of high hydrostatic pressure on the binding capacity, interaction, and antioxidant activity of the binding products of cyanidin-3-glucoside and blueberry pectin[J].Food Chemistry, 2021, 344:128731.
[49] SCHMITT C, TURGEON S L.Protein/polysaccharide complexes and coacervates in food systems[J].Advances in Colloid and Interface Science, 2011, 167(1-2):63-70.
[50] CHEN G, WANG S T, FENG B, et al.Interaction between soybean protein and tea polyphenols under high pressure[J].Food Chemistry, 2019, 277:632-638.
[51] WANG N, FAN H X, WANG J X, et al.Fabrication and characterization of curcumin-loaded composite nanoparticles based on high-hydrostatic-pressure-treated zein and pectin:Interaction mechanism, stability, and bioaccessibility[J].Food Chemistry, 2024, 446:138286.
[52] YANG Z Y, ZHANG Y, JIN G X, et al.Insights into the impact of modification methods on the structural characteristics and health functions of pectin:A comprehensive review[J].International Journal of Biological Macromolecules, 2024, 261:129851.
[53] YUE Y Y, WANG B T, XI W X, et al.Modification methods, biological activities and applications of pectin:A review[J].International Journal of Biological Macromolecules, 2023, 253:127523.
[54] 牟方婷, 袁美, 石黎琳, 等.超声和微波辅助果胶酶处理对果胶结构的影响[J].食品与发酵工业, 2021, 47(4):215-221; 236.
MU F T, YUAN M, SHI L L, et al.Effect of ultrasonic and microwave assisted with pectinase treatment on pectin structure[J].Food and Fermentation Industries, 2021, 47(4):215-221; 236.
[55] 赵文婷, 郭兴峰, 高林, 等.超高压辅助酶法制备低酯果胶[J].农业工程学报, 2015, 31(8):257-263.
ZHAO W T, GUO X F, GAO L, et al.Preparation of low-methoxyl pectin by high hydrostatic pressure-assisted with enzyme methods[J].Transactions of the Chinese Society of Agricultural Engineering, 2015, 31(8):257-263.
[56] MUDUGAMUWA ARACHCHIGE M P, MU T H, MA M M.Effect of high hydrostatic pressure-assisted pectinase modification on the Pb2+ adsorption capacity of pectin isolated from sweet potato residue[J].Chemosphere, 2021, 262:128102.
[57] MA J, TONG P Y, CHEN Y J, et al.The inhibition of pectin oligosaccharides on degranulation of RBL-2H3 cells from apple pectin with high hydrostatic pressure assisted enzyme treatment[J].Food Chemistry, 2022, 371:131097.
[58] WAN L, CHEN Q Q, HUANG M L, et al.Physiochemical, rheological and emulsifying properties of low methoxyl pectin prepared by high hydrostatic pressure-assisted enzymatic, conventional enzymatic, and alkaline de-esterification:A comparison study[J].Food Hydrocolloids, 2019, 93:146-155.