唾液链球菌嗜热亚种(Streptococcus salivarius subsp. thermophilus)是一种同型乳酸发酵、兼性厌氧的革兰氏阳性菌。作为链球属唯一公认的安全菌株,因其产酸和产香特征而广泛用于乳制品工业。乳制品作为唾液链球菌嗜热亚种的主要分离源,对其基因进化具有重要影响。YU等[1]对95株唾液链球菌嗜热亚种菌株进行了比较基因组分析,发现唾液链球菌嗜热亚种可以分为4个分支;其中分离自我国传统乳制品的菌株是ST1和ST2分支的重要来源,而工业发酵菌多分布于ST3和ST4分支。
前期研究多聚焦于唾液链球菌嗜热亚种商业菌株的碳源和氮源代谢能力,研究表明具有不同基因组特征的菌株其代谢能力和发酵特性存在显著差异。唾液链球菌嗜热亚种菌株在碳源利用方面可分解利用乳糖、半乳糖、葡萄糖、蔗糖和果糖等,其中菌株对乳糖的利用能力普遍高于葡萄糖[2]。在氮源代谢方面,唾液链球菌嗜热亚种仅含一种由PrtS编码的胞壁蛋白酶,可以水解蛋白质,将酪蛋白水解成寡肽供菌株利用[3]。此外,菌株中普遍存在的HtrA基因和SepM基因编码的胞外肽酶可以将环境中较长的肽链水解为短肽和氨基酸,但不同菌株的基因表达强度存在显著差异。研究表明,与游离氨基酸相比,寡肽是乳酸菌氮源利用的主要来源[4]。多肽的跨膜转运系统目前在不同菌株中共发现3条途径,这些跨膜转运系统具有菌株特异性[5];转运至胞内的肽段必须在内肽酶和氨肽酶的作用下才能分解为氨基酸进入菌株代谢系统。这些代谢途径在不同菌株中被证明,影响唾液链球菌嗜热亚种在乳环境中对乳糖、酪蛋白和小分子肽的利用情况,进而影响菌株代谢及发酵速率。
我国有着丰富而独特的唾液链球菌嗜热亚种菌株资源,但是目前尚缺乏针对我国特色唾液链球菌嗜热亚种菌株牛乳体系生长代谢特性的研究。因此本文选取了4株分离自我国且处于不同进化分支的唾液链球菌嗜热亚种菌株,比较了不同菌株在碳源代谢和氮源代谢方面的差异;探讨了菌株在培养基体系和牛乳体系生长代谢特性及其影响因素,分析不同菌株牛乳发酵差异原因,以期为唾液链球菌嗜热亚种菌株利用和产品开发提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
4株唾液链球菌嗜热亚种菌株来自江南大学食品学院生物技术中心菌种保藏库,菌株信息如表1所示。
表1 唾液链球菌嗜热亚种菌株信息
Table 1 The information of S.salivarius strains
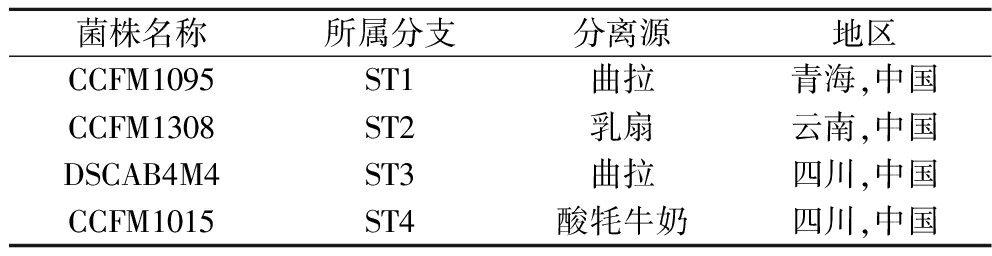
菌株名称所属分支分离源地区CCFM1095ST1曲拉青海,中国CCFM1308ST2乳扇云南,中国DSCAB4M4ST3曲拉四川,中国CCFM1015ST4酸牦牛奶四川,中国
1.1.2 试剂
脱脂乳粉(蛋白>32.9%,乳糖>54.5%),光明乳业股份有限公司;琼脂粉、牛肉膏、胰蛋白胨、冰醋酸、葡萄糖、大豆蛋白胨、酵母粉、Na2HPO4、吐温-80、FeSO4、酚酞、K2CrO4、柠檬酸氢二铵、无水乙酸钠、MgSO4、NaH2PO4、NaOH、NaCl、MnSO4、KH2PO4、乙醇、K2HPO4、HNO3、AgNO3、三氯乙酸、乙醚、亚铁氰化钾、CuSO4、三羟甲基氨基甲烷,国药集团化学试剂有限公司;抗坏血酸、β-甘油磷酸钠,上海麦克林生化科技有限公司。
1.1.3 培养基
乳酸链球菌培养基(standard lactic streptococci medium,M17)用于唾液链球菌嗜热亚种的活化及计数;化学限定培养基(chemically defined medium,CDM)用于唾液链球菌嗜热亚种碳源和氮源合成利用能力测定。
1.2 仪器设备
GR60DA型高压蒸汽灭菌器,美国ZEALWAY公司;超净工作台,北京鑫瑜佳创工程科技有限公司;pH计,奥豪斯仪器有限公司;5425R型台式高速冷冻离心机,德国Eppendorf公司;GKP-9160型隔水式恒温培养箱,上海森信实验仪器有限公司;LA84/A型电子分析天平,瑞士梅特勒-托利多公司;HD-UV90型紫外可见分光光度计,霍尔德电子科技有限公司;e2695型高效液相色谱仪,沃特世公司。
1.3 实验方法
1.3.1 唾液链球菌嗜热亚种碳水化合物利用能力测定
已灭菌的单一碳源M17中加入5 g/L的溴甲酚紫溶液(体积分数1.5%),将活化三代的唾液链球菌嗜热亚种按体积分数为2%的比例加入培养基中,于37 ℃分别培养12和24 h后取出观察颜色变化。每个样品设置3组平行。
1.3.2 唾液链球菌嗜热亚种氮源利用能力测定
酪蛋白利用能力测定:在不含氮源的CDM培养基中添加10 g/L酪蛋白作为唯一氮源,灭菌后按4%(体积分数)接入已活化三代的菌株,在生长第36、48和60 h测定OD600的值。每个样品设置3组平行。
氨基酸合成利用能力测定:参照LETORT等[6]的方法并略作修改。20种氨基酸质量浓度分别为(g/L):脯氨酸0.68;色氨酸0.05;苯丙氨酸0.28;丙氨酸0.24;甲硫氨酸0.12;缬氨酸0.33;亮氨酸0.48;甘氨酸0.18;异亮氨酸0.22;苏氨酸0.23;丝氨酸0.34;半胱氨酸0.25;酪氨酸0.29;天冬氨酸0.46;赖氨酸0.44;谷氨酸0.40;天冬酰胺0.35;谷氨酰胺0.39;精氨酸0.13;组氨酸0.15。
将氨基酸用水溶解超声后过0.22 μm水相滤膜除菌加入培养基中,按4%(体积分数)接入已活化三代的唾液链球菌嗜热亚种按,在生长第36、48和60 h测定OD600的值。
1.3.3 唾液链球菌嗜热亚种培养基体系生长产酸曲线测定
将已活化三代的菌株以体积分数2%的比例接种于M17中,于42 ℃恒温培养并每隔2 h取样测定菌液的pH值和OD600值,取样至生长曲线平稳为止。每个样品设置3组平行。
1.3.4 唾液链球菌嗜热亚种培养基体系主要酶活力测定
将活化两代的菌株以体积分数为2%的比例接种于200 mL的M17培养基中并在42 ℃下培养12 h,测定OD600值。12 000 r/min、4 ℃下离心5 min后收集菌体,用50 mmol/L PBS(pH 7.0)清洗2次后重悬于提取液中,冰浴超声波破碎(功率300 W,超声波3 s,间隔7 s,总时间3 min),12 000 r/min、4 ℃下离心15 min,取上清液即粗酶液置于冰上待测。
胞壁蛋白酶活力测定:参考姜杨[7]的方法并略作修改。配制三乙醇胺缓冲盐水溶液(tris buffered saline,TBS)和5 mg/mL的荧光标记酪蛋白储备液备用,根据试剂盒说明书稀释荧光标记酪蛋白工作液并测定485、538 nm下的荧光强度,使用BCA试剂盒测定蛋白含量。菌株胞壁蛋白酶比酶活力定义为每毫克蛋白增加的荧光强度。每个样品设置3组平行。
β-半乳糖苷酶活力测定:参考杨宇[8]的方法并略作修改。现用现配质量浓度为4 mg/mL的邻硝基苯-β-D-吡喃半乳糖苷(O-nitrophenyl-β-D-galactopyranoside,ONPG)溶液作为底物,于粗酶液中加入200 μL的底物溶液,置于30 ℃中恒温反应30 min,反应结束后加入500 μL Na2CO3溶液(1 mol/L)终止反应,将反应液于10 000 r/min、25 ℃下离心5 min后吸取上清液测定OD420和OD550值。菌株β-半乳糖苷酶活力定义为单位时间内从ONPG溶液中释放单位2-硝基苯酚所需的酶量。每个样品设置3组平行。
脲酶活力测定:使用脲酶活性检测试剂盒测定脲酶活力。参照ZOTTA等[9]的方法并略作修改。取适量粗酶液沸水浴处理5~10 min(密封以防止水分散失),冷却至室温后即为灭活酶液。按试剂盒说明书依次加入试剂,绘制标准曲线并测定OD630值,酶活力单位定义为每104个细菌每分钟生成1 μg的NH3-N所需的酶量。每个样品设置3组平行。
1.3.5 唾液链球菌嗜热亚种牛乳发酵生长及产酸能力测定
将活化三代以上的唾液链球菌嗜热亚种于8 000 r/min、4 ℃条件下离心20 min,菌泥用生理盐水洗涤2次后按菌泥与无菌脱脂乳质量1∶2重悬于脱脂乳中冻干,保证冻干菌粉中菌株活力为1010 CFU/mL以上,每次发酵实验前对菌粉进行活菌计数。按质量分数为11%配制复原脱脂乳,搅拌至乳粉完全溶解,置于4 ℃水合12 h以上,105 ℃灭菌10 min。将菌粉复溶后加入脱脂乳保证接菌量为106 CFU/mL以上。完全摇匀后置于42 ℃培养箱中恒温发酵。在菌株接种后的0~24 h每隔2 h取样1次,用pH计测定pH变化,将发酵乳梯度稀释后对活菌进行计数。每个时间点样品3组平行。
1.3.6 唾液链球菌嗜热亚种牛乳发酵过程中糖利用能力测定
乳糖、半乳糖和葡萄糖利用能力测定:参考杨宇[8]的方法并略作修改。称取0.50 g发酵乳样品,用1.4 mL超纯水稀释后55 ℃超声波10 min,然后加入3.1 mL乙腈,混匀后常温静置5 min以沉淀蛋白质。之后将样品于8 000 r/min、4 ℃下离心3 min后将上清液通过0.45 μm有机相滤膜过滤。通过Waters HPLC用Sugar-pak1 6.5 mm×300 mm2柱以及蒸发光散射检测器ELSD检测。
β-半乳糖苷酶活力测定:取不同发酵时间的发酵乳样品5 mL,用体积比为1∶3的Tris酸溶液(0.6 g/L三羟甲基氨基甲烷用水溶解,用1 mol/L HCl溶液调pH值至6.5)洗涤3次,6 000 r/min离心5 min,倒掉上清液,用PBS(称取8.0 g NaCl、0.2 g KCl、1.44 g Na2HPO4、0.24 g KH2PO4溶于800 mL蒸馏水中,用HCl溶液调节溶液pH值至7.4,最后加蒸馏水定容至1 L即可得0.01 mol/L PBS)复溶至OD600值在0.6~1.0。其余操作同1.3.4节。
1.3.7 唾液链球菌嗜热亚种发酵乳乳清肽浓度测定
使用PierceTM定量肽检测试剂盒测定肽浓度。分别取1、2、4、6、8、10 μL质量浓度为1 mg/mL的肽标准品于96孔板中,加水补足至每孔均为20 μL,加入180 μL工作液(试剂A∶试剂B∶试剂C=50∶48∶2,体积比)并于37 ℃静置15 min,快速测定OD480值,绘制标准曲线。实验组在孔板内加入稀释后的乳清溶液以保证浓度在标准曲线范围内,其余操作与绘制标准曲线相同。
1.3.8 唾液链球菌嗜热亚种牛乳发酵代谢特征差异分析
参考CUI等[10]的方法并略作修改。吸取1 mL样品冻干后准确称取0.030 g冻干样品,加入1 mL甲醇溶液振荡混匀后于-20 ℃静置12 h,14 000 r/min、4 ℃离心15 min后,吸取500 μL上清液并加入10 μL 2 mg/mL核糖醇甲醇溶液(现用现配),充分振荡混匀后干燥至试剂完全挥干。每个样品3组平行。向样品中加入100 μL 10 mg/mL甲氧羟胺盐酸盐吡啶溶液(现用现配),混匀后37 ℃加热60 min,之后加入40 μL的双(三甲基硅基)三氟乙酰胺(N-methyl-N-(trimethylsilyl) trifluoroacetamide,MSTFA)试剂,混匀后40 ℃加热30 min,于4 ℃下11 000 r/min离心15 min,吸取100 μL上清液进行GC-MS分析。选用Rtx-5MS毛细管柱(30 m×0.25 mm,0.25 μm)配备高纯氦为载气进样,其余气相及质谱条件参照杨宇[8]的方法设置。最后用NIST2001库比对各峰图,用面积归一化法相对定量。
1.4 统计分析及数据处理
使用SPSS 22.0进行单因素方差分析;用GraphPad Prism 9.0.0、Origin 2023绘图;使用Metaboanalyst(https://www.metaboanalyst.ca/)绘制PCA图、VIP图和气泡图。
2 结果与讨论
2.1 唾液链球菌嗜热亚种生长特性研究
2.1.1 唾液链球菌嗜热亚种碳水化合物利用能力差异
糖代谢为细胞的生长和繁殖提供必需的能量,碳源利用情况直接影响菌株的生长情况。4株唾液链球菌嗜热亚种菌株的碳水化合物利用能力情况如表2所示。所有菌株都可以利用乳糖、蔗糖、果糖和葡萄糖,均不能利用岩藻糖、N-乙酰葡萄糖胺和N-乙酰半乳糖胺。研究表明,嗜热链球菌利用葡萄糖、乳糖和果糖是所有现有研究的共同特征,而其他糖类的利用则存在明显的菌株差异[11]。在唾液链球菌嗜热亚种可以代谢的不同糖类(蔗糖、葡萄糖、果糖、乳糖和半乳糖)中,菌株更喜欢乳糖作为其主要碳源[12]。菌株DSCAB4M4和CCFM1015无法利用半乳糖。菌株的碳水化合物利用能力表明,4株菌均具有在牛乳体系利用乳糖生长产酸的潜力。
表2 唾液链球菌嗜热亚种单一碳水化合物利用能力
Table 2 Carbohydrate utilization ability of S.thermophilus
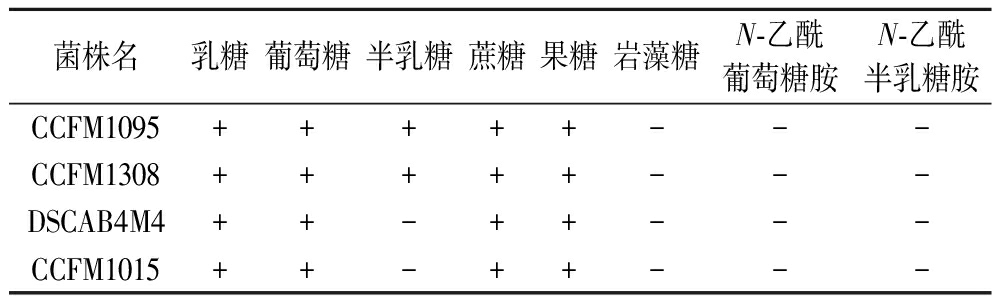
菌株名乳糖葡萄糖半乳糖蔗糖果糖岩藻糖N-乙酰葡萄糖胺N-乙酰半乳糖胺CCFM1095+++++---CCFM1308+++++---DSCAB4M4++-++---CCFM1015++-++---
注:+代表菌株可以自我合成;-代表菌株不能自我合成(下同)。
2.1.2 唾液链球菌嗜热亚种氮源利用能力差异
牛乳中酪蛋白约占总蛋白质含量的70%,因此探究菌株是否可以代谢酪蛋白对菌株能否在牛乳中生长至关重要。4株唾液链球菌嗜热亚种在仅以酪蛋白为唯一氮源的CDM中的生长状况如图1所示。仅菌株CCFM1015生长状况良好,而其他3株菌无法以酪蛋白作为氮源满足自身生长。酪蛋白利用能力差异说明除CCFM1015外的3株菌可能在牛乳体系中的生长受氮源利用限制。
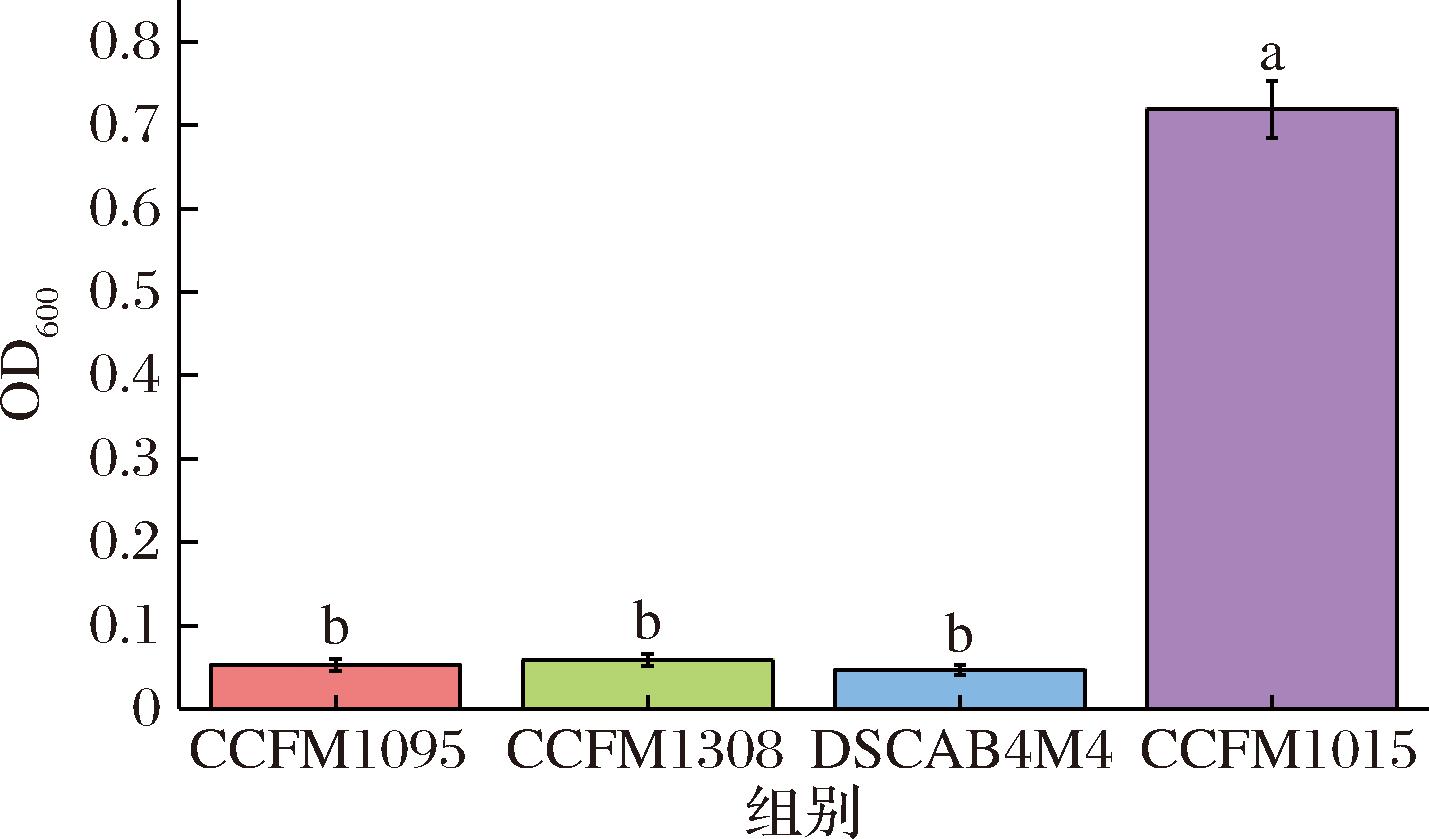
图1 唾液链球菌嗜热亚种在以酪蛋白为氮源的CDM培养基中生长情况
Fig.1 Growth of S.salivarius in CDM medium with casein as nitrogen source
注:a~d表示标有不同字母的组别具有显著性差异(P<0.05)(下同)。
针对菌株无法利用酪蛋白的情况,进一步探究菌株是否可以通过自身氨基酸的合成弥补这一缺陷。4株菌的氨基酸营养缺陷情况如表3所示。菌株对于氨基酸的利用有2种方式:一种是直接摄取环境中的氨基酸进行代谢,另一种是通过菌株自身代谢合成。与通过生物体自身代谢合成所需的氨基酸不同,氨基酸营养缺陷型菌株无法通过自身合成这些氨基酸,必须通过从外部环境中摄取相应的氨基酸满足自身生长,依赖外源氨基酸供应。所有菌株都存在氨基酸营养缺陷,但菌株CCFM1095存在最多的营养缺陷类型,共缺乏8种氨基酸的生物合成能力;其他3株菌均存在2种氨基酸缺陷类型。所有菌株都属于半胱氨酸缺陷型,此外CCFM1308缺乏组氨酸合成能力;DSCAB4M4缺乏赖氨酸合成能力,CCFM1015缺乏亮氨酸的生物合成能力。而菌株CCFM1095除半胱氨酸外,自身还无法合成缬氨酸、精氨酸、组氨酸、蛋氨酸、亮氨酸、异亮氨酸和赖氨酸。牛乳环境本身所含游离氨基酸较少,菌株CCFM1095较弱的氨基酸合成能力有可能成为菌株在氮源缺乏的环境中限制生长的最重要因素之一。有文献[11]表明,链球菌属的菌株大部分存在多种氨基酸营养缺陷,因此大部分链球菌属都存活在营养物质较为丰富的环境中,例如植物、人类黏膜和乳环境中。GARAULT等[13]证明了支链氨基酸生物合成途径是唾液链球菌嗜热亚种在牛奶中最佳生长的必要途径,且蛋氨酸在含硫氨基酸的相互转化中起着核心作用。
表3 唾液链球菌嗜热亚种氨基酸缺陷类型
Table 3 Types of amino acid deficiency of S.salivarius
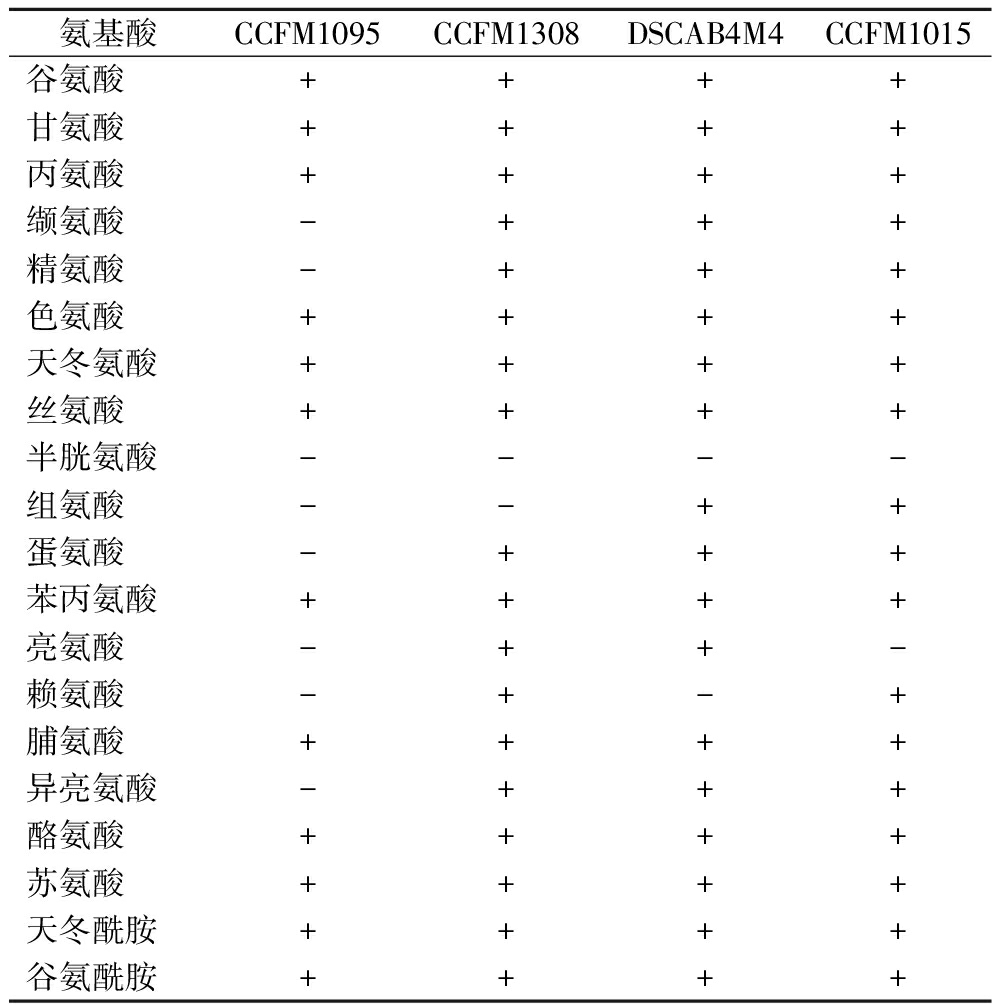
氨基酸CCFM1095CCFM1308DSCAB4M4CCFM1015谷氨酸++++甘氨酸++++丙氨酸++++缬氨酸-+++精氨酸-+++色氨酸++++天冬氨酸++++丝氨酸++++半胱氨酸----组氨酸--++蛋氨酸-+++苯丙氨酸++++亮氨酸-++-赖氨酸-+-+脯氨酸++++异亮氨酸-+++酪氨酸++++苏氨酸++++天冬酰胺++++谷氨酰胺++++
2.1.3 唾液链球菌嗜热亚种培养基体系生长特性差异
4株菌在以乳糖为唯一碳源的M17中生长特性如图2-a所示。可以看出,4株菌在M17中的生长能力存在显著差异,菌株CCFM1015和CCFM1095在12 h后OD600值趋于稳定,菌株CCFM1308和DSCAB4M4在10 h趋于稳定。菌株CCFM1015的OD600值最高,其次是菌株CCFM1095和CCFM1308,而菌株DSCAB4M4的OD600值最低,说明菌株DSCAB4M4在以乳糖为单一碳源的M17中生长能力较差,而菌株CCFM1015的生长能力最好。同时监测了4株菌在该培养条件下的产酸能力,如图2-b所示。可以看出,与生长能力变化相似,4株菌在2~12 h和5.71,菌株CCFM1308产酸能力次之,12 h pH值为5.82,而菌株DSCAB4M4产酸能力最差,12 h时pH值仅为6.36。因此,除菌株DSCAB4M4外,其余3株菌具有发酵牛乳的潜力。
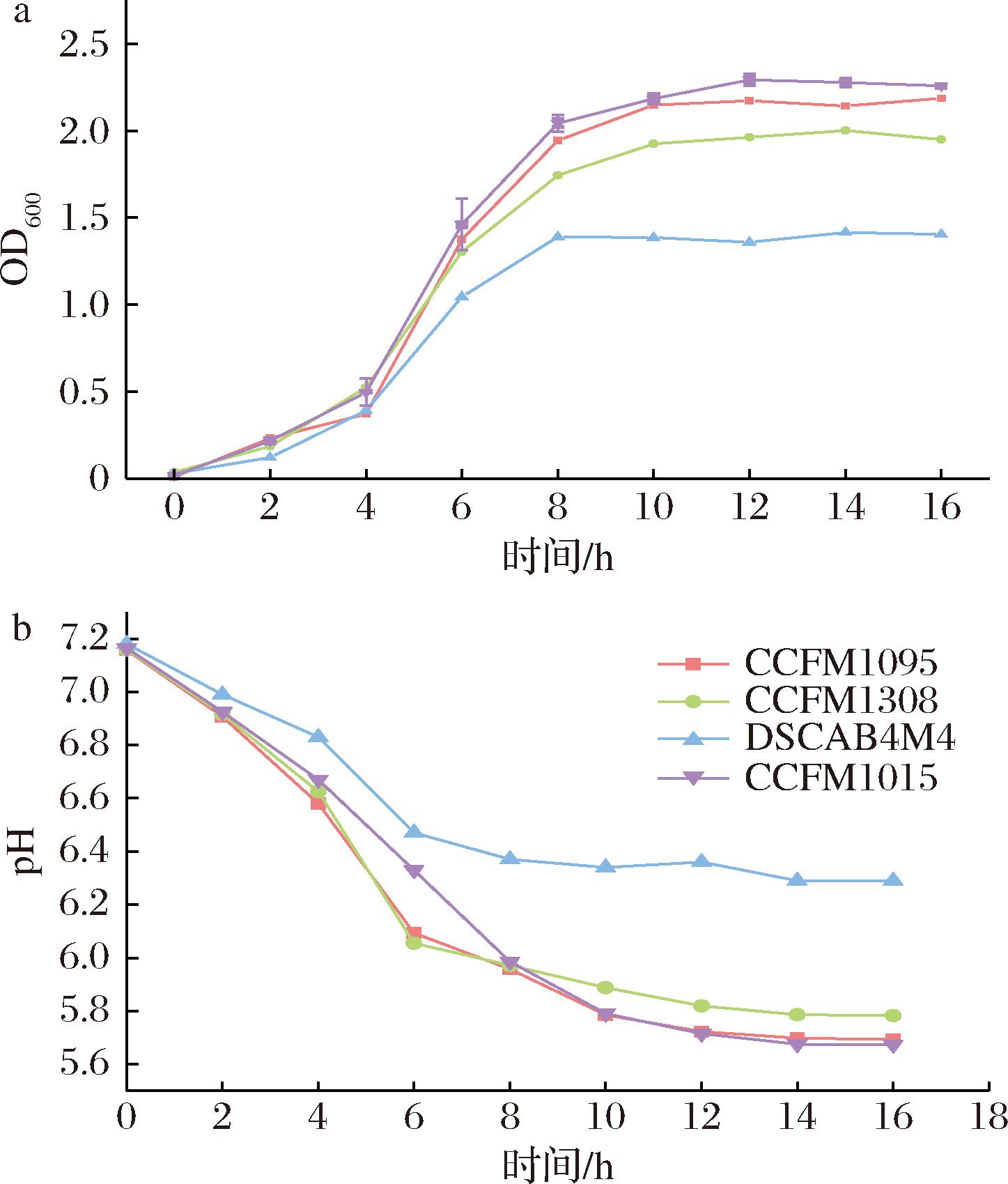
a-OD值;b-pH值
图2 唾液链球菌嗜热亚种M17中生长产酸能力差异
Fig.2 Differences in growth and acid production ability in lactose-M17 broth of S.salivarius
快速生长代谢乳糖产酸,并在12 h后pH达到稳定值,除菌株DSCAB4M4外,菌株CCFM1015和CCFM1095产酸能力相当,12 h时pH值分别为5.72
2.1.4 唾液链球菌嗜热亚种培养基体系酶活力特性差异
脲酶被认为广泛存在于唾液链球菌嗜热亚种中,脲酶的功能之一是为谷氨酰胺的合成提供氨[14],脲酶对唾液链球菌嗜热亚种耐酸性的提高至关重要,可代谢尿素产生氨减缓环境酸化速率[9]。4株唾液链球菌嗜热亚种在M17中的脲酶活性、胞壁蛋白酶酶活力及β-半乳糖苷酶活力如图3所示。可以看出,菌株CCFM1015这3种酶的活力显著高于其他3株菌,其中除菌株菌株CCFM1015外其余菌株均无胞壁蛋白酶酶活力,这与前述仅CCFM1015有PrtS基因吻合。β-半乳糖苷酶活力菌株CCFM1095仅次于CCFM1015,而DSCAB4M4的酶活力最低。而DSCAB4M4的脲酶较CCFM1095和CCFM1308无明显降低,说明对于菌株DSCAB4M4来说,较低的β-半乳糖苷酶活力可能是限制其在M17培养基中快速生长产酸的因素之一。
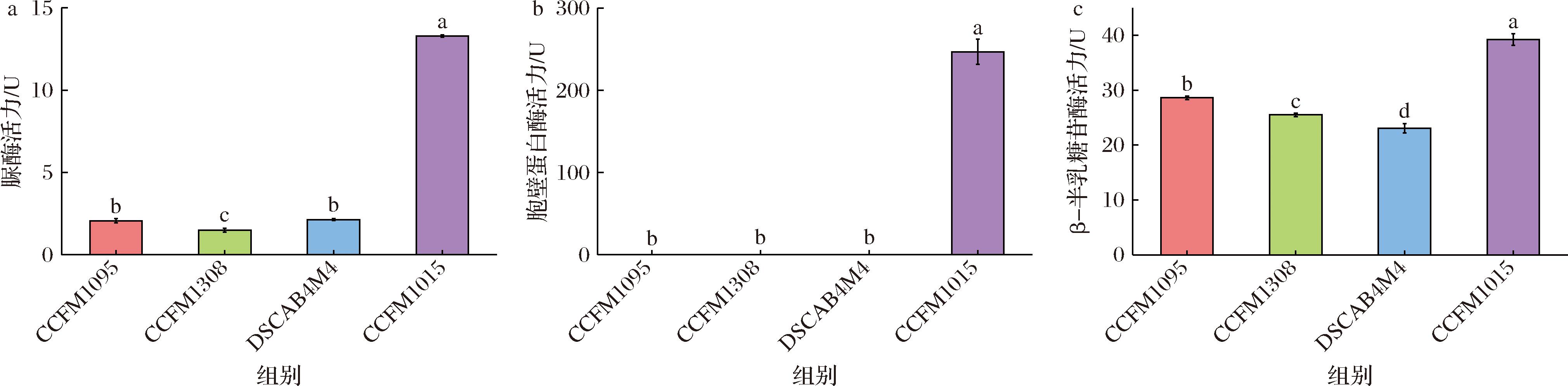
a-脲酶活力;b-胞壁蛋白酶活力;c-β-半乳糖苷酶活力
图3 唾液链球菌嗜热亚种M17中酶活力差异
Fig.3 Differences in enzyme activity in lactose-M17 broth of S.salivarius
2.2 唾液链球菌嗜热亚种牛乳发酵特性研究
2.2.1 唾液链球菌嗜热亚种牛乳发酵生长产酸能力差异
4株唾液链球菌嗜热亚种在脱脂牛乳体系中的生长产酸特性如图4所示。可以看出,菌株CCFM1095生长产酸速率最快,在8 h活菌数增量达到2.40个数量级,pH值降至4.61。在发酵后期活菌数增长量减缓甚至略微下降,有可能是因为菌株利用酪蛋白[15]且乳环境酸度不断提高而限制了生长速率。而其余3株菌产酸速度缓慢,在发酵24 h后CCFM1308的pH值约为5.00,CCFM1095和DSCAB4M4分别为5.27和5.48,均未达到凝乳点,3株菌的活菌数增量最大只有1.04个数量级,生长速度缓慢。与M17体系不同,4株菌在牛乳体系中显示出完全不同的生长速率,2种培养基均以乳糖作为碳源且添加量足够,但与牛乳中富含较多酪蛋白等蛋白质相比,M17中含有可供菌株直接利用的氮源——丰富的肽和氨基酸,菌株可以在M17中不通过水解酪蛋白的步骤即可获得氮源,这可能会削弱菌株间在氮源利用上的差异。
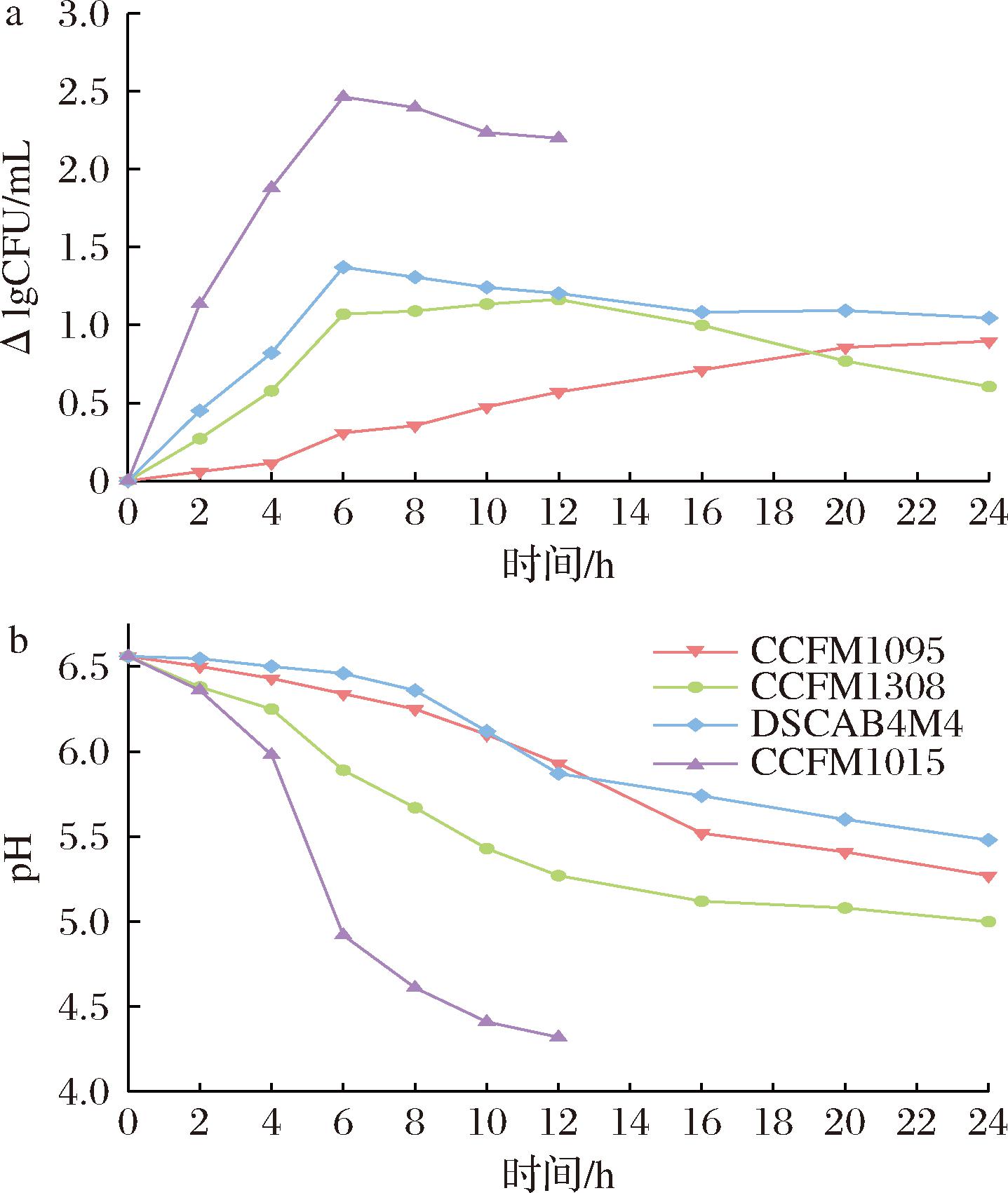
a-菌株牛乳体系活菌数变化;b-牛乳体系pH值变化
图4 唾液链球菌嗜热亚种牛乳发酵过程中生长产酸能力差异
Fig.4 Differences in growth and acid production ability of S.salivarius fermented in skim milk
2.2.2 唾液链球菌嗜热亚种牛乳发酵乳糖利用能力差异
从图4可以看出,菌株在牛乳体系中的生长产酸主要发生在前12 h,因此研究了发酵前12 h环境中的乳糖、半乳糖和葡萄糖变化情况,如图5所示。从图5-a可以看出,4株菌在乳糖消耗量和时间上存在显著差异,菌株CCFM1015在发酵0~4 h快速代谢乳糖,菌株DSCAB4M4和CCFM1308在0~8 h快速消耗乳糖,相比而言,菌株CCFM1095在12 h内消耗乳糖含量极少。由图5-b和图5-c可以看出,除CCFM1095外,由于无法代谢半乳糖,菌株DSCAB4M4和CCFM1015环境中的半乳糖含量不断积累,而菌株CCFM1308在4 h后半乳糖含量没有显著变化,可能是因为菌株在产生半乳糖的同时代谢利用;3株菌环境中的葡萄糖含量也在4 h以后快速下降,说明在发酵0~4 h菌株快速代谢乳糖,而4~12 h除利用乳糖外,还利用半乳糖和葡萄糖进行生长。而菌株CCFM1095因为消耗乳糖含量少,导致生成的半乳糖和葡萄糖含量极少。
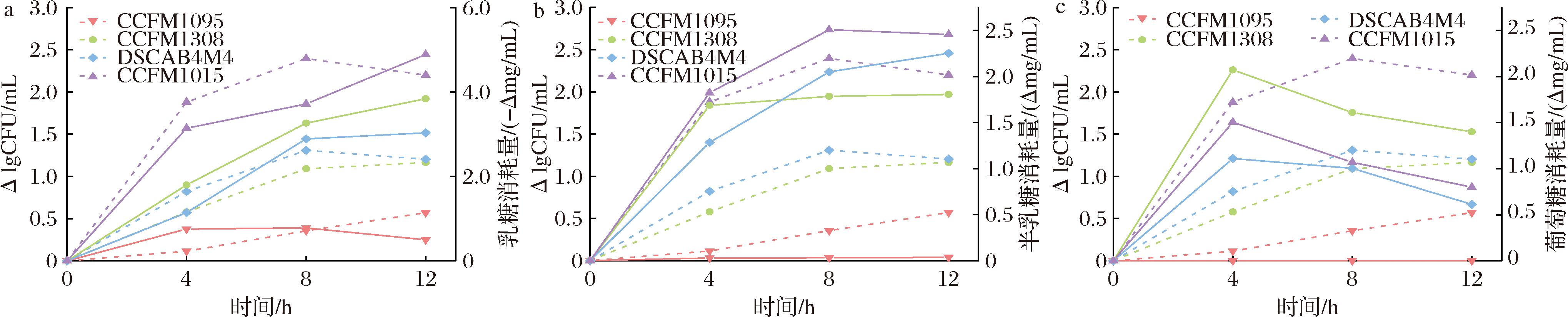
a-牛乳体系前12 h乳糖消耗量;b-半乳糖消耗量;c-葡萄糖消耗量
图5 唾液链球菌嗜热亚种牛乳发酵前12 h乳糖利用能力差异
Fig.5 Differences in lactose utilization ability of S.salivarius fermented milk for 12 hours
注:实线(右侧)代表物质变化情况;虚线(左侧)代表菌株活菌数变化(下同)。
由图6可知,菌株CCFM1015在4 h酶活力达到最大,而菌株CCFM1308和DSCAB4M4在8 h酶活最大,而菌株CCFM1095酶活力最低。与牛乳体系相比,M17体系富含更丰富的氮源,菌株CCFM1095的β-半乳糖苷酶活力也较牛乳中更高,说明该菌株乳糖代谢能力受到了氮源利用的影响,进而影响在牛乳中的生长产酸。因此推测CCFM1095在牛乳体系中因无法利用酪蛋白而极大地限制了其生长。
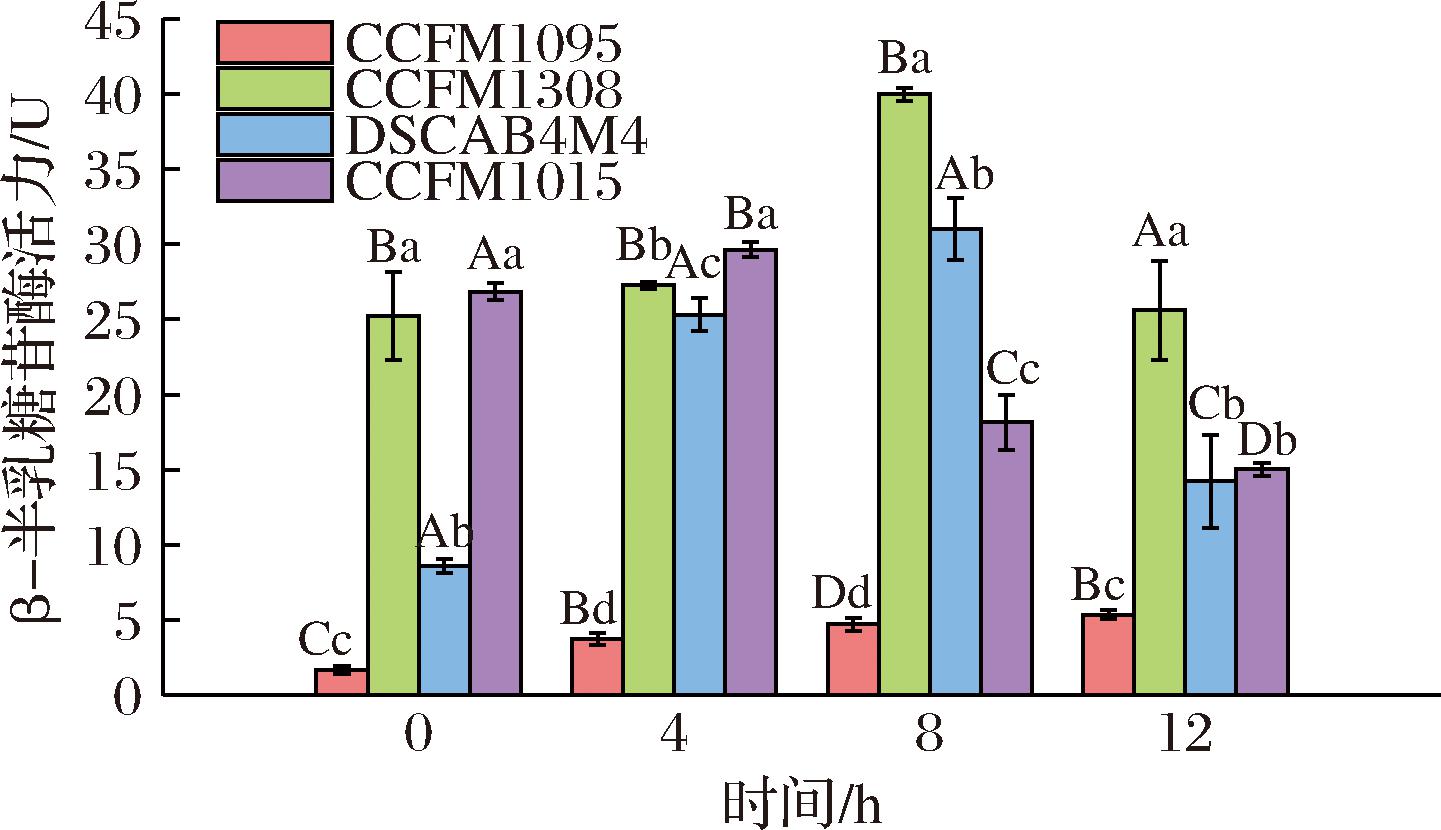
图6 唾液链球菌嗜热亚种牛乳中β-半乳糖苷酶活力
Fig.6 The β-galactosidase activity of S.salivarius strains fermented in skim milk
注:a~d表示同一时间不同菌株的组别标有不同字母则具有显著性差异(P<0.05);A~D表示同一菌株不同时间的组别标有不同字母则具有显著性差异(P<0.05)。
2.2.3 唾液链球菌嗜热亚种牛乳发酵氮源利用能力差异
前12 h发酵乳中的肽质量浓度测定结果如图7所示。不同菌株的肽利用情况不同,对菌株CCFM1015来说,在0~4 h菌株快速利用环境中的多肽,而在4 h以后,多肽浓度趋于稳定,可能是菌株在利用多肽的同时释放PrtS酶分解酪蛋白产生多肽,达到肽消耗和生成的平衡。其余3株菌均无法利用酪蛋白,CCFM1308在4~8 h快速利用多肽,而DSCAB4M4在0~4 h快速利用多肽。相比而言,菌株CCFM1095在4~12 h缓慢利用多肽。结合生长特性来看,除CCFM1095外,其余菌株均在0~8 h实现快速生长,而CCFM1095在0~12 h内保持均一的生长速率。由此可见,氮源利用能力影响着菌株的生长情况。
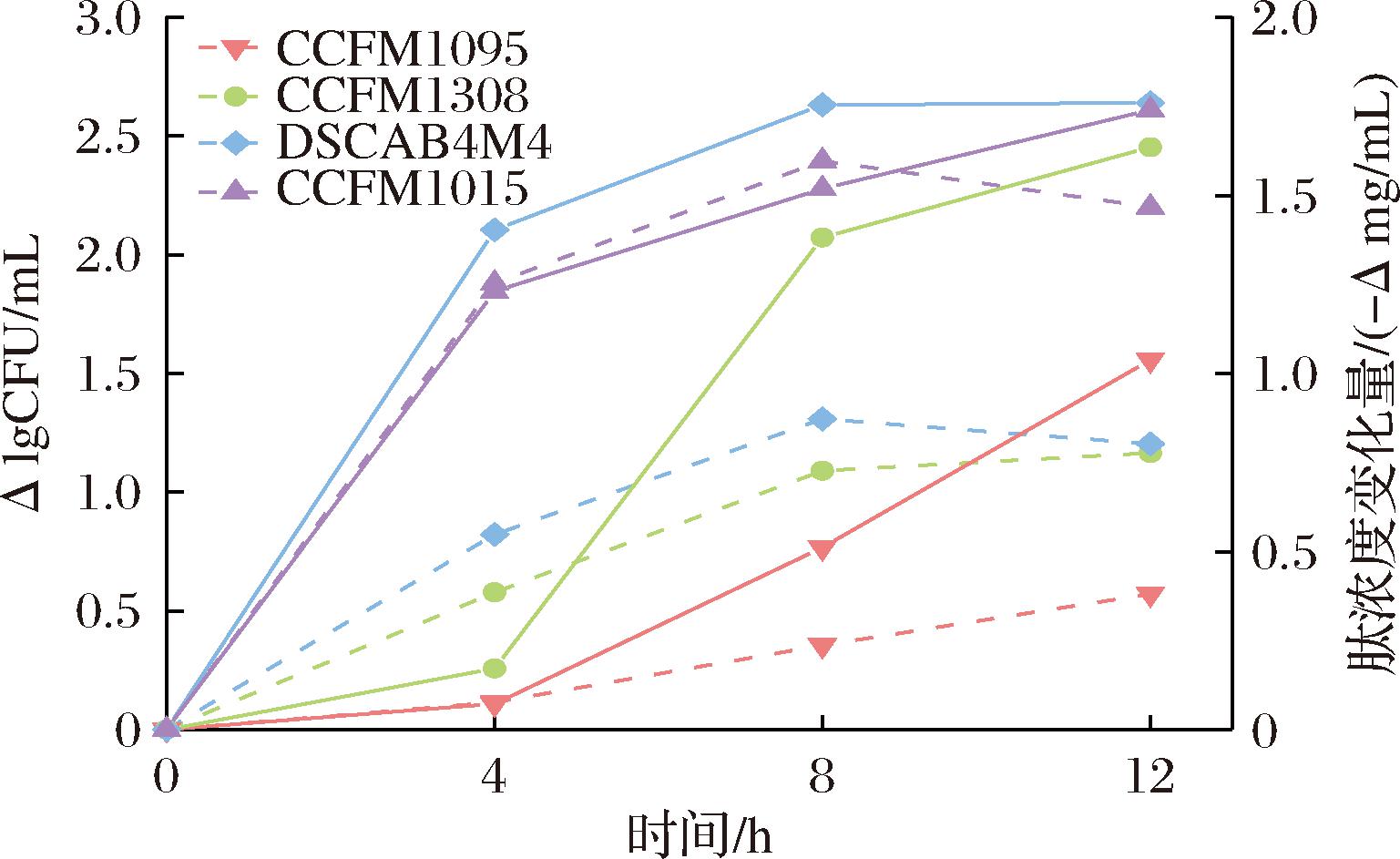
图7 唾液链球菌嗜热亚种发酵过程牛乳体系多肽含量变化
Fig.7 Changes in peptide content in milk fermentation process of S.salivarius
2.2.4 唾液链球菌嗜热亚种牛乳发酵代谢差异
4株唾液链球菌嗜热亚种的物质利用差异会导致不同菌株发酵乳间代谢物质差异较大,因此测定了4株菌发酵乳中的物质组成,结果如图8所示。经过发酵后不同样品在物质组成上与原乳存在显著差异,且CCFM1095发酵乳与其他3株菌相比差异更大。在VIP值大于1的20种差异代谢物中,原乳中含量较高的丝氨酸、腺嘌呤、谷氨酸、苏氨酸、色氨酸和莽草酸等含量显著下降且在菌株CCFM1308发酵乳中下降最快。而乳酸、羟基乙酸、羟基丁酸、硬脂酸、丁酸、丙酸和戊酸等有机酸在发酵过程中大量积累。这些差异物涉及的代谢通路主要集中在半乳糖代谢和氨基酸代谢,其中CCFM1095在乳糖代谢上更突出,菌株CCFM1038对于氨基酸的利用能力较高,在氨基酸代谢上则表现得更为活跃。
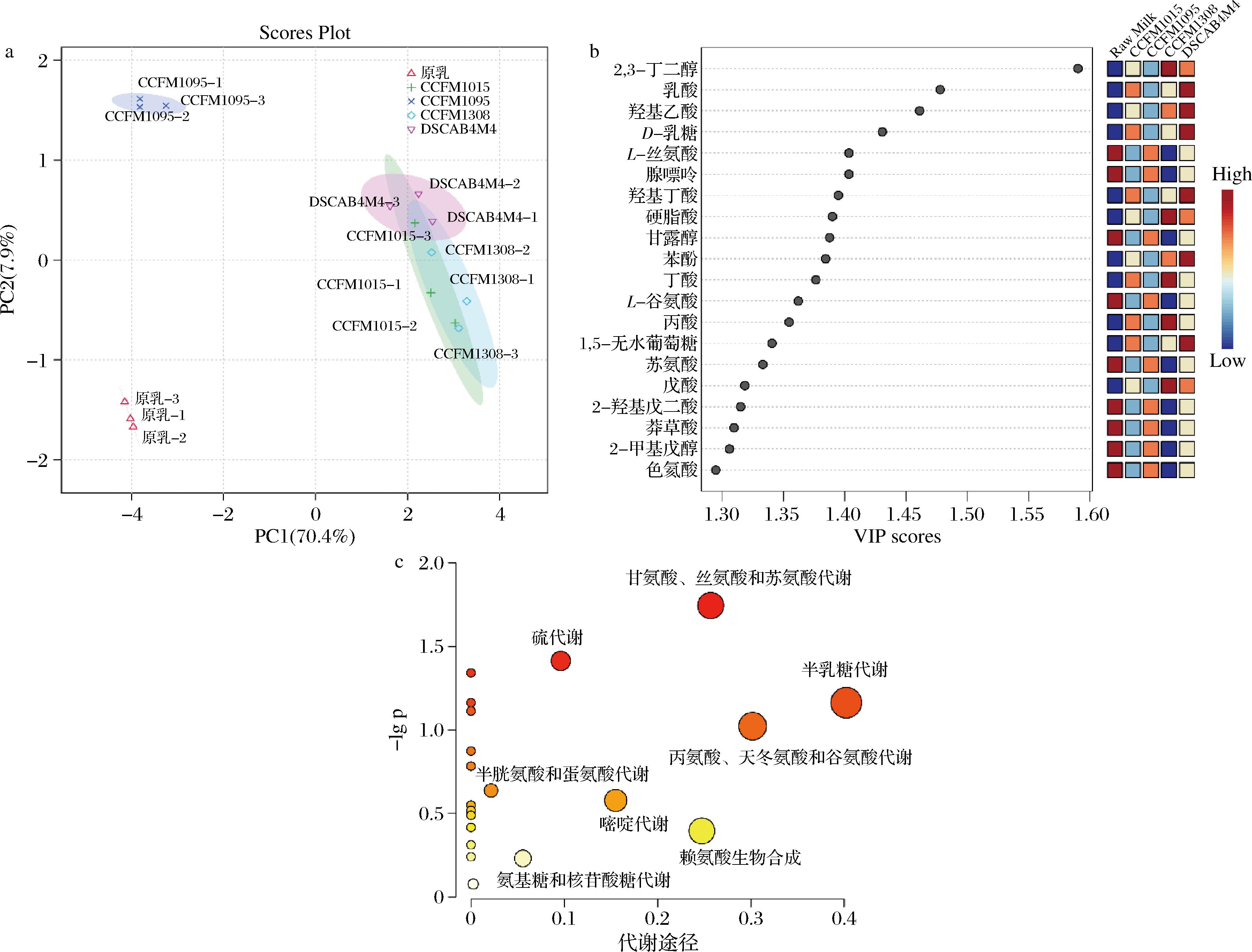
a-PLSDA;b-差异代谢物分析(VIP>1);c-差异物质KEGG通路分析
图8 唾液链球菌嗜热亚种牛乳发酵代谢物差异
Fig.8 Metabolite differences of S.salivarius in milk
3 结论
唾液链球菌嗜热亚种对碳源和氮源的利用能力显著影响其生长和发酵速率,而不同菌株间物质代谢能力存在显著差异。通过对分离自我国传统乳制品的隶属不同进化分支的菌株进行研究发现,碳水化合物利用方面,仅CCFM1095和CCFM1308可以代谢利用半乳糖。在氮源利用方面,仅CCFM1015可以水解酪蛋白,所有菌株均无法合成半胱氨酸;CCFM1095属于8种氨基酸营养缺陷型,氮源利用显著影响菌株生长代谢。4株菌在营养丰富的M17中除DSCAB4M4外其他菌株生长产酸无显著差异,而在牛乳体系中菌株在0~12 h快速代谢生长,其中仅CCFM1015发酵迅速,其他3株菌在24 h均未达到发酵终点,特别是CCFM1095乳糖代谢能力与其在培养基中相比显著降低。菌株间差异代谢物主要集中在半乳糖代谢途径和氨基酸代谢途径,氮源利用可能是限制菌株牛乳体系生长的重要因素。通过解析不同分支代表菌株的代谢差异和牛乳发酵速率差异的原因,以期为后续针对性改进菌株发酵效率、助力菌株在发酵乳制品中的应用。
[1] YU P, JIANG Y, PAN Y Q, et al.Strain-specific effect of Streptococcus thermophilus consumption on host physiology[J].Food Science and Human Wellness, 2024, 13(5):2876-2888.
[2] VAN DEN BOGAARD P T C, HOLS P, KUIPERS O P, et al.Sugar utilisation and conservation of the gal-lac gene cluster in Streptococcus thermophilus[J].Systematic and Applied Microbiology, 2004, 27(1):10-17.
[3] 白凤翎, 张柏林, 赵宏飞.乳酸菌蛋白代谢研究进展[J].食品科学, 2010, 31(19):381-384.
BAI F L, ZHANG B L, ZHAO H F.Progress in protein metabolism of lactic acid bacteria[J].Food Science, 2010, 31(19):381-384.
[4] ZHAO H F, BAI F L, ZHOU F, et al.Characterization of soybean protein hydrolysates able to promote the proliferation of Streptococcus thermophilus ST[J].Journal of Food Science, 2013, 78(4):M575-M581.
[5] POQUET I, SAINT V, SEZNEC E, et al.HtrA is the unique surface housekeeping protease in Lactococcus lactis and is required for natural protein processing[J].Molecular Microbiology, 2000, 35(5):1042-1051.
[6] LETORT C, JUILLARD V.Development of a minimal chemically-defined medium for the exponential growth of Streptococcus thermophilus[J].Journal of Applied Microbiology, 2001, 91(6):1023-1029.
[7] 姜杨. 瑞士乳杆菌功能基因组解析及其生物学作用研究[D].无锡:江南大学, 2023.
JIANG Y.Characterization of functional genomics and biological function of Lactobacillus helveticus[D].Wuxi:Jiangnan University, 2023.
[8] 杨宇. 基于发酵特性的乳酸乳球菌乳酸亚种基因组分析及应用[D].无锡:江南大学, 2022.
YANG Y.Functional genomic analysis of Lactococcus lactis subsp.lactis focusing on fermentation characteristics and application in fermentation[D].Wuxi:Jiangnan University, 2022.
[9] ZOTTA T, RICCIARDI A, ROSSANO R, et al.Urease production by Streptococcus thermophilus[J].Food Microbiology, 2008, 25(1):113-119.
[10] CUI S M, ZHAO N, LU W W, et al.Effect of different Lactobacillus species on volatile and nonvolatile flavor compounds in juices fermentation[J].Food Science &Nutrition, 2019, 7(7):2214-2223.
[11] CUI Y H, XU T T, QU X J, et al.New insights into various production characteristics of Streptococcus thermophilus strains[J].International Journal of Molecular Sciences, 2016, 17(10):1701.
[12] VAILLANCOURT K, MOINEAU S, FRENETTE M, et al.Galactose and lactose genes from the galactose-positive bacterium Streptococcus salivarius and the phylogenetically related galactose-negative bacterium Streptococcus thermophilus:Organization, sequence, transcription, and activity of the gal gene products[J].Journal of Bacteriology, 2002, 184(3):785-793.
[13] GARAULT P, LETORT C, JUILLARD V, et al.Branched-chain amino acid biosynthesis is essential for optimal growth of Streptococcus thermophilus in milk[J].Applied and Environmental Microbiology, 2000, 66(12):5128-5133.
[14] MONNET C, MORA D, CORRIEU G.Glutamine synthesis is essential for growth of Streptococcus thermophilus in milk and is linked to urea catabolism[J].Applied and Environmental Microbiology, 2005, 71(6):3376-3378.
[15] LETORT C, NARDI M, GARAULT P, et al.Casein utilization by Streptococcus thermophilus results in a diauxic growth in milk[J].Applied and Environmental Microbiology, 2002, 68(6):3162-3165.