开菲尔(Kefir)是一种通过牛奶与开菲尔粒(Kefir Grain)共生发酵制成的含酒精发酵饮料[1],口感微酸,具有丰富的风味[2],并且富含维生素、矿物质和益生菌[3]。这种开菲尔发酵乳含有特定的微生物菌群混合物,它们以共生的方式存在于开菲尔发酵乳中,占据其主要生态位的细菌主要为乳酸细菌,真菌主要为酵母[4],此外,还含有一些可变的微生物群[5]。开菲尔复杂的微生物群落和他们之间的相互作用是其丰富功能性和益生性的基础,微生物间的相互作用在开菲尔的发酵过程中发挥着关键作用。有研究表明,不同的微生物相互作用可以导致开菲尔代谢发生改变,这些代谢产物呈现出不同的风味和口感特征[6]。此外,它们还影响着开菲尔的功能性和益生性,表现出调节良好的免疫系统、抗过敏反应[7]、治疗肥胖[8]、抗病原菌[9]和调节肠道菌群[10]等活性,使其在功能性食品领域具有广泛的应用前景。
开菲尔乳杆菌(Lactobacillus kefiri)是一种天然的开菲尔特异性菌株[11],是良好的益生菌,其在开菲尔粒中占据主导地位[12]。其发酵上清液被证明具有抗氧化活性和抗衰老作用[13],其代谢产生的胞外多糖是有效的益生元,并且对黄曲霉毒素具有较高的抑制率[14]。马尔克斯克鲁维酵母(Kluyveromyces marxianus )和酿酒酵母(Saccharomyces cerevisiae)是开菲尔中的主要真菌[15],二者均属酵母纲但属不同的科。二者都能够利用碳水化合物进行发酵,将其转化为酒精和CO2。而K. marxianus常被用于生产乳制品、酒精和酶等产品[16],而S. cerevisiae 主要用于啤酒、葡萄酒和其他发酵酒的生产。由于K. marxianus还具有代谢乳糖的能力,通常也被应用于奶啤的发酵生产[17]。
由于混合发酵发酵乳中微生物之间存在着复杂的相互作用,这些作用导致发酵过程、品质等发生较大的改变。本文实验室筛选的一株高产胞外多糖的L. kefiri,和从开菲尔中筛选出来的2株酵母进行共培养,以研究他们的相互作用对生长和代谢的影响,旨在为研究L. kefiri和酵母菌的相互作用并应用到代谢产物提取和发酵生产提供一定基础。
1 材料与方法
1.1 材料与仪器
1.1.1 菌种
Lactobacillus kefiri L63、Kluyveromyces marxianus Y4、Saccharomyces cerevisiae Y2,均采自并分离于内蒙古自治区锡林郭勒盟牧民家中的开菲尔粒。
1.1.2 培养基与试剂
MRS培养基(质量分数):蛋白胨1%、牛肉粉0.5%、酵母粉0.5%、葡萄糖2%、吐温-80 0.1%、K2HPO4 0.2%、CH3COONa 0.5%、柠檬酸三铵0.2%、MgSO4 0.02%、MnSO4 0.005%,调节pH至6.2左右。YPD培养基:蛋白胨2%、葡萄糖2%、酵母浸粉1%,调节pH值至6.5左右。脱脂乳粉,丹麦Arla公司。硫酸,国药集团化学试剂有限公司;无水乙醇,天津鑫铂特化工有限公司;苯酚,天津市福晨化学试剂厂;酚酞、氢氧化钠,天津大茂化学试剂厂,上述试剂均为分析纯。细菌、酵母基因组提取试剂盒,天根生化科技有限公司。
1.1.3 器材与设备
3 500 Da透析袋,北京索莱宝科技有限公司;FE-28型pH计,上海梅特勒-托利多仪器有限公司;INFINITE200PRO酶标仪,奥地利Tecan公司;FCD-3000生化培养箱,天津通利信达仪器厂;SW-CJ-2D超净工作台,上海鼎科科学仪器有限公司;Velocity 18R冷冻离心机,澳大利亚Dynamica公司;Biometra TAdvanced 96 G, 230 V型PCR仪,德国耶拿分析仪器股份公司;LightCycler®96型qPCR仪,罗氏诊断产品(上海)有限公司。
1.2 实验方法
1.2.1 保守区域序列测定
将从开菲尔中分离得到的乳酸菌和酵母菌使用MRS肉汤和YPD肉汤培养基于37 ℃下恒温培养24 h,于5 000 r/min离心10 min收集菌体,使用无菌生理盐水重悬并洗涤菌体,然后离心收集菌体。使用天根基因提取试剂盒提取总DNA,加入PCR反应体系对细菌和酵母分别进行16S rDNA测序和ITS测序。DNA引物和反应体系如表1、表2所示。
表1 16S rDNA PCR反应体系
Table 1 16S rDNA PCR reaction system

反应体系体积/μL2× Mix缓冲液(含dNTP,MgCl2,Taq酶等)25模板链127F21492R2ddH2020共计50
表2 ITS PCR反应体系
Table 2 ITS PCR reaction system

反应体系体积/μL2× Mix缓冲液(含dNTP,MgCl2,Taq酶等)25模板链1ITS12ITS42ddH2020共计50
16S rDNA测序引物:27F:5′-AGAGTTTGATCMTGGCTCAG-3′;1492R:5′-GGTTACCTTGTTACGACTT-3′;ITS转录识别间隔区域测序引物:ITS1:5′-TCCGTAGGTGAACCTGCGG-3′;5′-ITS4:TCCTCCGCTTATTGATATGC-3′。
将琼脂糖以1%溶解于Tris-硼酸(TBE)电泳缓冲液中,加热至溶解,冷却制胶。取2 μL PCR反应液进行电泳,电泳结果应显示细菌PCR反液约为1 500 bp,酵母在约为750 bp条带颜色较深,证明扩增成功,将扩增成功的序列送往上海生工生物工程股份有限公司进行测序。
1.2.2 生长曲线
将培养好的乳酸菌和酵母菌分别于5 000 r/min离心10 min收集菌体,以无菌生理盐水重悬并调节OD600值为1附近,制成一定浓度的菌悬液。将制备好的菌悬液涡旋混匀,以5%的接种量接种至对应的培养基中,并把两株酵母以2.5%的接种量分别与2.5%的乳酸菌共培养。使用酶标仪测定波长600处的菌悬液吸光值,以未接种的培养基作为空白,每个样3个平行,间隔2 h取一次点,持续24 h。
1.2.3 混合发酵中单菌株丰度变化
取一定浓度的L63菌悬液,将其以无菌生理盐水依次稀释至原来浓度的1/5、1/25、1/125、1/625。分别取样活菌计数,从对应浓度下取200 μL菌液提取总DNA,然后使用每种微生物特定的序列进行qPCR反应,qPCR引物的目标序列为L. kefiri的recombinase RecA基因。上游引物:5′-GGGAGATGCCCATGTTGGT-3′;下游引物:5′-AAGCTTTCGAAGTGCCTGTGA-3′。反应完成后获得不同浓度下的Cq值,每个样本3个平行。应注意设计的引物具有特异性,针对某种微生物设计的引物不能扩增其他微生物。将测得的活菌数和Cq值的平均值线性拟合,得到Cq值关于每毫升活菌数对数的方程为:Y=-0.301 5×X+15.06,R2=0.993 6。将制备好的乳酸菌和酵母菌菌悬液分别以2.5%单独接种至MRS培养基中,然后再把2株酵母以2.5%的接种量分别与2.5%的乳酸菌接种至MRS培养基中共培养24 h,间隔6 h充分混匀后取样200 μL,每个样本3个平行。将取好的样本提取总DNA,通过荧光信号阈值Cq来表征样本中该种微生物的丰度。通过测得不同采样点下不同样本的Cq值来表征共培养对L. kefiri在发酵过程中的丰度变化。
1.2.4 胞外多糖产量测定
取配制的不同质量浓度(40、80、120、160、200 mg/L)的葡糖糖溶液1 mL,加入1 mL 50 g/L苯酚溶液后加入5 mL浓硫酸充分反应,于波长490 nm下测吸光值,将吸光值与葡萄糖浓度线性拟合,得到OD490值关于葡萄糖溶液浓度的方程为:Y=164.1×X-1.623,R2=0.998 7。将制备好的OD600值约为1的L63和Y2、Y4菌悬液以2.5%分别单独接种至MRS培养基中作为对照,然后再把Y2、Y4以2.5%的接种量分别与2.5%的乳酸菌接种至MRS培养基中共培养,于37 ℃下培养24 h。取10 mL培养液加入4倍体积乙醇于4 ℃下醇沉24 h,取静置后的液体于10 000 r/min离心10 min,弃去上清液,加入10 mL蒸馏水重新溶解沉淀后转入3 500 Da的透析袋中透析24 h,每隔4 h更换一次透析用蒸馏水。取透析完成的溶液使用苯酚硫酸法测定粗多糖产量。
1.2.5 发酵乳pH和滴定酸度
将制备好的OD600值约为1的乳酸菌菌悬液和酵母菌悬液分别以2.5%接种并再把2株酵母以2.5%的接种量分别与2.5%的乳酸菌接种至巴氏灭菌乳中,间隔4 h取样,测定发酵乳的pH和滴定酸度。滴定酸度的测定参考国标:GB 5009.239—2016 《食品安全国家标准 食品酸度的测定》,取1 mL发酵乳并记录下质量与2 mL蒸馏水混合,加入2滴酚酞指示剂,然后用标定好的NaOH溶液滴定,边滴定边混匀发酵乳和NaOH溶液,滴定发酵乳溶液至微粉色且5 s内不褪色,记下消耗NaOH体积,每个样本3次平行。滴定酸度(TA)的计算如公式(1)所示:
(1)
式中:X,样本的酸度,°T;c,NaOH标准溶液的浓度,mol/L;V,滴定中NaOH标准溶液消耗的体积,mL;m,取样的质量,g;0.1为酸度理论定义NaOH的摩尔浓度,mol/L。
1.2.6 代谢组学检测
将制备好的OD600值约为1的L63菌悬液和Y2、Y4菌悬液分别以2.5%接种至MRS培养基中培养作为对照,然后将Y2与Y4的菌悬液以2.5%分别和L63菌悬液以2.5%混合培养。培养24 h后取出用液氮速冻,然后送往上海拜谱生物科技有限公司进行非靶向代谢组学检测(LC-MS/MS)。色谱分析参数如下:进样量5 μL,柱温40 ℃,流速300 μL/min;色谱流动相 A:0.1%甲酸水溶液,B:含 0.1%甲酸的乙腈溶液。色谱梯度洗脱程序如下:0~2 min,0% B;2~6 min,B 从 0%线性变化至 48%;6~10 min,B 从 48%线性变化至100%;10~12 min,B 维持在 100%;12~12.1 min,B 从 100%线性变化至 0%,12.1~15 min,B 维持在 0%。
1.2.7 数据处理与分析
使用Excel对实验数据进行统计;使用SPSS 27对实验数据进行统计分析;使用Graphpad Prism9.4.1进行图像绘制。
2 结果与分析
2.1 16S rDNA与ITS测序结果
将测序获得的16S rDNA与ITS序列于NCBI上的BLAST上进行同源性分析,结果显示L63与L. kefiri的相似度可达99%,Y2与S. cerevisiae 的相似度可达95%,Y4与K. marxianus相似度可达99%。根据测序结果初步判定L63、Y2、Y4分别为L. kefiri、S. cerevisiae 和K. marxianus。将待测细菌和酵母分别与部分模式株分别基于16S rDNA和ITS序列构建系统发育树如图1和图2所示。
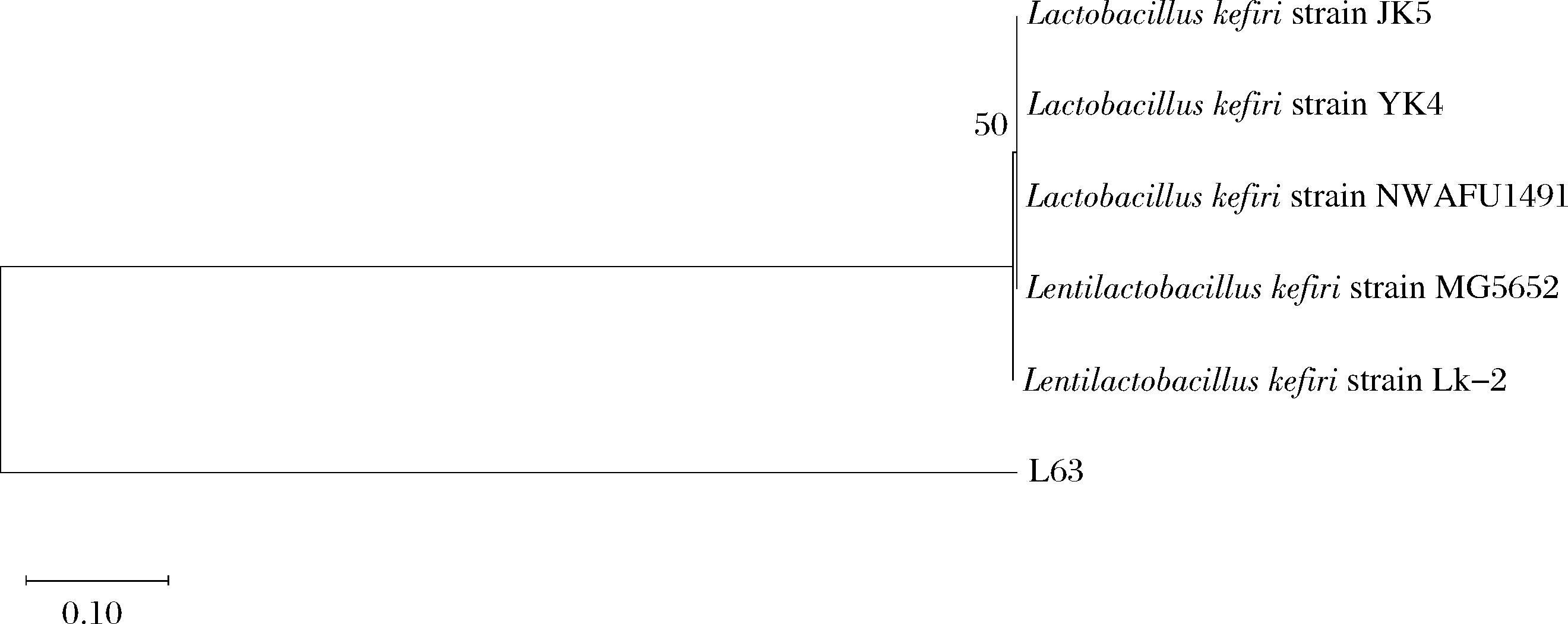
图1 基于16S rDNA序列构建的L63菌株系统发育树
Fig.1 Phylogenetic tree of strain L63 constructed on the basis of 16S rDNA sequences
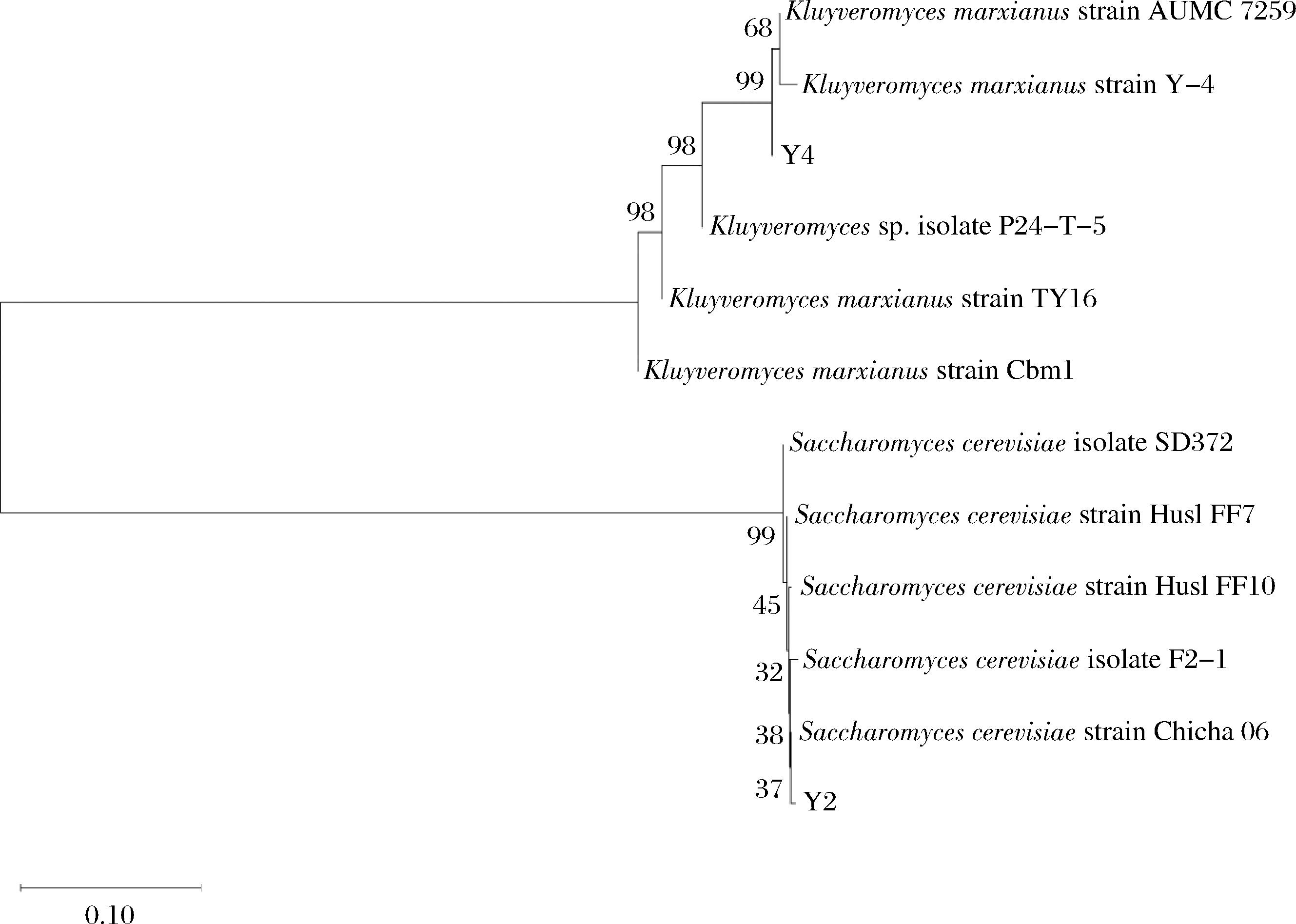
图2 基于ITS序列构建的Y2、Y4菌株系统发育树
Fig.2 Phylogenetic tree of Y2 and Y4 strains constructed based on ITS sequences
根据系统发育树图可以发现,菌株L63与Lactobacillus kefiri strain Lk-2的同源性最高;Y2与Saccharomyces cerevisiae Chicha06同源性最高;Y4与Kluyveromyces marxianus strain AUMC 7259的同源性最高。
2.2 生长曲线
如图3所示,通过生长曲线可以看出,L63在12 h附近进入生长稳定期,从生长16至18 h后开始衰退。酵母菌的生长曲线并不呈现出S型,约在22~24 h进入衰退期。共培养时,生长曲线更符合L63的变化,约在16 h进入衰退期,菌密度开始下降。Y2、Y4与L63在共培养时在衰退期前(0~16 h)生长状态基本相同,二者无显著差异,但在衰退期时二者出现了不同情况,Y4组下降较为缓慢,菌密度随时间波动;而Y2组相较于Y4组则发生了显著的下降,且下降幅度较大。
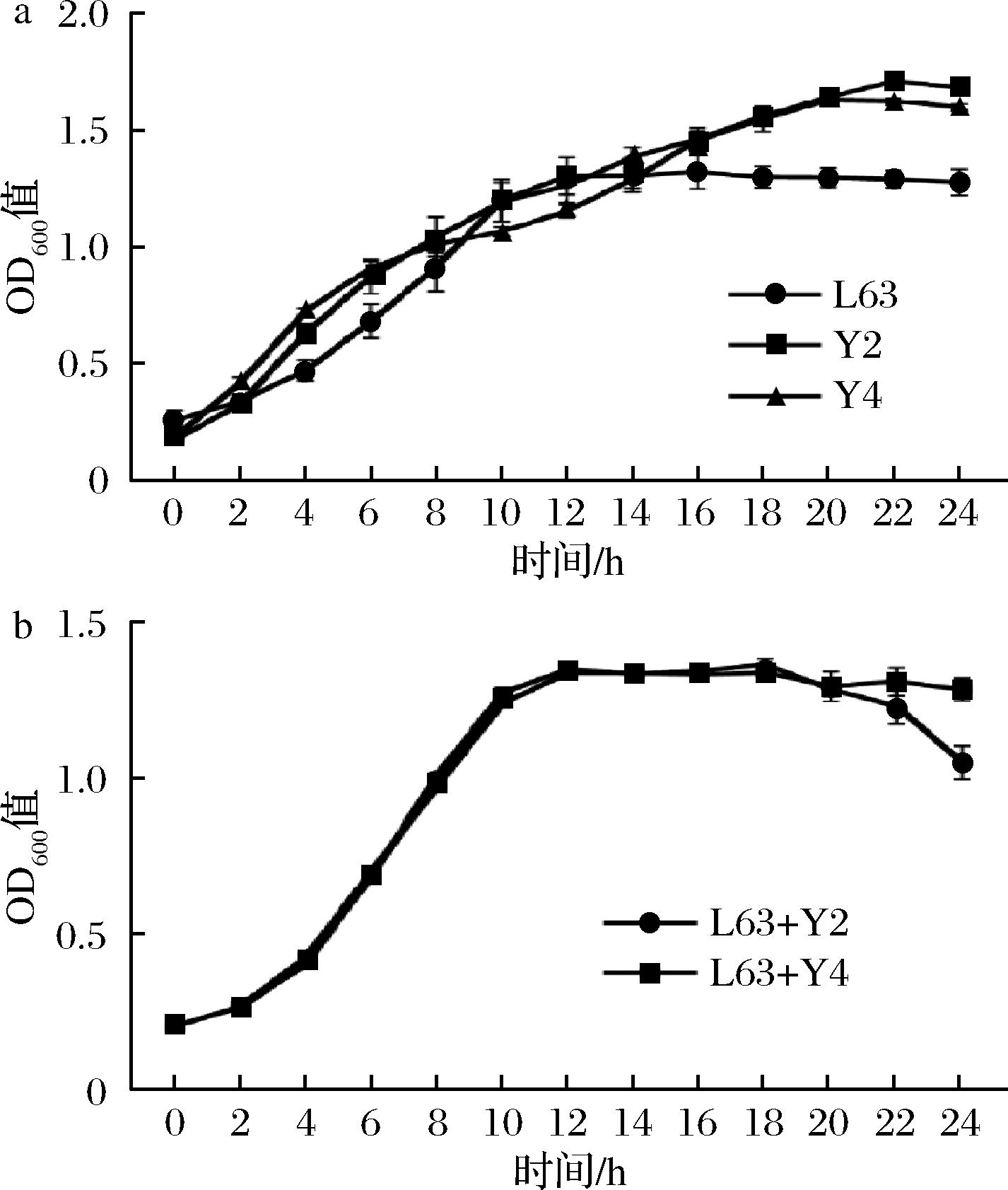
a-L. kefiri L63、S. cerevisiae Y2、K. marxianus Y4的生长曲线;b-S. cerevisiae Y2、K. marxianus Y4分别与L. kefiriL63共培养的生长曲线
图3 生长曲线
Fig.3 Growth curves
2.3 混合发酵中单菌株丰度变化
如图5所示(标准曲线见图4),在发酵前期,K. marxianus Y4对Lactobacillus kefiri L63的生长有促进作用,而在后期2株酵母均对Lactobacillus kefiri L63的生长出现了抑制作用。整体而言,混合培养时相较于单独培养对乳酸菌的生长起了抑制作用,这与之前的研究结果类似[18]。乳酸菌和酵母菌之前存在着复杂的共生关系,既有双向受益[19],又有单向受益,还存在着拮抗关系[20],并因乳酸菌菌种和酵母菌菌种的差异而存在差异。在本实验共培养生长曲线中二者混培的菌密度并未出现明显的下降趋势,这可能是因为L63对酵母的生长有促进作用。乳酸菌代谢的乳酸对阳离子具有螯合作用,能够减轻阳离子对酵母菌生长的影响,这也是酵母菌丰度后期提升的潜在原因[21]。
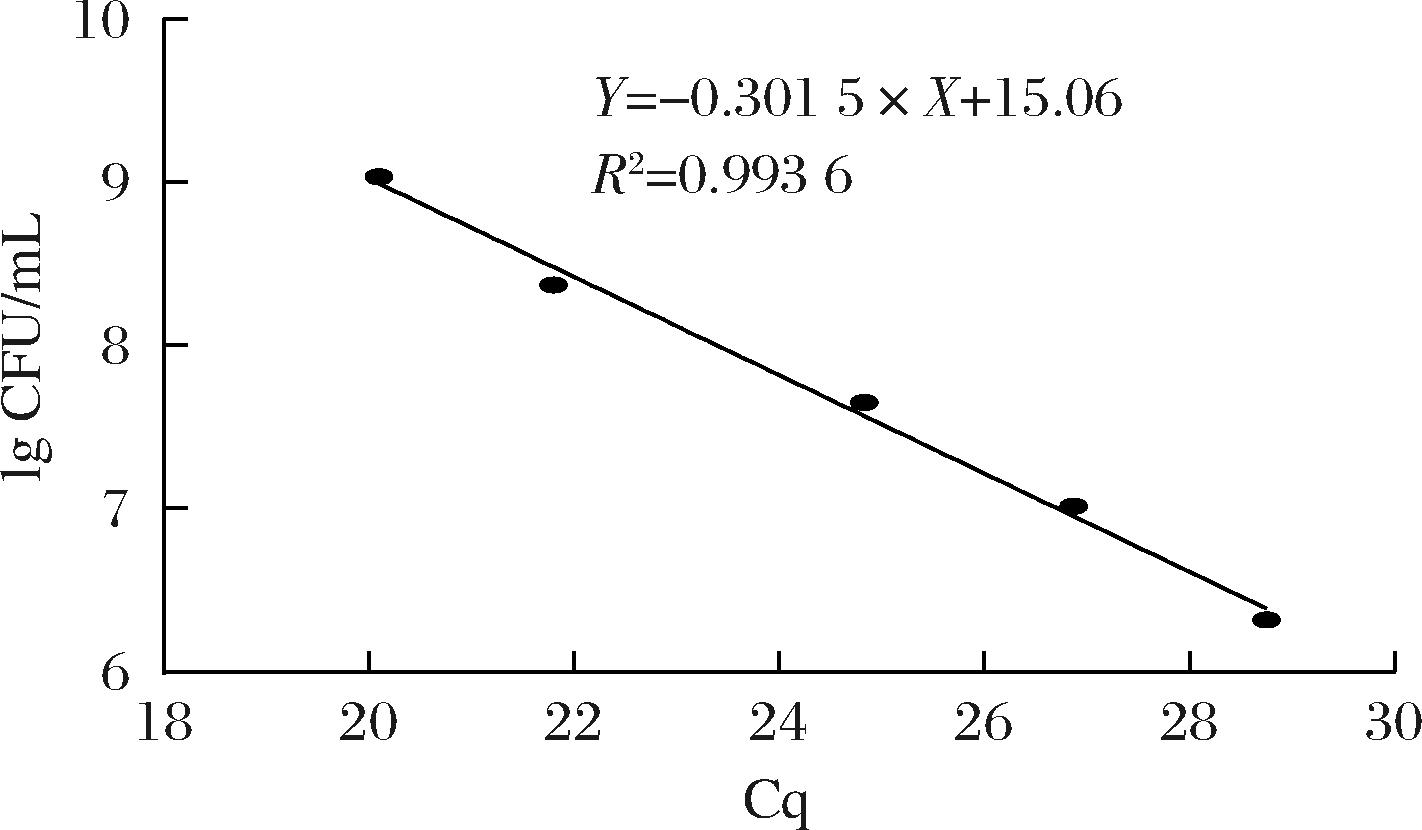
图4 Cq值与L. kefiri活菌数的标准曲线
Fig.4 Standard curve of Cq values versus L. kefirii viable counts
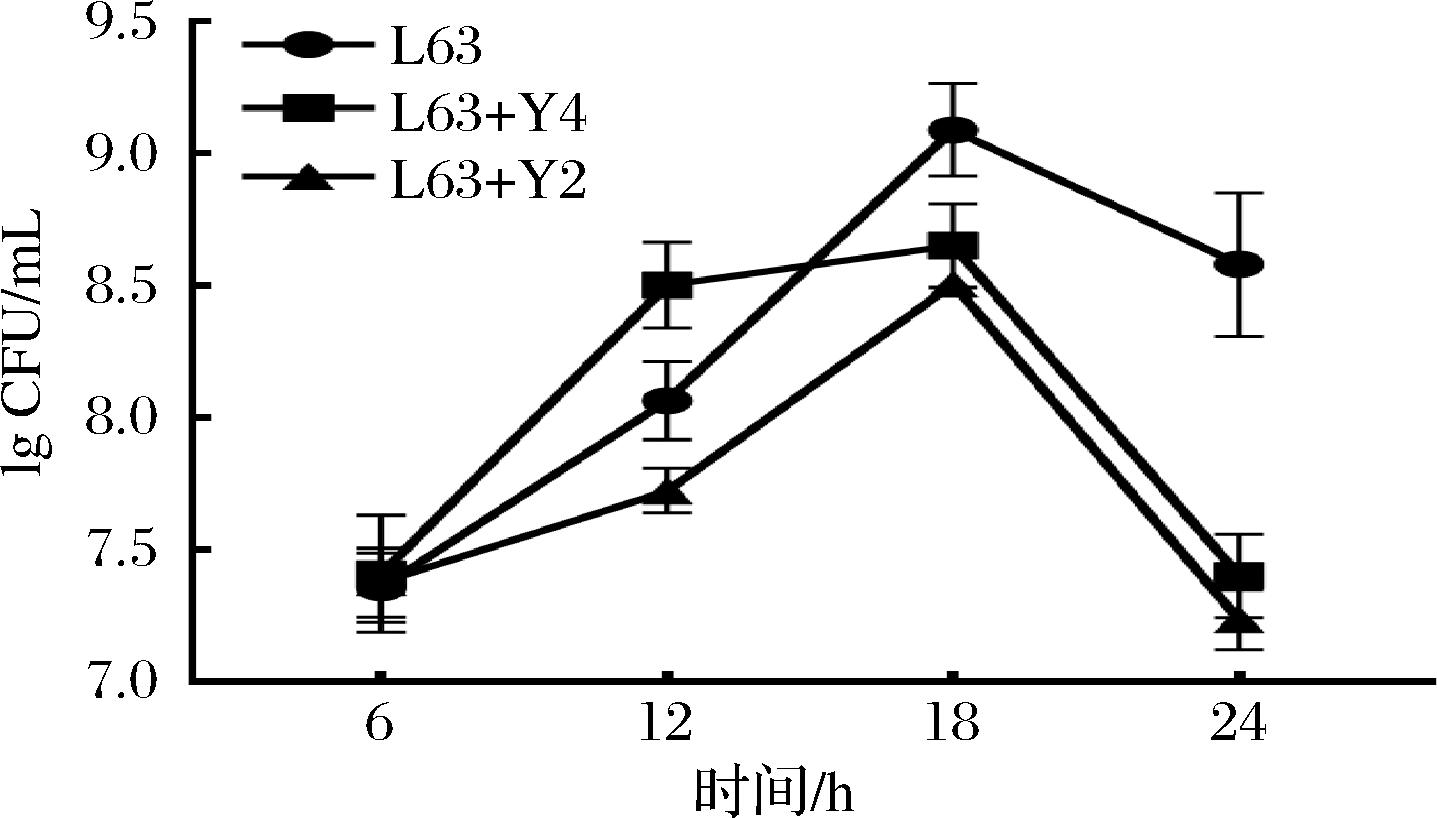
图5 L63共培养与非共培养时的生长状态
Fig.5 Growth status of L63 in co-culture vs.non-co-culture
2.4 胞外多糖产量测定
多糖产量结果显示如图7所示(标准曲线见图6),Lactobacillus kefiri L63在与酵母Y2、Y4共培养时均会导致其胞外多糖产量显著上升(P<0.01),而2株酵母和L. kefiri共培养时,两者多糖产量并无显著变化。出现这种现象可能是因为胞外多糖是一种抗逆性产物,共培养体系中生长后期酵母菌代谢产生大量乙醇,导致生长环境不再适合乳酸菌生长,因此乳酸菌产生更多的胞外多糖来起到缓冲作用,以减少外部环境如pH过低、渗透压等因素带来的不利影响[22]。通常来说,乳酸菌胞外多糖表现出一些健康益处,例如抗肿瘤和调节免疫活性、抗氧化作用、作为益生元使用等[23],因此可以调节乳酸菌的培养条件来获取更多乳酸菌胞外多糖来应用这些功能。
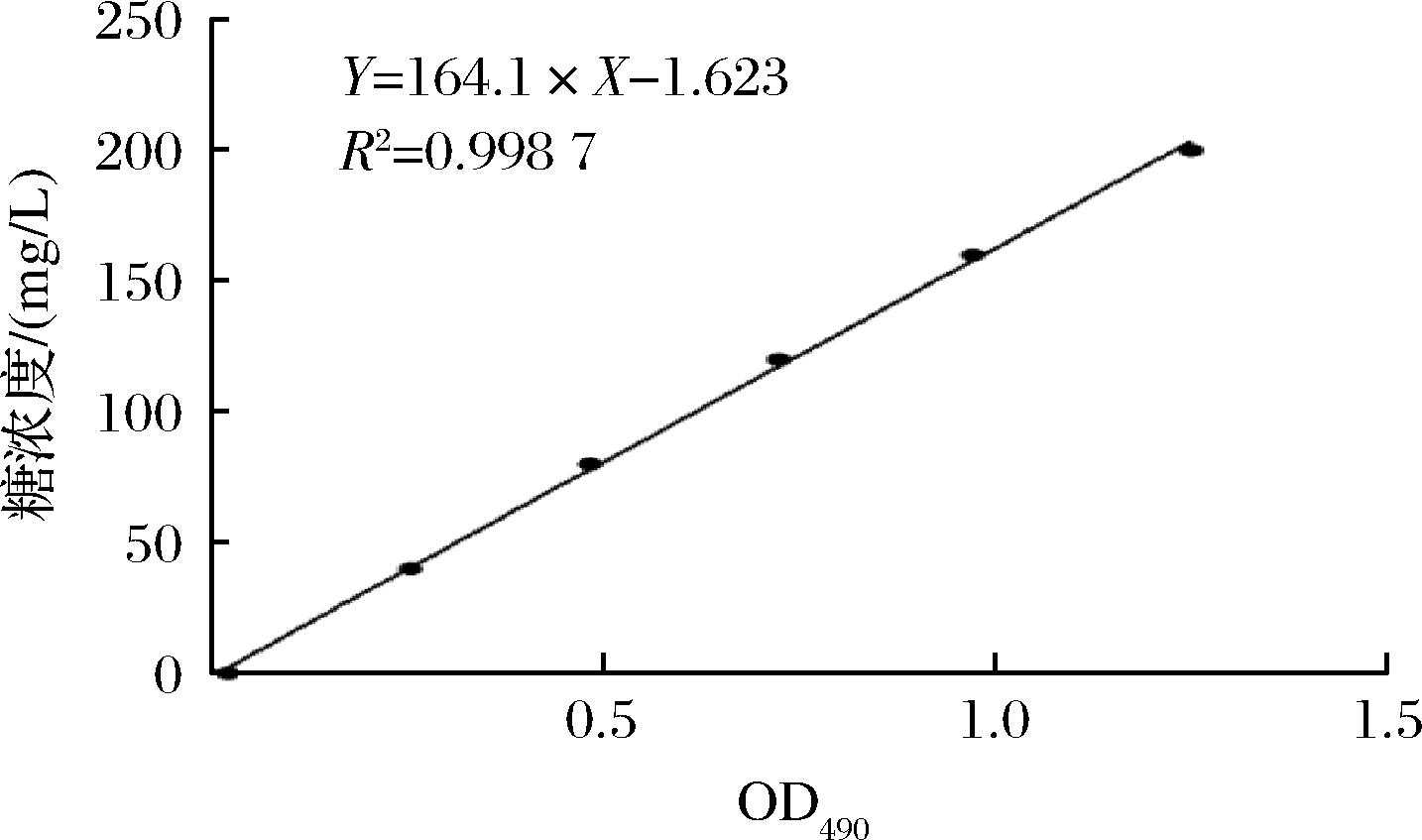
图6 OD490与糖浓度的标准曲线
Fig.6 Standard curve of OD490 vs.sugar concentration
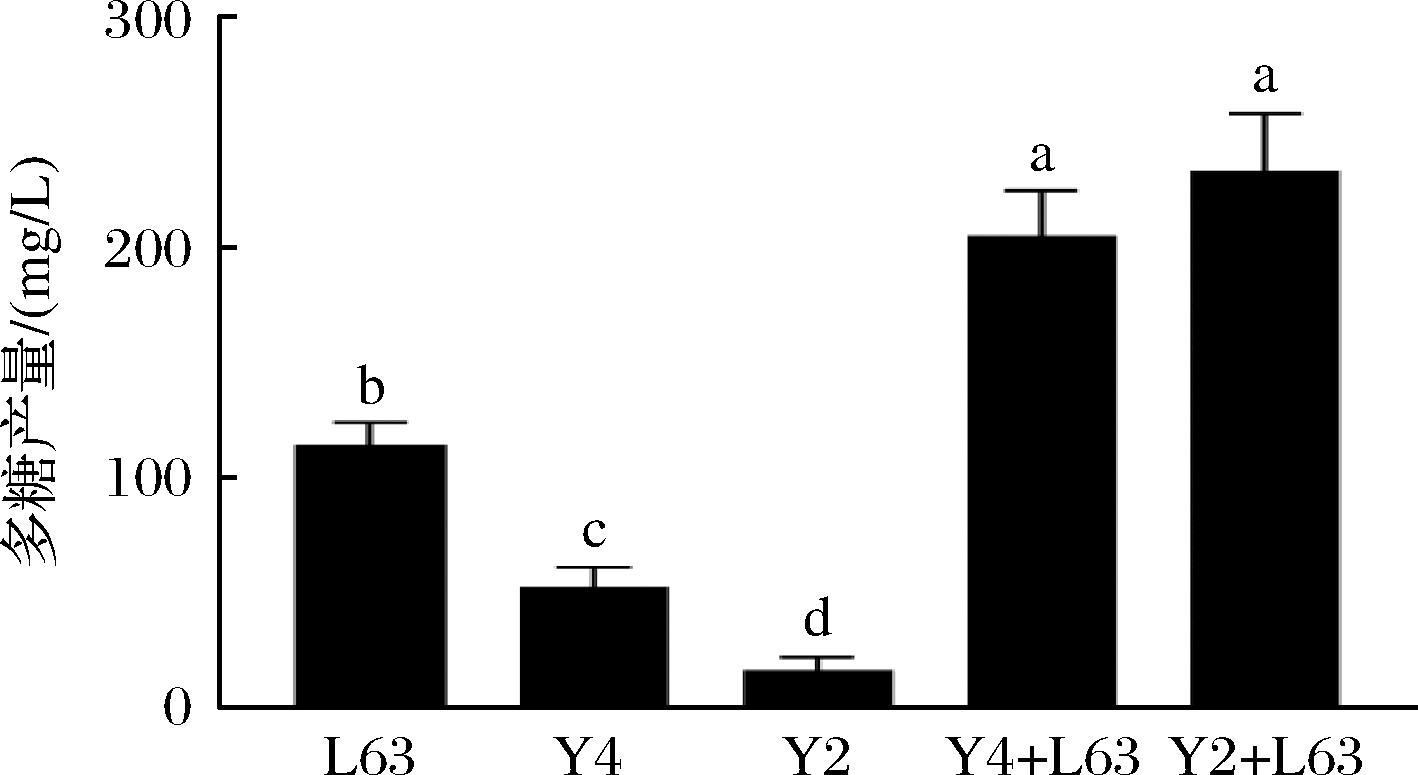
图7 菌株的胞外多糖产量
Fig.7 Exopolysaccharide production of the strain
注:不同小写字母表示差异显著(P<0.05)。
2.5 发酵乳pH和滴定酸度
对混合培养发酵乳和单株发酵过程中pH值和滴定酸度变化的统计学对比,如图8所示,双因素方差分析结果显示,时间、混培及时间和混配的交互作用都对发酵过程中的pH值和滴定酸度变化有着显著影响(P<0.01,如表3、表4所示)。在混合发酵过程中,主要呈现出的趋势为:和酵母共培养时,前期可显著促进发酵乳酸化,而在后期与L. kefiri单株发酵的pH值和滴定酸度均趋于一致,在后期的酸度体现出无显著差异。这可能是因为混合发酵过程中L. kefiri中后期的生长受到抑制作用,产酸量下降导致。
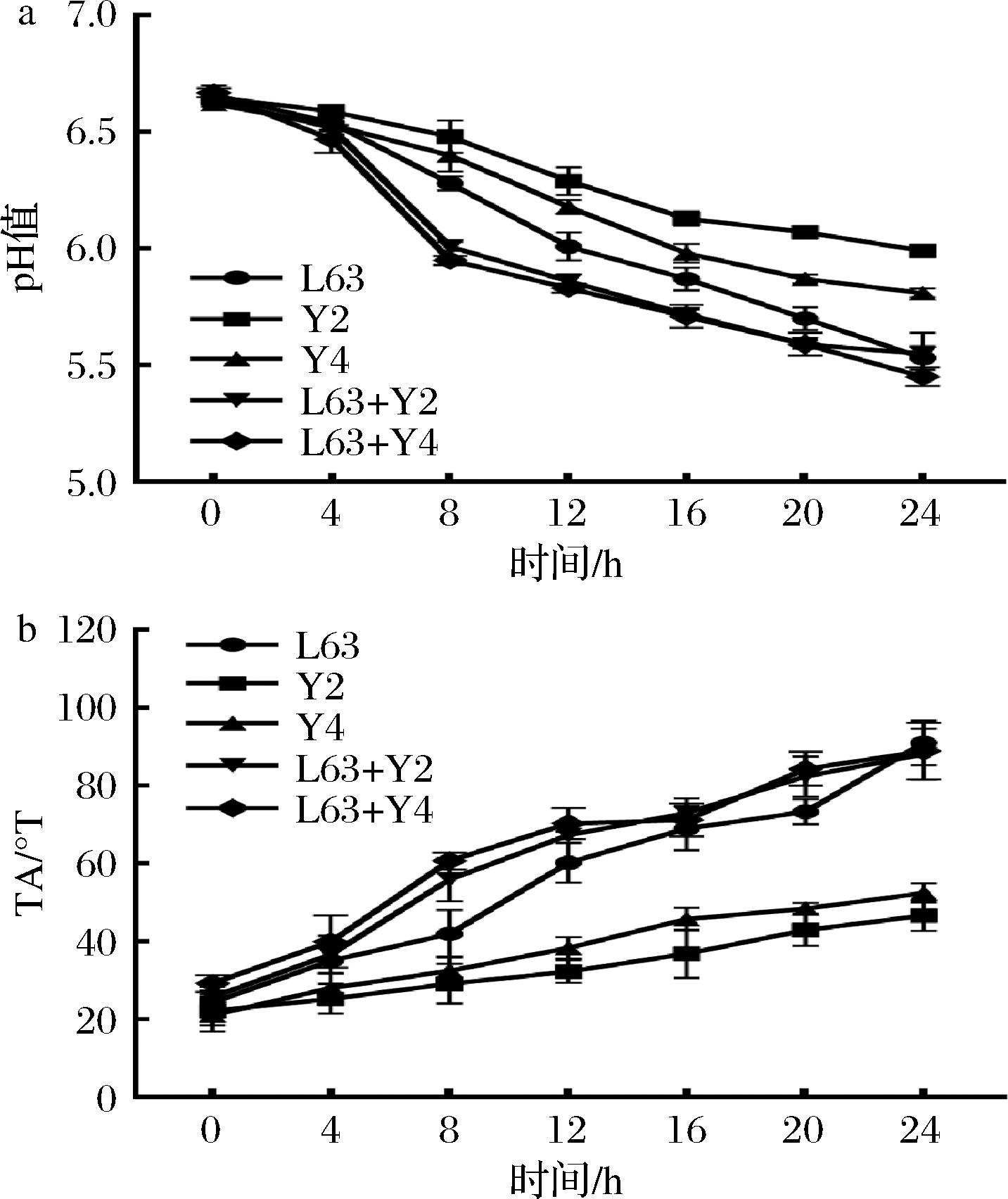
a-pH;b-TA
图8 混合发酵过程中的酸度变化
Fig.8 Acidity changes during mixed fermentation
表3 培养时间与共培养对pH影响的主体间效应检验
Table 3 Between-subjects effect test for the effect of incubation time and co-culture on pH
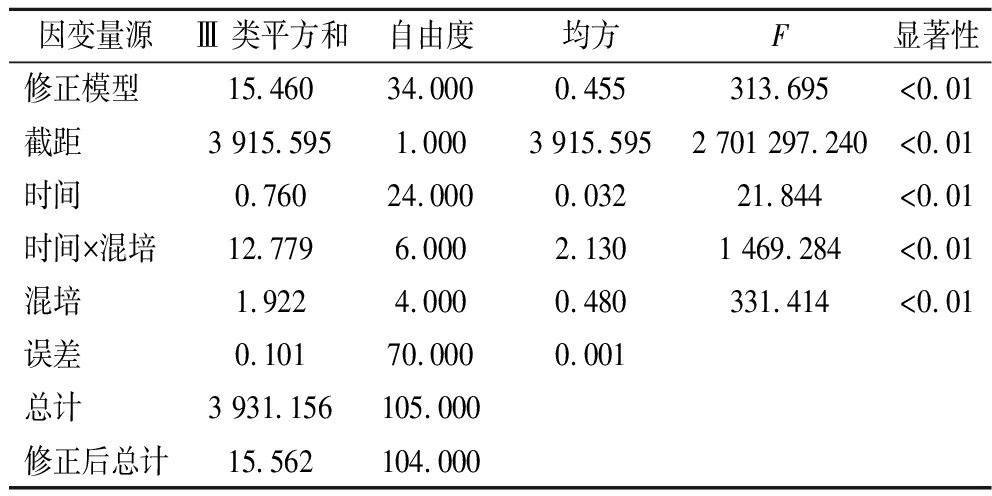
因变量源Ⅲ 类平方和自由度均方F显著性修正模型15.46034.0000.455313.695<0.01截距3 915.5951.0003 915.5952 701 297.240<0.01时间0.76024.0000.03221.844<0.01时间×混培12.7796.0002.1301 469.284<0.01混培1.9224.0000.480331.414<0.01误差0.10170.0000.001总计3 931.156105.000修正后总计15.562104.000
表4 培养时间与共培养对TA影响的主体间效应检验
Table 4 Between-subjects effect test for the effect of incubation time and co-culture on TA
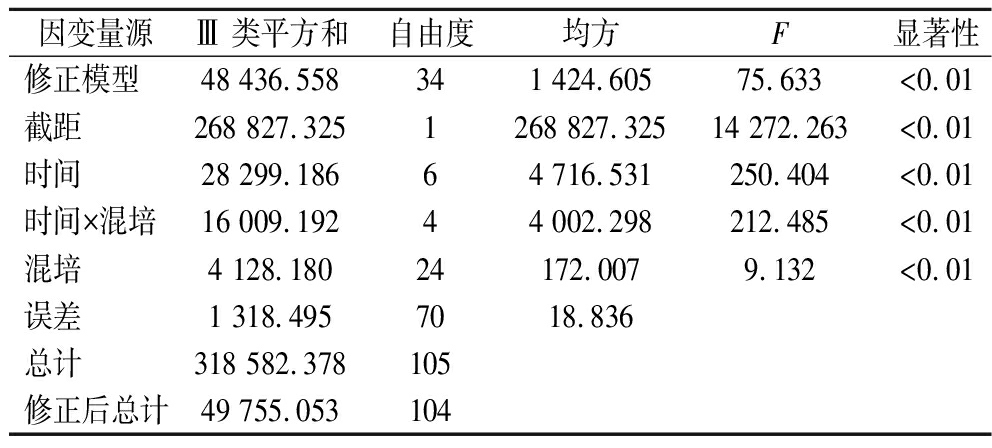
因变量源Ⅲ 类平方和自由度均方F显著性修正模型48 436.558341 424.60575.633<0.01截距268 827.3251268 827.32514 272.263<0.01时间28 299.18664 716.531250.404<0.01时间×混培16 009.19244 002.298212.485<0.01混培4 128.18024172.0079.132<0.01误差1 318.4957018.836总计318 582.378105修正后总计49 755.053104
2.6 代谢组学检测
非靶向代谢组学检测结果显示,Y4与L63共培养组(MK组)和Y2与L63共培养组(SK组)中分别检测到2 040种和2 039种差异代谢物。
以VIP值>1,Padj<0.05,-1
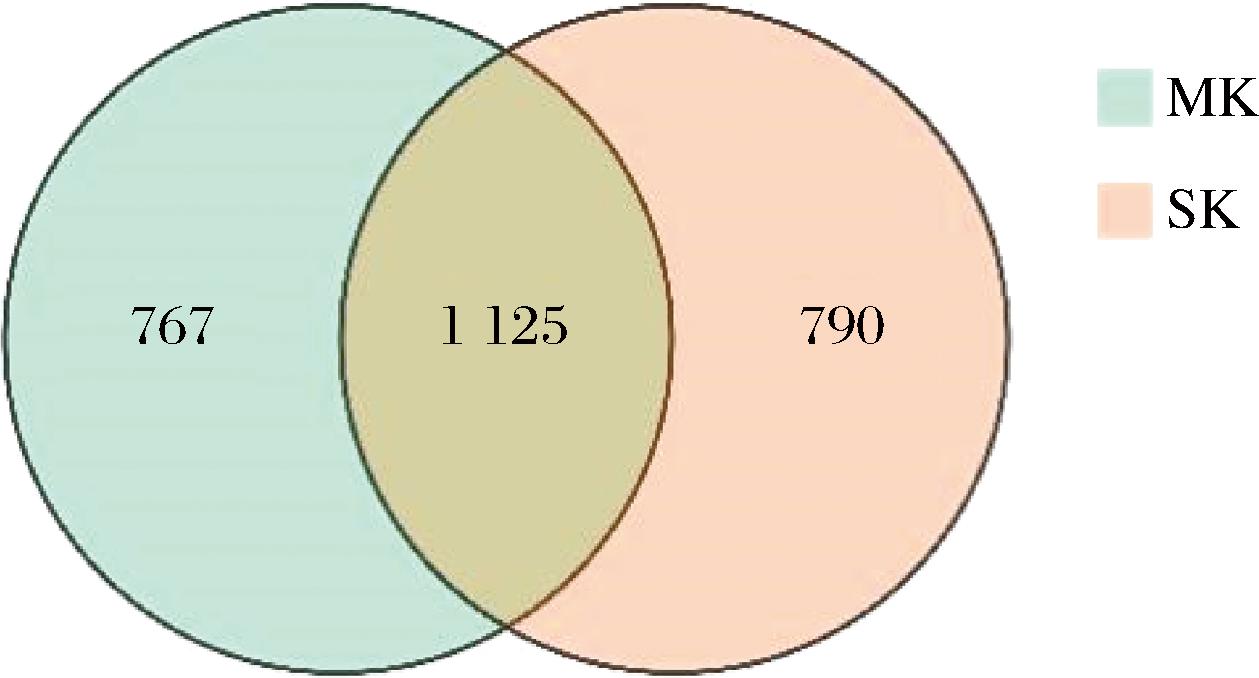
图9 不同共培养组的差异代谢物Venn图
Fig.9 Differential metabolite Venn plots for different co-culture groups
PCA图显示了不同样本数据在主成分空间中的分布,如图10所示,其中,KaM组为L63和Y4的非共培养组,KaS为L63和Y2的非共培养组,KM组为L63和Y4的共培养组,KS为L63和Y2的非共培养组。PCA强调了主成分对数据结构的重要性,以及降维对数据可视化的影响。PC1(94.2%)是数据中变异最大的主成分,这意味着PC1捕捉了数据中最显著的模式或方向,在乳酸菌酵母菌的相互作用引起的变化中起到主导作用。组间分离状态良好,证明与不同酵母发生相互作用和相同酵母发生相互作用前后有着显著的差异,代谢特征相差较大。
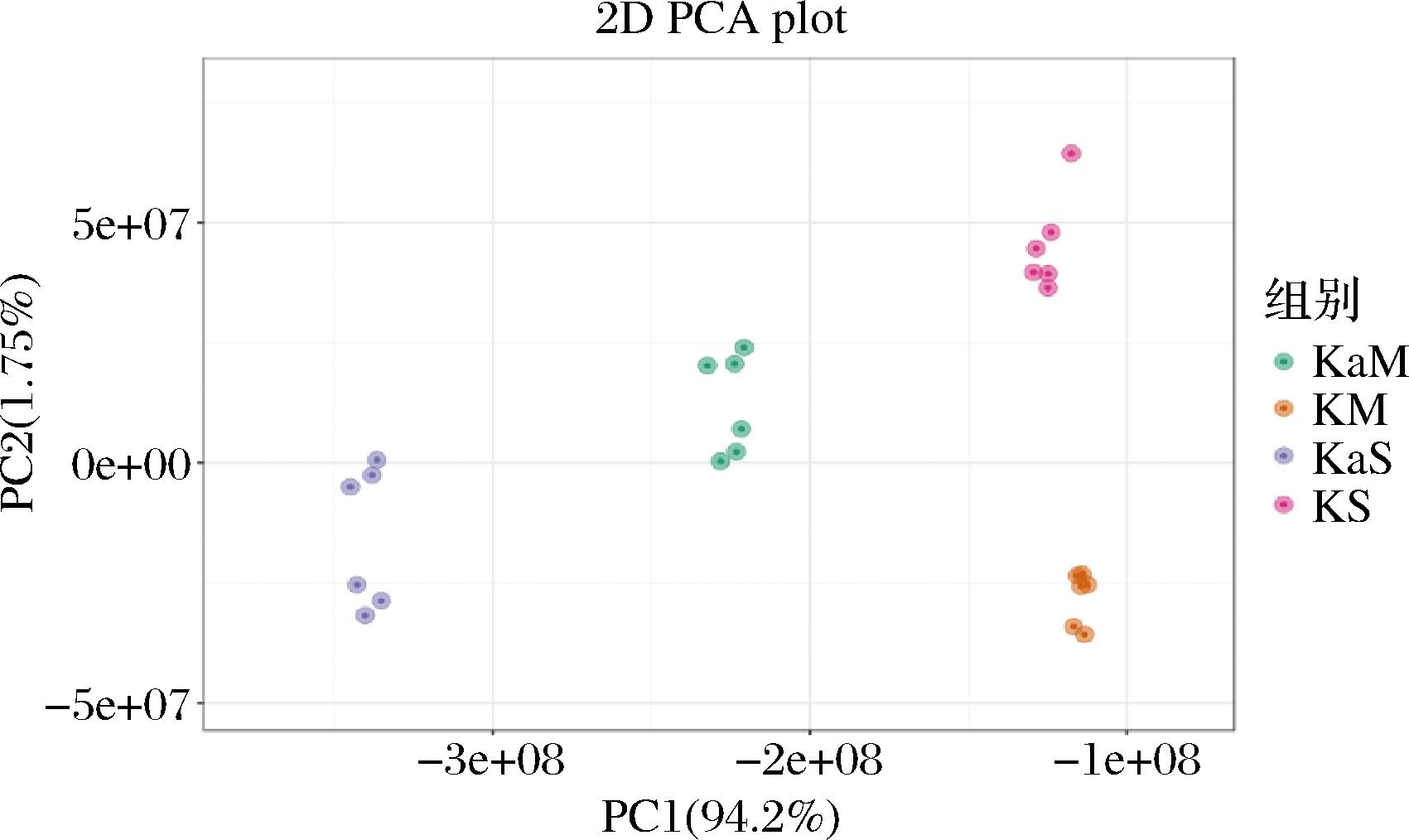
图10 不同共培养组和非共培养组的PCA图
Fig.10 PCA plots of different co-culture and non-co-culture groups
如图11非靶向代谢组学检测结果所示,在K. marxianus和L. kefiri的相互作用使得109种代谢物发生显著上调,1 931种发生显著下调(P<0.05,-1
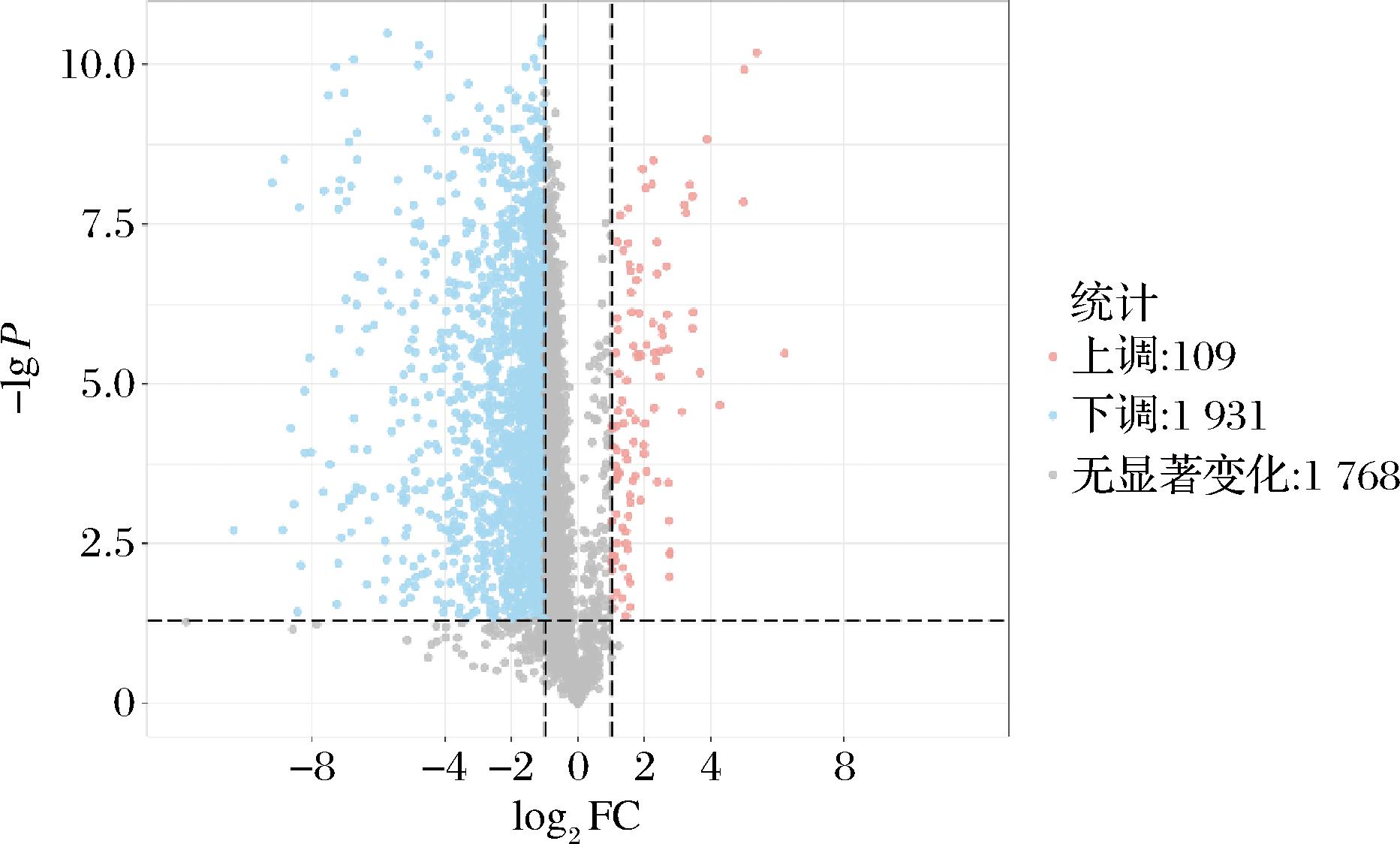
图11 L63和Y4相互作用的差异代谢物火山图
Fig.11 Differential metabolite volcano plots of L63 and Y4 interactions
图12表明,K. marxianus和S. cerevisiae 分别与L. kefiri相互作用中导致大部分的代谢物产生发生了显著下调。与克鲁维酵母互作时,上调最明显代谢物通常为有机酸及其衍生物,有机氮化物等,下调最明显的代谢物为有机杂环化合物和有机含氧化合物等;而S. cerevisiae 与L. kefiri互作时,上调最明显的代谢物主要为一些脂类化合物,下调则主要为一些与蛋白合成相关的化合物。
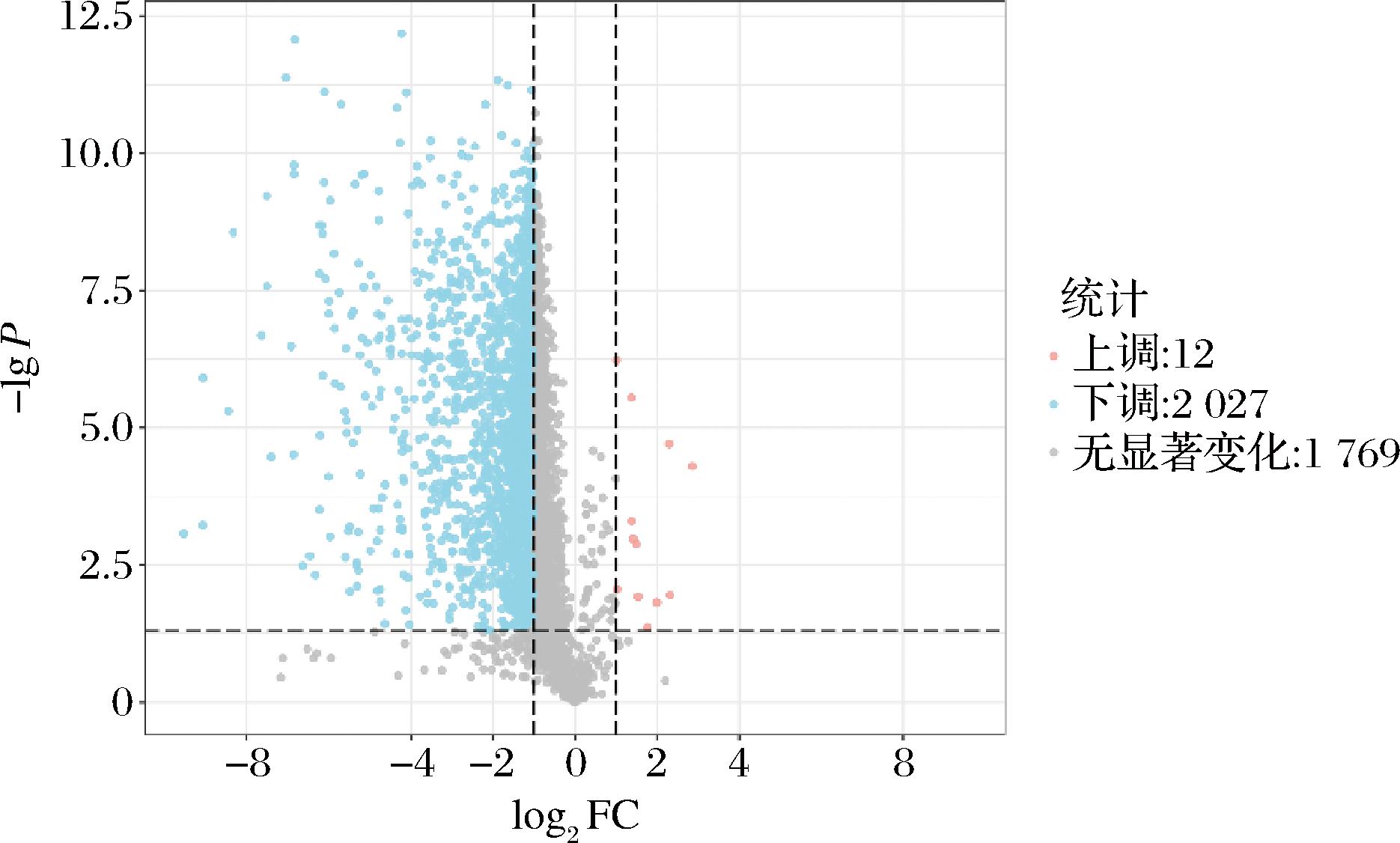
图12 L63和Y2相互作用的差异代谢物火山图
Fig.12 Volcano plot of differential metabolites of L63 and Y2 interactions
图13展示了L63和不同酵母相互作用的差异代谢物种类,MK组和SK组的差异代谢物主要分为脂类和类脂分子、有机酸及其衍生物、有机杂环化合物、苯基丙酮和多酮类化合物、苯类及其衍生物、有机含氧化合物、生物碱及其衍生物、核苷、核苷酸及类似物等。其中脂类和类脂分子均为二者的差异代谢物占比最多成分,结果表明脂类和类脂分子是L. kefiri和酵母之间相互作用受到影响最大的化合物分类,脂质是细胞膜的主要组成部分,同时也是能量的储存和传递的关键分子,因此,共培养体系中脂质与脂质分子类差异代谢物的大比例存在可能反映了微生物在互作过程中对于细胞结构和能量需求的调整。
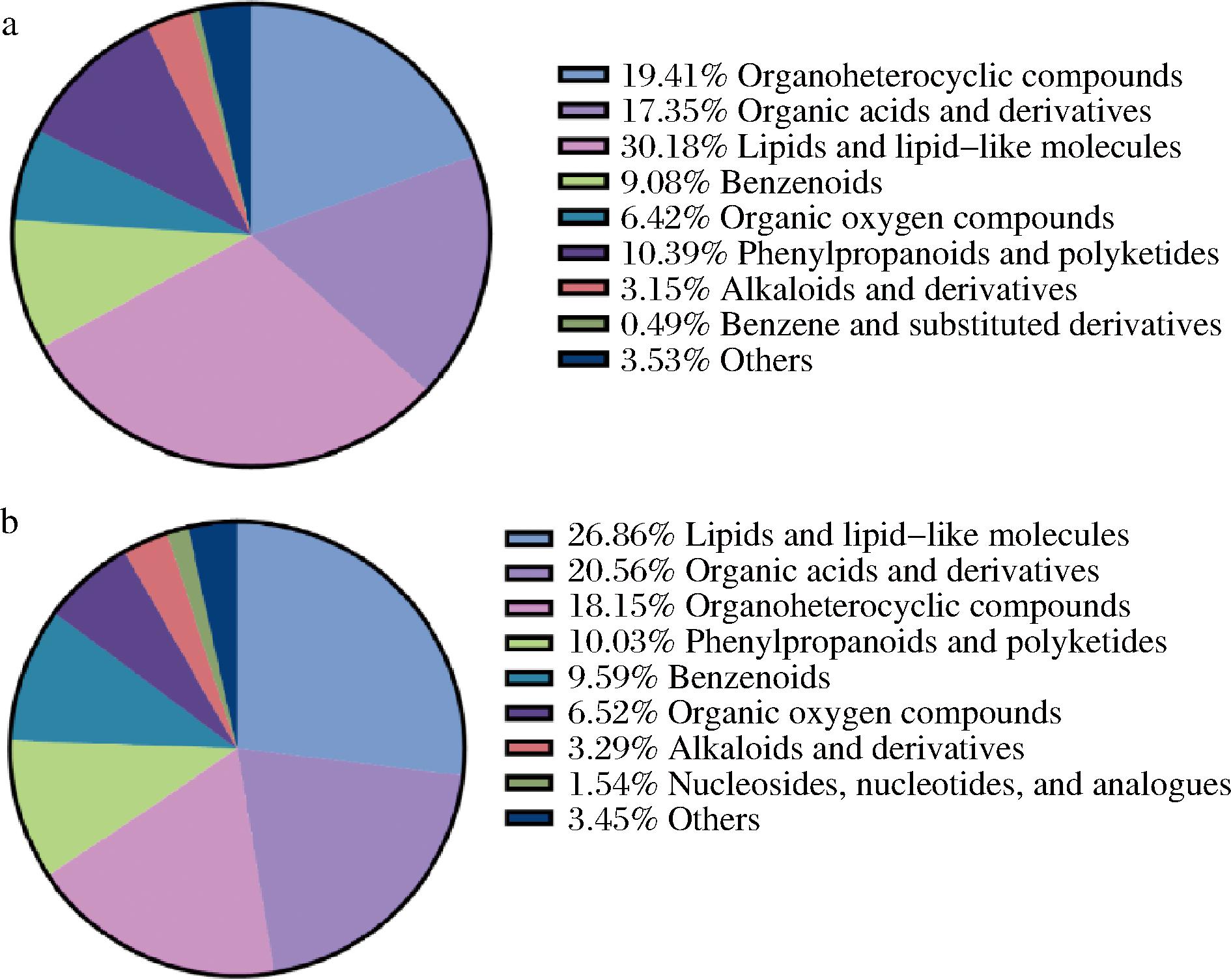
a-L63和Y4相互作用的差异代谢物分类;b-L63和Y2相互作用的差异代谢物分类
图13 相互作用的差异代谢物分类
Fig.13 Differential metabolite classification of interactions
注:Organoheterocyclic compounds,有机杂环化合物;Organic acids and derivatives,有机酸及其衍生物;Lipids and lipid-like molecules,脂类和类脂分子;Benzenoids,类苯;Organic oxygen compounds,有机氧化物;Phenylpropanoids and polyketides,苯丙酮和多酮类化合物;Alkaloids and derivatives,生物碱及其衍生物;Benzene and substituted derivatives,苯及取代衍生物;Nucleosides, nucleotides,and analogues,核苷、 核苷酸及类似物。
通过共培养与非共培养体系的差异代谢物代谢通路富集分析,展示了K. marxianus和S. cerevisiae 与L. kefiri互作所引起的代谢差异(图14、图15),及这些差异代谢物在代谢通路上的分布情况,进而展示这些互作引起的不同生命活动。富集分析结果表明,L. kefiri和K. marxianus的相互作用引起几个最显著的通路为天冬氨酸代谢、嘌呤代谢、瓦伯格效应和尿素代谢等。L. kefiri和S. cerevisiae 相互作用引起的几个最显著的通路为嘌呤代谢、苯乙酸酯代谢、天冬氨酸代谢和胆汁酸合成代谢等。二者均显著影响了天冬氨酸代谢和嘌呤代谢,天冬氨酸代谢在生命活动中具有多种重要的生物学功能,是重要的氮源供体[24],其功能主要包括参与肽和蛋白质合成;通过与α-酮戊二酸反应而进入三羧酸循环,参与能量代谢过程中的三羧酸循环和氧化磷酸化,为机体提供能量等。嘌呤代谢是指嘌呤核苷酸的合成、降解和利用过程,嘌呤是一种含氮碱基,是DNA和RNA的组成部分,嘌呤在神经调节和传递、细胞增殖和分化以及能量代谢中发挥着重要作用[25]。同时也是许多重要生物分子的前体,如腺苷三磷酸(ATP)、辅酶NAD、FAD等,主要为维持基本生命活动过程。从2.3节混合发酵下L. kefiri的丰度变化来看,其在生长后期受到大幅度抑制,可能是因为这些基本生命活动通路受到抑制所导致。瓦伯格效应(Warburg effect)是一种癌症细胞代谢的特殊现象,其主要特征包括:通过高速糖酵解快速获取能量来使细胞生长、线粒体失衡氧化磷酸化减少和产生大量乳酸,即使是在有氧环境也是如此。缺氧环境是瓦伯格效应的重要调控因素之一[26],缺氧微环境可通过缺氧诱导因子1-α诱导葡萄糖转运体1 (glucose transporters 1, GLUT1) 和葡萄糖转运体3 (glucose transporters 3, GLUT3) 上调, 进而促进葡萄糖的吸收和瓦伯格效应[27]。在缺氧环境中,酵母也可以表现出瓦伯格效应的现象,随着共培养时O2浓度降低,而酵母菌则可能需要增加糖酵解以满足酵母菌在缺氧条件下的能量需求和细胞生长。有研究发现,酵母菌是良好的瓦伯格效应研究的模型,在酵母的瓦伯格效应中,发现线粒体的功能并未失衡,而是每个细胞的线粒体呼吸链单位较少[28]。
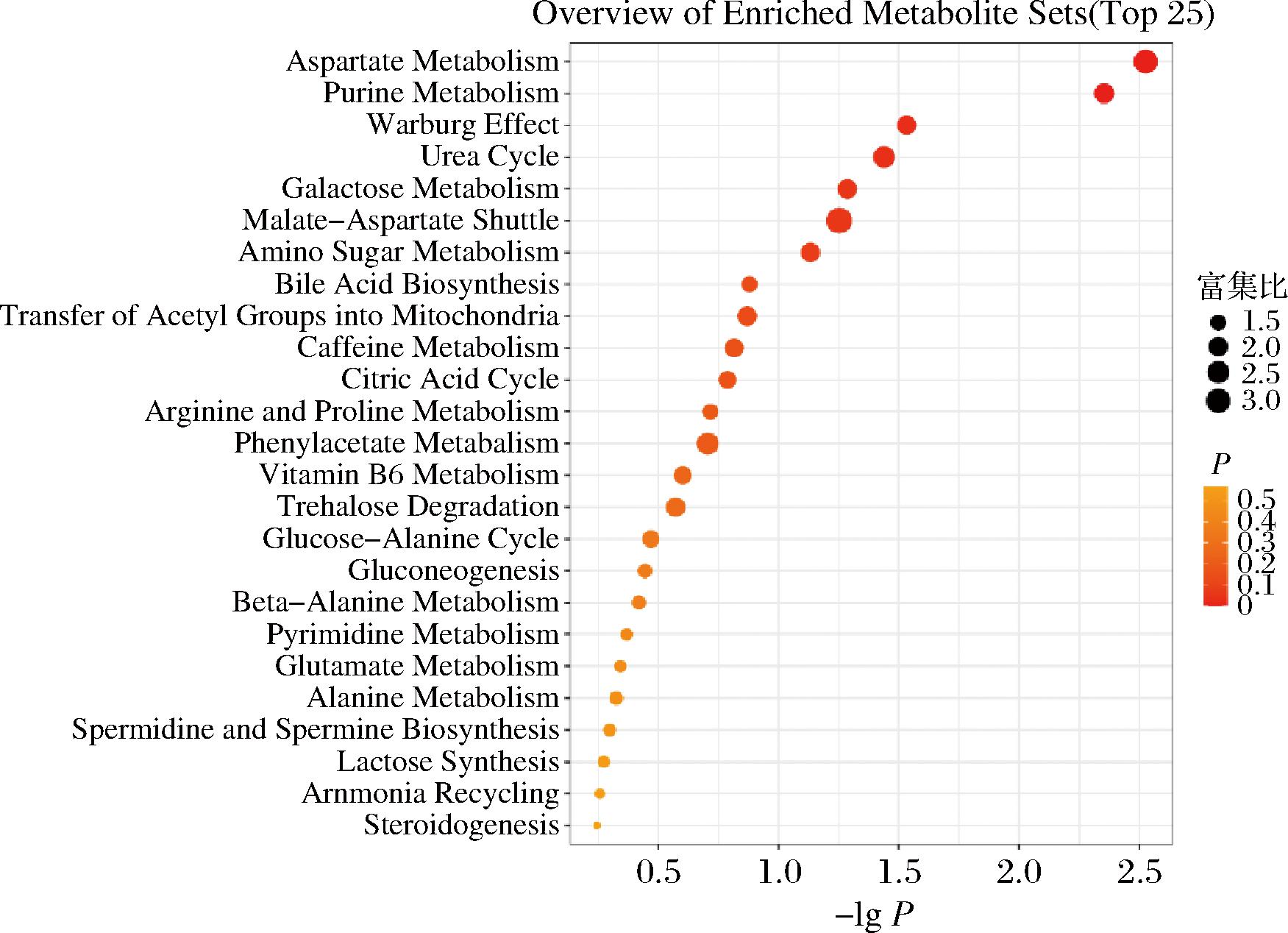
图14 L63和Y4相互作用的差异代谢物分布通路
Fig.14 Differential metabolite distribution pathways for L63 and Y4 interactions
注:Aspartate Metabolism,天冬氨酸代谢;Purine Metabolism,嘌呤代谢;Warburg Effect ,瓦伯格效应;Urea Cycle,尿素循环;Galactose Metabolism,半乳糖代谢;Malate-Aspartste Shuttle,苹果酸-天门冬氨酸转运;Amino Sugar Metabolism ,氨基酸糖代谢;Bile Acid Biosynthesis,胆汁酸的生物合成;Transfer of Acetyl Groups into Mitochondria,乙酰基转移至线粒体;Caffeine Metabolism,咖啡因代谢;Citric Acid Cycle,柠檬酸循环;Arginine and Proline Metabolism,精氨酸和脯氨酸代谢;Phenylacetate Metabolism,苯乙酸代谢;Vitamin B6 Metabolism,维生素 B6 代谢;Trehalose Degradation,海藻糖降解;Glucose-Alanine Cycle,葡萄糖-丙氨酸循环;Gluconeogenesis,葡萄糖合成;Beta-Alanine Metabolism ,β-丙氨酸代谢;Pyrimidine Metabolism,嘧啶代谢;Glutamate Metabolism,谷氨酸代谢;Alanine Metabollsm,丙氨酸代谢;Spermicine and Spermine Biosynthesis,精胺和精胺的生物合成;Lactose Synthesis,乳糖合成;Ammonia Recycling,氨回收;Steroidogenesis,类固醇生成。

图15 L63和Y2相互作用的差异代谢物分布通路
Fig.15 Differential metabolite distribution pathways for L63 and Y2 interactions
注:Purine Metabolism,嘌呤代谢;Phenylacetate Metabolism,苯乙酸代谢;Aspartate Metabolism,天冬氨酸代谢;Bile Acid Biosynthesis,胆汁酸的生物合成;Thiamine Metabolism,硫胺素代谢;Pyrimidine Metabolism,嘧啶代谢;Malate-Aspartate Shuttle,苹果酸-天门冬氨酸转换;Trehalose Degradation,海藻糖降解;Ammonia Recycling,氨回收;Steroidogenesis,类固醇生成;Caffeine Metabolism,咖啡因代谢;Fatty Acid Biosynthesis,脂肪酸的生物合成 ;Galactose Metabolism ,半乳糖代谢 ;Urea Cycle,尿素循环;Alpha Linolenic Acid and Linoleic Acid Metabolism,亚麻酸和亚油酸代谢;Spermidine and Spermine Biosynthesis,精胺和精胺的生物合成;Methionine Metabolism,蛋氨酸代谢;Vitamin B6 Metabolism,维生素 B6 代谢;Lactose Synthesis,乳糖合成;Riboflavin Metabolism,核黄素代谢;Warburg Effect,瓦伯格效应;Amino Sugar Metabolism,氨基酸糖代谢;Pantothenate and CoA Biosynthesis,泛酸和 CoA 的生物合成;Betaine Metabolism,甜菜碱代谢;Beta-Alanine Metabolism,β-丙氨酸代谢。
3 结论
本研究主要探讨了Kluyveromyces marxianus Y4和Saccharomyces cerevisiae Y2与L63共培养时的生长变化、胞外多糖产量、发酵乳的酸度变化、代谢组学的差异等方面。结果表明,Kluyveromyces marxianus Y4在前期对L. kefiri的生长有促进作用,而在发酵后期2株酵母均体现出对L. kefiri生长有抑制作用;共培养时候能够显著促进胞外多糖产量上升,但2株酵母对胞外多糖产量提升无显著差异,因此可能多糖产量上升主要源自于乳酸菌菌株的抗逆性;在共同发酵牛乳的时,发酵前期两者均可促进L63产酸,但随着发酵进行与L63单独发酵趋于统一;代谢组学分析结果表明,二者共培养与非共培养下的差异代谢物主要集中在脂类和类脂分子中,脂类和类脂分子主要与细胞膜的合成相关,这可能是因为互作中对细胞数量变化的影响导致,而两者差异代谢物分布的通路也不同,但主要跟能量代谢、遗传、呼吸作用等相关,这些通路都和细胞最基本的生长状态相关,在一定角度上解释了发酵后期L. kefiri的生长状态。
综上所述,乳酸菌和酵母菌的共同培养对代谢产物的生产(以胞外多糖产量为例)、发酵乳发酵条件优化等方面均有积极作用,但还需要根据应用场景继续深入研究,并在将来有望应用于生物活性产物生产和发酵食品中。
[1] 王荫榆, 李会荣, 贾士芳, 等.应用变性梯度凝胶电泳和16S rDNA序列分析对kefir粒中细菌多样性的研究[J].微生物学报, 2006, 46(2):310-313.
WANG Y Y, LI H R, JIA S F, et al.Analysis of bacterial diversity of kefir grains by denaturing gradient gel electrophoresis and(16S rDNA) sequencing[J].Acta Microbiologica Sinica, 2006, 46(2):310-313.
[2] FARAG M A, JOMAA S A, EL-WAHED A A, et al.The many faces of kefir fermented dairy products:Quality characteristics, flavour chemistry, nutritional value, health benefits, and safety[J].Nutrients, 2020, 12(2):346.
[3] AHMED Z, WANG Y, AHMAD A, et al.Kefir and health:A contemporary perspective[J].Critical Reviews in Food Science and Nutrition, 2013, 53(5):422-434.
[4] DE ALMEIDA BRASIEL P G, MEDEIROS J D, MACHADO A B F, et al.Microbial community dynamics of fermented kefir beverages changes over time[J].International Journal of Dairy Technology, 2021, 74(2):324-331.
[5] MALBA A R V, MILANOVI
A R V, MILANOVI S D, LON
S D, LON AR E S, et al.Milk-based beverages obtained by kombucha application[J].Food Chemistry, 2009, 112(1):178-184.
AR E S, et al.Milk-based beverages obtained by kombucha application[J].Food Chemistry, 2009, 112(1):178-184.
[6] WANG H, GUO M R.Microbiological profiles, physiochemical properties and volatile compounds of goat milk kefir fermented by reconstituted kefir grains[J].LWT, 2023, 183:114943.
[7] BAARS T, VAN ESCH B, VAN OOIJEN L, et al.Raw milk kefir:Microbiota, bioactive peptides, and immune modulation[J].Food &Function, 2023, 14(3):1648-1661.
[8] KIM D H, CHON J W, KIM H, et al.Modulation of intestinal microbiota in mice by kefir administration[J].Food Science and Biotechnology, 2015, 24(4):1397-1403.
[9] LIU S Q, LU S Y, QURESHI N, et al.Antibacterial property and metagenomic analysis of milk kefir[J].Probiotics and Antimicrobial Proteins, 2022, 14(6):1170-1183.
[10] TU M Y, HAN K Y, CHANG G R, et al.Kefir peptides prevent estrogen deficiency-induced bone loss and modulate the structure of the gut microbiota in ovariectomized mice[J].Nutrients, 2020, 12(11):3432.
[11] KÖK TA T, AT
T, AT LGAN S, ÖZDEMIR N.Presence of Lactobacillus kefiranofaciens subsp.kefiranofaciens, Lentilactobacillus kefiri and Lentilactobacillus parakefiri in the stools of Balb/c consuming natural kefir[J].Biologia, 2022, 77(8):2393-2403.
LGAN S, ÖZDEMIR N.Presence of Lactobacillus kefiranofaciens subsp.kefiranofaciens, Lentilactobacillus kefiri and Lentilactobacillus parakefiri in the stools of Balb/c consuming natural kefir[J].Biologia, 2022, 77(8):2393-2403.
[12] ALRADDADI F A J, ROSS T, POWELL S M.Evaluation of the microbial communities in kefir grains and kefir over time[J].International Dairy Journal, 2023, 136:105490.
[13] ZHANG Y Z, LIU P P, FU H, et al.Effects of Lactobacillus kefiri fermentation supernatant on skin aging caused by oxidative stress[J].Journal of Functional Foods, 2022, 96:105222.
[14] ZAMANPOUR S, ALI NOORI S M, SHOKROLLAHI YANCHESHMEH B, et al.A systematic review to introduce the most effective postbiotics derived from probiotics for aflatoxin detoxification in vitro[J].Italian Journal of Food Science, 2023, 35(4):31-49.
[15] YOUN H Y, KIM D H, KIM H J, et al.Survivability of Kluyveromyces marxianus isolated from Korean kefir in a simulated gastrointestinal environment[J].Frontiers in Microbiology, 2022, 13:842097.
[16] KARIM A, GERLIANI N, AÏDER M.Kluyveromyces marxianus:An emerging yeast cell factory for applications in food and biotechnology[J].International Journal of Food Microbiology, 2020, 333:108818.
[17] WANG L, GAO E Y, HU M, et al.Isolation, identification and screening of high-quality yeast strains for the production of milk beer[J].International Journal of Dairy Technology, 2018, 71(4):944-953.
[18] 廖一漠. 短乳杆菌与马克斯克鲁维酵母菌混合发酵乳品质分析及代谢组学研究[D].雅安:四川农业大学, 2023.
LIAO Y M.Quality analysis and metabolomics of mixed fermented milk from Lactobacillus shortum and Saccharomyces cerevisiae Maximiliani[D].Ya’an:Sichuan Agricultural University, 2023.
[19] DU TOIT S C, ROSSOUW D, DU TOIT M, et al.Enforced mutualism leads to improved cooperative behavior between Saccharomyces cerevisiae and Lactobacillus plantarum[J].Microorganisms, 2020, 8(8):1109.
[20] CARBONETTO B, NIDELET T, GUEZENEC S, et al.Interactions between Kazachstania humilis yeast species and lactic acid bacteria in sourdough[J].Microorganisms, 2020, 8(2):240.
[21] 刘豪栋, 杨昳津, 林高节, 等.酵母与乳酸菌的相互作用模式及其在发酵食品中的应用研究进展[J].食品科学, 2022, 43(9):268-274.
LIU H D, YANG Y J, LIN G J, et al.Recent progress in understanding the interaction patterns between yeast and lactic acid bacteria and their applications in fermented foods[J].Food Science, 2022, 43(9):268-274.
[22] CAGGIANIELLO G, KLEEREBEZEM M, SPANO G.Exopolysaccharides produced by lactic acid bacteria:From health-promoting benefits to stress tolerance mechanisms[J].Applied Microbiology and Biotechnology, 2016, 100(9):3877-3886.
[23] RUAS-MADIEDO P, HUGENHOLTZ J, ZOON P.An overview of the functionality of exopolysaccharides produced by lactic acid bacteria[J].International Dairy Journal, 2002, 12(2-3):163-171.
[24] 张昕, 王惠君, 薛卫杰, 等.苹果酸-天冬氨酸代谢对水稻镉吸收转运特性的影响[J].农业环境科学学报, 2023, 42(10):2147-2154.
ZHANG X, WANG H J, XUE W J, et al.Effects of malate-aspartic acid metabolism on cadmium uptake and transport in rice[J].Journal of Agro-Environment Science, 2023, 42(10):2147-2154.
[25] 李梦倩, 王明婷, 许毓柳, 等.嘌呤代谢通路异常与抑郁症发病机制的研究[J].齐齐哈尔医学院学报, 2023, 44(20):1901-1906.
LI M Q, WANG M T, XU Y L, et al.Study on the role of purine metabolic pathway disorders in the pathogenesis of depression[J].Journal of Qiqihar Medical University, 2023, 44(20):1901-1906.
[26] 李璐, 董斌.乏氧微环境、“瓦伯格” 效应及上皮间质转化相关性[J].中国生物化学与分子生物学报, 2018, 34(9):949-953.
LI L, DONG B.The correlation of hypoxic tumor microenvironment, Warburg effect and epithelial-mesenchymal transition[J].Chinese Journal of Biochemistry and Molecular Biology, 2018, 34(9):949-953.
[27] ZHAO M T, ZHANG Z Y.Glucose transporter regulation in cancer:A profile and the loops[J].Critical Reviews in Eukaryotic Gene Expression, 2016, 26(3):223-238.
[28] BOUCHEZ C L, HAMMAD N, CUVELLIER S, et al.The Warburg effect in yeast:Repression of mitochondrial metabolism is not a prerequisite to promote cell proliferation[J].Frontiers in Oncology, 2020, 10:1333.