马铃薯作为中国第四大主粮,以其营养价值丰富、产量高、适应能力强、储存时间长和应用性广泛而受到重视。马铃薯种殖的过程中,经常存在马铃薯晚疫病、马铃薯粉痂病等植物性病害。马铃薯晚疫病主要由致病疫霉菌(Paenibacillus infesfans)侵染所致,具有极强的流行性;马铃薯粉痂病,是由马铃薯粉痂病菌(Spongospora subterranea)引起的难治性土传疾病,对生产构成了重大威胁。目前马铃薯晚疫病和马铃薯粉痂病防治方式主要有化学防治和生物防治,但是长期使用化学防治会带来安全性、环保性和抗药性等问题。而生物防治方法由于其安全性、环保性和无抗药性等特性,成为研究的焦点。研究表明,相较于化学农药,微生物及其代谢产物已成为一种重要的绿色防控方式[1]。
微生物代谢产生的挥发性物质(volatile organic compounds,VOCs)在控制病原菌方面具有巨大的潜力[2],其分子质量低、可快速降解[3],对植物病原菌显示出良好的拮抗活性[4-5]。目前,利用生防菌产生的挥发性物质来抑制各种植物病原菌已成为研究热点[6-7]。荧光假单胞菌(Pseudomonas fluroescens)YG-1的挥发性物质可有效抑制烟草根黑腐病菌的生长,使菌丝扭曲畸形[8];钩状木霉(Trichoderma hamatum)ZQ202104的挥发性物质对辣椒炭疽菌和薏苡黑粉菌的生长均具有抑制作用[9]。
本实验以课题组早期从土壤中分离的多黏类芽孢杆菌(Paenibacillus polymyxa)HL11为拮抗菌,研究其产生的挥发性物质对致病疫霉菌和马铃薯粉痂病菌生长的影响,并利用GC-MS对挥发性物质组分进行鉴定分析,并进行抑菌相关研究,旨在为研究HL11控制病原菌提供新思路。
1 材料与方法
1.1 材料与试剂
1.1.1 供试菌株与培养基
芽孢杆菌:多黏类芽孢杆菌HL11,由本实验室自主分离并保存。
试病原真菌:致病疫霉菌、马铃薯粉痂病菌,湖北省生物农药工程技术研究中心。
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基(g/L):马铃薯200、葡萄糖20、琼脂18。
马铃薯葡萄糖液体培养基(g/L):马铃薯200、葡萄糖20。
LB固体培养基(g/L):酵母浸粉5.0、蛋白胨10.0、NaCl 5.0,琼脂粉18。
1.1.2 试剂
乙酸异戊酯,上海麦克林科技股份有限公司;酵母浸粉、蛋白胨、葡萄糖、NaCl(均为生化试剂),国药集团化学试剂有限公司;细菌基因组DNA提取试剂盒,天根生化科技(北京)有限公司;甘油明胶封片剂、Gluta固定液(电镜专用,体积分数2.5%,下同),北京索莱宝科技有限公司;质量分数50%多菌灵、质量分数80%代森锰锌,中国农科院植保所中保绿农集团;枯草芽孢杆菌1 000亿芽孢/g,飞翔农资;体积分数为75%酒精、NaClO,市售;马铃薯,湖北恩施建始县。
1.2 仪器与设备
CAR/PDMS SPME手动进样手柄及萃取头,美国Supelco公司;7890B-5977B GC-MS,美国安捷伦公司;SU8010高分辨场发射扫描电镜(scanning electron microscope,SEM),日本日立公司;ZHWY-2102C恒温摇床、ZFD-5430电热鼓风干燥箱,上海智城分析仪器制造有限公司;YXQ-LS全自动数显高压蒸汽灭菌锅,上海博讯实业有限公司;DNP-9022生化培养箱,上海精宏分析仪器制造有限公司。
1.3 实验方法
1.3.1 菌种的活化及种子液的制备
将斜面保存的HL11接种于100 mL LB培养基的锥形瓶中,30 ℃、200 r/min摇床培养16 h。将上述菌液按照体积分数2%转接至新的LB培养基中,在相同条件下继续培养24 h得到HL11的种子液。
1.3.2 菌株形态、生理生化
该菌株在LB固体培养基上划线,37 ℃培养24 h后,观察LB平板上的菌落状态;具体方法参照《伯杰细菌鉴定手册》对HL11进行革兰氏染色,在光学显微镜、扫描电镜下观察菌体形态特征,并进行生理生化实验。
1.3.3 分子生物学鉴定
以HL11的基因组DNA为模板,以引物27 F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1 492 R(5′-TAC-GGCTACCTTGTTACGACTT-3′)为引物,进行PCR扩增。将PCR扩增片段进行测序后,通过NCBI-BLAST(https://blast.ncbi.nlm.nih.gov/Blast.cgi)比对分析;并通过MEGA软件构建系统发育树。
1.3.4 挥发性物质对致病疫霉菌、马铃薯粉痂病菌的菌丝生长影响
本实验采用平板对扣法测定HL11挥发性物质对致病疫霉菌、马铃薯粉痂病菌的抑菌情况;使用0.5 cm打孔器制备植物病原真菌菌饼,接种于9 cm PDA平板培养皿中心。将已经活化好的HL11接种于100 mL LB液体培养基,在30 ℃、200 r/min条件下培养24 h。采用活菌计数法调节HL11的菌液浓度,吸取100 μL的1.0×108 CFU/mL菌液于LB固体培养基上,涂布均匀,然后将真菌PDA平板置于细菌平板正上方,2个平板接触的区域使用3 cm的保鲜膜密封。空白对照组是将接种真菌的PDA平板放置于空白LB平板上方。每个处理重复3组,置于28 ℃培养箱,每隔24 h测量各处理组致病疫霉菌、马铃薯粉痂病菌被抑制的真菌直径,直至空白对照组真菌不再生长。分别计算出致病疫霉菌、马铃薯粉痂病菌的抑菌率,计算如公式(1)所示:
抑菌率![]()
(1)
1.3.5 SEM观察挥发性物质处理对菌丝形态的影响
在1.3.4节实验第7天时,打开上述双层平板挑取空白对照组、实验组的菌丝,将其涂抹在干净的锡纸上,铺平风干,将锡纸上的样品浸泡在体积分数为2.5%的戊二醛溶液,在4 ℃条件下固定3 h。采用PBS溶液进行2次冲洗,每次15 min。接着,使用不同体积分数的乙醇溶液(50%、60%、70%、80%、90%、95%、100%)进行脱水处理,每个体积分数阶段持续10 min,最后用体积分数100%的乙酸异戊酯溶液进行2次置换,每次15 min。使用扫描电镜在12 kV下观察菌丝形态。
1.3.6 光学显微镜观察挥发性物质对菌丝形态的影响
在1.3.4节实验第7天时,打开上述双层平板挑取空白对照组、实验组的菌丝,将其涂抹在干净的锡纸上,铺平风干。取样、制样,并使用光学显微镜观察菌丝的形态。
1.3.7 顶空固相微萃取(headspace solid-phase micro-extraction-GC-MS,HS-SPME-GC-MS)检测HL11的挥发性物质成分
1.3.7.1 顶空固相微萃取
参考SUN等[10]的方法,并有所改动。取1.3.1节培养好的HL11发酵液200 μL,将其转接到顶空瓶中的LB固体培养基上,在30 ℃条件下培养48 h。将萃取头插入顶空瓶中40 ℃萃取20 min,萃取顶空瓶中收集的挥发性物质,吸附完成后,立即插入GC-MS进样口中解析2 min,进行分析。
1.3.7.2 GC-MS分析
参考IAMANAKA等[11]的方法,并有所改动。GC条件:色谱柱为HP-5MS(30.0 m×250 μm×0.25 μm)弹性石英毛细管柱,色谱柱采用系统升温,在初始温度为50 ℃条件下,时间为5 min,然后以10 ℃升高到250 ℃,继续保持5 min。柱箱温度250 ℃,载气为高纯度He(≥99.99%),柱前压7.93 psi,载气流量1 mL/min,进样量1 μL。质谱条件:EI源,离子源温度230 ℃,进样口温度250 ℃,四极杆温度150 ℃,电子能量70 eV,发射电流34.6 Ma。检测后与美国国家标准与技术研究院(National Institute of Standards and technology,NIST)数据库比对鉴定,选取相似度>80%的组分[12]进行成分分析。
1.3.8 HL11的挥发性物质对接种致病疫霉菌和马铃薯粉痂病菌的离体防治
同1.3.1节。参考赵锦芳等[13]的方法,并有所改动。选取个头大小均匀、无病虫害、无明显损伤的马铃薯,使用质量分数为2%的NaClO溶液对马铃薯表面进行消毒,然后使用无菌水洗去马铃薯表面残余的NaClO,吹干备用。使用0.5 cm打孔器在马铃薯两端打2个接种孔,深度0.3 cm。同时使用0.5 cm打孔器将PDA培养基上培养7 d的致病疫霉菌、马铃薯粉痂病菌打成直径0.5 cm的菌饼,并将致病疫霉菌、马铃薯粉痂病菌饼接在马铃薯打孔处。
阴性空白对照组:不打孔,不接种病原菌;空白对照组:打孔、接种病原菌菌饼,同时将3个空白LB固体平板放在聚乙烯薄膜自封袋密封;实验组:打孔、接种病原菌菌饼,同时将3个涂布浓度为1.0×108CFU/mL HL11菌液的LB固体平板一起放入聚乙烯薄膜自封袋密封;阳性对照组:打孔并接种病原菌菌饼,分别在LB固体培养基平板上涂布等量的50%多菌灵800倍液、80%代森锰锌800倍液、枯草芽孢杆菌1 000亿芽孢/g 500倍液等农药,每组涂布LB平板然后分别放进聚乙烯薄膜自封袋密封,每组实验放6个平行马铃薯,每组实验设置3组平行对照。
将上述实验样品放置于28 ℃、黑暗条件下贮藏7 d。每隔24 h观察和记录各组的马铃薯发病情况,将观察到的马铃薯病斑个数及时拍照并记录各组的数据。按照公式(2)、公式(3)分别计算马铃薯的感染率、防治效果。
感染率![]()
(2)
防治效果![]()
(3)
1.4 数据统计分析
使用Excel处理数据、Origin 2019b作图,SPSS数据软件进行方差分析,实验重复3次,取测定结果的平均值±标准差。
2 结果与分析
2.1 HL11的鉴定
2.1.1 形态学特征及革兰氏染色
HL11在LB平板上过夜培养后,菌落生长迅速,形成的单菌落不透明,菌落呈现乳白色有隆起,菌落边缘较圆滑,表面有褶皱出现,并且具有黏性(图1-a)。在光学显微镜下,可观察出其菌体细胞呈现长杆状,用革兰氏染色呈现阳性(图1-b)。在扫描电镜下,菌体(图1-c)表面光滑,两端钝圆。
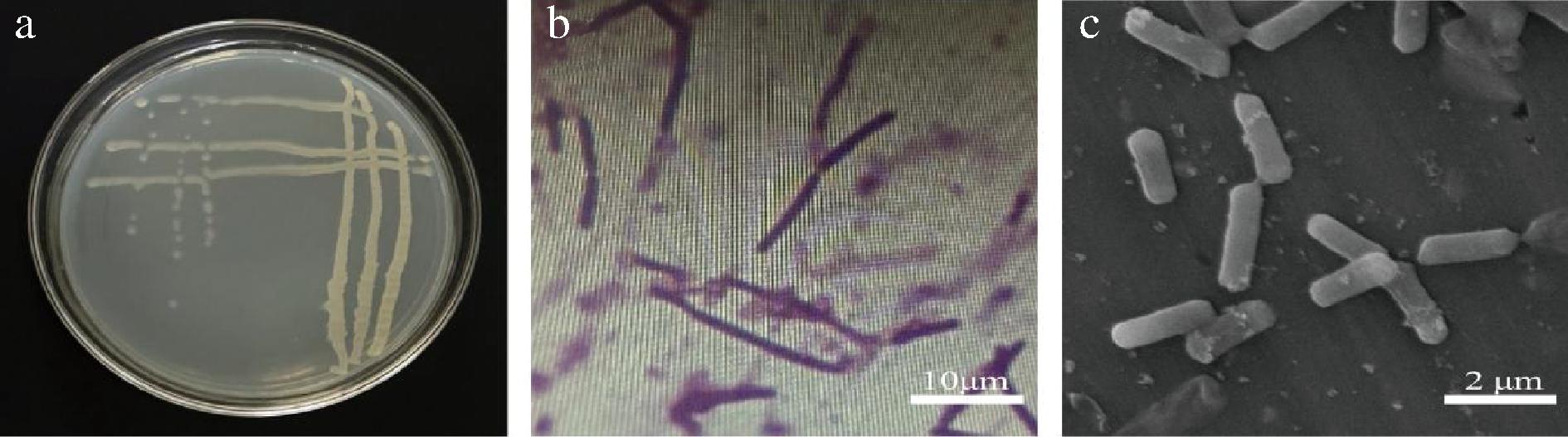
a-菌落形态;b-革兰氏染色;c-扫描电镜图
图1 菌株HL11 形态特征
Fig.1 Morphological characteristics of strain HL11
2.1.2 HL11菌株生理生化鉴定
菌株HL11在接触酶反应、V-P、明胶液化、淀粉水解、甘露醇、葡萄糖氧化发酵反应、葡萄糖分解反应、硝酸盐还原、厌氧生长等反应中呈阳性;甲基红反应、吲哚实验、柠檬酸盐利用实验为阴性,能够产生酪蛋白酶、不能分解尿素;根据形态学特征以及生理生化实验,初步推测菌株HL11为类芽孢杆菌属(Paenibacillus)。结果如表1所示,菌株HL11能够使硝酸盐还原成亚硝酸盐,能够产生淀粉酶、酪蛋白酶以及在葡萄糖分解反应、厌氧生长等反应中呈阳性。生理生化实验表明菌株HL11具有芽孢杆菌特征。
表1 菌株HL11生理生化特征
Table 1 Physiological and biochemical characteristics of strain HL11

生理生化特征结果生理生化特征结果接触酶反应+硝酸盐还原+V-P+厌氧生长+明胶液化+甲基红反应-淀粉水解+吲哚实验-甘露醇+柠檬酸盐利用实验-葡萄糖氧化发酵反应+酪蛋白酶+葡萄糖分解反应+尿素-
注:+:阳性反应;-:阴性反应。
2.1.3 HL11菌株分子生物学鉴定
以菌株HL11的基因组DNA为模板,通过细菌通用引物27 F和1 492 R进行PCR扩增(如图2),待反应结束后,取2.5 μL PCR扩增产物送至生工生物工程(上海)有限公司进行测序。

图2 PCR扩增结果
Fig.2 PCR amplification results
测序结果显示,HL11菌株的扩增片段为1 399 bp,在NCBI中进行BLAST分析后,挑选出相关序列,并利用MEGA软件基于GenBank中获得的序列数据构建系统进化树(图3)。通过比对发现HL11与P.polymyxa PP11(登录号:MF001283.1)亲缘关系最近,结合形态学鉴定,HL11为多黏类芽孢杆菌。
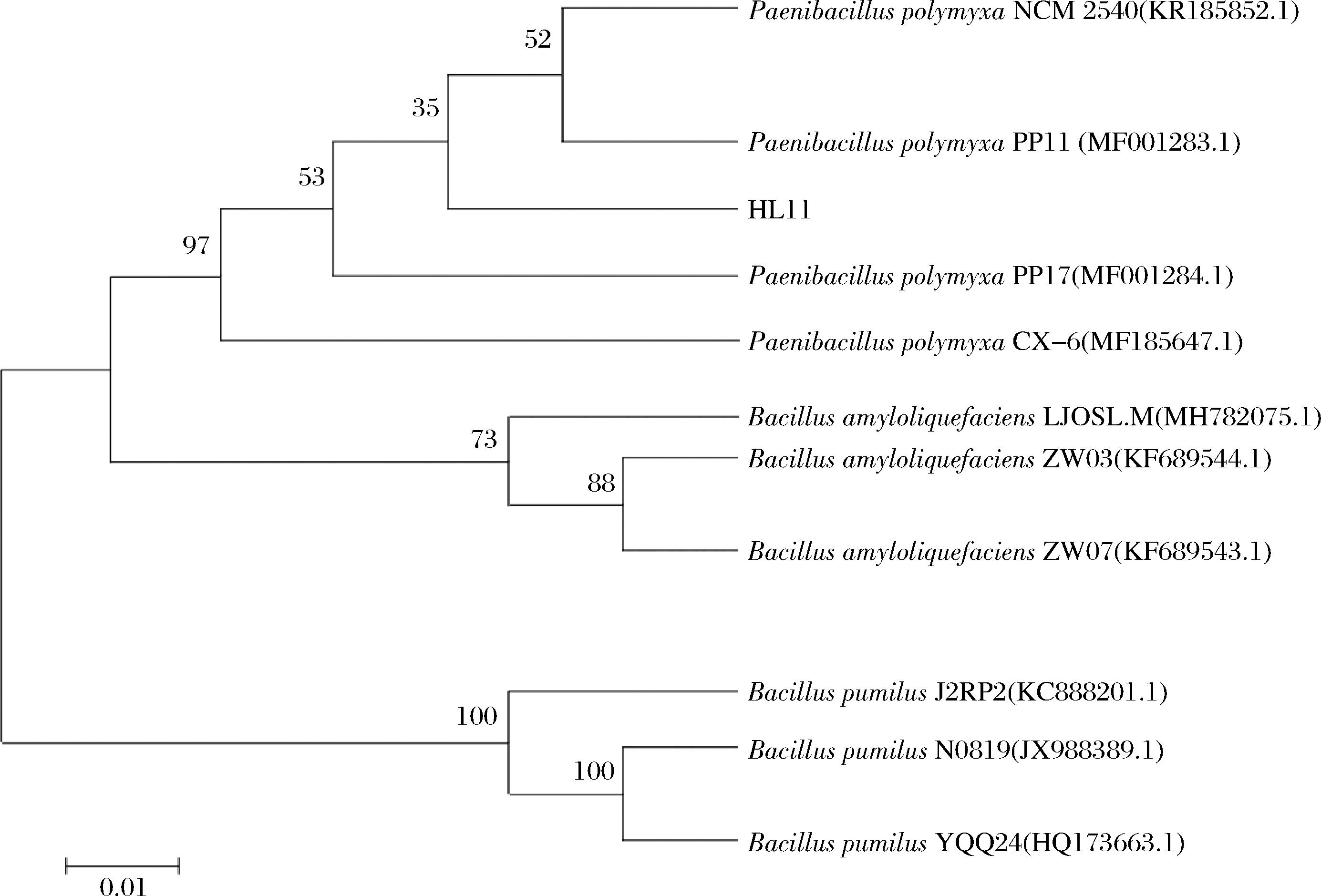
图3 HL11的16S rDNA的基因系统发育进化树
Fig.3 Phylogenetic evolution tree of 16S rDNA of HL11
2.2 HL11挥发性物质对致病疫霉菌和马铃薯粉痂病菌菌丝生长抑制作用
由图4可知,与对照组相比,HL11对致病疫霉菌和马铃薯粉痂病菌的抑制作用极为明显,对致病疫霉菌的抑制效果更佳;其菌丝体及孢子较少,而对扣过程中其孢子和菌丝体没有掉落在对扣板上,对照组掉落在对扣板上的菌丝体和孢子较多。菌株HL11产生的挥发性物质对致病疫霉菌和马铃薯粉痂病菌的平均抑菌率分别为(77.75±1.78)%和(54.37±1.39)%,两者存在显著性差异(P<0.05)。
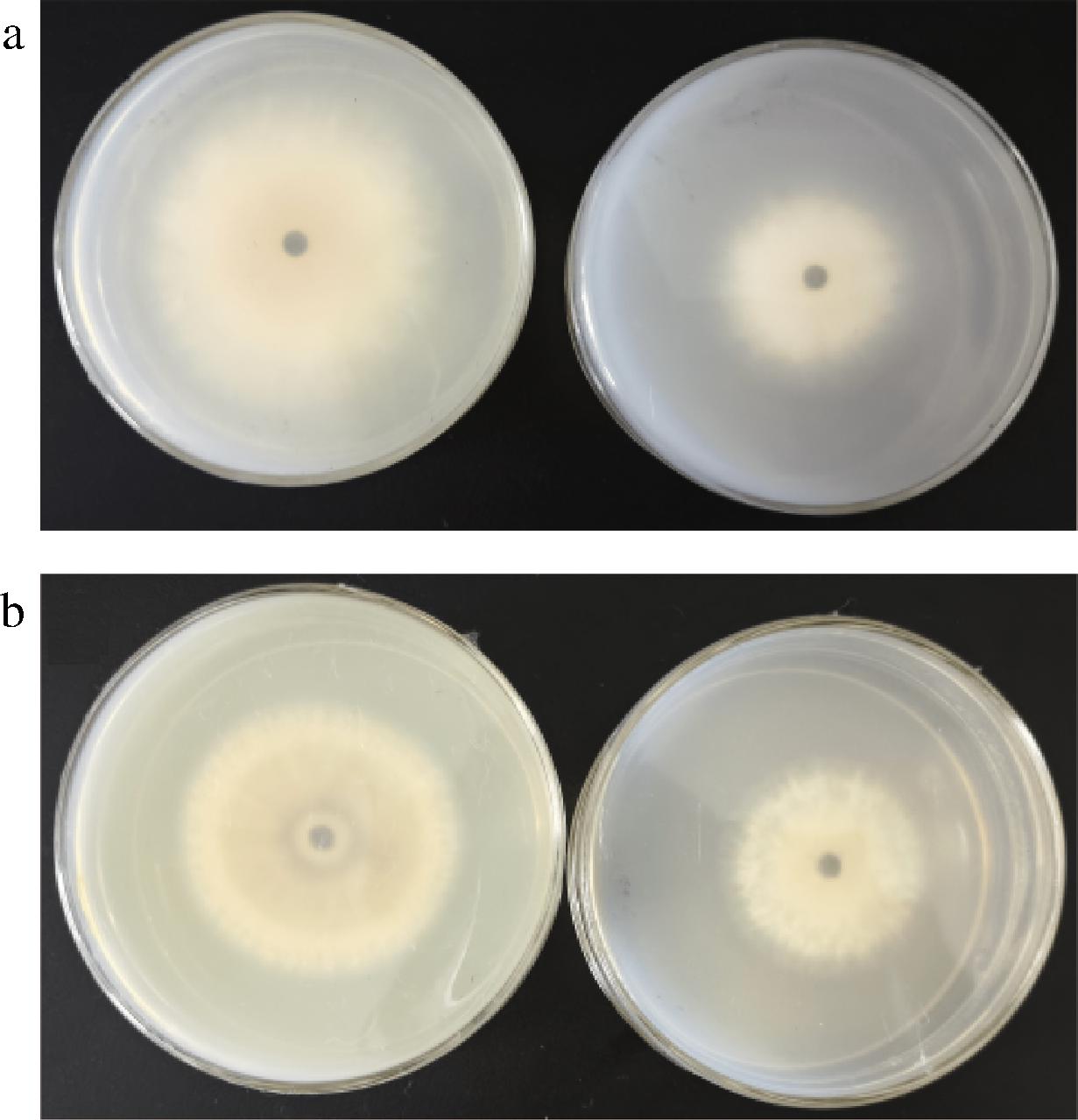
a-P.infesfans;b-S.subterranea
图4 HL11的挥发性物质对致病疫霉菌和马铃薯粉痂病菌生长抑制图
Fig.4 The growth inhibition of volatile substances of HL11 on P.infestans and S.subterranea
由图5可知,菌株HL11产生的挥发性物质对致病疫霉菌和马铃薯粉痂病菌的抑菌率随着时间呈现逐渐减小的趋势。HL11生长初期时,培养基的营养物质比较充足,菌体繁殖快速且能够产生大量的挥发性物质,而植物病原菌初期生长较缓慢,受到挥发性物质的影响较大;而随着培养时间的延长,培养基中的营养物质和菌体生长空间下的压缩,HL11生长缓慢产生的挥发性物质减少。因此,植物病原菌受到的抑制作用下降,从而HL11的挥发性物质对2种真菌的抑菌率呈现逐渐减小的趋势。
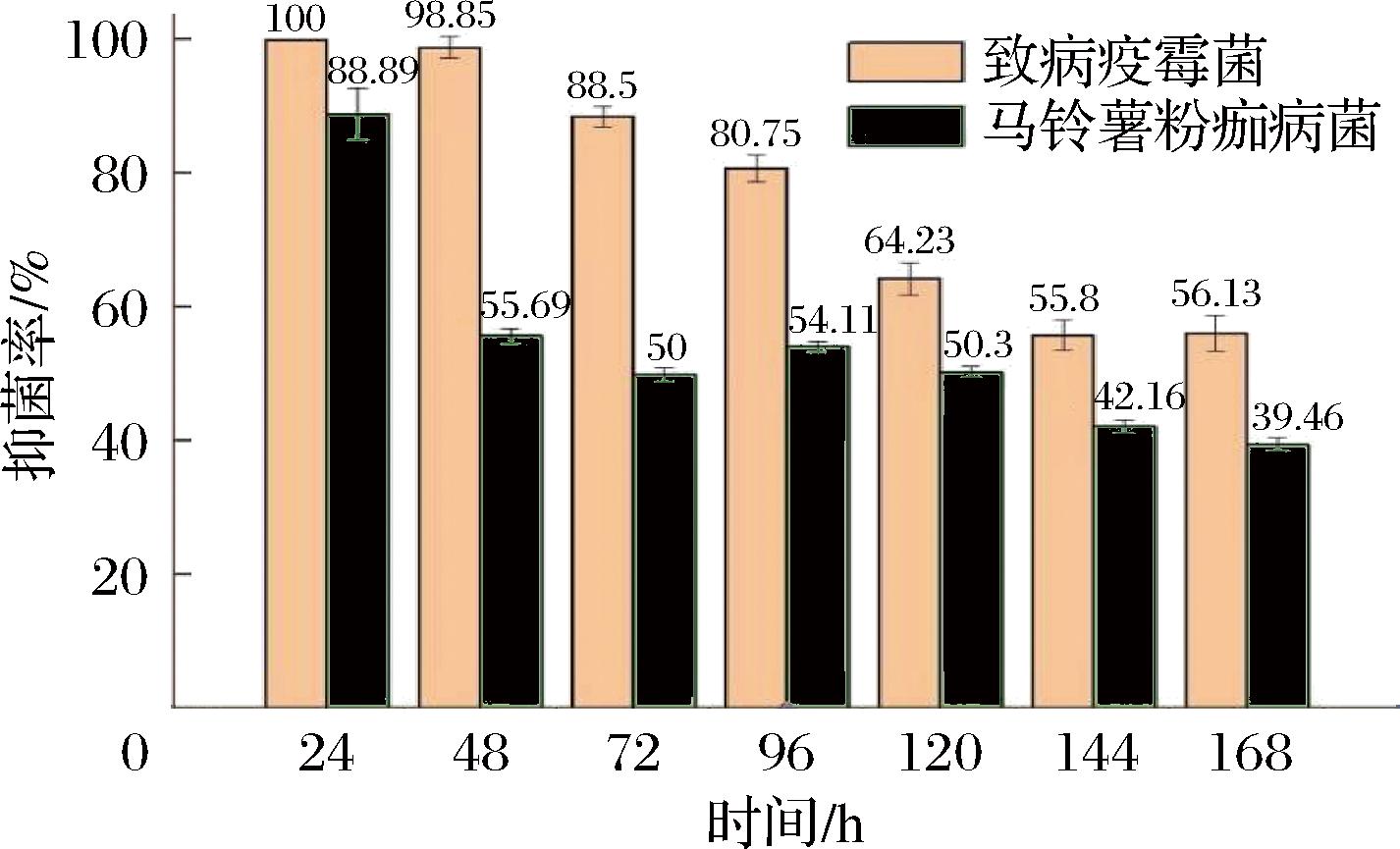
图5 HL11的挥发性物质对致病疫霉菌和马铃薯粉痂病菌不同时间段的抑制率
Fig.5 Inhibition rate of volatile substances of HL11 on P.infestans and S.subterranea in different time periods
2.3 光学显微镜观察挥发性物质对菌丝形态的影响
如图6所示,在光学显微镜下,无任何处理的空白对照组真菌菌丝形态正常无明显变化,菌丝表面光滑、结构完整呈现树枝状的长细条;而实验组真菌菌丝末端膨大,菌丝缠绕在一起,菌丝表面出现皱褶或者凹陷。
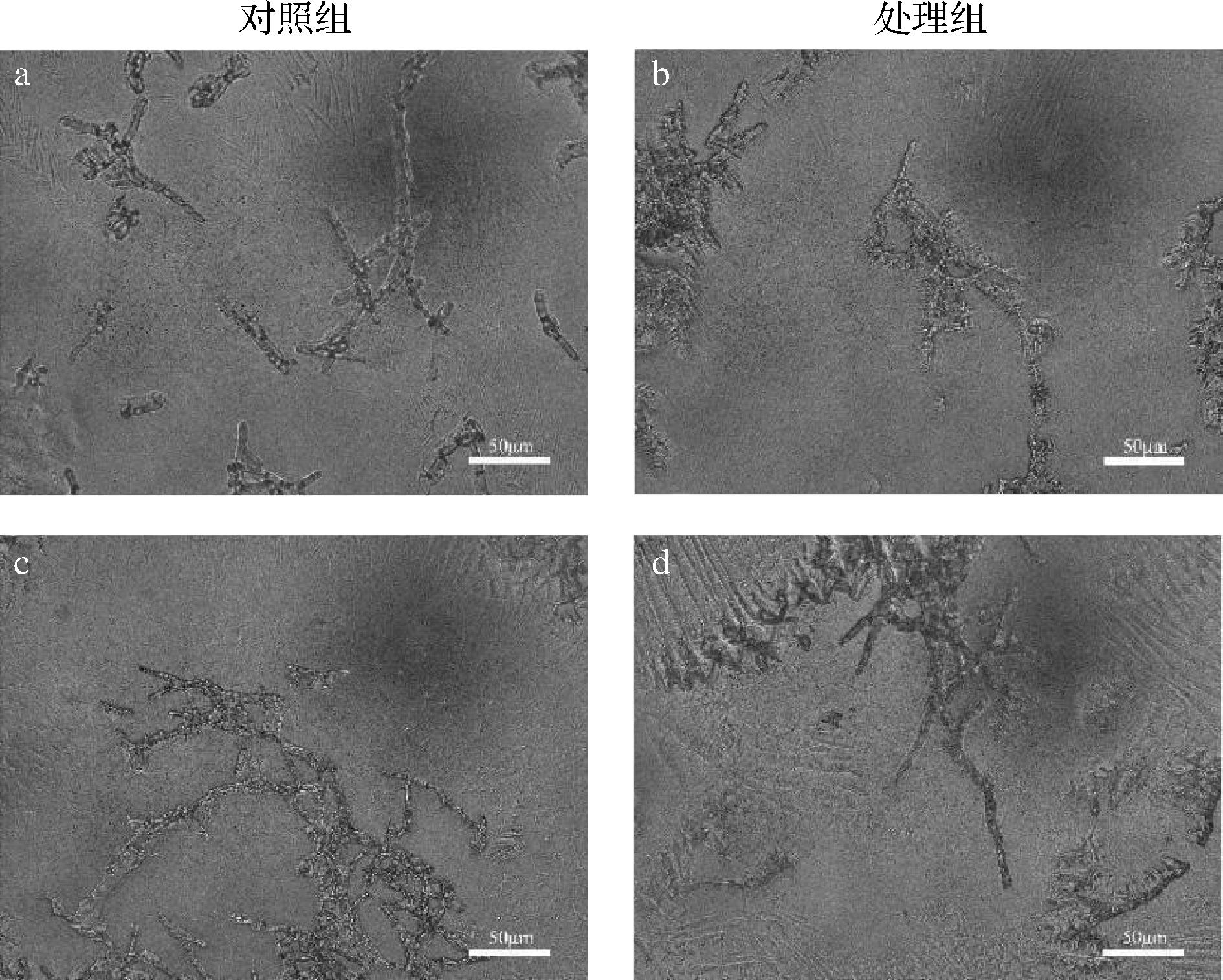
a-P.infesfans对照组菌丝;b-P.infesfans VOCs处理组;c-S.subterranea对照组菌丝;d-S.subterraneaVOCs处理组
图6 光学显微镜下观察经HL11的挥发性物质处理的菌丝形态
Fig.6 The morphology of mycelium treated with VOCs of HL11 was observed under an optical microscope
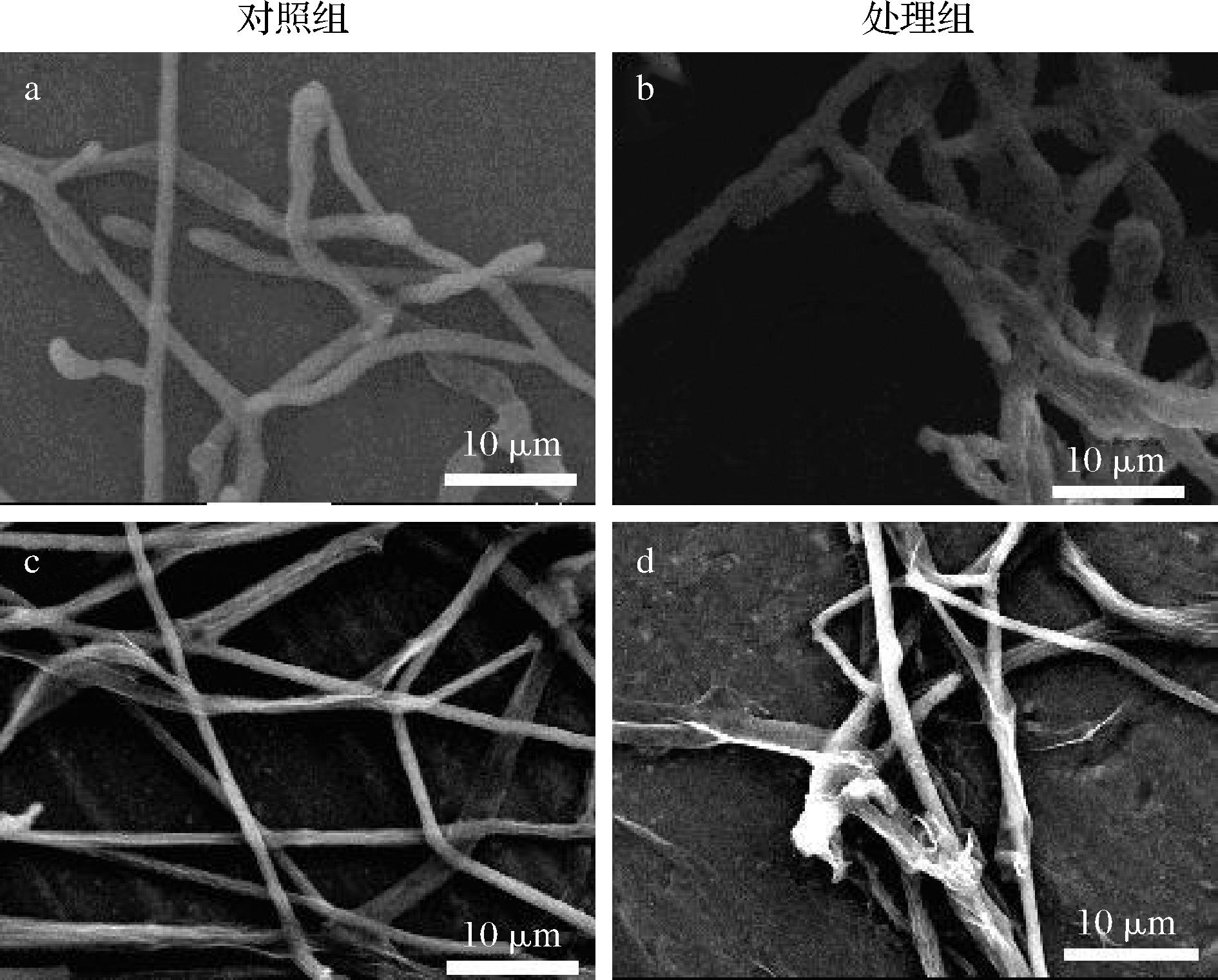
a-P.infesfans对照组菌丝;b-P.infesfansVOCs处理组;c-S.subterranea对照组菌丝;d-S.subterraneaVOCs处理组
图7 扫描电镜下观察菌丝形态
Fig.7 Mycelium of morphology under SEM
2.4 扫描电镜观察菌丝体的形态变化
如图7所示,经过挥发性物质处理的菌丝,出现断裂,末端膨大变形、皱缩或者凹陷,部分菌丝有内容物溢出,菌丝缠绕在一起,表明挥发性物质中具有破坏真菌菌丝生长的成分或物质;进一步观察发现,对照组的菌丝形态正常,菌丝呈纤细完整的细条状,表面光滑。
2.5 HS SPME GC/MS法分析P.polymyxa相关挥发性物质成分
通过HS-SPME-GC-MS对HL11发酵过程中产生的挥发性物质化合物进行检测和分析,检测的挥发性物质中相似度>80%的组分有12种,如表2所示。
表2 HL11挥发性物质相似度>80%的组分
Table 2 The components of HL11 volatile substances with similarity greater than 80%
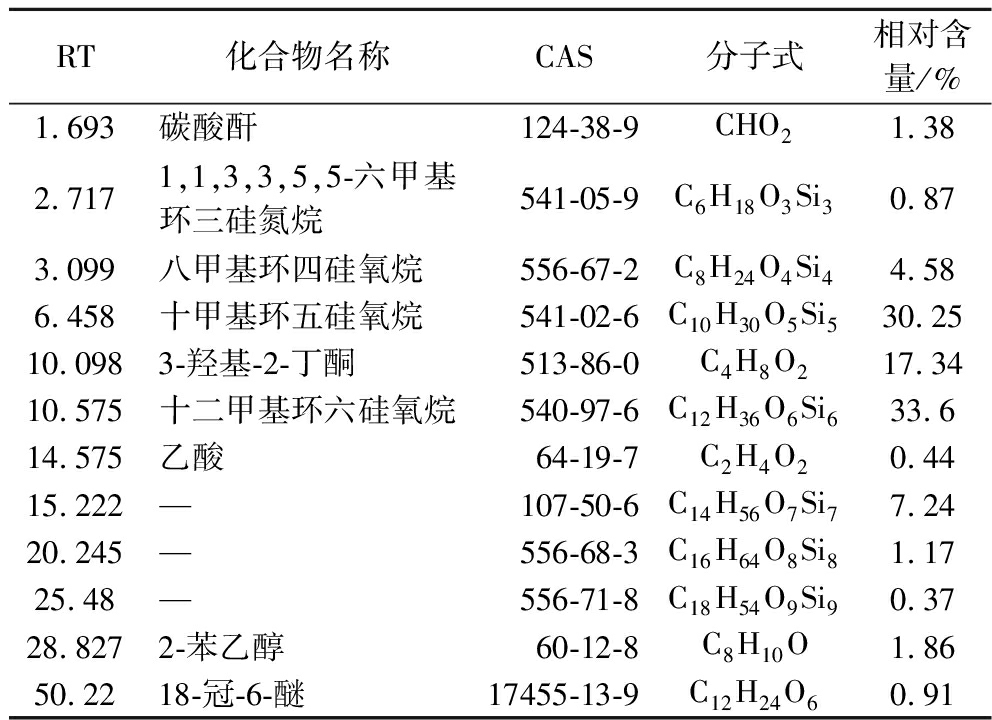
RT化合物名称CAS分子式相对含量/%1.693碳酸酐124-38-9CHO21.382.7171,1,3,3,5,5-六甲基环三硅氮烷541-05-9C6H18O3Si30.873.099八甲基环四硅氧烷556-67-2C8H24O4Si44.586.458十甲基环五硅氧烷541-02-6C10H30O5Si530.2510.0983-羟基-2-丁酮513-86-0C4H8O217.3410.575十二甲基环六硅氧烷540-97-6C12H36O6Si633.614.575乙酸64-19-7C2H4O20.4415.222—107-50-6C14H56O7Si77.2420.245—556-68-3C16H64O8Si81.1725.48—556-71-8C18H54O9Si90.3728.8272-苯乙醇60-12-8C8H10O1.8650.2218-冠-6-醚17455-13-9C12H24O60.91
注:—为未鉴定出的物质。
对HL11所产生的挥发性物质成分进行鉴定,共得到12种相似度>80%的组分,主要有酸酐、硅氧烷、丁酮、乙酸、2-苯乙醇、醚以及3种尚未被NIST收录的化合物。本研究中所鉴定的HL11挥发性成分中,3-羟基-2-丁酮和2-苯乙醇已被证实对一些植物病原菌有较强抑菌性,其中3-羟基-2-丁酮是主要抑菌成分,相对含量为17.34%,且能够有效抑制果实采后病菌青霉(Penicillium crustosum)[14];陈莹莹等[15]发现膜醭毕赤酵母产生的挥发性物质中含有3-羟基-2-丁酮,可抑制灰葡萄孢(Botrytis cinerea)的菌丝生长,抑制率高达72.41%。黄伟等[16]研究发现,产香真菌M6-5挥发物质中的2-苯乙醇对库尔勒香梨黑斑病菌链格孢菌(Alternaria alternata)有抑制作用;方静凡[17]研究发现,2-苯乙醇具有广谱抑菌活性,对引起柑橘、苹果、芒果、番茄等水果发病的多种植物病原菌具有较好的抑菌作用。
2.6 HL11的挥发性物质对致病疫霉菌、马铃薯粉痂病菌的离体防治效果
由图8和表3实验结果表明,接种了致病疫霉菌的空白对照组在72 h时马铃薯发病率为91.67%,在144 h时发病率为100%;使用了多菌灵农药处理实验组,168 h的发病率为16.67%,表明多菌灵农药对马铃薯晚疫病有较好的防治效果(>80%),且效果最佳;使用了代森锰锌农药处理的实验组,168 h的发病率为25%,防治效果>70%;使用了HL11产生的挥发性物质的实验组马铃薯,168 h的发病率为50%,防治效果>50%。接种了马铃薯粉痂病菌的空白对照组在72 h时发病率为88.92%,在144 h发病率100%;使用了多菌灵农药处理实验组,168 h的发病率为25%,多菌灵农药处理实验组防治效果>70%;用了枯草芽孢杆菌农药处理实验组,168 h的发病率为30.58%,枯草芽孢杆菌农药处理实验组防治效果接近于70%;使用了HL11产生的挥发性物质处理的实验组马铃薯,168 h的发病率为58.33%,防治效果为40%~50%,效果较一般。实验结果表明,HL11产生的挥发性物质对马铃薯晚疫病防治效果较于马铃薯粉痂病菌更好些,且HL11的挥发性物质对致病疫霉菌抑菌率大于对马铃薯粉痂病菌的抑菌率。通过离体防治实验进一步验证了HL11产生的挥发性物质对致病疫霉菌和马铃薯粉痂病菌有一定的抑制作用,可在一定程度上防治马铃薯晚疫病和粉痂病。
表3 HL11挥发性物质防治马铃薯发病效果 单位:%
Table 3 Effect of HL11 volatile substances on prevention and treatment of potato disease
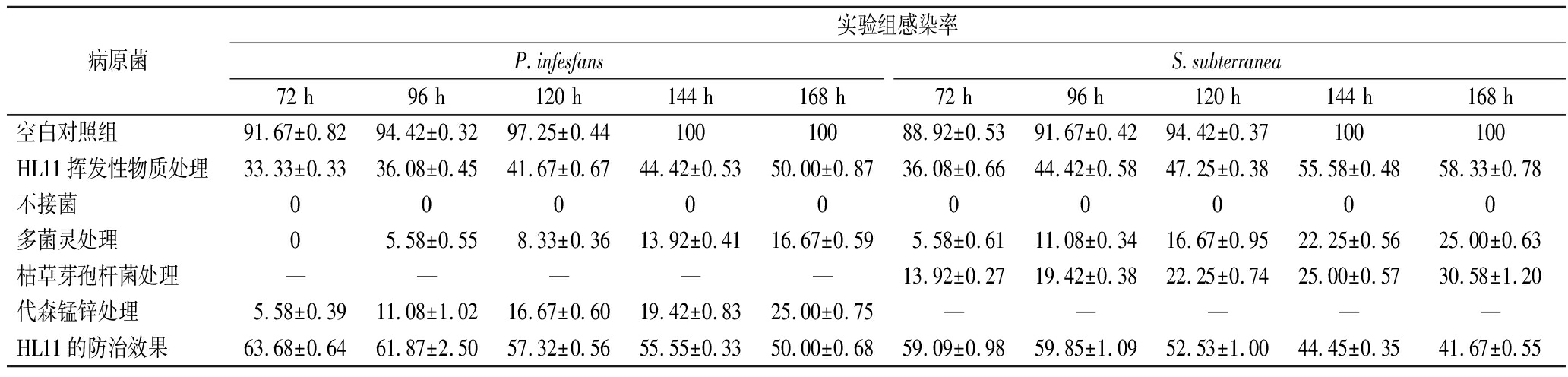
病原菌实验组感染率P.infesfansS.subterranea72 h96 h120 h144 h168 h72 h96 h120 h144 h168 h空白对照组91.67±0.8294.42±0.3297.25±0.4410010088.92±0.5391.67±0.4294.42±0.37100100HL11挥发性物质处理33.33±0.3336.08±0.4541.67±0.6744.42±0.5350.00±0.8736.08±0.6644.42±0.5847.25±0.3855.58±0.4858.33±0.78不接菌0000000000多菌灵处理05.58±0.558.33±0.3613.92±0.4116.67±0.595.58±0.6111.08±0.3416.67±0.9522.25±0.5625.00±0.63枯草芽孢杆菌处理—————13.92±0.2719.42±0.3822.25±0.7425.00±0.5730.58±1.20代森锰锌处理5.58±0.3911.08±1.0216.67±0.6019.42±0.8325.00±0.75—————HL11的防治效果63.68±0.6461.87±2.5057.32±0.5655.55±0.3350.00±0.6859.09±0.9859.85±1.0952.53±1.0044.45±0.3541.67±0.55
注:—表示未进行实验。
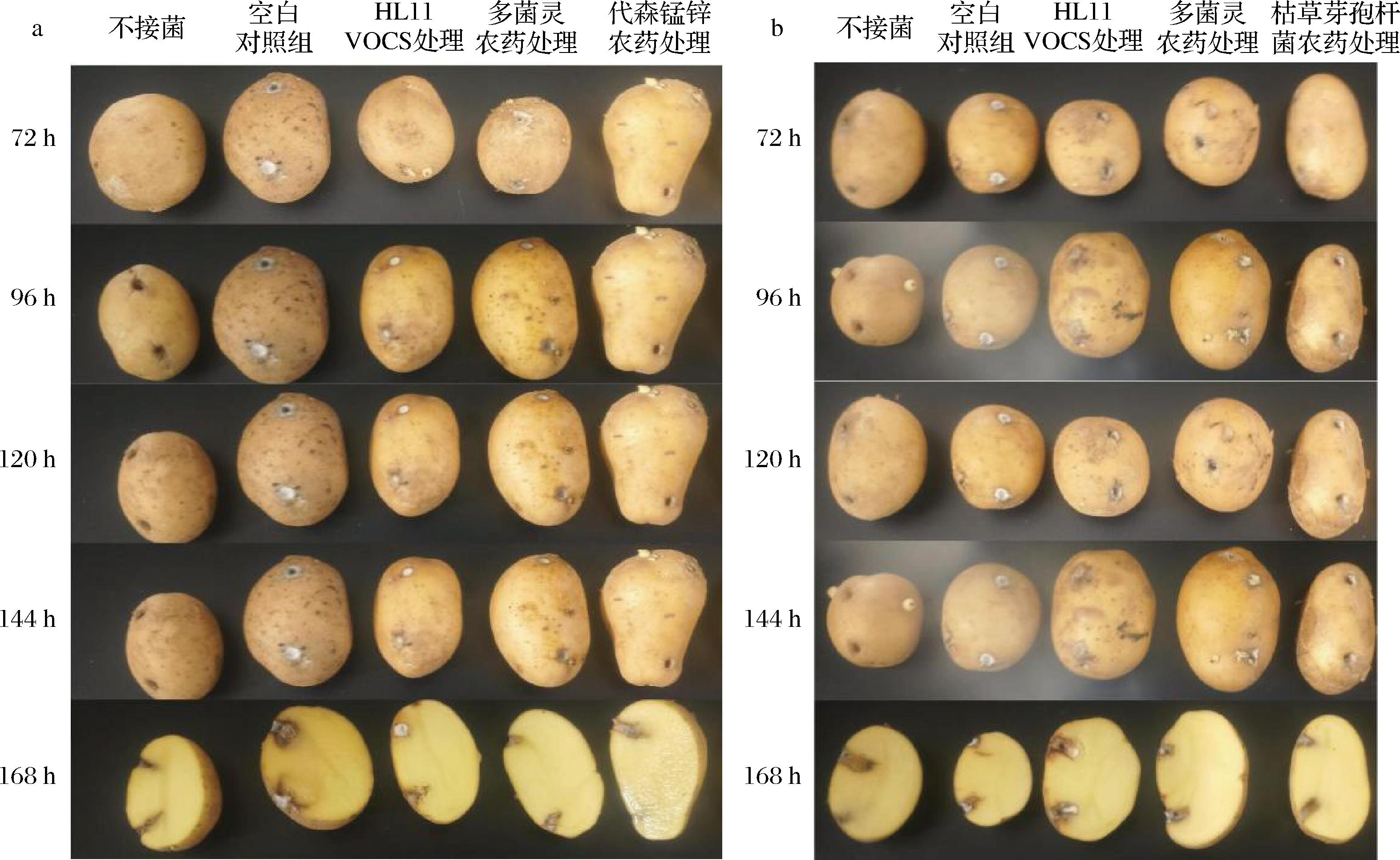
a-接种P.infesfans后;b-接种S.subterranea后
图8 HL11挥发性物质对马铃薯的体外防治效果
Fig.8 In vitro control effect of VOCs from HL11 on potato
3 结论与讨论
芽孢杆菌作为一类生防菌,能产生多种抗菌挥发性物质,同种不同株的芽孢杆菌产生的抗菌挥发性物质也有所不同,其产生的挥发性物质对多种植物病原菌有抑制作用[18];解淀粉芽孢杆菌(Bacillus amyloliquefaciens) XJ5菌株可产生对苹果褐腐菌(Monilinia fructigena)具有明显拮抗作用的挥发性物质[19];枯草芽孢杆菌(Bacillus subtilis) CF-3 菌株产生的挥发性物质能显著抑制桃褐腐病菌(Monilinia fructicola)和胶孢炭疽菌(Colletotrichum gloeosporioides)孢子的萌发和生长[20-21];贝莱斯芽孢杆菌(Bacillus velezensis)HY19菌株挥发性物质显著抑制意大利青霉和指状青霉的菌丝生长[22];目前,芽孢杆菌作为生防菌已受到人们的广泛关注,但关于芽孢杆菌产生的挥发性物质防治马铃薯晚疫病和粉痂病的相关报道较少。本研究中,以致病疫霉菌、马铃薯粉痂病菌为指示菌,对菌株HL11所产生的挥发性物质抑菌活性进行探究。平板对扣实验表明,HL11产生的挥发性物质对致病疫霉菌和马铃薯粉痂病菌均具有较好的抑菌效果;离体实验表明,HL11对马铃薯晚疫病和粉痂病都具有一定的防治效果。同时,还对HL11产生的挥发性物质进行了GC-MS分析,产生的12种组分中,3-羟基-2-丁酮和2-苯乙醇有相关文献报道,两者均对植物病原菌有抑制效果,而这2种抑菌化合物单体对致病疫霉菌和马铃薯粉痂病菌的抑菌活性相关报道较少,其挥发性物质抑菌机理是通过单一成分还是协同作用抑制病原菌生长繁殖性,还需进一步深入研究。以上研究可为HL11开发生防菌剂提供坚实的理论依据和数据支撑。
[1] 王静, 曹建敏, 陈德鑫, 等.短小芽孢杆菌AR03挥发性有机物的抑菌活性及其组分分析[J].中国农业科学, 2018, 51(10):1908-1919.
WANG J, CAO J M, CHEN D X, et al.Antimicrobial effect and components analysis of volatile organic compounds from Bacillus pumilus AR03[J].Scientia Agricultura Sinica, 2018, 51(10):1908-1919.
[2] SCHALCHLI H, TORTELLA G R, RUBILAR O, et al.Fungal volatiles:An environmentally friendly tool to control pathogenic microorganisms in plants[J].Critical Reviews in Biotechnology, 2016, 36(1):144-152.
[3] HUNG R, LEE S, BENNETT J W.Fungal volatile organic compounds and their role in ecosystems[J].Applied Microbiology and Biotechnology, 2015, 99(8):3395-3405.
[4] GOTOR-VILA A, TEIXID N, DI FRANCESCO A, et al.Antifungal effect of volatile organic compounds produced by Bacillus amyloliquefaciens CPA-8 against fruit pathogen decays of cherry[J].Food Microbiology, 2017, 64:219-225.
N, DI FRANCESCO A, et al.Antifungal effect of volatile organic compounds produced by Bacillus amyloliquefaciens CPA-8 against fruit pathogen decays of cherry[J].Food Microbiology, 2017, 64:219-225.
[5] GAO Z F, ZHANG B J, LIU H P, et al.Identification of endophytic Bacillus velezensis ZSY-1 strain and antifungal activity of its volatile compounds against Alternaria solani and Botrytis cinerea[J].Biological Control, 2017, 105:27-39.
[6] HANSCHEN F S, WINKELMANN T.Biofumigation for fighting replant disease-A review[J].Agronomy, 2020, 10(3):425.
[7] WAISEN P, CHENG Z Q, SIPES B S, et al.Effects of biofumigant crop termination methods on suppression of plant-parasitic nematodes[J].Applied Soil Ecology, 2020, 154:103595.
[8] 付克剑, 苏友波, 崔永和, 等.荧光假单胞菌YG-1对烟草根黑腐病菌的体外拮抗[J].中国烟草科学, 2024, 45(1):39-47.
FU K J, SU Y B, CUI Y H, et al.In vitro antagonism of Pseudomonas fluorescens YG-1 against Thielaviopsis basicola[J].Chinese Tobacco Science, 2024, 45(1):39-47.
[9] 郑传奇, 令狐美林, 舒忠泽, 等.钩状木霉的分离鉴定及对辣椒炭疽菌和薏苡黑粉菌的抑菌活性[J].南方农业学报, 2023, 54(7):2050-2059.
ZHENG C Q, LINGHU M L, SHU Z Z, et al.Isolation, identification of Trichoderma hamatum and determination of its antibacterial activity on Colletotrichum capsici and Ustilago coicis[J].Journal of Southern Agriculture, 2023, 54(7):2050-2059.
[10] SUN D D, WOOD-JONES A, WANG W S, et al.Monitoring MVOC profiles over time from isolates of Aspergillus flavus using SPME GC-MS[J].Journal of Agricultural Chemistry and Environment, 2014, 3(2):48-63.
[11] IAMANAKA B T, TEIXEIRA A A, TEIXEIRA A R R, et al.Potential of volatile compounds produced by fungi to influence sensory quality of coffee beverage[J].Food Research International, 2014, 64:166-170.
[12] 李梦华, 王国义, 张晓旭, 等.SPME-GC-MS分析炭黑曲霉挥发性物质的条件优化[J].食品科学, 2018, 39(10):318-325.
LI M H, WANG G Y, ZHANG X X, et al.Optimization of solid-phase microextraction-gas chromatography-mass spectrometry method for microbial volatile organic compounds from Aspergillus carbonarius[J].Food Science, 2018, 39(10):318-325.
[13] 赵锦芳, 李敏, 龙同, 等.一株卡氏芽孢杆菌ST-1及其在香梨病害防治或贮藏保鲜中的应用:中国,CN115109723A[P].2022-09-27.
ZHAO J F, LI M, LONG T, et al.A strain of Bacillus cabrialesii ST-1 and its application in disease control or storage and preservation of fragrant pears:China, CN115109723A[P].2022-09-27.
[14] ARREBOLA E, SIVAKUMAR D, KORSTEN L.Effect of volatile compounds produced by Bacillus strains on postharvest decay in citrus [J].Biological Control, 2010, 53(1):122-128.
[15] 陈莹莹, 张亚敏, 郭红莲.膜醭毕赤酵母挥发性物质对灰葡萄孢菌的抑菌活性及组分分析[J].食品与发酵工业, 2023, 49(13):64-69.
CHEN Y Y, ZHANG Y M, GUO H G.Antifungal activity of volatile compounds from Pichia membranaefaciens and its component analysis against Botrytis cinerea[J].Food and Fermentation Industries, 2023, 49(13):64-69.
[16] 黄伟, 王宁, 刘峰娟, 等.产香真菌M6-5的鉴定及其挥发性物质对库尔勒香梨果实采后黑斑病的抑制效果[J].食品科学, 2022, 43(22):199-206.
HUANG W, WANG N, LIU F J, et al.Identification of aroma-producing fungal strain M6-5 and inhibitory effect of volatile substances from it on postharvest black spot of korla fragrant pear[J].Food Science, 2022, 43(22):199-206.
[17] 方静凡. 2-苯乙醇对柑橘青霉及生防菌34-9的作用研究[D]武汉:华中农业大学, 2013.
FANG J F.Effects of 2-phenylethanol(PEA)on citrus blue mold and biocontrol yeast 34-9[D].Wuhan:Huazhong Agricultural University, 2013.
[18] ALOO B N, MAKUMBA B A, MBEGA E R.The potential of Bacilli rhizobacteria for sustainable crop production and environmental sustainability[J].Microbiological Research, 2019, 219:26-39.
[19] 郭洁心, 张育铭, 朱洪磊, 等.解淀粉芽胞杆菌XJ5挥发性物质抑菌活性及对苹果褐腐病防效测定[J].中国生物防治学报, 2020, 36(4):575-580.
GUO J X, ZHANG Y M, ZHU H L, et al.Antifungal activity of volatile organic compounds from Bacillus amyloliquefaciens XJ5 and control effect against Monilinia fructigena[J].Chinese Journal of Biological Control, 2020, 36(4):575-580.
[20] ZHOU M S, LI P Z, WU S Y, et al.Bacillus subtilis CF-3 volatile organic compounds inhibit Monilinia fructicola growth in peach fruit[J].Frontiers in Microbiology, 2019, 10:1804.
[21] ZHAO P Y, LI P Z, WU S Y, et al.Volatile organic compounds (VOCs) from Bacillus subtilis CF-3 reduce anthracnose and elicit active defense responses in harvested litchi fruits[J].AMB Express, 2019, 9(1):119.
[22] 李素平, 李微, 韩冷, 等.贝莱斯芽孢杆菌HY19挥发物对采后柑橘的防腐效果[J].园艺学报, 2024, 51(1):162-174.
LI S P, LI W, HAN L, et al.Bacillus velezensis HY19 volatile organic compounds as a preservative in postharvest citrus fruit management[J].Acta Horticulturae Sinica, 2024, 51(1):162-174.